样品检验原始记录
样品检验原始记录
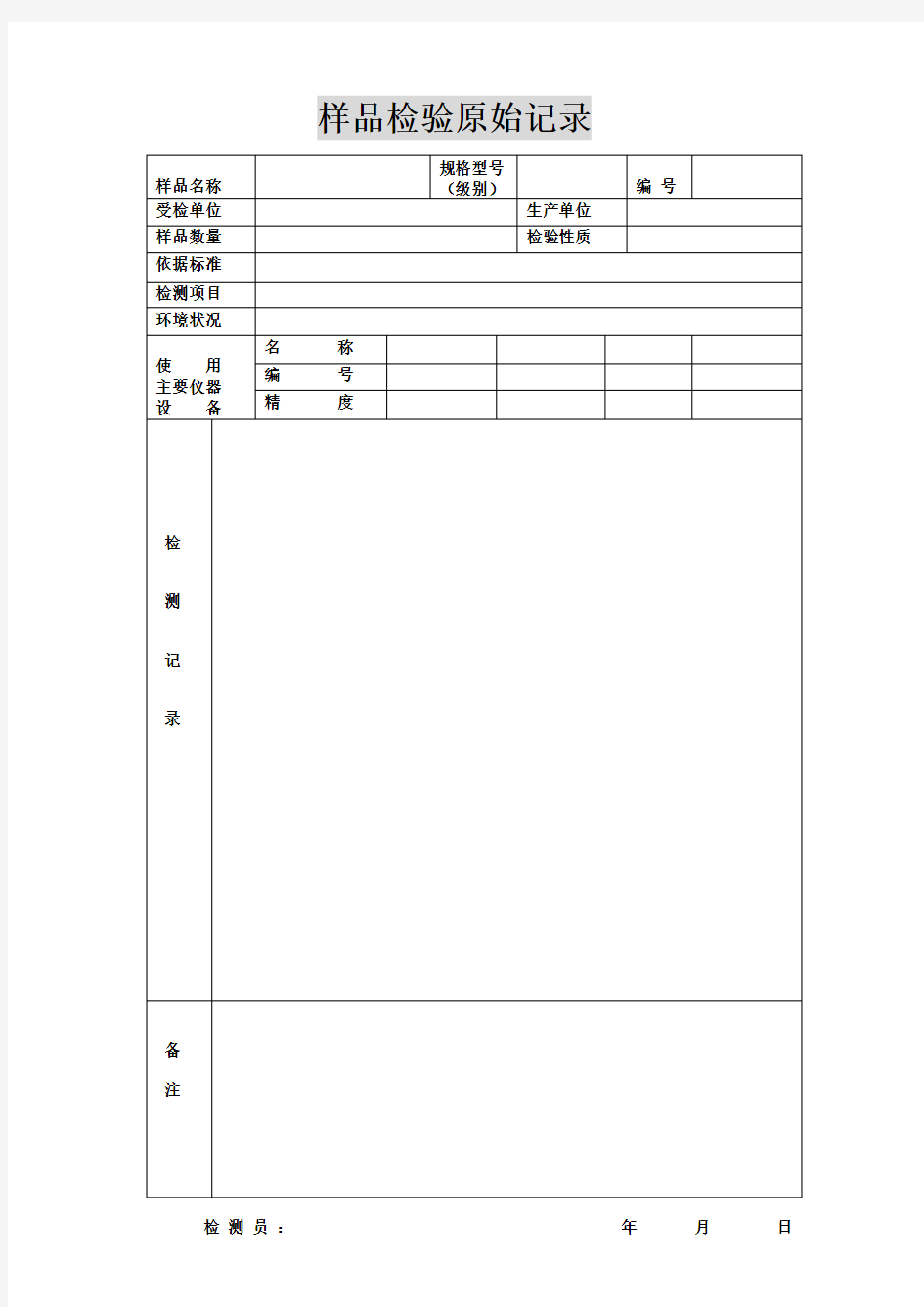
检测员:年月日
检验原始记录和出厂检验报告
出厂检验原始记录 化验:审批: 产品名称样品数量抽样基数 规格型号抽样地点生产日期 检验依据 检验项目实测数据检测仪器 酒精度,%(V/V) GB/T10345.3酒精计法 总酸(以乙酸计),g/L GB/T10345.4 总酯(以乙酸乙酯计),g/L GB/T10345.5 第一法 固形物/(g/L) 感官取100mL酒样经蒸馏后定容至100mL备用。 测定值: 测定温度:℃ 吸取50.00ml样液进行测定。 样品测定消耗氢氧化钠标液(ml):V= V’= 氢氧化钠标液的浓度:c= mol/L = ? ? = 0. 50 60 V c X ()() 0. 50 60 ? ? = = X ()() 2 + = 上述样品加入25.00ml氢氧化钠标准溶液,在100℃水浴锅上回流1h,用 盐酸标准溶液滴至终点 测定时,消耗硫酸标液的体积(ml):V= V’= 硫酸标液的浓度:c= mol/L () 0. 50 88 V c ? - ? = V X= X ()() 2 + = 取50mL酒样注入恒重100mL瓷蒸发皿,置于水浴至干,在将蒸发皿放 入103℃干燥箱直至恒重。 1000 0. 50 1 ? - = m m X X1= X 2= 色泽和外观: 香气: 口味: 风格: 酒精计 电子天平
出厂检验报告 化验: 审批: 产品名称 抽样人员 生产日期 抽样数量 检验日期 报告日期 检验依据 项 目 检验标准值 检验结果 判定 感 官 色泽和外观 无色或微黄,清亮透明,无悬浮物, 无沉淀; 香气 香气自然纯正清雅; 口味 酒体醇和、甘冽净爽; 风格 具有本品的典型风格。 酒精度/%vol 41-68 总酸/(g/L ) ≥0.3 总酯/(g/L ) ≥0.5 固形物/(g/L ) ≤0.5 甲醇/(g/L ) ≤0.6 结论 该批产品 □符合 □不符合 要求。 日期:
检验原始记录规范
检验原始记录规范 1 范围 本规范规定了检验原始记录(以下简称原始记录)的基本要求、格式和填写要求。 2 术语 2.1 测定值 测定时,从仪器仪表或量具上读取的数值。 2.2 给定值 为了得到测定值而按标准规定给出的标准试剂(或试样)特性的量值。 2.3 计算值 由给定值和测定值经计算公式,按有效数字运算规则计算所得到的数值。 2.4 灭菌 用物理或化学的方法杀灭传播媒介上所有的微生物,使其达到无菌。 2.5 消毒 用物理或化学的方法杀灭或清除传播媒介上的病原微生物,使其达到无害化。 3 基本要求 3.1 原始记录的内容应包括与检验有关的一切资料、数据和现象,完整地记 录全过程。 3.2 每一样品的原始记录应给出足够的信息以保证检验能够再现。 3.3 原始记录要格式化,每类样品应有固定的格式。 3.4 多个产品的同一检验项目的原始记录不准集中填写。
3.5 填写原始记录最好用钢笔(蓝色或黑色),也可使用碳素笔,禁止用铅笔。 3.6 字迹清晰、端正,尤其是0到9这10个阿拉伯数字和计量单位的书写。 3.7 改正错误的时要用“杠改法”(在需要改正的地方用红色笔划一横杠,在其右上方进行修改),并加盖改正人本人印章或签字确认。 3.8 记录应卷面整齐、洁净。同一页中不准使用两色或两色以上的墨水。 3.9 原始记录不允许重新抄写整理,要保持原始记录的原始属性。 3.10 对因检测、填写或其他原因造成得失误,使原始记录出现多处错误或卷面不洁欲作废的原始记录,不准撕毁废弃,应加盖“作废”(红色)章,仍与重新填写的原始记录一起存档。 4 填写要求 4.1 样品编号 样品编号为样品唯一性标识号,由业务室负责编写,原始记录样品编号应与检验报告及送样单编号一致。 4.2 共页第页 4.2.1 原始记录总页数等于手填原始记录页数与仪器设备自动记录页数之和。 4.2.2 手填写的原始记录应采用A4幅面纸,并算为1页:仪器设备自动记录纸不小于32开为1页;如小于32开,要粘贴在A4幅面原始记录纸上。 4.2.3 从第1起,按顺序排列。 4.3 检验项目 检验项目名称应与产品检验标准中规定的名称一致。如果一个检验项目需引用另一个检验项目的数据,在检验项目栏内应填写两个检验项目名称;本栏内还
检验记录、化验报告书管理规定.doc
1目的 明确检验原始记录的书写、检验报告单的填写及其存档和保管的标准操作规程。 2 范围 适用于质监科化验室检验原始记录、检验报告书的管理。 3 责任 质监科有关人员。 4 内容 4.1 检验人员应按规定做好检验记录,根据检验结果出具检验报告单。 4.2检验原始记录是检验人员对其检验工作的全面记载,是产品质量信息的主要 来源,因此一定要保持它的正确性、严密性、全面性和可靠性。 4.3检验记录要按规定内容逐项进行填写,记载检验过程的一切原始数据和现 象,其中包括鉴别试验、测试数据及演算过程、结论意见、化验员签章、化验室负责人复核并签章。 4.4检验报告单要以检验原始记录为依据,是决定物料、中间产品是否流入下道 工序,成品是否出厂的依据。因此填写检验报告单时,检验依据必须明确,检验结论必须清楚,并有化验员签章、化验室负责人复核签章、质监科科长审查和部门签章。 4.5检验记录、检验报告书必须按品种分类、以批号顺序装订,同时检验报告单 还需编号,建立检验台帐,并归档专人专柜保存。不得外借,内部查阅要登记并及时归还保管人。 4.6成品检验报告书为一式3份、中间体为2份、物料为2份,分别交仓库或车 间,另一份质监科存档,仓库、车间也要设专人保存检验报告。 第2页/共2页 4.7检验原始记录、检验报告书须按批号保存三年或药品有效期后一年,方可 销毁。 5 记录
记录名称保存部门保存时间 中间产品检验记录质监科三年 中间产品检验报告单质监科三年 检验原始记录质监科三年 检验报告单质监科三年 物料检验台帐质监科三年 成品检验台帐质监科三年 QF-01-005-00 检验原始记录
检验原始记录管理制度.doc
检验原始记录管理制度1 湖南有色凯铂生物药业有限公司GMP文件 制定检验原始记录的管理办法,明确了检验原始记录的填写、审核、存档要求。 责任 质量部负责本制度的制定,检验人员负责实施,质量监督员负责监督执行。 范围 适用于与公司产品检验有关的所有原始记录的管理。 内容 1、质量检验室负责的样品分析检验的全过程必须填写相应的原始记录,记录应准确、完整、及时; 2、记录应字迹清晰、工整,当有笔误发生时,不得随意涂改,不允许使用修正液,应在写错处划一条横线,横线划过后,原笔误依然清晰可辨,在横线上方填写正确的数据或字迹,然后签上更正人姓名和更正日期; 3、检验原始记录应包括样品名称、批号,检验项目、质量标准依据、样品外观现象、计算公式,化学结果、现象(如果采用标准品应注明其重量、纯度和其它必要信息)、化验员的结论和签名,计算审核人的签名;
4、各种数据的准确度的确定 4.1 样品重量的有效数字应与称量时使用的天平的精度保持一致; 4.2 滴定液消耗的毫升数读到0.01ml; 4.3 在数据处理过程中,对有效位数之后的数字的修约采用“四舍六入五留双”的规则,详见《有效数字的修约管理制度》; 4.4 最后报告检测结果的有效位数应与方法要求相一致。在运算过程中,其有效位数可适当保留,而在运算结束后根据有效数字的修约规则对结果进行修约。 5、含量分析的相对偏差的要求 5.1 平行样的取样量相对偏差不超过5% 5.2 取样量不超过规定量±10% 5.3 仪器分析法不超过3% 6、记录复核 检验记录完成后,应由化测室负责人对记录内容、计算结果进行复核并签字;复核后的记录,如属于内容和计算错误,复核人要负责,如属于检验错误,则复核人没有责任; 7、检验原始记录应整理成批检验记录,至少要保存至成品有效期后一年,无有效期的产品应保存三年;批检验记录的保存由质量部质量保证室负责;
中间产品检验方法验证报告
分发部门:
目录 一、概述 二、验证前准备 三、验证记录与结果 四、漏项与偏差处理 五、评价与建议 六、验证结论 七、附件:相关记录与图谱
一、概述 为更好实现产品过程控制,我中控实验室依据《分析方法确认与验证管理规程》(文件编码:)与《中华人民共和国药典》2010版附录中相关规定和相应指导原则的要求,制定出一系列检验方法验证实验来考察本产品中间产品检验方法的适用性,从而确保该方法能够可靠有效地用于控制药品的内在质量。 本中间产品检验标准操作规程中所列检验项目有:干燥失重、硬度检查、崩解时限、重量差异、脆碎度、含量测定,根据检验项目的设定目的和验证内容的不同要求,现主要对颗粒含量测定检验项目进行了方法验证。 验证实施时间:自年月日开始至年月日完成。 二、验证前准备 1、培训确认 2、所用仪器设备,包括电子分析天平、检验方法中规定的仪器设备已经校验,且在有效期内。 3 试验所用的玻璃计量器具需清洁,并经检定后符合要求。 4 相关对照品、试剂试药均符合《中国药典》要求。 三、验证结果 1 含量测定方法各项验证实验结果 含量——专属性验证结果 试验人/日期复核人/日期 含量——重复性验证结果
试验人/日期复核人/日期 含量——准确度验证结果 是否符合要求: 试验人/日期复核人/日期 含量——线性验证结果 试验人/日期复核人/日期2 含量测定方法验证小结 小结人:日期: 四、漏项与偏差处理 无
五、评价与建议 小结人:日期:六、验证结论 总结人:日期: 七、附件 相应验证记录与图谱。
中间产品检验方法验证记录 1 检验依据:《中国药典》2010年版 2 检验方法: 3 验证记录 3.3 验证步骤 3.3.1 专属性:分别取空白辅料混合物、空白溶剂,按照“2”项下所述方法配制 3.3.2 准确度:按处方比例配制3个不同浓度(80%、100%、120%)的试样,每个浓度的样品按照“2”
药材检验原始记录样本
XXXXX药业(饮片)有限公司 原药材检验报告单 XXXXX药业(饮片)有限公司
原药材检验记录 【性状】 结果: 【鉴别】(1)显微鉴别 横截面: 结果: 粉末: 结果: (2)薄层鉴别 供试品溶液的制备:取粉末1g,加乙醇15ml,加热回流1小时,放冷,滤过,滤液
蒸干,残渣加乙醇5ml使溶解。 对照药材、对照品溶液配制:取菊花对照药材1g,同法制成对照药材溶液。再取绿原酸对照品,加乙醇制成每1ml含O.5mg的溶液。 温度:(℃) 相对湿度:(%) 展开剂:三氯甲烷-丙酮-甲醇-5%浓氨试液 (6:1:1:0.1) 薄层板:硅胶G 显色剂:稀碘化铋钾试液 灯光:白光、紫外光灯(365nm) 展距:(cm) 供试品色谱中,在与对照药材色谱相对应的位置 上,显相同颜色的荧光斑点。 S1为对照药材(对照品为中检所提供编号为) S2为对照品(对照品为中检所提供编号为) T为样品 结果: 【检查】杂质不得过 XX % (附录IX A) 杂质称重: g 杂质计算结果为: % (标准规定不得过 XX %) 结果: 膨胀度应不低于4.0(附录IX O) 温度:(℃)相对湿度:(%) 电子天平型号:CP214 溶剂:水 样品编号 1# 2# 3# 干燥品称重: g g g 第一次样品膨胀后体积: ml ml ml 第二次样品膨胀后体积: ml ml ml (两次差异不超过0.1ml) 膨胀度计算结果为:(标准规定不低于4.0)
结果: 水分不得过12.0% (附录Ⅸ H 第一法)。 温度:(℃)相对湿度:(%) 烘箱型号:DHG-91012SA型电子天平型号:CP214 样品编号 1# 2# 第一次称量瓶干燥(105℃ 3h) (g)(g)第二次称量瓶恒重(105℃ 1h) (g)(g)样品称重(g)(g)第一次称量瓶+样品干燥(105℃ 5h) (g)(g)第二次称量瓶+样品恒重(105℃ 1h) (g)(g)水分计算结果为:(%)(标准规定不得过12.0%) 结果: 总灰分不得过4.0%(附录Ⅸ K) 温度:(℃)相对湿度:(%) 马福炉型号:SX2.5-10 电子天平型号:CP214 样品编号 1# 2# 第一次坩锅称重(600℃ 3h) (g)(g)第二次坩锅恒重(600℃ 0.5h) (g)(g)样品称重(g)(g)第一次坩锅+残渣称重(600℃ 3h) (g)(g)第二次坩锅+残渣恒重(600℃ 0.5h) (g)(g)总灰分计算结果为:(%)(标准规定不得过4.0%) 结果: 酸不溶性灰分不得过3.0%(附录Ⅸ K)。 温度:(℃)相对湿度:(%) 马福炉型号 SX2.5-10 电子天平型号 CP214
检验原始记录规范标准[详]
检验原始记录规 1 围 本规规定了检验原始记录(以下简称原始记录)的基本要求、格式和填写要求。 2 术语 2.1 测定值 测定时,从仪器仪表或量具上读取的数值。 2.2 给定值 为了得到测定值而按标准规定给出的标准试剂(或试样)特性的量值。 2.3 计算值 由给定值和测定值经计算公式,按有效数字运算规则计算所得到的数值。 2.4 灭菌 用物理或化学的方法杀灭传播媒介上所有的微生物,使其达到无菌。 2.5 消毒 用物理或化学的方法杀灭或清除传播媒介上的病原微生物,使其达到无害化。 3 基本要求 3.1 原始记录的容应包括与检验有关的一切资料、数据和现象,完整地记 录全过程。 3.2 每一样品的原始记录应给出足够的信息以保证检验能够再现。 3.3 原始记录要格式化,每类样品应有固定的格式。 3.4 多个产品的同一检验项目的原始记录不准集中填写。
3.5 填写原始记录最好用钢笔(蓝色或黑色),也可使用碳素笔,禁止用铅笔。 3.6 字迹清晰、端正,尤其是0到9这10个阿拉伯数字和计量单位的书写。 3.7 改正错误的时要用“杠改法”(在需要改正的地方用红色笔划一横杠,在其右上方进行修改),并加盖改正人本人印章或签字确认。 3.8 记录应卷面整齐、洁净。同一页中不准使用两色或两色以上的墨水。 3.9 原始记录不允许重新抄写整理,要保持原始记录的原始属性。 3.10 对因检测、填写或其他原因造成得失误,使原始记录出现多处错误或卷面不洁欲作废的原始记录,不准撕毁废弃,应加盖“作废”(红色)章,仍与重新填写的原始记录一起存档。 4 填写要求 4.1 样品编号 样品编号为样品唯一性标识号,由业务室负责编写,原始记录样品编号应与检验报告及送样单编号一致。 4.2 共页第页 4.2.1 原始记录总页数等于手填原始记录页数与仪器设备自动记录页数之和。 4.2.2 手填写的原始记录应采用A4幅面纸,并算为1页:仪器设备自动记录纸不小于32开为1页;如小于32开,要粘贴在A4幅面原始记录纸上。 4.2.3 从第1起,按顺序排列。 4.3 检验项目 检验项目名称应与产品检验标准中规定的名称一致。如果一个检验项目需引用另一个检验项目的数据,在检验项目栏应填写两个检验项目名称;本栏还可填
检验原始记录标准管理规程
目的:检验原始记录是判定检验结果的原始证明,是质量检验的原始数字和文字记录,是反映质量检验的第一手资料。原始记录是否准确、真实、完整将直接影响检验工作的质量,为规范检验原始记录的管理,特制定规程。 应用范围:本规程适用于原辅料、包装材料、中间体、成品等检验原始记录的管理。 责任人:QC。 内容 1 检验记录是出具检验报告书的原始记录,检验原始记录必须用蓝黑墨水或碳素笔及时填写,做到记录原始、数据真实、字迹清晰、易读、资料完整。 2 检验人员检验前要仔细核对检品标签内容、封装情况是否正常,样品的数量是否够所检用量的三倍。 3 检验记录应当保持清洁,不得撕毁和任意涂改,如发现有误,可在原处画一横线,保持原有信息仍清晰可辩,书写正确信息后签名或盖章并加注日期,必要时注明情况,但不得涂改。 4 检验过程中的全部项目、实验现象、原始数据、实验温度、仪器名称、型号等,均应及时完整记录。严禁事先记录、事后补记、转抄。 5 检验原始记录应由第二个有检验资质的人进行复核并签名。 6 检验或试验结果无论成败,均应详细记录,失败的应及时总结分析,并在原始记录上注明。 7 如检验设备具备打印功能,应尽可能采用设备自动打印的记录、图谱和曲线图。自动打印的记录、图谱和曲线图上应标明样品的名称、批号和相应要求参数,还应有操作人员签名及检验日期。 8 检验记录中不应出现空白区域或空白页。如确认空白区域或空白页不需填写后,应在空白区域用一斜线划掉。 9 原始检验记录不得携出所外,不得私自泄露有关内容。活页实验记录应系统收集统一编号,按规定由QA归档保存,原辅料、包材、中间产品及成品保存至相关成品有效期后
质量检验记录表大全16
1目的 为证明产品质量符合规定的要求及体系及其过程运行的有效性提供客观证据,为实现可追溯性和采取纠正预防措施提供依据。 2适用围 质量管理体系所有相关的质量记录。 3职责和权限 质量记录编制:由各责任单位执行。 4术语 记录:为已完成的活动或达到的结果提供客观证据的文件。 质量记录:质量活动的真实记载。 5作业程序 5.1 质量记录分类 按质量记录的容进行分类。具体参考《质量记录清单》。 5.2 质量记录标识 按表头进行标识,具体参考《质量记录清单》及《文件和资料控制程序》。 5.3 质量记录收集 由各部门自行收集,按质量记录类别、日期、名称等进行归类保存。质量记录必须按要求填写,保证字迹清晰、数据准确。 5.4 质量记录编目 各责任单位在质量记录保存一年后,交由质量管理部按记录类别、日期、名称等进行编目,建立索引表。 5.5 质量记录归档 各权责单位每年6月15日以前将前一期之质量记录进行归档集中管理。 5.6 质量记录查阅 需经部门经理批准的人员,才可查阅质量记录。 5.7 质量记录保管 质量记录一般保存3年,对于特别的记录,按实际需要规定保存期限。具体参考《质量记录清单》。保管人必须注意储存环境,避免记录受潮、污损、变质、遗失。
5.8 质量记录的销毁 5.8.1由质量管理部每年6月15日指定人员对将超过保存期的质量的记录进行统一销毁。5.8.2质量记录在销毁前,责任单位必须提供清单交管理代表确认后方可执行。 5.9质量记录事项 5.9.1检验或作业人员于填写质量记录时,须依据相关填写说明或单位主管指导填写,但注意 不得潦草或不清楚。 5.9.2如欲修改时,原则上避免使用修正液,应将修正部分画线删掉,并将资料 更正后签注修改人员及修改日期以示负责。 5.10签章 5.10.1可使用亲笔签字或盖章两种方式,但两者都需注明签章日期。 5.10.2若因职务代理关系需签章时,应于签章旁边注明(代)字样。 6相关文件 序号名称编号 1 文件和资料控制程序WAYOUT-QP-22 7相关记录 序号名称模板编号 1 质量记录清单WAYOUT-QF-46
IQC品质检验记录表
IQC品质检验记录表 摘要:IQC即进货检验,指对供应商提供过来的原材料进行检测,并最后做出判断该批产品是接收还是拒收,在这过程中,我们作为品质检测人员就需要对检测的内容进行记录,下面主要分享几个IQC记录表给大家。 IQC的重要性 IQC的工作主要是控制公司所有的外购物料和外协加工物料的质量,保证不满足公司相关技术标准的产品不进入公司库房和生产线,确保生产使用产品都是合格品。IQC是公司整个供应链的前端,是构建公司质量体系的第一道防线和闸门。如果不能把关或是把关不严,让不合格物料进入库房和生产线,将把质量问题在后工序中成指数放大,如果把质量隐患带到市场,造成的损失更是无法估量,甚至会造成灾难性后果。因此,IQC检验员的岗位责任非常重大,工作质量非常重要.IQC作为质量控制的重要一环,要严格按标准按要求办事,质量管理不要受其他因素干扰。下图是IQC检验的一般流程: 作为一名IQC检验人员,除了严格按照IQC检验流程进行操作时,还需根据在检测的过程,把相关信息记录下来,下面提供几个IQC操作人员常用的几个品质检验记录表: 1、进料检验记录表
2、进料检验报告表 进料检验专员依据检验结果判定物料合格与否,若检验物料不合格,数量未达到拒收数量上限,则判定物料验收结果为“合格”;若检验物料的不合格数量达到或超过企业规定的数量,则判定物料验收结果为“不合格” 3、进料检验日统计报表
以上是IQC来料检验中常用到的几个记录表格,IQC除了要负责对购进的材料进行质量控制外,还要做各种数据统计分析等,这里的分析报表非常多,在这也介绍款IQC分析系统给大家,此系统主要是为了方便大家在做IQC统计报表时用的,无需人工记录数据,该系统可自动采集测量数据并进行数据分析,最后可直接导出各种IQC统计报表,如月统计报表跟日统计报表等
化验室各类原始记录表格
检测任务通知单 样品编号样品名称检验性质要求完成时间月日原料组成执行标准样品室负责人 检测项目分析方法养分含量%承检者任务完成时间承检者签字 样品制备要求 备注 经办人:任务通知日期:年月日
样品领取、返还登记表 表07 编号样品名称领样人领用日期样品用量返还人返还时间样品保管人备注注:一律用签字笔或钢笔黑体字填写。
试剂使用台帐 表08 试剂名称(纯 度) 试剂 用途领用人时间保管人备注领用量返还量 说明:一律用签字笔或钢笔黑体字填写。
称量瓶.坩埚恒重原始记录 表10 恒重日期天平编 号 干燥时 间 烘干温 度℃ 容器编号 测定次数 12345
标准溶液标定原始记录 表11 被标定溶液名称及配制浓度基准物(液)名称 及浓度 标定方法依据计算公式 标定日期年月日温度℃湿度%天平(基准液滴定管)编号被标定溶液滴定管编号 简要标定操作 过程 重复测定次数基准物质 量m (g) 或基准液 体积ml 起 始 读 数 ml 最 后 读 数 ml 滴定 管补 正 ml 空 白 补 正 ml 温度 补正 ml 真实 体积 V ml 被 标 液 浓 度 mol/L 平 均 值 mol/L 最 后 定 值 mol/L 标定1 2 3 4 复标1 2 3 4 标定质量控制方法允差实标误差结论 备注 标定人:复标人:审核人:
水分含量测定原始记录 (烘箱法) 表14样品名称样品编号检验性质 检验依据检验日期年月日 天平编号烘箱编号室内温度℃,湿度% 真空度MP a烘箱温度干燥时间分 测定次数 项目 1234干燥前称量瓶+试样m2g 干燥前称量瓶m3g 干燥前试样质量m=m2-m3g 干燥后称量瓶+试样m4g 干燥后试样的质量m1=m4-m0 g 计算结果H2O % 平均值H2O % 计算公式:H2O%=m-m1 ×100 m 空称量瓶恒重记录1234 平均重m0 检验人:复合人: 日期:日期:
