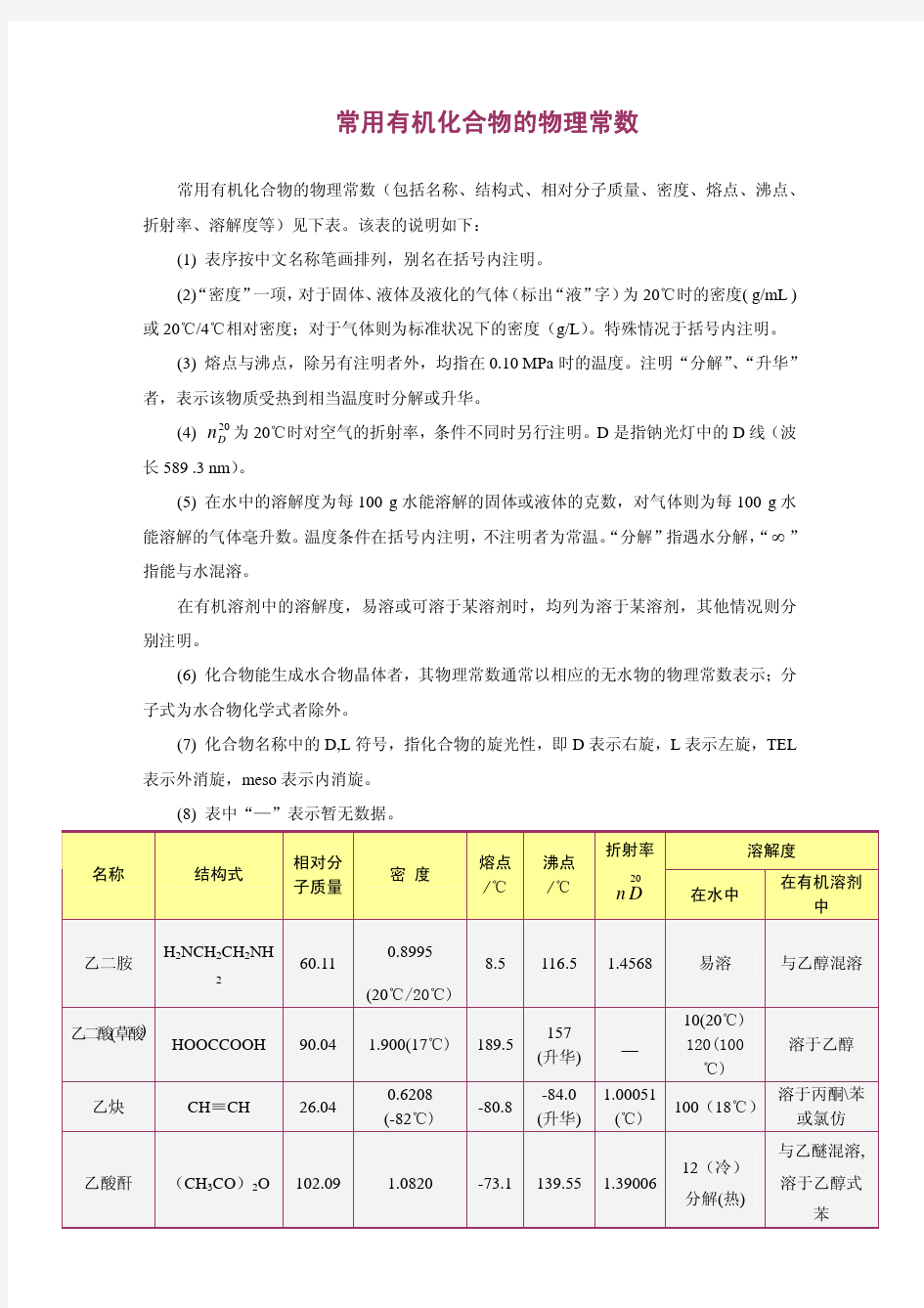
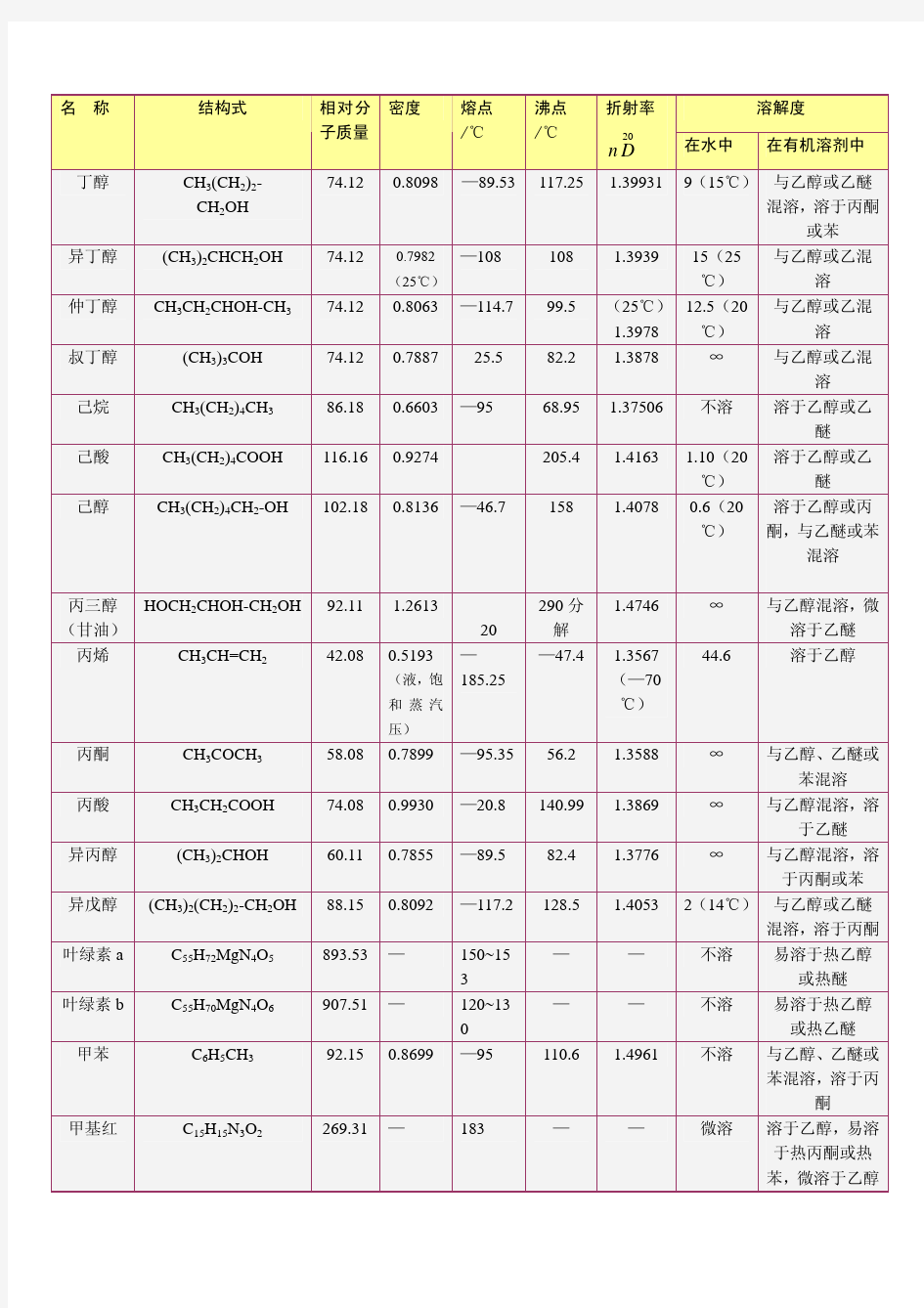
常用有机化合物的物理常数
总复习:有机化合物的性质
专题:有机化学 第四讲有机化合物的性质 北京四中 一、结构 核心是 二、化学性质 1、以代表物为思维载体 2、从头往后梳理 (一)烷烃的化学性质 1、取代反应: 甲烷的氯代反应较难停留在一氯代甲烷阶段 2.氧化在空气中燃烧: 3、热裂 把烷烃的蒸气在没有氯气的条件下,加热到4500C以上时,分子中的键发生断裂,形成较小的分子。这种在高温及没有氧气的条件下发生键断裂的反应称为反应。 (二)单烯烃 乙烯是最简单的单烯烃,分子式为,结构简式为。
(2)氧化反应: ①与酸性KMnO4的作用:使KMnO4溶液 分离甲烷和乙烯不用酸性KMnO4 补充:烯烃与KMnO4的反应 在中性或碱性的高锰酸钾溶液中, 烯烃被氧化成二元醇,高锰酸钾被还原成。在酸性高锰酸钾溶液中,烯烃中碳碳双键完全断裂,CH2=基被氧化成,RCH=基被氧化成,基被氧化成。高锰酸钾被还原成。 (3)加聚反应: 补充:二烯烃化学性质:
乙炔性质 化学键: 独特的大π键:介于单键和双键之间的独特的键(键长、键能) 苯的化学性质 1、易取代 (1)卤代: (2)硝化 (苯分子中的H原子被硝基取代的反应)
2、难氧化: 不使酸性高锰酸钾溶液褪色 3、加成 (1)取代反应: 三硝基甲苯(TNT) (2)氧化反应 (五)卤代烃 R CH CH 2 H X消除反应 取代反应 δ δ- +
1、被羟基取代(卤代烷的水解) 2.消除反应 卤代烷在KOH或NaOH等强碱的醇溶液中加热,分子中脱去一分子卤化氢生成烯烃的反应叫做消除反应。 (六)乙醇 醇的主要化学性质 1、与金属Na的取代 CH3CH2OH + Na → (乙醇钠)﹢ 功能: 2、乙醇与HX反应: 思考: 两者是否可逆反应? 3、脱水: 分子内脱水:消去反应
高中化学有机化合物知识点总结整理
高中化学有机物知识点总结 一、重要的物理性质 1.有机物的溶解性 (1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。 (3)具有特殊溶解性的: ①乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。 ②乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反 应吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。 ③有的淀粉、蛋白质可溶于水形成胶体 ..。蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反应中也有此操作)。 ④线型和部分支链型高聚物可溶于某些有机溶剂,而体型则难溶于有机溶剂。2.有机物的密度 小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂) 3.有机物的状态[常温常压(1个大气压、20℃左右)] (1)气态: ①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态 ②衍生物类: 一氯甲烷( ....,沸点为 ...HCHO ...). ....-.21℃ ...-.24.2℃ .....).甲醛( .....CH ..3.Cl..,.沸点为 (2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。如,己烷CH3(CH2)4CH3甲醇CH3OH 甲酸HCOOH 乙醛CH3CHO ★特殊: 不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。如,石蜡C12以上的烃 饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态 4.有机物的颜色 ☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色 ☆淀粉溶液(胶)遇碘(I2)变蓝色溶液; ☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。 5.有机物的气味 许多有机物具有特殊的气味,但在中学阶段只需要了解下列有机物的气味:☆甲烷无味 ☆乙烯稍有甜味(植物生长的调节剂) ☆液态烯烃汽油的气味 ☆乙炔无味 ☆苯及其同系物芳香气味,有一定的毒性,尽量少吸入。
有机物的物理性质规律
有机物物理性质的主要规律 河北省宣化县第一中学栾春武 一、密度 物质的密度是指单位体积里所含物质的质量,它与该物质的相对分子质量、分子半径等因素有关。一般来说,有机物的密度与分子中相对原子质量大的原子所占质量分数成正比。例如,烷、烯、炔及苯的同系物等物质的密度均小于水的密度,并且它们的密度均随分子中碳原子数的增加和碳元素的质量分数的增大而增大;而一卤代烷、饱和一元醇随分子中碳原子数的增加,氯元素、氧元素的质量分数降低,密度逐渐减小。 二、溶解性 有机物一般不易溶于水,而易溶于有机溶剂,这是因为有机物分子大多数是非极性分子或弱极性分子,含有憎水基。根据“相似相溶”原理,水是极性分子,只有当某有机物分子中含有亲水基团时,则该有机物就可能溶于水。 亲水基一般包括:-OH、-CHO、COOH等;憎水基一般包括:-R、-NO2、-X、-COOR等。 1. 能溶于水的有机物: ① 小分子醇:CH3OH、C2H5OH、CH2OHCH2OH、甘油等; ②小分子醛:HCHO、CH3CHO、CH3CH2CHO等; ③小分子羧酸:HCOOH、CH3COOH、CH3CH2COOH等; ④低糖:葡萄糖(C6H12O6)、果糖(C6H12O6)、蔗糖(C12H22O11); ⑤氨基酸:CH3CH(NH2)COOH等。 一般来说,低级醇、低级醛、低级酸,单糖和二糖水溶性好,即亲水基占得比重相对较大,憎水基占得比重相对较小,故能溶于水。
2. 不易溶于水的有机物: ① 烷、稀、炔、芳香烃等烃类均不溶于水,因为其分子内不含极性基团; ② 卤代烃:CH3Cl、CHCl3、CCl4、CH3CH2Br、等均不溶于水; ③ 硝基化合物:硝基苯、TNT等; ④ 酯:CH3COOC2H5、油脂等; ⑤ 醚:CH3OCH3、C2H5OC2H5等; ⑥ 大分子化合物或高分子化合物:如高级脂肪酸、塑料、橡胶、纤维等。 一般来说,液态烃、一氯代烃、苯及其同系物、酯类物质不溶于水且密度比水小;硝基苯、溴苯、四氯化碳、氯仿、溴代烃、碘代烃不溶于水且密度比水大。 3. 有机物在汽油、苯、四氯化碳等有机溶剂中的溶解性与在水中的相反: 如乙醇是由较小憎水基团C2H5和亲水基团-OH构成,所以乙醇易溶于水,同时因含有憎水基团,所以必定也溶于四氯化碳等有机溶剂中。其它醇类物质由于都含有亲水基团-OH,小分子都溶于水,但在水中的溶解度随着憎水基团的不断增大而逐渐减小,在四氯化碳等有机溶剂中的溶解度则逐渐增大。 4. 特殊物质(苯酚)在常温时,在水里溶解度不大,当温度高于65℃ 时,能和水以任意比例互溶。 三、熔、沸点 熔、沸点是物质状态变化的标志,有机物熔、沸点的高低与分之间的相互作用、分子的几何形状等因素有关。 1. 结构相似的有机物,相对分子质量越大,分子间作用力越大,其熔、沸点越高。如链烃同系物的沸点,随着相对分子质量的增大而升高,状态由气态(分子中碳原子数小于等于4者及新戊烷通常为气态)到液态,最后变为固态。
常用有机溶剂的物理常数
常用有机溶剂的物理常数 溶剂mp bp D420n D20εR D μAcetic acid 乙酸 17 118 1.0491.3716 6.15 12.9 1.68 Acetone 丙酮 -95560.7881.358720.7 16.2 2.85 Acetonitrile 乙腈 -44820.7821.344137.5 11.1 3.45 Anisole 苯甲醚 -3 1540.9941.5170 4.33 33 1.38 Benzene 苯 5 800.8791.5011 2.27 26.2 0.00 Bromobenzene 溴苯 -31156 1.4951.5580 5.17 33.7 1.55 Carbon disulfide 二硫化碳 -11246 1.2741.6295 2.6 21.3 0.00 Carbon tetrachloride 四氯化碳 -2377 1.5941.4601 2.24 25.8 0.00 Chlorobenzene 氯苯 -46132 1.1061.5248 5.62 31.2 1.54 Chloroform 氯仿 -6461 1.4891.4458 4.81 21 1.15 Cyclohexane 环己烷 6 810.7781.4262 2.02 27.7 0.00 Dibutyl ether 丁醚 -981420.7691.3992 3.1 40.8 1.18 o –Dichlorobenzene 邻二氯苯 -17181 1.3061.55149.93 35.9 2.27 1,2-Dichloroethane 1,2-二氯乙烷-3684 1.2531.444810.36 21 1.86 Dichloromethane 二氯乙烷 -9540 1.3261.42418.93 16 1.55 Diethylamine 二乙胺 -50560.7071.3864 3.6 24.3 0.92 Diethyl ether 乙醚 -117350.7131.3524 4.33 22.1 1.30 1,2-Dimethoxyethane 1,2-二甲氧基 -68850.8631.37967.2 24.1 1.71 乙烷 N,N –Dimethylacetamide N,N-二甲 -201660.9371.438437.8 24.2 3.72 基乙酰胺 N,N –Dimethylformamide -601520.9451.430536.7 19.9 3.86 N,N-二甲基甲酰胺 Dimethyl sulfoxide二甲基亚砜 19 189 1.0961.478346.7 20.1 3.90 1,4-Dioxane 1,4-二氧六环 12 101 1.0341.4224 2.25 21.6 0.45 Ethanol 乙醇 -114780.7891.361424.5 12.8 1.69 Ethyl acetate 乙酸乙酯 -84770.9011.3724 6.02 22.3 1.88 Ethyl benzoate 苯甲酸乙酯 -35213 1.0501.5052 6.02 42.5 2.00 Formamide 甲酰胺 3 211 1.1331.4475111.0 10.6 3.37 Hexamethylphosphoramide 7 235 1.0271.458830.0 47.7 5.54 Isopropyl alcohol 异丙醇 -90820.7861.377217.9 17.5 1.66 isopropyl ether 异丙醚 -6068 1.36
最新化学高中有机化学物理性质知识讲解
一、有机代表物质的物理性质 1. 状态 固态:饱和高级脂肪酸、脂肪、TNT、萘、苯酚、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋酸(16.6℃以下) 气态:C4以下的烷烃、烯烃、炔烃、甲醛、一氯甲烷 液态:油状: 硝基苯、溴乙烷、乙酸乙酯、油酸 粘稠状: 石油、乙二醇、丙三醇 2. 气味 无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味) 稍有气味:乙烯特殊气味:苯及同系物、萘、石油、苯酚 刺激性:甲醛、甲酸、乙酸、乙醛 甜味:乙二醇、丙三醇、蔗糖、葡萄糖 香味:乙醇、低级酯苦杏仁味:硝基苯 3. 颜色 白色:葡萄糖、多糖淡黄色:TNT、不纯的硝基苯黑色或深棕色:石油 4. 密度 比水轻的:苯及苯的同系物、一氯代烃、乙醇、低级酯、汽油 比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃 5. 挥发性:乙醇、乙醛、乙酸 6. 升华性:萘、蒽 7. 水溶性:不溶:高级脂肪酸、酯、硝基苯、溴苯、烷烃、烯烃、炔烃、苯及同系物、萘、蒽、石油、卤代烃、TNT、氯仿、CCl4 能溶:苯酚(0℃时是微溶) 微溶:乙炔、苯甲酸 易溶:甲醛、乙酸、乙二醇、苯磺酸 与水混溶:乙醇、苯酚(70℃以上) 、乙醛、甲酸、丙三醇 二、有机物之间的类别异构关系 1. 分子组成符合CnH2n(n≥3)的类别异构体: 烯烃和环烷烃; 2. 分子组成符合CnH2n-2(n≥4)的类别异构体: 炔烃和二烯烃; 3. 分子组成符合CnH2n+2O(n≥3)的类别异构体: 饱和一元醇和饱和醚; 4. 分子组成符合CnH2nO(n≥3)的类别异构体: 饱和一元醛和饱和一元酮; 5. 分子组成符合CnH2nO2(n≥2)的类别异构体: 饱和一元羧酸和饱和一元酯; 6. 分子组成符合CnH2n-6O(n≥7)的类别异构体: 苯酚的同系物,芳香醇及芳香醚; 如n=7,有以下五种: 邻甲苯酚,间甲苯酚,对甲苯酚;苯甲醇;苯甲醚. 7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体: 氨基酸和硝基化合物. 三、能发生取代反应的物质 1. 烷烃与卤素单质: 卤素单质蒸汽(如不能为溴水)。条件:光照. 2. 苯及苯的同系物与(1)卤素单质(不能为水溶液):条件-- Fe作催化剂 (2)浓硝酸: 50℃-- 60℃水浴(3)浓硫酸: 70℃--80℃水浴 3. 卤代烃的水解: NaOH的水溶液 4. 醇与氢卤酸的反应: 新制氢卤酸 5. 乙醇与浓硫酸在140℃时的脱水反应. 6.酸与醇的酯化反应:浓硫酸、加热 6.酯类的水解: 无机酸或碱催化 6. 酚与1)浓溴水2)浓硝酸 四、能发生加成反应的物质 1. 烯烃、炔烃、二烯烃、苯乙烯的加成: H2、卤化氢、水、卤素单质 2. 苯及苯的同系物的加成: H2、Cl2 3. 不饱和烃的衍生物的加成:
有机物的物理性质规律
有机物的物理性质规律 有机物的物理性质与化学性质同等重要,且“结构决定性质,性质反映结构”不仅表现在化学性质中,同时也体现在某些物理性质上。有机物一些物理性质存在着内在规律,如果抓住其中的规律,可以更好地认识有机物。 一、熔沸点 有机物微粒间的作用是分子间作用力,分子间的作用力比较小,因此烃的熔沸点比较低。对于同系物,随着相对分子质量的增加,分子间作用力增大,因此同系物的熔沸点随着相对分子质量的增大而升高。 1. 烃、卤代烃及醛 各种烃的同系物、卤代烃及醛的熔沸点随着分子中碳原子数的增加而升高。如:4CH 、1048362H C H C H C 、、都是烷烃,熔沸点的高低顺序为:10483624H C H C H C CH <<<;846342H C H C H C 、、都是烯烃,熔沸点的高低顺序为:846342H C H C H C <<;再有Cl CH CH Cl CH 233<,CHO CH HCHO 3<等。 同类型的同分异构体之间,主链上碳原子数目越多,烃的熔沸点越高;支链数目越多,空间位置越对称,熔沸点越低。如4332233323)CH (C CH CHCH )CH (CH )CH (CH >>。 2. 醇 由于分子中含有—OH ,醇分子之间存在氢键,分子间的作用力较一般的分子间作用力强,因此与相对分子质量相近的烃比较,醇的熔沸点高的多,如OH CH CH 23的沸点为78℃,323CH CH CH 的沸点为-42℃,23CH CH CH =的沸点为-48℃。 影响醇的沸点的因素有: (1)分子中—OH 个数的多少:—OH 个数越多,沸点越高。如乙醇的沸点为78℃,乙二醇的沸点为179℃。 (2)分子中碳原子个数的多少:碳原子数越多,沸点越高。如甲醇的沸点为65℃,乙醇的沸点为78℃。 3. 羧酸 羧酸分子中含有—COOH ,分子之间存在氢键,不仅羧酸分子间羟基氧和羟基氢之间存在氢键,而且羧酸分子间羰基氧和羟基氢之间也存在氢键,因此羧酸分子之间形成氢键的机会比相对分子质量相近的醇多,因此羧酸的沸点比相对分子质量相近的醇的沸点高,如1-
有机物的物理性质规律
有机物的物理性质规律 有机物的物理性质与化学性质同等重要,且“结构决定性质,性质反映结构”不仅表现在化学性质中,同时也体现在某些物理性质上。有机物一些物理性质存在着内在规律,如果抓住其中的规律,可以更好地认识有机物。 一、熔沸点有机物微粒间的作用是分子间作用力,分子间的作用力比较小,因此烃的熔沸点比较低。对于同系物,随着相对分子质量的增加,分子间作用力增大,因此同系物的熔沸点随着相对分子质量的增大而升高。 1. 烃、卤代烃及醛 各种烃的同系物、卤代烃及醛的熔沸点随着分子中碳原子数的增加而升高。同类型的同分异构体之间,主链上碳原子数目越多,烃的熔沸点越高;支链数目越多,空间位置越对称,熔沸点越低。例如 2. 醇 由于分子中含有—OH,醇分子之间存在氢键,分子间的作用力较一般的分子间作用力强,因此与相对分子质量相近的烃比较,醇的熔沸点高的多。影响醇的沸点的因素有:(1)分子中—OH个数的多少:—OH个数越多,沸点越高。如乙醇的沸点为78℃,乙二醇的沸点为179℃。 (2)分子中碳原子个数的多少:碳原子数越多,沸点越高。如甲醇的沸点为65℃,乙醇的沸点为78℃。 3. 羧酸 羧酸分子中含有—COOH,分子之间存在氢键,不仅羧酸分子间羟基氧和羟基氢之间存在氢键,而且羧酸分子间羰基氧和羟基氢之间也存在氢键,因此羧酸分子之间形成氢键的机会比相对分子质量相近的醇多,因此羧酸的沸点比相对分子质量相近的醇的沸点高,如1-丙醇的沸点为97.4℃,乙酸的沸点为118℃。影响羧酸的沸点的因素有: (1)分子中羧基的个数:羧基的个数越多,羧酸的沸点越高; (2)分子中碳原子的个数:碳原子的个数越多,羧酸的沸点越高。 二、状态物质的状态与熔沸点密切相关,都决定于分子间作用力的大小。
有机物物理性质
有机物物理性质 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN
1 有机物物理性质归类 一密度 烃的密度一般随碳原子数的增多而增大;一氯代烃的相对密度随着碳原子数的增加而减小。 注意: 1.通常气态有机物的密度与空气相比,相对分子质量大于29的,比空气的密度大。 2.通常液态有机物与水相比: 密度比水小:烃,酯,一氯代烃,一元醇,醛,酮,高级脂肪酸等 密度比水大:硝基苯,溴代烃,二氯(或以上)代烃,乙二醇,丙三醇等 二状态 [常温常压(1个大气压、20℃左右)] 由于有机物大都为大分子(相对无机物来说),所以有机物分子间引力较大,因此一般情况下呈液态和固态,只有少部分小分子的有机物呈气态支链越多,熔沸点越低 1.随着分子中碳原子数的增多,烃由气态经液态到固态。分子中含有1~4个碳原子的轻一般为气态,5~16个碳原子的烃一般为液态,17个以上的为固态。如通常状况下CH4、C4H8呈气态,苯及苯的同系物一般呈液态,大多数呈固态。 2.醇类、羧酸类物质中由于含有—OH,分子之间存在氢键,所以醇类、羧酸类物质分子中碳原子较少的,在通常状况下呈液态,分子中碳原子较多的呈固态,如:甲醇、乙醇、甲酸和乙酸等呈液态。 3.醛类 通常状况下除碳原子数较少的甲醛呈气态、乙醛等几种醛呈液态外,相对分子质量大于100的醛一般呈固态。 4.酯类 通常状况下一般分子中碳原子数较少的酯呈液态,其余都呈固态。 5.苯酚及其同系物 由于含有_OH,且苯环相对分子质量较大,故通常状况下此类物质呈固态。 常见物质(1)气态: ①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态 ②衍生物类:
第五部分 有机化合物物理性质的比较
第五部分有机化合物物理性质的比较 有机化合物的物理性质通常包括状态、比重、熔点、沸点、溶解度、折光率及比旋光度等。物质的物理性质在一定程度上反映了分子结构的特点。通过不同类型化合物物理性质的比较,可以找出一些物质结构与物理性质之间相关的规律。 一、沸点与分子结构的关系 一种物质的沸点主要取决于液体分子间引力的大小,分子间引力越大,沸点越高。而分子间引力与分子的大小、偶极矩、极化度、氢键等因素密切相关。有机化合物的沸点一般有如下规律。 1.同系物的沸点随分子量的增大而升高;同分异构体随支链的增多,沸点下降。 2.含极性基团的化合物,分子的偶极矩增大,沸点比相应的烃类化合物高;此类化合 物的同分异构体中,极性基团连在伯碳原子上的异构体沸点最高,连在叔碳原子上的异构体沸点最低。 3.能形成氢键的化合物,沸点显著增高。形成氢键的基团越多,氢键越强,沸点越高。 能形成分子内氢键的异构体比只能形成分子间氢键的异构体的沸点低。 4.在顺反异构体中,一般顺式异构体的沸点高于反式。 二、熔点与分子结构的关系 纯净的固体物质都有其固定的熔点。熔点的高低决定于晶格能的大小,晶格能越大,熔点越高。晶格能的大小主要由分子间作用力、分子的结构和形状以及晶格的类型所决定。 以离子为晶格单位的有机盐类或能形成内盐的氨基酸等都具有较高的熔点。极性化合物的熔点比分子量相近的非极性化合物的熔点高;能形成氢键的化合物,熔点高于相应的烃;能形成分子内氢键的异构体熔点较低。 同系物中,熔点随相对分子质量的增大而升高,而且分子结构对称性越强,熔点越高。 三、溶解度与分子结构的关系 有机化合物的溶解度与分子的结构及所含的官能团有密切的关系。一般说,极性化合物易溶于极性溶剂,非极性化合物易溶于非极性溶剂,这就是“相似相溶”规律。 1.一般离子型的有机化合物易溶于水。如有机酸盐及铵类化合物。 2.能与水形成氢键的化合物易溶于水。如直链烃基不超过4个碳原子,支链烃基不超过5 个碳原子的一元醇、一元醛和酮以及一元胺等化合物,一般都能溶于水。随烃基的增大,在水中的溶解度减小。 能形成分子内氢键的化合物在水中的溶解度减小。如水杨酸、邻硝基苯酚在水中的溶解度均比苯酚小。 3.一般碱性化合物可溶于酸,如有机胺可溶于盐酸。一般含氧有机化合物,可与浓硫酸作 用形成(样)盐,可溶于过量的浓硫酸中。 4.一般酸性的有机化合物可溶于碱。如,羧酸、酚、磺酸等可溶于NaOH溶液中。
有机物的物理性质规律
有机物的物理性质规律 刘春亮 有机物的物理性质与化学性质同等重要,且“结构决定性质,性质反映结构”不仅表现在化学性质中,同时也体现在某些物理性质上。有机物一些物理性质存在着内在规律,如果抓住其中的规律,可以更好地认识有机物。 一、熔沸点 有机物微粒间的作用是分子间作用力,分子间的作用力比较小,因此烃的熔沸点比较低。对于同系物,随着相对分子质量的增加,分子间作用力增大,因此同系物的熔沸点随着相对分子质量的增大而升高。 1. 烃、卤代烃及醛 各种烃的同系物、卤代烃及醛的熔沸点随着分子中碳原子数的增加而升高。如:4CH 、1048362H C H C H C 、、都是烷烃,熔沸点的高低顺序为:10483624H C H C H C CH <<<;846342H C H C H C 、、都是烯烃,熔沸点的高低顺序为:846342H C H C H C <<;再有Cl CH CH Cl CH 233<,CHO CH HCHO 3<等。 同类型的同分异构体之间,主链上碳原子数目越多,烃的熔沸点越高;支链数目越多,空间位置越对称,熔沸点越低。如4332233323)CH (C CH CHCH )CH (CH )CH (CH >>。 例1:下列物质的沸点按由高到低的顺序排列正确的是( ) ①3223CH )CH (CH ②3323CH )CH (CH ③CH )CH (33 ④3223CH CHCH )CH ( A. ②④①③ B. ④②①③ C. ④③②① D. ②④③① 答案:A 2. 醇 由于分子中含有—OH ,醇分子之间存在氢键,分子间的作用力较一般的分子间作用力强,因此与相对分子质量相近的烃比较,醇的熔沸点高的多,如OH CH CH 23的沸点为78℃,323CH CH CH 的沸点为-42℃,23CH CH CH =的沸点为-48℃。 影响醇的沸点的因素有: (1)分子中—OH 个数的多少:—OH 个数越多,沸点越高。如乙醇的沸点为78℃,乙二醇的沸点为179℃。 (2)分子中碳原子个数的多少:碳原子数越多,沸点越高。如甲醇的沸点为65℃,乙醇的沸点为78℃。 3. 羧酸 羧酸分子中含有—COOH ,分子之间存在氢键,不仅羧酸分子间羟基氧和羟基氢之间存在氢键,而且羧酸分子间羰基氧和羟基氢之间也存在氢键,因此羧酸分子之间形成氢键的机会比相对分子质量相近的醇多,因此羧酸的沸点比相对分子质量相近的醇的沸点高,如1-丙醇的沸点为97.4℃,乙酸的沸点为118℃。 影响羧酸的沸点的因素有:
有机物重要的物理性质
有机物重要的物理性质 1.有机物的密度 (1)小于水的密度,且与水(溶液)分层的有:各类烃、一氯代烃、酯(包括油脂) (2)大于水的密度,且与水(溶液)分层的有:多氯代烃、溴代烃(溴苯等)、碘代烃、硝基苯 2.有机物的状态[常温常压(1个大气压、20℃左右)] (1)气态: ①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态 ②衍生物类: 一氯甲烷(CH3Cl,沸点为-24.2℃)氟里昂(CCl2F2,沸点为-29.8℃) 氯乙烯(CH2==CHCl,沸点为-13.9℃)甲醛(HCHO,沸点为-21℃) 氯乙烷(CH3CH2Cl,沸点为12.3℃)一溴甲烷(CH3Br,沸点为3.6℃) 四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃) 甲乙醚(CH3OC2H5,沸点为10.8℃)环氧乙烷(,沸点为13.5℃) (2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。如, 己烷CH3(CH2)4CH3环己烷 甲醇CH3OH甲酸HCOOH 溴乙烷C2H5Br乙醛CH3CHO 溴苯C6H5Br硝基苯C6H5NO2 ★特殊: 不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态
(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。如, 石蜡C12以上的烃 饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态 ★特殊:苯酚(C6H5OH)、苯甲酸(C6H5COOH)、氨基酸等在常温下亦为固态 3.有机物的颜色 ☆绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色,常见的如下所示: ☆三硝基甲苯(俗称梯恩梯TNT)为淡黄色晶体; ☆部分被空气中氧气所氧化变质的苯酚为粉红色; ☆2,4,6-三溴苯酚为白色、难溶于水的固体(但易溶于苯等有机溶剂); ☆苯酚溶液与Fe3+(aq)作用形成紫色[H3Fe(OC6H5)6]溶液; ☆多羟基有机物如甘油、葡萄糖等能使新制的氢氧化铜悬浊液溶解生成绛蓝色溶液; ☆淀粉溶液(胶)遇碘(I2)变蓝色溶液; ☆含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。 有机物重要的物理性质 有机物的溶解性 (1)难溶于水的有:各类烃、卤代烃、硝基化合物、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。 (2)易溶于水的有:低级的[一般指N(C)≤4]醇、(醚)、醛、(酮)、羧酸及盐、氨基酸及盐、单糖、二糖。(它们都能与水形成氢键)。 (3)具有特殊溶解性的:
最新有机化合物概述教案资料
第五单元 有机化合物概述 第一节 有机化合物及其特性 自然界的物质种类繁多,数不胜数。为了系统研究各种物质,根据它们的组成、结构、性质及来源,通常将物质分为无机化合物和有机化合物两大类。化学家最初界定无机物和有机物就是从它们的来源的不同出发的。19世纪以前,人们已知的有机物都从动植物等有机体中取得,所以把这类化合物叫做有机物。到19世纪20年代,科学家先后用无机物人工合成了许多有机物,如尿素、醋酸、脂肪等等,从而打破有机物只能从有机体中取得的观念。现在有机化合物的名称已失去原有的意义,只是化学界仍在沿用这一习惯名称。有机物遍布于人类的物质世界,在人们的衣食住行、医疗卫生、工农业生产、能源、材料、生命科学等领域中起着重要的作用。在本章中,我们主要学习有机物的概念、结构、特性和分类等一些基础知识。 一、有机化合物的概念 大多数有机化合物由碳、氢、氧、氮等元素组成,少数还含有硫、磷、卤素等。这几种为数不多的元素,以不同的原子数目和排列方式组成不同的有机化合物分子。任何一种有机化合物,其分子组成中都含有碳元素,绝大多数还含有氢元素。由于有机化合物分子中的氢原子可以被其他的原子或原子团所替代,从而衍生出许多不同种类的有机化合物,所以现代人们把碳氢化合物及其衍生物称为有机化合物,简称有机物。研究有机化合物的化学称为有机化学。但并非所有的含碳化合物都是有机物,少数含碳化合物如:一氧化碳、二氧化碳、碳酸及其盐、金属碳化物等,由于其组成和性质与无机物相似,习惯上仍把它们归为无机物。 有机化合物与医学的关系十分紧密。人体组织主要由有机物组成,如生命物质蛋白质、糖类、脂肪、维生素等都属于有机物,人类生命的过程,主要为人体内有机化学反应的结果;绝大多数合成药物和中草药的有效成分,都是有机物,它们的结构和性质决定了应用及疗效。所以学习有机化学基础知识,对学习医学、护理学、药学等科学是非常必要的。 二、有机化合物的结构 有机化合物的结构特点,主要是由碳原子的结构特点决定的。 (一)碳原子的结构 碳原子位于元素周期表中第2周期第ⅣA 族, 最外层有4个电子,它既不容易失去电子也不容易得到电子,为不活泼的非金属元素。因此,在有机化合物中碳原子易与其它原子共
有机化合物重要理化性质
有机化合物重要理化性质 一、有机化合物的沸点 有机化合物沸点的高低,主要取决于分子间引力的大小,分子间引力越大,沸点就越高,反之则越小。而分子间引力的大小受分子的偶极矩、极化度、氢键等因素的影响。具体可以归纳出4条规律: 1、在同系物中,随着分子相对质量增加,沸点升高;直链异构体的沸点高于支链异构体;支链愈多,沸点愈低。 2、 含有极性基团的化合物偶极矩增大,其沸点比母体烃类化合物沸点高。同分异构体的沸点一般是:伯异构体>仲异构体>叔异构体。 3、当分子中入能形成缔合氢键时,则沸点显著升高,且形成的氢键越多,沸点越高。 4、在顺反异构体中,一般顺式异构体的沸点高于反式。 二、有机化合物的熔点 有机化合物熔点的高低取决于晶格引力的大小,晶格引力愈大,熔点愈高,反之则越小。而晶格引力的大小,主要主要取决于分子间作用力性质、分子结构形状以及晶格的类型,其中以离子间的电性吸引力最大,偶极分子间的吸引力与分子间的缔合次之,非极性分子间的色散力最小。因此,化合物的熔点与其结构可以归纳出以下5条规律: 1、以离子为晶格单位的无机盐、有机盐或能形成内盐的氨基酸等都有很高的熔点。 2、在分子中引入极性基团,偶极矩增大,熔点、沸点都升高,故极性化合物比相对分子质量接近的非极性化合物的熔点高。 3、在分子中引入极性基团,偶极矩增大,熔点、沸点都升高,故极性化合物比相对分子质量接近的非极性化合物的熔点高;但是当羟基上引入烃基时,则熔点降低。 4、能形成分子间氢键的比形成分子内氢键的熔点高。 5、同系物中,熔点随分子相对质量的增大而升高,且分子结构愈对称,排列愈整齐,熔点升高。 CH 3CH 2CH 2CH 3 ;CH 3CH 2CH 2CH 2CH 3 ;CH 3CHCH 2CH 3 ;CH 3 C CH 3 ; CH 3CH 3 CH 3< < < CH 3CH 2CH 2CH 3 ;CH 3CH 2CH 2CH 2Cl ;CH 3CH 2CH 2CH 2NO 2 ;沸点: - 0.5℃ 78.4℃ 153℃ CH 3CH 2CH 2CH 2OH ;CH 3CHCH 2CH 3 ; C CH 3CH 3CH 3 ;沸点: 11.7℃ 99.5℃ 82.5℃ CH 3CH 2CH 3 ;CH 3CH 2CH 2OH ;CH 2CH 2CH 2 ;CH 2CHCH 2 ;沸点: -45℃ 97℃ 216℃ 290℃ H H Cl Cl CH 3CH 3H H 3C C H H Cl C C 沸点: 60.1℃ 48℃ 37℃ 29℃
有机物物理性质的主要规律
有机物物理性质的主要规律 有机物化学性质实质就是官能团的性质,因而规律明显,记忆方便,但有机物的物理性质可谓各显其色、五花八门。在此化学姐从某一角度把有机物物理性质进行总结,方便大家记忆。 1密度 物质的密度是指单位体积里所含物质的质量,它与该物质的相对分子质量、分子半径等因素有关。一般来说,有机物的密度与分子中相对原子质量大的原子所占质量分数成正比。例如,烷、烯、炔及苯的同系物等物质的密度均小于水的密度,并且它们的密度均随分子中碳原子数的增加和碳元素的质量分数的增大而增大;而一卤代烷、饱和一元醇随分子中碳原子数的增加,氯元素、氧元素的质量分数降低,密度逐渐减小。 2溶解性 有机物一般不易溶于水,而易溶于有机溶剂,这是因为有机物分子大多数是非极性分子或弱极性分子,含有憎水基。根据“相似相溶”原理,水是极性分子,只有当某有机物分子中含有亲水基团时,则该有机物就可能溶于水。 亲水基一般包括:-OH、-CHO、COOH等;憎水基一般包括:-R、-NO2、-X、-COOR等。 1. 能溶于水的有机物: ①小分子醇:CH3OH、C2H5OH、CH2OHCH2OH、甘油等; ②小分子醛:HCHO、CH3CHO、CH3CH2CHO等; ③小分子羧酸:HCOOH、CH3COOH、CH3CH2COOH等; ④低糖:葡萄糖(C6H12O6)、果糖(C6H12O6)、蔗糖(C12H22O11); ⑤氨基酸:CH3CH(NH2)COOH等。
一般来说,低级醇、低级醛、低级酸,单糖和二糖水溶性好,即亲水基占得比重相对较大,憎水基占得比重相对较小,故能溶于水。 2. 不易溶于水的有机物: ①烷、稀、炔、芳香烃等烃类均不溶于水,因为其分子内不含极性基团; ②卤代烃:CH3Cl、CHCl3、CCl4、CH3CH2Br、等均不溶于水; ③硝基化合物:硝基苯、TNT等; ④酯:CH3COOC2H5、油脂等; ⑤醚:CH3OCH3、C2H5OC2H5等; ⑥大分子化合物或高分子化合物:如高级脂肪酸、塑料、橡胶、纤维等。 一般来说,液态烃、一氯代烃、苯及其同系物、酯类物质不溶于水且密度比水小;硝基苯、溴苯、四氯化碳、氯仿、溴代烃、碘代烃不溶于水且密度比水大。 3. 有机物在汽油、苯、四氯化碳等有机溶剂中的溶解性与在水中的相反: 如乙醇是由较小憎水基团C2H5和亲水基团-OH构成,所以乙醇易溶于水,同时因含有憎水基团,所以必定也溶于四氯化碳等有机溶剂中。其它醇类物质由于都含有亲水基团-OH,小分子都溶于水,但在水中的溶解度随着憎水基团的不断增大而逐渐减小,在四氯化碳等有机溶剂中的溶解度则逐渐增大。 4. 特殊物质(苯酚)在常温时,在水里溶解度不大,当温度高于65℃时,能和水以任意比例互溶。 3熔、沸点 熔、沸点是物质状态变化的标志,有机物熔、沸点的高低与分之间的相互作用、分子的几何形状等因素有关。
常用有机溶剂的物理常数
常用有机溶剂的物理常数
常用有机溶剂的物理常数 溶剂熔点沸点密度折射率介电常 数 摩尔折射 率 偶极矩 Acetic acid 乙酸17 118 1.049 1.3716 6.15 12.9 1.68 Acetone 丙酮-95 56 0.788 1.3587 20.7 16.2 2.85 Acetonitrile 乙腈-44 82 0.782 1.3441 37.5 11.1 3.45 Anisole 苯甲醚-3 154 0.994 1.5170 4.33 33 1.38 Benzene 苯 5 80 0.879 1.5011 2.27 26.2 0.00 Bromobenzene 溴苯-31 156 1.495 1.5580 5.17 33.7 1.55 Carbon disulfide 二硫化碳-112 46 1.274 1.6295 2.6 21.3 0.00 Carbon tetrachloride 四氯化碳-23 77 1.594 1.4601 2.24 25.8 0.00 Chlorobenzene 氯苯-46 132 1.106 1.5248 5.62 31.2 1.54 Chloroform 氯仿-64 61 1.489 1.4458 4.81 21 1.15 Cyclohexane 环己烷 6 81 0.778 1.4262 2.02 27.7 0.00 Dibutyl ether 丁醚-98 142 0.769 1.3992 3.1 40.8 1.18 o –Dichlorobenzene 邻二氯苯-17 181 1.306 1.5514 9.93 35.9 2.27 1,2-Dichloroethane 1,2-二氯乙 烷 -36 84 1.253 1.4448 10.36 21 1.86 chloromethane 二氯甲烷-95 40 1.326 1.4241 8.93 16 1.55 Diethylamine 二乙胺-50 56 0.707 1.3864 3.6 24.3 0.92 Diethyl ether 乙醚-117 35 0.713 1.3524 4.33 22.1 1.30 1,2-Dimethoxyethane 1,2-二甲 氧基乙烷 -68 85 0.863 1.3796 7.2 24.1 1.71 N,N –Dimethylacetamide N,N- 二甲基乙酰胺 -20 166 0.937 1.4384 37.8 24.2 3.72 N,N –Dimethylformamide N,N-二甲基甲酰胺 -60 152 0.945 1.4305 36.7 19.9 3.86 Dimethyl sulfoxide二甲基亚砜19 189 1.096 1.4783 46.7 20.1 3.90 1,4-Dioxane 1,4-二氧六环12 101 1.034 1.4224 2.25 21.6 0.45 Ethanol 乙醇-114 78 0.789 1.3614 24.5 12.8 1.69 Ethyl acetate 乙酸乙酯-84 77 0.901 1.3724 6.02 22.3 1.88 Ethyl benzoate 苯甲酸乙酯-35 213 1.050 1.5052 6.02 42.5 2.00 Formamide 甲酰胺 3 211 1.133 1.4475 111.0 10.6 3.37 Hexamethylphosphoramide 7 235 1.027 1.4588 30.0 47.7 5.54 Isopropyl alcohol 异丙醇-90 82 0.786 1.3772 17.9 17.5 1.66
有机代表物质的物理性质
理科有机物考点全汇总(一) 一、有机代表物质的物理性质 1. 状态 固态:饱和高级脂肪酸、脂肪、TNT、萘、苯酚、葡萄糖、果糖、麦芽糖、淀粉、纤维素、醋酸(16.6℃以下) 气态:C4以下的烷烃、烯烃、炔烃、甲醛、一氯甲烷 液态:油状: 硝基苯、溴乙烷、乙酸乙酯、油酸 粘稠状: 石油、乙二醇、丙三醇 2. 气味 无味:甲烷、乙炔(常因混有PH3、H2S和AsH3而带有臭味) 稍有气味:乙烯 特殊气味:苯及同系物、萘、石油、苯酚 刺激性:甲醛、甲酸、乙酸、乙醛 甜味:乙二醇、丙三醇、蔗糖、葡萄糖 香味:乙醇、低级酯苦杏仁味:硝基苯 3. 颜色
白色:葡萄糖、多糖 淡黄色:TNT、不纯的硝基苯 黑色或深棕色:石油 4. 密度 比水轻的:苯及苯的同系物、一氯代烃、乙醇、低级酯、汽油 比水重的:硝基苯、溴苯、乙二醇、丙三醇、CCl4、氯仿、溴代烃、碘代烃 5. 挥发性: 乙醇、乙醛、乙酸 6. 升华性: 萘、蒽 7. 水溶性 不溶:高级脂肪酸、酯、硝基苯、溴苯、烷烃、烯烃、炔烃、苯及同系物、萘、蒽、石油、卤代烃、TNT、氯仿、CCl4 能溶:苯酚(0℃时是微溶) 微溶:乙炔、苯甲酸 易溶:甲醛、乙酸、乙二醇、苯磺酸 与水混溶:乙醇、苯酚(70℃以上) 、乙醛、甲酸、丙三醇 二、有机物之间的类别异构关系 1. 分子组成符合CnH2n(n≥3)的类别异构体: 烯烃和环烷烃; 2. 分子组成符合CnH2n-2(n≥4)的类别异构体: 炔烃和二烯烃; 3. 分子组成符合CnH2n+2O(n≥3)的类别异构体: 饱和一元醇和饱和醚; 4. 分子组成符合CnH2nO(n≥3)的类别异构体: 饱和一元醛和饱和一元酮; 5. 分子组成符合CnH2nO2(n≥2)的类别异构体: 饱和一元羧酸和饱和一元酯; 6. 分子组成符合CnH2n-6O(n≥7)的类别异构体: 苯酚的同系物,芳香醇及芳香醚; 如n=7,有以下五种: 邻甲苯酚,间甲苯酚,对甲苯酚;苯甲醇;苯甲醚. 7. 分子组成符合CnH2n+2O2N(n≥2)的类别异构体: 氨基酸和硝基化合物.
有机化合物的物理性质与相关计算
有机化合物的物理性质与相关计算 一、有机物的物理性质 1.沸点 (1)同系物的沸点随着相对分子质量的增大而升高。如:CH4、C2H6、C3H8、C4H10都是烷烃,沸点的高低顺序为: (2)同类型的同分异构体之间,支链数目越多,沸点越低,如;结构越对称,沸点越低,如(以C8H10为例);芳香族化合物如苯的二取代物,一般,邻位____间位_____对位。 (3)从状态看:g < l < s (4)从分子极性看:分子极性越强,熔沸点越高,如C2H5OH CH3OCH3 2、状态 (1)随着分子中碳原子数的增多,烃由气态经液态到固态。分子中含有1~4个碳原子的烃一般为气态,5~16个碳原子的烃一般为液态(新戊烷沸点是9.5 ℃为特例),17个以上的为固态。 (2)卤代烃中CH3Cl为气态(CH3CH2Cl沸点为12.3℃),其余卤代烃一般为液态。 (3)醇类、羧酸类物质中由于含有—OH,分子之间存在氢键,所以醇类、羧酸类物质分子中碳原子较少的,在通常状况下呈液态,分子中碳原子较多的呈固态,如:甲醇、乙醇、甲酸和乙酸等呈液态。 (4)醛类 通常状况下除碳原子数较少的甲醛呈气态、乙醛等几种醛呈液态外,相对分子质量大于100的醛一般呈固态。 3、密度 烃的密度一般随碳原子数的增多而增大;一氯代烷的相对密度随着碳原子数的增加而减小。 注意: (1)通常气态有机物的密度与空气相比,相对分子质量大于29的,比空气的密度大。 (2)通常不溶于水的液态有机物的密度与水相比: 密度比水小的有烃、酯、、油脂、一氯代烷、油酸等高级脂肪酸等; 密度比水大的有硝基苯、四氯化碳、氯仿等多卤代烃等。 4、溶解性 研究有机物的溶解性时,常将有机物分子的基团分为亲水基和憎水基:具有不溶于水的性质或对水无吸引力的基团,称为_______;具有溶于水的性质或对水有吸引力的基团,称为________。有机物的溶解性由分子中亲水基团和憎水基团的溶解性决定。 (1)官能团的溶解性 常见的亲水基:__________________________________________________; 常见的憎水基:_________________________________________________。 (2)有机物在汽油、苯、四氯化碳等有机溶剂中的溶解性与在水中相反。如乙醇是由较小憎水基团和亲水基团—OH构成,所以乙醇易溶于水,同时因含有憎水基团,所以也必定溶于四氯化碳等有机溶剂中。其他醇类物质由于都含有亲水基团—OH,小分子都溶于水,但在水中的溶解度随着憎水基团的不断增大而逐渐减小,在四氯化碳等有机溶剂中的溶解度则逐渐增大。 5、气味 中学化学中涉及到的很多有机物具有一定的气味,如:苯、苯酚_______,硝基苯_________,甲醛、乙醛、乙酸________,低级酯(如乙酸乙酯)_______。 6、颜色 中学化学中接触到的小分子有机物绝大多数为无色,苯酚为______晶体,露置在空气中常显________色,这是由于__________________,混有Br2的溴苯为________色。
