高中化学总结性复习-07-元素周期表 元素周期律(通用)

第7讲 元素周期表 元素周期律
原子半径、主要化合价的周期性变化,了解元素周期律。
2.了解元素周期表的结构(周期、族),知道金属、非金属在周期表中的位置。
3.以第三周期元素为例,知道同周期元素性质递变规律与原子结构的关系。
4.以IA
、VIIA 元素为例,理解同主族元素性质的递变规律与原子结构的关系。
5.了解元素周期表在科学研究、地质探矿等领域的广泛应用,从多角度、多层面了解元
1.元素周期律的涵义及实质:通过该知识点,培养学生归纳能力和推理能力及迁移应用
能力。
2.微粒半径比较及元素金属性非金属性强弱的比较:通过该知识点,培养学生分析综合
能力,推理能力。该知识点易于与重要元素及其化合物的知识点结合起来进行综合考查。
3.元素周期表的结构与原子结构的关系及相互推断:通过该知识点,培养学生分析综合
能力,归纳推理及演绎推理能力。
4.同周期、同主族元素性质的递变规律及位、构、性三者的相互推断:通过该知识点培
养学生的理解能力,归纳推理能力及迁移运用能力。该知识点易于与元素化合物知识结合
起来综合考查,也易出现推断和预测未知新元素的位、构、性等信息考查题型。
5.元素周期表对科研及生产的指导作用
通过该知识点,培养学生分析推理能力,创造思维能力及自学能力。该知识点易与工
农业生产上有重要用途的一些重要元素化合物知识结合起来(如催化剂、农药等)进行综合能
力考查。
一、知识体系:
随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化:
①、原子最外层电子数呈周期性变化
元素周期律 ②、原子半径呈周期性变化
③、元素主要化合价呈周期性变化 ④、元素的金属性与非金属性呈周期性变化 ①、按原子序数递增的顺序从左到右排列;
具体
表现
形
式七八
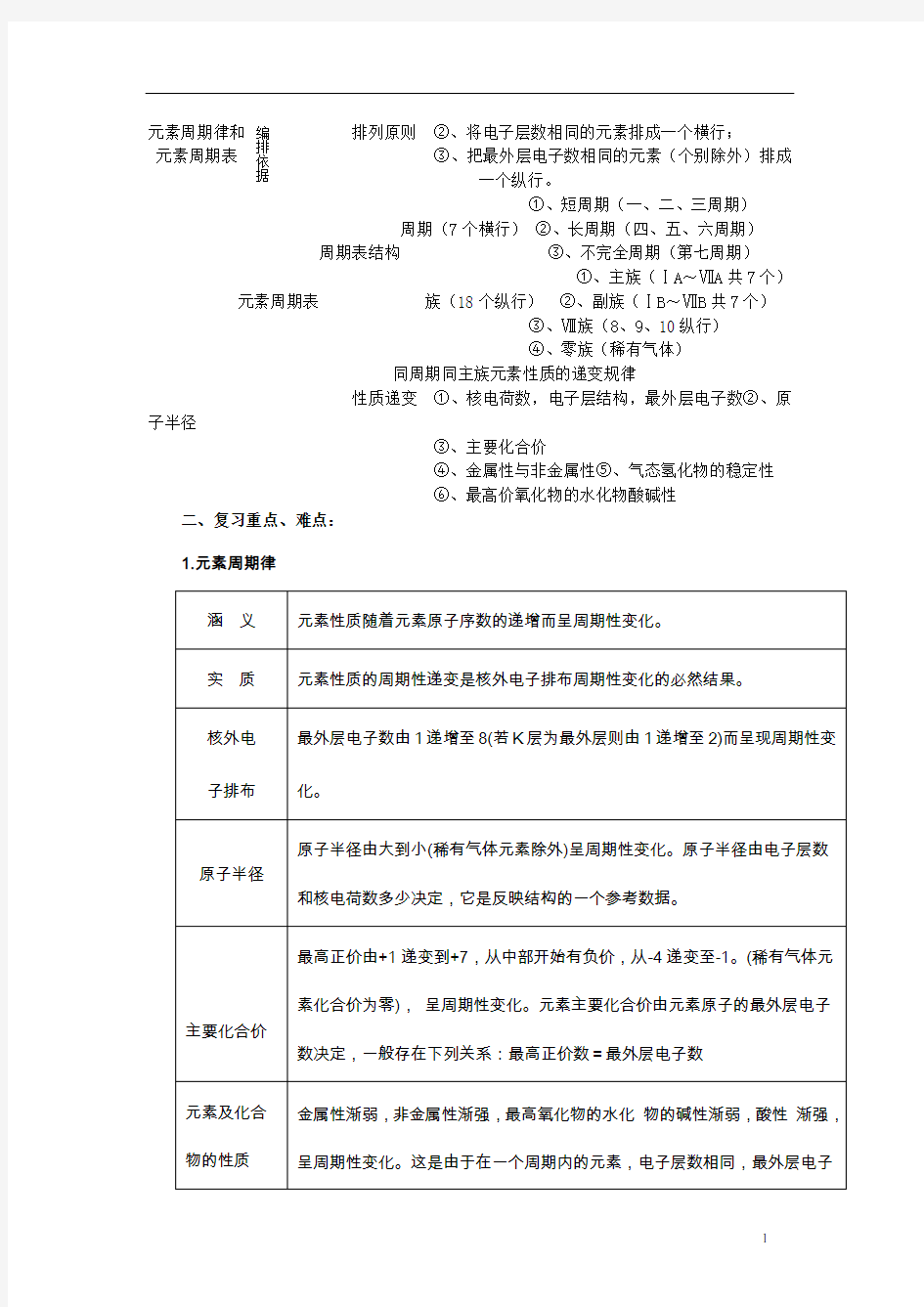
元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。
①、短周期(一、二、三周期)
周期(7个横行) ②、长周期(四、五、六周期)
周期表结构 ③、不完全周期(第七周期)
①、主族(ⅠA ~ⅦA 共7个)
元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个)
③、Ⅷ族(8、9、10纵行)
④、零族(稀有气体)
同周期同主族元素性质的递变规律
性质递变 ①、核电荷数,电子层结构,最外层电子数②、原
子半径
③、主要化合价
④、金属性与非金属性⑤、气态氢化物的稳定性
⑥、最高价氧化物的水化物酸碱性
二、复习重点、难点:
1.元素周期律
编排依
据
2.简单微粒半径的比较方法
3.元素金属性和非金属性强弱的判断方法
4.元素周期表的结构
5.同周期、同主族元素性质的递变规律
原子结构核电荷数逐渐增大增大
电子层数相同增多
原子半径逐渐减小逐渐增大
化合价最高正价由+1→+7
负价数=8-族序数
最高正价和负价数均相
同,最高正价数=族序数元素的金属性和非金属性金属性逐渐减弱,非
金属性逐渐增强。
金属性逐渐增强,非金属
性逐渐减弱。
单质的氧化性和还原性氧化性逐渐增强,还
原性逐渐减弱。
氧化性逐渐减弱,还原性
逐渐增强。
最高价氧化物的水化物的酸碱
性
酸性逐渐增强,碱性
逐渐减弱。
酸性逐渐减弱,碱性逐渐
增强。
气态氢化物的稳定性、还原性,
水溶液的酸性。
稳定性逐渐增强,还
原性逐渐减弱,酸性
逐渐增强。
稳定性逐渐减弱,还原性
逐渐增强,酸性逐渐减弱。
6.元素的原子结构,在周期表中的位置及元素性质之间的关系。7.解答元素推断题的一些规律和方法
元素的推断多为文字叙述题。考查该知识点的题型主要有选择题、填空题、推断题等,涉及知识面广,常给出如下条件:结构特点,性质特点,定量计算。常需运用相关的基础知识去解决问题。
(1)根据原子序数推断元素在周期表中的位置。
记住稀有气体元素的原子序数:2、10、18、36、54、86。用原子序数减去比它小而相近的稀有气体元素的原子序数,即得该元素所在的纵行数。再运用纵行数与族序数的关系确定元素所在的族;这种元素的周期数比相应的稀有气体元素的周期数大1。
(2)根据位置上的特殊性确定元素在周期表中的位置。
主族序数等于周期数的短周期元素:H、Be、Al。
主族序数等于周期数2倍的元素:C、S。
最高正价与最低负价代数和为零的短周期元素:C、Si
短周期中最高正价是最低负价绝对值3倍的元素:S。
(3)根据元素性质、存在、用途的特殊性。
形成化合物种类最多的元素、或单质是自然界中硬度最大的物质的元素、或气态氢化物中氢的质量分数最大的元素:C。
空气中含量最多的元素、或气态氢化物的水溶液呈碱性的元素:N。
地壳中含量最多的元素、或气态氢化物的沸点最高的元素、或气态氢化物在通常情况下呈现液态的元素:O。
最活泼的非金属元素:F;最活泼的金属元素:Cs;最轻的单质的元素:H;最轻的金属元素:Li;单质的着火点最低的非金属元素是:P。
8、周期表中部分规律总结
(1)最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1
或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He 除外)。
(2)在周期表中,第ⅡA与ⅢA族元素的原子序数差别有以下三种情况:①第1~3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差25。
(3)同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅢA~ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
(4)元素周期表中金属和非金属之间有一分界线,分界线右上方的元素为非金属元素,分界线左下方的元素为金属元素(H除外),分界线两边的元素一般既有金属性,也有非金属性。
(5)对角线规则:沿周期表中金属与非金属分界线方向对角(左上角与右下角)的两主族元素性质相似,这一规律以第二、三周期元素间尤为明显。
典例解析
例1、推断下列微粒的名称,并用电子式表示其形成过程
(1)离子化合物AB,阳离子比阴离子多一个电子层,1mol AB中含12mol电子,则化合物的名称为__________,形成过程为___________。
(2)由第三周期元素的半径最大的阳离子和半径最小的阴离子形成的化合物为
___________,名称为___________,形成过程为___________。
解析:(1)AB为离子化合物,则A为金属元素,B为非金属元素,且A、B、的原子序数小于12。A可能为Li、Be、Na,B可能为H、O、F,又因阳离子与阴离子中,半径最大的阳离子为Na+,半径最小的阴离子为Cl—。
答案(1)氢化钠,
(2)NaCl氯化钠,
例2、某元素的离子R2+有5个电子层,最外层有2个电子。当RCl2固体配成溶液时,为得到澄清溶液并防止变质,常在溶液中加入少量R单质和盐酸,下列叙述正确的是()
A、R为ⅡA族元素
B、R的最高价氧化物的对应水化物是强碱
C、R2+的硝酸盐水溶液呈中性
D、RCl2有还原性,可进一步被氧化
解析:R2+最外层有2个电子,说明R为ⅣA族金属元素,其最高价氧化物对应水化物应是弱碱。为防止变质,往溶液中加入R是为了防止R2+被氧化,加入盐酸是防止发生水解。答案:D。
点评:本题可以由已有知识:“在配制FeSO4溶液时,加入少量铁屑和稀盐酸,以防止
Fe2+被氧化和发生水解而变质”。进行迁移。
例3、某元素R具有微弱放射性,其原子核内中子数比质子数多43。由R组成的固体单质A,在一定条件下密度为6.88g·cm-3。用X射线研究固体A表明,在边长为1.00×10-7cm 的立方体中含有20个原子。R在化学反应中常表现为+2价、+4价。在溶液中R2+稳定,而R4+有强氧化性,可将NO氧化为HNO3。氧化物R3O4其性质与Fe3O4有些类似。R的另一种质量数比R少2的同位素较为稳定,与铁可形成合金,在潮湿环境中易形成铁锈。R的单质及化合物在工农业生产、医疗卫生、科学技术等各个领域都有很多用途。请回答:(1)R原子的摩尔质量为_________________。
(2)R元素处于周期表中第______周期_______族。
(3)假若使少量R4+加到Fe(NO3)2溶液中,是否会发生反应?若“否”,说明原因;若“是”,请写出离子方程式______________。
(4)R3O4因具有氧化性,被大量用于油漆涂料,涂在钢铁表面,有利于形成耐腐蚀的钝化层。R3O4与足量HNO3反应,生成R的氧化物、R的硝酸盐和水三种物质,此反应的方程式为:_____________________________________。
解析:(1)据题意:含20个R原子的立方体体积为1.0×10-21cm3,则每立方厘米的空间含R原子:
则R原子摩尔质量为6.88g·cm-3÷( mol·cm-3)=207g·mol-1
(2)由于原子的摩尔质量在数值上近似等于其质量数。设质子数为x,有:x+(x+43)=207得x=82。
再由稀有气体定位法86-82=4,故R为第六周期ⅣA族,其对应元素为Pb元素。
(3)因Pb4+能将NO氧化成HNO3,即氧化性Pb4+>HNO3,而氧化性:HNO3>Fe3+,故氧化性Pb4+>Fe3+。反应为:Pb4++2Fe2+=Pb2++2Fe3+
(4)把Pb3O4改写成2PbO·PbO2,PbO为碱性氧化物,能与酸反应,且HNO3不能氧化Pb2+(因氧化性Pb4+>HNO3),而PbO2不属碱性氧化物,不与HNO3反应,Pb3O4+4HNO3=PbO2+2Pb(NO3)2+2H2O
点评:解答此类题目也可先猜后算,即由题目所给信息进行推断,如本题:R的常见化合价+2、+4(可能是ⅣA族),溶液中R2+稳定,而R4+有强氧化性(碳族中只有Pb是低价稳定)。氧化物R3O4(可能为Pb3O4),R与铁形成的合金在潮湿的环境中形成铁锈(形成原电池,Fe活泼作负极被氧化)。再进行相关运算。
例4、不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。试根据元素在周期表中的位置,分别图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是:_______________________;各主族中E 值的这种变化特别体现了元素性质的_______变化规律;
(2)同周期内,随原子序数增大,E值增大,但个别元素的E值出现反常现象。试预测下列关系式中正确的是_________(填写编号,多选倒扣);
①E(砷)>E(硒)②E(砷)
④E(溴) (3)估计1mol气态Ca原子失去最外层一个电子所需能量E值的范围:_____ (4)10号元素E值较大的原因是_______________________。 解析:(1)随着原子序数增大,E值变小,周期性;(在同一主族中,随着原子序数增大,原子半径增大,原子核对最外层电子的吸引力减小,失去电子能力增大,即E值减小;)(2)①③(在同一周期内,出现反常现象的是第二主族的E值大于第三主族,第五主族的E值大于第六主族,选项中①属反常现象,③属正常现象;)(3)419、738;(1mol气态Ca 原子失去最外层一个电子所需能量E值应大于K原子的E值小于Mg原子的E值。)(4)10号元素是氖,该元素原子的最外层电子排布已达到8电子稳定结构。 例5、(2002·上海化学·25)制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境的温度降低,达到制冷的目的。人们曾采用过乙醚、CH3Cl等作制冷剂,但它们不是有毒,就易燃烧。于是科学家根据元素性质的递变规律来开发新的制冷剂。根据现有的知识,某些元素化合物的易燃性、毒性变化趋势如下:(1)氢化物的易燃性:第二周期>>H2O>HF;第三周期 SiH4>PH3>> (2)化合物的毒性:(用>或<=填空) PH3>NH3 H2S H2O; CS2 CO2 CCl4>CF4 (3)已知CCl4的沸点为76.8℃。CF4的沸点为-128℃。新制冷剂的沸点介于其间。经过较长 时间的反复试验,一种新的制冷剂氟里昂CF2Cl2终于诞生了,其它类似的还可以是。 (4)然而这种制冷剂造成了当今的某种环境问题是。但求助于周期表中元素及化合物的变化趋势来开发制冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分) ①毒性②沸点③易燃性④水溶性⑤颜色 A.①②③B.②④⑤C.②③④ 解析;此题介绍了制冷剂的使用以及对环境的污染和开发新制冷剂的思路,阅读后感到耳目一 新,但此题所考的知识点却很简单,属于典型的起点高落点低的题目。 根据元素周期律和周期表不难完成,由题目信息毒性:PH3>NH3及同主族元素所形成的组成和结构相似的物质的毒性,从上而下逐渐增大;(3)由氟里昂的组成CF2Cl2就很容易联想到类似的物质CF3Cl、、CFCl3(4)根据题目的信息,可以总结出一般开发新的制冷剂要注意的问题包括:毒性、沸点、可燃性、以及对环境的危害等因素。 解答:(1)CH4>NH3 H2S>HCl (2) >>(3)CF3Cl或CFCl3(4)大气臭氧层出现空洞,A 例6、(2003·上海·25)下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。 (1)下列(填写字母编号)组元素的单质可能是电的良导体。 A.a、c、h B.b、g、k C.c、h、l D.d、e、f (2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响: ⒈原子核对核外电子的吸引力⒉形成稳定结构的倾向 下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1) ①通过上述信息和表中的数据分析为什么锂原子失去第二个核外电子时所需的能量要远远大于失去第一个电子所需的能量。 ②表中的X可能为以上13种元素中的(填写元素符号)元素。用元素符号表示X和j形成化合物的化学式。 ③Y是周期表中的族元素。 ④以上13种元素中(填写字母)元素原子失去核外第一个电子需要的能量最多 解析:(1)从所给元素在周期表中的位置不难知道a、d、c、f分别为Na、Mg、Sr和Al,e处于过渡元素区也一定为金属,它们都是电的良导体;h为碳元素,其单质中的一种石墨也是电的良导体,故应选A、D两组 (2)①锂原子核外共有3个电子,其中两个在K层,当失去最外层的一个电子后,锂离子处于稳定结构,根据题给信息2可知,要使锂离子再失去一个电子便会形成不稳定结构,因此锂离子失去第二个电子时所需的能量远大于失去第一个电子所需的能量。 ②由表中数据可知:X失去第二个电子所需能量远大于失去第一个电子所需的能量(9倍多),而失去第三个、第四个电子所需的能量皆不足前者的2倍,故第一个电子为最外层电子,而其它几个电子应处于内层。结合所给的周期表知,X应为a即钠元素,j即氧元素,二者形成的化合物的化学式分别为:Na2O和Na2O2 ③由表中Y的数据可知,Y失去第一、二、三个电子所需的能量差别不大,而失去第四个电子所需的能量远大于失去第三个电子所需的能量,因此Y元素最外层由三个电子即为第ⅢA主族元素Al。 ④从题目信息知道,原子失电子所需的能量不仅与原子核对核外电子的吸引力有关,还与形成稳定结构的倾向有关。结构越稳定失电子所需的能量越高,在所给的13种元素中,处于零族的m元素已达8电子的稳定结构,因此失去核外第一个电子需要的能量最多。 解答:(1)a d (2)①Li失去一个电子后形成稳定结构,在失去一个电子很困难②a Na2O和Na2O2③第三主族或ⅢA ④m 一、选择题 1. 下列叙述正确的是:() A.同一主族的元素,原子半径越大,其单质的熔点一定越高 B.同一周期元素的原子,半径越小越容易失去电子 C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 D.稀的气体元素的原子序数越大,其单质的沸点一定越高 2.下列说法正确的是() A.ⅠA族元素的金属性比ⅡA族元素的金属性强 B.ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 C.同周期非金属氧化物对应的水化物的酸性从左到右依次增强 D.第三周期元素的离子半径从左到右逐渐减小 3. X、Y、Z是3种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是() A.元素非金属性由弱到强的顺序为Z<Y<X B.Y元素最高价氧化物对应水化物的化学式可表示为H3YO4 C.3种元素的气态氢化物中,Z的气态氢化物最稳定 D.原子半径由大到小的顺序为Z>Y>X 4.下列说法中错误的是() A.原子及其离子的核外电子层数等于该元素所在的周期数 B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 C.除氦以外的稀有气体原子的最外层电子数都是8 D.同一元素的各种同位素的物理性质、化学性质均相同 5.某短周期元素X的气态氢化物与该元素最高价氧化物的水化物反应生成盐,则该元素() A.在周期表中处于第三周期,第ⅦA族 B.处于第二周期VA族 C.氢化物没有PH3、H2S稳定 D.常见价态只有-3、+2、+3、+5价6.在元素周期表中,主族元素自ⅢA族的硼到ⅦA族的砹连一条斜线,即为金属和非金属的分界线,从分界线附近可以找到() A.耐高温材料B.新型农药材料 C.半导体材料D.新型催化剂材料7.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是() A.电子数 B.最外层电子数 C.电子层数 D.最高化合价 8.下列叙述正确的是() A.发生化学反应时失去电子越多的金属原子,还原能力越强 B.金属阳离子被还原后,一定得到该元素的单质 C.核外电子总数相同的原子,一定是同种元素的原子 D.能与酸反应的氧化物,一定是碱性氧化物 9.已知两元素A与B的原子序数分别为a、b,且原子半径B>A,则a与b的相对大小关系() A.a一定大于b B.a一定小于b C.若元素A、B在同一周期,则a一定大于b D.若元素A、B不在同一周期,则a一定大于b 10.某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是() A.X的最高含氧酸的分子式可表示为H3XO4 B.X是第二周期VA族元素 C.X是第二周期ⅥA族元素 D.X的最高化合价为+4价 二、填空题 11、X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外电子数之和为17.请填空: ⑴Y、Z和W是否位于同一周期(填“是”或“否”):理由是 ⑵Y是 Z是 W是 ⑶X、Y、Z和W可组成一化合物,其原子个数比为8:2:4:1,写出该化合物的名称及化学式:。. 12.置换反应的通式可以表示为:单质(1) + 化合物(1) ==单质(2) + 化合物(2)请写出满足以下要求的3个置换反应的化学方程式: ①所涉及的元素的原子序数都小于20;②6种单质分属于6种不同的主族 13、已知X、Y、Z都是短周期的元素,它们的原子序数依次递增,X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以气态化合物,则 (1)X是、Y是、Z是 (2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是 (3)由X、Y、Z中的两种元素组成,且与X2Z分子具有相同电子数的两种离子是和(4)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是 14、X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种为金属;X 原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。单质Y和W都可与浓的NaOH溶液反应。请回答下列问题: (1)Y、Z、W的原子半径由小到大的顺序是________________________。 (2)ZW2的电子式是_____________,它在常温下呈液态,形成晶体时,属于_______晶体。 (3)工业生产单质Y的原理是_____________________________(用化学方程式表示)。 (4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是___________________。 (5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是_________________。 15、(1)元素甲是第三周期ⅥA族元素,请在右方框中按氦元素(图1)的式样,写出元素甲的原子序数、元素符号、元素名称、相对原子质量和最外电子层排布。 (2)元素乙的3p亚层中只有1个电子,则乙原子半径与甲原子半径比较:________>________ 甲、乙的最高价氧化物水化物的酸性强弱为:________>________ (用化学式表示)。 (3)元素周期表体现了元素周期律,元素周期律的本质是原子核外电子排布的__________,请写出元素在元素周期表中的位置与元素原子结构的关系:_____________________________________。 16、下表中的实线表示元素周期表的部分边界。①-⑤分别表示元素周期表中对应位置的元素。 (1)请在上表中用实线补全元素周期表边界。 (2)元素⑤的原子核外p电子数比s电子总数多_______个。元素③氢化物的电子式为_______。 (3)元素④—般在化合物中显_____价,但与_____形成化合物时,所显示的价态则恰好相反。 (4)在元素①的单质、元素②的单质和元素①②形成的合金这三种物质中,熔点最低的是_____。 a.元素①的单质 b.元素②的单质 c.元素①②形成的合金 d.无法判断17.已知X、Y、Z、W四种元素位于周期表中三个不同周期,且均为短周期元素,原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y元素的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断: (1)X、Y、Z、W四种元素的符号:X__________、Y__________、Z__________、W__________。 (2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式为 __________。 (3)由X、Y、Z所形成的离子化合物是__________,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式是__________。 18.近几十年发展起来的关于超重元素核稳定性理论认为:当原子核中质子数目达到某一“幻数”(奇异的、有魔力的数)时,这个核将是特别稳定的。在周期表中铀以前的元素中具有2、8、20、28、50、82个质子或中子的核子是特别稳定的,中子数126也是一个重要的幻数。氦、氧、钙、铅的质子数和中子数都是幻数,具有这种双幻数的原子核更为稳定。科学家们用计算机算出下一个具有幻数的元素将是舍114个质于和184个中子的第114号元素X(称为超重元素)。若巳知原子结构规律不发生变化,该元素X就是第__________周期第__________族元素,其最高价氧化物的分子式为__________,再下一个具有双幻数的超重元素是质子数为164、中子数为318的第164号元素Y,它应是第__________周期第__________第元素。 19.下表是元素周期表的一部分: 1A ⅡA ⅢA ⅣA VA ⅥA ⅦA 1 ① 2 ② ③ ④ ⑤ ⑥ 3 ⑦ ⑧ ⑨ ⑩ (1)表中元素⑩的氢化物的化学式为__________,此氢化物的还原性比元素⑨的氢化物的还原性__________(填“强”或“弱”)。 (2)某元素原子的气态氢化物最易溶于水,则该元素的元素符号是________,其单质的电子式为__________。 (3)俗称为“矾”的一类化合物通常含有共同的元素是__________。 (4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物女相似的性质。写出元素③的氢氧化物与NaOH 溶液反应的化学方程式__________。 又如表中与元素⑦的性质相似的不同族元素是__________(填元素符号)。 20.m 、n 、x 、y 四种主族元素在周期表里的相对位置如图所示,已知它们的原子序数总和为46, m n x y (1)m 与y 形成的化合物中含__________键,属__________分子(填“极性”或“非极性”)。 (2)x 元素形成的单质属__________晶体。 (3)由n 、y 的氢化物相互作用所生成的物质的电子式为__________。 (4)写出m 单质与x 元素最高价氧化物对应的水化物的化学反应方程式__________。 (5)核电荷数比x 元素少8的元素可形成多种粒子,按要求填入空格中: 质子数 16 16 16 电子数 16 17 18 化学式 参考答案: 1、D 2、B 3、AD 4、AD 5、D 6、C 7、A 8、C 9、C 10、A 11.⑴否 如果位于同一周期,则其电子数之和应该是3 的倍数。⑵Y :氮元素 Z :氧元素 W :硫元素 ⑶名称:硫酸铵 化学式:(NH 4)2SO 4 12.2Al+6HCl==AlCl 3+3H 2↑2F 2+2H 2O==4HF+O 2 (其它合理答案也行) 13、⑴ 氢 氮 氧 ⑵ N 2O 5 ⑶ NH 4+ HO - ⑷ NH 4NO 3 14.(1)Cl <S <Al (2) ;分子(3)2Al 2O 3 4Al + 3O 2 ↑ (4)Be + 2NaOH = Na 2BeO 2 + H 2 ↑(5)3:5 15、 (1) (2)3S 23P 1 Al>S (3)周期性变化 元素的周期数即为原子结构 最外电子层数;元素的主族序数即为原子结构的最外层电子数。 16、 (2)1个 H:N:H (3)-2 氟(4)C 17、(1)X:H、Y:N、Z:O、W:Na。(2)以上元素中的两种元素组成的能溶于水且水溶液呈碱性的化合物是NH3,其电子式为。(3)X、Y、Z所形成的离子化合物是NH4NO3, W的最高价氧化物的水化物是NaOH,NH4NO3与NaOH反应的离子方程式为:NH4++OH-NH3↑+H2O。 18、七ⅣA XO2八ⅣA 19、(1)HCl 弱 (2)(3)H、O、S(4)Be(OH)2+2NaOH=Na2BeO2+2H2O Li 20、(1)m与y形成的化合物为CCl4;极性非极性(2)x元素形成的单质为S;分子晶体 (3) (4)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O (5)O2 O2-O22- 高中化学元素周期律知识点规律大全 1.原子结构 [核电荷数、核内质子数及核外电子数的关系] 核电荷数=核内质子数=原子核外电子数 注意:(1) 阴离子:核外电子数=质子数+所带的电荷数 阳离子:核外电子数=质子数-所带的电荷数 (2)“核电荷数”与“电荷数”是不同的,如Cl-的核电荷数为17,电荷数为1. [质量数] 用符号A表示.将某元素原子核内的所有质子和中子的相对质量取近似整数值相加所得的整数值,叫做该原子的质量数. 说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A=Z + N. (2)符号A Z X的意义:表示元素符号为X,质量数为A,核电荷数(质子数)为Z的一个原子.例如,23 Na中,Na原子的质量数为23、质子数为11、中子数为12. 11 [原子核外电子运动的特征] (1)当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出现机会的多少. (2)描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少. (3)在通常状况下,氢原子的电子云呈球形对称。在离核越近的地方电子云密度越大,离核越远的地方电子云密度越小. [原子核外电子的排布规律] (1)在多电子原子里,电子是分层排布的. (2)能量最低原理:电子总是尽先排布在能量最低的电子层里,而只有当能量最低的电子层排满后,才依次进入能量较高的电子层中.因此,电子在排布时的次序为:K→L→M…… (3)各电子层容纳电子数规律:①每个电子层最多容纳2n2个电子(n=1、2……).②最外层容纳的电子数≤8个(K层为最外层时≤2个),次外层容纳的电子数≤18个,倒数第三层容纳的电子数≤32个.例如:当M层不是最外 第七讲元素周期表和元素周期律 一、分析热点把握命题趋向 热点内容主要集中在以下几个方面:一是元素周期律的迁移应用,该类题目的特点是:给出一种不常见的主族元素,分析推测该元素及其化合物可能或不可能具有的性质。解该类题目的方法思路是:先确定该元素所在主族位置,然后根据该族元素性质递变规律进行推测判断。二是确定“指定的几种元素形成的化合物”的形式,该类题目的特点是:给出几种元素的原子结构或性质特征,判断它们形成的化合物的形式。解此类题的方法思路是:定元素,推价态,想可能,得化学式。三是由“位构性”关系推断元素,该类题目综合性强,难度较大,一般出现在第Ⅱ卷笔答题中,所占分值较高。 二.学法指导:1、抓牢两条知识链 (1)金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子失去电子的能力→元素的金属性→最高价氧化物对应水化物的碱性→单质置换水(或酸)中氢的能力→单质的还原性→离子的氧化性。 (2)非金属元素链:元素在周期表中的位置→最外层电子数及原子半径→原子获得电子的能力→元素的非金属性→最高价氧化物对应水化物的酸性→气态氢化物形成难易及稳定性→单质的氧化性→离子的还原性。 2、理解判断元素金属性或非金属性强弱的实验依据 (1)金属性强弱的实验标志 ①单质与水(或酸)反应置换氢越容易,元素的金属性越强。②最高价氧化物对应的水化物的碱性越强,元素的金属性越强。③相互间的置换反应,金属性强的置换弱的。④原电池中用作负极材料的金属性比用作正极材料的金属性强。⑤电离能 (2)非金属性强弱的实验标志 ①与氢气化合越容易(条件简单、现象明显),元素的非金属性越强。②气态氢化物越稳定,元素的非金属性越强。③最高价氧化物对应的水化物的酸性越强,元素的非金属性越强。④相互间置换反应,非金属性强的置换弱的。⑤电负性 三.规律总结: 1、同周期元素“四增四减”规律 同周期元素从左至右:①原子最外层电子数逐渐增多,原子半径逐渐减小;②非金属性逐渐增强,金属性逐渐减弱;③最高价氧化物对应的水化物的酸性逐渐增强,碱性逐渐减弱;④非金属气态氢化物的稳定性逐渐增强,还原性逐渐减弱。 2、同主族元素“四增四减四相同”规律 同主族元素从上到下:①电子层数逐渐增多,核对外层电子的引力逐渐减弱;②金属性逐渐增强,非金属性逐渐减弱;③非金属气态氢化物的还原性逐渐增强,稳定性减弱;④最高价氧化物对应的水化 知识网络 中子N (不带电荷) 同位素 原子核 → 质量数(A=N+Z ) 近似相对原子质量 质子Z (带正电荷) → 核电荷数 元素 → 元素符号 原子结构 : 最外层电子数决定主族元素的 电子数(Z 个): 化学性质及最高正价和族序数 核外电子 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化 ①、原子最外层电子的周期性变化(元素周期律的本质) 元素周期律 ②、原子半径的周期性变化 ③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ③、不完全周期(第七周期) ①、主族(ⅠA ~ⅦA 共7个) 元素周期表 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 决定原子呈电中性 编排依据 X)(A Z 七 主七副零 和八 三长三短一不全 决定元素种类 最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 如:Na>Mg>Al>Si>P>S >Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如: Li 初三化学元素周期表 顺口溜:氢(qīng) 氦(hài) 锂(lǐ) 铍(pí) 硼(péng) 碳(tàn) 氮(dàn) 氧(yǎng) 氟(fú) 氖(nǎi) n) 硫(liú)氯(lǜ) 氩(yà) 钠(nà) 镁(měi) 铝(lǚ) 硅(guī) 磷(lí 钾(jiǎ) 钙(gài) 钪(kàng) 钛(tài) 钒(fán) 铬(gè) 锰(měng) 铁(tiě) 钴(gǔ) 镍(niè) 铜(tóng) 锌(xīn) 镓(jiā) 锗(zhě) 砷(shēn) 硒(xī) 溴(xiù)氪(kè) 铷(rú) 锶(sī) 钇(yǐ) 锆(gào) 铌(ní) 钼(mù) 锝(dé) 钌(liǎo) 铑(lǎo) 钯(pá) 银(yín) 镉(gé) 铟(yīn) 锡(xī) 锑(tī) 碲(dì) 碘(diǎn) 氙(xiān) 铯(sè) 钡(bèi) 镧(lán) 铪(hā) 钽(tǎn) 钨(wū) 铼(lái) 锇(é) 铱(yī) 铂(bó) 金(jīn) 汞(gǒng) 铊(tā) 铅(qiān) 铋(bì) 钋(pō) 砹(ài) 氡(dōng) 钫(fāng) 镭(léi) 锕(ā) 钅卢(lú) 钅杜(dù) 钅喜(xǐ) 钅波(bō) 钅黑(hēi) 钅麦(mài) 钅达(dá) 钅仑(lún) 镧(lán) 铈(shì) 镨(pǔ) 钕(nǚ) 钷(pǒ) 钐(shān) 铕(yǒu) 钆(gá) 铽(tè) 镝(dí) 钬(huǒ) 铒(ěr) 铥(diū) 镱(yì)镥(lǔ) 锕(ā) 钍(tǔ) 镤(pú) 铀(yóu) 镎(ná) 钚(bù) 镅(méi) 锔(jū) 锫(péi) 锎(kāi) 锿(āi) 镄(fèi) 钔(mén) 锘(nuò) 铹(láo)附化学元素周期表口诀 青害李皮朋,探丹阳付奶。 (氢氦锂铍硼,碳氮氧氟氖) 那美女桂林,流露押嫁该。 (钠镁铝硅磷,硫氯氩钾钙) 抗台反革命,提供难题新。 (钪钛钒铬锰,铁钴镍铜锌) 假者生喜羞,可入肆意搞。 (镓锗砷硒溴,氪铷锶钇锆) 你母得了痨,八音阁隐息。 (铌钼锝钌铑,钯银镉铟锡) 替弟点仙色,贝兰是普女。 作业 1 1、某元素的原子结构示意图为:,则该元素在元素周期表中的位置是 () A.第二周期,第ⅠA族 B.第二周期,第ⅤA族 C.第三周期,第ⅣA族 D.第三周期,第ⅤA族 2、下图微粒的结构示意图,正确的是() A.Mg2+ B.Cl C.Ar D.K 3、下列原子中,最容易形成阳离子的是() A. B. C. D. 4、元素的化学性质主要决定于() A.主要化合价 B.核外电子数 C.原子半径 D.最外层电子数 5、和氖原子有相同的电子层的微粒是()A.He B.K+ C.Cl- D.Na+ 6、核外电子层结构相同的一组微粒是() A.Mg2+,Al3+,Cl-,Ne B.K+,Ca2+,S2-,Ar C.Na+,F-,S2-,Ar D.Mg2+,Na+,Cl-,S2- 7、核外电子排布相同的离子A m+和B n-,两种元素的质子数,前者与后者的关系是()A.大于 B.小于 C.等于 D.不能肯定 8、今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L 层电子数恰为A原子L层电子数的2倍.则A、B分别是() A.He和B B.C和Cl C.Na和Si D.C和Al 题目 1 2 3 4 5 6 7 附8 答案 9、有A、B、C三种元素,已知C原子最外层电子数为次外层电子数的3倍;B和C 原子核外电子层数相等,而最外层电子数之和为10;A、C能形成AC型化合物,A2+离子和B原子电子层数也相同.回答: (1)画出A2+离子的结构示意图_______________; (2)A、B、C三元素符号分别为________、________、________。 作业2 1.元素性质呈现周期性变化的根本原因是() 高中化学元素周期表 教案 Revised on November 25, 2020 通过学生亲自编排元素周期表培养学生的求实、严谨和创新的优良品质;提高学生的学习兴趣 教学方法:通过元素周期表是元素周期律的具体表现形式的教学,进行“抽象和具体”这一科学方法的指导。 教学重难点:同周期、同主族性质的递变规律;元素原子的结构、性质、位置之间的关系。 教学过程: [新课引入] 初中我们学过了元素周期律,谁还记得元素周期律是如何叙述的吗[学生活动] 回答元素周期律的内容即:元素的性质随着元素原子序数的递增而呈周期性的变化。 [过渡]对!这样的叙述虽然很概括,但太抽象。我们知道元素周期律是自然界物质的结构和性质变化的规律。既然是规律,我们只能去发现它,应用它,而不能违反它。但是,我们能否找到一种表现形式,将元素周期律具体化呢经过多年的探索,人们找到了元素周期表这种好的表现形式。元素周期表就是元素周期表的具体表现形式,它反映了元素之间的相互联系的规律。它是人们的设计,所以可以这样设计,也可以那样设计。历史上本来有“表”的雏形,经过漫长的过程,现在有了比较成熟,得到大家公认的表的形式。根据不同的用途可以设计不同的周期表,不同的周期表有不同的编排原则,大家可以根据以下原则将前18号元素自己编排一个周期表。 [多媒体展示]元素周期表的编排原则: 1.按原子序数递增顺序从左到右排列; 2.将电子层数相同的元素排列成一个横行; 3.把最外层电子数相同的元素排列成一列(按电子层递增顺序)。 [过渡]如果按上述原则将现在所知道的元素都编排在同一个表中,就是我们现在所说的元素周期表,现在我们一同研究周期表的结构。 [指导阅读]大家对照元素周期表阅读课本后,回答下列问题。 1.周期的概念是什么 2.周期是如何分类的每一周期中包含有多少元素。 3.每一周期有什么特点 4.族的概念是什么 5.族是如何分类的主族和副族的概念是什么,包括哪些列,如何表示 6.各族有何特点 [教师归纳小结] [板书] 一、元素周期表的结构 1、横行--周期 ①概念 ②周期分类及各周期包含元素的个数。 ③特点 a.周期序数和电子层数相同; 元素周期表的规律 一、原子半径 同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。 二、主要化合价(最高正化合价和最低负化合价) 同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到 +7价),第一周期除外,第二周期的0、F元素除外最低负化合价递增(从-4价到-1价)第 一周期除外,由于金属元素一般无负化合价,故从W A族开始。元素最高价的绝对值与最低价的绝对值的和为8 三、元素的金属性和非金属性 同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增; 同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减; 四、单质及简单离子的氧化性与还原性 同一周期中,从左到右,随着原子序数的递增,单质的氧化性增强,还原性减弱;所 对应的简单阴离子的还原性减弱,简单阳离子的氧化性增强。同一族中,从上到下,随着原子序数的递增,单质的氧化性减弱,还原性增强;所对应的简单阴离子的还原性增强, 简单阳离子的氧化性减弱。元素单质的还原性越强,金属性就越强;单质氧化性越强,非金属性就越强。 五、最高价氧化物所对应的水化物的酸碱性 同一周期中,从左到右,元素最高价氧化物所对应的水化物的酸性增强(碱性减弱); 同一族中,从上到下,元素最高价氧化物所对应的水化物的碱性增强(酸性减弱)。 元素的最高价氢氧化物的碱性越强,元素金属性就越强;最高价氢氧化物的酸性越强, 元素非金属性就越强。 六、单质与氢气化合的难易程度 同一周期中,从左到右,随着原子序数的递增,单质与氢气化合越容易; 同一族中,从上到下,随着原子序数的递增,单质与氢气化合越难。 七、气态氢化物的稳定性 同一周期中,从左到右,随着原子序数的递增,元素气态氢化物的稳定性增强; 同一族中,从上到下,随着原子序数的递增,元素气态氢化物的稳定性减弱。 此外还有一些对元素金属性、非金属性的判断依据,可以作为元素周期律的补充: 随同一族元素中,由于周期越高,价电子的能量就越高,就越容易失去,因此排在下面 的元素一般比上面的元素更具有金属性。元素的气态氢化物越稳定,非金属性越强。 同一族的元素性质相近。 以上规律不适用于稀有气体。 八、位置规律判断元素在周期表中位置应牢记的规律: (1)元素周期数等于核外电子层数; (2 )主族元素的族数等于最外层电子数。 九、阴阳离子的半径大小辨别规律 三看: 一看电子层数,电子层数越多,半径越大, 二看原子序数,当电子层数相同时,原子序数越大半径反而越小三看最外层电子数,当电子层数和原子序数相同时最外层电子书越多半径越小 + 2+ 3+ 2- - r(Na)>r(Mg)>r(AI)>r(S)>r(CI)、r(Na ) >r(Mg )>r(AI 卜 r(0 ) >r(F) r(S2—)>r(CI—)>r(Ar) >r(K+)>r(Ca2+)、r(02—)> r(F—)> r ( Na+) > r ( Mg2+) > r (Al3+) 元素周期表 【教学目标】 1、了解元素周期表的结构以及周期、族等概念。 2.使学生理解同周期、同主族元素性质的递变规律,并能运用原子结构理论解释这些递变规律。 3.使学生了解原子结构、元素性质及该元素在周期表中的位置三者间的关系,初步学会运用周期表。 【教学重点】元素周期表的结构,元素的性质、元素在周期表中的位置与原子结构的关系 【教学过程】 一、元素周期表的结构: ⑴元素周期表的编排。 ①按原子序数递增的顺序,从左至右排列; ②将电子层数相同的元素排在一横行; ③将不同横行中最外层电子数相同的元素,按电子层数的递增的顺序,由上而下排成一纵行。 由此可见,元素在周期表中的周期数,与其电子层数相同;主族元素的族系数,与其最外层电子数相同。即 周期数 = 电子层数。族系数(指主族)= 最外层电子数。 ⑵周期表的结构概括: 练1、A、B、C三种短周期元素,B分别与A和C相邻,它们的原子序数之和为27。则B元素可能是。(答:碳或镁) 练2、根据下列关系,分别指出B元素与A元素的原子序数差。 ①A、B同主族,分别在第三和第四周期,原子序数差为; ②A 、B 同周期,分别在ⅡA 和ⅢA 族,原子序数差为 ; ③A 、B 均在第五周期,分别为ⅢB 和ⅡB ,原子序数差为 ; ④A 、B 同周期,分别在Ⅷ和0族,原子序数差为 ; [答:①8或8;②1或11或25;③9;④10或9或8。] (3)元素周期表中元素的金属性与非金属性的递变 二、由原子序数推导元素在周期表中的位置方法: ⑴根据每个周期排布元素的种类数〔一(2)、二(8)、三(8)、四(18)、五(18)、六(32)〕的特点,用递减法推出位置数。如推32X 在周期表中的位置:32-2(一)-8(二)-8(三)=14(四),14-10=4(10为过渡元素的种类数),4即为主族族序数。所以35X 处于第四周期第ⅣA 族。 ⑵根据元素原子的序数画出原子结构简图,如35X 的位置: 由可知处于第四周期ⅦA 族。 另外同族上下相邻的两元素的序数相差8(二~三周期)、相差18(三~四~五周期)、相差32(五~六~七周期)等特点也应熟悉。 三、利用元素在周期表中的位置判断元素的性质。 同周期元素的性质有一定的递变规律,同主族元素的性质有很大的相似性,又有一定的递变规律。根据这些规律,并参照已知元素的性质,就可推测未知元素的性质。 元素周期表规律总结 一。主族元素的判断方法:符合下列情况的均是主族元素 1. 有1~3个电子层的元素(除去He、Ne、Ar); 2。次外层有2个或8个电子的元素(除去惰性气体); 3. 最外层电子多于2个的元素(除去惰性气体); 二。电子层结构相同的离子或原子(指核外电子数与某种惰性元素的电子数相同而且电子层排布也相同的单核离子或原子) (1)2个电子的He型结构的是:H-、He、Li+、Be2+; (2)10个电子的Ne型结构的是:N3—、O2-、F—、Ne、Na+、Mg2+、Al3+ (3)18个电子的Ar型结构的是:S2—、Cl-、Ar、K+、Ca2+ 三。电子数相同的微粒(包括单核离子、原子、也包括多原子分子、离子) 1。2e—的有:H-、H2、He、Li+、Be2+; 2. 10e-的有:N3-、O2-、F—;Na+、Mg2+、Al3+;Ne、HF、H2O、NH3、CH4(与Ne同周期的非金属的气态氢化物)NH4-、NH2-、H3O+、OH—; 3. 18e-的有:S2—、CL-、Ar、K+、CA2+;SiH4、PH3、H2S、HCl(与Ar同周期的非金属的气态氢化物);HS—、PH4+及、H2O2、F2、CH3-OH、CH3—CH3、CH3-F、CH3-NH2、NH2—NH2、NH2-、OH—等. 四. 离子半径的比较: 1. 电子层结构相同的离子,随原子序数的递增,离子半径减小. 2。同一主族的元素,无论是阴离子还是阳离子,电子层数越多,半径越大。即从上到下,离子半径增大. 3。元素的阳离子半径比其原子半径小,元素的阴离子半径比其原子半径大。 五。同一主族的相邻两元素的原子序数之差,有下列规律: 1。同为IA、IIA的元素,则两元素原子序数之差等于上边那种元素所在周期的元素种类数。 高中化学元素周期律知识点规律大全 1原子结构 [核电荷数、核内质子数及核外电子数的关系]核电荷数=核内质子数=原子核外电子数 注意:(1)阴离子:核外电子数=质子数+所带的电荷数 阳离子:核外电子数=质子数一所带的电荷数 (2) “核电荷数”与“电荷数”是不同的,如C「的核电荷数为17,电荷数为1. [质量数]用符号A表示?将某元素原子核内的所有质子和中子的相对质量取近似整数值相加所得的整数值,叫做 该原子的质量数. 说明(1)质量数(A)、质子数(Z)、中子数(N)的关系:A= Z + N . (2)符号A X的意义:表示元素符号为X质量数为A,核电荷数(质子数)为Z的一个原子.例如,J Na中,Na原子的质量数为23、质子数为11、中子数为12. [原子核外电子运动的特征] (1) 当电子在原子核外很小的空间内作高速运动时,没有确定的轨道,不能同时准确地测定电子在某一时刻所处 的位置和运动的速度,也不能描绘出它的运动轨迹.在描述核外电子的运动时,只能指出它在原子核外空间某处出 现机会的多少. (2) 描述电子在原子核外空间某处出现几率多少的图像,叫做电子云.电子云图中的小黑点不表示电子数,只表 示电子在核外空间出现的几率.电子云密度的大小,表明了电子在核外空间单位体积内出现几率的多少. (3) 在通常状况下,氢原子的电子云呈球形对称。在离核越近的地方电子云密度越大,离核越远的地方电子云密 度越小. [原子核外电子的排布规律] (4)原子最外层中有8个电子(最外层为K层时有2个电子)的结构是稳定的,这个规律叫“八隅律”?但如PCI5中的P原子、BeCl2中的Be原子、XeF4中的Xe原子,等等,均不满足“八隅律”,但这些分子也是稳定的. 2?元素周期律 [原子序数]按核电荷数由小到大的顺序给元素编的序号,叫做该元素的原子序数. 原子序数=核电荷数=质子数=原子的核外电子数 [元素原子的最外层电子排布、原子半径和元素化合价的变化规律] 元素周期律和元素周期表知识总结 考试大纲要求 1.理解原子的组成及同位素的概念。掌握原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。 2.以第1、2、3周期的元素为例,掌握核外电子排布规律。 3.掌握元素周期律的实质及元素周期表(长式)的结构(周期、族)。 4.以第3周期为例,掌握同一周期内元素性质(如:原子半径、化合价、单质及化合物性质)的递变规律与原子结构的关系;以ⅠA族和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 知识规律总结 一、原子结构 1.几个量的关系() 质量数(A)=质子数(Z)+中子数(N) 质子数=核电荷数=原子序数=原子的核外电子数 离子电荷数=质子数-核外电子数 2.同位素 (1)要点:同——质子数相同,异——中子数不同,微粒——原子。 (2)特点:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。 注意:同种元素的同位素可组成不同的单质或化合物,如H2O和D2O是两种不同的物质。 3.相对原子质量 (1)原子的相对原子质量:以一个12C原子质量的1/12作为标准,其它原子的质量跟它相比较所得的数值。它是相对质量,单位为1,可忽略不写。 (2)元素的相对原子质量:是按该元素的各种同位素的原子百分比与其相对原子质量的乘积所得的平均值。元素周期表中的相对原子质量就是指元素的相对原子质量。 4.核外电子排布规律 (1)核外电子是由里向外,分层排布的。 (2)各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。 (3)以上几点互相联系。 核外电子排布规律是书写结构示意图的主要依据。 5.原子和离子结构示意图 注意:①要熟练地书写1~20号元素的原子和离子结构示意图。 ②要正确区分原子结构示意图和离子结构示意图(通过比较核内质子数和核外电子数)。 6.微粒半径大小比较规律 (1)同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。 (2)同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。 (3)电子层结构相同的离子,核电荷数越大,则离子半径越小。 (4)同种元素的微粒半径:阳离子<原子<阴离子。 (5)稀有气体元素的原子半径大于同周期元素原子半径。 (6)电子层数多的阴离子半径一定大于电子层数少的阳离子半径,但电子层数多的阳离子半径不一定大于电子层数少的阴离子半径。 二、元素周期律和周期表 1.位、构、性三者关系 2019中考必备:初中化学元素周期表规律 一、元素周期表中元素及其化合物的递变性规律1、原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 2、元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外); (2)同一主族的元素的最高正价、负价均相同。 3、单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。 4、元素的金属性与非金属性 (1)同一周期的元素从左到右金属性递减,非金属性递增; (2)同一主族元素从上到下金属性递增,非金属性递减。5、最高价氧化物和水化物的酸碱性 元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 6、非金属气态氢化物 元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。 7、单质的氧化性、还原性 一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。 二、推断元素位置的规律 判断元素在周期表中位置应牢记的规律: 1、元素周期数等于核外电子层数; 2、主族元素的序数等于最外层电子数; “知识梳理”栏 元素周期表中规律的总结 一、编排规律 1、原子序数=质子数=核电荷数=原子核外电子数 2、周期序数=原子核外电子层数 3、主族序数=最外层电子数=价电子数 4、1到7周期可容纳元素种数分别为2、8、8、18、18、32、32(目前7周期只有26种)。 5、主族(除ⅠA族)中,非金属元素种数=族序数-2。 二、“定性”规律 1、若主族元素族数为m,周期数为n,则: ①m-n<0时为金属,且值越小,金属性越强; ②m-n>0时是非金属,越大非金属性越强; ③m-n=0时多为两性元素。 如钫位于第7周期第ⅠA族,m-n=-6<0,钫的金属性最强;F位于第二周期VIIA族,m-n=5>0,F的非金属性最强;铝位于第3周期IIIA族,m-n=0,铝为两性元素。 2、对角线规律:左上右下的两主族元素性质相似。如铍与铝的化学性质相似,均能与 强酸和强碱反应。 3、金属与非金属的分界线附近,金属大都有两性,非金属及其某些化合物大都为原子 晶体(如晶体硼、晶体硅、二氧化硅晶体、碳化硅晶体等)。 4、若将表中第ⅤA与ⅥA之间分开,则左边元素氢化物的化学式,是将H写在后边(如SiH4、PH3、CaH2等);而右边元素氢化物的化学式,是将H写在前边(如H2O、HBr等)。 5、符合下列情况的均是主族元素: ①有1~3个电子层的元素(He、Ne、Ar除外)。 ②次外层有两个或8个电子的元素(稀有气体除外)。 ③最外层电子数多于2个的元素(稀有气体除外)。 三、“序差”规律 1、同一周期IIA、IIIA族元素的原子序数相差可能是1、11或25。 2、同一主族相邻周期元素的原子序数之差可能是2、8、18、32。 3、“左上右下”规律:上下相邻两元素,若位于ⅢB之左(如ⅠA、IIA族),则原子序数之差等于上一元素所在周期的元素种数;若位于ⅢB之右(如IIIA~0族),则原子序数之差等于下一元素所在周期的元素种数。 四、“定位”规律 1、比大小定周期。比较该元素的原子序数与0族元素的序数大小,找出与之相邻的0族元素,那么该元素就和序数大的0族元素处于同一周期。 2、求差定族数。若该元素的原子序数比相应的0族元素多1或2时,则分别位于0族元素下周期的第IA或IIA族;若少1、2、3或4时,则分别位于同周期的第VIIA、VIA、VA、IVA族。 五、性质递变性规律 1、原子(离子)的半径 ①同一周期元素(惰性气体元素除外)从左到右,原子半径逐渐减小。 ②同一主族元素从上到下,原子(或离子)半径逐渐增大。 ③同种元素,阳离子半径<原子半径,阴离子半径>原子半径。 1. 碳是C、磷是P、铅的符号是Pb 2. Cu铜、Ca钙、钨的符号W 3. H氢、S硫、硅的符号Si 4. 金Au、银Ag、镁的符号Mg 5. 钠Na、氖Ne、汞的符号Hg 6. 硼是B、钡Ba、铁的符号Fe 7. 锌Zn、锰Mn、锡的符号Sn 8. 钾是K、碘是I、氟的符号是F 9. 氧是O、氮是N、溴的符号是Br 10. Al铝、Cl氯、锑的符号Sb 第一周期:氢氦---- 侵害 第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰---- 嫁改康太反革命 铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者 砷硒溴氪---- 生气休克 第五周期:铷锶钇锆铌---- 如此一告你 钼锝钌---- 不得了 铑钯银镉铟锡锑---- 老把银哥印西堤 碲碘氙---- 地点仙 第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河 钽钨铼锇---- 但(见)乌(鸦)(引)来鹅 铱铂金汞砣铅---- 一白巾供它牵 铋钋砹氡---- 必不爱冬(天) 第七周期:钫镭锕---- 很简单了~就是---- 防雷啊! 20个必记:氢氦锂铍硼碳氮氧氟氖钠镁铝硅磷硫氯氩钾钙(5个一记会好记点) 这是一场没有结局的表演 包含所有荒谬和疯狂 像个孩子一样满怀悲伤 静悄悄地熟睡在大地上 现在我有些倦了 倦得像一朵被风折断的野花 所以我开始变了 变得像一团滚动炽热的花火 看着眼前欢笑骄傲的人群 心中泛起汹涌的浪花 跳着放荡的舞蹈穿行在旷野 感到狂野而破碎的辉煌 现在我有些醉了 醉得像一只找不到方向的野鸽所以我开始变了 变得像一团暴烈炽热的花火 蓝色的梦睡在静静驶过的小车里漂亮的孩子迷失在小路上 这是一个永恒美丽的生活 没有眼泪没有哀伤 现在我有些倦了 倦得像一朵被风折断的野花 所以我开始变了 变得像一团滚动炽热的花火 现在我有些醉了 醉得像一只找不到方向的野鸽所以我开始变了 变得像一团暴烈炽热的花火 物质结构元素周期律 第二节元素周期律教案 【课程三维目标】 [知识与技能]:1、了解原子核外电子排布 2、能结合有关数据和实验事实认识元素周期律 3、掌握第三周期元素性质递变规律 4、掌握原子结构与元素性质的关系,了解周期表中主族与周期的性质递变[过程与方法]:查阅资料、阅读、比较、分析、讨论、归纳、信息处理、实验验证 [情感与态度]:1、.体验科学方法对科学研究的价值 2、认识由量变到质变的规律和对立统一的规律,形成正确的哲学观 【课前预习案】 1、复习上一节内容的原子结构 2、阅读教材13至18页,尽量寻找重点,寻找规律 3、填写教材14至15页的原子核外电子排布(用原子结构示意图来表示) 4、掌握原子核外电子的排布 5、从表1-2中找一些最外层电子数与内(或次外)层电子数之间的关系 6、确定元素周期律的内容、元素周期表和元素周期律的应用 一、原子核外电子的排布 原子是由原子核和核外电子构成的。核外电子在离核的一定区域内绕原子核作高速的运转运动,它们的运动是有一些规律的,否则就会发生碰撞等问题。原子的核外电子由于运动从而具有能量,而运动的速度或状态不同,又使这些电子的能量会有所不同。对于原子核来说,离核近的区域能量低,离核远的区域能量高,于是,科学家根据能量的高低和离核的远近将原子核外的一定空间形象的划分为不同的区域,将之称为电子层。科学家将原子核外一共分为了七个电子层,用n=1、2、3、4、5、6、7或(K、L、M、N、O、P、Q)来表示。 1、电子层 (其实,只有电子层还不能很好的表示电子在核外的排布,科学家还将其分为了电子亚层和轨道,这在以后的内容中学习,都是一些比较容易接受的内容。) 核外电子在排布的时候,不是想往哪里去就在那里排,而是首先排在能量低的地方,也就是K层,通常是一层排满后再排下一层。 2、电子排布规律: 1、电子总是尽可能的先排在能量低的电子层里,然后才由里及外的向外排列 2、每个电子层最外排电子数为2 n2 (n为电子层数) 化学元素周期表规律 (一)元素周期律和元素周期表 1.元素周期律及其应用 (1)发生周期性变化的性质 原子半径、化合价、金属性和非金属性、气态氢化物的稳定性、最高价氧化物对应水化物的酸性或碱性。 (2)元素周期律的实质 元素性质随着原子序数递增呈现出周期性变化,是元素的原子核外电子排布周期性变化的必然结果。也就是说,原子结构上的周期性变化必然引起元素性质上的周期性变化,充分体现了结构决定性质的规律。 2.比较金属性、非金属性强弱的依据 (1)金属性强弱的依据 1/单质跟水或酸置换出氢的难易程度(或反应的剧烈程度)。反应越易,说明其金属性就越强。 2/最高价氧化物对应水化物的碱性强弱。碱性越强,说明其金属性也就越强,反之则弱。 3/金属间的置换反应。依据氧化还原反应的规律,金属甲能从金属乙的盐溶液中置换出乙,说明甲的金属性比乙强。 4/金属阳离子氧化性的强弱。阳离子的氧化性越强,对应金属的金属性就越弱。 (2)非金属性强弱的依据 1/单质跟氢气化合的难易程度、条件及生成氢化物的稳定性。越易与反应,生成的氢化物也就越稳定,氢化物的还原性也就越弱,说明其非金属性也就越强。 2/最高价氧化物对应水化物酸性的强弱。酸性越强,说明其非金属性越强。 3/非金属单质问的置换反应。非金属甲把非金属乙对应的阴离子从其盐溶液中置换出来,说明甲的非金属性比乙强。 如Br2 + 2KI == 2KBr + I2 4/非金属元素的原子对应阴离子的还原性。还原性越强,元素的非金属性就越弱。 3.常见元素化合价的一些规律 (1)金属元素无负价。金属单质只有还原性。 (2)氟、氧一般无正价。 (3)若元素有最高正价和最低负价,元素的最高正价数等于最外层电子数;元素的最低负价与最高正价的关系为:最高正价+|最低负价|=8。 (4)除某些元素外(如N元素),原子序数为奇数的元素,其化合价也常呈奇数价,原子序数为偶数的元素,其化合价也常呈偶数价,即价奇序奇,价偶序偶。 若元素原子的最外层电子数为奇数,则元素的正常化合价为一系列连续的奇数,若有偶数则为非正常化合价,其氧化物是不成盐氧化物,如NO;若原子最外层电子数为偶数,则 正常化合价为一系列连续的偶数。 4.原子结构、元素性质及元素在周期表中位置的关系1/原子半径越大,最外层电子数越少,失电子越易,还原性越强,金属性越强。 2/原子半径越小,最外层电子数越多,得电子越易,氧化性越强,非金属性越强。 3/在周期表中,左下方元素的金属性大于右上方元素;左下方元素的非金属性小于右上方元素。 初三化学元素周期表口诀 规律 Newly compiled on November 23, 2020 按周期分: 第一周期:氢氦----侵害 第二周期:锂铍硼碳氮氧氟氖----鲤皮捧碳蛋养福奶 第三周期:钠镁铝硅磷硫氯氩----那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰----嫁改康太反革命 铁钴镍铜锌镓锗----铁姑捏痛新嫁者 砷硒溴氪----生气休克 第五周期:铷锶钇锆铌----如此一告你 钼锝钌----不得了 铑钯银镉铟锡锑----老把银哥印西堤 碲碘氙----地点仙 第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河 钽钨铼锇----但(见)乌(鸦)(引)来鹅 铱铂金汞砣铅----一白巾供它牵 铋钋砹氡----必不爱冬(天) 第七周期:钫镭锕----很简单了~就是----防雷啊! B、按族分: 氢锂钠钾铷铯钫——请李娜加入私访 铍镁钙锶钡镭——媲美盖茨被雷 硼铝镓铟铊——碰女嫁音他 碳硅锗锡铅——探归者西迁 氮磷砷锑铋——蛋临身体闭 氧硫硒碲钋——养牛西蹄扑 氟氯溴碘砹——父女绣点爱 氦氖氩氪氙氡——害耐亚克先动 C、全部 青害李碧朋,探丹阳付奶。(氢氦锂铍硼,碳氮氧氟氖) 那美女桂林,流露押嫁该。(钠镁铝硅磷,硫氯氩钾钙)抗台反革命,提供难题新。(钪钛钒铬锰,铁钴镍铜锌)假者生喜羞,可入肆意搞。(镓锗砷硒溴,氪铷锶钇锆)你母得了痨,八音阁隐息。(铌钼锝钌铑,钯银镉铟锡)替弟点仙色,贝兰是普女。(锑碲碘氙铯,钡镧铈铺钕)破杉诱扎特,弟火而丢意。(钷钐铕钆铽,镝钬铒铥镱) 虏获贪污赖,我一并进攻。(镥铪钽钨铼,锇铱铂金汞) 他钱必不安,东方雷阿土。(铊铅铋钚砹,氡钫镭锕钍) 普诱那不美,惧怕可爱肥。(镤铀镎钚镅,锔锫锎锿镄) 们若老,炉肚喜波黑,卖UunUuuUub! 规律 一、元素周期表中元素及其化合物的递变性规律 1、原子半径 (1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小; (2)同一族的元素从上到下,随电子层数增多,原子半径增大。 2、元素化合价 (1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外); (2)同一主族的元素的最高正价、负价均相同。 3、单质的熔点 (1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减; (2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增。 4、元素的金属性与非金属性 (1)同一周期的元素从左到右金属性递减,非金属性递增; (2)同一主族元素从上到下金属性递增,非金属性递减。 5、最高价氧化物和水化物的酸碱性 元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。 6、非金属气态氢化物 元素非金属性越强,气态氢化物越稳定。同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。 高中化学元素周期律练习题 一、单选题 1.下列关于元素周期表的说法不正确的是 ( ) A.编制第一张元素周期表的是俄国化学家门捷列夫 B.门捷列夫编制元素周期表的排序依据是原子的核电荷数 C.门捷列夫编制元素周期表的排序依据是相对原子质量 D.元素周期表揭示了化学元素间的内在规律 2、下列关于元素周期表的说法正确的是 A .在元素周期表中,每一列就是一个族 B .主族元素都是短周期元素 C .副族元素都是金属元素 D .元素周期表每个长周期包含32种元素 3.下列关于元素周期表的说法正确的是( ) A.元素周期表共有七个周期 B.元素周期表共有18个族 C.所含元素种数最多的族是Ⅷ族 D.原子核外最外层电子数为2的元素都是第ⅡA 元素 4、元素在周期表中的位置,能反映原子结构和元素的化学性质,下列有关说法正确的是 A .由长、短周期元素共同组成的元素族称为主族 (除零族外) B .同一元素不可能既表现金属性,又表现非金属性 C .短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构 D .互为同位素的不同核素,物理性质和化学性质都不同 5.下列说法正确的是( ) A.卤族元素都有正化合价 B.卤族元素的单质都只具有氧化性 C.卤族元素的最低化合价都是-1价 D.卤族元素氢化物都是强酸 6、下列叙述中正确的是 A.卤族元素是典型的非金属元素,因此不能与其他非金属元素反应 B.碱金属元素单质越活泼,其熔点和沸点就越高 C.卤族元素单质都能与水剧烈反应 D.卤族元素单质都能和氢气反应,且气态氢化物的稳定性随单质氧化性的增强而增强 7、下列有关卤族元素的叙述不正确的是 A.卤素单质从F 2到I 2,颜色加深,熔沸点升高 B.卤族元素从Cl 到I,最高价氧化物对应水化物的酸性减弱 C.卤族元素从F 到I, HX 水溶液酸性增强 D.卤素单质氧化性F 2>Cl 2>Br 2>I 2,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来 8.下列有关卤族元素的说法中,正确的是( ) A.密度:22Cl >Br B. 44HFO >HClO C.热稳定性:HBr>HI D.最外层电子数:Br>I 元素周期律和元素周期表习题 知识网络 中子N 原子核 质子Z 原子结构 : 电子数(Z 个)核外电子 排布规律 → 电子层数 周期序数及原子半径 表示方法 → 原子(离子)的电子式、原子结构示意图 随着原子序数(核电荷数)的递增:元素的性质呈现周期性变化 ①、原子最外层电子的周期性变化(元素周期律的本质) 元素周期律 ②、原子半径的周期性变化 ③、元素主要化合价的周期性变化 ④、元素的金属性与非金属性的周期性变化 ①、按原子序数递增的顺序从左到右排列; 元素周期律和 排列原则 ②、将电子层数相同的元素排成一个横行; 元素周期表 ③、把最外层电子数相同的元素(个别除外)排成一个纵行。 ①、短周期(一、二、三周期) 周期(7个横行) ②、长周期(四、五、六周期) 周期表结构 ①、主族(ⅠA ~ⅦA 共7个) 族(18个纵行) ②、副族(ⅠB ~ⅦB 共7个) ③、Ⅷ族(8、9、10纵行) ④、零族(稀有气体) 同周期同主族元素性质的递变规律 ①、核外电子排布 ②、原子半径 性质递变 ③、主要化合价 ④、金属性与非金属性 ⑤、气态氢化物的稳定性 ⑥、最高价氧化物的水化物酸碱性 电子层数 相同条件下,电子层越多,半径越大。 判断的依据 核电荷数 相同条件下,核电荷数越多,半径越小。 最外层电子数 相同条件下,最外层电子数越多,半径越大。 微粒半径的比较 1、同周期元素的原子半径随核电荷数的增大而减小(稀有气体除外) 如:Na>Mg>Al>Si>P>S>Cl. 2、同主族元素的原子半径随核电荷数的增大而增大。如:Li高中化学元素周期律知识点规律大全
第七讲 元素周期表的九大规律
元素周期表规律总结(同一主族_对角线规则)1
初三化学元素周期表(完整版)
高中化学必修二元素周期律练习题
高中化学元素周期表教案
元素周期表的规律总结
人教版第一册必修高中化学元素周期表
元素周期表规律总结
高中化学元素周期律知识点规律大全
元素周期律和元素周期表知识总结
中考必备:初中化学元素周期表规律
元素周期表中规律总结.pdf
初中化学元素周期表和记忆口诀
高中化学元素周期律
化学元素周期表规律
初三化学元素周期表口诀规律
高中化学元素周期律练习题(附答案)
高中化学元素周期表和元素题型归纳
