第六章 溶液中配合物的稳定性规律.

第六章溶液中配合物的稳定性规律
稳定性包括有两种:
1 热稳定性
2 溶液中的稳定性,即稳定常数的大小。
主要要讨论的内容有:
1 中心离子的本性与配合物稳定性的关系
2 配体性质与配合物稳定性的关系
3 其它因素,如溶剂、离子强度等的影响
讨论所涉及的稳定常数的类型有三种
1 热力学稳定常数,即活度稳定常数
2 浓度稳定常数,在固定的离子强度下测定得到的数据,
3 混合稳定常数,其中有的组分(如H+)用活度,另外的组分用浓度
在进行比较时,应当采用同一条件下测出的稳定常数。
第一节配位键的强弱与软硬酸碱原理
1 软硬酸碱规则
广义的酸碱定义:
碱(如OH-)能给出电子对,而酸(H+)则能接受电子对。
据此定义,所有的金属离子都是广义酸,而所有的配体都是碱
配合物的形成过程可看成是酸碱反应的过程:
H++ OH- = H2O
Cu2++ 4NH3= Cu(NH3 )42+
中心离子配体配合物
广义酸广义碱酸碱化合物
广义酸有软酸、硬酸、交界酸之分
硬酸:若中心离子的正电荷高,体积小,极化性低的金属离子
软酸:若中心离子的正电荷低,体积大,外层电易被激发。
交界酸:介于硬、软酸之间的称为交界酸
广义碱:
硬碱:若配体体积小,电负性高,极化性低,难氧化,难失去外层电子,称为软碱
软碱:若配体体积大,极化性高,易氧化,即易失去外层电子的称为软碱。
交界碱:介于两者之间的称为交界碱。
配体中碱的分类:
硬碱:O2-, H2O, OH-, F-, CH3COO-, PO3-4,SO42-, CO32-, ClO4-, NO3-, ROH, RO-, R2O, NH3
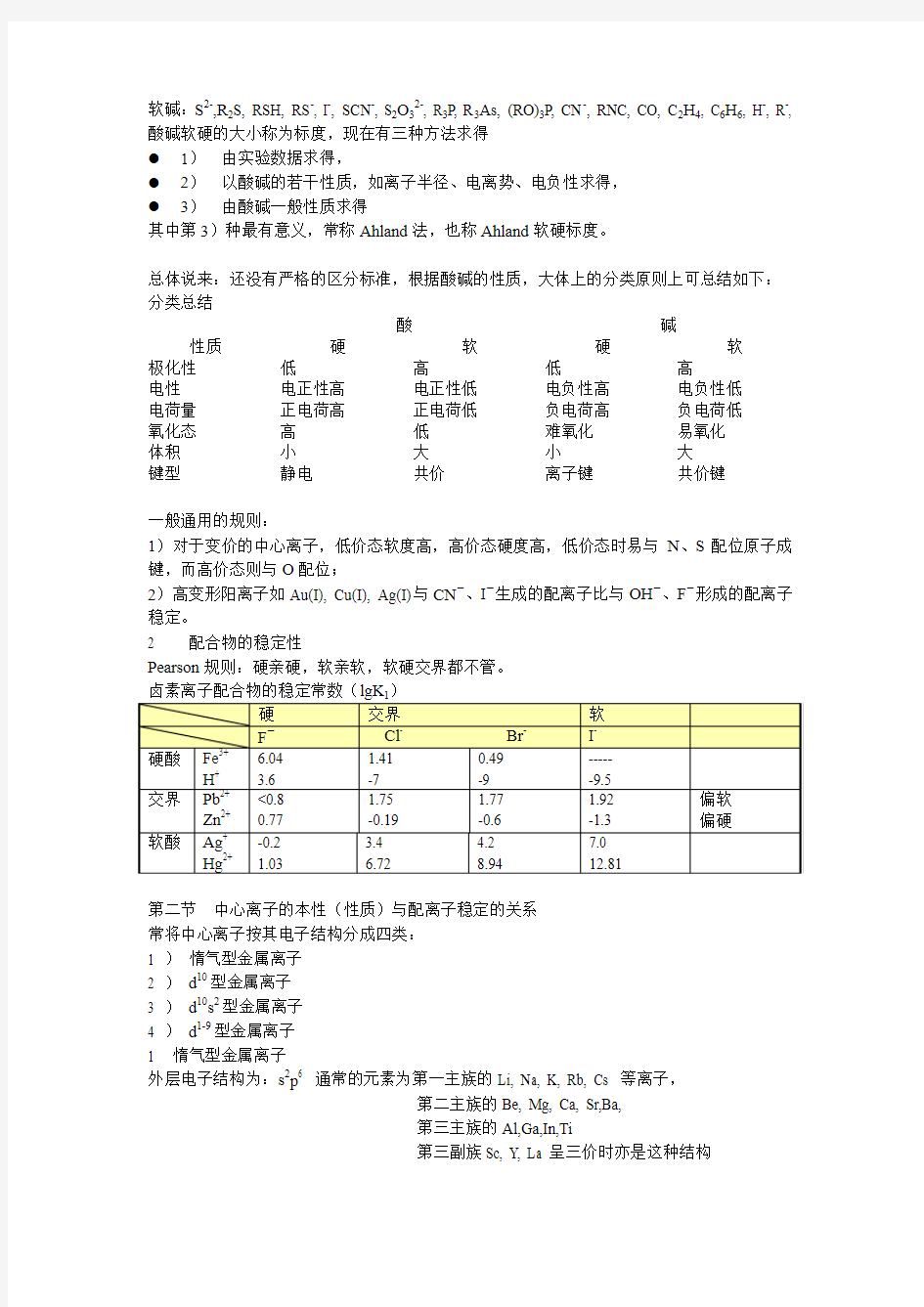
软碱:S2-,R2S, RSH, RS-, I-, SCN-, S2O32-, R3P, R3As, (RO)3P, CN-, RNC, CO, C2H4, C6H6, H-, R-, 酸碱软硬的大小称为标度,现在有三种方法求得
●1)由实验数据求得,
●2)以酸碱的若干性质,如离子半径、电离势、电负性求得,
●3)由酸碱一般性质求得
其中第3)种最有意义,常称Ahland法,也称Ahland软硬标度。
总体说来:还没有严格的区分标准,根据酸碱的性质,大体上的分类原则上可总结如下:分类总结
酸碱性质硬软硬软
极化性低高低高
电性电正性高电正性低电负性高电负性低
电荷量正电荷高正电荷低负电荷高负电荷低
氧化态高低难氧化易氧化
体积小大小大
键型静电共价离子键共价键
一般通用的规则:
1)对于变价的中心离子,低价态软度高,高价态硬度高,低价态时易与N、S配位原子成键,而高价态则与O配位;
2)高变形阳离子如Au(I), Cu(I), Ag(I)与CN-、I-生成的配离子比与OH-、F-形成的配离子稳定。
2 配合物的稳定性
Pearson规则:硬亲硬,软亲软,软硬交界都不管。
卤素离子配合物的稳定常数(lgK)
第二节中心离子的本性(性质)与配离子稳定的关系
常将中心离子按其电子结构分成四类:
1 )惰气型金属离子
2 )d10型金属离子
3 )d10s2型金属离子
4 )d1-9型金属离子
1 惰气型金属离子
外层电子结构为:s2p6 通常的元素为第一主族的Li, Na, K, Rb, Cs 等离子,
第二主族的Be, Mg, Ca, Sr,Ba,
第三主族的Al,Ga,In,Ti
第三副族Sc, Y, La呈三价时亦是这种结构
一般认为:具有8电子结构的中心离子形成配合物时,只有静电吸引力与配体作用。
形成的配位键属于电价型,其稳定性主要受中心离子的电荷和半径的影响。
1)半径的影响配体一定时,中心离子的半径愈小,形成配合物稳定性愈高;
2)电荷的影响中心离子的电荷增加,配离子的稳定性增加,且电荷的影响比半径的影响大
一些离子与EDTA配合物的稳定常数(lgK)
离子Na+ Ca2+ Y3+
半径(nm) 9.5 9.9 9.3
lgK 1.64 10.61 18.08
离子Sr2+ La3+
半径(nm) 11.3 11.5
lgK 8.68 15.46
3)离子势Z2/r的影响:综合考虑电荷与半径的因素,Z2/r上升,K上升,且规律性良好。
2 d10型金属离子
这类金属离子是第一副族失去一个电子,如Cu,Ag, Au
第二副族失去二个电子,如Zn, Cd, Hg
第三副族失去三个电子,如Ga, In, Tl
特点:d电子处于饱和态,d电子具有一定的活动性,但比较弱,与惰气型离子相比,它们相对容易变形,即容易受极化。
原则:考虑这一类离子形成配合物时,既要考虑静电作用,又要考虑共价作用,和惰气型的离子相比,它们更容易形成较稳定的配合物。
对于一些配体来说:形成的配合物的稳定次序有;Zn2+ 另外也可能有:Zn2+>Cd2+ 原因:Zn2+是典型的硬酸,Hg2+是典型的软酸,Cd2+是中间酸 3 d1-9型金属离子 这一类金属离子主要指过渡系金属,大部分有色金属落在此范围。对这些金属离子与配体形成的配合物大量稳定常数的数据得出以下规律: Mn2+ < Fe2+ 此规律称为Irving---Williams 顺序。 用晶体场理论可以解释此顺序。 对于第四周期从Ca2+到Zn2+各元素的+2价离子形成的配离子,假定其都为“高自旋”的八面体,其配位反应简单地写成: M2++6L =ML6 该反应的ΔG=ΔH-TΔS 对于同一种配体,不同的金属离子形成配合物的熵变大小相差很小,可以近似认为是相等。ΔG的大小实际上由ΔH的大小决定。ΔH的大小则由晶体场的稳定化能决定,即晶体场稳定化能的大小顺序与ΔH的大小顺序是一致的,因而也决定了晶体场的稳定化能。 虽然晶体场稳定化能在放出的总能量中只占很小一部分,但对于各能量的次序却起了决定性的作用。因此,各M2+分别与某一配体L形成八面体弱场配离子时放出的热量(DTAH)的大小顺序由相应的晶体场稳定化能的大小顺序所决定,也就是说,晶体场稳定化能的大小顺序与DTAH的顺序是一致的,因而也决定了DTAG的大小顺序。 在d8和d3时稳定化能最大,在d0, d5, d10时稳定化能最小。对于d电子来说,其晶体场稳定化能有: 金属离子M2+与配体怕配合物稳定性的理论顺序。 而Irving-Williams顺序为: d8和d9的次序相反应由John-Teller效应解释。 晶体场理论解释的局限:1 只讨论的是高自旋配合物的情况 2假设都是6配位, 第三节配体的本性与配离子稳定性的关系 1配体的碱性 1)对于一些重要的无机配体,形成的配合物的稳定性与配体的第一级加质子常数有一定的关系。 2)对结构相对来说比较复杂的有机配体 当配位原子相现的一系列结构密切相关的体分别与同是金属离子形成配离子时,它们的稳定常数的大小顺序往往与相应的配体的第一级加质子常数的大小顺序一 致,而且在不少情况下稳定常数的对数值与相应的配位体的第一级加质子常数的对 数值还存在线性关系(直线自由能) 例如,对N-(对位取代苯基础理论氨基)氨基乙酸根,这些配体与Cu(II), Ni(II), Zn(II)等形成的配合物的稳定常数与相应的加质子常数的对数值成以下: lgK CuL=1.5851lgK1H-2.544 lgK NiL=0.8001lgK1H-0.543 lgK ZnL=0.8111lgK1H-0.673 2螯环的影响 当一个配体有两个以上的配位原子时,且两个配位原子同时与金属离子配位时所形成的配合物称为螯合物。 ●螯合物的稳定性一般比组成相近的非螯合物的稳定性要大一些,这种效应称为螯合 效应 ●螯合效应的定性解释:ΔS变大的结果 ●螯环大小对配合物稳定性的影响: 以五员环或六员环最稳定,而五员环往往又比六员环稳定。 单键的以五员环稳定,有双键的则是六员环稳定 题6.1判断图6-23所示各电路中的反馈支路是正反馈还是负反馈。如是负反馈,说明是何种反馈类型。 - +++ + - i U o U CC V VT 1VT 2b1R b2 R c R e11 R e12 R e2 R f R 1 C 2 C 3C e C +- +++ - i U o U C C V VT 11 C 2 C e1 R +VT 2 b21R b22R c2 R e2 R e C 4 C 3 C f R ++b11R b12 R c1R - + + + - i U o U +V 12CC V VT 1 VT 2 Ω39k Ω k 12ΩM 1Ω k 220Ω k 9.3 (a ) (b ) (c ) 图6-21 解:(1)电压并联负反馈;(2)电压串联正反馈;(3)电压串联负反馈 题6.2 用理想集成运放组成的两个反馈电路如图6-22所示,请回答: 1.电路中的反馈是正反馈还是负反馈?是交流反馈还是直流反馈? 2.若是负反馈,其类型怎样?电压放大倍数又是多少? ∞ A o U i U -+ - +L R 3 R 2 R 1R ∞A i U -+ - +Ω k 30Ω k 5.7Ω k 10 图6-22 解:1.反馈类型分别是电压串联交直流负反馈,电流并联负反馈; 2.放大倍数分别为4、2 L R R - 题6.3判断图6-23中各电路所引反馈的极性及反馈的组态。 ∞ A o U i U - +-+L R 2 R 1 R o I ∞A o U i U - +- +L R 3 R 2R o I 4 R 1 R ∞A o U i U -+ - + L R 4 R 2R 5 R 1 R 3 R (a ) (b ) (c ) 图6-23 解:(1)电流串联负反馈;(2)电流并联负反馈;(3)电压并联负反馈 题6.4判断图6-24所示电路的交流反馈类型。 A 1 R F R ' R u I u O +_ +_∞ GMP文件验证篇 盐酸小檗碱对照品溶液有效期验证方案 方案编号: SOP-COD0400 年月 验证方案审批表 验证方案名称盐酸小檗碱对照品溶液有效期验证方案 验证方案编号SOP—COD0400 方案起草人起草日期 方案审核部门审核人审核日期审核意见化验室 质量部 批准意见 批准人 批准日期 执行日期 盐酸小檗碱对照品溶液有效期验证方案目录 1.目的 2.背景 3.稳定性研究 .标签 .对照品溶液配制 .贮存条件 .测试时间点 .分析方法和接受标准 4.参考文件 5.结果报告 6.附件 1.目的:确定盐酸小檗碱对照品溶液的有效期。 2.背景:因药典中没有规定对照品溶液的有效期,因此,对于没有规定有效期的盐酸小檗碱对照品溶液进行4个月的研究,来观察其稳定性,并规定其内部使用有效期。本方案适用于常规方法—高效液相色谱法。 3. 稳定性研究: .标签:用于对照品溶液效期研究的溶液瓶上需注明“用于对照品溶液效期研究”。 .对照品溶液配制:根据《中国药典》2010版一部中药成方制剂—黄连上清片的含量测定项下对照品溶液制备方法。 .贮存条件:按规定将配制好的盐酸小檗碱对照品溶液用封口膜封好,放在2~8℃的冰箱内贮存。注意:用于分析前需放置至室温。 .测试时间点:分别在0天、7天、14天、30天、2个月、3个月、4个月内测试。 .分析方法和接受标准: 3.5.1分析方法:高效液相色谱法。色谱条件与系统适应性试验:以十八烷基硅烷键合硅胶为填充剂;以乙腈L磷酸二氢钾溶液(35:65)为流动相;检测波长345nm,理论板数按盐酸小檗碱峰计算应不低于4000. 对照品液的制备取盐酸小檗碱对照品适量,精密称定,加甲醇制成1 ml含20ug的溶液。 分别制备两份盐酸小檗碱对照品溶液(贴上“用于对照品溶液效期研究”的贴签),在零时间点,对两份对照品溶液分析两次,互相复核含量。在零时间点以外的测试时间点,分别新鲜配制一份对照品溶液,并用新鲜配制的对照品溶液和用于研究效期的两份对照品溶液分析两次。用新鲜配制的对照品溶液的平均响应值,来重新计算用于研究效期的两份对照品溶液的含量值。 山东xx制药有限公司对照品溶液稳定性研究报告 文件类别:操作文件 颁发部门:质量管理部 持有部门: 分发号: 生效日期: 分发部门:中心检验室、质量管理部 1.目的:为研究检验方法中未规定效期的对照品溶液的稳定性,特制定此规程。 2.范围:本规程适用于检验方法中未规定效期的对照品溶液。 3.依据:《药品生产质量管理规范》、《中华人民共和国药典》、《确认与验证管理规程》以及各品种质量标准。 4.责任:质量控制部部长、QC主管、QC检验员对规程的实施负责。 5.正文: 5.1.稳定性研究方案:各品种检验中使用的对照品溶液如需在一定时期内重复使用,QC检验员应制定稳定性研究方案,经组长或QC主管审核,质量控制部负责人批准后方可进行。稳定性研究方案中应明确对照品溶液的名称和浓度,配制过程、检测方法(包括检测前对照品溶液的稀释)、贮存条件、拟研究的时间及测试时间点等。稳定性研究方案应有编号,编制规则:P+方案制定日期(两位年两位月)+两位流水号,如:P120801:5.2.稳定性研究的实施: 5.2.1.标签:所有用于对照品溶液效期研究的溶液标签上都需标注“用于对照品溶液效期研究”。 5.2.2.对照品溶液配制:对照品溶液的配制应按品种规定的方法进行。 5.2.3.储存条件:对照品溶液一般密封储存在2~8℃冰箱内,用于验证分析前需放置至室温。在研究过程中对照品溶液应始终保存在指定的贮存条件下。 5.2.5.程序和接受标准 5.2.5.1.程序:分别制备两份对照品溶液,在零时间点,对每份对照品溶液分析两次,互相复核。在零时间点以外的测试时间点,新鲜配制一份对照品溶液。对新鲜配制的对照品溶液和用于研究效期的两份对照品溶液分析两次。用新鲜配制的对照品溶液的平均响应值,来重新计算用于研究效期的两份对照品溶液的含量值。 5.2.5.2.接受标准:在每次分析前,观察测试用的对照品溶液与新鲜配制的对照品溶液的外观是否一致。如果溶液异常(如出现浑浊),则停止对照品溶液的测试。在零时间点,每份对照品溶液互相复核的结果相对偏差不得过1.0%。在每个分析测试点,对照品溶液的活性成分的含量与零点的相对偏差不得过1.0%。 5.3.验证结果评定与报告:对照品溶液效期研究结束后,QC 检验员需要起草报告总结分析数据,报告应有编号(将相应方案中的P替换为R)。报告经组长或QC主管审核、质量控制部负责人批准后,确定的有效期可以生效。QC检验员在有效期生效后应登记台账以便于查对。 5.4.如有必要,可在增加中期报告或进行进一步的稳定性研究。 6.附则: 6.1.相关文件:无。 对照品溶液稳定性研究 方案 Company number:【0089WT-8898YT-W8CCB-BUUT-202108】 对照品溶液稳定性研究方案 文件类型:方法研究编号: 文件编号:﹡﹡ 页() 作者 分析师: 审核: 主管/经理 批准: 质量部经理: 签名:日期: 1.目的: 本草案目的是为了研究在方法中未规定对照品溶液的效期饿稳定性。 2.背景 目前,在药典中没有规定对照品溶液的效期(部分方法研究报告中提供对照品溶液的效期)。因此,对于没有规定有效期的对照品溶液可以研究至少一个月的时间,来确定对照品溶液的稳定性。对于对照品溶液的研究适用于常规分析方法,例如液相,气相,薄层,紫外等分析方法。 3.稳定性研究: 标签 所有用于对照品溶液效期的溶液标签上都需要标注“用于对照品溶液效期研究”。 对照品溶液配制 对照品溶液的配制遵循相应的分析方法。 储存条件 对照品溶液密封储存在2~8℃冰箱中(其他储存条件需在总结报告中说明),用于验证分析前需放置至室温。 测试时间点 测试时间可以用参照下表,更改的时间点需在总结报告中说明。 备注:×=测试点,【×】=可选择点 程序和接受标准 方法 分别制备两份对照品溶液,在零时间点,对每份对照品溶液分析两次,互相复核。在零时间点以外的测试时间点,新鲜配制一份对照品溶液。对新鲜配制的对照品溶液和用于研究效期的两份对照品溶液分析两次。用新鲜配制的对照品溶液的平均响应值,来重新计算用于研究效期的两份对照品溶液的含量值。 在每次分析前,观察测试用的对照品溶液与新鲜配制的对照品溶液的外观是否一致。如果溶液异常(如出现浑浊),或者色谱图中出现显着的杂质峰,则停止对照品溶液的测试。 在每次分析前,必须首先保证系统满足方法的系统适应性(如重复性,拖尾因子,分离度,理论塔板数等等)。在零时间点,每份对照品溶液互相复核的结果不得过。在每个分析测试点,对照品溶液的活性成分的含量与零点的差异不得过。 UV方法 第四节配合物与超分子 [核心素养发展目标] 1.能从微观角度理解配位键的形成条件和表示方法,能判断常见的配合物。2.能利用配合物的性质去推测配合物的组成,从而形成“结构决定性质”的认知模型。 3.了解超分子的结构特点与性质。 一、配合物 1.配位键 (1)概念:由一个原子单方面提供孤电子对,而另一个原子提供空轨道而形成的化学键,即“电子对给予—接受”键。 (2)表示方法:配位键常用A—B表示,其中A是提供孤电子对的原子,叫给予体,B是接受孤电子对的原子,叫接受体。 如:H3O+的结构式为;NH+4的结构式为。 (3)形成条件 形成配位键的一方(如A)是能够提供孤电子对的原子,另一方(如B)是具有能够接受孤电子对的空轨道的原子。 ①孤电子对:分子或离子中,没有跟其他原子共用的电子对就是孤电子对。如、 、分子中中心原子分别有1、2、3对孤电子对。含有孤电子对的微粒:分子如CO、NH3、H2O等,离子如Cl-、CN-、NO-2等。 ②含有空轨道的微粒:过渡金属的原子或离子。一般来说,多数过渡金属的原子或离子形成配位键的数目基本上是固定的,如Ag+形成2个配位键,Cu2+形成4个配位键等。 2.配合物 (1)概念 通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。如[Cu(NH3)4]SO4、[Ag(NH3)2]OH等均为配合物。 (2)组成 配合物[Cu(NH3)4]SO4的组成如下图所示: ①中心原子:提供空轨道接受孤电子对的原子。中心原子一般都是带正电荷的阳离子(此时又叫中心离子),最常见的有过渡金属离子:Fe3+、Ag+、Cu2+、Zn2+等。 ②配体:提供孤电子对的阴离子或分子,如Cl-、NH3、H2O等。配体中直接同中心原子配位的原子叫做配位原子。配位原子必须是含有孤电子对的原子,如NH3中的N原子,H2O中的O原子等。 ③配位数:直接与中心原子形成的配位键的数目。如[Fe(CN)6]4-中Fe2+的配位数为6。 (3)常见配合物的形成实验 实验操作实验现象有关离子方程式 滴加氨水后,试管中首先出现蓝色沉淀,氨水过量后沉淀逐渐溶解,得到深蓝色的透明溶液,滴加乙醇后析出深蓝色晶体Cu2++2NH3·H2O===Cu(OH)2↓+2NH+4、Cu(OH)2+4NH3=== [Cu(NH3)4]2++2OH-、 [Cu(NH3)4]2++SO2-4+H2O===== 乙醇[Cu(NH3)4]SO4·H2O↓ 溶液变为红色Fe3++3SCN-Fe(SCN)3滴加AgNO3溶液后,试管 中出现白色沉淀,再滴加氨水后沉淀溶解,溶液呈无色Ag++Cl-===AgCl↓、AgCl+2NH3===[Ag(NH3)2]++Cl- (4)配合物的形成对性质的影响 ①对溶解性的影响 一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。如Cu(OH)2+4NH3===[Cu(NH3)4]2++2OH-。 ②颜色的改变 当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。如Fe3+与SCN-形成硫氰化铁配离子,其溶液显红色。 对照品溶液稳定性确认方案编号:VDP-DZP-001-00 对照品溶液名称: 起草人:起草日期: 审核人:审核日期: 批准人:批准日期: 1.目的: 本草案目的是为了研究在HPLC含量测定特定存放条件下方法中未规定对照品溶液的有效期稳定性。 2.背景: 目前,在2015版《中国药典》中没有规定对照品溶液的有效期。对照品因量小价格昂贵,为获取企业利润最大化,避免不必要的费用支出。因此,对于没有规定有效期的对照品溶液研究至少需要半年的时间,来确定对照品溶液的稳定性。对于对照品溶液的研究适用于常规分析方法,例如液相,气相,薄层,紫外等分析方法。 3.稳定性研究: 3.1标签 所有用于对照品溶液效期的溶液标签上都需要标注“用于对照品溶液效期研究”。 3.2对照品溶液配制 对照品溶液的配制遵循相应的分析方法。称样量大于10mg,先配制成贮备液,再用溶剂稀释至规定的浓度范围。 3.3储存条件 对照品溶液密封储存在2~8℃冰箱中(其他储存条件需在总结报告中说明),用于验证分析前需放置至室温。 3.4测试时间点 对照品溶液存放6个月时或7个月时。 3.5程序和接受标准 3.5.1 HPLC方法 3.5.1.1对照品溶液的制备 我单位制定对照品溶液的使用期限为半年,所以需对首次配制的对照品溶液在存放6个月后进行标定。具体方法为:用新配制的对照品溶液对存放6个月、7个月的对照品溶液进行标定。新配制的对照品溶液连续进5针做系统性实验,将6个月或7个月前配制的对照品溶液作为样品进行含量测定。 3.5.1.2接受标准 在每次分析前,观察测试用的对照品溶液与新配制的对照品溶液的外观是否一致。如果溶液异常(如出现浑浊),或者色谱图中出现显著的杂质峰,则停止对照品溶液的测试。 在每次分析前,必须首先保证系统满足方法的系统适应性(如重复性,拖尾因子,分离度,理论塔板数等)。 在6月或7月测定的含量与在零月的含量差异不超过5.0%,判定结果为对照品溶液在6个月内含量稳定。计算时以0月配制的浓度为依据。 在6月或7月测定的含量与在零月的含量差异超过5.0%时,判定结果为对照品溶液在6个月内含量降解。同时用新标定的浓度和0月时的配制浓度计算校正因子。在0~6月使用该对照品溶液时,计算该对照品溶液浓度时以0月配制的浓度乘以校正因子为依据。 4参考文件: 《中国药典》2015年版四部、药品GMP指南《质量控制实验室与物料系统》P91-P97。5结果报告: 对照品溶液效期研究报告结束后,需要起草研究报告总结分析数据。在对照品溶液稳定性研究记录复核后,报告经主管领导签字后,新的效期可以执行。如必要,可以增加中期报告,或进行进一步的稳定性研究。 6.附件: 对照品溶液稳定性研究方案 文件类型:方法研究编号: 文件编号:﹡﹡ 页() 作者 分析师: 审核: 主管/经理 批准: 质量部经理: 签名:日期: 1.目的: 本草案目的是为了研究在方法中未规定对照品溶液的效期饿稳定性。 2.背景 目前,在药典中没有规定对照品溶液的效期(部分方法研究报告中提供对照品溶液的效期)。因此,对于没有规定有效期的对照品溶液可以研究至少一个月的时间,来确定对照品溶液的稳定性。对于对照品溶液的研究适用于常规分析方法,例如液相,气相,薄层,紫外等分析方法。 3.稳定性研究: 3.1标签 所有用于对照品溶液效期的溶液标签上都需要标注“用于对照品溶液效期研究”。 3.2对照品溶液配制 对照品溶液的配制遵循相应的分析方法。 3.3储存条件 对照品溶液密封储存在2~8℃冰箱中(其他储存条件需在总结报告中说明),用于验证分析前需放置至室温。 3.4测试时间点 测试时间可以用参照下表,更改的时间点需在总结报告中说明。 备注:×=测试点,【×】=可选择点 3.5程序和接受标准 3.5.1HPLC方法 3.5.1.1对照品溶液的制备 分别制备两份对照品溶液,在零时间点,对每份对照品溶液分析两次,互相复核。在零时间点以外的测试时间点,新鲜配制一份对照品溶液。对新鲜配制的对照品溶液和用于研究效期的两份对照品溶液分析两次。用新鲜配制的对照品溶液的平均响应值,来重新计算用于研究效期的两份对照品溶液的含量值。 3.5.1.2接受标准 在每次分析前,观察测试用的对照品溶液与新鲜配制的对照品溶液的外观是否一致。如果溶液异常(如出现浑浊),或者色谱图中出现显著的杂质峰,则停止对照品溶液的测试。 在每次分析前,必须首先保证系统满足方法的系统适应性(如重复性,拖尾因子,分离度,理论塔板数等等)。在零时间点,每份对照品溶液互相复核的结果不得过2.0。在每个分析测试点,对照品溶液的活性成分的含量与零点的差异不得过2.0。 3.5.2 UV方法 …… 4参考文件: 《中国药典》﹡﹡﹡﹡年版﹡﹡部(或其他方法号) 5结果报告: 对照品溶液效期研究报告结束后,需要起草研究报告总结分析数据。在对照品效期研究记录复核后,报告经主管领导签字后,新的效期可以执行。如必要,可以增加中期报告,或进行进一步的稳定性研究。 6.附件 第六章电力系统暂态稳定分析 6.1概述 在正常的稳态运行情况下,电力系统中各发电机组输出的电磁转矩和原动机输入的机械转矩平衡,因此所有发电机转子速度保持恒定。但是电力系统经常遭受到一些大干扰的冲击,例如发生各种短路故障,大容量发电机、大的负荷、重要输电设备的投入或切除等等。在遭受大的干扰后,系统中除了经历电磁暂态过程以外,也将经历机电暂态过程。事实上,由于系统的结构或参数发生了较大的变化,使得系统的潮流及各发电机的输出功率也随之发生变化,从而破坏了原动机和发电机之间的功率平衡,在发电机转轴上产生不平衡转矩,导致转子加速或减速。一般情况下,干扰后各发电机组的功率不平衡状况并不相同,加之各发电机转子的转动惯量也有所不同、使得各机组转速变化的情况各不相同。这样,发电机转子之间将产生相对运动,使得转子之间的相对角度发生变化,而转子之间相对角度的变化又反过来影响各发电机的输出功率,从而使各个发电机的功率、转速和转子之间的相对角度继续发生变化。 与此同时,由于发电机端电压和定子电流的变化,将引起励磁调节系统的调节过程;由于机组转速的变化,将引起调速系统的调节过程;由于电力网络中母线电压的变化,将引起负荷功率的变化;网络潮流的变化也将引起一些其他控制装置(如SVC、TCSC、直流系统中的换流器)的调节过程,等等。所有这些变化都将直接或间接地影响发电机转抽上的功率平衡状况。 以上各种变化过程相互影响,形成了一个以各发电机转子机械运动和电磁功率变化为主体的机电暂态过程。 电力系统遭受大干扰后所发生的机电暂态过程可能有两种不同的结局。—种是各发电机转子之间的相对角度随时间的变化呈摇摆(或振荡)状态,且振荡幅值逐渐衰减,各发电机之间的相对运动将逐渐消失,从而系统过渡到一个新的稳态运行情况,各发电机仍然保持同步运行。这时,我们就称电力系统是暂态稳定的。另—种结局是在暂态过程中某些发电机转子之间始终存在着相对运动,使得转子间的相对角度随时间不断增大、最终导致这些发电机失去同步。这时称电力系统是暂态不稳定的。当一台发电机相对于系统中的其他机失去同步时,其转子将以高于或低于需要产生系统频率下电势的速度运行,旋转的定子磁场(相应于 配合物在溶液中的稳定性 【摘要】配合物在溶液中的稳定性是指配离子或分子在溶液中解离为水合金属离子和配体,当达到平衡时其解离程度的大小。稳定性是配合物在溶液中的一个重要性质,了解配合物对在溶液中的稳定性及其规律,必须从中心离子和配体的本性以及它们之间的相互作用入手。本文主要讨论中心离子性质对配合物稳定性的影响 【关键词】惰气性、d10型、d10s2型、d1-9型金属离子 1、惰气性金属离子 碱金属: Li+、Na+、K+、Rb+、Cs+ 碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+及:Al3+、Sc3+、Y3+、La3+ (1)作用力:中心原子与配体间的作用主要是静电作用。 (2)影响稳定性的因素: 中心离子的电荷和半径。中心离子的电荷越大,半径越小形成配离子越稳定。 配合物的稳定性随z2/r增大而增大 稳定性顺序为: Li>Na>K>Rb>Cs; Be>Mg>Ca>Sr>Ba 2、d10型金属离子 Cu(Ⅰ)、Ag(Ⅰ)、Au(Ⅰ) Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ) Ga(Ⅲ)、In(Ⅲ)、Tl(Ⅲ) Ge(Ⅳ)、Sn(Ⅳ)、Pb(Ⅳ) (1)作用力: 化学键在不同的程度上有明显的共价性。 (2)稳定性的规律: ①这种金属离子的配合物一般比电荷相同、体积相近的惰气金属离子的配合物要稳定些。 ②Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)这三种金属离子配合物的稳定性是Hg(Ⅱ)的最高。 ③Zn(Ⅱ)和Cd(Ⅱ)的顺序不一致,在与有些配体配位时,Zn(Ⅱ)的配合物的稳定性大于Cd(Ⅱ)的配合物的稳定性,但与另一些配体配位时则出现相反的现象。 例如:Zn(Ⅱ)、Cd(Ⅱ)、Hg(Ⅱ)与卤素离子形成的配离子时,在Cl-、Br-、I-作配体时稳定性顺序都是Zn 案例题 1,有一台三绕组变压器,容量为25MV A ,电压为110/35/10KV ,阻抗电压U k %按第二种组合方式(即降压型)为U k12%=10.5,U k13%=18,U K23%=6.5,接入110KV 供电系统,系统短路容量S S ”=1500MV A,见下图。 (1)阻抗电压的这种组合,则高、中、低三个绕组排列顺序自铁芯向外依次为( )。 A 、中—低—高 B 、高—中—低 C 、低—中—高 D 、高—低—中 (2)每个绕组的等值电抗百分值为( )。 A 、1x =11 2x =7 3x =-0.5 B 、1x =7 2x =-0.5 3x =11 C 、1x =-0.5 2x = 11 3x =7 D 、1x =11 2x =-0.5 3x =7 (3)取基准容量S j =100MV A ,则每个绕组归算到基准容量时的电抗标幺值为( )。 A 、28.01=*x 02.02-=*x 44.03=*x B 、44.01=*x 02.02-=*x 28.03=*x C 、28.01=*x 44.02=*x 02.03-=*x D 、44.01=*x 28.02=*x 02.03-=*x 1 2 1 37KV K 3 (4)短路点K 1的超瞬态三相短路电流周期分量有效值"K I 为( )。 A 、3.2KA B 、3.71KA C 、1.98KA D 、2.17KA (5)短路点K 2的超瞬态三相短路电流周期分量有效值"K I 为( )。 A 、7.64KA B 、11.29KA C 、13.01KA D 、6.99KA 1题答案 (1)C (2)D (3)B (4)A (5)D 计算过程 (2)()%U %U %U 2 1 %2313121k k k x -+= ()115.6185.102 1 =-+= ()%U %U %U 2 1 %1323122k k k x -+= ()5.0185.65.102 1 -=-+= ()%U %U %U 2 1 %1223133k k k x -+= ()75.105.6182 1 =-+= (3)44.025 10010011% 11=?==*r j S S x x 02.025 100 1005.0% 22-=?-= =*r j S S x x 对照品溶液稳定性考察报告 (薄层色谱法用于鉴别) 报告书编号:YB- 1203·0017-00-01(2013) 一、考察目的:通过薄层鉴别实验,考察葛根素等共33种对照品分别用相应溶剂所配制的相应浓度的对照品溶液的稳定性,从而规定其用于薄层鉴别实验的有效期。 二、考察范围:对照品溶液稳定性考察。 三、考察类型:同步考察 四、考察日期及对照品及相应溶剂种类 考察日期2013 年01 月01 日至2013 年08 月30 日 对照品及相应溶剂种类:大黄素(甲醇液)、大黄素(乙醇液)、丹参酮IIA(乙酸乙酯液)、丹参酮IIA (甲醇液)、丹酚酸B(75%甲醇液)、丹皮酚(丙酮液)、甘草酸铵(甲醇液)、葛根素(甲醇液)、瓜氨酸(稀乙醇液)、桂皮醛(乙醇液)、华蟾酥毒配基(乙醇液)、黄芪甲苷(甲醇液)、黄芩苷(甲醇液)、黄芩素(甲醇液)、汉黄芩素(甲醇液)、苦参碱和槐定碱(混合乙醇溶液)、苦参碱(甲醇液)、氧化苦参碱(甲醇液)、苦杏仁苷(甲醇液)、芒柄花素(甲醇液)、毛蕊花糖苷(甲醇液)、没食子酸(甲醇液)、人参皂苷R0蜕皮甾酮(混合甲醇溶液)、山栀苷甲酯(乙醇液)、8-0-乙酰山栀苷甲酯(乙醇液)、芍药苷(乙醇液)、天麻素(甲醇液)、五味子甲素(三氯甲烷液)、盐酸水苏碱(无水乙醇液)、氧化苦参碱(乙醇液)、异钩藤碱(甲醇液)、栀子苷(乙醇液)、酯蟾酥毒配基(乙醇液)、梓醇(甲醇液)、盐酸小檗碱(甲醇液)、黄芩苷((甲醇液)。 五、考察过程中的偏差及漏项情况: 考察试验过程中无偏差情况发生,考察项目无遗漏;考察实施过程中考察方案无修改,考察记录完整,实验结果符合考察要求,无需做进一步的补充试验。 六、考察过程总结: 检验仪器设备均在检定效期内;试剂试液等实验条件均符合检验要求;人员具有相应的检验能力和资质。整个考察过程严格按《对照品(标准品)和对照药材溶液稳定性考察操作规程》(方案编码:1203·0117-00)进行考察。 七、通过考察确认文件的适用性: 文件名称文件编号 《对照品(标准品)和对照药材溶液稳定性考察操作规程》1203·0117-00 八、考察结论及建议: 本次考察过程中,实验过程严格按《对照品(标准品)和对照药材溶液稳定性考察操作规程》以及相关操作规程进行操作。检验过程中未发生偏差,无漏项。确定了葛根素等共33种对照品 橙皮苷对照品溶液稳定性研究方案 文件编码DWF-2013-01 起草人/日期 审核人/日期批准人/日期 1目的 本方案目的是为了研究橙皮苷对照品溶液的有效期。 2适用范围 本方案适用于橙皮苷对照品溶液有效期的研究。 3 职责 QC部门负责人:负责监督本方案的执行。 QC标准品管理员:负责按照本方案要求对橙皮苷对照品溶液进行稳定性研究。 4内容 4.1对照品溶液的配制 取橙皮苷对照品一定量于25ml容量瓶中,用甲醇色谱纯定容至刻度,得到浓度为 0.25mg/ml的溶液。 4.2储存条件 密封储存于2~8℃冰箱内,用于验证分析前需放置至室温。 4.3测试时间点 4.3.1首先测试3个月,可以参照下表。 测试时间点 0天1月2月3月 4.3.2若3个月内稳定性研究结果无异常,则延长测试时间为6个月,可参照下表。 测试时间点 2个月3个月4个月5个月6个月 4.3.3若6个月内稳定性研究结果无异常,则延长测试时间为1年,可参照下表。 测试时间点 8个月 1 0个月12个月[χ] [χ] 备注:[χ]=可选择点 4.4.4 每个测试的时间点可根据具体试验安排适当提前或错后,6个月以内的测试一般应在时间 点的前后7天内完成,6个月-12个月的测试前后分别不应超过10天。若有超出时限的时间更改点,需在总报告中说明。 4.4测试方法和程序 4.4.1测试方法 4.4.1.1照高效液相色谱法进行测定。 4.4.1.2色谱条件:以十八烷基硅烷键合硅胶柱为填充剂,以甲醇-醋酸-水(35:4:61)为流动 相,检测波长为283nm。 4.4.1.3测定法:精密吸取配制好的对照品溶液10ul,注入液相色谱仪,测定。 4.4.2测试程序 4.4.2.1零时间点测试程序 分别制备两份对照品溶液,在零时间点,对每份对照品溶液测试两次,互相复核,计算, 并记录结果。 4.4.2.2在零时间点以外的测试程序 新鲜配制一份对照品溶液,对新鲜配制的对照品溶液和零时间点配制的两份对照品溶液分 别测试两次。用新鲜配制的对照品溶液的平均响应值,来重新计算零时间点配制的两份对 照品溶液的含量值,记录结果。 4.5接受标准 4.5.1在每次分析前,观察测试用的对照品溶液与新鲜配制的对照品溶液的外观是否一致。如果 溶液异常(如出现浑浊),或者色谱图中出现显著的杂质峰,则停止对照品溶液的测试。 在每次分析时,必须首先保证系统满足方法的系统适用性(如重复性、拖尾因子、分离度、理论塔板数等)。 4.5.2在零时间点,每份对照品溶液互相复核的结果相对标准偏差不得过 2.0%。 4.5.3在零时间点以外的测试点,对照品溶液的活性成分的含量与零点的相对标准偏差不得过 2.0%。 5 参考文件 《中国药典》2010年一部 6 结果报告 对照品溶液稳定性研究结束后,对数据进行总结分析,并出具研究报告,报告经质量检验 科科长审核、主管厂长批准后执行该有效期。 7 附:记录 时间点对照品溶液 配制批号 含量 (mg/m1) 与零时间点的 RSD(%) 与零时间点的 平均RSD(%) 结果 xxxx药业有限公司 对照品溶液稳定性研究方案 起草人:日期:年月日 审核人:日期:年月日 批准人:日期:年月日 1 目的 本草案目的是为了研究在方法中未规定对照品溶液的效期的稳定性。 2 背景 目前,在药典中没有规定对照品溶液的效期。因此,对于没有规定效期的对照品溶液可以研究至少一个月的时间,来确定对照品溶液的稳定性。对于对照品溶液效期的研究适用于常规分析方法,例如液相,气相,薄层,紫外等分析方法。 3 稳定性研究: 3.1 标签 所有用于对照品溶液效期研究的溶液标签上都需标注“用于对照品溶液效期研究”。3.2 对照品溶液配制 对照品溶液的配制应遵循相应的产品分析方法。 3.3 储存条件 对照品溶液密封储存在2~8 ℃冰箱内(其他储存条件需在总结报告中说明),用于验证分析前需放置至室温。 3. 5. 1 程序方法 对照品溶液的制备分别制备两份对照品溶液,在零时间点,对每份对照品溶液分析两次,互相复核。在零时间点以外的测试时间点,新鲜配制一份对照品溶液。对新鲜配制的对照品溶液和用于研究效期的两份对照品溶液分析两次。用新鲜配制的对照品溶液的平均响应值,来重新计算用于研究效期的两份对照品溶液的含量值。 3. 5. 2接受标准 在每次分析前,观察测试用的对照品溶液与新鲜配制的对照品溶液的外观是否一致。如果溶液异常(如出现浑浊),或者色谱图中出现显著的杂质峰,则停止对照品溶液的测试。在每次分析时,必须首先保证系统满足方法的系统适用性(如重复性,拖尾因子,分离度,理论塔板数等等)。在零时间点,每份对照品溶液互相复核的结果不得过2.0。在每个分析测试点,对照品溶液的活性成分的含量与零点的差异不得过2.0。 第三章配位场理论和络合物结构 一、选择题 1.中央金属固定,下列离子或化合物作为配体时,场强最强的是:() A. CN- B. NH3 C. H 2 O D. SCN- 2.具有理想正八面体的电子组态(高自旋时)是:() A. (t 2g )3 B. (t 2g )1 C. (t 2g )4(e g )2 D. 以上都 不对 3.平面正方形场中,d轨道的最高简并度是:() A. 2 B. 3 C. 4 D. 1 4.导致Ni2+水合能在第一系列过渡金属元素中最大的主要原因是:( ) A. CFSE最大 B. 电子成对能最大 C. 原子序数最大 D. H 2 O是弱 场 5.下列原子作为电子给予体时,哪个原子引起的分裂能最大:() A. C B. F C. O D. N 6.决定成对能P的主要因素是:( ) A. 分裂能 B. 库仑能 C. 交换能 D. 配位场强度 7.下列配位化合物高自旋的是:() A. [Co(NH 3) 6 ]3+ B. [Co(NH 3 ) 6 ]2+ C. [Co(NO 2 ) 6 ]3- D. [Co(CN) 6 ]4- 8.下列配位化合物磁矩最大的是:() A. [FeF 6]3- B. [Mn(CN) 6 ]3- C. [Ni(H2O) 6 ]2+ D. [Co(NH3) 6 ]3+ 9.判断下列配位化合物的稳定化能大小的次序是: () (1) [CoF 6]4-(2)[NiF 6 ]4-(3)[FeF 6 ]3- A.(1)> (2)>(3) B.(1)=(2)<(3) C.(1)<(2)<(3) D.(2)>(1)>(3) 10.Ni和CO可形成羰基配合物N i (CO)n,其中n是:( ) A. 6 B. 3 C. 4 D.5 11.[Cu(H 2O) 4 ·2H 2 O]2+溶液出现蓝色的原因是:() A. 自旋相关效应 B. d-d跃迁 C. σ-π跃迁 D. 姜-泰勒效应12.配位化合物d-d跃迁光谱一般出现在什么区域:() A. 红外 B. 微波 C. 远紫外 D. 可见—紫外 13.关于[FeF 6 ]3-络离子,下列哪个叙述是错误的:() A.是高自旋络离子 B. CFSE为0 C. 中心离子的电子排斥与Fe3+相同 D. CFSE不为0 14.下列哪个轨道上的电子在XY平面上出现的几率密度为零:()A.3Pz B. 3dx2-y2 C. 3s D. 3dz2 15.下列分子中,呈反磁性的是:( ) A. B 2 B. NO C. CO D. O 2 16.晶体场稳定化能正确的大小顺序是:( ) A.[Mn(H 2O)6]2+ <[Fe(CN)6]3-<[Fe(H 2 O)6]3+<[Ru(CN)6]3- B.[Fe(H 2O)6]3+<[Mn(H 2 O)6]2+<[Ru(CN)6]3-<[Fe(CN)6]3- C.[Fe(CN)6]3-<[Fe(H 2O)6]3+ 配位化学讲义第六章溶液中配合物的稳定性 第六章 配合物在溶液中的稳定性 第一节 影响配合物稳定性的因素 一、概述 逐级稳定常数和积累稳定常数: M + L = ML [M][L] [ML]K 1= [M][L][ML] K β11= = ML + L = ML 2 [ML][L]][ML K 22= 22212[M][L]] [ML K K β= = ML 2 + L = ML ][L][ML ][ML K 233= 333213[M][L]] [ML K K K β= = …………… ……………… ………… 二、金属离子对配合物稳定性的影响 1、具有惰性气体电子结构的金属离子 碱金属:Li+、Na+、K+、Rb+、Cs+ 碱土金属:Be2+、Mg2+、Ca2+、Sr2+、Ba2+ 及:Al3+、Sc3+、Y3+、La3+ 一般认为它们与配体间的作用主要是静电作用,金属离子z/r越大,配合物越稳定。 例:二苯甲酰甲烷[phC(O)CH2C(O)ph]配合物的lgK1值(30℃,75%二氧六环) M2+ lgK1 Be2+13.62 Mg2+8.54 Ca2+7.17 Sr2+ 6.40 Ba2+ 6.10 2、Irving-Williams顺序 研究发现:第四周期过渡金属 离子与含O、N配位原子的配体 的高自旋八面体配合物,其稳 定性顺序如下: Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+ CFSE(Dq) 0 -4 -8 -12 -6 0 这称为Irving-Williams顺序,可用CFSE解释。Ni2+< Cu2+,可用Jahn-Teller效应解 释。 第三节 络合物的分子轨道理论 一、理论要点 络合物的分子轨道理论主要认为在络合物中,中心离子或原子与配位体之间不仅以静电作用相互作用着,而且往往有量子力学效应在其中起重要作用,即往往在中心离子或原子与配位体之间有共价键的生成。 二、类型 共价键:常见的有σ、π键 ①n (满)?→? σ d (空轨道)接受电子 σ键 ②n 、π(满)?→? π d (空)接受电子 正常π配键 ③*π(空)??← π d (满)授予电子 反馈π键 ①、③同时存在,称为电子授受键,即为σ键+反馈π键,同一配位体中,①、②不同时存在。 三、络合物的成键情况 1、M -L 间的σ键成键情况 2、M -L 间的π键 分裂能值大小与配体和中心原子之间σ键及π键的成键效应有关。 若配体为强的π电子给予体,形成L →M π配键,则分裂能减小,故卤素离子等是弱场; 若配体为强的π电子接受体,形成M →L π配键,则分裂能增大,故CN - ,CO,NO 2等是强场;而NH 3、H 2O 等分子与中心离子只能形成σ键,不能与M 形成π键,所以是中间场 即 中场:NH 3 、H 2O 只有σ键Fig3.1 强场:CN - 有π* 高能Fig3.3 弱场:卤素、 有π成键 Fig3.2 3、M-L 间σ-π键 (1)、羰基配合物中的σ-π键 a.M 与L 之间的σ键和反馈π键,合称为σ-π键,也称为电子授受键。 中心金属与配体之间σ键和反馈π键的形成是同时进行的,σ键的形成,使中心原子 的电负性增加,有利于反馈π键的形成;而反馈π键的形成(LM ),使中心原子的负电荷减少 ,由利于中心原子接受电子,形成σ键。 b.协同效应:σ键形成(M ←L ),中心金属M 电负性增加,有利于反馈π键的形成 反馈π键(M →L ),中心M 电负性降低,有利于σ键形成 σ-π键产生的效应: 一、加强了中心金属和配位体之间的结合。σ键反馈π键双重成键,解释零价或低价过渡金属络合物稳定性事实; 二、削弱了配位体内部的结合。由于反馈键的形成,使电子从中心金属的t2g 轨道返回到CO 的反键轨道中,这就削弱了C 和O 键的强度。 c、18电子规则 每个金属原子的价电子数和它周围配体提供的价电子数(每个CO 提供一对孤对电子)加在一起满足18电子层的惰气结构。这是将惰气都很稳定的事实应用于金属络合物而提出的。 四、有机金属络合物 1、不饱和烃络合物——络合物的结构 (1)、金属-乙烯络合物 以铂的乙烯络合物为代表:[PtCl 3(C 2H 4)]H 2O 蔡赛盐 正方形结构,乙烯以侧基与中心金属结合,C-C 键与PtCl 3-所组成的平面垂直,而且两个C 原子与的Pt 2+距离相等,如图示: Cl Cl Pt 2+C C H H H Cl 蔡塞盐 (2)金属-乙炔络合物 第六章电力系统暂态稳定分析 6。1概述 在正常的稳态运行情况下,电力系统中各发电机组输出的电磁转矩和原动机输入的机械转矩平衡,因此所有发电机转子速度保持恒定。但是电力系统经常遭受到一些大干扰的冲击,例如发生各种短路故障,大容量发电机、大的负荷、重要输电设备的投入或切除等等。在遭受大的干扰后,系统中除了经历电磁暂态过程以外,也将经历机电暂态过程。事实上,由于系统的结构或参数发生了较大的变化,使得系统的潮流及各发电机的输出功率也随之发生变化,从而破坏了原动机和发电机之间的功率平衡,在发电机转轴上产生不平衡转矩,导致转子加速或减速。一般情况下,干扰后各发电机组的功率不平衡状况并不相同,加之各发电机转子的转动惯量也有所不同、使得各机组转速变化的情况各不相同。这样,发电机转子之间将产生相对运动,使得转子之间的相对角度发生变化,而转子之间相对角度的变化又反过来影响各发电机的输出功率,从而使各个发电机的功率、转速和转子之间的相对角度继续发生变化。 与此同时,由于发电机端电压和定子电流的变化,将引起励磁调节系统的调节过程;由于机组转速的变化,将引起调速系统的调节过程;由于电力网络中母线电压的变化,将引起负荷功率的变化;网络潮流的变化也将引起一些其他控制装置(如SVC、TCSC、直流系统中的换流器)的调节过程,等等.所有这些变化都将直接或间接地影响发电机转抽上的功率平衡状况. 以上各种变化过程相互影响,形成了一个以各发电机转子机械运动和电磁功率变化为主体的机电暂态过程。 电力系统遭受大干扰后所发生的机电暂态过程可能有两种不同的结局。—种是各发电机转子之间的相对角度随时间的变化呈摇摆(或振荡)状态,且振荡幅值逐渐衰减,各发电机之间的相对运动将逐渐消失,从而系统过渡到一个新的稳态运行情况,各发电机仍然保持同步运行。这时,我们就称电力系统是暂态稳定的。另-种结局是在暂态过程中某些发电机转子之间始终存在着相对运动,使得转子间的相对角度随时间不断增大、最终导致这些发电机失去同步。这时称电力系统是暂态不稳定的。当一台发电机相对于系统中的其他机失去同步时,其转子将以高于或低于需要产生系统频率下电势的速度运行,旋转的定子磁场(相应于系 第六章 配合物在溶液中的稳定性 第一节 影响配合物稳定性的因素 一、概述 逐级稳定常数和积累稳定常数: M + L = ML [M][L] [ML]K 1= [M][L][ML]K β11== ML + L = ML 2 [ML][L]][ML K 22= 22212[M][L]][ML K K β== …………… ……………… ………… 二、金属离子对配合物稳定性的影响 1、具有惰性气体电子结构的金属离子 碱金属:M+ 碱土金属:M2+ 及:Al3+、Sc3+、Y3+、La3+ 金属离子z/r越大,配合物越稳定。 例:二苯甲酰甲烷[phC(O)CH2C(O)ph]配合物的lgK1值(30℃,75%二氧六环) M2+ lgK1 Be2+13.62 Mg2+8.54 Ca2+7.17 Sr2+ 6.40 Ba2+ 6.10 2、Irving-Williams顺序 研究发现:第四周期过渡金属离子与含O、N配位原子的配体的高自旋八面体配合物,其稳定性顺序如下: Mn2+ < Fe2+ < Co2+ < Ni2+ < Cu2+ > Zn2+ CFSE(Dq) 0 -4 -8 -12 -6 0 e g t2g 这称为Irving-Williams顺序,可用CFSE解释。Ni2+< Cu2+,可用Jahn-Teller效应解释。 三、配体性质对配合物稳定性的影响 1、碱性 配位原子相同,结构类似的配体与同种金属离子形成配合物时,配体碱性越强,配合物越稳定。 例:Cu2+的配合物: 配体lgK H lgK1 BrCH2CO2H 2.86 1.59模拟电子技术基础 第六章课后答案
液相色谱对照品或者标准品溶液稳定性验证方案
对照品溶液稳定性研究操作规程
对照品溶液稳定性研究方案
第三章 第四节 配合物与超分子
对照品溶液稳定性确认方案
对照品溶液稳定性研究方案设计
第六章 电力系统暂态稳定分析
配合物在溶液中的稳定性
第六章 短路电流计算习题-案例题
对照品(标准品)和对照药材溶液稳定性考察报告
DWF-2018-01橙皮苷对照品溶液稳定性研究的方案设计设计
对照品溶液稳定性研究方案与报告
第三章配位场理论和络合物结构
配位化学讲义 第六章 溶液中配合物的稳定性
第三章第三节络合物的分子轨道理论
第六章-电力系统暂态稳定分析
(1)溶液中配合物的稳定性
