小专题 化学平衡常数(高三复习,含答案)

小专题平衡常数
一、分压平衡常数的计算
1.在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生
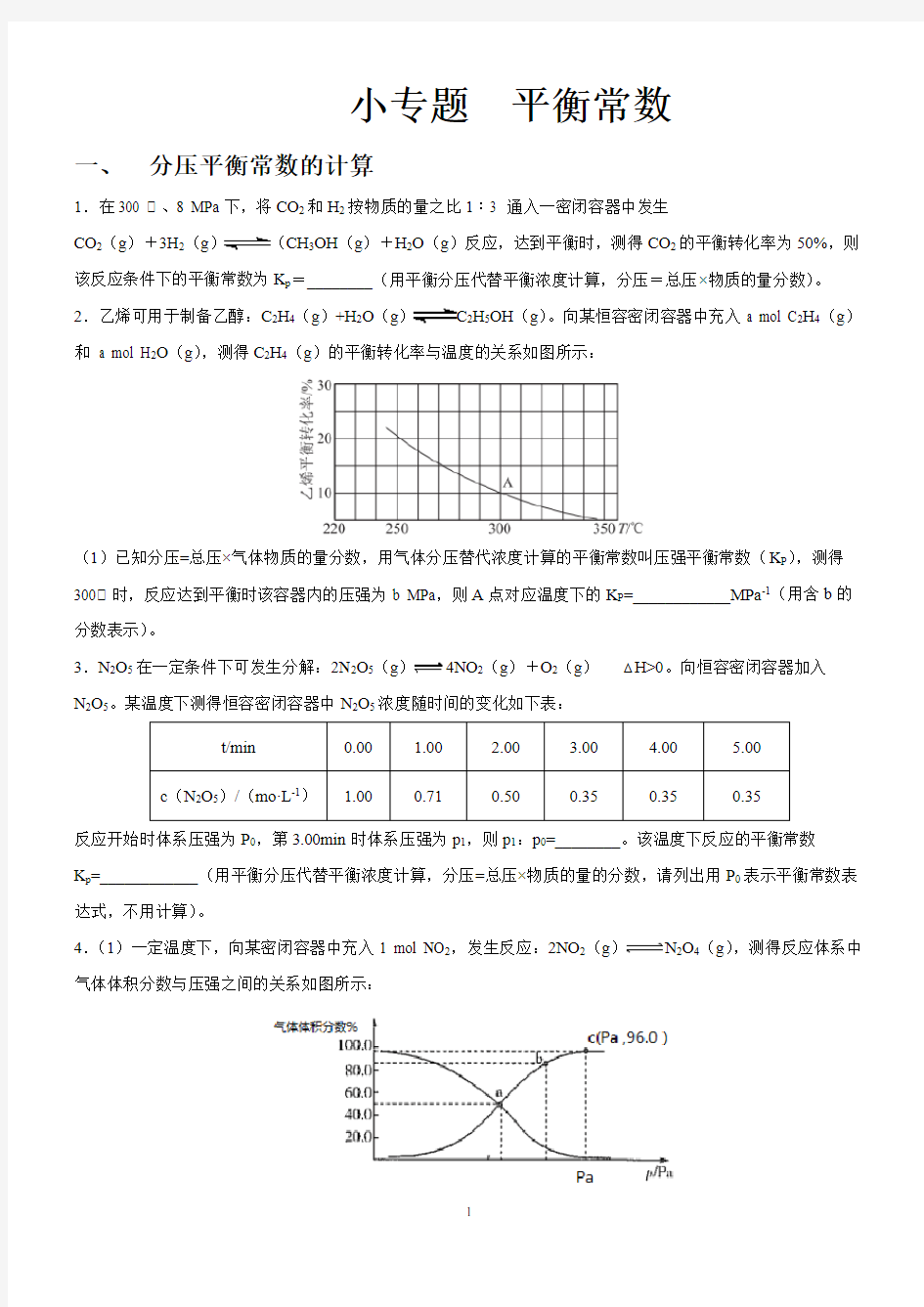
CO2(g)+3H2(g)(CH3OH(g)+H2O(g)反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为K p=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。2.乙烯可用于制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。向某恒容密闭容器中充入a mol C2H4(g)和 a mol H2O(g),测得C2H4(g)的平衡转化率与温度的关系如图所示:
(1)已知分压=总压×气体物质的量分数,用气体分压替代浓度计算的平衡常数叫压强平衡常数(K P),测得300℃时,反应达到平衡时该容器内的压强为b MPa,则A点对应温度下的K P=____________MPa-1(用含b的分数表示)。
3.N2O5在一定条件下可发生分解:2N2O5(g)4NO2(g)+O2(g)△H>0。向恒容密闭容器加入
N2O5。某温度下测得恒容密闭容器中N2O5浓度随时间的变化如下表:
反应开始时体系压强为P0,第3.00min时体系压强为p1,则p1:p0=________。该温度下反应的平衡常数
K p=____________(用平衡分压代替平衡浓度计算,分压=总压×物质的量的分数,请列出用P0表示平衡常数表达式,不用计算)。
4.(1)一定温度下,向某密闭容器中充入1 mol NO2,发生反应:2NO2(g)N2O4(g),测得反应体系中气体体积分数与压强之间的关系如图所示:
1
a 点时NO 2的转化率为___________,用平衡分压代替平衡浓度也可求出平衡常数K p ,则该温度下K p =________Pa -1。
5.环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下: 氢化反应:(l )+H 2(g )垐垐垐?噲垐垐?
催化剂
(环戊烯)
(l ) ?H=-100.5 kJ/mol 副反应:
(l )+H 2(g )垐垐垐?噲
垐垐?
催化剂(环戊烷)
(l ) ?H=-109.4 kJ/mol
解聚反应:
垐垎?噲垐?解聚二聚
2(g ) ?H>0
实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa 的双环戊二烯和水蒸气,达到平衡后总压为500 kPa ,双环戊二烯的转化率为80%,则 p (H 2O )=________kPa ,平衡常数K p =__________kPa (Kp 为以分压表示的平衡常数)。
二、 速率常数的应用
6.在容积均为1 L 的密闭容器A(起始500 ℃,恒温)、B(起始500 ℃,绝热)两个容器中分别加入0.1 mol N 2O 、0.4 mol CO 和相同催化剂。实验测得A 、B 容器中N 2O 的转化率随时间的变化关系如图乙所示。
(1)500 ℃该反应的化学平衡常数K =________(用分数表示)。
(2)实验测定该反应的反应速率v 正=k 正·c(N 2O)·c(CO),v 逆=k 逆·c(N 2)·c(CO 2),k 正、k 逆分别是正、逆反应速率常数,c 为物质的量浓度。计算M 处的v 正
v 逆
=________(保留两位小数)。
7.甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH 4(g)+H 2O(g)CO(g)+3H 2(g)。
通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa 条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H 2的物质的量分数与水碳比、平衡温度的关系如图所示。
据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为
________________,其压强平衡常数为________________;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=________________(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
8.航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatior反应:CO2(g)+4H2(g)CH4(g)+2H2O(g)
水电解反应:2H2O(g)2H2(g)+O2(g)
一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g)C(s)+2H2O(g)△H<0代替Sabatier反应,再电解水实现O2的循环利用。
350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应,若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强随时间的变化如表所示:
①350℃时Bosch反应的K p=_________________(K p为用气体的分压表示的平衡常数,分压=气体的体积分数×体系总压)
②Bosch反应的速率方程:v正=k正?c(CO2)?c2(H2),v逆=k逆?c2(H2O)(k是速率常数,只与温度有关)。
3
30min时,k
k
正
逆
_________________
2
2
2
22
c(H O)
c(CO)c(H)
(填“>”“<”或“=”);升高温度,k正增大的倍数
_________________k逆增大的倍数。(填“>”“<”或“=”)
9.利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
2CH3OH(g)CH3OCH3(g)+ H2O(g)ΔH,其速率方程式为:v正=k正·c2(CH3OH),v逆=k逆·c (CH3OCH3)·c(H2O),k正、k逆为速率常数且只与温度有关。经查阅资料,上述反应平衡状态下存在计算
式:lnKc = ?2.205+
2708.6137
T
(Kc为化学平衡常数;T 为热力学温度,单位为K)。
反应达到平衡后,仅升高温度,k正增大的倍数_________ k逆增大的倍数(填“>”、“<”或“=”)。
10.一定温度下,在1 L恒容密闭容器中充入一定量C2H4(g)和H2O(g),发生如下反应:C2H4(g)+ H2O(g)
CH3CH2OH(g) ΔH,测得C2H4(g)的转化率(α)与时间(t)的关系如图2所示。其中T1、T2表示温度,速率方程:υ正=k正·c(C2H4)·c(H2O),υ逆=k逆·c(CH3CH2OH)(k是速率常数,只与温度有关)。
①N点:k正/k逆_______c(CH3CH2OH)/c(C2H4)?c(H2O)(填“>”“<”或“=”),升高温度,k正增大的倍数________k逆增大的倍数(填“>”“<”或“=”)。
②温度为T1时,测定平衡体系中c(H2O)=0.25 mol·L?1,则:k正/k逆=__________L·mol?1。
5
小专题 平衡常数 参考答案
1.【答案】
1
48
【解析】若反应条件为压强8MPa ,300℃的反应温度下二氧化碳和氢气按1:3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,
()()()()
()()()
2232CO g +3H g CH OH g +H O g mol 1300
mol 0.5 1.50.50.5mol 0.5
1.5
0.5
0.5
?
始变平
分压=总压×物质的量分数,物质的量分数=
该物质的物质的量总的物质的量
,故P (CO 2)=
80.54
33?=,P (H 2)=8 1.543?=,P (CH 3OH )=80.5433?=,P (H 2O )=80.5433
?=Kp=
344
33443
?
?=148(MPa )?2 2.【答案】(1)
19
81b
【解析】(1)由图可知,A 点时乙烯的平衡转化率为10%,则平衡时C 2H 4(g )、H 2O (g )、C 2H 5OH (g )的物质的量分别为0.9a mol 、0.9a mol 、https://www.360docs.net/doc/ea8184053.html, mol ,总的物质的量为1.9amol 。平衡时A 点对应容器的总压强为b MPa ,故C 2H 4(g )、H 2O (g )、C 2H 5OH (g )的分压分别为
0.9b MPa 1.9、0.9b MPa 1.9、0.1b
MPa 1.9
,则-1P 0.1b
MPa
191.9K ==MPa 0.9b 0.9b 81b MPa MPa 1.9 1.9
?。故答案为:1981b 。
3.【答案】1.975
4002
0(1.3P )(0.325P )(0.35P ) 【解析】压强之比等于物质的量之比,第3.00min 时,c (N 2O 5)=0.35mo·L -1,c (NO 2)=1.3mo·L -1,c (O 2)
=0.325mo·L -1,设容器的体积为VL ,()1
11
00.35 1.30.325 1.9751.00mol L VL P
P mol L VL
--++?==?g g ;根据表中数据可知3min 时达到平衡状态,且上一步计算得到平衡时总压为1.975P 0;
()()()
252211124(?) 1.000.000.00(?)0.65 1.300.325(?)
0.35
1.30
0.325
N O g NO g O g mol L mol L mol L ---=+开始转化平衡
该温度下平衡常数4400002
2001.300.325( 1.975)( 1.975)
(1.3)(0.325)1.975 1.975=0.35(0.35)( 1.975)1.975
P P P P Kp P P ????=? 4.【答案】(1)66.7% 600/p 0
【解析】(1)②a 点时,设消耗了xmolNO 2,则生成0.5xmolN 2O 4,剩余(1-x )molNO 2,1-x=0.5x ,
x=2/3mol ,此时NO 2的转化率为66.7%,平衡时p (N 2O 4)=0.96p 0,p (NO 2)=0.04p 0,由此可求出K p =600/p 0。 5.【答案】50 3200
【解析】设加入的双环戊二烯的物质的量为x mol 、水的物质的量为y mol ,由于达到平衡时双环戊二烯的转化率为80%,则剩余双环戊二烯的物质的量为0.2x mol 、生成环戊二烯的物质的量为1.6x mol 。在恒温恒容条件下,气体的压强之比等于物质的量之比,所以(x+y )mol :(0.2x+1.6x+y )mol=300kPa :500kPa=3:5,解得x :y=5:1,则平衡时H 2O 的分压p (H 2O )=
ymol ymol 1
500?kPa 500?kPa 500?kPa 1.8xmol 0.2xmol ymol 1.85ymol ymol 10?=?=?++?+=50 kPa ;p (双环戊二
烯)=
0.2x 1500?kPa 500?kPa 1.8x y 10?=?+=50 kPa ;p (环戊二烯)= 1.6x 8
500?kPa 500?kPa 1.8x y 10
?=?+=400 kPa ,则该反应的化学平衡常数用平衡分压表示Kp=()()
()2
2p 400?kPa p 50?kPa
=
环戊二烯双环戊二烯=3200 kPa 。
6.【答案】(1)145
(2)1.69
【解析】(1)图乙中b 曲线对应A 容器中N 2O 的转化率,达到平衡时N 2O 转化率为25%,则有: N 2O(g)+CO(g)
N 2(g)+CO 2(g)
起始浓度/(mol·L -
1) 0.1 0.4 0 0 转化浓度/(mol·L -
1) 0.025 0.025 0.025 0.025 平衡浓度/(mol·L -1) 0.075 0.375 0.025 0.025 则500 ℃时该反应的化学平衡常数K =
c (N 2)·c (CO 2)c (N 2O )·c (CO )=0.025×0.0250.075×0.375=1
45
。
(2)由(1)分析可知,500 ℃恒温容器中达到平衡时,N 2O(g)、CO(g)、N 2(g)和CO 2(g)的平衡浓度(mol·L -
1)分别为0.075、0.375、0.025、0.025,则有v 正=k 正·c(N 2O)·c(CO)=k 正×0.075×0.375,v 逆=k 逆·c(N 2)·c(CO 2)=k
逆
×0.025×0.025;达到平衡时v 正=v 逆,则有k 正×0.075×0.375=k 逆×0.025×0.025,据此可得k 正k 逆=1
45;M 点对应的N 2O
的转化率为20%,此时N 2O(g)、CO(g)、N 2(g)和CO 2(g)的浓度(mol·L -
1)分别为0.08、0.38、0.02、0.02,则有
v 正v 逆
7
=
k 正×0.08×0.38
k 逆×0.02×0.02
≈1.69。
7.【答案】66.67% 4.32×10?2(MPa)2
6
k 【解析】操作压强为0.1MPa 、平衡温度为900℃条件下,水碳比为1.0时,H 2的物质的量分数为0.6,设甲烷和H 2O 的物质的量均为amol ,达化学平衡时,甲烷消耗x ,
4222CH (g)+H O(g)CO(g)+3H (g)00
3--332(H )0.6223
a a x x x x a x a x
x x x
x a a x ?===
+?
起始(mol)转化(mol)平衡(mol),得,则CH 4的转化率42
3(CH )=100%66.67%a
a
α?= 已知:气体分压=气体的物质的量分数×总压,1342103
(CH )(H O)0.1a a p p p p ==?=总总 2(H )0.6p p =总,
21
(CO)(H )0.23
p p p =
=总,压强平衡常数为3
3222420.2(0.6)(CO)(H ) 4.32=4.32 4.3210(CH )(H O)0.10.1P p p p p K p p p p p -??===?=???22总总总总总
(0.1MPa)(MPa);
反应速率方程为v=kp(CH 4)p -1
(H 2),此时反应速率0.1=0.66
p k
v k
p =总总 。
8.【答案】①
1
P
②> < 【解析】①向体积为2L 的恒容密闭容器中通入8molH 2和4molCO 2发生以上反应,结合三段式计算平衡状态气体物质的量,设达到平衡状态消耗二氧化碳物质的量为x ,
222CO (g)+2H (g)C(s)+2H O(g)
()480
()22()4822mol mol x x x mol x x x
--?起始变化平衡
气体压强之比等于物质的量之比,
486
48225
x x x +=-+-+ ,得出x=2mol ,则平衡下n(CO 2)=2mol ,
n(H 2)=4mol ,P=5.00P ,CO 2%=20%,H 2%=40%,H 2O%=40%,
22(40% 5.00)1
(20% 5.00)(40% 5.00)p P K P P P
?==??? ;
②Bosch 反应的速率方程: 222=()()v k c CO c H ??正正 ,2
2=()v k c H O ?逆逆(k 是速率常数,只与温度有关)。30min 时,图表数据分析反应正向进行,v 正>v 逆,则得到222=()()v k c CO c H ??正正>2
2=()v k c H O ?逆逆,
222
22()()()
k c H O k c CO c H >?正逆,反应为放热反应,升高温度,平衡逆向进行,v 正<v 逆,k 正增大的倍数<k 逆增大的倍数。
9.【答案】<
【解析】温度升高,lnK C 减小,K C 减小,说明升高温度,平衡逆向移动,故升高温度,k 正增大的倍数小于k 逆增大的倍数;
10.【答案】①> < ② 16
【解析】①反应达到平衡时,υ正=υ逆,可得平衡常数K=,N 点正反应速率大于逆反应速率,则
c (CH 3CH 2OH )
c (C 2H 4
)?c (H 2
O )
<,根据“先拐先平数值大”可知,T 2>T 1,且平衡时T 2温度下,C 2H 4的转化率小于T 1的转化
率,故正反应为放热反应,升温平衡向逆向移动,说明k 逆增大倍数大于k 正增大倍数。
②温度为T 1时,C 2H 4(g)的平衡转化率为80%,设C 2H 4的起始浓度为c mol/L ,平衡时c(C 2H 4)=0.2c mol·L ?1,c(CH 3CH 2OH)=0.80c mol·L ?1,已知c(H 2O)=0.25 mol·L ?1,则:K==0.8c
0.2c×0.25L/mol=16
高考化学二轮复习专题十九化学平衡及其计算(含解析)
高考化学二轮复习专题十九化学平衡及其计算(含解析) 1、一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图 所示:下列描述正确的是( ) A.反应的化学方程式为: X(g)+Y(g)Z(g) B.反应开始到10s,X的物质的量浓度减少了0.79mol/L C.反应开始到10s时,Y的转化率为79.0% D.反应开始到10s,用Z表示的反应速率为0.158mol/(L·s) 2、(NH4)2S03氧化是氨法脱硫的重要过程。某小组在其他条件不变时,分别研究了一段时间 内温度和(NH4)2S03,初始浓度对空气氧化(NH4)2S03速率的影响,结果如下图。 下列说法不正确的是( ) A. 60℃之前,氧化速率增大与温度升高化学反应速率加快有关 B. 60℃之后,氧化速率降低可能与02的溶解度下降及(NH4)2SO3受热易分解有关 SO 水解程度增大有关 C. (NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,与2 3 D. (NH4)2SO3初始浓度增大到一定程度,氧化速率变化不大,可能与02的溶解速率有关 3、将1mol M和2mol N置于体积为2L的恒容密闭容器中,发生反应:M(s)+2N(g)P(g)+Q(g) △H 。反应过程中测得P的体积分数在不同温度下随时间的变化如图所示。下列说法正确的 是( )
A.若X、Y两点的平衡常数分别为K1、K2,则K1>K2 B.温度为T1时,N的平衡转化率为80%,平衡常数K =40 C.无论温度为T1还是T2,当容器中气体密度和压强不变时,反应达平衡状态 D.降低温度、增大压强、及时分离出产物均有利于提高反应物的平衡转化率 4、温度为一定温度下,向2.0L恒容密闭容器中充入1.0mol PCl 5,反应PCl5(g)PCl3(g)+ Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( ) t/s 0 50 150 250 350 n(PCl3)/mol 0 0.16 0.19 0.20 0.20 A.反应在前50s的平均速率v(PCl3) = 0.0032mol·L-1·s-1 B.保持其他条件不变,升高温度,平衡时c(PCl3) = 0.11mol·L-1,则反应的ΔH<0 C.相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,反应达到平衡前v(正)> v(逆) D.相同温度下,起始时向容器中充入2.0mol PCl3和2.0mol Cl2,达到平衡时,PCl3的转化率小于80% 5、T℃时,发生可逆反应A(g)+2B(g)2C(g)+D(g) ΔH<0。现将1mol A和2mol B加入甲容器中,将4mol C和2mol D加入乙容器中。起始时,两容器中的压强相等,t1时两容器内均达到平衡状态(如图所示,隔板K固定不动)。下列说法正确的是( )
化学平衡常数 专题
化学平衡常数题组 1、N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0 T1温度时,向密闭容器中通入N2O5,部分实验数据见下表: 时间/s 0 500 1000 1500 c(N2O5)/mol·L-1 5.00 3.52 2.50 2.50 下列说法中不正确的是( ) A.T1温度下,500 s时O2的浓度为0.74 mol·L-1 B.平衡后其他条件不变,将容器的体积压缩到原来的1/2,则再平衡时c(N2O5)>5.00 mol·L-1 C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1
高三化学平衡专题复习习题
化学平衡: 1、反应:4NH3+5O2===4NO+6H2O,在5L得密闭容器中进行,半分钟后,NO得物质得量增加 了0、3mol,则此反应得平均速率表示正确得就是( ) A、v(O2)=0、01mol?L-1?s-1 B、v(NO)=0、008mol?L-1?s-1 C、v(H2O)=0、003mol?L-1?s-1 D、v(NH3)=0、004mol?L-1?s-1 2、当增大压强时,下列化学反应速率不会变大得就是( ) A.碘蒸气与氢气化合生成碘化氢 B.稀硫酸与氢氧化钡溶液反应 C.二氧化碳通入澄清石灰水 D.氨得催化氧化反应 3.下列表格中得各种情况,可以用下面对应选项中得曲线表示得就是( ) 选项反应纵坐标甲乙 A 外形、大小相近得金属与水反应 反应 速率 K Na B 4 mL 0、01 mol/L得KMnO4溶液, 分别与不同浓度得H2C2O4(草酸) 溶液各2 mL反应 0、1 mol/L得 H2C2O4溶液 0、2 mol/L得H2C2O4 溶液C 5 mL 0、1 mol/L Na2S2O3溶液与5 mL 0、1 mol/L H2SO4溶液反应 热水冷水D 5 mL 4%得过氧化氢溶液分解放出 O2 无MnO2粉末加MnO2粉末 A. B. C. D、 4.(09全国卷Ⅰ13)下图表示反应() X g4()() Y g Z g +,0 H ?<,在某温度时X 得浓度随时间变化得曲线: 下列有关该反应得描述正确得就是( ) A、第6min后,反应就终止了 B、X得平衡转化率为85% C、若升高温度,X得平衡转化率将大于85% D、若降低温度,v正与v逆将以同样倍数减少
高考化学平衡大题训练
1.甲醇是基本有机化工原料.甲醇及其可制得产品的沸点如下. 名称甲醇二甲胺二甲基甲酰胺甲醚碳酸二甲酯 结构简式CH3OH (CH3)2NH (CH3)2NCHO CH3OCH3(CH3O)2CO 沸点(℃) 64.7 7.4 153℃﹣24.9 90℃ (1)在425℃、A12O3作催化剂,甲醇与氨气反应可以制得二甲胺.二甲胺显弱碱性,与盐酸反应生成(CH3)2NH2Cl,溶液中各离子浓度由大到小的顺序为. (2)甲醇合成二甲基甲酰胺的化学方程式为:2CH3OH+NH3+CO(CH3)2NCHO+2H2O△H若该反应 在常温下能自发进行,则△H0 (填“>”、“<”或“=“). (3)甲醇制甲醚的化学方程式为:2CH3OH CH3OCH3+H2O△H.一定温度下,在三个体积均为1.0L 的恒容密闭容器中发生该反应. 容器编号温度/℃起始物质的量/mol 平衡物质的量/mol CH3OH CH3OCH3H2O Ⅰ387 0.20 x Ⅱ387 0.40 y Ⅲ207 0.20 0.090 0.090 ①x/y=. ②已知387℃时该反应的化学平衡常数K=4.若起始时向容器I中充入0.1mol CH3OH、0.15mol CH3OCH3和0.10mol H2O,则反应将向(填“正”或“逆”)反应方向进行. ③容器Ⅱ中反应达到平衡后,若要进一步提高甲醚的产率,可以采取的措施为. (4)以甲醇为主要原料,电化学合成碳酸二甲酯工作原理如图所示. 电源负极为(填“A”或“B“),写出阳极的电极反应式.若参加反应的O2为 1.12m 3(标 准状况),则制得碳酸二甲酯的质量为kg. 2. (16分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。 (1)CO可用于炼铁,已知:Fe2O3(s)+3C(s)=2Fe (s)+3CO(g) ΔH 1=+489.0 kJ· mol-1, C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1,则CO还原Fe2O3(s)的热化学方程式为。 (2)CO与O2设计成燃料电池(以KOH溶液为电解液)。该电池的负极反应式为。 (3)CO 2和H2充入一定体积的恒容密闭容器中,在两种温度下发生反应:CO2(g) +3H2(g) CH3OH(g) +H2O(g) 测得CH3OH的物质的量随时间的变化如图5。 ①该反应的ΔH 0(填“大于或小于”),曲线I、Ⅱ对应的平衡常数大小关系为 KⅠKⅡ(填“>、=或<”)。 ② 容器甲乙
高三二轮专题复习:化学平衡常数(教学设计)
高三二轮专题复习教学设计 化学平衡常数 考纲要求: (6)化学反应速率和化学平衡 ①了解化学反应速率的概念、反应速率的定量表示方法。 ②了解催化剂在生产、生活和科学研究领域中的重要作用。 ③了解化学反应的可逆性。 ④了解化学平衡建立的过程。了解化学平衡常数的含义,能利用化学平衡常数进行相关的计算。 ⑤理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能利用相关理论解析其一般规律。 ⑥了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 高考分析: 化学反应速率和化学平衡是高考的必考容,其主要命题的容有: ①化学反应速率影响因素及其计算; ②化学平衡状态的判断及其影响因素; ③应用平衡移动的原理判断反应进行的方向; ④化学反应速率和化学平衡的图像分析; ⑤转化率、平衡常数的含义及相关计算 将化学反应速率和化学平衡移动的原理与化工生产、生活实际相结合的题目是最近几年高考命题的热点,特别是化学平衡常数的影响因素及其计算是新教材增加的容,高考的热点。 学情分析: 从解题得分的统计可以发现:学生不能灵活的利用平衡移动的规律解决有关平衡的问题,特别是复杂点的问题往往感到触手无策;对平衡常数的理解仅停留在概念定义层面,不能充分发挥它解决平衡问题的功能。 复习目标: 1.加深学生对化学平衡常数的理解,并熟练的利用化学平衡常数进行相关的计算,提高解题技能。 2.帮助学生将化学平衡、平衡常数等知识点进行系统化、网络化。 教学过程: 1.展示考纲要求: 化学反应速率和化学平衡 ①了解化学反应速率的概念、反应速率的定量表示方法。 ②了解催化剂在生产、生活和科学研究领域中的重要作用。 ③了解化学反应的可逆性。 ④了解化学平衡建立的过程。了解化学平衡常数的含义,能利用化学平衡常数进行相关的计算。 ⑤理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能利用相关理论解析其一般规律。 ⑥了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 讲解: 化学平衡常数的影响因素及其计算是新教材增加的容,是高考的热点。2013、2014年新课标全国Ⅰ卷、Ⅱ卷均考查了化学平衡常数这一知识点。
高中化学09化学平衡图像专题
一、几大影响因素对应的基本v-t图像 1.浓度 当其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。 改变浓度对反应速率及平衡的影响曲线: 2.温度。 在其他条件不变的情况下,升高温度,化学平衡向着吸热的方向进行;降低温度,化学平衡向着放热的方向进行。 化学平衡图像专题知识梳理
由曲线可知:当升高温度时,υ正和υ逆均增大,但吸热方向的速率增大的倍数要大于放热方向的速率增大的倍数,即υ吸>υ放,故化学平衡向着吸热的方向移动;当降低温度时,υ正和υ逆 <υ放,故化学平降低,但吸热方向的速率降低的倍数要大于放热方向的速率降低的倍数,即υ 吸 衡向着放热的方向移动。 3.压强 对于有气体参加且方程式左右两边气体物质的量不等的反应来说,在其他条件不变的情况下,增大压强,平衡向着气体物质的量减小的方向移动;减小压强,平衡向着气体物质的量增大的方向移动。 改变压强对反应速率及平衡的影响曲线[举例反应:mA(g)+n(B)p(C),m+n>p] 由曲线可知,当增大压强后,υ正和υ逆均增大,但气体物质的量减小的方向的速率增大的 倍数大于气体物质的量增大的方向的速率增大的倍数(对于上述举例反应来说,即'υ正增大的倍 数大于'υ逆增大的倍数),故化学平衡向着气体物质的量减小的方向移动;当减小压强后,υ正和υ 均减小,但气体物质的量减小的方向的速率减小的倍数大于气体物质的量增大的方向的速率逆 减小的倍数(对于上述举例反应来说,即'υ正减小的倍数大于'υ逆减小的倍数),故化学平衡向着气体物质的量增大的方向移动。 【注意】对于左右两边气体物质的量不等的气体反应来说: *若容器恒温恒容,则向容器中充入与反应无关的气体(如稀有气体等),虽然容器中的总压强增大了,但实际上反应物的浓度没有改变(或者说:与反应有关的气体总压强没有改变),故无论是反应速率还是化学平衡均不改变。 *若容器恒温恒压,则向容器中充入与反应无关的气体(如稀有气体等),为了保持压强一定,容器的体积一定增大,从而降低了反应物的浓度(或者说:相当于减小了与反应有关的气体压强),故靴和她均减小,且化学平衡是向着气体物质的量增大的方向移动。
备战高考化学化学反应速率与化学平衡(大题培优)含详细答案
备战高考化学化学反应速率与化学平衡(大题培优)含详细答案 一、化学反应速率与化学平衡 1.某化学兴趣小组欲测定KClO 3,溶液与3NaHSO 溶液反应的化学反应速率.所用试剂为10mL0.1mol/LKClO 3,溶液和310mL0.3mol /LNaHSO 溶液,所得数据如图所示。已知: 2334ClO 3HSO Cl 3SO 3H ----++=++。 (1)根据实验数据可知,该反应在0~4min 内的平均反应速率 ()Cl v -=________()mol /L min ?。 (2)某同学仔细分析实验数据后发现,在反应过程中,该反应的化学反应速率先增大后减小.某小组同学针对这一现象进一步探究影响该化学反应速率的因素,具体方法如表示。 方案 假设 实验操作 Ⅰ 该反应放热使溶液温度升高,反应速率加快 向烧杯中加入10mL0.1mo//L 的3KClO 溶液和10mL0.3mol/L 的 3NaHSO 溶液, Ⅱ 取10mL0.1mo/L 的3KClO 溶液加入烧杯中,向其中加入少量NaCl 固体,再加入10mL0.3mol/L 的3NaHSO 溶液 Ⅲ 溶液酸性增强加快了化学反应速率 分别向a 、b 两只烧杯中加入10mL0.1mol/L 的3KClO 溶液;向烧杯a 中加入1mL 水,向烧杯b 中加入1mL0.2mol/L 的盐酸;再分别向两只烧杯中加入10mL0.3mol/L 的3NaHSO 溶液 ①补全方案Ⅰ中的实验操作:________。 ②方案Ⅱ中的假设为________。 ③除Ⅰ、Ⅱ、Ⅲ中的假设外,还可以提出的假设是________。 ④某同学从控制变量的角度思考,认为方案Ⅲ中实验操作设计不严谨,请进行改进:________。 ⑤反应后期,化学反应速率变慢的原因是________。
高考化学平衡移动练习题(含答案)
化学平衡移动专题练习 1.在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是() A.反应混和物的浓度B.反应物的转化率 C.正、逆反应速率D.反应混和物的压强 2.在下列平衡体系中,保持温度一定时,改变某物质的浓度,混合气体的颜色会改变;改变压强时,颜色也会改变,但平衡并不移动,这个反应是() A.2NO+O22NO2B.Br2(g)+H22HBr C.N2O42NO2 D.6NO+4NH35N2+3H2O 3.在某温度下,反应ClF(g) + F2(g)ClF3(g)(正反应为放热反应)在密闭容器中达到平衡。下列说法正确的是()A.温度不变,缩小体积,Cl F的转化率增大 B.温度不变,增大体积,Cl F3的产率提高 C.升高温度,增大体积,有利于平衡向正反应方向移动 D.降低温度,体积不变,F2的转化率降低 4.已建立化学平衡的可逆反应,当改变条件使化学反应向正反应方向移动时,下列有关叙述正确的是()①生成物的百分含量一定增加②生成物的产量一定增加 ③反应物转化率一定增大④反应物浓度一定降低 ⑤正反应速率一定大于逆反应速率⑥使用了合适的催化剂 A.①②B.②⑤C.③⑤D.④⑥ 5.在一密闭容器中,反应aA(g) bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新平衡时,B的浓度是原来的60%,则() A.平衡向逆反应方向移动了B.物质B的质量分数增加了C.物质A的转化率减小了D.a>b 6.在一固定容积的密闭容器中充入2mol NO2,一定温度下建立如下平衡:2NO2(g) N2O4此时平衡混合气体中NO2的体积分数为x%;若再充入1mol N2O4,在温度不变的情况下,达到新平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是() A.x>y B.x=y C.x<y D.不能确定 7.下列事实中,不能用列夏特列原理解释的是( )A.溴水中有下列平衡:Br2+H2O HBr+HBrO当加入AgNO3溶液后溶液颜色变浅 B.对二氧化硫的品红溶液加热可使颜色变深 C.反应CO+NO2CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 D.合成氨反应N2+3H22NH3(正反应放热)中使用催化剂8.在密闭容器中进行H2(g)+Br2(g) 2HBr(g)+Q;反应达到平衡后,欲使颜色加深,应采取的措施是() A.升温B.降温C.减小容器体积D.增大容器体积 9.在体积可变的密闭容器中,反应mA(g)+nB(s)pC (g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。 下列说法中,正确的是() A.(m+n)必定小于p B.(m+n)必定大于p C.m必定小于p D.n必定大于p 10.某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g) Z(g)+W(s);△H>0,下列叙述正确的是() A.加入少量W,逆反应速率增大 B.当容器中气体压强不变时,反应达到平衡 C.升高温度,平衡逆向移动 D.平衡后加入X,上述反应的△H增大 11.一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应2SO2+O22SO3平衡时SO3为n mol,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的物质的量可能大于n的是()A.1 mol SO2+1 mol O2+1 mol SO3 B.4 mol SO2+1 mol O2 C.2 mol SO2+1 mol O2+2 mol SO3 D.2 mol SO2+1 mol O2 12.下列说法中正确的是()A.可逆反应的特征是正反应速率和逆反应速率相等B.其他条件不变时,升高温度可使化学平衡向放热反应的方向移动C.其他条件不变时,增大压强会破坏有气体存在的反应的平衡状态D.在其他条件不变时,使用催化剂可以改变化学反应速率,但不能改变化学平衡状态 13.在一定条件下,向5L密闭容器中充入2mol A气体和1mol B气体,发生可逆反应: 2A(g)+B(g) 2C(g),达到平衡时容器内B的物质的量浓度为0.1mol/L,则A的转化率为() A.67%B.50%C.25%D.5% 14.对于平衡体系:aA(g)+bB(g) cC(s)+dD(g)+Q;有下列判断,其中不正确的是()
化学平衡高考题(含答案)
化学平衡 1.(08年全国理综I ·11)已知:4NH 4(g)+5O 2(g) = 4NO(g)+6H 2O(g),ΔH=-1025kJ ·mol -1 ,该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不. 正确.. 的是C 2.(08年全国理综II ·13)在相同温度和压强下,对反应 CO 2 ( g ) + H 2 ( g ) CO(g ) + H 2O( g )进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下 表: 上述四种情况达到平衡后, n ( CO )的大小顺序是 A A .乙=丁>丙=甲 B .乙>丁>甲>丙 物质 物质的量 实验 CO 2 H 2 CO H 2O 甲 a mol a mol 0 mol 0 mol 乙 2a mol a mol 0 mol 0 mol 丙 0 mol 0 mol a mol a mol 丁 a mol 0 mol a mol a mol C . D . 1200℃ N O 含量 时间 1000℃ N O 含量 时间 1000℃ 催化剂 1000℃ 无催化剂 N O 含量 时间 10×105Pa 1×105Pa A . B . N O 含量 时间 1000℃ 1200℃
C .丁>乙>丙=甲 D .丁>丙>乙>甲 3.(08年天津理综·8)对平衡CO 2(g ) CO 2(aq ) .△H =-19.75kJ·mol - 1,为增大 二氧化碳气体在水中的溶解度,应采用的方法是D A .升温增压 B .降温减压 C .升温减压 D .降温增压 4.(08年山东理综·14)高温下,某反应达到平衡,平衡常数) H ()CO () O H ()CO (222c c c c K ??=。恒容 时,温度升高,H 2浓度减小。下列说法正确的是A A .该反应的焓变为正值 B .恒温恒容下,增大压强,H 2浓度一定减小 C .升高温度,逆反应速率减小 D .该反应的化学方程式为CO +H 2O CO 2+H 2 5.(08年宁夏理综·12)将固体NH 4I 置于密闭容器中,在一定温度下发生下列反应: ①NH 4I(s) NH 3(g)+HI(g);②2HI(g) H 2(g)+I 2(g) 达到平衡时,c (H 2)=0.5mo l ·L -1,c (H I )=4mo l ·L -1,则此温度下反应①的平衡常数为C A .9 B .16 C .20 D .25 6.(08年四川理综·8)在密闭容器中进行如下反应:H 2(g) +I 2(g) 2HI(g),在温度T 1和T 2时,产物的量与反应时 间的关系如下图所示.符合图示的正确判断是D A .T 1>T 2,ΔH >0 B .T 1>T 2,ΔH <0 C .T 1<T 2,ΔH >0 D .T 1<T 2,ΔH <0 7.(08年广东理基·36)对于反应2SO 2(g)+O 2(g) 2SO 3(g)能增大正反应速率的措施是 A .通入大量O 2 B .增大容器容积 C .移去部分SO 3 D .降低体系温度 8.(08年广东化学·8)将H 2(g)和Br 2(g)充入恒容密闭容器,恒温下发生反应H 2(g )+Br 2(g) 2HBr (g )△H <0,平衡时Br 2(g)的转化率为a ;若初始条件相同,绝热下进行上述反应,平衡时Br 2(g)的转化率为b 。a 与b 的关系是A 催化剂 高温 T 1碘化氢的量 时 间 T 2
2019年高考化学专题复习:化学平衡图像专题
化学平衡图像专题 1.对反应2A(g)+2B(g)3C(g)+D(?),下列图象的描述正确的是 A. 依据图①,若t1时升高温度,则ΔH<0 B. 依据图①,若t1时增大压强,则D是固体或液体 C. 依据图②,P1>P2 D. 依据图②,物质D是固体或液体 【答案】B 2.下列图示与对应的叙述相符的是 A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化 B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液 C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH D. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大 【答案】B 3.—定条件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往2L 恒容密闭容器中充入1 mol CO2和3 mol H2,在不同催化剂作用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是
A. a 点v(正)>v(逆) B. b点反应放热53.7 kJ C. 催化剂效果最佳的反应是③ D. c点时该反应的平衡常数K=4/3(mol-2.L-2) 【答案】A 4.如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是 A. 正反应是放热反应 B. A、B一定都是气体 C. D一定不是气体 D. C可能是气体 【答案】B 5.下图是恒温下H 2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是 A. 升高温度 B. 增大压强 C. 增大反应物浓度 D. 加入催化剂
平衡常数K专题解析
平衡常数K专题解析
平衡常数K 专题 化学平衡常数统领化学平衡移动的结果分析,堪称化学平衡的精灵,是高考试题的宠儿。纵观各地高考试题,放在一起,经过排序之后,发现很美妙的一件事情,平衡常数的不同层面像一首美妙的歌曲呈现在考试题中。 一、序曲----化学平衡常数的常规考查 1、前奏---化学平衡常数的常规计算 例1.(2014·重庆理综化学卷,T11节选)氢能是最重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。储氢可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢。 (g) +3H 2(g) 在某温度下,向恒容容器中加入环己烷,其起始浓度为amol ·L -1 ,平衡时苯的浓度为bmol ·L -1 ,该反应的平衡常数K = 解析:利用三段式解题 (g) +3H 2(g) 高温 FeSO 4/Al 2O 3 高温 FeSO 4/Al 2O 3
起始(mol/L) a 0 0 转化(mol/L) b b 3b 平衡(mol/L) a-b b 3b 化学平衡常数K= =mol3/L3; 2、小插曲---固体物质在平衡常数表达式 中处理的技巧 例2.(2014·福建理综化学卷,T24节 选)铁及其化合物与生产、生活关系密切。 已知t℃时,反应FeO(s)+CO(g)Fe(s) (g)的平衡常数K=0.25。 +CO 2 ①t℃时,反应达到平衡时n(CO):n(CO2) =。 ②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。 此时FeO(s)转化率为50%,则x =。
解析:根据反应FeO(s)+CO(g)Fe(s)+CO (g),平衡常数K为0.25,因为固体的浓度为 2 )/c(CO)=0.25,体积相同,所以反1,则k=c(CO 2 应达到平衡时n(CO):n(CO2)=4:1,若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为率为50%, FeO(s)+CO(g)Fe(s)+CO (g) 2 起始 0.02 x 0 0 变化 0.01 0.01 0.01 0.01 平衡时 0.01 x-0.01 0.01 0.01 因为温度不变,所以平衡常数K=0.25得: 0.0.1/(x-0.01)=0.25 解得x=0.05。 二、深入考查-----化学平衡常数与平衡移动因素的辩证思维
高考试题汇编化学平衡
高考试题汇编—化学反应原理 1.(2012海南?15)己知A(g) + B(g) C(g) + D(g)反应的平衡常数和温度的关系 如下: 温度/℃ 700 800 830 1000 1200 平衡常数 1.7 1.1 1.0 0.6 0.4 回答下列问题: (1)该反应的平衡常数表达式K= ,△H= 0(填“<”“>”“=”); (2) 830℃时,向一个5L 的密闭容器中充入0.20 mol 的A 和0.80mol 的B ,如 反应初始6s 内A 的平均反应速率v (A) = 0.003 mol ·L -1·s - 1,则6s 时c(A) = mol ·L - 1,C 的物质的量为 mol ;若反应经一段时间后,达到平衡时A 的转化率为 ,如果这时向该密闭容器中再充入1mol 氩气,平衡时A 的转化率为 ; (3)判断该反应是否达到平衡的依据为 (填正确选项前的字母): a .压强不随时间改变 b .体系的密度不随时间改变 c .c(A)不随时间改变 d .单位时间里生成C 和A 的物质的量相等 (4) 1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为 。 2.(2012山东?29)偏二甲肼与N 2O 4是常用的火箭推进剂,二者发生如下化学反应:(CH 3)2NNH 2(l)+2N 2O 4(1)=2CO 2(g)+3N 2(g)+4H 2O(g) (I) (1)反应(I)中氧化剂是 。 (2)火箭残骸中常现红棕色气体,原因为:N 2O 4(g)2NO 2(g) (Ⅱ) 当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。 (3)一定温度下,反应(II)的焓变为△H 。现将1molN 2O 4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 。 若在相同沮度下,上述反应改在体积为IL 的恒容密闭容器中进行,平衡常数 (填“增大” “不变”或“减小”),反应3s 后NO 2的物质的 量为0.6mol ,则0~3s 的平均反应速率v (N 2O 4)= mol·L -1·s - 1。 a 气体密度 b △H /K J ?m o l d N 2O 4转化率 c v (正) NO 2 N 2O 4
高考化学备考百强校微测试系列专题30化学平衡图像
专题30 化学平衡图像 (满分60分时间25分钟) 姓名:_______________班级:_______________得分:_______________ 1.丁烯(C4H8)是制备线性低密度聚乙烯(LLDPE)的原料之一,可由丁烷(C4H10)催化脱氢制备,C4H10(g) C4H8(g)+H2(g)△H=+123kJ/mol。该工艺过程中生成的副产物有(C)、C2H6、C2H4、C4H6等。进料比[]和温度对丁烯产率的影响如图1、图2所示。已知原料气中氢气的作用时活化固体催化剂。 下列分析正确的是 A.氢气的作用是活化固体催化剂,改变氢气量不会影响丁烯的产率 B.丁烷催化脱氢是吸热反应,丁烯的产率随温度升高而不断增大 C.随温度升高丁烯裂解生成的副产物增多,会影响丁烯的产率 D.一定温度下,控制进料比[]越小,越有利于提高丁烯的产率 【答案】C 【解析】 【详解】 A. 原料气中氢气的作用是活化固体催化剂,同时氢气也是丁烷催化脱氢的的生成物,增 大氢气的浓度,不利于该反应平衡的正向移动,由图1可知维持一定的进料比[],有利于提高丁烯的产率,当[]过大时,丁烯的产率呈下降趋势,故A分析错误; B.由图2可知,当温度高于590oC时,由于副反的发生,导致副产物增多,而丁烯的产
率是下降的, 【点睛】本题主要考查化学反应原理在化学工艺条件选择上的应用,氢气在反应中能活化固体催化剂,从而加快化学反应速率,但同时,氢气是该反应的生成物,氢气的浓度过大,不利于反应的正向进行,故要综合两方面的因素进行分析。 2.在一定温度下,将0.40 mol NO和0.20 mol CO充入一个容积为2 L的密闭容器中进行如下反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH<0,反应过程中物质的物质的量随时间的变化如图所示。下列有关叙述正确的是 A.在0~6 min内v(CO2)约为1.3×10-3mol·L-1·min-1 B.第8 min时改变的条件可能是升高温度 C.该反应在第二次达到平衡时的化学平衡常数约为3.44 L·mol-1 D.该反应在8~12 min内CO的转化率为60% 【答案】C 【解析】 【详解】
高三专题复习化学平衡图像(带答案)
化学平衡图像 1.在A(g)+B(g)=C(g)+D(g)的反应体系中,C的百分含量和时间的关系如图所示,若反应分别在400℃和100℃下进行,所得曲线分别为Q 与P,则正反应是放热反应的图为() 2.如图所示,反应2SO 2(g)+O2(g)2SO3(g);△H<0,在不同温度、不同压强(P1>P2)下达到平衡时,混合气中SO3的体积φ(SO3)随温度变化的曲线应为() 3.用来表示可逆反应:2A (g)+B(g)2C(g)(正反应放热)的正确图象是下图中的() 4.对于可逆反应:A 2(g)+3B2(g)2AB3(g)(正反应放热),下列图象中正确的是() 5.T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是()A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 B.t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动 C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1
C反应,达到平衡后,C的浓度仍为0.4 mol·L—1 D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 6.已知可逆反应aA+bB cC中,物质的含量A% 和C%随温度的变化曲线如图所示,下列说法正确的是 () A.该反应在T1、T3温度时达到过化学平衡B.该 反应在T2温度时达到过化学平衡 C.该反应的逆反应是放热反应D.升高温度,平衡会向正反应方向移动 7.右图表示反应N 2(g)+3H2(g)2NH3(g); ΔH=-92.2kJ/mol。在某段时间t0~t6中反应速率与 反应过程的曲线图,则氨的百分含量最高的一段时间 是() A.t0~t1B.t2~t3C.t3~t4 D.t5~t6 8.在一定条件下,将X和Y两种物质按不同的比例放入密闭容器中反应,平衡后测得X,Y的转化率与起始时两物质的物质的量之 比n x/n y的关系如图所示,则X,Y的反应方程式可表示 为() A.2X+Y3Z B.3X+2Y2Z C.X+3Y Z D.3X+Y Z 9.可逆反应aX(g)+bY(g)cZ(g)在一定温 度下的一密闭容器内达到平衡后,t0时改变某一外界条 件,化学反应速率(v)-时间(t)图象如右图。则下列说法中正确的是()A若a+b=c,则t0时只能是增大了容器的压强B.若a+b=c,则t0时只能是加入了催化剂 C.若a+b≠c,则t0时只能是增大了容器的压强D.若a+b≠c,则t0时只能是加入了催化剂 10.对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如右图所示,则图象中关于X、Y、Z、W四种物质的聚集状态为() A.Z、W均为气体,X、Y中有一种是气体 B.Z、W中有一种是气体,X、Y皆非气体 C.X、Y、Z、W皆非气体 D.X、Y均为气体,Z、W中有一种为气体
高中化学平衡试题详细答案
化学平衡反应试题 1.在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s)+2B(g)C(g)+D(g)已达平衡状态的是 A.混合气体的压强 B.混合气体的密度 C.气体的平均相对分子质量 D.B的物质的量浓度 【答案】A 【解析】在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,所以选项D可以说明。分解反应式可知,反应前后体积不变,所以压强和气体的物质的量都是不变的,因此A 不正确;密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量 水变化的,所以选项B可以说明;混合气的平均相对分子质量是混合气的质量和混合气的总 的物质的量的比值,物质的量不变,但质量是变化的,所以选项C也可以说明。答案选A。2.下列说法中,可以证明反应N2+3H22NH3已达到平衡状态的是 A.3v(H2) = 2v(NH3) B.3v正(H2) = 2v逆(NH3) C.3v(N2) = v(H2) D.2v正(N2) = v逆(NH3) 【答案】D 【解析】在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。所以如果反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,则就能说明反应已经达到平衡 状态,因此根据方程式可知,选项D正确。 3.一定温度下的恒容容器中,发生反应A(s)+2B(g)=当C(g)+D(g),下列能表示该反应已达平衡状态的是 (B)正=V(D)逆 B.混合气体的密度保持不变 C.气体总物质的量不随时间变化而变化 D.混合气体的压强不随时间变化而变化 【答案】B 【解析】在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。A中反应速率的方向相反,但 不满足速率之比是相应的化学计量数之比,不正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,所以B正确;根据方程式可知,反应前 后体积是不变的,所以气体的物质的量和压强都是不变的,因此CD不正确,答案选B。4.在一定条件下,可逆反应X(g)+3Y(g)2Z(g)达到平衡时有50%的Y转化为气体Z,若X的转化率为25%,则起始时充入容器的X与Y的物质的量之比应为() A. 3:2 B. 2:3 C. 1:3 D. 1:2 【答案】B 【解析】设起始时充入容器的X与Y的物质的量分别是x和y,则根据方程式可知︰=1︰3,解得x︰y=2︰3,答案选B。 5.一定条件下,对于可逆反应X(g)+3Y(g)2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是() A.c1∶c2=3∶1 B.平衡时,Y和Z的生成速率之比为2∶3
高考化学化学平衡常数知识点总结
2019年高考化学化学平衡常数知识点总结 1、化学平衡常数 (1)化学平衡常数的数学表达式 (2)化学平衡常数表示的意义 平衡常数数值的大小可以反映可逆反应进行的程度大小,K 值越大,反应进行越完全,反应物转化率越高,反之则越低。 2、有关化学平衡的基本计算 (1)物质浓度的变化关系 反应物:平衡浓度=起始浓度-转化浓度 生成物:平衡浓度=起始浓度+转化浓度 其中,各物质的转化浓度之比等于它们在化学方程式中物质的计量数之比。 (2)反应的转化率(α):α= ×100% (3)在密闭容器中有气体参加的可逆反应,在计算时经常用到阿伏加德罗定律的两个推论: 恒温、恒容时:恒温、恒压时:n1/n2=V1/V2 (4)计算模式 浓度(或物质的量) aA(g)+bB(g) cC(g)+dD(g) 起始 m n O O 转化 ax bx cx dx 平衡 m-ax n-bx cx dx α(A)=(ax/m)×100%
ω(C)= ×100% (3)化学平衡计算的关键是准确掌握相关的基本概念及它们相互之间的关系。化学平衡的计算步骤,通常是先写出有关的化学方程式,列出反应起始时或平衡时有关物质的浓度或物质的量,然后再通过相关的转换,分别求出其他物质的浓度或物质的量和转化率。概括为:建立解题模式、确立平衡状态方程。说明: ①反应起始时,反应物和生成物可能同时存在; ②由于起始浓度是人为控制的,故不同的物质起始浓度不一定是化学计量数比,若反应物起始浓度呈现计量数比,则隐含反应物转化率相等,且平衡时反应物的浓度成计量数比的条件。 ③起始浓度,平衡浓度不一定呈现计量数比,但物质之间是按计量数反应和生成的,故各物质的浓度变化一定成计量数比,这是计算的关键。
高三化学考前复习教案:专题 化学反应速率及化学平衡
专题十八化学反应速率及化学平衡(两课时) 【考试说明】 1、了解平均反应速率的定义及其定量表示方法。 2、了解温度、浓度、压强和催化剂影响化学反应速率一般规律。 3、认识催化剂在生产、生活和科学研究领域中的重大作用。 4、了解化学反应的可逆性,能用焓变和熵变说明常见简单化学反应的方向。 5、理解化学平衡和平衡常数的含义,能利用化学平衡常数计算反应物的转化率。 6、理解浓度,压强、温度、催化剂对化学平衡影响的一般规律。 7、了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用 【要点精讲】 要点一、化学反应速率的概念及有关计算 1、概念: 2、计算公式:3、单位: 4、注意点:(1)固体或纯液体(不是溶液)的浓度可视为不变的常数,故一般不用固体或纯液体表示化学反应速率,同一化学反应的速率可以用不同物质的浓度变化来表示,其数值不一定相同,但表示的意义相同。其速率数值之比等于方程式中化学计量数之比。 (2)化学反应速率均用正值表示。 (3)所研究的反应速率一般指平均速率,不是瞬时速率。 【典例1】将4mol A气体和2mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g)2C(g)。若经2s后测得C的浓度为0.6 mol·L—1,现有下列几种说法: 1用物质A表示的反应平均速率为0.3mol·L—1·s—122 s时物质B的浓度为0.7 mol·L—13用物质B表示的反应的平均速率为0.6 mol·L—1·s—142 s时物质A的转化率为70%,其中正确的是() A.12B.14C.23D.34 【典例2】反应A(气)+3B(气)2C(气)+2D(气)在四种不同情况下的反应速率分别如
