第9章 化学动力学基本原理习题解答
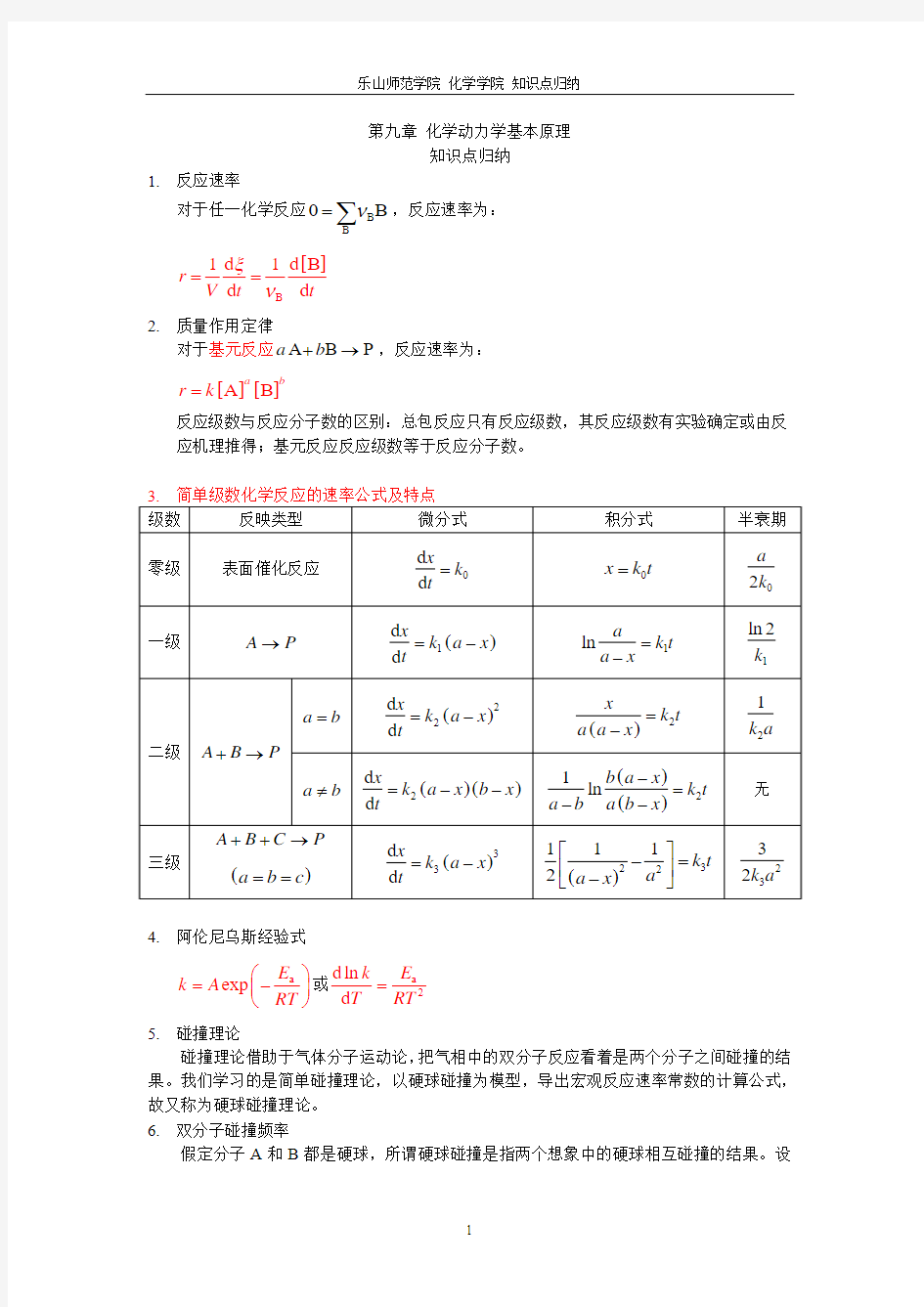

第九章 化学动力学基本原理
知识点归纳
1. 反应速率
对于任一化学反应B
B
0B ν
=
∑,反应速率为:
[]
B 1d 1d B d d r V t t
ξν==
2. 质量作用定律
对于基元反应A B P a b +→,反应速率为:
[][]A B a b
r k =
反应级数与反应分子数的区别:总包反应只有反应级数,其反应级数有实验确定或由反应机理推得;基元反应反应级数等于反应分子数。
4. 阿伦尼乌斯经验式
a exp E k A RT ??=- ???
或a 2d ln d E k
T RT = 5. 碰撞理论
碰撞理论借助于气体分子运动论,把气相中的双分子反应看着是两个分子之间碰撞的结果。我们学习的是简单碰撞理论,以硬球碰撞为模型,导出宏观反应速率常数的计算公式,故又称为硬球碰撞理论。 6. 双分子碰撞频率
假定分子A 和B 都是硬球,所谓硬球碰撞是指两个想象中的硬球相互碰撞的结果。设
单位体积中A 、B 分子数分别为
A N V 、
B N
V
,A 、B 分子的直径分别为A d 和B d ,当分子碰撞时,分子中心的最小距离为A B AB 2d d d +=
,并令A B
A B
M M M M μ=+,μ为摩尔折合质量,A M 、B M 分别为A 、B 的摩尔质量。
再把单位体积中的分子数换算为物质的量的浓度,即[]A 1A N V L =
?,[]B 1
B N V L
=?,在单位时间单位体积内A 、B 分子碰撞的总数(即碰撞频率)为:
][]
2
AB AB A B Z d L π=
若体系中只有一种分子,则相同分子的碰撞频率为:
]2
2
AA AA 2A Z d L π=
7. 有效碰撞分数
c
exp E
q RT ??=- ???
8. 简单碰撞理论计算双分子反应速率常数
(
)2
c sct AB E k T
d RT π??
=- ???
9. 实验活化能
根据实验活化能的定义:()
2
a d ln d k T E RT T
=
将反应速率常数代入得:2
c 2a c 2
1
21E E RT T R E RT T ??=+
??=+? 10. 过渡态理论计算速率常数
化学反应要经过一个由反应物分子以一定的构型存在的过渡态,反应物与过渡态之间存在化学平衡,总反应的速率由过渡态转化为产物的速率决定。该理论提供了一种计算反应速率常数的方法,只要知道分子的某些物性即可计算k 。
(1) 用统计热力学方法处理的过渡态理论计算速率常数
0B
B B
exp E k T f k h
f RT ≠??
=- ???
∏ (2) 过渡态理论的热力学处理方法:
()1B r m r m exp exp n
k T S H k c h R RT ≠≠-??????=- ? ?????
实验活化能:a 0r m E E nRT H nRT ≠=+=?+
11. 单分子反应理论
单分子反应是经过相同分子间的碰撞而得到活化态,获得足够能量的活化分子并不立即分解,它需要一个分子内部能量的传递过程,以便把能量集中到要破裂的键上去,因此在碰撞之后与进行反应之间出现一段停滞时间,此时,活化分子可能进行反应,也可能消活化而再变成普通分子。在浓度不是很稀的情况下,这种活化与消活化之间有一个平衡存在,如果活化分子分解或转化为产物的速率比消活化作用缓慢,则上述平衡基本上可认为不受影响。
作业解答
习题2 某物质按一级反应进行计算。已知反应完成40%需时50min,试求:(1)以s 为单位的速率常数;(2)完成80%反应所需时间。
解:(1) 141
1111ln
ln s 1.710 s 1506010.4k t
x ---??===? ?-?-??
(2) 341111ln ln s 9.4710 s 1 1.71010.80t k x -??=
==? ?-?-??
习题4 N 2O 5在25℃时分解反应的半衰期为5.70h ,且与N 2O 5初始压力无关。试求此反
应在25℃条件下完成90%所需时间。
解:t 1/2与起始压力无关,所以是一级反应:
1/2111
ln ln 18.9 h 1ln 210.90
t t k x =
==-- 习题7 一级反应C 6H 5N 2Cl 在水溶液中分解按下式进行: C 6H 5N 2Cl(aq)→C 6H 5Cl(aq)+N 2(g)
在反应过程中,用量气管测量所放出的N 2的体积。假设t 时刻体积为V ,t =∞时体积为V ∞。试证明速率常数为
1
ln V k t V V
∞∞=-
证:
6526520 C H N Cl(aq)C H Cl(aq)+N (g)0 0 0 t c t t c V t →===∞ V ∞
当t =∞时,反应物完全分解,故: 0c V ∞∝,或0'c k V ∞=('k 为比例系数)
c V V ∞∝-,或()'c k V V ∞=-
对于一级反应:
()0'111
ln ln ln 'c k V V k t c t k V V t V V
∞∞∞∞===--
习题14 氰酸铵在水溶液中转化为尿素的反应为
422NH OCN CO(NH )→
测得如下数据:
试确定反应级数。
解:根据不同反应级数半衰期的特点可知,一级反应的半衰期与起始浓度无关,零级反应的半衰期与起始浓度成正比;二级反应的半衰期与起始浓度成反比。从题给数据看出,半衰期随起始浓度的增加而减少,则一定不是一级或零级反应,现在只要验证1/21/t a ∝,计算结果如下:
1/2 37.03:19.15:9.454:2:1t =
1111/
::4:2:10.050.100.20
a = 所以为二级反应。 或用公式:()
()
1/21/2ln /'1ln /'t t n a a =-
()
()ln 19.15/37.031 1.952ln 0.1/0.05n =-
=≈
()
()
ln 9.45/37.031 1.992ln 0.20/0.05n =-
=≈
习题19 已知某反应活化能1a 80kJ mol E -=?,试求(1)由20℃变到30℃;由100℃变到110℃,其速率常数各增大了多少倍?
解:由阿累尼乌斯公式a exp E k A RT ??
=-
???
得:
()a 212
112
exp
E T T k k RTT -= 代入数据得: (1)
()3a 212112801010
exp exp 2.968.314293303E T T k k RTT -??===?? (2)
()3a 212112
801010exp exp 1.968.314373383E T T k k RTT -??===?? 计算表明低温时速率常数对温度更敏感。
习题24 在水溶液中,2-硝基丙烷与碱作用为二级反应。其速率常数与温度的关系为:
()1313163
lg /mol dm min 11.9/K
k T --??=-
试求反应的活化能,并求当两种反应物的初始浓度均为3
3
8.010mol dm --??,10℃反应
的半衰期为多少?
解:将题给公式与[]()
a
lg / 2.303E k k B RT
=-比较,可得:
311a 3163 2.3038.31460.5610J mol 60.56kJ mol E --=??=??=?
在10℃时,[]()
3163
lg /11.900.7233283
k k =-=
()131283K 5.288mol dm min k --=??
1/23
01123.64min 5.288810t kc -=
==?? 习题27 在300K 条件下将1 g N 2及1 g H 2在体积为1.00dm 3的容器中混合。已知N 2和H 2分子的碰撞直径分别为10
3.510
m -?及102.510m -?,试求此容器中每秒内两种分子的碰
撞次数。
解:根据碰撞理论,N 2与和H 2分子之间碰撞次数为:
()()()()()()
1/2
2
2222AB
22H N H N 1182H N N N Z RT M M V V
σσπ??
??+??=+?? ? ? ?????????
其中
()()()222532H H 3.0110m H N m L
V M V -==?
()()()222532N N 2.1510m N N m L
V M V
-==? 代入数值得:
()2
1/2
10332525
35313231
2.5
3.510118 3.148.314300*********.0110 2.15103.410m s 3.410dm s AB
Z -------??+?????=?????+?? ???????????
????=??=?? 1.00dm 3的容器中每秒内的碰撞次数为32
3.410?
习题30 有两个级数相同的反应其活化能数值相同,但二者的活化熵相差60.00
11J mol K --??时比较二反应在300K 时的速率常数之比。
解:根据过渡态理论公式:
()1
B exp exp k T S H k c h R RT -≠≠??????=- ? ?????
3
12(1)(2)60.00exp exp 1.36108.314k S S k R ≠≠???-?===? ???
乐山师范学院化学学院其它习题
化学反应原理综合练习题
化学反应原理综合练习题 一、选择题 1.下列说法正确的是() A.反应热是指反应过程中放出的热量 B.1molH2SO4和1molBa(OH)2完全中和所放出的热量为中和热 C.相同条件下将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多D.物质发生化学变化都伴随着能量变化 2、用铂电极电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是() A、稀NaOH溶液 B、HCl溶液 C、NaCl溶液 D、酸性AgNO 3 3、用惰性电极电解下列溶液一段时间后,再加入一定量的某中纯净物(括号内物质),可使溶液恢复到原来的成分和浓度的是() A、AgNO3 (AgNO3) B、NaOH (NaOH) C、KCl (HCl) D、CuSO4 (Cu(OH)2) 4.已知31g红磷(P,固体)在氧气中燃烧生成P4O10固体放出738.5kJ热量,31g白磷(P4,固体)在氧气中燃烧生成P4O10固体放出745.8kJ热量。下列判断正确的是() A白磷在氧气中燃烧的热化学方程式P4(s)+5O2(g)=P4O10(s)△H=-745.8kJ·mol-1 B.红磷转化成白磷时放出热量 C.红磷比白磷稳定 D.31g红磷中蕴含的能量为738.5kJ 5.增大压强,对已达到平衡的下列反应产生的影响是()3X(g)+Y(g) 2Z(g)+2Q(s) A.正反应速率增大,逆反应速率减小,平衡向正反应方向移动 B.正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 C.正、逆反应速率都增大,平衡向正反应方向移动 D.正、逆反应速率都没有变化,平衡不发生移动 6.在稀氨水中存在平衡:NH3·H2O NH4++OH-,要使用NH3·H2O和NH4+的浓度都增大,应采取的措施是( ) A.加NaOH溶液B.加NH4Cl固体C.加盐酸D.加NaCl溶液7.在密闭容器中,反应SO2+NO2NO+SO3(气),达到平衡后,若往容器中通入少量O2,此时将将会发生的变化是() A.容器内压强增大,平衡向正反应方向移动
化学动力学基础(一、二)习题
化学动力学基础(一、二)习题
化学动力学基础(一、二)习题 一、选择题: 1、某反应的速率常数k=0.0462分-1,又知初始浓度为0.1mol.dm-3,则该反应的半衰期为: (A) 1/(6.93×10-2×0.12) (B) 15分(C) 30分(D) 1/(4.62×102×0.1)分 答案:(B) 2、某一级反应, 当反应物的浓度降为起始浓度的1%时,需要t1秒, 若将反应物的浓度提高一倍, 加快反应速率, 当反应物浓度降低为起始浓度的1%时, 需时为t2, 则: (A ) t1﹥t2(B) t1=t2 (C) t1﹤t2(D) 不能确定二者关系 答案:(B) 3、某反应物反应掉7/8所需的时间恰好是它反应掉1/2所需时间的3倍, 则该反应的级数是: (A) 零级(B) 一级反应(C) 三级反应(D) 二级反应 答案:(B )
4、反应A→B(Ⅰ);A→D(Ⅱ), 已知反应Ⅰ的活化能E1大于反应Ⅱ的活化能E2, 以下措施中哪一种不能改变获得B和D的比例: (A)提高反应温度(B) 降低反应温度 (C) 延长反应时间(D) 加入适当的催化剂 答案:C 5、由基元步骤构成的复杂反应:2A→2B+C A+C→2D,以C物质的浓度变化表示反应速率的速率方程(已知:-dC A/dt=K A1C A2-K A2C B2C c+K A3C A C C ) 则 (A)dC c/dt=K A1C A2-K A2C B2C c+K A3C A C C (B)dC c/dt=1/2K A1C A2-1/2K A2C B2C c+1/2K A3C A C C (C)dC c/dt=2K A1C A2-2K A2C B2C c+2K A3C A C C (D)dC D/dt=-K A3C A C C 答案:(B) 6、反应Ⅰ, 反应物初始浓度C0’, 半衰期t1/2’, 速率常数K1, 反应Ⅱ, 反应物初始浓度C0”, 半衰期t1/2”, 速率常数K2,
南京大学《物理化学》练习 第十章 化学动力学基础(一)
第十章化学动力学基础(一) 返回上一页 1. 298 K时N2O5(g)分解反应半衰期t1/2为5.7 h,此值与N2O5的起始浓度无关,试求: (1) 该反应的速率常数. (2) 作用完成90%时所须的时间. 2. 某人工放射性元素放出α粒子,半衰期为15 min ,试问该试样有80%分解,需时若干? 3. 把一定量的PH3(g)迅速引入温度为950 K的已抽空的容器中,待反应物达到该温度时开始计时(此时已有部分分解),测得实验数据如下: t/s 0 58 108 ∞ P/kPa 35.00 36.34 36.68 36.85 已知反应 4pH3(g) P4(g) + 6H2(g) 为一级反应,求该反应的速率常数k值(设在t=∞时反应基本完成) 4. 在某化学反应中随时检测物质A的含量,1小时后,发现A已作用了75%,试问2小时后A还剩余多少没有作用?若该反应对A 来说是: (1) 一级反应. (2) 二级反应(设A与另一反应物B起始浓度相同) (3) 零级反应(求A作用完所用时间) 5. 在298 K时, NaOH与CH3COOCH3皂化作用的速率常数k2与NaOH与CH3COOC2H5皂化作用的速率常数k2' 的关系为k2=2.8k2' .试问在相同的实验条件下,当有90% CH3COOCH3被分解时, CH3COOC2H5的分解百分数为若干?
6. 对反应2NO(g) +2H2(g)---> N2(g) +2H2O(l) 进行了研究,起始时NO与H2的物质的量相等.采用不同的起始压力相应的有不同的半衰期,实验数据为: p0 /kPa 47.20 45.40 38.40 33.46 26.93 t1/2/min 81 102 140 180 224 求该反应级数为若干? 7. 反应A+B P的动力学实验数据如下, [A]0/(mol·dm-3) 1.0 2.0 3.0 1.0 1.0 [B]0/(mol·dm-3) 1.0 1.0 1.0 2.0 3.0 r0/(mol·dm-3·s-1) 0.15 0.30 0.45 0.15 0.15 若该反应的速率方程为 ,求x和y的值. 8. 碳的放射性同位素在自然界树木中的分布基本保持为总碳量的 1.10×%.某考古队在一山洞中发现一些古代木头燃烧的灰烬,经分析的含 量为总碳量的9.87×%,已知的半衰期为5700年,试计算这灰距今约有多少年? 9. 某抗菌素在人体血液中呈现简单级数的反应,如果给病人在上午8点注射一针抗菌素,然后在不同时刻t测定抗菌素在血液中的浓度c(以mg/100 cm3表示),得到以下数据 t/h 4 8 12 16 c /(mg/100 cm3) 0.480 0.326 0.222 0.151 (1) 确定反应的级数. (2) 求反应的速率常数k和半衰期t1/2.
宁波高考化学专题题库∶化学反应原理的综合题
宁波高考化学专题题库∶化学反应原理的综合题 一、化学反应原理 1.为了证明化学反应有一定的限度,进行了如下探究活动: 步骤1:取8mL0.11mol L -?的KI 溶液于试管,滴加0.11mol L -?的FeCl 3溶液5~6滴,振荡; 请写出步骤1中发生的离子反应方程式:_________________ 步骤2:在上述试管中加入2mLCCl 4,充分振荡、静置; 步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加0.11mol L -?的KSCN 溶液5~6滴,振荡,未见溶液呈血红色。 探究的目的是通过检验Fe 3+,来验证是否有Fe 3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想: 猜想一:KI 溶液过量,Fe 3+完全转化为Fe 2+,溶液无Fe 3+ 猜想二:Fe 3+大部分转化为Fe 2+,使生成Fe (SCN )3浓度极小,肉眼无法观察其颜色为了验证猜想,在查阅资料后,获得下列信息: 信息一:乙醚比水轻且微溶于水,Fe (SCN )3在乙醚中的溶解度比在水中大。 信息二:Fe 3+可与46[()]Fe CN - 反应生成蓝色沉淀,用K 4[Fe (CN )6]溶液检验Fe 3+的灵敏度比用KSCN 更高。 结合新信息,请你完成以下实验:各取少许步骤2静置分层后的上层水溶液于试管A 、B 中,请将相关的实验操作、预期现象和结论填入下表空白处: 【答案】322222Fe I Fe I +-++=+ 若液体分层,上层液体呈血红色。 则“猜想一”不成立 在试管B 中滴加5-6滴K 4[Fe (CN )6]溶液,振荡 【解析】 【分析】 【详解】 (1) KI 溶液与FeCl 3溶液离子反应方程式322222Fe I Fe I +-++=+; (2)①由信息信息一可得:取萃取后的上层清液滴加2-3滴K 4[Fe (CN )6]溶液,产生蓝色沉淀,由信息二可得:往探究活动III 溶液中加入乙醚,充分振荡,乙醚层呈血红色,
物理化学第8章化学动力学习题答案
第8章 化学动力学 习题 1. 请根据质量作用定律写出下列基元反应的反应速率表示式(试用各种物质分别表示)。 (1)P B A k 2?→?+ (2)2A+B P k 2?→? (3)S P B A 22+→+ (4)M Cl M Cl +→+22 解: (1)B A P B A c kc dt dc dt dc dt dc ==-=-21,(2)B A P B A c kc dt dc dt dc dt dc 2 2121==-=-, (3)22121B A S P B A c kc dt dc dt dc dt dc dt dc ===-=-,(4)M 2Cl Cl Cl c kc dt dc dt dc 212==-。 2. 某气相反应的速率表示式分别用浓度和压力表示时为n A c c c k =γ和n A p p p k =γ,试求 k c 与k p 之间的关系,设气体为理想气体。 解:因为 p A =c B R T =c A R T , n A n p n A c c RT k c k )(=,则 n p c RT k k )(= 3. 298K 时N 2O 5(g)分解反应其半衰期2/1t 为5.7h ,此值与N 2O 5的起始浓度无关,试求: (1)该反应的速率常数。(2)作用完成90%时所需时间。 解:根据题意判断该分解反应为一级反应,因此可求得 (1)12/11216.07 .52 ln 2ln -===h t k ,(2)h k x t 94.181216 .09.011 ln 11ln =-=-= 4. 某人工放射性元素放出α粒子,半衰期为15min ,试问该试样有80%分解,需时若干? 解:根据题意判断该放射反应为一级反应,因此可求得 (1)12/1min 04621.015 2 ln 2ln -===t k ,(2)min 83.3404621 .08.011 ln 11ln =-=-=k x t 。 5. 把一定量的PH 3(g)迅速引入温度为950K 的已抽空的容器中,待反应物达到该温度时开始计时(此时已有部分分解),测得实验数据如下:
结构化学试题及答案
兰州化学化学化工学院 结构化学试卷及参考答案 2002级试卷A —————————————————————————————————————— 说明: 1. 试卷页号 5 , 答题前请核对. 2. 题目中的物理量采用惯用的符号,不再一一注明. 3. 可能有用的物理常数和词头: h Planck常数J·s=×10-123N=×10mol -31m=×10 电子质量kg e-34 0-9-12, n: 10 p : 10 词头:—————————————————————————————————————— 一.选择答案,以工整的字体填入题号前[ ]内。(25个小题,共50分) 注意:不要在题中打√号,以免因打√位置不确切而导致误判 [ ] 1. 在光电效应实验中,光电子动能与入射光的哪种物理量呈线形关系:A .波长 B. 频率 C. 振幅 [ ] 2. 在通常情况下,如果两个算符不可对易,意味着相应的两种物理量A.不能同时精确测定 B.可以同时精确测定 C.只有量纲不同的两种物理量才不能同时精确测定 Yθφ)图,[ ] 3. (θφ的变化A.即电子云角度分布图,反映电子云的角度部分随空间方位,θφ的变化,反映原子轨道的角度部分随空间方位即波函数角度分布图,B. C. 即原子轨道的界面图,代表原子轨道的形状和位相 [ ] 4. 为了写出原子光谱项,必须首先区分电子组态是由等价电子还是非等价电子形成的。试判断下列哪种组态是等价组态: 21111 C. 2p2s2s2p B. 1sA.-2-,何者具有最大的顺磁性 , OO , O[ ] 5. 对于222-2- C.O A. B.OO222[] 6. 苯胺虽然不是平面型分子,但-NH与苯环之间仍有一定程度的共轭。据2此判断 A.苯胺的碱性比氨弱 B.苯胺的碱性比氨强 C.苯胺的碱性与氨相同 -的分子轨道与N相似:] 7. 利用以下哪一原理,可以判定CO、CN[2 A.轨
2020年高考化学综合题分类练习卷:化学反应原理练习卷
2019年高考化学综合题分类练习卷:化学反应原理练习卷
化学反应原理练习卷 1.党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM 2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。 (1)汽车尾气中含有NO 和CO气体,可利用催化剂对CO、NO进行催化转化反应: 2CO(g) +2NO(g) N2(g) +2CO2(g) △H ①已知下列热化学方程式:N2(g) +O2(g) =2NO(g) △H1 = + 180.5kJ/mol,2C(s) +O2(g) =2CO(g) △H2=-2210kJ/mol ,C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol,则△H=_________。 ②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2 L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动 (填“向左”“向右”或“不”)。 (2)在相同温度下,两个体积均为1L 的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编 号起始物质的量 /mol 平衡物质的量 /mol N O C O N CO 2 CO2 I 0.2 0.2 0 0 a II 0.3 0.3 b 0.1 0.2 ①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。 ②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K 为________。 (3)汽车使用乙醇汽油并不能破少NO x的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO 催化转化进行研究。测得NO 转化为N 2的转化率随温度CO 混存量的变化情况如图所示。 ①在n(NO)/n(CO) =1条件下,最佳温度应控制在_______左右。 ②若不使用CO,温度超过775 K,发现NO的分解率降低,
化学动力学基础试题
第十章 化学动力学基础(一) 思考题: 1. (1) 反应级数等于反应分子数; (2) 某化学反应式为A +B=C 乙则该反应为双分子反应。你认为(1)和(2)是否正确? 2.有一平行反应 ,已知E 1>E 2,若B 是所需要的产品,从动力学的角度 定性他考虑应采用怎样的反应温度。 3.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温度有利于生成更多的产物,这句话对吗? 4.判断正确与否:一个化学反应进行完全所需的时间是半衰期的2倍。 5.阿仑尼乌斯经验式的适用条伴是什么?实验活化能E a 对于基元反应和复杂反应含义有何不同? 选择题: 1.质量作用定律表达式不适用于( )。 (A )以分子数表示的速率方程式 (B )以浓度表示的速率方程式 (C )以压力表示的速率方程式 (D )以表面覆盖度表示的速率方程式 2.关于反应分子数的表述不正确的是( )。 (A )反应分子数是实验值 (B )反应分子数不一定和测得的反应级数相等 (C )某反应的反应分子数一定等于该反应的反应物化学计量数之和 (D )实际的反应中双分子反应发生的几率大于单分子反应和三分子反应 3.下列说法正确的是( )。 (A )双分子反应一定表现为二级反应 (B )单分子反应一定表现为一级反应 (C )有反应分子数可言的反应一定是基元反应 (D )反应分子数不一定为正整数 4.某一反应在有限时间内可反应完全,所需时间为c 0/k ,该反应级数为: (A) 零级 ; (B) 一级 ; (C) 二级 ; (D) 三级 5. 有如下简单反应 a A + b B →dD ,已知a < b < d ,则速率常数k A 、k B 、k D 的关系为: (A) d k b k a k D B A << (B) k A < k B < k D (C) k A > k B > k D (D) d k b k a k D B A >> 6.对基元反应的以下说法中不正确的是( )。 (A )只有基元反应才有反应分子数可言 C B A 1 2
(完整word版)第4章化学动力学基础习题及全解答.doc
第四章 化学动力学基础 1. 某基元反应 A+2B k 2P ,试分别用各种物质随时间的变化率表示反应的速率方程式。 dc(A) 1 dc( B) 1 dc(P ) 解 : r dt 2 dt 2 dt 2. 对反应 A —→ P ,当反应物反应掉 3 所需时间是它反应掉 1 所需时间的 3 倍,该反应是 4 2 几级反应?请用计算式说明。 解: 设为 a 初始浓度, x 为 t 时刻的产物浓度 t 3 4 3 3 x 4 t t 1 2 1 2 对于零级反应 k 0 2 ln 1 3 t 3 4 1 4 2 t 1 2 1 a ln 1 1 t ln x 1 对于一级反应 k 1 a 2 1 1 1 t 对于二级反应 k 2 a x a 或者:先假设此反应为二级反应,则有: 1 1 3 t 3 4 1 4 3 t 1 2 1 1 1 1 2 1 1 1 1 t 1 3 C 1 kt 1/ 4C 0 kt kC 0 C 0 C 0 1 1 1 1 t 2 1 C 2 kt 1/ 2C 0 kt kC 0 C 0 C 0 t 1 3t 2 答:该反应是二级反应。 3. 试证明一级反应的转化率分别达 50%、75%和 87.5%,所需时间分别是 t 1 / 2 、2 t 1 / 2 、3 t 1/ 2 。 证:设为 y 转化率 t 1 ln 1 ln 2 t 1 2 对于一级反应 k 2 1 y k 1 t 1 ln 1 ln 2 t 当 y=50%时 k 2 1 50% k 1 1 2 t 1 ln 1 1 2ln 2 2t 1 2 当 y=75%时 k 2 75% k 1
化学反应原理期末试题含答案复习课程
化学反应原理期末试 题含答案
化学反应原理期末试题含答案 1.下列有关说法正确的是() A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的ΔH<0 B.NH3(g)+HCl(g))=NH4Cl(s)室温下能自发进行,说明该反应的ΔH<0 C.N2(g)+3H2(g) 2NH3(g)ΔH<0,其他条件不变时升高温度,反应速率v(H2)和氢气的平衡转化率均增大 D.水的离子积常数K w随着温度的升高而增大,说明水的电离是放热反应2.下列说法正确的是 A.将纯水加热至较高温度,K w变大、pH变小、呈酸性 B.常温下,将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 C.向0.1 mol·L-1醋酸溶液中加入少量冰醋酸,溶液的pH减小,醋酸电离程度变大 D.等体积、pH都为3的酸HA和HB分别与足量的Zn反应,HA放出的 H2多, 说明HA的酸性小于HB 3. 分析下列硫燃烧时的能量变化图,判断有关热 化学方程式和说法正确的是( ) A.S(s,单斜)+O2(g)===SO2(g) ΔH=+297.16 kJ·mol-1 B.S(s,正交)===S(s,单斜) ΔH=-0.33 kJ·mol-1 C.S(s,正交)+O2(g)===SO2(g) ΔH=-296.83 kJ·mol-1 D.单斜硫的稳定性大于正交硫的稳定性 4. 在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断中正确的是( ) A.10 min时,改变的外界条件可能是减小压强 B.0~5 min内,v(H2)=0.1 mol·(L·min)-1 C.恒温下,缩小容器体积,平衡后c(H2)减小 D.12 min时,反应达平衡时,气体的平均摩尔质量不
结构化学题库
结构化学题库及答案 一选择性 晶体结构 1. 金刚石属立方晶系,每个晶胞所包括的C原子个数为下列哪个数(B) A. 4 B.8 C.12 D.16 2. 在CsCl 型晶体中, 正离子的配位数是(B) A.6 B.8 C.10 D.12 3. 对于NaCl 晶体的晶胞体中所含的粒子, 下列哪种说法是正确的(D) A. 一个Na+和一个Cl- B.二个Na+和二个CI- C.三个Na+和三个Cl- D.四个Na+和四个CI- 4. 已知NaCl 晶体属于立方面心点阵式, 故其晶胞中喊有的结构基元数为(C) A.1 B.2 C.4 D.8 5. 在晶体中不会出现下列哪种旋转轴(D) A.2 次轴 B.3 次轴 C.4 次轴 D.5 次轴 6. 对于立方晶系的特征对称元素的定义,下列说法正确的是( A) (A) 四个三次轴(B)三个四次轴(C)六次轴(D)六个二次轴 7. 石墨晶体中层与层之间的结合是靠下列哪一种作用?( D) (A) 金属键(B)共价键(C)配位键(D)分子间力 8. 在晶体中,与坐标轴c 垂直的晶面,其晶面指标是下列哪一个?(A) (A)(001) (B) (010) (C)(100)(D)(111) 9. 用Bragg方程处理晶体对X射线的衍射问题,可将其看成下列的那种现象? ( A) (A)晶面的反射(B)晶体的折射(C)电子的散射(D)晶体的吸收 10. Laue 法可研究物质在什么状态下的结构?( A) (A)固体(B)液体(C)气体(D)等离子体 11. 某元素单质的晶体结构属于A1 型面心立方结构,则该晶体的晶胞有多少个原子?( D) (A) 一个原子 (B)两个原子(C)三个原子(D)四个原子 12. 在下列各种晶体中,含有简单的独立分子的晶体是下列的哪种?( C) (A)原子晶体(B)离子晶体 (C)分子晶体(D)金属晶体 13. X 射线衍射的方法是研究晶体微观结构的有效方法,其主要原因是由于下列的哪种?( C) (A)X射线的粒子不带电(B) X射线可使物质电离而便于检测 (C) X 射线的波长和晶体点阵面间距大致相当 (D) X 射线的穿透能力强
化学反应原理综合试题解题策略
题型1 化学反应原理综合试题解题策略 角度1化学能与热能、电能的相互转化综合判断与计算[题型解读]化学能与热能、电能的相互转化是高考的必考热点内容。试题形式常与能量图像,电化学装置图为背景进行综合考查,一般难度中档。 近几年高考的命题角度主要有①根据能量图像判断焓变ΔH;②结合盖斯定律进行ΔH计算或书写热化学方程式;③结合背景材料或装置图示进行原电池原理、电解原理的问题分析;④书写一定背景下的电极反应式;⑤一定条件的电化学计算等。预测2016年高考命题不会超出上述命题角度,特别是盖斯定律的应用和一定背景的电极反应式的书写仍会是命题的热点。 (1)(2015·菏泽一模)(3分)甲醇是重要的可再生燃料。已知在常温常压下: 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g)ΔH=-1 275.6 kJ/mol 2CO(g)+O2(g)===2CO2(g)ΔH=-566.0 kJ/mol H2O(g)===H2O(l)ΔH=-44.0 kJ/mol 则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________________________________________________。 (2)(2015·泰安二模)(19分)氧化还原反应与生产、生活、科技密切相关。请回答下列问题: ①银制器皿日久表面变黑是因为表面生成了Ag2S的缘故,该现象属于________腐蚀。如果加入一定浓度硝酸将发生反应3Ag2S+8HNO3===6AgNO3+3S↓+2NO↑+4H2O,
同时Ag 与硝酸反应生成AgNO 3、NO 、H 2O ,当生成22.4 mL 的气体时,参加反应硝酸的物质的量为________。 图1 ②在如图1所示的原电池装置中,负极的电极反应为_________________________,H +的移动方向为________;电池总反应方程式为________________________,当电路中转移0.1 mol e -时,交换膜左侧溶液中离子减少的物质的量为________。 图2 ③电解NO 制备NH 4NO 3原理如图2所示,接电源正极的电极为________(填X 或Y),X 电极反应式为________________________________,为使电解产物完全转化为NH 4NO 3,需要补充的物质A 的化学式为________。 【信息提取】 (2)①n (HNO 3)∶n (NO)=8∶2――――――――――→n ?NO ?=0.001 mol n (HNO 3)=0.004 mol ; ②右侧通Cl 2――→得电子右端为正极;左端电极反应为Ag -e -+Cl -===AgCl ;右侧溶液 增加Cl -,H +向右侧溶液移动; ③NO →NH +4 ――→得电子X 为阴极,NO →NO -3――→失电子Y 为阳极。 【标准答案】 (1)CH 3OH(l)+O 2(g)===CO(g)+2H 2O(l) ΔH =-442.8 kJ/mol(3分) (2)①化学(2分) 0.004 mol 或4×10-3mol(3分) ②Ag -e -+Cl -===AgCl(2分) 向右(2分) 2Ag +Cl 2===2AgCl(2分) 0.2 mol(2分) ③Y(2分) NO +6H ++5e -===NH +4+H 2O(2分) NH 3或NH 3· H 2O(2分) 【评分细则】 (1)化学计量数与ΔH 不一致不给分,不注明状态不给分,ΔH 的符号,单位错的不给分。 (2)①只填“化学”才得分,其他不给分;无单位的不给分。 ②写成Ag -e -===Ag +不给分,写成2Ag -2e -+2Cl -===2AgCl 的给分,0.2 mol 漏掉单位的不给分。
天津大学版物理化学 第11章化学动力学习题答案
物化习题参考答案 第十一章 化学动力学 11.1,11.3, 11.5, 11.6, 11.9, 11.17, 11.26, 11.46, 11.47 11.1解:根据k 的单位知该反应为一级反应 1ln 1kt α =- 51exp()1exp( 2.2105400)0.112αkt -=--=--创= 11.3解: 2 21111ln 111ln 1αα-=-t t min 4.195.011ln 3.011ln min 1011ln 11ln 1212=??? ??--=???? ?? --=αα t t 11.5解: 32 ln )875.01ln(2/18/7=--=t t 7118002 /18/7=-=c c t t 11.6解: (g)N (g)H C (g)NNCH CH 26233+→-- 0=t k P a 332 .210=p 0 0 t t = p p p -0 p p -0 总总; =p p p p p p -=-0022 恒容时:kt p p =0ln kt p p p =-总002ln 1-500s 1079.6732 .22332.212332.21ln s 100012ln 1-?=-?=-=总p p p t k s 1002.12ln 42/1?== k t
11.9解: 1:139.0U U:235238= -110235-110238a 1072.9)U (;a 10520.1)U (--?=?=k k 设20亿年前为23502380:c c ,有t k c c t k c c U)(ln U)(ln 23523523502382382380==及 解得:1:272350 2380=c c 11.17解: s 2,kPa 325.1011,21 1,0==t p ; s 20,kPa 133.102,212,0==t p 题给条件表明:0211p t ∝;反应为2级 -611012 11 4.9310Pa s 101.325kPa 2s k p t --= ==醋′ 11.26解: (g)COOCl 2(g)ClCOOCCl 23→-- 0=t 0p 0 t t = p )(20p p - ∞=t 0 02p p =∞ 总总总; =p p p p p p p p p p p -=-=-=-+∞0002222 恒容时:p p 0ln kt p p p =-=∞∞总2/ln 1-4s 1078.5710 .2008.42/008.4ln 51s 71)280(-?=-= ℃k 1-3s 1084.2838.2554.32/554.3ln 20s 31)305(-?=-=℃k 11 21221a mol kJ 169)/ln(-?=-= T T k k T RT E 11.46解:22Cl H 3H Cl 2HCl d d c c k c c k t c ??+= 以稳态近似法处理: 022 d d M 2Cl 4Cl H 3H Cl 2M Cl 1Cl 222=-+-=????c c k c c k c c k c c k t c
最新结构化学练习题带答案
结构化学复习题 一、选择填空题 第一章量子力学基础知识 1.实物微粒和光一样,既有性,又有性,这种性质称为性。 2.光的微粒性由实验证实,电子波动性由实验证实。 3.电子具有波动性,其波长与下列哪种电磁波同数量级? (A)X射线(B)紫外线(C)可见光(D)红外线 4.电子自旋的假设是被下列何人的实验证明的? (A)Zeeman (B)Gouy (C)Stark (D)Stern-Gerlach 5.如果f和g是算符,则 (f+g)(f-g)等于下列的哪一个? (A)f2-g2; (B)f2-g2-fg+gf; (C)f2+g2; (D)(f-g)(f+g) 6.在能量的本征态下,下列哪种说法是正确的? (A)只有能量有确定值;(B)所有力学量都有确定值; (C)动量一定有确定值;(D)几个力学量可同时有确定值; 7.试将指数函数e±ix表示成三角函数的形式------ 8.微观粒子的任何一个状态都可以用来描述;表示粒子出现的概率密度。 9.Planck常数h的值为下列的哪一个? (A)1.38×10-30J/s (B)1.38×10-16J/s (C)6.02×10-27J·s (D)6.62×10-34J·s 10.一维势箱中粒子的零点能是 答案: 1.略. 2.略. 3.A 4.D 5.B 6.D 7.略 8.略 9.D 10.略 第二章原子的结构性质 1.用来表示核外某电子的运动状态的下列各组量子数(n, 1, m, m s)中,哪一组是合理的? (A)2,1,-1,-1/2;(B)0,0,0,1/2;(C)3,1,2,1/2;(D)2,1,0,0。 2.若氢原子中的电子处于主量子数n=100的能级上,其能量是下列的哪一个: (A)13.6Ev; (B)13.6/10000eV; (C)-13.6/100eV; (D)-13.6/10000eV; 3.氢原子的p x状态,其磁量子数为下列的哪一个? (A)m=+1; (B)m=-1; (C)|m|=1; (D)m=0; 4.若将N原子的基电子组态写成1s22s22p x22p y1违背了下列哪一条? (A)Pauli原理;(B)Hund规则;(C)对称性一致的原则;(D)Bohr理论 5.B原子的基态为1s22s2p1,其光谱项为下列的哪一个? (A) 2P;(B)1S; (C)2D; (D)3P; 6.p2组态的光谱基项是下列的哪一个? (A)3F;(B)1D ;(C)3P;(D)1S; 7.p电子的角动量大小为下列的哪一个?
第三章化学动力学基础课后习题参考答案
1 第三章化学动力学基础课后习题参考答案 2解:(1)设速率方程为 代入数据后得: 2.8×10-5=k ×(0.002)a (0.001)b ① 1.1×10-4=k ×(0.004)a (0.001)b ② 5.6×10-5=k ×(0.002)a (0.002)b ③ 由②÷①得: 2a =4 a=2 由③÷①得: 2b =2 b=1 (2)k=7.0×103(mol/L)-2·s -1 速率方程为 (3)r=7×103×(0.0030)2×0.0015=9.45×10-5(mol ·L -1·s -1) 3解:设速率方程为 代入数据后得: 7.5×10-7=k ×(1.00×10-4)a (1.00×10-4)b ① 3.0×10-6=k ×(2.00×10-4)a (2.00×10-4)b ② 6.0×10-6=k ×(2.00×10-4)a (4.00×10-4)b ③ 由③÷②得 2=2b b=1 ②÷①得 22=2a ×21 a=1 k=75(mol -1·L ·s -1) r=75×5.00×10-5×2.00×10-5=7.5×10-8(mol ·L -1·s -1) 5解:由 得 ∴△Ea=113.78(kJ/mol ) 由RT E a e k k -=0得:9592314.81078.11301046.5498.03?=?==??e ke k RT E a 9解:由阿累尼乌斯公式:RT E k k a 101ln ln -=和RT E k k a 202ln ln -=相比得: ∴ 即加催化剂后,反应速率提高了3.4×1017倍 因△r H θm =Ea(正) -Ea(逆) Ea(逆)=Ea(正)-△r H θm =140+164.1=304.1(kJ/mol) 10解:由)11(ln 2 112T T R Ea k k -=得: )16001(314.8102621010.61000.1ln 2 384T -?=??-- T 2=698(K ) 由反应速率系数k 的单位s-1可推出,反应的总级数为1,则其速率方程为 r=kc(C 4H 8) 对于一级反应,在600K 下的)(1014.110 10.6693.0693.0781s k t ?=?== - ) ()(2O c NO kc r b a =)()(107223O c NO c r ?=) ()(355I CH c N H C kc r b a =)11(ln 2112T T R E k k a -=)627 15921(314.8498.081.1ln -=a E ) /(75.41046.5656314.81078.113903s mol L e e k k RT E a ?=??==??--36.40298314.810)140240(ln 32112=??-=-=RT E E k k a a 1712104.3ln ?=k k
化学反应原理综合测试题(供参考)
2017--2018学年度高二第一学期期末考试 化学试题 说明: 1.本试卷分第I卷(1—4页)和第II卷(5—8页),全卷满分100分,考试时间90分钟。 2.可能用到的相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Fe 56 Cu 64 第I卷(选择题共48分) 单项选择题:包括16小题,每小题3分,共计48分。每小题只有一个 ....选项符合题意。 1.下列说法正确的是 A.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同 B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的能量多 C.在加热条件下发生的反应均为吸热反应 D.物质发生化学反应时不一定都伴随着能量变化 2.关于中和热的测定实验,下列说法正确的是 A.为了使反应充分,可以向酸(碱)中分次加入碱(酸) B.为了使反应进行的更完全,可以使酸或碱适当过量 C.中和热为一定值,实验结果与所用酸(碱)的用量和种类均无关 D.用铜丝代替玻璃棒搅拌,会使中和热测定值偏大 3.稀氨水中存在着下列平衡:NH 3? H2O NH4++OH- ,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入适量的物质是(忽略溶解热) ①NH4C1 固体②硫酸③NaOH 固体④水⑤加热 A.仅①②③⑤ B. 仅③⑤ C. 仅③ D. 仅①③ 4.下列叙述正确的是 ①原电池是把化学能转化成电能的一种装置 ②原电池的正极发生氧化反应,负极发生还原反应 ③不能自发进行的氧化还原反应,通过原电池的装置均可实现 ④碳棒不能用来作原电池的正极 ⑤反应Cu+2Ag+=2Ag+Cu2+,能以原电池的形式来实现 A.①⑤B.①④⑤C.②③④D.②⑤ 5.下列化学方程式中,不正确的是 A.甲烷的燃烧热△H =-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
结构化学 第三章习题及答案
习题 1. CO 是一个极性较小的分子还是极性较大的分子?其偶极矩的方向如何?为什么? 2. 下列AB型分子:N2,NO,O2,C2,F2,CN,CO,XeF中,哪几个是得电子变为AB–后比原来中性分子键能大?哪几个是失电子变为AB+ 后比原来中性分子键能大? 3. 按分子轨道理论说明Cl2的键比Cl2+ 的键强还是弱?为什么? 4. 下列分子中,键能比其正离子的键能小的是____________________ 。键能比其负离子的键能小的是________________________ 。 O2,NO,CN,C2,F2 5. 比较下列各对分子和离子的键能大小: N2,N2+( ) O2,O2+( ) OF,OF–( ) CF,CF+( ) Cl2,Cl2+( ) 6. 写出O2+,O2,O2–和O22–的键级、键长长短次序及磁性。 7. 按分子轨道理论写出NF,NF+ 和NF–基态时的电子组态,说明它们的键级、不成对电子数和磁性。 8. 判断NO 和CO 哪一个的第一电离能小,原因是什么? 9. HF分子以何种键结合?写出这个键的完全波函数。 10.试用分子轨道理论讨论SO分子的电子结构,说明基态时有几个不成对电子。 11.下列AB型分子:N2,NO,O2,C2,F2,CN,CO,XeF中,哪几个是得电子变为AB–后比原来中性分子键能大?哪几个是失电子变为AB+ 后比原来中性分子键能大? 12.OH分子于1964年在星际空间被发现。 (a)试按分子轨道理论只用O原子的2 p轨道和H原子的1 s轨道叠加,写出其电子组态。 (b)在哪个分子轨道中有不成对电子? (c)此轨道是由O和H的原子轨道叠加形成,还是基本上定域于某个原子上? (d)已知OH的第一电离能为13.2eV,HF的第一电离能为16.05eV,它们的差值几乎与O原子和F原子的第一电离能(15.8eV和18.6eV)的差值相同,为什么? (e)写出它的基态光谱项。 13.试写出在价键理论中描述H2运动状态的、符合Pauli 原理的波函数,并区分其单态和三重态。
第十一章化学动力学基础1练习题
第十一章 化学动力学基础(1)练习题 一、判断题: 1.在同一反应中各物质的变化速率相同。 2.若化学反应由一系列基元反应组成,则该反应的速率是各基元反应速率的代数和。 3.单分子反应一定是基元反应。 4.双分子反应一定是基元反应。 5.零级反应的反应速率不随反应物浓度变化而变化。 6.若一个化学反应是一级反应,则该反应的速率与反应物浓度的一次方成正比。 7.一个化学反应进行完全所需的时间是半衰期的2倍。 8.一个化学反应的级数越大,其反应速率也越大。 9.若反应 A + B Y + Z 的速率方程为:r =kc A c B ,则该反应是二级反应,且肯定不 是双分子反应。 10. 下列说法是否正确: (1) H 2+I 2=2HI 是2 分子反应;(2) 单分子反应都是一级反应,双分子反应都是二级反应。; (3) 反应级数是整数的为简单反应 (4) 反应级数是分数的为复杂反应。 11.对于一般服从阿累尼乌斯方程的化学反应,温度越高,反应速率越快,因此升高温 度有利于生成更多的产物。 12.若反应(1)的活化能为E 1,反应(2)的活化能为E 2,且E 1 > E 2,则在同一温度下k 1一 定小于k 2。 13.若某化学反应的Δr U m < 0,则该化学反应的活化能小于零。 14.对平衡反应A Y ,在一定温度下反应达平衡时,正逆反应速率常数相等。 15.平行反应C B A 21?→??→?k k ┤,k 1/k 2的比值不随温度的变化而变化。 16.复杂反应的速率取决于其中最慢的一步。 17.反应物分子的能量高于产物分子的能量,则此反应就不需要活化能。 18.温度升高。正、逆反应速度都会增大,因此平衡常数也不随温度而改变。 二、单选题: 1.反应3O 2 2O 3,其速率方程 -d[O 2]/d t = k [O 3]2[O 2] 或 d[O 3]/d t = k '[O 3]2[O 2],那 么k 与k '的关系是: (A) 2k = 3k ' ; (B) k = k ' ; (C) 3k = 2k ' ; (D) ?k = ?k ' 。 2.有如下简单反应 a A + b B dD ,已知a < b < d ,则速率常数k A 、k B 、k D 的关系为: (A) d k b k a k D B A << ; (B) k A < k B < k D ; (C) k A > k B > k D ; (D) d k b k a k D B A >> 。 3.关于反应速率r ,表达不正确的是: (A) 与体系的大小无关而与浓度大小有关 ; (B) 与各物质浓度标度选择有关 ; (C) 可为正值也可为负值 ; (D) 与反应方程式写法无关 。 4.进行反应A + 2D 3G 在298K 及2dm 3容器中进行,若某时刻反应进度随时间变 化率为0.3 mol·s -1,则此时G 的生成速率为(单位:mol·dm -3·s -1) : (A) 0.15 ; (B) 0.9 ; (C) 0.45 ; (D) 0.2 。 5.基元反应体系a A + d D g G 的速率表达式中,不正确的是: (A) -d[A]/d t = k A [A]a [D]d ; (B) -d[D]/d t = k D [A]a [D]d ; (C) d[G]/d t = k G [G]g ; (D) d[G]/d t = k G [A]a [D]d 。 6.某一反应在有限时间内可反应完全,所需时间为c 0/k ,该反应级数为: (A) 零级 ; (B) 一级 ; (C) 二级 ; (D) 三级 。 7.某一基元反应,2A(g) + B(g) E(g),将2mol 的A 与1mol 的B 放入1升容器中混 合并反应,那么反应物消耗一半时的反应速率与反应起始速率间的比值是:
