离子交换分离纯化蛋白原理总结

离子交换分离纯化蛋白原理及应用
离子交换剂
基质主要有树脂、纤维素、葡聚糖凝胶、聚丙烯酰胺凝胶和硅胶(HPLC)等
离子交换树脂一般只适合分离小分子物质如氨基酸等,不适合分离蛋白质等大分子物质,一方面是因为大分子不易进入树脂紧密交联结构的内部,另一方面因为交联聚苯乙烯骨架疏水性很强,用于蛋白质分离时,会出现疏水性的不可逆吸附。此外,离子交换树脂的机械强度较差,而且树脂的体积常随着溶剂离子强度的变化发生溶胀和收缩。
根据交换基团的电荷性质进行分类:
阳离子交换树脂:强酸型含磺酸基团 (R-SO3H)
中等酸型含磷酸基团 (-O-PO2H4)
弱酸型含酚基、羧基
阴离子交换树脂:强碱含季胺基团 [-N+(CH3)3]
弱碱含叔胺、伯胺基团[-N(CH3)2
阴离子交换树脂对化学试剂及热都不如阳离子交换树脂稳定。
弱酸型—只能在碱性pH范围内使用弱碱型—只能在酸性pH范围内使用
离子交换纤维素的种类很多,可分为阴离子交换纤维素和阳离子交换纤维素两大类。由于这些材料是纤维状的,大部分活性基团分布在表面,所以,适合于分离蛋白质等生物大分子。阴离子交换纤维素—DEAE-纤维素,具二乙胺乙基,阳离子交换纤维素—CM-纤维素,具有羧甲基,分别是应用得最广泛的阴离子交换纤维素和阳离子交换纤维素。另外,根据纤维素颗粒的物理结构不同,可分为“纤维型”和“微晶型”两大类。“微晶型”因颗粒细、比重大,能制成紧密的柱,交换容量大,分辨率高。
离子交换凝胶:离子交换葡聚糖凝胶和聚丙烯酰胺凝胶具有许多优点,分离大分子物质,不会引起被分离物质的变性戒失活,非特异性吸附很低;交换容量大(为离子交换纤维素的3-4 倍);容易制成微球型,因此装柱和层析时的流速都较易控制。它的缺点是随着洗脱液的离子强度和pH 的变化,床体积变化大,明显影响流速;另外,由于它的凝胶性质,有时会把大分子物质排阻在网络结构之外。如:葡聚糖(Sephadex)、聚丙烯酰胺(PAG)、琼脂糖(Sepharose)
平衡缓冲液:它的离子强度和pH的选择首先要保证各个待分离物质如蛋白质的稳定。其次是要使各个待分离物质与离子交换剂有适当的结合。
增强洗脱液与离子交换剂的结合力,降低分离物与离子交换剂的结合力
洗脱缓冲液:在离子交换层析中一般常用梯度洗脱,通常有改变离子强度和改变pH两种方式。改变离子强度通常是在洗脱过程中逐步增大离子强度,从而使与离子交换剂结合的各个组分被洗脱下来;而改变pH的洗脱,对于阳离子交换剂一般是pH从低到高洗脱,阴离子交换剂一般是pH从高到低。由于pH可能对蛋白的稳定性有较大的影响,故一般通常采用改变离子强度的梯度洗脱。
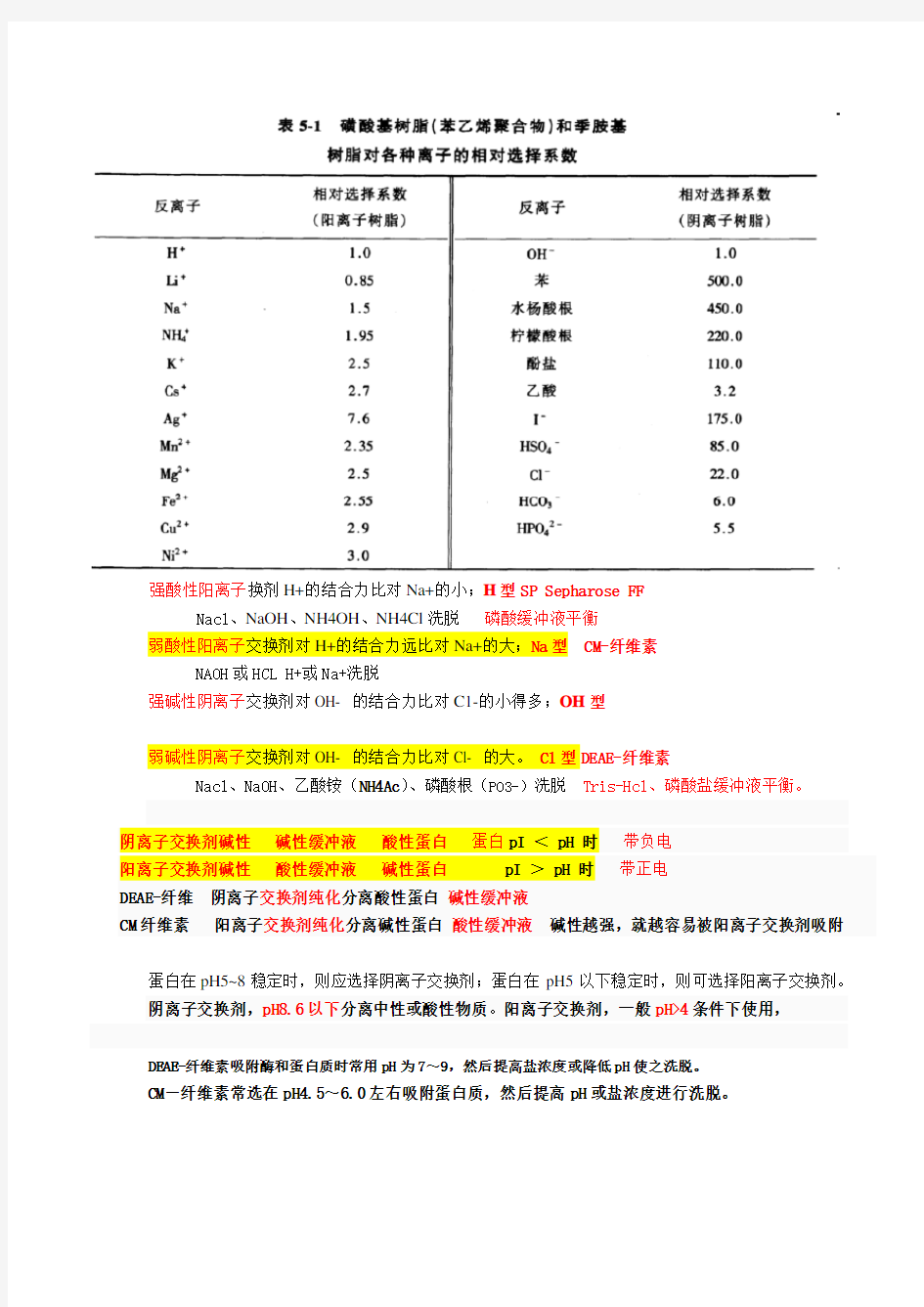
强酸性阳离子换剂H+的结合力比对Na+的小;H型SP Sepharose FF
Nacl、NaOH、NH4OH、NH4Cl洗脱磷酸缓冲液平衡
弱酸性阳离子交换剂对H+的结合力远比对Na+的大;Na型CM-纤维素
NAOH或HCL H+或Na+洗脱
强碱性阴离子交换剂对OH- 的结合力比对C1-的小得多;OH型
弱碱性阴离子交换剂对OH- 的结合力比对Cl- 的大。Cl型DEAE-纤维素
Nacl、NaOH、乙酸铵(NH4Ac)、磷酸根(PO3-)洗脱Tris-Hcl、磷酸盐缓冲液平衡。
阴离子交换剂碱性碱性缓冲液酸性蛋白蛋白pI < pH 时带负电
阳离子交换剂碱性酸性缓冲液碱性蛋白pI > pH 时带正电
DEAE-纤维阴离子交换剂纯化分离酸性蛋白碱性缓冲液
CM纤维素阳离子交换剂纯化分离碱性蛋白酸性缓冲液碱性越强,就越容易被阳离子交换剂吸附
蛋白在pH5~8稳定时,则应选择阴离子交换剂;蛋白在pH5以下稳定时,则可选择阳离子交换剂。
阴离子交换剂,pH8.6以下分离中性或酸性物质。阳离子交换剂,一般pH>4条件下使用,
DEAE-纤维素吸附酶和蛋白质时常用pH为7~9,然后提高盐浓度或降低pH使之洗脱。
CM-纤维素常选在pH4.5~6.0左右吸附蛋白质,然后提高pH或盐浓度进行洗脱。
例:
用离子交换,那首先就要考虑是要阳离子还是阴离子,还有就是你的目的物的PH值
蛋白质是pI=6.27 阴离子交换,用pH8.0-9.0的缓冲液
首先利用缓冲液PH值把目的蛋白给结合到柱子上,然后用合适的盐离子洗脱下来。
阴离子交换柱:上样缓冲液20mM Tris-HCl,用0—0.5M NaCl梯度洗脱,流速约2ml/min。
注意:首先是蛋白的等电点是多少选择pH值,挂柱时pH尽量不要超过pI值的2个点。Nacl的浓度可以设梯度,平衡时用0.1mol之后可以选择0.3 0.6 1.2mol的浓度,一般0.6 或1.2就可以洗脱下目的峰。然后蛋白上柱变性了是洗不下来的,只能用1mol NaOH或8 mol脲洗,再生柱子,还有些脂质洗不下来,需要用30%异丙醇洗柱再生。
蛋白质分离纯化的步骤
蛋白质分离纯化的一般程序可分为以下几个步骤: (一)材料的预处理及细胞破碎 分离提纯某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性。所以要采用适当的方法将组织和细胞破碎。常用的破碎组织细胞的方法有: 1. 机械破碎法 这种方法是利用机械力的剪切作用,使细胞破碎。常用设备有,高速组织捣碎机、匀浆器、研钵等。 2. 渗透破碎法 这种方法是在低渗条件使细胞溶胀而破碎。 3. 反复冻融法 生物组织经冻结后,细胞内液结冰膨胀而使细胞胀破。这种方法简单方便,但要注意那些对温度变化敏感的蛋白质不宜采用此法。 4. 超声波法 使用超声波震荡器使细胞膜上所受张力不均而使细胞破碎。 5. 酶法 如用溶菌酶破坏微生物细胞等。 (二)蛋白质的抽提 通常选择适当的缓冲液溶剂把蛋白质提取出来。抽提所用缓冲液的pH、离子强度、组成成分等条件的选择应根据欲制备的蛋白质的性质而定。如膜蛋白的抽提,抽提缓冲液中一般要加入表面活性剂(十二烷基磺酸钠、tritonX-100 等),使膜结构破坏,利于蛋白质与膜分离。在抽提过程中,应注意温度,避免剧烈搅拌等,以防止蛋白质的变性。(三)蛋白质粗制品的获得选用适当的方法将所要的蛋白质与其它杂蛋白分离开来。比较方便的有效方法是根据蛋白质溶解度的差异进行的分离。常用的有下列几种方法: 1.等电点沉淀法不同蛋白质的等电点不同,可用等电点沉淀法使它们相互分离。 2.盐析法 不同蛋白质盐析所需要的盐饱和度不同,所以可通过调节盐浓度将目的蛋白沉淀析出。被盐析沉淀下来的蛋白质仍保持其天然性质,并能再度溶解而不变性。 3.有机溶剂沉淀法 中性有机溶剂如乙醇、丙酮,它们的介电常数比水低。能使大多数球状蛋白质在水溶液中的溶解度降低,进而从溶液中沉淀出来,因此可用来沉淀蛋白质。此外,有机溶剂会破坏蛋白质表面的水化层,促使蛋白质分子变得不稳定而析出。由于有机溶剂会使蛋白质变性,使用该法时,要注意在低温下操作,选择合适的有机溶剂浓度。 (四)样品的进一步分离纯化
蛋白纯化离子交换层析
蛋白纯化离子交换层析 离子交换层析技术是以离子交换剂为固定相,常见的离子交换剂是由一类不溶于水的惰性高分子聚合物基质,通过共价键结合某种电荷基团,形成带电基质,带异性电荷的平衡离子能够通过静电力作用结合在电荷基质上,而平衡离子能够与样品流动相中的离子基团发生可逆交换而吸附在交换剂上,不同带电荷蛋白间结合吸附固定相的能力不同。离子交换技术就是根据蛋白质样品间带电性质的差别而进行分离的一种层析方法。 常见的离子交换剂有离子交换纤维素、离子交换树脂和离子交换葡聚糖凝胶。根据与高分子聚合物基质共价结合的电荷基团的性质不同,可以将离子交换剂分为阳离子交换剂和阴离子交换剂,在阳离子交换剂中,带正电荷的平衡离子能够和流动相中带正电荷的离子基团进行交换。例如DEAE纤维素阳离子交换剂,当纤维素交换剂分子上结合阳离子基团二乙氨乙基(DEAE)时,形成阳离子纤维素—O—C6 H14N+H,可与带负电荷的蛋白质进行结合,交换阴离子。 根据与高分子聚合物基质共价结合的电荷基团的解离度不同,又可以分为强酸型、中等酸型、弱酸型三类阳离子交换剂,强酸型离子交换剂在较大的pH范围内电荷基团完全解离,而弱酸型只能在较小的pH范围内完全解离,如结合羧甲基的离子交换剂在pH小于6时就失去了交换能力。 强酸型阳离子交换剂一般结合的基团有:磺酸甲基、磺酸乙基;中等酸型阳离子交换剂有:磷酸基团和亚磷酸基团;弱酸型离子交换剂有:酚羟基和羧基类; 在阴离子交换剂中,带负电荷的平衡离子能与流动相中带负电的离子基团进行交换,例如阴离子交换剂CM纤维素,当纤维素交换剂分子上结合羧甲基(CM)时,形成带有负电荷的阴离子(纤维素-O-CH2-COO一),可与带正电荷蛋白质结合,交换阳离子。 根据与高分子聚合物基质共价结合的电荷基团的解离度不同,可分为强碱型、中等碱型、弱碱型阴离子交换剂。一般结合季胺基团基质的交换剂为强碱型离子交换剂,结合叔胺、仲胺、伯胺等为中等或者弱碱型离子交换剂。 蛋白质是两性电解质,当溶液的pH值与蛋白质等电点相同时,蛋白质的静电荷为0,当溶液pH值大于蛋白质等电点时,羧基电离,蛋白质带负电荷,蛋白质能够被阴离子交换剂所吸附,相反,当溶液的pH值小于蛋白质等电点时,则氨基电离,蛋白质带正电荷,被阳离子交换剂所吸附,溶液的pH值距蛋白质等电点越远,蛋白质带电荷越多,与交换剂的结合程度也越强,反之则越弱。 当溶液的pH值发生改变时,蛋白质与交换剂的吸附作用也发生变化,因此可以通过改变洗脱液的pH值来改变蛋白对交换剂的吸附能力,从而把不同的蛋白质逐个分离,当pH值增高时,抑制蛋白质阳离子化,随之对阳离子交换剂的吸附力减弱,当pH值降低时,抑制蛋白质阴离子化,随之降低蛋白质对阴离子交换剂的吸附。 另外,无机盐离子(如NaCl)对交换剂也具有交换吸附的能力,当洗脱液中的离子强度增加时,无机盐离子和蛋白质竞争吸附交换剂。当Cl-的浓度大时,蛋白质不容易被吸附,吸附后也易于被洗脱,当Cl-浓度小时,蛋白质易被吸附,吸附后也不容易被洗脱。 因此,洗脱阴离子交换剂结合的蛋白时,则降低pH值,增加盐离子浓度;洗脱阳离子交换剂结合蛋白时,则升高溶液pH值,增加盐离子浓度,能够洗脱交换剂上的结合蛋白。
蛋白纯化层析柱
蛋白纯化层析 从个人学术性实验室到大型的医药制造企业,小型或者大规模的蛋白纯化通常都需要几种类型的液相色谱仪。这些相关的大部分技术已应用了多年,但是新型柱料的发展为这些利用蛋白物理和化学特性进行分离的,经过时间考验的方法注入了新的力量。其中最值得提到的就是凝胶过滤层析技术(gel filtration,GF),离子交换层析技术(ion exchange,IEX),羟基磷灰石层析(hydroxyapatite,HAP)和疏水作用层析(hydrophobic interaction,HI),以及亲和层析和高效液相色谱方法(high-performance liquid chromatography,HPLC)。 对于一个初接触蛋白纯化的新手而言,从哪儿下手也许是令人头疼的一件事,但是幸运的是目前这些流程都已经逐步系统化了。GE Healthcare(原Amersham Biosciences)的技术顾问Andrew Mitchell 解释道,通常利用液相色谱技术进行蛋白纯化有三步: 捕获——从细胞其它成份,比如DNA和RNA中分离需要的蛋白; 区分——从与目的蛋白具有相近的大小,或者相似的物理/化学特征的污染物中分离蛋白; 修饰——使分离得到的样品处于可使用状态。 这每一个纯化的步骤都有特定的色谱层析技术和最佳的beads大小。第一步捕获步骤,也就是从细胞裂解物粗成份中分离蛋白,这需要一个具有高容量和高流量(flow rate)的填料。bead大小比较大,范围比较宽(比较于bead大小平均值)的“fast flow”填料比较理想,
这种填料也有利于防止目标蛋白被水解——因为速度比较快。 第二步则对分辨率要求更高,需要更好的从混合物中分离需要的成份。通常bead的大小与分辨率成反比,因此在这一部中比较小的bead 比较合适。吸附性的技术,比如离子交换IEX和疏水作用HI通常被用在纯化的这前两个步骤,而凝胶过滤则会留到了最后的修饰那一步,用于小体积,高浓度的样品。另外要注意,进行凝胶过滤层析时,样品的体积应该保持在柱床体积的1%到4%。 选择柱料的时候有两个因素要考虑到,针对目的蛋白的选择性和有效性——这些可以由洗脱峰的宽度来说明。其中选择性主要是指填料与目的蛋白相互作用以及结合的能力,IEX和HI层析方法就是指目标分子与筛分介质之间的相互作用,而GF的选择性依赖于填料的分馏范围(fractionation range)。 柱料的有效性则是指层析介质洗脱样品得到显著层析峰的能力,Mitchell表示,“如果你的峰值不集中,比较宽,那么即使是选择性很好,分辨率仍然会被消弱”。bead越大,洗脱峰就越不集中,柱子的有效性就越低。纯化洗脱相近的蛋白需要高效性,高选择性和高效性的结合就会得到高分辨率。 凝胶过滤层析(gel filtration chromatography) 凝胶过滤法(gel filtration)也称为排阻层析(exclusion chromatography)、凝胶层析(gel chromatography)或分子筛层析(molecular sieve chromatofraphy),它是在1960年后发展出来的技术。
离子交换柱层析原理
离子交换层析介质的应用 离子交换层析分离纯化生物大分子的过程,主要是利用各种分子的可离解性、离子的净电荷、表面电荷分布的电性差异而进行选择分离的。现已成为分离纯化生化制品、蛋白质、多肽等物质中使用最频繁的纯化技术之一。 子交换层析(Ion Exchange Chromatography 简称为IEC)是以离子交换剂为固定相,依据流动相中的组分离子与交换剂上的平衡离子进行可逆交换时的结合力大小的差别而进行分离的一种层析方法。离子交换层析是目前生物化学领域中常用的一种层析方法,广泛的应用于各种生化物质如氨基酸、蛋白、糖类、核苷酸等的分离纯化。 1.离子交换层析的基本原理: 离子交换层析是通过带电的溶质分子与离子交换层析介质中可交换离子进行交换而达到分离纯化的方法,也可以认为是蛋白质分子中带电的氨基酸与带相反电荷的介质的骨架相互作用而达到分离纯化的方法。 离子交换层析法主要依赖电荷间的相互作用,利用带电分子中电荷的微小差异而进行分离,具有较高的分离容量。几乎所有的生物大分子都是极性的,都可使其带电,所以离子交换层析法已广泛用于生物大分子的分离、中等纯化及精制的各个步骤中。 由于离子交换层析法分辨率高,工作容量大,并容易操作,因此它不但在医药、化工、食品等领域成为独立的操作单元,也已成为蛋白质、多肽、核酸及大部分发酵产物分离纯化的一种重要的方法。目前,在生化分离中约有75%的工艺采用离子交换层析法。 2.离子交换层析介质: 离子交换层析的固定相是离子交换剂,它是由一类不溶于水的惰性高分子聚合物基质通过一定的化学反应共价结合上某种电荷基团形成的。离子交换剂可以分为三部分:高分子聚合物基质、电荷基团和平衡离子。电荷基团与高分子聚合物共价结合,形成一个带电的可进行离子交换的基团。平衡离子是结合于电荷基团上的相反离子,它能与溶液中其它的离子基团发生可逆的交换反应。平衡离子带正电的离子交换剂能与带正电的离子基团发生交换作用,称为阳离子交换剂;平衡离子带负电的离子交换剂与带负电的离子基团发生交换作用,称为阴离子交换剂。在一定条件下,溶液中的某种离子基团可以把平衡离子置换出来,并通过电荷基团结合到固定相上,而平衡离子则进入流动相,这就是离子交换层析的基本置换反应。通过在不同条件下的多次置换反应,就可以对溶液中不同的离子基团进行分离。下面以阴离子交换剂为例简单介绍离子交换层析的基本分离过程。 阴离子交换剂的电荷基团带正电,装柱平衡后,与缓冲溶液中的带负电的平衡离子结合。待分离溶液中可能有正电基团、负电基团和中性基团。加样后,负电基团可以与平衡离子进行可逆的置换反应,而结合到离子交换剂上。而正电基团和中性基团则不能与离子交换剂结合,随流动相流出而被去除。通过选择合适的洗脱方式和洗脱液,如增加离子强度的梯度洗脱。随着洗脱液离子强度的增加,洗脱液中的离子可
蛋白质纯化的方法选择
蛋白质纯化的方法选择 随着分子生物学的发展,越来越多的科研人员熟练掌握了分子生物学的各种试验技术,并研制成套试剂盒,使基因克隆表达变得越来越容易。但分子生物学的上游工作往往并非是最终目的,分子克隆与表达的关键是要拿到纯的表达产物,以研究其生物学作用,或者大量生产出可用于疾病治疗的生物制品。相对与上游工作来说,分子克隆的下游工作显得更难,蛋白纯化工作非常复杂,除了要保证纯度外,蛋白产品还必须保持其生物学活性。纯化工艺必须能够每次都能产生相同数量和质量的蛋白,重复性良好。这就要求应用适应性非常强的方法而不是用能得到纯蛋白的最好方法去纯化蛋白。在实验室条件下的好方法却可能在大规模生产应用中失败,因为后者要求规模化,且在每日的应用中要有很好的重复性。本文综述了蛋白质纯化的基本原则和各种蛋白纯化技术的原理、优点及局限性,以期对蛋白纯化的方法选择及整体方案的制定提供一定的指导。 1、蛋白纯化的一般原则 蛋白纯化要利用不同蛋白间内在的相似性与差异,利用各种蛋白间的相似性来除去非蛋白物质的污染,而利用各蛋白质的差异将目的蛋白从其他蛋白中纯化出来。每种蛋白间的大小、形状、电荷、疏水性、溶解度和生物学活性都会有差异,利用这些差异可将蛋白从混合物如大肠杆菌裂解物中提取出来得到重组蛋白。蛋白的纯化大致分为粗分离阶段和精细纯化阶段二个阶段。粗分离阶段主要将目的蛋白和其他细胞成分如DNA、RNA等分开,由于此时样本体积大、成分杂,要求所用的树脂高容量、高流速,颗粒大、粒径分布宽.并可以迅速将蛋白与污染物分开,防止目的蛋白被降解。精细纯化阶段则需要更高的分辨率,此阶段是要把目的蛋白与那些大小及理化性质接近的蛋白区分开来,要用更小的树脂颗粒以提高分辨率,常用离子交换柱和疏水柱,应用时要综合考虑树脂的选择性和柱效两个因素。选择性树脂与目的蛋白结合的特异性,柱效则是指各蛋白成分逐个从树脂上集中洗脱的能力,洗脱峰越窄,柱效越好。仅有好的选择性,洗脱峰太宽,蛋白照样不能有效分离。 2、各种蛋白纯化方法及其优、缺点 2.1 蛋白沉淀蛋白能溶于水是因为其表面有亲水性氨基酸,在蛋白质的等电点处若溶液的离子强度特别高或者特别低,蛋白则倾向于从溶液中析出。硫酸铵是沉淀蛋白最常用的盐,因为它在冷的缓冲液中溶解性好,冷的缓冲液有利于保持目的蛋白的活性。硫酸铵分馏常用作试验室蛋白纯化的第一步,它可以初步粗提蛋白质,去除非蛋白成分。蛋白质在硫酸铵沉淀中较稳定,可以短期在这种状态下保存中间产物,当前蛋白质纯化多采用这种办法进行粗分离翻。在规模化生产上硫酸铵沉淀方法仍存在一些问题,硫酸铵对不锈钢器具的腐蚀性很强。其他的盐如硫酸钠不存在这种问题,但其纯化效果不如硫酸铵。除了盐析外蛋白还可以用多聚物如PEG和防冻剂沉淀出来,PEG是一种惰性物质,同硫酸铵一样对蛋白有稳定效果,在缓慢搅拌下逐渐提高冷的蛋白溶液中的PEG浓度,蛋白沉淀可通过离心或过滤获得,蛋白可在这种状态下长期保存而不损坏。蛋白沉淀对蛋白纯化来说并不是多么好的方法,因为它只能达到几倍的纯化效果,而我们在达到目的前需要上千倍的纯化。其好处是可以把蛋白从混杂有蛋白酶和其他有害杂质的培养基及细胞裂解物中解脱出来。 2.2 缓冲液的更换虽然更换缓冲液不能提高蛋白纯度,但它却在蛋白纯化方案中起着极其重要的作用。不同的蛋白纯化方法需要不同pH及不同离子强度的缓冲液。假如你用硫酸铵将蛋白沉淀出来,毫无疑问蛋白是处在高盐环境中,需要想办法脱盐,可用的方法有利用半透膜透析,通过勤换透析液体去除盐分,此法尚可,但需几个小时,通常要过夜,也难以用于大规模纯化中。新型的设备将透析膜夹在两个板中间,板的一侧加缓冲液,另一侧加需脱盐的蛋白溶液,并在蛋白溶液一侧通过泵加压,可以使两侧溶液在数小时内达到平衡,若增加对蛋白溶液的压力,还可迫使水分和盐更多通过透析膜进入透析液达到对蛋白浓缩的目的。也有出售的脱盐柱,柱内的填料是小孔径的颗粒,蛋白分子不能进入孔内,先于高浓度盐离子从柱中流出,从而使二者分离。蛋白纯化的每一步都会造成目的蛋白的丢失,缓冲液平衡的步骤尤甚。蛋白会结合在任何它能接触的表面上,剪切力、起泡沫和离子强度的快速变化很容易让蛋白失活。 2.3 离子交换色谱这是在所有的蛋白纯化与浓缩方法中最有效方法。基于蛋白与离子交换树脂间的相互电荷作用,通过选择不同的缓冲液,同一种蛋白既可以和阴离子交换树脂(能结合带负电荷的分子)结合,也可以和阳离子交换树脂结合。树脂所用的带电基团有四种:二乙基氨基乙基用于弱的阴离子交换树脂;羧甲基用于弱的阳离子交换树脂;季铵用于强阴离子交换树脂;甲基磺酸酯用于强阳离子交换树脂。蛋白质由氨基酸组成,氨基酸在不同的pH环境中所带总电荷不同。大多数蛋白在生理pH(pH6~8)下带负电荷,需用阴离子交换柱纯化,极端的pH下蛋白会变性失活.应尽量避免。由于在某个特定的pH下不同的蛋白所带电荷数不同,与树脂的结合力也不同,随着缓冲液中盐浓度的增加或pH的变化,蛋白按结合力的强弱被依次洗脱。在工业化生产中更多地是改变盐浓度而不是去改变pH值,因为前者更容易控制。在实验室中几乎总是用盐浓度梯度去洗脱离子交换柱,利用泵的辅助可以使流入柱的缓冲液中盐浓度平稳地上升,当离子强度能够中和蛋白的电荷时,蛋白就被从柱上洗脱下来。但在工业生产中盐浓度很难精确控制,所以常用分步洗脱而不足连续升高的盐梯度。与排阻层析相比,离子交换特异性更好,有更多的参数可以调整以获得最优的纯化效果,树脂也比较便宜。值得一提的是,即便是用最精确控制的条件,仅用离子交换单一的方法也得不到纯的蛋白,还需要其他的纯化步骤。
蛋白质的分离纯化和表征
蛋白质的分离纯化和表征 第一节蛋白质的酸碱性质 各个解离基团的pK 值与游离氨基酸的不完全相同。等电点要用等电聚焦等方法测定。 第二节蛋白质分子的大小与形状
一、根据化学组成测定最低相对分子质量 假定某种微量成分只有一个,测出其百分含量后,可用比例式算出最低相对分子质量。 若测出两种微量成分的百分含量,分别用比例式算出的最低相对分子质量不相同时,可计算两个最低相对分子质量近似的最小公倍数。 例题:一种纯酶含亮氨酸(Mr 131)1.65%,含异亮氨酸(Mr131)2.48%,求最低相对分子质量。 解:按照Leu 的百分含量计算,最低Mr X1: X1=(100′ 131)/1.65=7939.4。 按照Ile 的百分含量计算最低Mr X2: X2=(100′ 131)/2.48=5282.3。 由于X1 和X2 数字差异较大,提示这种酶含Leu 和Ile 不止1 个,为了估算Leu 和Ile 的个数,首先计算: X1/X2=7939.4/5282.3≈1.5。 这种酶含任何氨基酸的个数均应是整数,说明该酶至少含有2 个Leu,3 个Ile,其最低相对分子质量为: 7939.4 ′2 =15878.8或5282.3×3=15846.9。 二、渗透压法测定相对分子质量 三、沉降分析法测定相对分子质量
基本原理: (一)离心力(centrifugal force,Fc) 当一个粒子(生物大分子或细胞器)在高速旋转下受到离心力作用时,此离心力“Fc”由下式定义: F=m·a=m·ω2 r a—粒子旋转的加速度,m—沉降粒子的有效质量,ω—粒子旋转的角速度,r—粒子的旋转半径(cm)。 (二)相对离心力(relative centrifugal force,RCF) 由于各种离心机转子的半径或者离心管至旋转轴中心的距离不同,离心力而受变化,因此在文献中常用“相对离心力”或“数字×g”表示离心力,只要RCF 值不变,一个样品可以在不同的离心机上获得相同的结果。 RCF 就是实际离心场转化为重力加速度的倍数。
Protocol蛋白质纯化步骤
Protocol 蛋白质纯化方法(镍柱) 柱前操作 1.IPTG诱导后,收菌,8000rpm/min(r/m)离心10min; 2.用Binding Buffer(BB)溶解(每100ml原菌液加BB 20ml),超声裂解30min(工作:5s,停止:5s),1500r/m离心10min,去除杂质; 3.取上清,12000r/m离心20min, 得包涵体; 4.用含2M尿素的BB洗包涵体,12000r/m离心20min,(上清做电泳);??? 5.用含6M尿素的BB溶解包涵体,12000r/m离心20min,(上清做电泳); 6.对照电泳结果,将上清或包涵体溶解液上柱; 平衡柱子(柱体积:V) 7. 3V(3倍柱体积)ddH2O(洗乙醇); 8. 5V Charge Buffer(CB); ??? 9. 3V BB; 柱层析 10.上样; 11. 10V Washing Buffer(WB); 12. 6V Elute Buffer(EB); 13.分管收集,每管1~2ml. 各种缓冲液配方 1. 8×BB: 4M NaCl, 160mM Tris-HCl, 40mM imidazole(咪唑),pH=7.9 1000ml NaCl: 58.44×4=233.76g Tris-HCl: 121.14×160×10-3=19.3824g Imidazole: 68.08×40×10-3=2.7232g 2. 8×CB: 400mM NiSO4 1000ml NiSO4: 262.8×400×10-3=105.12g 3. 8×WB: 4M NaCl, 160mM Tris-HCl, 480mM imidazole, pH=7.9 1000ml NaCl: 233.76g, Tris-HCl:19.3824g, Imidazole: 32.6784g 4. 4×EB: 2M NaCl, 80mM Tris-HCl, 4M imidazole, pH=7.9 1000ml NaCl: 118.688g, Tris-HCl:9.6912g, Imidazole: 272.32g 5. 6M 尿素 1000ml 尿素:60.06×6=360.36g
蛋白质的分离纯化方法(参考资料)
蛋白质的分离纯化方法 2.1根据分子大小不同进行分离纯化 蛋白质是一种大分子物质,并且不同蛋白质的分子大小不同,因此可以利用一些较简单的方法使蛋白 质和小分子物质分开,并使蛋白质混合物也得到分离。根据蛋白质分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。透析和超滤是分离蛋白质时常用的方法。透析是将待分离的混合物放入半透膜制成的透析袋中,再浸入透析液进行分离。超滤是利用离心力或压力强行使水和其它小分子通过半透膜,而蛋白质被截留在半透膜上的过程。这两种方法都可以将蛋白质大分子与以无机盐为主的小分子分开。它们经常和盐析、盐溶方法联合使用,在进行盐析或盐溶后可以利用这两种方法除去引入的无机盐。由于超滤过程中,滤膜表面容易被吸附的蛋白质堵塞,以致超滤速度减慢,截流物质的分子量也越来越小。所以在使用超滤方法时要选择合适的滤膜,也可以选择切向流过滤得到更理想的效果离心也是经常和其它方法联合使用的一种分离蛋白质的方法。当蛋白质和杂质的溶解度不同时可以利用离心的方法将它们分开。例如,在从大米渣中提取蛋白质的实验中,加入纤维素酶和α-淀粉酶进行预处理后,再用离心的方法将有用物质与分解掉的杂质进行初步分离[3]。使蛋白质在具有密度梯度的介质中离心的方法称为密度梯度(区带)离心。常用的密度梯度有蔗糖梯度、聚蔗糖梯度和其它合成材料的密度梯度。可以根据所需密度和渗透压的范围选择合适的密度梯度。密度梯度离心曾用于纯化苏云金芽孢杆菌伴孢晶体蛋白,得到的产品纯度高但产量偏低。蒋辰等[6]通过比较不同密度梯度介质的分离效果,利用溴化钠密度梯度得到了高纯度的苏云金芽孢杆菌伴孢晶体蛋白。凝胶过滤也称凝胶渗透层析,是根据蛋白质分子大小不同分离蛋白质最有效的方法之一。凝胶过滤的原理是当不同蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入珠内网状结构,而被排阻在凝胶珠之外,随着溶剂在凝胶珠之间的空隙向下运动并最先流出柱外;反之,比凝胶珠孔径小的分子后流出柱外。目前常用的凝胶有交联葡聚糖凝胶、聚丙烯酰胺凝胶和琼脂糖凝胶等。在甘露糖蛋白提纯的过程中使用凝胶过滤方法可以得到很好的效果,纯度鉴定证明产品为分子量约为32 kDa、成分是多糖∶蛋白质(88∶12)、多糖为甘露糖的单一均匀糖蛋白[1]。凝胶过滤在抗凝血蛋白的提取过程中也被用来除去大多数杂蛋白及小分子的杂质[7]。 2.2 根据溶解度不同进行分离纯化 影响蛋白质溶解度的外部条件有很多,比如溶液的pH值、离子强度、介电常数和温度等。但在同一条件下,不同的蛋白质因其分子结构的不同而有不同的溶解度,根据蛋白质分子结构的特点,适当地改变外部条件,就可以选择性地控制蛋白质混合物中某一成分的溶解度,达到分离纯化蛋白质的目的。常用的方法有等电点沉淀和pH值调节、蛋白质的盐溶和盐析、有机溶剂法、双水相萃取法、反胶团萃取法等。 等电点沉淀和pH值调节是最常用的方法。每种蛋白质都有自己的等电点,而且在等电点时溶解度最
蛋白纯化离子交换层析法
蛋白纯化离子交换层析 研究生的生活,单调的科研,重复的脚印,匆匆的轨迹,踩着早上的时光一如往常的走进实验室,摊开实验记录本,写上日期,就像每天写日记一样开始计划今天的实验日记,用笔似乎要绘制一副有关实验的画面。 如果你处在这样的科研氛围里,慢慢的就会体味到科学本身就像窗外的大自然一样的美,绿色撩人,诗意陶醉…… 今天,我们写下的实验日记——蛋白纯化离子交换层析法,文章详细的总结了离子交换层析的定义、离子交换层析的原理、离子交换剂的种类,似乎要提醒一下脑子要保持清醒了,不然,看完之后,你能分清楚阴阳离子交换剂的概念,熟知它们的区别么? ————你会创造规律科研生活的美 我,生在春天里,刚发芽的地方是实验室 知了也睡了,而我刷夜实验室 因为我在等待秋天收获的季节 虽然有可能错过成功的喜悦,却收获心灵上的成长
离子交换层析技术是以离子交换剂为固定相,常见的离子交换剂是由一类不溶于水的惰性高分子聚合物基质,通过共价键结合某种电荷基团,形成带电基质,带异性电荷的平衡离子能够通过静电力作用结合在电荷基质上,而平衡离子能够与样品流动相中的离子基团发生可逆交换而吸附在交换剂上,不同带电荷蛋白间结合吸附固定相的能力不同。离子交换技术就是根据蛋白质样品间带电性质的差别而进行分离的一种层析方法。 常见的离子交换剂有离子交换纤维素、离子交换树脂和离子交换葡聚糖凝胶。根据与高分子聚合物基质共价结合的电荷基团的性质不同,可以将离子交换剂分为阳离子交换剂和阴离子交换剂,在阳离子交换剂中,带正电荷的平衡离子能够和流动相中带正电荷的离子基团进行交换。例如DEAE纤维素阳离子交换剂,当纤维素交换剂分子上结合阳离子基团二乙氨乙基(DEAE)时,形成阳离子纤维素—O—C6 H14N+H,可与带负电荷的蛋白质进行结合,交换阴离子。 根据与高分子聚合物基质共价结合的电荷基团的解离度不同,又可以分为强酸型、中等酸型、弱酸型三类阳离子交换剂,强酸型离子交换剂在较大的pH范围内电荷基团完全解离,而弱酸型只能在较小的pH范围内完全解离,如结合羧甲基的离子交换剂在pH小于6时就失去了交换能力。 强酸型阳离子交换剂一般结合的基团有:磺酸甲基、磺酸乙基;中等酸型阳离子交换剂有:磷酸基团和亚磷酸基团;弱酸型离子交换剂有:酚羟基和羧基类; 在阴离子交换剂中,带负电荷的平衡离子能与流动相中带负电的离子基团进行交换,例如阴离子交换剂CM纤维素,当纤维素交换剂分子上结合羧甲基(CM)时,形成带有负电荷的阴离子(纤维素-O-CH2-COO一),可与带正电荷蛋白质结合,交换阳离子。 根据与高分子聚合物基质共价结合的电荷基团的解离度不同,可分为强碱型、中等碱型、弱碱型阴离子交换剂。一般结合季胺基团基质的交换剂为强碱型离子交换剂,结合叔胺、仲胺、伯胺等为中等或者弱碱型离子交换剂。 蛋白质是两性电解质,当溶液的pH值与蛋白质等电点相同时,蛋白质的静
蛋白质提取与制备的原理和方法
蛋白质提取与制备的原理和方法 蛋白质提取与制备蛋白质种类很多,性质上的差异很大,既或是同类蛋白质,因选用材料不同,使用方法差别也很大,且又处于不同的体系中,因此不可能有一个固定的程序适用各类蛋白质的分离。但多数分离工作中的关键部分基本手段还是共同的,大部分蛋白质均可溶于水、稀盐、稀酸或稀碱溶液中,少数与脂类结合的蛋白质溶于乙醇、丙酮及丁醇等有机溶剂中。因此可采用不同溶剂提取、分离及纯化蛋白质和酶。 蛋白质与酶在不同溶剂中溶解度的差异,主要取决于蛋白分子中非极性疏水基团与极性亲水基团的比例,其次取决于这些基团的排列和偶极矩。故分子结构性质是不同蛋白质溶解差异的内因。温度、pH、离子强度等是影响蛋白质溶解度的外界条件。提取蛋白质时常根据这些内外因素综合加以利用。将细胞内蛋白质提取出来。并与其它不需要的物质分开。但动物材料中的蛋白质有些可溶性的形式存在于体液(如血浆、消化硫等)中,可以不必经过提取直接进行分离。蛋白质中的角蛋白、胶原及丝蛋白等不溶性蛋白质,只需要适当的溶剂洗去可溶性的伴随物,如脂类、糖类以及其他可溶性蛋白质,最后剩下的就是不溶性蛋白质。这些蛋白质经细胞破碎后,用水、稀盐酸及缓冲液等适当溶剂,将蛋白质溶解出来,再用离心法除去不溶物,即得粗提取液。水适用于白蛋白类蛋白质的抽提。如果抽提物的pH用适当缓冲液控制时,共稳定性及溶解度均能增加。如球蛋白 类能溶于稀盐溶液中,脂蛋白可用 稀的去垢剂溶液如十二烷基硫酸钠、洋地黄皂苷(Digitonin)溶液或有机溶剂来抽提。其它不溶于水的蛋白质通常用稀碱溶液抽提。 蛋白质类别和溶解性质 白蛋白和球蛋白: 溶于水及稀盐、稀酸、稀碱溶液,可被50%饱和度硫酸铵析出。 真球蛋白: 一般在等电点时不溶于水,但加入少量的盐、酸、碱则可溶解。 拟球蛋白: 溶于水,可为50%饱和度硫酸铵析出 醇溶蛋白: 溶于70~80%乙醇中,不溶于水及无水乙醇 壳蛋白: 在等电点不溶于水,也不溶于稀盐酸,易溶于稀酸、稀碱溶液 精蛋白: 溶于水和稀酸,易在稀氨水中沉淀 组蛋白: 溶于水和稀酸,易在稀氨水中沉淀 硬蛋白质: 不溶于水、盐、稀酸及稀碱 缀合蛋白(包括磷蛋白、粘蛋白、糖蛋白、核蛋白、脂蛋白、血红蛋白、金属蛋白、黄素蛋白和氮苯蛋白等) : 此类蛋白质溶解性质随蛋白质与非蛋白质结合部分的不同而异,除脂蛋白外,一般可溶于稀酸、稀碱及盐溶液中,脂蛋白如
蛋白纯化层析柱
蛋白纯化层析柱 2011-06-15 15:19:14 易生物仪器浏览次数:1164 网友评论 0 条 从个人学术性实验室到大型的医药制造企业,小型或者大规模的蛋白纯化通常都需要几种类型的液相色谱仪。这些相关的大部分技术已应用了多年,但是新型柱料的发展为这些利用蛋白物理和化学特性进行分离的,经过时间考验的方法注入了新的力量。其中最值得提到的就是... 关键词:蛋白离子交换分离分子物质树脂从个人学术性实验室到大型的医药制造企业,小型或者大规模的蛋白纯化通常都需要几种类型的液相色谱仪。这些相关的大部分技术已应用了多年,但是新型柱料的发展为这些利用蛋白物理和化学特性进行分离的,经过时间考验的方法注入了新的力量。其中最值得提到的就是凝胶过滤层析技术(gel filtration,GF),离子交换层析技术(ion exchange,IEX),羟基磷灰石层析(hydroxyapatite,HAP)和疏水作用层析(hydrophobic interaction,HI),以及亲和层析和高效液相色谱方法(high-performance liquid chromatography,HPLC)。 对于一个初接触蛋白纯化的新手而言,从哪儿下手也许是令人头疼的一件事,但是幸运的是目前这些流程都已经逐步系统化了。GE Healthcare(原Amersham Biosciences)的技术顾问Andrew Mitchell解释道,通常利用液相色谱技术进行蛋白纯化有三步: 捕获——从细胞其它成份,比如DNA和RNA中分离需要的蛋白; 区分——从与目的蛋白具有相近的大小,或者相似的物理/化学特征的污染物中分离蛋白; 修饰——使分离得到的样品处于可使用状态。 这每一个纯化的步骤都有特定的色谱层析技术和最佳的beads大小。
蛋白质的离子交换层析技术模板
离子交换层析技术 层析( chromatography) 也称为色谱, 就是将混合物中各种组分分离的方法, 是分离、纯化及鉴定生物大分子时最常使用的技术之一。一个层析系统都包括两相, 即固定相和移动相。当移动相流过加有样品的定相时, 由于各组分在两相之间的分配比例不同, 它们( 各组分) 就会以不同的速度移动而相互分离开来。定相能够是固体, 也能够是被固体或凝胶所支持的液体。定相能够被装入柱中或涂成薄层、薄膜, 成为层析”床”。动相能够是气体, 也能够是液体, 前者称为气相层析, 或者成为液相层析。 离子交换层析技术是以离子交换纤维素、离子交换树脂或离子交换葡聚糖凝胶为固定相, 以待分离的样品为移动相, 分离和提纯蛋白质、核酸、酶、激素和多糖等的一项技术。 ( 一) 原理 在纤维素与葡聚糖分子上结合有一定的离子基团, 当结合阳离子基团时, 可换出阴离子, 则称为阴离子交换剂。如二乙氨乙基( Dicthylaminoethyl, DEAE) 纤维素。在纤维素上结合了DEAE, 含有带正电荷的阳离子纤维素—O—C6 H14N+H, 它的反离子为阴离子( 如Cl-等) , 可与带负电荷的蛋白质阴离子进行交换。当结合阴离子基团时, 可置换阳离子, 称为阳离子交换剂, 如羧甲基( Carboxymethy, CM) 纤维素。纤维素分子上带有负电荷的阴离子( 纤维素-O-CH2-COO一) , 其反离子为阳离子( 如Na+等) ,可与带正电荷蛋白质阳离子进行交换。 溶液的pH值与蛋白质等电点相同时, 静电荷为0, 当溶液pH值大于蛋白质等电点时, 则羧基游离, 蛋白质带负电荷。反之, 溶液的pH值小于蛋白质等电点时, 则氨基电离, 蛋白质带正电荷。溶液的pH值距蛋白质等电点越远,
蛋白质分离与纯化教学设计课题
蛋白质分离与纯化教学设计 一、教学背景分析 【教材分析】 “蛋白质的分离与纯化”实验是《高中生物》选修1生物技术实践 5.3血红蛋白的提取与分离中的容。本节课的主要容包括蛋白质的提取、分离纯化等基本知识,主要要求学生掌握凝胶电泳的实验原理以及操作方法。“血红蛋白分离与纯化”实验不仅是学习血红蛋白的提取、分离纯化方法,而且也是进一步掌握蛋白质的组成、结构和功能的基础。 【学情分析】 到目前为止,学生已经学习了蛋白质的相关知识,对蛋白质有了一定的了解,“蛋白质的分离与纯化”实验目的是使学生体验从复杂细胞混合物体系中提取和纯化生物大分子的基本原理、过程和方法,虽然操作难度较大,但原理清晰,动手机会较多,学习兴趣很高。学生有必修“生命活动的主要承担者——蛋白质”的基础,在一定程度上掌握了蛋白质的组成、结构和功能等基础知识,学生在进行实验前还是能大概了解影响蛋白质分离纯化的因素的,再者经过老师的指导,实验能取得良好的结果的。 二、教学目标 【知识目标】 1.了解从血液中提取蛋白质的原理与方法。 2.说出凝胶电泳的基本原理与方法。 【能力目标】 运用凝胶电泳对蛋白质进行分离纯化。 【情感态度与价值观目标】 1.培养学生科学实验的观点。 2.初步形成科学的思维方式,发展科学素养和人文精神。 三、教学重难点
【教学重点】 从血液中提取蛋白质;凝胶电泳分离纯化蛋白质。 【教学难点】 样品预处理,色谱柱的装柱,纯化分离操作。 四、实验实施准备 【教师准备】 1.分组。学生按学科能力的强中弱平均分组,各组尽量平衡,各组自行分工,并由实验员统一安排实验过程。 2.实验材料:血液 仪器:试管、胶头滴管、烧杯、玻璃棒、离心机、研磨器、透析袋、电泳仪等。 试剂:20mmol/L磷酸缓冲液(pH为8.6)、蒸馏水、聚丙烯酸铵、生理盐水、5%醋酸水溶液等。 【学生准备】 1.预习实验“蛋白质分离纯化”,了解蛋白质的相关信息。 2.进行分组。 五、教学方法 【教法】分析评价法、任务驱动法、直观演示法 【学法】自主学习法、合作交流法 六、教学媒体 黑板、多媒体 七、课时安排 两个课时(80min) 一个课时用来讲述理论部分知识:样品处理与色谱柱分离纯化蛋白质的原理与方法; 另一课时用来进行实验。
离子交换层析
实验二离子交换层析纯化兔血清IgG 【原理】 DEAE-Sephadex A-50 (二乙氨基- 乙基- 葡萄糖凝胶A-50 )为弱碱性阴离子交换剂。用NaOH 将Cl - 型转变为OH - 型后,可吸附酸性蛋白。血清中的γ 球蛋白属于中性蛋白(等电点为pH6.85 ~7.5 ),其余均属酸性蛋白。pH7.2 ~7.4 的环境中。酸性蛋白均被DEAE-Sephadex A-50 吸附,只有γ 球蛋白便可在洗脱液中先流出,而其他蛋白则被吸附在柱上,从而便可分离获得纯化的IgG 。 【试剂与器材】 1. DEAE-Sephadex A-50 2.0.5mol/L HCl 和NaOH 3.0.1mol/L pH7.4 PBS 4.0.1mol/L Tris-HCl(pH7.4)
5.0.02 %NaN 3 6.PEG 7. 无水乙醇 8. 紫外分光光度计 9.1cm×20cm 玻璃层析柱 10. 自动部分收集器 【操作步骤】 1 .DEAE-Sephadex A-50 预处理称DEAE-Sephadex A-50 (下称A-50 )5g ,悬于500ml 蒸馏水内,1h 后倾去上层细粒。按每克A-50 加0.5mol/L NaOH 15ml 的比例,将浸泡于0.5mol/L NaOH 液中,搅匀,静置30min ,装入布氏漏斗(垫有 2 层滤纸)中抽滤,并反复用蒸馏水抽洗至pH 呈中性;再以0.5mol/L HCl 同上操作过程处理,最后以0.5mol/L NaOH 再处理一次,处理完后,将A-50 浸泡于0.1mol/L pH7.4 PBS 中过夜。
2 .装柱 ( 1 )将层析柱垂直固定于滴定架上,柱底垫一圆形尼龙纱,出水口接一乳胶或塑料管并关闭开关。 (2 )将0.1mol/L Tris-HCl(pH7.4) 沿玻璃棒倒入柱中至1/4 高度,再倒入经预处理并以同上缓冲液调成稀糊状的A-50 。待A-50 凝胶沉降2 ~3cm 高时,开启出水口螺旋夹,控制流速1ml/min ,同时连续倒入糊状A-50 凝胶至所需高度。 ( 3 )关闭出水口,待A-50 凝胶完全沉降后,柱面放一圆形滤纸片,以橡皮塞塞紧柱上口,通过插入橡皮塞之针头及所连接的乳胶或塑料管与洗脱液瓶相连接。 3 .平衡启开出水口螺旋夹,控制流速 4 滴/min ,使约2 倍床体积的洗脱液流出。并以pH 计与电导仪分别测定洗脱液及流出液之PH 值与离子强度,两者达到一致时关闭出水口,停止平衡。 4 .加样及洗脱启开上口橡皮塞及下口螺旋夹,使柱中液体缓慢滴出,当柱面液体与柱面相切时,立即关闭出水口,以毛细滴管沿柱壁加入样品(0.5ml 血清,体积应小于床体积的2% ,蛋白浓度以<100mg 为宜)。松开出水口螺旋夹使面样品缓慢进入柱内,至与柱面
分离纯化蛋白质的方法及原理
(二)利用溶解度差别 影响蛋白质溶解度的外部因素有:1、溶液的pH;2、离子强度;3、介电常数;4、温度。但在同一的特定外部条件下,不同蛋白质具有不同的溶解度。 1、等电点沉淀:原理:蛋白质处于等电点时,其净电荷为零,由于相邻蛋白质分子之间没有静电斥力而趋于聚集沉淀。因此在其他条件相同时,他的溶解度达到最低点。在等电点之上或者之下时,蛋白质分子携带同种符号的净电荷而互相排斥,阻止了单个分子聚集成沉淀,因此溶解度较大。不同蛋白质具有不同的等电点,利用蛋白质在等电点时的溶解度最低的原理,可以把蛋白质混合物分开。当pH被调到蛋白质混合物中其中一种蛋白质的等电点时,这种蛋白质大部分和全部被沉淀下来,那些等电点高于或低于该pH的蛋白质则仍留在溶液中。这样沉淀出来的蛋白质保持着天然的构象,能重新溶解于适当的pH和一定浓度的盐溶液中。 5、盐析与盐溶:原理:低浓度时,中性盐可以增加蛋白质溶解度这种现象称为盐溶.盐溶作用主要是由于蛋白质分子吸附某种盐类离子后,带电层使蛋白质分子彼此排斥,而蛋白质与水分子之间的相互作用却加强,因而溶解度增高。球蛋白溶液在透析过程中往往沉淀析出,这就是因为透析除去了盐类离子,使蛋白质分子之间的相互吸引增加,引起蛋白质分子的凝集并沉淀。当溶液的离子强度增加到一定程度时,蛋白质溶解程度开始下降。当离子强度增加到足够高时,例如饱和或半饱和程度,很多蛋白质可以从水中沉淀出来,这种现象称为盐析。盐析作用主要是由于大量中性盐的加入使水的活度降低,原来溶液中的大部分甚至全部的自由水转变为盐离子的水化水。此时那些被迫与蛋白质表面的疏水集团接触并掩盖他们的水分子成为下一步最自由的可利用的水分子,因此被移去以溶剂化盐离子,留下暴露出来的疏水基团。蛋白质疏水表面进一步暴露,由于疏水作用蛋白质聚集而沉淀。 盐析沉淀的蛋白质保持着他的天然构象,能再溶解。盐析的中性盐以硫酸铵为最佳,在水中的溶解度很高,而溶解度的温度系数较低。 3、有机溶剂分级分离法:与水互溶的有机溶剂(甲醇、乙醇和丙酮等)能使蛋白质在水中的溶解度显著降低。在室温下有机溶剂会引起蛋白质变性,如果预先将有机溶剂冷却到-40°C以下,然后在不断搅拌下逐滴加入有机溶剂,以防局部浓度过高,那么变性可以得到很大程度缓解。蛋白质在有机溶剂中的溶解度也随温度、pH和离子强度而变化。在一定温度、pH和离子强度条件下,引起蛋白质沉淀的有机溶剂的浓度不同,因此控制有机溶剂浓度也可以分
离子交换层析
离子交换层析 1、定义 2、发展 1848年,Thompson等人在研究土壤碱性物质交换过程中发现离子交换现象。本世纪40年代,出现了具有稳定交换特性的聚苯乙烯离子交换树脂。50年代,离子交换层析进入生物化学领域,应用于氨基酸的分析。目前离子交换层析仍是生物化学领域中常用的一种层析方法,广泛的应用于各种生化物质如氨基酸、蛋白、糖类、核苷酸等的分离纯化。常用的离子交换剂有:离子交换纤维素、离子交换葡聚糖和离子交换树脂。 3、基本信息 离子交换层析中,基质是由带有电荷的树脂或纤维素组成。带有正电荷的称之阳离子交换树脂;而带有负电荷的称之阴离子树脂。离子交换层析同样可以用于蛋白质的分离纯化。由于蛋白质也有等电点,当蛋白质处于不同的pH条件下,其带电状况也不同。阴离子交换基质结合带有负电荷的蛋白质,所以这类蛋白质被留在柱子上,然后通过提高洗脱液中的盐浓度等措施,将吸附在柱子上的蛋白质洗脱下来。结合较弱的蛋白质首先被洗脱下来。反之阳离子交换基质结合带有正电荷的蛋白质,结合的蛋白可以通过逐步增加洗脱液中的盐浓度或是提高洗脱液的pH值洗脱下来。 4、具体操作 预处理和装柱 对于离子交换纤维素要用流水洗去少量碎的不易沉淀的颗粒,以保证有较好的均匀度,对于已溶胀好的产品则不必经这一步骤。溶胀的交换剂使用前要用稀酸或稀碱处理,使之成为带H+或OH-的交换剂型。阴离子交换剂常用“碱-酸-碱”处理,使最终转为-OH-型或盐型交换剂;对于阳离子交换剂则用“酸-碱-酸”处理,使最终转为-H-型交换剂。 洗涤好的纤维素使用前必须平衡至所需的pH和离子强度。已平衡的交换剂在装柱前还要减压除气泡。为了避免颗粒大小不等的交换剂在自然沉降时分层,要适当加压装柱,同时使柱床压紧,减少死体积,有利于分辨率的提高。
蛋白质的分离纯化方法
蛋白质的分离纯化方法 根据分子大小不同进行分离纯化 蛋白质是一种大分子物质,并且不同蛋白质的分子大小不同,因此可以利用一些较简单的方法使蛋白 质和小分子物质分开,并使蛋白质混合物也得到分离。根据蛋白质分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。透析和超滤是分离蛋白质时常用的方法。透析是将待分离的混合物放入半透膜制成的透析袋中,再浸入透析液进行分离。超滤是利用离心力或压力强行使水和其它小分子通过半透膜,而蛋白质被截留在半透膜上的过程。这两种方法都可以将蛋白质大分子与以无机盐为主的小分子分开。它们经常和盐析、盐溶方法联合使用,在进行盐析或盐溶后可以利用这两种方法除去引入的无机盐。由于超滤过程中,滤膜表面容易被吸附的蛋白质堵塞,以致超滤速度减慢,截流物质的分子量也越来越小。所以在使用超滤方法时要选择合适的滤膜,也可以选择切向流过滤得到更理想的效果离心也是经常和其它方法联合使用的一种分离蛋白质的方法。当蛋白质和杂质的溶解度不同时可以利用离心的方法将它们分开。例如,在从大米渣中提取蛋白质的实验中,加入纤维素酶和α-淀粉酶进行预处理后,再用离心的方法将有 用物质与分解掉的杂质进行初步分离[3]。使蛋白质在具有密度梯度的介质中离心的方法称为密度梯度(区带)离心。常用的密度梯度有蔗糖梯度、聚蔗糖梯度和其它合成材料的密度梯度。可以根据所需密度和渗透压的范围选择合适的密度梯度。密度梯度离心曾用于纯化苏云金芽孢杆菌伴孢晶体蛋白,得到的产品纯度高但产量偏低。蒋辰等[6]通过比较不同密度梯度介质的分离效果,利用溴化钠密度梯度得到了高纯度的苏云金芽孢杆菌伴孢晶体蛋白。凝胶过滤也称凝胶渗透层析,是根据蛋白质分子大小不同分离蛋白质最有效的方法之一。凝胶过滤的原理是当不同蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入珠内网状结构,而被排阻在凝胶珠之外,随着溶剂在凝胶珠之间的空隙向下运动并最先流出柱外;反之,比凝胶珠孔径小的分子后流出柱外。目前常用的凝胶有交联葡聚糖凝胶、聚丙烯酰胺凝胶和琼脂糖凝胶等。在甘露糖蛋白提纯的过程中使用凝胶过滤方法可以得到很好的效果,纯度鉴定证明产品为分子量约为32 kDa、成分是多糖∶蛋白质(88∶12)、多糖为甘露糖的单一均匀糖蛋白[1]。凝胶过滤在抗凝血蛋白的提取过程中也被用来除去大多数杂蛋白及小分子的杂质[7]。 根据溶解度不同进行分离纯化 影响蛋白质溶解度的外部条件有很多,比如溶液的pH值、离子强度、介电常数和温度等。但在同一条件下,不同的蛋白质因其分子结构的不同而有不同的溶解度,根据蛋白质分子结构的特点,适当地改变外部条件,就可以选择性地控制蛋白质混合物中某一成分的溶解度,达到分离纯化蛋白质的目的。常用的方法有等电点沉淀和pH值调节、蛋白质的盐溶和盐析、有机溶剂法、双水相萃取法、反胶团萃取法等。 等电点沉淀和pH值调节是最常用的方法。每种蛋白质都有自己的等电点,而且在等电点时溶解度最
