平衡原理

平衡原理
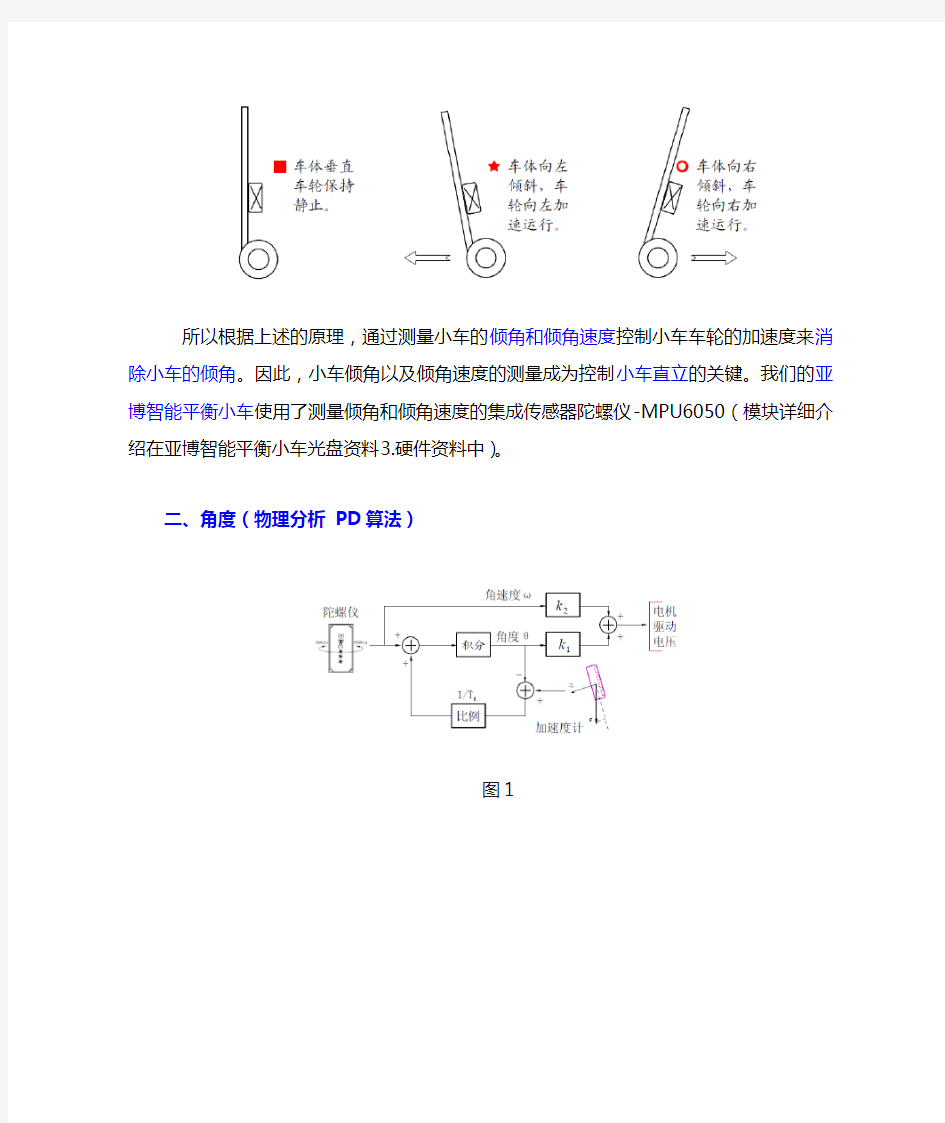
一、平衡小车原理
平衡小车是通过两个电机运动下实现小车不倒下直立行走的多功能智能小车,在外力的推拉下,小车依然保持不倒下。这么一说可能还没有很直观的了解究竟什么是平衡小车,不过这个平衡小车实现的原理其实是在人们生活中的经验得来的。如果通过简单的练习,一般人可以通过自己的手指把木棒直立而不倒的放在指尖上,所以练习的时候,需要学会的两个条件:一是放在指尖上可以移动,二是通过眼睛观察木棒的倾斜角度和倾斜趋势(角速度)。通过手指的移动去抵消木棒倾斜的角度和趋势,使得木棒能直立不倒。这样的条件是不可以缺一的,实际上加入这两个条件,控制过程中就是负反馈机制。
而世界上没有任何一个人可以蒙眼不看,就可以直立木棒的,因为没有眼睛的负反馈,就不知道笔的倾斜角度和趋势。这整个过程可以用一个执行式表达:
平衡小车也是这样的过程,通过负反馈实现平衡。与上面保持木棒直立比较则相对简单,因为小车有两个轮子着地,车体只会在轮子滚动的方向上发生倾斜。控制轮子转动,抵消在一个维度上倾斜的趋势便可以保持车体平衡了。
所以根据上述的原理,通过测量小车的倾角和倾角速度控制小车车轮的加
速度来消除小车的倾角。因此,小车倾角以及倾角速度的测量成为控制小车直立
的关键。我们的亚博智能平衡小车使用了测量倾角和倾角速度的集成传感器陀螺
仪-MPU6050(模块详细介绍在亚博智能平衡小车光盘资料3.硬件资料中)。
二、角度(物理分析PD算法)
图1
图2
控制平衡小车,使得它作加速运动。这样站在小车上(非惯性系,以车轮
作为坐标原点)分析倒立摆受力,它就会受到额外的惯性力,该力与车轮的加
速度方向相反,大小成正比。这样倒立摆(如图2)所受到的回复力为:公式1 F = mg sin θ-ma cos θ≈mg θ-mk1θ式1中,由于θ很小,所以进行了线
性化。假设负反馈控制是车轮加速度a与偏角θ成正比,比例为k1。如果比例
k1>g,(g是重力加速度)那么回复力的方向便于位移方向相反了。
而为了让倒立摆能够尽快回到垂直位置稳定下来,还需要增加阻尼力。增加的阻尼力与偏角的速度成正比,方向相反,因此公式1可改为:
F = mg θ-mk1θ -mk2θ`
按照上述倒立摆的模型,可得出控制小车车轮加速度的算法:
a =k1θ+k2θ` 式中θ为小车角度,θ`为角速度。k1 k2都是比例系数
根据上述内容,建立速度的比例微分负反馈控制,根据基本控制理论讨论小车通过闭环控制保持稳定的条件(这里需要对控制理论有基本了解)。假设外力干扰引起车模产生角加速度x(t)。沿着垂直于车模地盘方向进行受力分析,可以得到车模倾角与车轮运动加速度以及外力干扰加速度a(t)x(t)之间的运动方程。如图3所示。
图3
在角度反馈控制中,与角度成比例的控制量是称为比例控制;与角速度成比例的控制量称为微分控制(角速度是角度的微分)。因此上面系数k1,k2分别称为比例和微分控制参数。其中微分参数相当于阻尼力,可以有效抑制车模震荡。通过微分抑制控制震荡的思想在后面的速度和方向控制中也同样适用。
总结控制车模直立稳定的条件如下:
(1)能够精确测量车模倾角θ的大小和角速度θ'的大小;
(2)可以控制车轮的加速度。
上述控制实际结果是小车与地面不是严格垂直,而是存在一个对应的倾角。在重力的作用下,小车会朝着一个方面加速前进。为了保持小车的静止或者匀速运动需要消除这个安装误差。在实际小车制作过程中需要进行机械调整和软件参数设置。另外需要通过软件中的速度控制来实现速度的稳定性。在小车角度控制中出现的小车倾角偏差,使得小车在倾斜的方向上产生加速。这个结果可以用来进行小车的速度控制。下面将利用这个原理来调节小车的速度。
三、测速(物理模型建立数学模型传递函数PD算法)
假设小车在上面直立控制调节下已经能够保持平衡了,但是由于安装误差,传感器实际测量的角度与车模角度有偏差,因此小车实际不是保持与地面垂直,而是存在一个倾角。在重力的作用下,小车就会朝倾斜的方向加速前进。控制速度只要通过控制小车的倾角就可以实现了。具体实现需要解决三个问题:
(1)如何测量小车速度?
(2)如何通过小车直立控制实现小车倾角的改变?
(3)如何根据速度误差控制小车倾角?
第一个问题可以通过安装在电机输出轴上的光码盘来测量得到小车的车轮速度。如图4所示。利用控制单片机的计数器测量在固定时间间隔内速度脉冲信号的个数可以反映电机的转速。
图4
第二个问题可以通过角度控制给定值来解决。给定小车直立控制的设定值,在角度控制调节下,小车将会自动维持在一个角度。通过前面小车直立控制算法可以知道,小车倾角最终是跟踪重力加速度Z 轴的角度。因此小车的倾角给定值与重力加速度Z轴角度相减,便可以最终决定小车的倾角
第三个问题分析起来相对比较困难,远比直观进行速度负反馈分析复杂。首先对一个简单例子进行分析。假设小车开始保持静止,然后增加给定速度,为此需要小车往前倾斜以便获得加速度。在小车直立控制下,为了能够有一个往前的倾斜角度,车轮需要往后运动,这样会引起车轮速度下降(因为车轮往负方向运动了)。由于负反馈,使得小车往前倾角需要更大。如此循环,小车很快就会倾倒。原本利用负反馈进行速度控制反而成了“正”反馈。
为什么负反馈控制在这儿失灵了呢?原来在直立控制下的小车速度与小车倾角之间传递函数具有非最小相位特性(在此省略了分析),在反馈控制下容易造成系统的不稳定性。
为了保证系统稳定,往往取的小车倾角控制时间常数Tz很大。这样便会引起系统产生两个共轭极点,而且极点的实部变得很小,使得
系统的速度控制会产生的震荡现象。这个现象在实际参数整定的时候可以观察到。那么如何消除速度控制过程中的震荡呢?
要解决控制震荡问题,在前面的小车角度控制中已经有了经验,那就是在控制反馈中增加速度微分控制。但由于车轮的速度反馈信号中往往存在着噪声,对速度进行微分运算会进一步加大噪声的影响。为此需要对上面控制方法进行改进。原系统中倾角调整过程时间常数往往很大,因此可以将该系统近似为一个积分环节。将原来的微分环节和这个积分环节合并,形成一个比例控制环节。这样可以保持系统控制传递函数不变,同时避免了微分计算。
但在控制反馈中,只是使用反馈信号的比例和微分,没有利误差积分,所以最终这个速度控制是有残差的控制。但是直接引入误差积分控制环节,会增加系统的复杂度,为此就不再增加积分控制,而是通过与角度控制相结合后在进行改进。
要求小车在原地停止,速度为0。但是由于采用的是比例控制,如果此时陀螺仪有漂移,或者加速度传感器安装有误差,最终小车倾角不会最终调整到0,小车会朝着倾斜的方向恒速运行下去。注意此时车模不会像没有速度控制那样加速运行了,但是速度不会最终为0。为了消除这个误差,可以将小车倾角设定量直接积分补偿在角度控制输出中,这样就会彻底消除速度控制误差。第二点,由于加入了速度控制,它可以补偿陀螺仪和重力加速度的漂移和误差。所以此时重力加速度传感器实际上没有必要了。
此时小车在控制启动的时候,需要保持小车的垂直状态。此时
陀螺仪的积分角度也初始化为0。当然如果电路中已经包括了重力加速度传感器,也可以保留这部分,从而提高小车的稳定性。在后面的最终给定的控制方案中,保留了这部分的控制回路。
四、转向控制(PD算法)
通过左右电机速度差驱动小车转向消除小车距离道路中心的偏差。通过调整小车的方向,再加上车前行运动,可以逐步消除小车距离中心线的距离差别。这个过程是一个积分过程,因此小车差动控制一般只需要进行简单的比例控制就可以完成小车方向控制。但是由于小车本身安装有电池等比较重的物体,具有很大的转动惯量,在调整过程中会出现小车转向过冲现象,如果不加以抑制,会使得小车过度转向而倒下。根据前面角度和速度控制的经验,为了消除小车方向控制中的过冲,需要增加微分控制。
五、全方案整合
通过上面介绍,将车模直立行走主要的控制算法集中起来,如图5
图5
为了实现小车直立行走,需要采集如下信号:
(1)小车倾角速度陀螺仪信号,获得小车的倾角和角速度。
(2)重力加速度信号
(z轴信号),补偿陀螺仪的漂移。该信号可以省略,有速度控制替代。
(3)小车电机转速脉冲信号,获得小车运动速度,进行速度控制。(4)小车转动速度陀螺仪信号,获得小车转向角速度,进行方向控制。
在小车控制中的直立、速度和方向控制三个环节中,都使用了比例微分(PD)控制,这三种控制算法的输出量最终通过叠加通过电机运动来完成。
(1)小车直立控制:使用小车倾角的PD(比例、微分)控制;
g_fAngleControlOut = g_fCarAngle * g_fCarAngle_P + \ gyro[0] * g_fCarAngle_D ;
(2)小车速度控制:使用PD(比例、微分)控制;
g_fSpeedControlOutNew = (CAR_SPEED_SET - g_fCarSpeed) * g_fCarSpeed_P +\
(CAR_POSITION_SET - g_fCarPosition) * g_fCarSpeed_I; (3)小车方向控制:使用PD(比例、微分)控制。
speednow=-speedtarget*3.4 -gyro[2]*0.0015 ;
可通过单片机软件实现上述控制算法。
在上面控制过程中,车模的角度控制和方向控制都是直接将输出电压叠加后控制电机的转速实现的。而车模的速度控制本质上是通过调节车模的倾角实现的,由于车模是一个非最小相位系统,因此该反馈控制如果比例和速度过大,很容易形成正反馈,使得车模失控,造成系统的不稳定性。因此速度的调节过程需要非常缓慢和平滑。
六、PID算法
图6
控制相关的软件函数包括:
1.
AngleCalculate:小车倾角计算函数。根据采集到的陀螺仪和重力加速度传感器的数值计算小车角度和角速度。如果这部分的算法由外部一个运放实现,那么采集得到的直接是小车的角度和角速度,这部分算法可以省略。该函数是每5毫秒调用一次。
2.
AngelControl:小车直立控制函数。根据小车角度和角速度计算小车电机的控制量。直立控制是5毫秒调用一次。
3.
SpeedControl:小车速度控制函数。根据小车采集到的电机转速和速度设定值,计算电机的控制量。该函数是40毫秒调用一次。
4.
MotorOutput:电机输出量汇集函数。根据前面的直立控制、速度控制和方向控制所得到的控制量进行叠加,分别得到左右两个电极的输出电压控制量。对叠加后的输出量进行饱和处理。函数调用周期5毫秒。在此请大家注意速度控制量叠加的极性是负。
5.
MotorSpeedOut:电机PWM输出计算函数。根据左右两个电极的输出控制量的正负
极性,叠加上一个小的死区数值,克服车模机械静态摩擦力。函数调用周期5毫秒。
6.
SetMotorVoltage:PWM输出函数:根据两个电机的输出量,计算出PWM控制寄存器的数值,设置四个PWM控制寄存器的数值。函数调用周期1毫秒。
以上9个函数都是在1毫秒中断服务中进行被相互调用的。下图显示了这些函数之间的调用与参数传递关系。在个函数附近也表明了调用的周期。
7.
Chaoshengbo:加入超声波壁障模块:根据前方障碍物的距离检测,一旦检测到后,
通过直接PWM值输出(g_fchaoshengbooutput),相障碍物反方上运动,无需算法实现。每30毫秒调用一次。
七、程序(只给出一部分内容)
(1)时序总算法
void SysTick_Handler(void) //5ms定时器
{
BST_u8MainEventCount++; //总循环计数值
BST_u8trig++;
BST_u8SpeedControlCount++; //小车速度控制调用计数值
GetMotorPulse(); //脉冲计算函数
BST_u8SpeedControlPeriod++;
BST_u8DirectionControlPeriod++; //转向平滑输出计算比例值
BST_u8DirectionControlCount++;
AngleControl(); //角度PD控制PWNM输出MotorOutput(); //小车总PWM输出
if(BST_u8trig>=2)
{
UltrasonicWave_StartMeasure(); //调用超声波发送程序给Trig脚<10us 高电平
chaoshengbo(); //计算超声波测距距离
BST_u8trig=0;
}
if(BST_u8SpeedControlCount>=8) //当计数值8时,即总系统运行40ms时候(每
10个角度PWM输出中融入1个速度PWM输出,这样能保持速度PID输出不干扰角度PID 输出,从而影响小车平衡)
{
SpeedControl(); //车模速度控制函数每40ms调用一次
BST_u8SpeedControlCount=0; //小车速度控制调用计数值清零
BST_u8SpeedControlPeriod=0; //平滑输出比例值清零
}
}
(2)平衡程序
/***************************************************************
** 函数名称: SpeedControl
** 功能描述: 速度环控制函数
***************************************************************/
void SpeedControl(void)
{
BST_fCarSpeed = (BST_s32LeftMotorPulseSigma + BST_s32RightMotorPulseSigma );// * 0.5 ; //左右电机脉冲数平均值作为小车当前车速
//sumamm = (BST_s32LeftMotorPulseSigma + BST_s32RightMotorPulseSigma );
BST_s32LeftMotorPulseSigma =BST_s32RightMotorPulseSigma = 0; //全局变量注意及时清零
BST_fCarSpeedOld *= 0.7;
BST_fCarSpeedOld +=BST_fCarSpeed*0.3;
//BST_fCarSpeed = 0.7 * BST_fCarSpeedOld + 0.3 * BST_fCarSpeed ; //速度一阶滤波
BST_fCarPosition += BST_fCarSpeedOld; //路程即速度积分1/11 3:03
BST_fCarPosition += BST_fBluetoothSpeed; //融合蓝牙给定速度
BST_fCarPosition += fchaoshengbo; //融合超声波给定速度
if(stopflag==1)
{
BST_fCarPosition=0;
}
//积分上限设限//
if((s32)BST_fCarPosition > CAR_POSITION_MAX) BST_fCarPosition =
CAR_POSITION_MAX;
if((s32)BST_fCarPosition < CAR_POSITION_MIN) BST_fCarPosition =
CAR_POSITION_MIN;
BST_fSpeedControlOutNew = (BST_fCarSpeedOld -CAR_SPEED_SET ) *
BST_fCarSpeed_P + (BST_fCarPosition - CAR_POSITION_SET ) * BST_fCarSpeed_I; //速度PI算法速度*P +位移*I=速度PWM输出
}
void SpeedControlOutput(void)
//速度平滑输出函数
{
float fValue;
fValue = BST_fSpeedControlOutNew - BST_fSpeedControlOutOld ;
BST_fSpeedControlOut = fValue * (BST_u8SpeedControlPeriod + 1) /
SPEED_CONTROL_PERIOD + BST_fSpeedControlOutOld; //转向平滑输出计算公式
}
(3)蓝牙以及超声波
/***************************************************************
** 函数名称: BluetoothControl
** 功能描述: 蓝牙控制函数
手机发送内容
前:0x01 后:0x02
左:0x04 右:0x03
停止:0x07
功能键:(旋转)
左旋转:0x05 右旋转:0x06
停转:0x07
** 输入:
** 输出:
***************************************************************/
void USART3_IRQHandler(void)
{
u8 ucBluetoothV alue;
if(USART3->SR&(1<<5))//接收到数据
{
ucBluetoothValue =USART3->DR;
USART_ClearFlag(USART3,USART_FLAG_RXNE);
//USART_ClearITPendingBit(USART3, USART_IT_RXNE); //清除中断标志if(ucBluetoothValue<10)
{
switch (ucBluetoothValue)
{
case 0x01 : BST_fBluetoothSpeed = 3000 ;chaoflag=1; break; //向前速度250
case 0x02 : BST_fBluetoothSpeed = (-3000);chaoflag=1; break; //后退速度-250
case 0x03 : BST_fBluetoothDirectionNew= -300; chaoflag=1;break ;//左旋
case 0x04 : BST_fBluetoothDirectionNew= 300; chaoflag=1;break ;//右旋转
case 0x05 : BST_fBluetoothDirectionNew= driectionxco; chaoflag=1;break ;//左旋
case 0x06 : BST_fBluetoothDirectionNew= -driectionxco; chaoflag=1;break ;//右旋转case 0x07 : BST_fBluetoothDirectionL =0; BST_fBluetoothDirectionR = 0;
BST_fBluetoothDirectionSL =0; BST_fBluetoothDirectionSR =
0;fchaoshengbo=0;BST_fBluetoothDirectionNew=0;btcount1=0;chaoflag=0; break; //停case 0x08 : BST_fBluetoothDirectionSL =0; BST_fBluetoothDirectionSR =
0;directionl=0;directionr=0;btcount1=0;
fchaoshengbo=0;BST_fBluetoothDirectionNew=0;chaoflag=0;break; //停旋转
case 0x09 : BST_fBluetoothSpeed = 0 ; break;
default : BST_fBluetoothSpeed = 0;
BST_fBluetoothDirectionL=BST_fBluetoothDirectionR =
0;BST_fBluetoothDirectionSR=BST_fBluetoothDirectionSL=0;btcount1=0;chaoflag=0;break;
}
}
else if(ucBluetoothValue<64&ucBluetoothValue>9)
{
BST_fCarAngle_P=ucBluetoothValue*1.71875;
}
else if(ucBluetoothValue<128&ucBluetoothValue>64)
{
BST_fCarAngle_D=(ucBluetoothValue-64)*0.15625;
}
else if(ucBluetoothValue<192&ucBluetoothValue>128)
{
BST_fCarSpeed_P=(ucBluetoothValue-128)*0.46875;
}
else if(ucBluetoothValue<256&ucBluetoothValue>192)
{
BST_fCarSpeed_I=(ucBluetoothValue-192)*0.15625;
}
}
}
/**********************超声波距离计算***************************/
void chaoshengbo(void)
{
if(chaoflag==0)
{
juli=TIM_GetCounter(TIM1)*5*34/200.0;
if(juli<=4.00) //判断若距离小于8cm,小车输出向后PWM值。
{
fchaoshengbo= (-300);
}
else if(juli>=5&juli<=8)
{
fchaoshengbo=300;
}
else fchaoshengbo=0; //距离大于8cm ,超声波PWM输出为0
}
}
亚博智能STM32 智能平衡小车
解决化学平衡问题的两种方法
解决化学平衡问题的两种方法 化学平衡研究的对象是可逆反应,所以一旦反应开始,体系中反应物和生成物的浓度均不能为零。因此,在研究化学平衡问题时,我们常采用极端假设和过程假设的方法。这两种方法对于等效平衡的问题研究尤为实用。所谓等效平衡是指:对于在两个不同容器中发生的同一可逆反应,如果体系中各组分的百分含量均相等,则称这两个容器中的平衡状态为等效平衡状态。下面分别说明两种假设分析方法的用法。 一、恒温、恒容时等效平衡 1、对于aA(g)+bB(g)mC(g)+nD(g) (a+b不等于m+n)的反应,若在此条件下达到等效平衡状态,我们称之为“完全等效平衡”。如对于2SO2(g)+O2(g) 2SO3(g),在下列三个恒温、恒容容器中按起始物质的量发生上述反应:平衡后的结果(以三体系中的SO2为例)为n(SO2)相同;C((SO2)相同;SO2%相同。 [例1]若取amol SO2、bmolO2、cmol SO3置于上述容器中,保持温度和容积与上述相同,达平衡后与上述结果等效,则a、b、c应满足的条件是。 [解析]根据相同条件下可逆反应里,无论从反应物开始还是从生成物开始,只要起始状态相当,达到的平衡就是等效平衡。上述反应中为完全等效平衡,采用极端假设法来分析,假设c mol SO3全部反应掉,则体系中组分一定变为2molSO2和1molO2,则有a +c=2;2b+c=2。这种方法又叫“一边倒”。但这是应该注意,“一边倒”只是假设,而一旦反应开始,体系中反应物和生成物的浓度均不能为零,视为“不为零”。 [例2]在一个密闭容器中发生如下反应:2SO2(g)+O2(g) =2SO3(g),反应过程某一时刻SO2、O2、SO3的浓度均为0.2mol·L-1,反应达到平衡时,可能的数据是 A、C((SO2)=0.4mol·L-1 B、C((SO2)=C((SO3)=0.15mol·L-1 C、C((SO2)=0.25mol·L-1 D、C((SO2)+C((SO3)=0.4mol·L-1 [解析]根据题意反应不可能进行到底,所以A项错,而根据元素守恒,体系中的S元素为0.4mol,所以B项错,根据可逆反应的原理和元素守恒,答案选C、D。 2、对于aA(g)+bB(g) = mC(g)+nD(g) (a+b=m+n)的反应,若在恒温、恒容状态下达到平衡,只要求对应的物质比例相同即可,称之为“不完全等效平衡”。如对于I2(g) + H2(g) =2HI(g),再三个恒温、恒容容器中发生上述反应:平衡后的结果(以体系中的HI为例)为HI%相同;n(HI)不同;C(HI)不同。 那么,上述容器①②中的平衡状态为什么可以是等效平衡呢?我们就用过程假设法(放缩法)来研究:虽然要求是在恒温、恒容状态下进行反应,我们假设①容器容积为V,而对于容器②,我们先假设开始时其容积为2V,如图所示,将容器②分割成两部分,则结果为三个体积均为V的容器中互为完全等效平衡;然后将容器②的体积压缩到V,由于左右两端气体系数相等,所以过程中平衡不移动,两个容器中的HI%相等,则原来①和②容器中形成的为等效平衡。同理,①②容器和③中也为等效平衡。 [例3]若取amol I2、bmolH2、cmol HI置于上述容器中,保持温度和容积与上述相同,达平衡后与上述结果等效,则a、b、c应满足的条件是。 [解析]运用极端假设Cmol HI完全反应掉,结果中的n(I2):n(H2)=2:1则有(a + c/2):(b + c/2)=2:1,得2a = 4b + c。
平衡容器工作原理
平衡容器的工作原理 3.双室平衡容器的工作原理 3.1.简介 双室平衡容器是一种结构巧妙,具有一定自我补偿能力的汽包水位测量装置。它的主要结构如图1所示。在基准杯的上方有一个圆环形漏斗结构将整个双室平衡容器分隔成上下两个部分,为了区别于单室平衡容器,故称为双室平衡容器。为便于介绍,这里结合各主要部分的功能特点,将它们分别命名为凝汽室、基准杯、溢流室和连通器,另外文中把双室平衡容器汽包水位测量装置简称为容器。 3.2.凝汽室 理想状态下,来自汽包的饱和水蒸汽经过这里时释放掉汽化潜热,形成饱和的凝结水供给基准杯及后续环节使用。 3.3.基准杯 它的作用是收集来自凝汽室的凝结水,并将凝结水产生的压力导出容器,传向差压测量仪表——差压变送器(后文简称变送器)的正压侧。基准杯的容积是有限的,当凝结水充满后则溢出流向溢流室。由于基准杯的杯口高度是固定的,故而称为基准杯。 3.4.溢流室
溢流室占据了容器的大部分空间,它的主要功能是收集基准杯溢出的凝结水,并将凝结水排入锅炉下降管,在流动过程中为整个容器进行加热和蓄热,确保与汽包中的温度达到一致。正常情况下,由于锅炉下降管中流体的动力作用,溢流室中基本上没有积水或少量的积水。 3.5.连通器 倒T 字形连通器,其水平部分一端接入汽包,另一端接入变送器的负压侧。毋庸置疑,它的主要作用是将汽包中动态的水位产生的压力传递给变送器的负压侧,与正压侧的(基准)压力比较以得知汽包中的水位。它之所以被做成倒T 字形,是因为可以保证连通器中的介质具有一定的流动性,防止其延伸到汽包之间的管线冬季发生冻结。连通器内部介质的温度与汽包中的温度很可能不一致,致使其中的液位与汽包中不同,但是由于流体的自平衡作用,对使汽包水位测量没有任何。 3.6.差压的 通过前面的介绍可以知道,凝汽室、基准杯及其底部位于容器内部的导压管中的介质温度与汽包中的介质温度是相等的,即γw =γ`w ,γs =γ`s 。故而不难得到容器所输出的差压。本文以东方锅炉厂DG670-13.73-8A 型锅炉所采用的测量范围为±300mm 双室平衡容器为例加以介绍(如图1所示)。 通过图1可知,容器正压侧输出的压力等于基准杯口所在水平面以上总的静压力,加上基准杯口至L 形导压管的水平轴线之间这段垂直区间的凝结水压力,再加上L 形导压管的水平轴线至连通器水平轴线之间,位于容器的外部的这段垂直管段中的介质产生的压力。显而易见,其中的最后部分压力,由于其中的介质为静止的且距容器较远,因此其中的介质密度应为环境温度下的密度。因此 P += P J +320 γ w +(580-320) γ c 式中P + —— 容器正压侧输出的压力 γ w —— 容器中的介质密度(γ w = γ `w ) γ c —— 环境温度下水的密度 P J —— 基准杯口以上总的静压力 负压侧的压力等于基准杯口所在水平面以上总的静压力,加上基准杯口水平面至汽包中汽水分界面之间的饱和水蒸汽产生的压力,再加上汽包中汽水分界面至连通器水平轴线之间饱和水产生的压力,即 P -= P J +(580-h w ) γ s + h w γw
不平衡理论
如何理解不平衡理论?“不平衡”现象产生的原因是什么? 不平衡理论是马克思在《<政治经济学批判>导言》中提出的一个概念——物质生产的发展例如同艺术发展的不平衡关系。马克思认为,关于艺术,它的一定的繁盛时期决不是同社会的一般发展成比例的,因而也决不是同仿佛是社会组织的骨骼的物质基础的一般发展成比例的。不平衡理论有两大表现,一是艺术领域内部的不平衡,二是整个艺术领域同社会一般发展的不平衡。在艺术本身的领域内部,某些有重大意义的艺术形式只有在艺术不发达阶段上才是可能的,当艺术生产一旦作为艺术生产出现,它们就再不能以那种在世界史上划时代的、古典的形式创造出来。整个艺术领域中,艺术发展同社会发展的不成比例可以分为纵向的不平衡和横向的不平衡。纵向的不平衡是以时间为轴,不同时期的艺术形式和有其自身的样式和特点;横向的不平衡是指同一时期不同地区艺术发展的不平衡。 就其产生的原因来说: 第一、经济基础决定上层建筑。生产力对文学艺术的影响是终极的,而不是唯一的,经济基础与文学艺术之间的 关系不是直接的,无论是经济基础对文学艺术的决定 作用,还是文学艺术对经济基础的反映都不是直接 的。 第二、艺术生产自身的特征。艺术生产具有个体性特征,它
是特殊的精神生产活动,而这种生产活动是无功利 的,不是带来实际效益,而本质上和经济是不能兑换 的。 第三、文艺有其自身的传承性。文艺自身的传承、趋向,也是相对意义上对文艺的发展起特殊的作用。 第四、物质生产的发展和进步与艺术生产的发展和进步具有不同的表现形态。物质生产是呈阶梯状的,新的生 产力代替旧的生产力,失去社会进步,均表现为阶梯 式的向前发展。艺术生产的发展表现为任何一种艺术 形式都要经过发生、成立、成熟、衰落、消亡、新的 艺术形式产生、逐渐定型等这样一个循环运动的轨 迹。
负载均衡设备主要参数配置说明
(初稿)Radware负载均衡设备 主要参数配置说明 2007年10月 radware北京代表处
目录 一、基本配置 (3) 1.1 Tuning配置 (3) 1.2 802.1q配置 (4) 1.2 IP配置 (6) 1.3 路由配置 (7) 二、四层配置 (8) 2.1 farm 配置 (8) 2.2 servers配置 (10) 2.3 Client NAT配置 (11) 2.4 Layer 4 Policy配置 (16) 三、对服务器健康检查 (18) 3.1 基于连接的健康检查 (19) 3.2 高级健康检查 (21) 四、常用系统命令 (25)
一、基本配置 Radware负载均衡设备的配置主要包括基本配置、四层配置和对服务器健康检查配置。注:本文档内容,用红色标注的字体请关注。 1.1 Tuning配置 Rradware设备tuning table的值是设备工作的环境变量,在做完简单初始化后建议调整tuning值的大小。调整完tuning table后,强烈建议,一定要做memory check,系统提示没有内存溢出,才能重新启动设备,如果系统提示内存溢出,说明某些表的空间调大了,需要把相应的表调小,然后,在做memory check,直到没有内存溢出提示后,重启设备,使配置生效。 点击service->tuning->device 配置相应的环境参数,
在做一般的配置时主要调整的参数如下:Bridge Forwarding Table、IP Forwarding Table、ARP Forwarding Table、Client Table等。 Client NAT Addresses 如果需要很多网段做Client NAT,则把Client NAT Addresses 表的值调大。一般情况下调整到5。 Request table 如果需要做基于7层的负载均衡,则把Request table 的值调大,建议调整到10000。 1.2 80 2.1q配置 主要用于打VLAN Tag Device->Vlan Tagging
化学平衡与转化率问题专题
1.平衡常数越大,反应进行的越彻底,即转化率越高。 K〉100000时,认为反应完全进行。 2. T与P的影响 温度或压强改变后,若能是化学平衡向正反应方向移动,则反应物的转化率一定增大。 3.反应物用量(反应物浓度,一般为气体的浓度或者溶液中溶质的浓度)的影响 ⑴若反应物是一种,如:Aa(g)? Bb(g)+ cC(g)。增加A的量,平衡正向移动,A的转 化率的变化如下: 若在恒温恒压条件下,A的转化率不变。(构建模型) 若在恒温恒容条件下,(等效于加压),增加A的量,平衡正向移动,A的转化率与气态物质的化学计量数有关: a=b+c A的转化率不变 a>b+c A的转化率增大 a 化学平衡中转化率变化的判断技巧 一、增大或减少某反应物浓度判断转化率的变化 对于可逆反应aA(g)+bB(g)cC(g)+dD(g),若增大某一反应物浓度可使另一反应物转化率增大,而自身转化率下降,学生对转化率的这种变化很难接受,故可以设计以下例题帮助学生理解概念。 例1.在557℃时,密闭容器中进行下列反应CO+H2O CO2+H2。 若CO起始浓度为2mol/L(1),水蒸气浓度为3mol/L(2),达到平衡时,测得CO2的浓度为L。求CO及H2O的转化率。 分析:在掌握起始浓度、转化率、平衡浓度之间的关系和正确理解转化率概念的基础上,抓住转化浓度,利用常规解题方法。 CO + H2O(气) CO2 + H2 起始浓度 mol/L 2 3 0 0 CH 11 经济增长理论(一) 一、哈罗德一多马模型 (一)哈罗德-多马模型的基本假设条件 ① 假定储蓄S 与国民收入Y 呈一种简单的比例函数:S=sY ,这里s 为平均和边际储蓄倾向。 ② 假定劳动力以不变的外生比率n 增长,且L L n ? = ③ 假定没有技术进步,并对资本存量K 不进行折旧。 上述假定对哈罗德模式并不是必要,其目的仅仅是为了简单化。 ④ 在哈罗德模式中,假定生产函数具有固定系数的性质,生产一单位的产出Y 需要劳动L 和资本K 惟一给定,即: ?? ? ???=u L v K Y ,min (二)哈罗德-多马模型的基本公式 一个经济社会的资本存量K 和总产出Y 之间存在一定的比例,即: K=V Y 从而 ?Y= V ?K 其中,V 被称为资本-产出比。 定义经济的储蓄率为s ?K =I=S= sY= ?Y/V 则 G=?Y/Y=s/V 即为哈罗德-多马模型的基本公式。它表明,当经济处于均衡时,国民收入增长率等于该社会的储蓄率除以资本产出比。 (三)哈罗德-多马模型的含义 1.哈罗德—多马模型从凯恩斯的S=I这一公式出发,认为要使经济均衡增长,一个国家每一时刻的储蓄应当全部转化为投资。 2.由于储蓄比例和资本生产率共同决定经济增长率,因而即可以在资本生产率既定的条件下,用改变储蓄比例或投资比例的办法来改变经济增长率,也可以在储蓄比例不变的前提下,用改变资本生产率的办法来使经济增长率发生变动。 3.哈罗德—多马模型的经济增长模型认为,凯恩斯用短期分析法,从有效需求不足出发,只注意投资在增加总需求方面的作用,未注意到投资在总供给方面的作用。由于投资能形成新的生产能力,所以投资具有两重性,一方面可以增加总需求,另一方面具有生产能力效应,可以增加总供给。 (四)均衡增长率、实际增长率与自然增长率 1.均衡增长率。均衡增长率(warranted rate of growth) ,也称为合意的(满意的、有保证的)增长率,是指保证总需求与总供给相 等的增长率。其公式为Gw=s d /v r 。其中,Gw表示均衡增长率;s d 表示 意愿的(desired)储蓄率,即人们当前意愿储蓄的金额占其收入的比例;v r 表示意愿的资本-产量比率,即理性的企业家认为理想的资本-产量率。 哈罗德指出,假设s d 和v r 既定,则在经济增长过程中,要实现 每一年的总需求与总供给均相等或平衡的均衡增长,必须有足够的有效需求,保证由需求带动的国民收入(产量)增长率Gw所引致的投资I(=Gw·v r )恰好能够完全吸纳既定的储蓄。 F5 Application Management Products 服务器负载均衡原理 F5 Networks Inc 1.服务器负载平衡市场需求 (3) 2.负载平衡典型流程 (4) 2..1 通过VIP来截获合适的需要负载平衡的流量 (4) 2.2 服务器的健康监控和检查 (5) 2.3 负载均衡和应用交换功能,通过各种策略导向到合适的服务器 (6) 1.服务器负载平衡市场需求 随着Internet的普及以及电子商务、电子政务的发展,越来越多的应用系统需要面对更高的访问量和数据量。同时,企业对在线系统的依赖也越来越高,大量的关键应用需要系统有足够的在线率及高效率。这些要求使得单一的网络服务设备已经不能满足这些需要,由此需要引入服务器的负载平衡,实现客户端同时访问多台同时工作的服务器,一则避免服务器的单点故障,再则提高在线系统的服务处理能力。从业界环境来说,如下的应用需求更是负载均衡发展的推动力: ?业务系统从Client-Server转向采用Browser-Server 系统结构,关键系统需要高可用性 ?电子商务系统的高可用性和高可靠性需要 ?IT应用系统大集中的需要(税务大集中,证券大集中,银行大集中) ?数据中心降低成本,提高效率 负载均衡技术在现有网络结构之上提供了一种廉价、有效、透明的方法,来扩展网络设备和服务器的带宽、增加吞吐量、加强网络数据处理能力、提高网络的灵活性和可用性。它有两方面的含义:首先,大量的并发访问或数据流量分担到多台节点设备上分别处理,减少用户等待响应的时间;其次,单个重负载的运算分担到多台节点设备上做并行处理,每个节点设备处理结束后,将结果汇总,返回给用户,系统处理能力得到大幅度提高。 BIG/IP利用定义在其上面的虚拟IP地址来为用户的一个或多个应用服务器提供服务。因此,它能够为大量的基于TCP/IP的网络应用提供服务器负载均衡服务。BIG/IP 连续地对目标服务器进行L4到L7合理性检查,当用户通过VIP请求目标服务器服务时,BIG/IP根椐目标服务器之间性能和网络健康情况,选择性能最佳的服务器响应用户的请求。 下图描述了一个负载平衡发生的流程: 高考28题中的作图问题 一、看图问题 例1:在一密闭容器中发生反应N 2+3H 2 2NH 3 △H ﹤0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 (1)判断t 1、t 3、t 4时刻分别改变的一个条件。 t 1时刻_____ ___; t 3时刻______ __; t 4时刻____ ____。 小结: 二、作图问题 1、单条件定性型 例2:(1)如果在t 6时刻,从反应 体系中分离出部分氨,t 7时刻反应达到平衡状态,请在上图中画出反应速率的变化曲线。 (2)如果恒温恒压条件下t6时刻充入一定量的NH 3,t 7时达到平衡,请作图。 例3:2CO 2(g)+6H 2(g) CH 2=CH 2(g)+4H 2O(g) ΔH = a kJ ·mol -1 保持某温度(大于100℃)不变,在体积为V L 的恒 容容器中以n (H 2)∶n (CO 2)=3∶1的投料比加入反应 物,至t 0时达到化学平衡。t 1时将容器体积瞬间扩 大至2V L 并保持不变,t 2时重新达平衡。作出容器 内混合气体的平均相对分子质量随时间变化的图 像。 例4:氨催化氧化制NO 在热的铂铑(Pt-Rh )合金催化下进行,4NH 3(g)+5O 2(g) 4NO(g)+6H 2O(g),反应过程中合金始终保持红热。NH 3转化率在温度T1下随反应时间(t )的变化如下图:其他条件不变,仅改变温度为T 2(T 2大于T 1),在框图中画出温度T 2下NH 3转化率随反应时间变化的预期结果示意图。 2、单条件定量型 O t 0 t 1 t 2 时间 M 25 20 15 10 5 新人教版化学选修4高中《化学平衡》教案一 姓名班级学号 【课标要求】: 1.了解浓度、压强、温度等外界条件对化学平衡移动的影响。 2.掌握用化学平衡的移动原理来定性定量地分析化学平衡问题。 3.了解平衡移动原理的重要意义,学会解决问题的科学方法。 【重点】 浓度、压强、温度等外界条件对化学平衡移动的影响。 【难点】 用化学平衡的移动原理来定性定量地分析化学平衡问题。 阅读教材:P26-28 知识要点: 一、化学平衡的移动 化学平衡的研究对象是___________,化学平衡是有条件限制的___________平衡,只有在______________时才能保持平衡,当外界条件(浓度、温度、压强)改变时,化学平衡会被______________,反应混合物里各组分的含量不断___________,由于条件变化对正逆反应速率的影响不同,致使v正__________v 逆 ,然后在新条件下建立___________ 1、化学平衡移动的定义:化学上把这种可逆反应中旧化学平衡的破坏、新化学平衡建立的过程叫做化学平衡的移动 2、化学平衡移动的性质: ⑴、若外界条件变化引起v 正> v 逆 :平衡向______方向移动 ⑵、若外界条件变化引起v 正< v 逆 :平衡向______方向移动 ⑶、若外界条件变化引起v 正= v 逆 :旧平衡未被破坏,平衡_________ 巧记:化学平衡总往反应速率______的方向移动二、影响化学平衡的条件 (一)、浓度对化学平衡的影响 增大反应物浓度,正反应速率___________,平衡向___________移动 增大生成物浓度,逆反应速率 ,平衡向 移动 减小反应物浓度,正反应速率 ,平衡向 移动 减小生成物浓度,逆反应速率 ,平衡向 移动 【结论】: 当其他条件不变时,增大反应物浓度或减小生成物浓度,化学平衡向____反应方向移动; 增大生成物浓度或减小反应物浓度,化学平衡向_____反应 方向移动。 【练习】 1、 在水溶液中橙红色的Cr 2O 72—与黄色的CrO 4—有下列平衡关系:Cr 2O 72— +H 2O 2CrO 4—+2H +把重铬酸钾(K 2Cr 2O 7)溶于水配成稀溶液是橙色。 ⑴向上述溶液中加入NaOH 溶液,溶液呈 色,因为 ⑵向已加入NaOH 溶液的⑴中再加入过量的H 2SO 4溶液,溶液呈 色,因为 。 ⑶向原溶液中加入Ba(NO 3)2溶液(已知Ba(CrO 4)2为黄色沉淀),溶液呈 色,因为 。 2、对于密闭容器中进行的反应:SO 2(g)+ 12O 2(g) SO 3(g),如果温度保持 不变,下列说法中正确是( ) A 增加的SO 2浓度,正反应速率先增大,后保持不变 B 增加的O 2浓度,正反应速率逐渐增大 C 增加的SO 2浓度,逆反应速率先增大,后保持不变 D 增加的O 2浓度,逆反应速率逐渐增大 (二)、压强对化学平衡的影响 , 规律:增大压强,化学平衡向____________________________________移动; 减小压强,化学平衡向____________________________________移动; 现在越来越多的用户购买了负载均衡设备,但是在交流中发现很多人对负载均衡的一 些指标和作用理解的并不是那么确切,这里阐述一下个人的一些理解。 1. 吞吐量 各厂家对负载均衡设备的每个型号都有标称的吞吐量,客户购买了设备后,肯定是希 望设备在实际环境中能够达到标称的吞吐量。但这基本上是不可能的,原因很简单,设备的任何指标都是在最优的条件下测出的该设备所能发挥出的最大性能,就吞吐量来说,各厂家都是通过相同大小的大包来测的(传输一个大包自然比传输多个小包需要设备处理的次数少),而实际环境中,各种大小的包都有,所以实际的吞吐量肯定要打个折扣。 那么是否会有厂家宣称的吞吐量就是实际混合环境的吞吐量呢? 这基本不可能,第一,性能测试工具很难模拟出真实环境的流量,测出的值仍然跟实际不符,第二,与商业利益不符,没有任何一个厂家会有指标的最大值不说,而却宣称一个较小的值。 那么是否真有人在实际环境中测出设备的真实性能跟宣称性能差不多呢? 这是可能的,个人分析原因也是两方面:第一,配置的应用比较单一,例如负载均衡设备配置的是简单的四层处理,而且服务器内容就是一些静态网页。第二,跟产品设计的架构有关,例如本人以前看过某厂商的一款产品,主板跟交换板之间是通过一根1G的网线相连,虽然CPU处理的能力可能是大于1Gbps的,但是根据木板理论,该款设备的性能肯定不可能大于1Gbps, 由于CPU可能还有空闲处理能力,即使对于实际环境的混合流量,CPU的处理结果还是能 够达到1G,瓶颈在于那根网线到底能否达到1G的传输能力,所以实际环境中我们才看到 设备达到了宣称的性能。虽然是这样,但是从产品设计角度来说,性能瓶颈应该是来自于核心处理器的处理能力而不应该是来自于交换带宽的限制,这样的设备其实是有设计缺陷的,所以只能当作1G吞吐量的设备来卖。 2. bypass 这里说的bypass是指硬件bypass,而不是有些人说的某些流量bypass到某条路由,那种只能成为策略转发,不能用bypass字眼。首先明确范围,硬件bypass只能用于网络中处于二层不参与三层路由的设备,例如我们看到的很多的流程设备,在网络中仅仅配一个管理地址,而设备却是二层串接在网络中,对流经的流量做带宽管理,由于不参与三层路由交换,所以流控设备可以做到在设备坏掉或断电的情况下把自己当作网线一样透传流量。 负载均衡设备不存在bypass一说,因为负载均衡设备涉及到路由交换以及地址的访问,举个例子,服务器在负载均衡设备上映射的地址是1.1.1.1,所有用户访问的都是1.1.1.1,当负载均衡设备断电或坏掉,1.1.1.1这个地址在路由上就不存在了,即使bypass,用户也访问不到目的地址。同样对于所有参与路由交换的设备来说,设备断电或坏掉,那一段的路由 0气动平衡吊的工作原理 气动平衡吊是利用重物的重力和气缸内压力达到平衡来实现将重物提升或下降的气动搬运设备。一般一个气动平衡吊会有两个平衡点,分别是重载平衡和空载平衡。重载平衡是平衡吊上有重物时达到平衡状态,空载平衡是平衡吊上无负载时实现的平衡状态。不管是哪种平衡状态,抓具会处于静止,这时只需一个很小的外力就能实现提升或下降重物或抓具。利用气动平衡吊的这个原理,可以提高工作效率,降低工人劳动强度。并且气动平衡吊结构简单,组成部分少,造价成本低,能适合在恶劣工况环境中使用。 下图是气动平衡吊的简单气路图,得雷流体以气路图为例详细说明气动平衡吊的工作原理。 气动平衡吊的核心部件是一个大流量、大排放量、高精密度的气控减压阀,这个减压阀直接关系到重物的定位准确性,移动重物时需要的外力大小,移动重物的速度。 两个先导压力减压阀入口压力取自主管路,分别作为重载平衡和空载平衡的先导阀,两路先导气体通入两位三通换向阀,换向阀用于切换重载平衡和空载平衡。经过换向阀之后,先导气体通入气控减压阀,气控减压阀的出口压力则和对应的先导压力相等。主管路的气体经气控减压阀减压后通入气缸,气缸内充入气体后活塞上升,从而将重物拉起。 当重物被吊起后处于静止状态时就说明达到了重载平衡,这时只需一个很小的外力打破这个 平衡,就能实现轻松地上提或下放重物。以往下拉重物来打破平衡为例,当使用外力往下拉时,缸内活塞向下移动,这时缸内压力升高,超过了设定压力(这个设定压力就是平衡时的压力),多余的压力就会从气控减压阀的排放口排出。这样一个过程的结果是:活塞(重物)下降到一定位置静止不动,缸内压力又恢复到之前的平衡压力。反之,往上抬重物打破缸内压力平衡,也是一样的道理,只是气体一个是逆向流动(从缸内向气控减压阀的排气口流动),另一个是正向流动(气控减压阀向缸内流动)。 关于平衡吊气路系统的常见问题及解答: 1,为什么要使用两个先导减压阀来控制一个气控减压阀,而不是只用一个大流量的减压阀直接给气缸供气? 答:如果用一个手动调节的减压阀给气缸供气,减压阀出口压力只能实现一个平衡,无法在两个平衡点之间来回切换。 2,为什么要有重载平衡和空载平衡来回切换? 答:两种平衡分别对应有重物和无重物的情况,当重物被安放到支撑物上(如推车上)后,就应该用换向阀切换至空载平衡才能卸下吊钩。在空载平衡的状态下移动吊钩去吊另外一个重物,钩好后再切换到重载平衡,所以用气动平衡吊来来回搬运卸载重物需要切换两个平衡。 3,为什么不用两个大流量的减压阀接入一个换向阀,再从换向阀通入气缸? 答:正如前面所说的,满足气动平衡吊气路系统的减压阀必须是大流量、大排气量、高精度的,如果用两个这样的阀会大大增加使用成本。而使用一个满足这些条件的气控减压阀加两个先导阀则可以减少成本,因为先导阀可以用小流量的,成本较低。 4,如果气控减压阀不是大流量、大排气量、高精度的,会有什么后果? 答:这个问题需要从三个方面回答。1,流量不大,会引起向气缸内充气速度很慢,从而实现平衡的时间很长(特别是实现重载平衡的时间)。2,排气量小,多余的压力释放地慢,重物位移的速度就慢。3,精度不高,会导致很难调到平衡点,调不到平衡点就使重物无法处于静止状态,或者重物出现抖动现象。 素养说明:化学平衡在化工生产中有非常重要的应用,尤其是控制合适的反应条件使平衡向着理想的方向移动,是近几年高频考点,充分体现了学以致用的原则。 1.总体原则 (1)化工生产适宜条件选择的一般原则 条件原则 从化学反应速率分析既不能过快,又不能太慢 从化学平衡移动分析既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性 从原料的利用率分析增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本 从实际生产能力分析如设备承受高温、高压能力等 从催化剂的使用活性分析注意催化剂的活性对温度的限制 (2)平衡类问题需考虑的几个方面 ①原料的来源、除杂,尤其考虑杂质对平衡的影响。 ②原料的循环利用。 ③产物的污染处理。 ④产物的酸碱性对反应的影响。 ⑤气体产物的压强对平衡造成的影响。 ⑥改变外界条件对多平衡体系的影响。 2.典型实例——工业合成氨 (1)反应原理 N2(g)+3H2(g)2NH3(g)ΔH=-92.4 kJ·mol-1 (2)反应特点:①反应为可逆反应;②正反应为放热反应;③反应物、生成物均为气体,且正反应为气体物质的量减小的反应。 (3)反应条件的选择 反应条件对化学反应 速率的影响 对平衡混合物中 氨含量的影响 合成氨条件的选择 增大压强增大反应 速率 平衡正向移动,提高平 衡混合物中氨的含量 压强增大,有利于氨的合成, 但需要动力大,对材料、设 备的要求高。故采用10~30 MPa的高压 升高温度增大反 应速率 平衡逆向移动,降低平 衡混合物中氨的含量 温度要适宜,既要保证反应 有较快的速率,又要使反应 物的转化率不能太低。故采 用400~500 ℃左右的温度, 并且在该温度下催化剂的活 性最大 使用催化剂增大反 应速率 没有影响 工业上一般选用铁触媒作催 化剂 (4)原料气的充分利用 合成氨反应的转化率较低,从原料充分利用的角度分析,工业生产中可采用循环操作的方法可提高原料的利用率。 [题型专练] 1.某工业生产中发生反应:2A(g)+B(g)2M(g)ΔH<0。下列有关该工业生产的说法中正确的是() A.这是一个放热的熵减反应,在低温条件下该反应一定可自发进行 B.若物质B价廉易得,工业上一般采用加入过量的B,以提高A的转化率 C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高 D.工业生产中常采用催化剂,因为使用催化剂可提高反应物的转化率 解析这是一个放热的熵减反应,只有当ΔH-TΔS<0时,该反应才能自发进行,A错误;加入过量的B,可以提高A的转化率,B正确;升高温度,平衡逆向移动,反应物的转化率降低,C错误;使用催化剂只能改变反应速率,不能使平衡发生移动,不能提高反应物的转化率,D错误。 化学平衡问题 考点1化学平衡的理解及平衡的判定 1. 定义:是指在一定条件下的里,正反应和逆反应的相等 ..,反应体系中所有参加反应的物质的质量或浓度可以的状态。 2. 化学平衡的特征: (1)化学平衡研究的对象是可逆反应;(逆) (2)达到平衡时正反应速率等于逆反应速率;(等) (3)达到平衡时反应混合物中各组分的浓度;(定) (4)由于化学平衡状态时反应仍在进行,故其是一种; (动) (5)条件改变平衡会发生移动.(变) 3.化学平衡状态的判定 例举反应m A(g) + n B(g) p C(g) + q D(g) 混合物体系中各成分的含量各物质的物质的量或各物质的质量分数一定平衡 各物质的质量或物质的质量分数一定平衡 各气体的体积或体积分数一定平衡 总体积、总压强、总物质的量一定不一定平衡 正、逆反应速率相等在单位时间内消耗了m mol A,同时也生成了m mol A, 即v(正)=v(逆) 平衡 在单位时间内消耗了n mol B,同时也消耗了p mol C,即 v(正)=v(逆) 平衡 v(A):v(B):v(C):v(D)=m:n:p:q,v(正)不一定等 于v(逆) 不一定平衡 在单位时间内生成了n mol B,同时也消耗了p mol C,因 均指v(逆) 不一定平衡 压强m + n ≠ p + q 时,总压强一定(其他条件一定)平衡 m + n = p + q 时,总压强一定(其他条件一定)不一定平衡 混合气体的平均相对分子质量M r M r一定时,且m + n ≠ p + q时(非气体的不算)平衡 M r一定时,且m + n = p + q时(非气体的不算)不一定平衡 温度任何化学反应都伴有能量的变化,当体系温度一定时(其 他不变) 平衡 气体的密度密度一定不一定平衡 颜色反应体系内有色物质的颜色稳定不变平衡 注意:“同边异,异边同”原理(平衡的判断方法之一) 核心素养提升○ 25化学平衡移动原理在化工生产中的广泛 应用[科学精神与社会责任] 素养说明:化学平衡在化工生产中有非常重要的应用,尤其是控制合适的反应条件使平衡向着理想的方向移动,是近几年高频考点,充分体现了学以致用的原则。 1.总体原则 (1)化工生产适宜条件选择的一般原则 条件原则 从化学反应速率分析既不能过快,又不能太慢 从化学平衡移动分析既要注意外界条件对速率和平衡影响的一致性,又要注 意二者影响的矛盾性 从原料的利用率分析增加易得廉价原料,提高难得高价原料的利用率,从而 降低生产成本 从实际生产能力分析如设备承受高温、高压能力等 从催化剂的使用活性分 析 注意催化剂的活性对温度的限制 (2)平衡类问题需考虑的几个方面 ①原料的来源、除杂,尤其考虑杂质对平衡的影响。 ②原料的循环利用。 ③产物的污染处理。 ④产物的酸碱性对反应的影响。 ⑤气体产物的压强对平衡造成的影响。 ⑥改变外界条件对多平衡体系的影响。 2.典型实例——工业合成氨 (1)反应原理 N2(g)+3H2(g)2NH3(g)ΔH=-92.4 kJ·mol-1 (2)反应特点:①反应为可逆反应;②正反应为放热反应;③反应物、生成物均为气体,且正反应为气体物质的量减小的反应。 (3)反应条件的选择 反应条件对化学反应 速率的影响 对平衡混合物中 氨含量的影响 合成氨条件的选择 增大压强增大反应速 率 平衡正向移动, 提高平衡混合物 中氨的含量 压强增大,有利于氨的合成,但 需要动力大,对材料、设备的要 求高。故采用10~30 MPa的高压 升高温度增大反应速 率 平衡逆向移动, 降低平衡混合物 中氨的含量 温度要适宜,既要保证反应有较 快的速率,又要使反应物的转化 率不能太低。故采用400~500 ℃ 左右的温度,并且在该温度下催 化剂的活性最大 使用催化 剂增大反应速 率 没有影响工业上一般选用铁触媒作催化剂 (4)原料气的充分利用 合成氨反应的转化率较低,从原料充分利用的角度分析,工业生产中可采用循环操作的方法可提高原料的利用率。 [题型专练] 1.某工业生产中发生反应:2A(g)+B(g)2M(g)ΔH<0。下列有关该工业生产的说法中正确的是() A.这是一个放热的熵减反应,在低温条件下该反应一定可自发进行 B.若物质B价廉易得,工业上一般采用加入过量的B,以提高A的转化率 C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高 D.工业生产中常采用催化剂,因为使用催化剂可提高反应物的转化率 解析这是一个放热的熵减反应,只有当ΔH-TΔS<0时,该反应才能自发进行,A错误;加入过量的B,可以提高A的转化率,B正确;升高温度,平衡逆向移动,反应物的转化率降低,C错误;使用催化剂只能改变反应速率,不能使平衡发生移动,不能提高反应物的转化率,D错误。 答案 B F5负载均衡原理 一负载均衡基本概念 1、什么是负载均衡? 负载均衡技术在现有网络结构之上提供了一种廉价、有效、透明的方法,来扩展网络设备和服务器的带宽、增加吞吐量、加强网络数据处理能力、提高网络的灵活性和可用性。它有两方面的含义:首先,大量的并发访问或数据流量分担到多台节点设备上分别处理,减少用户等待响应的时间;其次,单个重负载的运算分担到多台节点设备上做并行处理,每个节点设备处理结束后,将结果汇总,返回给用户,系统处理能力得到大幅度提高。 BIG/IP利用定义在其上面的虚拟IP地址来为用户的一个或多个应用服务器提供服务。因此,它能够为大量的基于TCP/IP的网络应用提供服务器负载均衡服务。BIG/IP 连续地对目标服务器进行L4到L7合理性检查,当用户通过VIP请求目标服务器服务时,BIG/IP根椐目标服务器之间性能和网络健康情况,选择性能最佳的服务器响应用户的请求。 下图描述了一个负载平衡发生的流程: 1. 客户发出服务请求到VIP 2. BIGIP接收到请求,将数据包中目的IP地址改为选中的后台服务器IP地址,然后将数据包发出到后台选定的服务器 3. 后台服务器收到后,将应答包按照其路由发回到BIGIP 4. BIGIP收到应答包后将其中的源地址改回成VIP的地址,发回客户端,由此就完成了一个标准的服务器负载平衡的流程。 2.负载平衡典型流程 ●通过VIP来截获合适的需要负载平衡的流量 ●服务器监控和健康检查,随时了解服务器群的可用性状态 ●负载均衡和应用交换功能,通过各种策略导向到合适的服务器 2.1 通过VIP来截获合适的需要负载平衡的流量 在BIGIP上通过设置VIP来截获需要进行负载平衡的流量,这个VIP地址可以是一个独立的主机地址和端口的组合(例如:202.101.112.115:80)也可以是一个网络地址和端口的组合(例如:202.101.112.0:80),当流量经过BIGIP的时候,凡是命中VIP 的流量都将被截获并按照规则进行负载平衡。 2.2 服务器的健康监控和检查 服务器 (Node) - Ping (ICMP) BIGIP可以定期的通过ICMP包对后台服务器的IP地址进行检测,如果在设定的时间内能收到该地址的ICMP的回应,则认为该服务器能提供服务 服务 (Port) – Connect BIGIP可以定期的通过TCP包对后台服务器的服务端口进行检测,如果在设定的时间内能收到该服务器端口的回应,则认为该服务器能提供服务 扩展内容查证(ECV: Extended Content Verification)—ECV ECV是一种非常复杂的服务检查,主要用于确认应用程序能否对请求返回对应的数据。如果一个应用对该服务检查作出响应并返回对应的数据,则BIG/IP控制器将该服务器标识为工作良好。如果服务器不能返回相应的数据,则将该服务器标识为宕机。宕机一旦修复,BIG/IP就会自动查证应用已能对客户请求作出正确响应并恢复向该服务器传送。该功能使BIG/IP可以将保护延伸到后端应用如Web内容及数据库。BIG/ip的ECV 功能允许您向Web服务器、防火墙、缓存服务器、代理服务器和其它透明设备发送查询,然后检查返回的响应。这将有助于确认您为客户提供的内容正是其所需要的。 扩展应用查证(EAV: Extended Application Verification) EAV是另一种服务检查,用于确认运行在某个服务器上的应用能否对客户请求作出响应。为完成这种检查,BIG/IP控制器使用一个被称作外部服务检查者的客户程序,该程序为BIG/IP提供完全客户化的服务检查功能,但它位于BIG/IP控制器的外部。例如,该外部服务检查者可以查证一个Internet或Intranet上的从后台数据库中取出数据并在HTML网页上显示的应用能否正常工作。EAV是BIG/IP提供的非常独特的功能,它提供管理者将BIG/IP客户化后访问各种各样应用的能力,该功能使BIG/IP在提供标准的可用性查证之外能获得服务器、应用及内容可用性等最重要的反馈。 第5章 化学平衡 思考题 1.反应达平衡时,宏观和微观特征有何区别 2.为什么化学反应通常不能进行到底 3.什么是复相化学反应其平衡常数有何特征 4.什么是解离压力 5.什么是标准摩尔生成Gibbs 自由能 6.根据公式r m ln G RT K O O ?=-,所以说r m G O ?是在平衡状态时的Gibbs 自由能的变化值,这样说对不对 7.在一定的温度、压力且不做非膨胀功的条件下,若某反应的r m 0G ?>,能否研制出一种催化剂使反应正向进行 8.若用下列两个化学计量方程式来表示合成氨反应,两者的r m G ?和K O 的关系如何 3H 2(g) + N 2(g) === 2NH 3(g) 3/2H 2(g) + 1/2N 2(g) === NH 3(g) 9.工业上制水煤气的反应为 C(s) + H 2O(g) === CO(g) + H 2(g) 1r m 133.5kJ mol H -?=g 设反应在673K 时达到平衡,试讨论下列因素对平衡的影响。 (1)增加碳的含量; (2)提高反应温度; (3)增加系统的总压力; (4)增加水气分压; (5)增加氢气分压; 10.五氯化磷的分解反应为 PCl 5(g) === Cl 2(g) + PCl 3(g) 在一定温度和压力下,反应达平衡,改变如下条件,五氯化磷的解离度如何变化为什么(设均为理想气体) (1)降低气体总压; (2)通入氮气,保持压力不变,使体积增加一倍; (3)通入氮气,保持体积不变,使压力增加一倍; (4)通入氯气,保持体积不变,使压力增加一倍。 概念题 1.在等温等压下,当反应的1r m 5kJ mol G O -?=g 时,该反应能否进行 (A )能正向自发进行 (B )能逆向自发进行 (C )不能判断 (D )不能进行 2.理想气体化学反应平衡时,应用下列哪个关系式 (A )r m ln p G RT K O ?=- (B )r m ln p G RT K O O ?=- (C )r m ln x G RT K O O ?=- (D )r m ln c G RT K O O ?=- 3.理想气体反应CO(g) + 2H 2(g) === CH 3OH(g)的r m G O ?与温度T 的关系为: r m G O ?=-21660+,若要使反应的平衡常数K O >1,则应控制的反应温度: (A )必须低于℃ (B )必须高于 (C )必须低于 (D )必须等于 4.在通常温度下,NH 4HCO 3(s)可发生如下分解反应 NH 4HCO 3(s) === NH 3(g) + CO 2(g) + H 2O(g) 设在两个容积相等的密闭容器A 和B 中,分别加入纯NH 4HCO 3(s)1kg 及20kg ,均保持在298K 。达到平衡后,下列哪种说法是正确的 (A )两容器中压力相等 (B )A 内压力大于B 内压力 (C )B 内压力大于A 内压力 (D )须经实际测定方能判别哪个容器中压力大 5.根据某一反应的r m G O ?值,下列何者不能确定 (A )标准状态下自发变化的方向 (B )在r m G O ?所对应的温度下的平衡位置 (C )在标准状态下系统所能做的最大非膨胀功 (D )提高温度与反应速率的变化趋势 6.某实际气体反应,用逸度表示的标准平衡常数随下列哪些因素而变经济增长理论一
F5负载均衡基本原理
化学平衡中的作图问题
新人教版化学选修4高中《化学平衡》教案一
负载均衡设备的理解
气动平衡吊工作原理
核心素养提升24化学平衡移动原理在化工生产中的广泛应用
化学平衡问题
核心素养提升25化学平衡移动原理在化工生产中的广泛应用
F5负载均衡原理
化学平衡.(试题及答案)
