应用化学往年试题

山东轻工业学院11/12学年第2学期《有机化学I 》期末考试试卷
(A 卷) (本试卷共10页)
一、按要求答题(本题满分55 分)
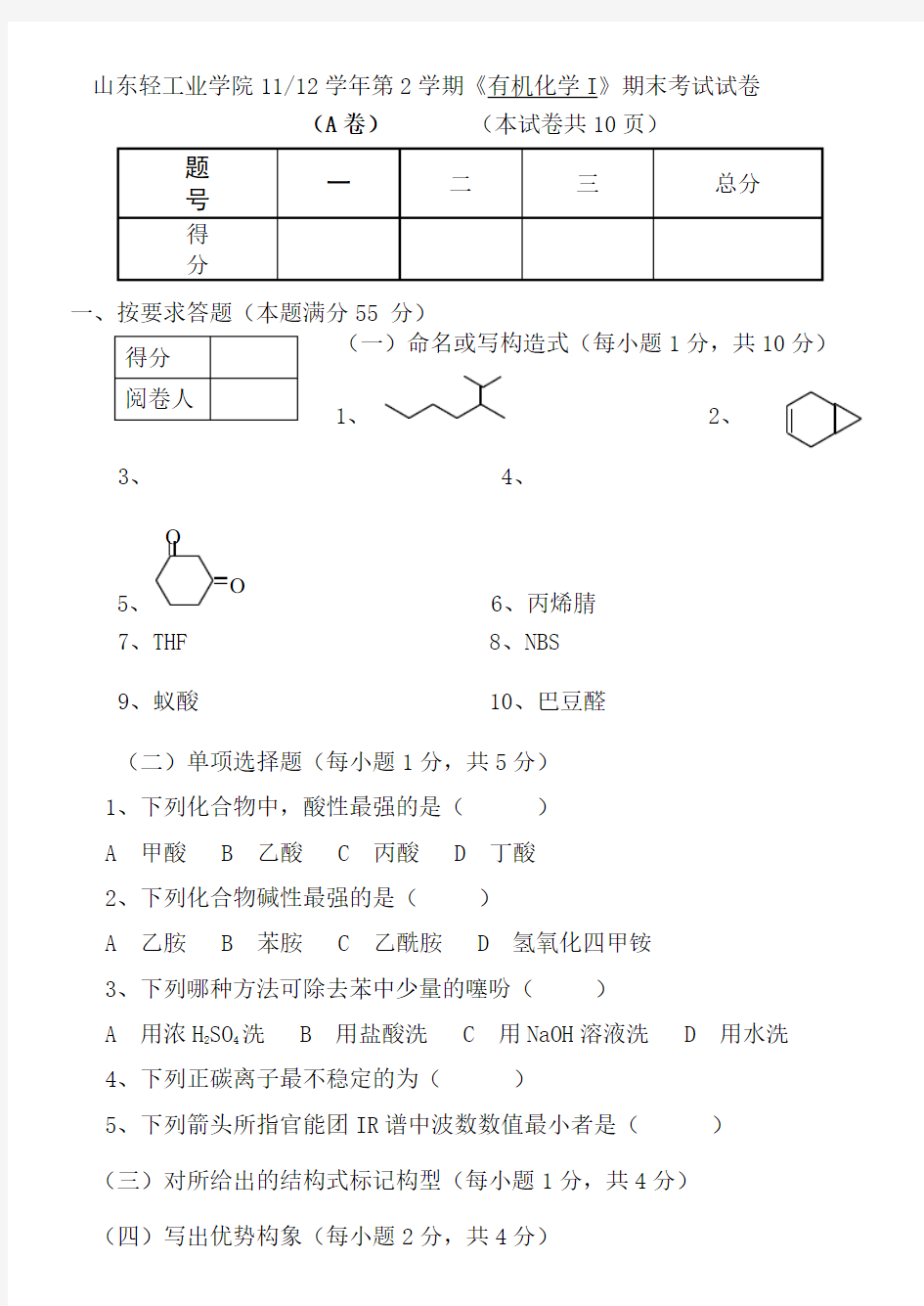
(一)命名或写构造式(每小题1分,共10分)
1、 2、
3、 4、
5、
O
O
6、丙烯腈
7、THF 8、NBS 9、蚁酸 10、巴豆醛 (二)单项选择题(每小题1分,共5分) 1、下列化合物中,酸性最强的是( ) A 甲酸 B 乙酸 C 丙酸 D 丁酸 2、下列化合物碱性最强的是( )
A 乙胺
B 苯胺
C 乙酰胺
D 氢氧化四甲铵 3、下列哪种方法可除去苯中少量的噻吩( )
A 用浓H 2SO 4洗
B 用盐酸洗
C 用NaOH 溶液洗
D 用水洗 4、下列正碳离子最不稳定的为( )
5、下列箭头所指官能团IR 谱中波数数值最小者是( ) (三)对所给出的结构式标记构型(每小题1分,共4分) (四)写出优势构象(每小题2分,共4分)
1、正丁烷(用纽曼投影式和锯架式表示)
2、β-D-吡喃葡萄糖(用椅式构象式表示)
(五)用化学方法鉴别(每小题3分,共15 分) 1、1-丁醇、2-丁醇、2-甲基-2-丙醇 2、呋喃、吡咯、吡啶
3、乙酰乙酸乙酯、2-己酮、3-己醇
4、氯乙烯、烯丙基氯、苄基氯
5、糠醛、糠酸、糠醇
(六)用机理解释下列反应。(任选一个题,共5分) 2、写出乙醛羟醛缩合反应机理。
选择的题号为 得分
(七)根据已知信息推出有机物构造式
(第3题必做,1、2题任选。1或2题4分,3题8 分;共12分) 1、A 、B 两种化合物的分子式均为C 3H 6Cl 2,分别测得它们的1HNMR 谱的数据为:
A :(2H )五重峰2.2ppm ,(4H )三重峰 3.7ppm 。
B :(6H )单 峰 2.4ppm 。 试推测A 、B 的结构。
2、某芳香族化合物分子组成写为 ,试根据下列反应确定其构
造。
3、某卤代烃(A )的分子式为C 6H 11Br ,用NaOH 乙醇溶液处理得(B )C 6H 10, (B )与溴反应的生成物再用KOH-乙醇处理得(C ),(C )可与丙烯醛进行双烯合成反应生成((D),将(C )臭氧化再还原水解可得丁二醛OHCCH 2CH 2CHO 和乙二醛OHC-CHO 氧化产物,试推出(A )(B )(C )(D )的构造式。 选择的题号为 得分 选择的题号为 得分
C 6H 4NO 2CH 3
二、完成反应(每题1分,本题满分30分)
(注意:请将答案直接写在括弧里) 三、有机合成题
(注意:任选三题。每题5分,本题满分15 分)
用指定原料合成产品(无机
试
剂任选)
1、苯为原料合成2-氟-1,3,5-三溴苯
2、苯、乙烯为原料合成2-苯基-2-丁醇
3、丙二酸二乙酯、乙烯为原料合成1,4-环己烷二甲酸
4、乙酰乙酸乙酯、丙烯为原料合成2,4-己二酮
5、丁二烯、乙烯为原料合成环己烷甲酸
山东轻工业学院12/13学年第1学期《有机化学》期末考试试卷
(A 卷) (本试卷共9页) 一、按要求答题(本题满分65分)
(一)命名(每小题1分,共5分)
1、
2、
3、 4、
5、
(二)是非题(每小题1分,共15分)
1、苯酚酸性比苯甲酸强。( )
Cl
CH CCH=CH
2
N
COOCH 3
2、甲胺碱性比氨强。()
3、糠醛不是芳香醛()
4、S
N
1反应是一步完成的协同反应。()
5、异丙胺是仲胺。()
6、某有机物在红外波谱的2140cm-1处有弱吸收,这预示着该化合物含有羧基。
7、TMS是“四甲基甲烷”的英文代号。()
8、二苯甲醇是邻二醇类化合物。()
9、互变异构是立体异构。()
10、核磁共振谱是分子吸收电磁波引起分子振动跃迁产生的。()
11、SOCl
2
的名称是“氯化砜”。()
12、葡萄糖是还原糖,果糖是非还原糖。()
13、含苯环的化合物有芳香性,不含苯环就没有芳香性。()
14、苯甲醚比苯难发生亲电取代反应。()
15、(R)-乳酸与(S)-乳酸是一对对映体。()
(三)对所给出的结构式标记构型(每小题1分,共4分)
(四)写出优势构象(每个2分,共6分)
1、CH
3—CH
2
CH
3
(用纽曼投影式和锯架式表示)
2、1-甲基-4-叔丁基环己烷(用椅式构象式表示)
(五)稳定性判断(每小题1分,共4分)
(六)用化学方法鉴别(每小题3分,共15 分)
1、乙二醇乙二胺乙醇
2、糠醛苯胺吡啶
3、 2,4-戊二酮 2-戊酮 3-戊酮
(七)用机理解释下列反应。(任选一个题,共6分)
选择的题号为 得分
(八)根据已知信息推出有机物构造式
(第3题必做,1或2小题4分,3小题6分;共10分)
1、化合物A(C 8H 10) 和化合物B(C 4H 6Cl 4)的1
HNMR 谱的数据分别为: A :(3H )t 1.2ppm ,(2H )q 2.6ppm, (5H )s 7.1ppm 。 B :(4H )d 3.9ppm, (2H )t 4.6ppm 。 试推测A 、B 的构造。
2、某光学活性化合物A(C 6H 10),经硝酸银的氨溶液处理生成白色沉淀,经还原得化合物B(C 6H 14),B 无光活性。试推测A 、B 的构造并写出A 的费舍尔投影式。
3、分子式为C 7H 12的三个异构体A 、B 、C 均能使Br 2/CCl 4溶液褪色。A 与HBr 加成的产物再用KOH/C 2H 5OH 处理得B ,用KMnO 4/ H +处理A 放出CO 2,同时生成环己酮。B 与Br 2/CCl 4溶液反应的产物再用KOH/C 2H 5OH 处理得D(C 7H 10),D 易脱氢生成甲苯。用KMnO 4/ H +氧化D 可生成CH 3COCOOH 及HOOCCH 2CH 2COOH 。C 与Br 2/CCl 4溶液反应的产物再用KOH/C 2H 5OH 处理得D 的异构体E ,E 与银氨溶液作用有沉淀生成;E 还可与HgSO 4/H 2SO 4溶液反应得含氧化合物F(C 7H 12O);E
用KMnO 4/ H +处理有环戊基甲酸生成。试推测A~F 的构造。 选择的题号为 3 得分 选择的题号为 得分
二、有机化学反应。(本题满分20分)
(一)写出下列反应按机理分类的反应名称(每小题1分,共
5分)
(二)写出下列反应名称(每小题1分,共5分)
(三)判断下列反应有无错误,并改正。(每小题1分,共10分)
三、有机合成题
(注意:任选三题。每题5分,本题满分15 分)
用指定原料合成产品(无机试剂任选)
齐鲁工业大学12/13学年第2学期《有机化学I 》期末考试试卷
(开卷:A 卷) 应化12-1.2.3 (本试卷共10页) 一
1、用5个关键词对教材P532“重氮盐的性质及应用”做出总结概括(共5分)
2、写出六种有芳香性但属于不同大类的有机物(中性分子或离子皆可)(3分)
3、已知:在酸催化下,苯与正丙醇反应的主产物是异丙苯,请您写出反应中
间体的构造式,并回答机理名称。(2分)
中间体构造: 机理名称: 4、写出1-甲基-4-叔丁基环己烷和1,3-环己二醇的优势构象。(3分) 5、有三种化合物,它们是“硝基苯、苯胺和苯酚”。(6分)
(1)请用化学方法鉴别这三种有机物。(用表格法或流程图表达鉴别过程) (2)若将三者混合组成的体系进行分离,给出用化学方法分离的方案。
(用流程图表示过程) 6、已知:
从机理上考虑,反应中有一步亚甲基迁移(扩环重排),请您写出该反应机理。(3分)
7、实验测得,下列反应的消旋化速率恰好是取代反应速率的2倍,这一事实说明什么问题,请您小结一下。(2分)
8、已知:烯烃氢化热(1mol烯烃催化加氢放出的能量)数值如下表
请您用电子效应解释它们的稳定性(谁更稳定,为什么?)(3分)
9、为什么羟基乙酸的酸性比乙酸强,而4-羟基苯甲酸的酸性比苯甲酸弱?请用电
子效应做出解释?(3分)
10、假定一个化合物的分子式为(C
3H
6
O)。(5分)
(1)写出这个分子式的所有可能的构造
(2)如果化合物的IR吸收在1715cm-1处,将得出什么结论?
(3)如果化合物在δ2.1 处同时有一个单1HNMR吸收峰,则该化合物的构造是什
么?
11、写出(R)-甘油醛的费舍尔投影式或点楔线式或纽曼投影式。(3分)
12、视图化学题(4分)
下列立体结构中哪些是一样的?
13、用反应式匹配反应名称(注明必要的反应条件),并总结规律。
(每小题2分,共10分。)
(1)乙炔水合反应:
小结“炔烃与水反应规律”:
(2)2-丁烯与溴分子的亲电加成反应:
小结“当考虑2-丁烯的顺反异构时,反应规律”:
(3)乙烯的硼氢化氧化水解反应:
小结“烯烃硼氢化氧化水解反应规律”:
(4)氢氧化三甲基乙基铵的受热分解反应:
小结“季铵盐受热分解反应规律”:
(5)异戊二烯与丙烯醛的双烯合成反应:
小结“双烯体和亲双烯体上皆有基团时反应规律“:
二、由产品分析原料
(任选五道题,每题4分,本题满分20分)“格氏试剂”的构造
醛(或酮)的构造
“重氮盐”的构造
反应试剂
选择EAA还是EM 构造式
含卤有机物的构造式
两种有机物的构造分别为
羰基化合物的构造
三、按题目要求完成合成(本题满分25分)
1、用两种方法完成下列有机合成(任选两道题,每题10分,共20分。)
方法一:
方法二:
方法一:
方法二:
方法一:
方法二:
2、请您以甲苯为原料利用磺酸基的占位、定位、脱磺基功能实现某个由原料到产
品的有机合成。(用反应式表示)。(5分)
06应用化学物化试题A
西北农林科技大学本科课程考试试卷 2005—2006学年第二学期《 物理化学 》课程A 卷 专业年级:应化04级 命题教师:杨 亚 提 审题教师: 考生姓名: 学 号: 考试成绩: 一、单项选择(每题1 分,共20分 ) 1、以下叙述中不正确的是( ) A .体系的同一状态具有相同的体积; B 、体系的不同状态可具有相同的体积; C 、状态改变,体系的所有状态函数都改变 D 、体系的某状态函数改变了,其状态一定改变 2、下列公式中不正确的是( ) A 、S T G p -=??)( B 、V p G T =??)( C 、2)/(T U T T A V -=??. D 、2)/(T U T T G p -=?? 3、下列关系式中哪一个不需要理想气体的假设?( ) A 、C p -C v = nR B 、dlnp/dT=△H/RT 2 C 、△H=△U+p △V ;(恒压过程) D 、绝热可逆过程,pV r =常数 4、在-20℃和1atm 下,1mol 的过冷水结成冰,则物系、环境及总熵变应该是 ( ) A 、△S 系<0、 △S 环<0、△S 总<0 B 、 △S 系<0、 △S 环>0、△S 总>0 C 、△S 系<0、 △S 环>0、△S 总<0 D 、 △S 系<0、 △S 环<0、△S 总<0 5、在一铝制筒中装有压缩空气,温度与环境平衡,突然打开活塞使气体喷出瓶外,当瓶内外压力刚好相等时关闭活塞,过一会儿筒中气体的压力有何变化?( ) A 、不变 B 、降低 C 、升高 D 、不能确定 6、在400K 时,A 的蒸气压为40kPa ,B 的蒸气压为60kPa ,两者形成理想溶液,当达气液平衡时,溶液中A 的量分数为0.6,气相中B 的量分数应为( )。 A 、0.31 B 、0.40 C 、0.50 D 、0.60 7、在α、β两相中均有A 和B 两种物质,达相平衡时,则有 A 、μA (α) =μ B (β) B 、μA (α) =μB (α) C 、μA (α) =μA (β) D 、无确定关系 8、298 K 时,已知Cu 2+ +2e =Cu φ1 = 0.337V , Cu + +e = Cu φ2 = 0.521V ,则反应 Cu 2+ + e =Cu + 的φ3是 ( ) A 、-0.153V B 、 –0.184V C 、0.153V D 、 0.184V 9、理想气体是 ( )。 A 、独立的非定位体系 B 、非独立的粒子体系 C 、独立的定位粒子体系 D 、定位的粒子体系 10、在一般情况下,电位梯度只影响 ( ) A 、离子的电迁移率 B 、离子迁移速率 C 、电导率 D 、离子的电流分数
应用化学专业介绍
应用化学专业介绍 应用化学专业介绍业务培养目标:本专业培养具备化学的基本理论、基本知识相较强的实验技能,能在科研机构、高等学校及企事业单位等从事科学研究、教学工作及管理工作的高级专门人才。业务培养要求:本专业学生主要学习化学方面的基础知识、基本理论、基本技能以及相关的工程技术知识,受到基础研究和应用基础研究方面的科学思维和科学实验训练,具有较好的科学素养,具备运用所学知识和实验技能进行应用研究、技术开发和科技管理的基本技能。毕业生应获得以下几方面的知识和能力:1.掌握数学、物理等方面的基本理论和基本知识;
2.掌握无机化学、分析化学(含仪器分析)、有机化学、物理化学(含结构化学)、化学工程及化工制图的基础知识、基本原理和基本实验技能;3.了解相近专业的一般原理和知识;4.了解国家关于科学技术、化学相关产品、知识产权等方面的政策、法规;5.了解化学的理论前沿、应用前景、最新发展动态,以及化学相关产业发展状况;6.掌握中外文资料查询、文献检索及运用现代信息技术获取相关信息的基本方法;具有一定的实验设计,创造实验条件,归纳、整理、分析实验结果,撰写论文,参与学术交流的能力。 7 . 熟练掌握实验室的各种仪器,并且能够利用各种仪器完成系列的物质检验,产品分析,等常规处理方法。 本段主干课程 主干学科:化学主要课程:无机化学、分析化学(含仪器分析)、有机化学、物理化学(含结构化学)、化学工程基础及化工制图。主要实践性
教学环节:包括生产实习、毕业论文等,一般安排10一20周。修业年限:四年授予学位:理学或工学学士相近专业:化学应用化学化学生物学分子科学与工程化学工程与工艺 本段就业方向 毕业生主要在精细化工相关企事业单位、商贸公司从事技术开发、产品研制、生产管理、生产监督、环境监测、质量检验、技术服务等工作。还可到相关行业从事化学品的应用研发、安全管理、质量检测等工作。[1] 1、全国高校应用化学专业排名推荐化学一级学科国家重点学科:北京大学、南开大学、吉林大学、复旦大学、南京大学、浙江大学、中国科学技术大学、厦门大学这些是最好的。后面是二级学科国家重点学科:无机化学:中山大学分析化学:清华大学北京协和医学院、武汉大学、湖南大学有机化学:四川大学、兰州大学、物理化学、北京师范大学、福州大学、山东大学
应用化学专业综合实验的设计研究
收稿日期:2009-06-06;修改日期:2009-07-16 作者简介:王彦林(1957-),男,教授,主要从事精细有 机合成与阻燃材料的研究。 应用化学专业综合实验的设计研究 王彦林,钱 永,赵 鑫,龚 菁,朱雪华,宫钦德 (苏州科技学院化学与生物工程学院,江苏苏州 215009) 摘要:结合苏州科技学院应用化学专业方向特色,总结了应用化学专业综合性实验开设的经验和效果,探讨了应用化学专业综合性实验的设计原则、思路及特点。指出充分将实验教学和科学研究双重目标和任务结合到一起,精心筛选和设计综合性实验项目,注意实验内容的学科交叉性以及与教师科研项目的结合性,才能取得良好的综合性、创新性和实用性教学效果。 关 键 词:应用化学;综合实验;创新;效果 中图分类号:G 642 423;O 69 文献标识码:A 文章编号:1672-4550(2010)01-0123-03 St udies on Design of Co mpre hensi ve Experi m ents for Applied Che m istry WANG Yan li n ,Q I A N Yong ,Z HAO X i n ,GONG Jing ,Z HU Xue hua ,GONG Q i n de (Ch e m istry and B i ological Engi n eeri ng C ollege ,Un i versit y of Science and T echnology of Suz h ou , Suz h ou 215009, Ch i na) Abstrac t :Based on the charac teristi c o f appli ed che m istry spec i a lity of U n i versity of Sc i ence and T echno logy of Suzhou ,exper i ence and effec t i n carry i ng out comprehens i ve experi m ents we re su mm ar ized ,and the pri nc i ples ,thoughts and character i sti cs o f comprehen si ve exper i m ents f o r app lied che m i stry we re d i scussed i n th i s article It w as concluded t hat i n teg ra ti ng ,creative and practical teach i ng effect cou l d be obta i ned on cond iti on that sc ientific research and expe ri m ent teach i ng w ere co m bined i n co m prehensi v e expe ri m en ts ,the experi m ent ite m s w ere chosen and desi gned elaborate l y ,the subject i ntercro ss and co rre late of the experi m ents and the scientific i te m s w ere reg arded K ey word s :appli ed che m istry ;co m prehensi ve experi m ent ;creativ it y ; effec t 1 引 言 应用化学是介于化学与化工之间的应用型理工科专业,是培养理工结合型的 用!化学的人才,它与化学专业培养 做!化学的人才在知识结构上不同[1] 。 用!化学要求有扎实的化学基础知识,必须有较强的应用实验研究和开发能力。这给应用化学专业本科生的实验教学提出了迫切而现实的任务。 面向21世纪教学内容和课程改革计划的目的之一,就是培养学生动脑筋、善思考的素质,以及综合运用知识,创新知识,解决问题的能力。因此,教育部高教司刘凤泰副司长在北京地区高校基础课教学实验室评估工作阶段总结会上提出: 面向21世纪教学内容和课程改革计划,保留少量必开的经典验证性实验,增开综合性,设计性实 验![2] 。 为了提高应用化学专业综合化学实验的质量, 综合化学实验的课程设置和实验教学内容急需更新,如何设计出一些新的综合化学实验,以满足培 养21世纪人才的需要已成为当务之急[3] 。 2 设立应用化学专业综合实验的思路 2 1 体现专业方向性 根据国家教育部专业分类应用化学又分有许多专业方向,要根据苏州科技学院应用化学专业方向特点来设计适应培养本专业人才的综合实验项目。例如我院的应用化学专业主要是精细化学品的研究、开发与应用方向,就要设计出包括精细化学品合成、性能检测与应用的实验题目。2 2 要具有创新性 实施创新教育、培养创新人才,已成为国内外教育改革的一大潮流。创新实验的选择应遵从的原则:(1)课题应新颖,能反应当今应用化学的发展及现实生活的要求,使学生感到有用还要有新鲜感;(2)能起到扩充知识,锻炼操作技能,培养分析问题、解决问题的能力的作用。2 3 与教学、科研相结合 应用化学综合实验决不是单一的教学过程,而应 123 第8卷 第1期实验科学与技术
应用化学实验室规章制度
实验室安全、防盗、防火制度 为确保人身和财产安全,维护正常教学秩序,实验室应注意如下安全: 一、安全用电 1.用电线路和配置应由变电所维修室安装检查,不得私自随意拉接。 2.专线专用,杜绝超负荷用电。 3.使用烘箱、电路等高热电器要有专人看守。温箱需经长时间试用检查,确定确实恒温后方可过夜使用。 4.不用电器时必须拉闸断电或拔下插头。 5.保险丝烧坏要查明原因,更换保险丝要符合规格,或找变电所更换。 6.经常检查电路、插头、插座,发现破损立即维修或更换。 二、防火防爆 1.严格安全用电是防火的关键。 2.易燃、易爆物品要远离火源。必须加热处理者,应有专人监护。 3.超高压汞灯在通电及断电后的20分钟内,不得检修和撞击,以防爆炸。 4.每室要有消防器材,并保证人人会用。 三、防水防盗 1.水槽内不许存放任何杂物,随时关闭水门。需长时间流水冲洗者,必须留人监护。 2.自来水、暖气有泄漏,要及时修理。 3.易燃易爆及有害物品实行双人、双锁专柜管理,领用时需经实验室负责人批准。 4.贵重小型仪器设备均应加锁保管,房门安装双锁。 5.下班离室前,必须检查水、电、锁。 四、防污染 1.有害有毒气体不得任意排放,必要时应到有毒气柜的地方处理。 2.有毒物品的空容器、包装物和废弃物,应交设备科统一处理,不得随意乱扔乱倒和当废品出售。 实验室危险品管理制度 一、化学农药等有毒品: 实验室主任根据实验需要提出领取计划,由有关领导签字后实验员购进,交专管人员上帐,放保险柜中保存。 使用这些由使用人到专管人员处按计划量领取、登记,当天用剩的药当天送回专管人员处保管。 科研使用有毒品由科研人员自己领取,领回后交专管人员保管,使用时按第二条办理。 剧毒品外单位借用时,经实验室主任同意,办理借用手续,登记药品名称,借用数量、时间,借用人单位、姓名、身份证号码。 二、易燃、易爆、腐蚀性药品:
应用化学专业化工基础单元测验(传热)
应用化学专业化工基础单元测验(传热) 一.填空题 1.(1分) 题号:4007 第4章知识点:100 难度:容易 某大型化工容器的外层包上隔热层,以减少热损失,若容器外表温度为150℃, 而环境温度为20℃,要求每平方米热损失不大于500w, 采用某隔热材料,其导热系数λ=0.35w.m-1.K-1,则其厚度不低于_______。(注:大型容器可视为平壁) 91mm 2.(2分) 题号:4018 第4章知识点:300 难度:容易 在列管式换热器中,用饱和蒸气加热空气,此时传热管的壁温接近________流体的温度,总传热系数K接近______流体的对流给热系数. 蒸气空气 3.(1分) 题号:4020 第4章知识点:400 难度:容易 热量传递的方式主要有三种:_____、_______、__________. 热传导热对流热辐射 4.(2分) 题号:4042 第4章知识点:200 难度:中等 对流传热中的努塞特准数式是______, 它反映了_________________。 N =αl/λ,对流传热过程几何尺寸对α的影响。 5.(1分) 题号:4051 第4章知识点:100 难度:中等 稳定热传导是指______________________________不随时间而改变。 传热系统中各点的温度仅随位置变 6.(2分) 题号:4055 第4章知识点:100 难度:中等 厚度不同的三种材料构成三层平壁,各层接触良好,已知b1>b2>b3;导热系数λ1<λ2<λ3。在稳定传热过程中,各层的热阻R1______R2______R3;各层导热速率Q1___Q2___Q3。 R1>R2>R3Q1=Q2=Q3 7.(3分) 题号:4062 第4章知识点:400 难度:较难 将单程列管式换热器改为双程的作用是__________,但这将使________减小,________ 增大。 提高管内α △t m阻力 8.(2分) 题号:4063 第4章知识点:200 难度:容易 对流传热过程是__________和__________之间的传热过程。 流体壁面 9.(2分) 题号:4067 第4章知识点:300 难度:中等 列管换热器中,用饱和水蒸汽加热空气。空气走管内,蒸汽走管间,则管壁温度接近____的温度,总传热系数接近_____的对流传热系数。 水蒸汽空气。 10.(1分) 题号:4068 第4章知识点:300 难度:中等 冷热水通过间壁换热器换热,热水进口温度为90℃,出口温度为50℃,冷水进口温度为15℃,出口温度为53℃,冷热水的流量相同,则热损失占传热量的___%(冷热水物性数据视为相同) 5% 11.(2分) 题号:4070 第4章知识点:300 难度:容易 两流体进行传热,冷流体从10℃升到30℃,热流体从80℃降到60℃,当它们逆流流动时,
06应用化学物化试题B
西北农林科技大学本科课程考试试卷 2005—2006学年第二学期《 物理化学 》课程B 卷 专业年级: 应化04级 命题教师: 杨亚提 审题教师: 考生姓名: 学 号: 考试成绩: 一、选择题(每题1 分,共20分) 1.理想气体的内能由U 1增加到U 2,若分别按Ⅰ等压、Ⅱ等容和Ⅲ绝热过程来完成这一变化,则 ( ) A.△T Ⅲ>△T Ⅱ>△T Ⅰ B.Q Ⅰ>Q Ⅱ>Q Ⅲ C. Q Ⅲ>Q Ⅱ>Q Ⅰ D. △H Ⅲ>△H Ⅱ>△H Ⅰ 2.下列各式属于化学势的是 ( ) A .Z n P T B n U ,,)( ?? B. Z n P T B n H ,,)(?? C. P H B n S T ,)(?? D. Z n P T B n G ,,)(?? 3.通常在定温定压下气-固吸附过程应满足 ( ) A.△G>0,△S>0,△H>0 B.△G<0,△S<0,△H<0 C.△G>0,△S<0,△H<0 D.△G<0,△S>0,△H>0 4.所谓溶胶的沉降平衡是指 ( ) A.各处浓度均匀一致 B.粒子恒速下沉 C.粒子重力=阻力 D.粒子以浓度梯度分布 5.表面活性剂溶液浓度达到临界胶束浓度以后,再增加浓度,溶液表面吸附量将 ( ) A.维持不变 B.略有增加 C.略有减少 D.明显增加 6.溶胶稳定性中起主导作用的是 ( ) A.布郎运动 B.聚结稳定性 C.动力稳定性 D.扩散运动 7.乳状液的形成类型取决于 ( ) A.媒剂的多少 B.媒剂的性质 C.媒质的性质 D.乳化剂的性质 8.恒温恒压下,纯液体A 、B 混合成理想溶液时 ( ) A. △mix V = 0 B. △mix H < 0 C. △mix S < 0 D. △mix G = 0 9.可以应用dG = -SdT + Vdp 的过程是 ( ) A.恒温下烧杯中进行的溶液反应 B.组成一定的混合气体膨胀 C.可逆电池中恒温恒压下化学反应 D.恒温恒压相变 10.将一定浓度的强电解质溶液逐渐稀释,其摩尔电导率 ( ) A.不变 B.减小 C.增大 D.先增后减 11.若液体对毛细管壁的润湿角大于900,则当毛细管插入该液体时,毛细管中将发生: A.液面上升 B.蒸气压小于平面时的饱和蒸气压 ( )
应用化学专业英语介绍
应用化学专业 报告 学院:理学院 专业:应用化学 学号:20100153022 姓名:浦仕瑞
Applied chemistry speciality One、applied chemistry speciality-main courses: Training target:This specialized raise has the chemical basic theory, basic knowledge in strong experimental skills,can in scientific research institutions,colleges and universities and enterprises and institutions, engaged in scientific research,teaching and management work of the senior specialized talents. Training requirements:Students of this specialty mainly study the basic knowledge of chemistry,the basic theory,basic skills and related engineering knowledge,is the basic research and applied basic research of scientific thought and scientific experiment training,has good scientific literacy,have use knowledge and experimental skills in applied research,technology development and technology management of the basic skills. Main courses: Main subject:chemical Main course:Inorganic chemistry、,analytical chemistry(including instrument analysis),organic chemistry,physical chemistry(including structural chemistry,chemical engineering foundation and chemical mapping. The main practice teaching links include production practice,graduation thesis,general arrangement and a week of twenty. Length of schooling:four years awarded degree:physical or Bachelor's Similar professional:chemical applied chemistry chemical biology molecular science and engineering chemical engineering and technology Two、Four chemistry: (Inorganic chemistry,analytical chemistry,organic chemistry,physical chemistry) Inorganic chemistry:Inorganic chemistry relative to organic chemistry, the non carbon.However,some carbon compounds,such as carbon monoxide,carbon dioxide,carbon disulfide,carbonic acid compounds,
应用化学综合实验思考题
草酸盐共沉淀法制备Y2O3:Eu纳米荧光粉 1、过滤所得前驱体放在马弗炉中焙烧的目的是什么? 答:当温度升高到一定值时,盐熔化形成熔体,熔盐提供了液态的环境,加快了固相反应物之间的传质速度,使得反应更容易进行,同时,由于熔盐双电子层效应,生成物之间又不容易团聚,因而更易获得分散细小粉体,随着温度增加,熔盐促进了Y3+,Eu3+及配位体的扩散起着熔焊作用,使激活剂更容易进入基质且分配均匀并促使基质结晶更完整,表面缺陷减少,发光亮度得以提高。 2、查阅文献,制备稀土发光材料的常用方法有哪些,各有何优缺点? 答:1)高温固相法 优点:微晶晶体质量优良,表面缺陷少,余光辉效率高,利于工业化生产。 缺点:烧结温度高,保温时间长,设备要求高。 2)软化学法 (1)溶胶—凝胶法 优点:可获得更细的粒径,无需研磨,且合成温度比传统合成方法更低。 缺点:发光效率低,余光辉性能差,结晶质量不好,晶粒形状又难以控制,不易工业化。(2)低温燃烧合成法 优点:具有安全、省时、节能的优点。 缺点:同上。 (3)水热合成法 优点:产物物相纯度高,可获得较小颗粒。 缺点:同上。 3)物理合成法 (1)CO2激光加热气相沉积法 优点:可获得的粒径更小的稀土纳米发光材料,也可通过控制蒸发室的气压来调整纳米微粒粒径的大小 缺点:当纳米微粒中Eu的含量超过0.7%时,将会出现单独的Eu2O3相Y2O3:Eu3+ (2)微波辐射合成法 优点:选择性加热、受热均匀、副反应减少、产物相对单纯;加热速度快,省时,能耗小。缺点:采用原料为极少吸收微波的氧化物,必须采取措施,如在被加热原料外覆盖微波吸收介质,才能有效的利用微波法合成发光材料。 荧光防伪材料的制备 3、实验时溶液PH过大或则过小有何影响? 答:PH过大,溶液中会产生Eu(OH)2白色沉淀。 PH过小,溶液中颜色消失。 4、查阅文献,除了Phen和TTA之外,稀土配合物发光材料的代表性配体还有哪些? 答:有三乙酰丙酮、三苯基氧膦,PMIP联吡啶等。 5、稀土离子Eu3+形成的产物一般发什么颜色光?为什么? 答:一般发红光,因为稀土铕配合物的荧光更强,Eu3+与5D0-7F2的特征发射,其发光波长为614nm左右,半峰宽小于10nm,其发红色光。
应用化学专业简介
应用化学专业简介 培养目标 本专业主要培养具备化学的基础知识、基本理论和较强实验技能,相关的工程技术知识和基本技能,能在石油、化工、制药等行业从事生产、质量检验、新产品应用及开发等工作,适应社会主义现代化建设事业需要的,德、智、体、美全面发展的高级技术应用型人才。 就业领域 毕业生主要在石油、化工、制药、环保及相关行业从事以下工作: 1.各种原料及成品的分析测试 2.化工、石油炼制等生产操作、技术和质量管理 3.石油产品的调配、分析与营销 4.精细化学品、油田化学剂的研制与开发 5.分析仪器的维护和保养,化验室的技术与质量管理 6.分析仪器营销 主要课程 分析化学、有机化学、物理化学、化工原理、石油产品分析与应用、油田化学原理与技术、化工设备和仪表、精细合成单元反应 新增课程 石油炼制、化工设备与仪表、化工仿真实习、石油商品学、精细化工概论、工业分析 主要课程介绍 1.无机化学:化学反应中有关平衡、氧化还原、周期率、物质结构等基本理论,元素和化合物的基本知识,化学反应的基本规律。 2.有机化学:有机物的命名、结构、物理性质和化学性质、实际应用。有机化合物的典型反应及重要合成方法,各类有机化合物相互转变的基本规律,有机化合物结构与性质关系。 3.分析化学:化学定量分析方法,包括酸碱滴定、配位滴定、氧化还原滴定、沉淀滴定、重量分析以及吸光光度法的基本原理、结果计算和实际应用。 4.物理化学:学习化学变化基本规律,内容包括化学热力学、化学动力学、电化学、统计热力学、表面化学及胶体化学初步。 5.高分子化学:高分子研究对象、聚合物分类、自由基均聚与共聚、阳离子聚合、阴离子聚合、缩合聚合等的基本原理、反应动力学以及实施方法。 6.仪器分析:紫外光谱法、红外光谱法、原子吸收光谱法、电位分析法、气相色谱法和液相色谱法的基本原理、分析方法及实际应用,相关仪器操作技术。7.化工原理:将复杂的化工工艺过程抽象为数量有限的单元操作,学习化工单元操作中的基本原理、典型设备及其计算。
应用化学试卷
- 1 - 装 订 线 兰州城市学院 2006-2007学年第一学期 《应用化学》期末考试试卷(A ) 承担单位 化学系 任课教师 朱彦荣 阅 卷 人 一、 填空(每空0.5分,共20分) 1、根据分子结构,可将糖类分为 、 、和 。 2、食品质量鉴定方法有 、 和 。 3、三大热能营养素是 、 、和 ;其中 是体内产热效能最高的热能营养素。 4、磷脂质据其结构、性质和起生理作用的部位分为 、 、和 。 5、β-胡萝卜素是 的前体,抗坏血酸就是维生素 。 6、蛋白质是人体中 元素的唯一补充源,含全部必需氨基酸的蛋白质称为 蛋白质。 7、人体中必需的七种常量元素是 。 8、食品和动植物机体中的水分有 和 两种存在形式。 9、农药据其毒杀方式分为 、 、 、和 。 10、酶作用的抑制分为 和 两种。 11、硝酸盐和亚硝酸盐是食品发色剂,但因有 作用和 作用,故其用量受到严格限制。 12、影响土壤肥力的因素主要有 、 、 、和 。 13、食品污染分为 性污染、 性污染和 性污染。 14、长效染发剂依其种类分为 、 和 。 15、氮肥中有效氮含量以 表示,磷肥中有效磷含量以 表示。
二、选择题(每题1分,共15分) 1、下列属于无糖食品的是() A、黄瓜 B、蜂蜜 C、食用油 D、瘦猪肉 2、维生素E和C在机体中生理作用的共同点是() A、氧化作用 B、抗坏血病作用 C、抗氧化作用 D、增强生育功能 3、非必需氨基酸是指() A、人体必需且体内不能合成的氨基酸 B、人体中非必需的氨基酸 C、人体必需但体内能合成的氨基酸 D、食品中不需要摄入的氨基酸 4、豆类蛋白质中()含量最丰富,故是谷类蛋白质理想的互补食品。 A、亮氨酸 B、糖类 C、脂肪 D、赖氨酸 5、下列物质中毒性最强的是() A、肉毒毒素 B、河豚毒素 C、苦杏仁甙 D、砒霜 6、必需氨基酸共有()种。 A、六种 B、八种 C、十二种 D、二十种 7、肥料三要素是() A、碳、氢、氧 B、钙、镁、磷 C、硫、铁、锰 D、氮、磷、钾 8、下列不属于还原性双糖的是 A、蔗糖 B、麦芽糖 C、乳糖 D、纤维二糖 9、作物生长需要量最大的三种元素是() A、钙、镁、磷 B、硫、锌、锰 C、碳、氢、氧 D、氮、磷、钾 10、维生素H又称() A、抗坏血酸 B、生育酚 C、核黄素 D、生物素 11、食品中Aw值一般() A、等于1 B、小于1 C、大于1 D、小于0 12、在氮平衡表达式B=I-(U+F+S)中,按照正常生理要求,B值应() A、等于0 B、小于0 C、大于0 D、等于1 13、一般养分(①钾盐②硝酸盐③氨盐④磷酸盐)在土壤中移动性从大到小的顺序为() A、①②③④ B、②③①④ C、③①④② D、③②④① - 2 -
应用化学专业描述
应用化学专业描述各位读友大家好,此文档由网络收集而来,欢迎您下载,谢谢 应用化学专业描述 专业级别:本科所属专业门类:化学类报读热度:★★ 培养目标:本专业培养具备化学的基本理论、基本知识和较强的实验技能,能在科研机构、高等学校及企事业单位等从事科学研究、教学工作及管理工作的高级专门人才。 培养要求:本专业学生主要学习化学方面的基础知识、基本理论、基本技能以及相关的工程技术知识,受到基础研究和应用基础研究方面的科学思维和科学实验训练,具有较好的科学素养,具备运用所学知识和实验技能进行应用研究、技术开发和科技管理的基本技能。 毕业生应获得的知识与能力: 1.掌握数学、物理等方面的基本理论和基本知识;
2.掌握无机化学、分析化学、有机化学、物理化学、化学工程及化工制图的基础知识、基本原理和基本实验技能; 3.了解相近专业的一般原理和知识; 4.了解国家关于科学技术、化学相关产业、知识产权等方面的政策、法规; 5.了解化学的理论前沿、应用前景、最新发展动态,以及化学相关产业发展状况; 6.掌握中外文资料查询、文献检索及运用现代信息技术获取相关信息的基本方法;具有一定的实验设计,创造实验条件,归纳、整理、分析实验结果,撰写论文,参与学术交流的能力。 主要课程:无机化学、分析化学、有机化学、物理化学、化学工程基础及化工制图。 学业年限:四年 授予学位:理学或工学学士 开设应用化学专业院校毕业生能力用人单位评价:
本专业毕业生能力被评为A+等级的学校有: 清华大学复旦大学浙江大学吉林大学 四川大学天津大学大连理工大学兰州大学 华南理工大学北京化工大学华东理工大学 本专业毕业生能力被评为A等级的学校有: 北京大学南京大学武汉大学北京师范大学 西安交通大学山东大学中山大学上海交通大学 华中科技大学哈尔滨工业大学中南大学东北大学 重庆大学北京理工大学北京科技大学湖南大学 东北师范大学福建师范大学南昌大学浙江工业大学 中国石油大学(北京) 太原理工大学中国石油大学(华东) 西北大学
应用化学综合实验实验报告5
无 机 综 合 实 验 报 告 理学院
题目Ⅰ利用粗铜粉制备硫酸四氨合铜(Ⅱ) 一、实验目的: 1.掌握利用铜粉制备硫酸铜的方法。 2.用精制的硫酸铜通过配位取代反应制备硫酸四氨合铜(Ⅱ)。 3.掌握和巩固倾析法、减压过滤、蒸发浓缩和重结晶等基本实验操作。 4.掌握固体的灼烧、直接加热、水浴加热和溶解等操作。 二、实验原理 1.利用废铜粉灼烧氧化法制备CuSO4·5H2O: 先将铜粉在空气中灼烧氧化成氧化铜,然后将其溶于硫酸而制得: 2Cu + O2 === 2CuO(黑色) CuO + H2SO4 === CuSO4 + H2O 由于废铜粉不纯,所得CuSO4溶液中常含有不溶性杂质和可溶性杂质FeSO4、Fe2(SO4)3及其他重金属盐等。Fe2+离子需用氧化剂H2O2溶液氧化为Fe3+ 离子,然后调节溶液pH≈4.0,并加热煮沸,使Fe3+离子水解为Fe(OH)3沉淀滤去。其反应式为 2Fe2+ + 2H+ + H2O2 === 2Fe3+ + 2H2O Fe3+ + 3H2O === Fe(OH)3↓+ 3H+ CuSO4·5H2O在水中的溶解度,随温度的升高而明显增大,因此粗硫酸铜中的其他杂质,可通过重结晶法使杂质在母液中,从而得到较纯的蓝色水合硫酸铜晶体。 硫酸铜晶体的化学式可写为[Cu(H2O)4]SO4·H2O,习惯上简写为CuSO4·5H2O,其中5个水分子结合的方式有所不同,Cu2+有空轨道,每个Cu2+可以跟4个水分子形成配位键,离子还可与1个水分子里的H原子形成氢键。 水合硫酸铜在不同的温度下可以逐步脱水,其反应式为 CuSO4·5H2O === CuSO4·3H2O + 2H2O(48℃) CuSO4·3H2O === CuSO4·H2O + 2H2O(99℃) CuSO4·H2O === CuSO4 + H2O(218℃) 2.硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4·H2O)的制备 硫酸四氨合铜(Ⅱ)([Cu(NH3)4]SO4·H2O)为蓝色正交晶体,在工业上用途广泛,主要用于印染,电镀,纤维,杀虫剂的制备和制备某些含铜的化合物。本实验通过将过量氨水加入硫酸铜溶液中反应得硫酸四氨合铜。离子反应式为: [Cu(H2O)6]2+ +4NH3 +SO42- ====[Cu(NH3)4]SO4·H2O+5H2O 硫酸四氨合铜溶于水但不溶于乙醇,因此在硫酸四氨合铜溶液中加入乙醇,即可析出深蓝色的[Cu(NH3)4]SO4·H2O晶体。 三、实验仪器及试剂 1.仪器: 托盘天平、恒温烘箱、干燥器、温度计(300℃)、瓷坩埚、研钵、烧杯(50mL)、电炉、布氏漏斗、抽滤瓶、精密pH试纸、蒸发皿、表面皿,水浴锅、量筒(10mL)。 2.试剂: 铜粉、无水乙醇、H2SO4(2mol·L-1)、H2O2(3%)、K3[Fe(CN)6](0.1mol·L-1)、NaOH(2mol·L-1)、氨水NH3·H2O(1:1)。 四、实验步骤
应用化学有机化学试题答案
一、命名或写出结构式(10分),每小题2分。 1、6-甲基-5-庚烯-1-炔 2、(2Z ,4E )-2-氯-2,4-己二烯 3、S-4-甲基-3-溴-1-戊烯 4、5-溴-2-萘甲酸 5、1-甲基螺[3.5]壬烷 二、完成下列各反应式(18分) 2. 3. Cl-CH 2CH 2-CF 3 1. Cl COOH ;; SO 3H SO 3H NO 2 ; 4、5、 CH CHCH-CH 3 CI Ph 6、 CH 2-CH-CH 3 7、 CH 3 H H CN Br CH CHCH-CH 3 OH C=C H CH 3Br 8、. CH 3
三、下列各反应中有无错误?如有,指出错在何处。(5分) 9、 CH 3 -C-CH 3 CH 3CH 2CH 3 COOH -C-CH 3 CH 3CH 2CH 3 10、. CH 3H C H 3CH 3C H 3C H 3CH 3CH 3 C H 3CH 2CH 3 H Li H H CuLi ( )2 11、 1、,( )2、) 3、() 4、(( ×生成 共 轭 烯烃 ) 5、( √ ) × 主要为 消 去产 物 ×× 不 反 应 有活 泼氢
四、回答下列问题(12分) 1、 (4分) 顺式反应快。 2、 2、3 (2分) 3、(3分) 4、 ④ (1分) 5、(2分) 五、按要求排列顺序(10分) 六、用简单的化学方法鉴别下列化合物(5分) 解答: 每鉴别出一个得1分。 顺式生 成: CH CH 3 2 ()反 式生成: CH CH 3 2 ()(1)()(2)()(3)()对映体顺反 异构 同一物 质CH 2=CH-CH=CH 2+H CH 3-CH-CH=CH 2CH 3-CH=CH-CH 2 Cl Cl 动力 学控制 热力学 控制+1、 A C B 2、3、4、?5、A C B C A B D C A B A C B A 、 B 、 C 、 D 、 无 无 现象无 现象 褪色 立即 有沉 淀片刻 后 有沉 淀加热 后 才有沉 淀
《应用化学实验Ⅰ》课程实验教学大纲
《应用化学实验Ⅰ》课程实验教学大纲 一、制定实验教学大纲的依据 根据本校《2004级本科指导培养计划》和应用化学教学基本要求而编写。 二、本实验课在专业人才培养中的地位和作用 《应用化学实验?》密切配合有机波谱分析和现代仪器分析的理论课,使学生在具有一定专业基础知识和技能的基础上,运用现代分析测试仪器,结合计算机知识进行各种试样组分的分离分析、成分测定、结构分析以及分析数据的计算机处理。 三、本实验课讲授的基本实验理论 本实验课程讲授电化学分析、高压液相色谱仪、气相色谱仪、原子吸收光谱仪以及紫外光谱仪、红外光谱仪等大型精密仪器的基本原理和基本操作方法;使学生掌握高压液相色谱、气相色谱分离混合物的基本操作与技能,掌握原子吸收光谱法测定金属元素的方法;掌握红外光谱仪、紫外光谱仪的制样技术和一般谱图的解析方法。 四、本实验课学生应达到的能力 1、掌握电位法测定离子浓度的基本原理和实验技术 2、掌握高压液相色谱、气相色谱分离混合物的基本操作与技能; 3、掌握原子吸收光谱法测定金属元素的方法; 4、了解紫外光谱仪、红外光谱仪的基本组成和构造,掌握制样技术和一般谱图的解析方法。 五、学时、教学文件 学时:本课程总学时为32学时,实验32学时。 教学文件:《应用化学实验指导书》,杜宝中编,校内印刷,2004 要求:学生实验前预习实验内容,并写出预习报告。指导教师应概述实验的原理、方法及设备使用等,具体实验步骤和实际数据处理由学生独立完成。 六、实验考核办法与成绩评定 实验成绩分平时成绩和考试成绩两部分,平时成绩占60%,考试成绩以最后的综述论文成绩记入总分,占实验成绩的40%。总成绩及格可获得学分,不及格者需重修。 七、仪器设备及注意事项 仪器设备:红外光谱仪、紫外光谱仪、原子吸收光谱仪、气和色谱、高效汇相色谱仪、PH/my 计。 注意事项:注意保护设备,严格按仪器使用规则操作,维持仪器的完好率。
应用化学《结构化学》期末考试试卷A答案
贵州师范大学2008 — 2009 学年度第 一 学期 《结构化学》课程期末考试试卷评分标准 (应用化学专业用,A 卷;闭卷) 物理常数: m e = 9.109×10-31 kg; e = 1.602×10-19 C; c = 2.998×108 m/s; h = 6.626×10-34 J ·s; 一、填空题(本大题共20空,每空 2 分,共 40 分)请将正确答案填在横线上。 1. 结构化学是研究 物质的微观结构及其宏观性能关系 的科学。 2. 测不准原理意义是: 不可能同时准确测定微观体系的位置坐标和动量 。 3. 态叠加原理是: 由描述某微观体系状态的多个波函数ψi 线性组合而成的波函数ψ也能描述这个微观体系的状态 。 4. 若Schr?dinger(薛定谔)方程?ψ = E ψ成立,力学量算符?对应的本征值是 E 。 5. 变分原理: 用试探波函数求解所得到体系的能量总是不低于体系基态真实的能量 。 6. H 2+成键轨道是 ψ1 ,反键轨道是 ψ2 ,电子总能量是ab S E ++= 11β α,键级为 0.5 。 7. 等性sp 3杂化,杂化指数是 3 。该杂化轨道p p s s sp c c 22223φφ+=Φ,则2 1c +2 2c = 1 。 8. 根据休克尔分子轨道(HMO)理论,苯分子中六个π电子的离域能是: 2β 。 9. O 2分子的键级是 2 , 分子中有 2 个单电子,分子是顺磁性,磁矩为2.828 B. M.。 10. 丁二烯分子C (1)H 2—C (2)H —C (3)H —C (4)H 2的四个π分子轨道和能级分别是: ψ1 = 0.3717φ1 + 0.6015φ2 + 0.6015φ3 + 0.3717φ4, E 1 = α + 1.618β ψ2 = 0.6015φ1 + 0.3717φ2 - 0.3717φ3 - 0.6015φ4, E 2 = α + 0.618β ψ3 = 0.6015φ1 - 0.3717φ2 - 0.3717φ3 + 0.6015φ4, E 3 = α - 0.618β ψ4 = 0.3717φ1 - 0.6015φ2 + 0.6015φ3 - 0.3717φ4, E 4 = α - 1.618β 由此可知,丁二烯π分子轨道的HOMO 是ψ2, LUMO 是 ψ3 , 四个π电子的总能量是4α + 4.742β, 这四个π电子的稳定化能是 |0.742β| ; C (1)—C (2)之间总键级为 1.894 , C (2)—C (3)之间的总键级为 1.447 ; 已知碳原子的最大成键度是4.732,则C (1)的自由价为 0.838 , C (2)的自由价为 0.391 。 二、单项选择题(本大题共10小题,每小题2分,共20分) 11. (A) 12. (C) 13. (D) 14. (A) 15. (A) 16. (D) 17. (D) 18. (D) 19. (B) 20. (B) 三、判断题(本大题共10小题,每小题1分,共10分):对的在括号内画√,错的画× 21. × 22. √ 23. √ 24. √ 25. √ 26. √ 27. √ 28. √ 29. √ 30. √ 四、名词解释(本题共5小题,每小题2分,共10分) 31. [分子]: 保持物质化学性质不变的最小微粒 32. [分子轨道]: 描述分子中电子运动状态的数学函数式 33. [算符]: 用于计算力学量的运算规则 34. [分裂能]: 配位中心原子(过渡金属原子或离子)在配位场作用下其d 轨道分裂为高能级和低能级,高–低能级差即分裂能 35. [John –Teller(姜泰勒)效应]: 过渡金属原子或离子在配位场作用下其d 轨道分裂后使d 轨道中电子分布不均而导致配合物偏离正多面体的现象 五、计算题(本大题共4小题,任选两小题,每小题10分,共20分) 36. 对共轭体系: 将π 10-9 米,计算π电子跃迁时所吸解:分子中共有10个π电子,电子排布为: 252 42322 21ψψψψψ。电子从能量最高的占据轨道5ψ跃迁到能量最低的轨道6ψ上所需要的能量: 192 9312 3422222210925.3) 103.1(101.98)10626.6()56(8)56(----?=??????-=-=?ml h E n (焦) ()() 1119 8 3410064.510 925.310998.210626.6---?=????=?=E hc λ(米) 37. 用Slater(斯莱脱)方法计算可知, 对电子组态为(1s)2(2s)2(2p)6(3s)2(3p)6(4s)1的4s 电子,其屏蔽常数8.164=s σ;对电子组态为(1s)2(2s)2(2p)6(3s)2(3p)6(3d)1的3d 轨道上的电子,其屏蔽常数为18.0。试通过计算证明: 钾原子基态的电子组态应该是(1s)2(2s)2(2p)6(3s)2(3p)6(4s)1。 解: 114.442.26.136.132222 *4-=-=-=n Z E s (e.v.), 511.13 16.136.1322 22 *3-=-=-=n Z E d (e.v.) E 3d > E 4s ,电子优先填充4s 轨道, K 原子电子组态应该是: (1s)2(2s)2(2p)6(3s)2(3p)6(4s)1
