液相阻断ELISA检测方法

一、亚洲I型口蹄疫抗体液相阻断 ELISA 试验操作方法
一、试验器材准备
1.移液器:5-50μl移液器、0.2—10μl移液器、50—200μl移液器、50
—300μl 12道移液器各一把。
2.移液枪尖 (若干)。
3.抗原抗体反应板:微量血凝板(U型、V型均可)5块,本试剂盒配备两块,用于被检血清的稀释和抗原抗体反应。注:抗原抗体反应板可重复使用,实验后,用水冲洗干净,然后用无离子水沸水浴30秒,晾干,待用。
4.超纯水 , 无离子水或蒸馏水。
二、试剂准备
1.包被缓冲液(PH9.6)
将所购试剂盒配备的碳酸盐缓冲液胶囊1粒小心打开,将胶囊内粉末倒入100ml无离子水中溶解即可。4℃存放,1月内有效。
2. 洗涤液(PBST)
将试剂盒配备的 25 倍浓缩 PBST 液(可能有结晶形成,用时微热溶化)用无离子水或蒸馏水做1:25稀释。(如果PH降低,务必用NaOH调至7.4)
3.底物溶液
取1片柠檬酸—磷酸盐片剂(试剂盒配备)溶于100mL无离子水中,溶化后,取50mL溶液, 再加1片邻苯二胺(OPD)片剂,充分溶解,分装(5mL/ 瓶或 10Ml ∕瓶 ), 避光之-2O℃保存。用前避光溶化 ,临时每1mL上述溶液加 10μL
本试剂盒配备的 3% 的双氧水(H
20
2
) 。
三、操作步骤
1.用包被缓冲液稀释亚洲 1 型口蹄疫病毒兔抗血清至工作浓(1:1000), 在 ELISA 板上每孔加 50μl, 振荡 , 封板或置湿盒内,室温过夜。
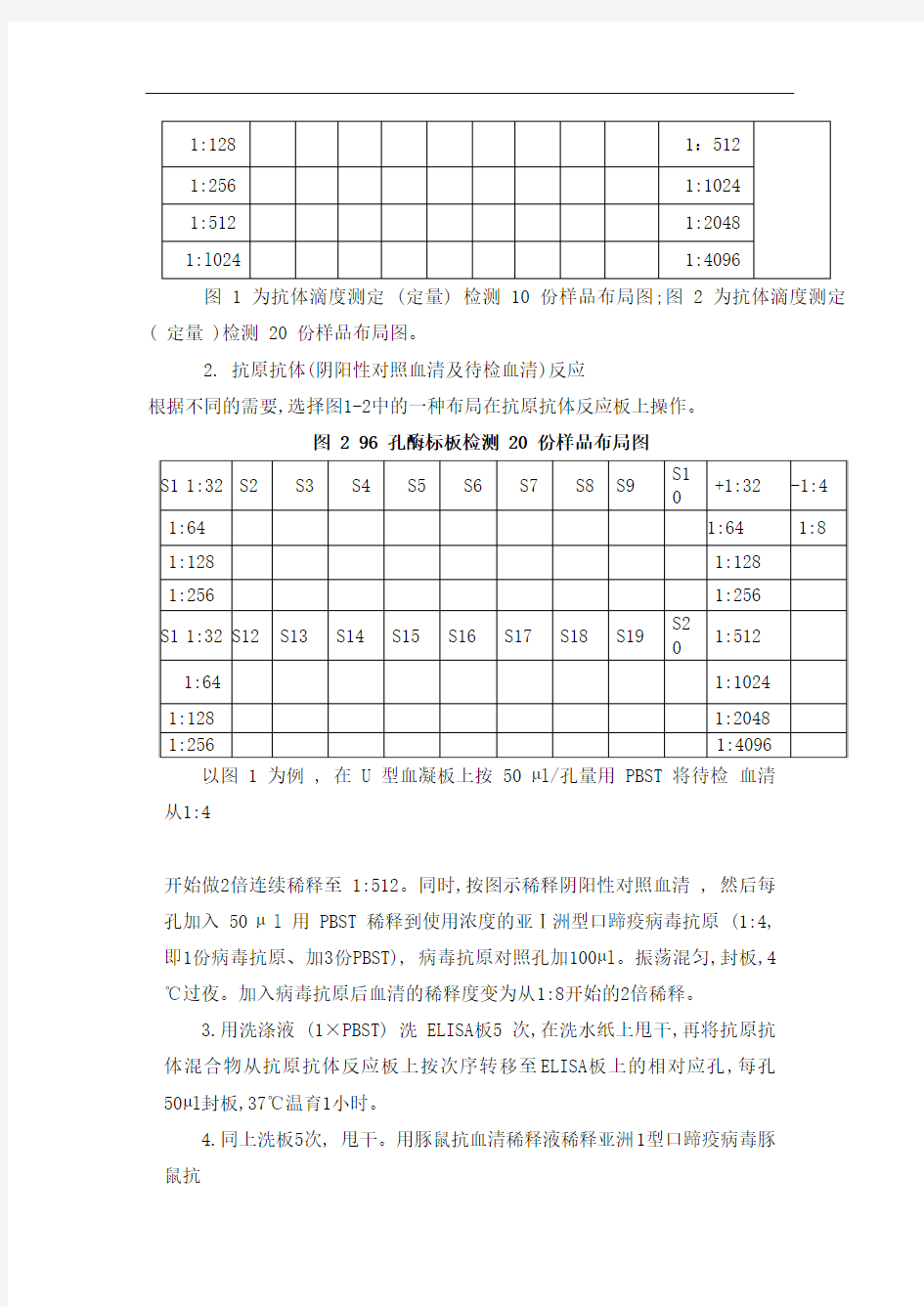
图 1 96 孔酶标板检测 10 份样品布局图
图 1 为抗体滴度测定 (定量) 检测 10 份样品布局图;图 2 为抗体滴度测定( 定量 )检测 20 份样品布局图。
2. 抗原抗体(阴阳性对照血清及待检血清)反应
根据不同的需要,选择图1-2中的一种布局在抗原抗体反应板上操作。
图 2 96 孔酶标板检测 20 份样品布局图
以图 1 为例 , 在 U 型血凝板上按 50 μl/孔量用 PBST 将待检血清
从1:4
开始做2倍连续稀释至 1:512。同时,按图示稀释阴阳性对照血清 , 然后每
孔加入 50 μ l 用 PBST 稀释到使用浓度的亚Ⅰ洲型口蹄疫病毒抗原 (1:4,
即1份病毒抗原、加3份PBST), 病毒抗原对照孔加100μl。振荡混匀,封板,4
℃过夜。加入病毒抗原后血清的稀释度变为从1:8开始的2倍稀释。
3.用洗涤液 (1×PBST) 洗 ELISA板5 次,在洗水纸上甩干,再将抗原抗
体混合物从抗原抗体反应板上按次序转移至ELISA板上的相对应孔,每孔
50μl封板,37℃温育1小时。
4.同上洗板5次, 甩干。用豚鼠抗血清稀释液稀释亚洲1型口蹄疫病毒豚
鼠抗
血清至工作浓度 (1:1000), 每孔加50μl,封板,37℃温育1小时。
5.同上洗板 5 次 , 甩干。用 l×PBST 稀释兔抗豚鼠酶结合物至工作浓度 (1:500), 每孔加 50 μl 封板 ,37 ℃温育 1 小时。
6. 同上洗板5次,每孔加50μl底物溶液 (务必加双氧水),37℃温育15分钟。每孔再加50μl终止液终止反应,立即在492nm波长下读取光吸收值(OD
492nm 值)。
四、结果判定
1. 试验认可标准
每块板设 4 孔病毒抗原对照,病毒抗原对照不加任何血清,直接用PBST 稀释至使用浓度,与血清/病毒抗原复合物同步加入ELISA板孔,50μl/孔,病毒抗原对照OD492nm 值应在1.5±0.5范围内。阳性对照抗体效价应在1:1024±1滴度以内,阴性对照血清抗体效价应<1:8。
2.病毒抗原对照平均OD492nm 值50%计算(临界值)
抗原对照是4孔,弃去最高和最低OD492nm值,计算剩余2孔的平均OD492nm值,再除以2,即50%对照值。该值即为临界值,表示阻断50%反应的对照OD492nm值。
3.结果判定
以病毒抗原对照平均OD492nm 值的50%为临界值,被检血清稀释孔OD492nm值大于临界值的孔为阴性孔,小于或等于临界值的孔为阳性孔,阳性孔的OD492nm值
等于临界值时所对应的稀释度为该份血清的抗体滴度。例如病毒抗原对照平均OD492nm值为1.2,则其50%为0.60。若某一待检血清在1:128时OD492nm值为0.6,则该份待检血清的抗体滴度为 1:128 。若临界值处于两个滴度之间 ,如处于1:64与1:128之间,则抗体滴度取中间值为1:9O。定性检测中 , 两个重复孔只要有一孔为阳性孔 , 则抗体滴度判定为 1:128, 两孔均为阳性孔 , 则判定为抗体滴度>1:128 。
ELISA抗体效价≥1:128,判定为亚洲 1 型口蹄疫抗体阳性。
ELISA抗体效价与保护力的关系:牛、羊:抗体效价≥1:128,99% 保护;
效价≤1:16, 不保护;效价在1:22-90之间,50%保护。
Waters_2695_型高效液相色谱仪操作方法
Waters 2695 型高效液相色谱仪操作方法 1 仪器组成及开机 1.1 仪器组成本仪器由Waters 2695 分离单元、2996型二极管阵列检测器、2420蒸发光散射检测器、色谱管理工作站和打印机组成。 2695 分离单元包括四元梯度洗脱的溶剂输送系统,四通道在线真空脱气机(或氦气脱气机),可容纳120 个样品瓶的自动进样系统,柱温箱,内置的柱塞杆密封垫清洗系统,溶剂瓶托盘,液晶显示器,键盘用户界面及软盘驱动器。 1.2 开机依次接通2695 分离单元、检测器、计算机和打印机的电源。接通2695 分离单元后,约20s 仪器开始自检,约1min 后,显示主屏幕,此时继续各部件的初始化,待主屏幕上方标题区出现“Idle ”时,仪器进入待命状态。 2 溶剂管理系统的准备 2.1 流动相脱气确认所有溶剂管路都充满溶剂,按【Menu/Status 】,进入“Status (1 )”屏幕,光标选“Degasser ”,按【Enter 】,显示选项屏幕,光标下移选“Continuous ”,按【Enter 】。 2.2 启动溶剂管理系统 2.2.1 干启动,当溶剂的管路是干的或是需要更换溶剂时,在“Status (1 )”屏幕下,按【Direct Function 】,光标选“Dry Prime ”,按【Enter 】,显示“Dry Prime ”屏幕,按欲启动的溶剂管路的屏幕键,如【OpenA 】,光标选“Duration ”,按数字键输入5min ,按【Continue 】,待限定时间结束后,重复操作,使实验所需的各溶剂管路均启动、排气并充满流动相。 2.2.2 湿启动在“Status (1 )”屏幕下,光标选“Compomtion ”中欲使用的流动相,输入10 0%,按【Direct Function 】,光标选“Wet Prime ”,按【Enter 】,显示“Wet Prime ”屏幕,输入7.5Ml/min 和6min ,按【OK 】,待限定时间结束后,对每种流动相重复操作。 2.2.3 平衡真空脱气机在“Status (1 )”屏幕下,光标选“Composition ”,输入流动相的组成,按【Enter 】再用光标选“Degasser ”中的“Normal ”,按【Enter 】,按【Direct Function 】,光标选“Wet Prime ”,输入0.000mL/min 和10min. ,按【OK 】。待限定时间结束后,按【Abort Prime 】。 3 样品管理系统的准备 3.1 冲洗自动进样器在“Status (1 )”屏幕下,光标选“Composition ”,输入流动相的组成。按【Direct Function 】,光标选“PurgeInjector ”,按【Enter 】,显示“Purge Injector ”屏幕,输入“Sample Loop Volumes 6.0 ”,光标下移“Compression Check ”,按任意数字键,按【OK 】。 3.2 冲洗进样针在主屏幕下,按【Diag 】,显示“Diagnositcs ”屏幕,按【Prime Ndl Wash 】,显示“Prime Needle Wash ”屏幕,按【Start 】,30s 内应见溶剂从废液排放口流出。按【Close】、【Exit 】。 3.3 冲洗柱塞杆密封垫在主屏幕下,按【Diag 】,显示“Diagnosities ”屏幕,按Prime Seal Wash ,显示“Prime Seal Wash ”屏幕,按【Start 】,待排放口有水流出,按【Halt 】、【Close】、【Exit 】。 3.4 装入样品与转盘将样品瓶插到样品盘合适的位置,打开样品仓门,显示“Door is Open ”屏幕,装入样品盘,按【Next 】,直至所有样品盘装毕,关仓门。 4 编辑分析方法及执行样品分析表 在主屏幕下,按【Develop Methods 】,显示“Methods ”屏幕。 4.1 编辑分析方法 4.1.1 建立新的分离方法在“Method ”屏幕下,按【New 】、【Separation Methods 】,输入方法名,按【Enter 】,显示分离方法屏幕,该屏幕共有6 页,通过按【Next 】或【Prev 】切换。如需设定梯度,在第( 1 )页按【Gradient 】,输入后按【Exit 】;如需设定色谱柱的温度,在第( 4 )页输入后按【Exit 】;在第(6 )页设定检测器的种类,光标选“Absorbance Detector ”,按【Enter 】,光标选“48 6﹨2487 ”,按Abs (1 )图标,设定检测波长,按【OK 】、【Exit 】、【Save 】。 4.1.2 编辑已建立的分离方法在“Methods ”屏幕下,光标选欲编辑﹨修改的分离方法的图标,按【Edit 】,编辑\ 改各种分析参数,按【Exit 】、【Save 】。 4.2 编辑执行样品分析表 4.2.1 建立新的样品组在“Methods ”屏幕下,按【New 】、【Sample Set 】,输入样品组名,按【Enter 】,显示方法组屏幕,在样品组表中输入待分析样品的信息。在“Vial ”中输入样品放置的位
ELISA检测方法有哪些
ELISA检测方法有哪些? 酶联免疫吸附测定(Enzyme Linked ImmunoSorbent Assay,ELISA)是研究蛋白抗体的重要方法。它是采用抗原与抗体的特异结合将被测物质与酶标抗体进行直接或间接结合,然后通过标记酶与底物产生颜色反应进行定性和定量分析。那么,它与其它检测方法的灵敏度及您了解吗?跟着小编往下看 ELISA通常分为四种类型:直接法、间接法、竞争法、夹心法等,直接上图: 直接法(Direct ELISA)仅需要抗原和酶标一抗,操作简便,可避免交叉反应,然而该方法要求酶标一抗有较高的特异性要求,同时也并非所有的一抗适合标记处理。直接法在实际运用中并不多见,它并不能对样本中抗体进行定量分析,因为样本中抗体是非酶标抗体,无法进行后续显色,但是该法经过改进就是竞争性ELISA方法,见后文。 间接法(Indirect ELISA)使用了二抗增加信号强度,也使抗体的选择多样化,然而间接法容易产生交叉反应。间接法只能用于测定抗体,主要用于疾病的诊断,其优点是只需要改变包被抗原,酶标抗体是通用的。 夹心法(Sandwich ELISA)分为双抗体夹心法和双抗原夹心法: 双抗体夹心法中抗原被两个抗体——捕捉抗体和检测抗体,结合于不同位点。捕捉抗体固定于载体上,检测抗体通过结合抗原进行显色分析。应用于双抗体夹心法检测的抗体需是单抗,而且对同一抗原结合位点不同,如此才能避免交叉反应或两种抗体竞争性结合同一位点。夹心法具有高灵敏度、高专一性的优势,但该法只适用于有多个结合位点的抗原检测,主要用于检测各种大分子抗原——例如在医学检测中测定HBsAg、HBeAg、AFP等。由于双抗体夹心法特异性高,在检测过程中有时会将样本和酶标抗体同时加入进行反应(一步法),此时如果样本中抗原含量过高会导致其与固相抗体和酶标抗体均有结合而不形成“夹心复合物”,
高效液相色谱仪操作步骤
高效液相色谱仪操作步骤: 1).过滤流动相,根据需要选择不同的滤膜(0.45um)。 2).对抽滤后的流动相进行超声脱气10-20分钟。 3).打开HPLC工作站(包括计算机软件和色谱仪),连接好流动相管道,连接检测系统。 4).进入HPLC控制界面主菜单,点击manual,进入手动菜单。 5).有一段时间没用,或者换了新的流动相,需要先冲洗泵和进样阀。冲洗泵,直接在泵的出水口,用针头抽取。冲洗进样阀,需要在manual菜单下,先点击purge,再点击start,冲洗时速度不要超过10 ml/min。 6).调节流量,初次使用新的流动相,可以先试一下压力,流速越大,压力越大,一般不要超过2000。点击injure,选用合适的流速,点击on,走基线,观察基线的情况。 7).设计走样方法。点击file,选取select users and methods,可以选取现有的各种走样方法。若需建立一个新的方法,点击new method。选取需要的配件,包括进样阀,泵,检测器等,根据需要而不同。选完后,点击protocol。一个完整的走样方法需要包括:a.进样前的稳流,一般2-5分钟;b.基线归零;c.进样阀的loading-inject转换;d.走样时间,随不同的样品而不同。 8).进样和进样后操作。选定走样方法,点击start。进样,所有的样品均需过滤。方法走完后,点击postrun,可记录数据和做标记等。全部样品走完后,再用上面的方法走一段基线,洗掉剩余物。 9).关机时,先关计算机,再关液相色谱。 10).填写登记本,由负责人签字。 注意事项: 1).流动相均需色谱纯度,水用20M的去离子水。脱气后的流动相要小心振动尽量不引起气泡。 2).柱子是非常脆弱的,第一次做的方法,先不要让液体过柱子。 3).所有过柱子的液体均需严格的过滤。
高效液相色检验方法验证方案
型高效液相色谱仪 测定川芎含量检验方法验证方案 文件编号 S-YF-013(01) 起草人崔英南日期 2012年08月26日审核人日期 2012年08月31日批准人李立新日期 2012年08月31日生效日期 2012年09月01日 验证项目申请单
文件编号: 验证项目计划书文件编号:
验证方案审批表吉
目录
1再确认目的 2再确认范围 3再确认责任 4内容 概述 再确认内容 再确认小组 4.2.2 预确认 4.2.3 安装确认 4.2.4 运行确认 4.2.5 性能确认 4.2.6 结果分析与评价4.2.7 再确认周期
目的 确认经设备确认高效液相,按药典检验方法测定生产品种含量,验证其检验结果科学性、准确性、精密性等,满足检验结果正确性需要,有效控制产品质量。 提供必要的文件以证实本设备的操作与所预期的完全一致。 根据本方案的验证,确认按检验操作规程操作,能有效的保持本设备于确认状态下,能稳定地、恒定地达成其所预期的功能。 范围 质量标准、检验操作规程文件的汇集。 验证设备用于含量测定检验方法的准确性在标准范围内 验证设备用于含量测定检验方法的精密度可靠性 验证设备用于含量测定检验方法,在设计的范围内,测试结果与供试品中被测物尝试直接呈正比关系的程度。 验证设备用于含量测定检验方法具有专属性。 验证设备用于含量测定检验方法在达到一定精密度、准确度和线性时,其测定值高低限在可控范围内。 验证设备用于含量测定检验方法的耐用性。 责任 质量管理部负责验证方案的起草,申请审批,验证过程的监督、资料的存档,再确认方案的执行及再确认结果的评估。 化验室负责实验的操作,原始记录、报告的填写。
高效液相色谱方法的验证
高效液相色谱方法的验证 ?方法验证的目的 ?方法验证的内容 ?方法验证的项目及测定方法
方法验证的目的 目的:证明采用的方法适合相应检测的要求。 方法验证是实验室针对特定方法的研究过程,通过设计方案,有步骤、系统地收集、处理实验数据,最终形成文件,以证明所用试验方法准确、灵敏、专属并重现。同一分析方法用于不同的检测项目会有不同的验证要求。
方法验证的内容 ?准确度 ?精密度 ?专属性 ?检测限 ?定量限 ?线性和范围 ?耐用性
准确度 定义:方法测定结果与真实值或参考值的接近程度。一般用回收率%表示。 1. 主成分含量测定 原料药:对照品或方法比对 2. 制剂、中药:标准加样回收 杂质定量 测定:加样回收(n 3 9) 杂质对照品 方法比对 回收率 C-A %=′ B 100% 杂质与主成分的相对含量 A:试验供试品中被测成分的量 (通常为含量测定量的50%) B: 试验供试品中加入的对照品的量 (通常为±20%) C:试验测定值
精密度 定义:在规定测试条件下,同一个均匀供试品,经多次取样测定所得结果之间的接近程度。一般用偏差,相对偏差和相对标准偏差 1. 重复性(n 9) 3 2. 中间精密度 3. 重复性 测定:HPLC方法的精密度测试,应从样品制备开始,设计3个浓度, 分别平行制备3份,以测定含量计算相对标准偏差;或同一样品平行制备6份供试品,分别进样,以峰面积计算相对标准偏差。 同一份供试品连续进样6次,计算得到的相对标准偏差只能表征进样精密度,不能作为方法精密度。
专属性 定义:在其它成分可能存在下,方法能正确测定出被测物的特性。 1. 鉴别反应 2. 含量测定 杂质测定 测定: 限量检查 空白制剂,模拟复方 加速破坏试样测试 DAD峰纯度检查
HIV实验室ELISA检测方法
人类免疫缺陷病毒抗体诊断试剂盒(酶联免疫法) 1 试剂信息 试剂厂家:北京万泰生物药业股份有限公司 2 样本要求 2.1 本试剂使用样品为人血清或血浆,含有EDTA、柠檬酸钠或肝素等抗凝剂的样品可用于本实验。 2.2 不能检测含悬浮纤维蛋白或聚集物,重度溶血的样品。 2.3 样品中应无微生物,可在2-8℃储存1周,长期储存应低温冻存,避免反复冻融。 2.4 使用前请将样品室温平衡30分钟以上,冷冻样品实验前需混匀。 3 检测步骤 3.1 配液:将浓缩洗涤液用蒸馏水或去离子水20倍稀释。 3.2 编号:将样品对应微孔板按序编号,每板应设阴性对照3孔,阳性对照1型、2型各1孔、空白对照1孔。 3.3 加样:分别在相应孔中加入待测样品或阴、阳性对照100μL。 3.4 温育:用封板膜封板后,置37±1℃温育60±2分钟。 3.5 洗板:小心揭掉封板膜,用洗板机洗涤5遍,最后一次尽量扣干。 3.6 加酶:每孔加入酶标试剂100μL,空白孔除外。 3.7 温育:用封板膜封板后,置37±1℃温育60±2分钟。 3.8 洗板:操作同步骤5。 3.9 显色:每孔加入显色剂A、B液各50μL,轻轻震荡混匀,37±1℃避光显色30±1分钟。 3.10 测定:每孔加入终止液50μL,轻轻振荡混匀,10分钟内测定结果。 4 参考值 临界值(CUTOFF)计算:临界值=阴性对照A均值+0.12. 5 检验结果的解释 5.1 阴性对照孔A值≦0.10,阳性对照A值≧0.80,否则试验无效。 5.2 若有1孔阴性对照A值大于0.1应舍弃,若两孔或两孔以上阴性对照A值大于0.1,应重复试验。
5.3 阴性判定:样品A值<临界值(CUTOFF)者为HIV抗体阴性。 5.4 阳性判定:样品A值≧临界值(CUTOFF)者为HIV抗体阳性。(注意:初试阳性应重新取样双孔复试。复试阳性者应按《全国艾滋病检测技术规范》送HIV确证实验室进行确证实验。)
高效液相色谱仪的操作步骤及注意事项
高效液相色谱仪的操作步骤及注意事项 一、操作步骤: 1.开机前先将流动相过滤和超声:水流动相用混合滤膜(0.2μm)过滤,有机流动相用有机滤膜过滤,之后超声脱气15-20分钟。(过滤的目的是除去流动相里的杂质,以免杂质进入色谱柱堵塞色谱柱;超声的目的是排除流动相里面的气体,以防气体进入色谱柱损害色谱柱,影响柱效能) 注:试验过程中由于只有0.45μm的混合滤膜,第一次使用时感觉效果不好,于是过滤水时同时使用两张混合滤膜过滤水流动相。 2.超声结束后,将流动相放置到规定位置(1号泵接水流动相,2号泵接有机流动相),开机逐个排气(先启动泵,排气结束后再打开检测器)。 3.排气结束后,关闭所有排气阀。先用纯有机流动相冲洗色谱柱20-30分钟,基线走稳之后,再打开水流动相(注意:水流动相和有机流动相流速之和为1ml/min),继续走基线,直到基线平稳。 注意:实验结束后,再用纯有机流动相冲洗色谱柱20-30分钟,冲出色谱柱内残留的样品物质,预防长时间不使用仪器样品的残留物质沉积在色谱柱内,导致下次使用难以冲出,色谱柱柱压偏高,基线不稳,出现大量鬼峰。(不同规格的色谱柱其所允许的最大流速之和不同) 4.走基线时,应将进样阀处于Load状态,用注射器进样时应快速进样,进样后将进样阀立即扳回到Inject状态,此时液相系统开始进入采样状态。采样结束后,可在数据分析里面查看分析结果并可进行编辑,也可以在脱机状态下查看样品的分析结果并编辑。 二、使用中常见的问题及注意事项 1.过滤时有时会出现流动相漏液。可能的原因是滤膜放置不正确(有点偏)和接头有点错位,导致流动相从缝隙中漏出。 注意:操作时,应先向滤瓶内倒入少量流动相,观察是否漏液并开始过滤,若未漏液,再向滤瓶中添加流动相。 2.超声时,瓶外液体的液面应高于瓶内流动相的液面,否则流动相内的气体可能无法排出液体,气体仍然残留在流动相内,以致开机排气时无气泡排出。
ELISA检测
ELISA检测 ----- 固相捕获法测IgM抗体 在病原体急性感染的诊断中,通常需检测IgM抗体,如急性甲型肝炎诊断的血清抗HAVIgM检测、急性乙型肝炎病毒感染的血清抗HBc lgM检测和TORCH项目的系列IgM检测等。IgM抗体也有使用间接法测定的,如目前在市场上可见到的有些TORCH系列的IgM检测试剂盒。在使用间接法测IgM抗体时,由于临床血清样本中含有高浓度的IgG抗体,其中部分特异IgG抗体将与IgM抗体竞争与固相抗原结合,从而干扰IgM抗体的检测。 因此,在使用间接法测定IgM抗体时,通常须将血清样本用抗人IgG抗体或SPA预处理,以去除IgG的干扰。这样不但测定较为繁琐,而且影响测定的特异性和灵敏度。目前,常用的IgM抗体检测方法为捕获法,即以抗人IgM抗体(抗人u链)作为固相抗体,当加入血清标本时,其中的IgM类抗体(特异的和非特异的)即可被固相抗体捕获,再加入特异抗原,其与固相上捕获的IgM抗体结合后,加入酶标抗特异抗原的抗体,最后加入底物显色。具体操作步骤如下: 1.首先将抗人IgMbt链抗体于碳酸盐缓冲液中40c下过夜包被聚苯乙烯等固相,形成固相抗体,洗涤去除未与固相结合或结合不紧的抗体后,用小牛血清或牛血清白蛋白等封闭,洗涤去除未结合的部分及杂质。 2.加入含待测IgM抗体的临床样本如血清等,温育一定时间后洗板;此时,待测样本中的IgM抗体就会与固相上的抗P链抗体反应而吸附于固相上。 3.加入特异的抗原如HAV抗原、HBcAg等,温育一定时间后洗板;此时,特异抗原就会与固相上的特异IgM抗体发生反应。 4.加入酶标记的抗特异抗原的抗体,温育一定时间后洗板;此时,在固相上即形成相应的抗原抗体复合物。 5.加入酶底物,温育显色测定 本方法要着重注意的是RF(1gM类)及其他非特异IgM的干扰。RF(1gM类)由于其能与固相抗人u 链抗体结合,并可与随后加入的酶标抗体(动物IgG)反应,从而导致假阳性反应。而非特异IgM由于其
高效液相色谱使用方法
高效液相色谱使用方法 一、开机 1、开机前准备:流动相使用前必须过0.45um的滤膜(有机相的流动相必须为色谱纯;水相必须用新鲜注射用水,不能使用超过3天的注射用水,以防止长菌或长藻类);把流动相放入溶剂瓶中。A瓶:为水相B瓶:为有机相。 2、打开电脑,选Win 2000,进入Win 2000界面。 3、双击CAG Boodp server图标,放大CAG Boodp server小图标,出现窗口,5min内打开液相各部件电源开关,等待1100广播信息后,表示通讯成功连接,关闭CAG Boodp serve窗口。 4、双击online图标,仪器自检,进入工作站。 该页面主要由以下几部分组成: ——最上方为命令栏,依次为File,Run Control,Instrumen…等; ——命令栏下方为快捷操作图标,如多个样品连续进行分析、单个样品进样分析、调用文件保存文件……等; ——中部为工作站各部件的工作流程示意图;依次为进样器-输液泵-柱温箱-检测器-数据处理-报告; ——中下部为动态监测信号; ——右下部为色谱工作参数:进样体积、流速、分析停止时间、流动相比例、柱温、检测波长等。 4、从“View”菜单中选择“Method and control”画面。 二、编辑参数及方法 1、开始编辑完整方法: 从“Method”菜单中选择“New method”,出现DEF-LC.M,从“Method”菜单中选择“Edit entire method”,选择方法信息、仪器参数及收集参数、数据分析参数和运行时间表等各项,单击OK,进入下一画面。 2、方法信息: 在“Method Comments”中加入方法的信息,如方法的用途等。单击OK,进入下一画面。 3、泵参数设定:
高效液相色谱法测定含量示例的方法再确证
高效液相色谱法测定含量示例的方法再确证作者:张建芝冯顺 来源:《维吾尔医药》2013年第07期 摘要:目的:确证用反相高效液相色谱法测定头孢氨苄含量的方法有效性和准确性。方法:以Diamonsil CLC-ODS(150mm x 6mm,10 lm)为色谱柱,水-甲醇- 3.89% 醋酸钠溶液- 4% 醋酸溶液(700:300:15:3)为流动相,检测波长为254 nm,外标法定量。结果:头孢氨苄浓度线性范围为0.02~0.20mg / ml,相关系数r= 0.9991,方法重复性试验 RSD为 1.42%。结论:该方法可简单高效地完成,结果准确性好、稳定可靠,确证高效液相色谱依然为头孢氨苄制剂的质量控制中有效可靠的方法。 关键词:头孢氨苄高效液相色谱法 头孢氨芐(Cefalexin,又译先锋霉素Ⅳ、头孢力新等)是一种半合成的第一代口服头孢霉素类类抗生素药物,化学名(6R,7R)-3-甲基-7-[(R)-2-氨基-2-苯乙酰氨基]-8-氧代-5-硫杂-1-氮杂双环[4.2.0]辛-2-烯-2-甲酸,化学式C16H17N3O4S,在临床上广为使用。其含量测定在旧版的中国药典( 1995年版)采用碘量法○1。但此法不仅操作步骤繁多,费工费时,干扰因素多;然后人们发明采用高效液相色谱法内标法测定的方法,但内标物保留时间过长,依然存在问题。最后人们又发现采用高效液相色谱法,用外标法测定其含量,方法操作简单方便、数据准确可靠,灵敏度较高,重复性好,最终获得了较为满意的结果○2。现在本文对这个方法进行确证,以确定该方法的有效性和准确性。 1.仪器与试药 分析天平(precisa instrument ltd switzer land xs 225a precisa ),高效液相色谱柱(diamonsic C18 250 * 46mm),检测器(UVD 170v),泵(P680 HPLC pump),头孢氨苄胶囊(广州白云山制药总厂批号:2110102) 2. 色谱条件 用十八烷基硅烷键和硅胶为填充剂:水-甲醇- 3.89% 醋酸钠溶液 - 4% 醋酸溶液(700:300:15:3)为流动相;检测波长为254nm;理论塔板数按头孢氨苄峰计算不低于1500。 3. 实验试剂制备 3.1 对照品储备液的制备:对照品储备液的制备:取头孢氨苄对照品约10mg,精密称定,置10ml量瓶中,加流动相稀释至刻度,摇匀,为对照品储备液。 3.2 供试品溶液的制备:去装量差异项下的内容物,混合均匀,精密量取适量(约相当于头孢氨苄0.1g),置于 100ml 容量瓶里,加流动相适量,充分振摇使溶解,再加流动相稀释至
ELISA检测方法
ELISA(酶联免疫吸附测定,enzyme linked immunosorbent assay)指将可溶性的抗原或抗体结合到聚苯乙烯等固相载体上,利用抗原抗体结合专一性进行免疫反应的定性和定量检测方法。 基本原理: ①使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。 ②使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。 ③在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。 ④加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅有无定性或定量分析。由于酶的催化效率很高,故可极大地放大反应效果,从而使测定方法达到很高的敏感度。 双抗夹心法 夹心法常用于检测大分子抗原,一般的操作步骤为: ①将具有专一性的抗体固著于塑胶孔盘上,完成后洗去多余抗体; ②加入待测检体,检体中若含有待测的抗原,则其会与塑胶孔盘上的抗体进行专一性键结; ③洗去多余待测检体,加入另一种对抗原专一的一次抗体,与待测抗原进行键结; ④洗去多余未键结一次抗体,加入带有酶的二次抗体,与一次抗体键结; ⑤洗去多余未键结二次抗体,加入酶底物使酵素呈色,以肉眼或仪器读取呈色结果。 间接法 间接法常用于检测抗体,一般的操作步骤为: ①将已知的抗原固著于塑胶孔盘上,完成后洗去多余的抗原。
②加入待测检体,检体中若含有待测的一次抗体,则其会与塑胶孔盘上的抗原进行专一性键结。 ③洗去多余待测检体,加入带有酶的二次抗体,与待测的一次抗体键结。 ④洗去多余未键结二次抗体,加入酶底物使酶呈色,藉仪器(ELISA reader)测定塑胶盘中的吸光值(OD值),以评估有色终产物的含量即可测量待测抗体的含量。 竞争法 竞争法是一种较少用到的ELISA检测机制,一般用于检测小分子抗原,其操作步骤为: ①将具有专一性的抗体固著于塑胶孔盘上,完成后洗去多余抗体; ②加入待测检体,使检体中的待测抗原与塑胶孔盘上的抗体进行专一性键结; ③加入带有酶的抗原,此抗原也可与塑胶孔盘上的抗体进行专一性键结,由于塑胶孔盘上固著的抗体数量有限,因此当检体中抗原的量越多,则带有酶的抗原可键结的固著抗体就越少,亦即,两种抗原皆竞相与塑胶孔盘上抗体键结,即所谓竞争法之由来。 ④洗去检体与带有酶的抗原,加入酶底物使酶呈色,当检体中抗原量越多,代表塑胶孔盘内留下之带有酶的抗原越少,显色也就越浅。 注:当需要侦测无法获得两种以上单一性抗体的抗原,或是不易得到足够的纯化抗体以固著于孔盘上时,一般会考虑使用竞争法ELISA。
岛津高效液相色谱LC-20AT操作流程
岛津高效液相色谱LC-20AT操作流程 1.开机 依次打开泵、自动进样器、柱温箱、检测器和控制台(最后打开控制台),再打开电脑,开启LCsolution 软件,点击“仪器1”按钮,出现设置界面。 2.装载方法文件 打开液相操作方法文件(如有更改,更改完后先保存),点击软件中“仪器开关”和“泵开关”按钮(若设置柱温,点击“柱温箱”的按钮)。开启仪器和电脑的连接;点击“下载”按钮,装载操作方法。 3.进样 将样品加入进样瓶中,放在样品架上,记下放置的位置编号。 3.1 单次进样 点击“单次运行”按钮,出现单次运行的对话框。核实方法文件的出处和名称,核实数据文件的出处和名称。输入样品瓶和进样体积。 (样品架输入“1”;如果是空针,样品瓶输入“-1”)。完成后,点击“确定”,开始检测。 3.2自动进样 点击“批处理”按钮,出现批处理表。依次输入“样品瓶” (样品瓶编号)、“样品架名称”(输入1)、方法文件、数据文件、进样体积。输完后,保存批处理文件,然后点击“批处理开始”按钮。 4.关机 点击“仪器开关”和“泵开关”按钮(包括柱温箱),将其从凹陷状态,变成凸出状态。关闭软件,关掉电脑。依次关掉控制台、检测器、柱温箱、自动进样器、泵。 5.脱气 5.1 泵的脱气 更换流动相,或者其他操作,只要吸滤头与空气接触,都需进行在线脱气。 将泵的脱气阀逆时针转动45~90度,点击仪器上“purge”按钮,进行脱气。脱气自动结束,再将脱气阀顺时针拧紧。
5.2 自动进样器的脱气 在方法文件中设置脱气的条件,装载方法文件后,点击“进样器脱气”按钮。 6.方法设置 打开软件后,在页面下方设置方法文件。一般需设置的条件有,洗脱“模式”(一般设置为低压梯度)、“泵A总流速”、“压力限制(泵A)” (最大值一般设为20.0MPa,最小设置为0.0MPa)、“L C时间程序”、 “采集时间”(开始和结束时间)、“通道波长”、“柱温箱温 度”、自动进样器和自动排气相关设置以及L C时间程序。 附:L C时间程序设置如下图:结束时,分别选择“Controller”和“Stop” 7.标准曲线制作 7.1 积分识别条件的设置 选取不同浓度标样中的某一数据文件,打开。点击“向导”按钮 。按照指示设置“半峰宽”、“斜率”、“最小锋面积”等积分条件,选择标准品对应的色谱峰、设置定量方法相关条件、目标峰识别相关条件,输入目标物的名称、按照级别输入标曲中相应的浓度。完成后,点击“完成”。点击,保存此积分识别条件,新建一个新文件名。 7.2 标曲批处理文件的设置 点击左边栏的“批处理”按钮,出现批处理界面。按浓度从小到大或从大到小,将标曲中的标样文件添加到批处理表中。点击“样品类型”中按钮,第一个浓度选择“标准”中的“初始化校准曲线”,其他浓度选择“标准”中的“添加校准级别”. “分析类型”选择“IT QT”;输入“方法文件”和“数据文件”名称;输入不同浓度对应的“级别”。完成后,保存批处理文件。点击“批处理开始”,制作标准曲线。点击标曲中最大或最小浓度的标样数据文件,查看标准曲线。 8.样品浓度计算
高效液相操作步骤
高效液相操作步骤 Company number:【WTUT-WT88Y-W8BBGB-BWYTT-19998】
Agilent 1200 LC 1、仪器设备:Agligengt 1200 LC * G1310A:(单元泵);G1312A,G1312B XL:(二元泵);G1311A:(四元泵) * G1329A(标准型自动进样器) * G1316A,G1316B XL:(柱温箱) * G1314B,G1314C XL:(VWD检测器) * G1362A(示差检测器) * G1315B,G1315C XL:(DAD检测器) * G1365B,G1365C XL:(MWD检测器) * G1321A(FLD检测器) * 色谱柱:Zorbax Eclipse XDB-C18 150×,5um column P/N993967-902/5063-6600 2、溶剂准备: * 色谱级纯或优级纯乙腈或甲醇 * 二次蒸馏水 基本操作步骤: (一)开机 1、打开计算机,进入Windows 2000(或Windows XP)画面。(IP地址由Bootp Service程序写入) 2、打开1200LC各模块电源 3、待各模块自检完成后,双击“Instrument 1 On line”图标,化学工作站自动与1200LC通讯,进入工作站画面。
4、从“View”菜单中选择“Method and Run control”画面,点击“View”菜单中得“Show Top Toolbar”,“Show status toolbar”,“System diagram”,“Sampling diagram”,使其命令前有“√”标志,来调用所需的界面。 5、把流动相放入溶剂瓶中。 6、打开“Purge”阀。 7、点击“Pump”图标,点击“Setup pump”选项,进入泵编辑画面。 8、设Flow:3-5ml/min,点击“OK”。 9、点击“Pump”图标,点击“Pump control”选项,选中“On”,点击“OK”。则系统开始Purge,直到管线内(由溶剂瓶到泵入口)无气泡为止,切换通道继续Purge,直到所有要用通道无气泡为止。 10、点击“Pump”图标,点击“Pump Control”选项,选中“Off”,点击“OK”关泵,关闭Purge value。 11、点击“Pump”图标,点击“Setup pump”选项,设Flow:min。 12、点击泵下面的瓶图标,如下图所示(以四元泵为例),输入溶剂的实际体积和瓶体积。也可输入停泵的体积。点击“OK”。 (二)数据采集方法编辑: 1、开始编辑方法: 从“Method”菜单中选择“Edit entire method”项,如上图所示选中除“Data analysis”外的三项,点击“OK”,进入下一画面。 2、方法信息: (1)在“Method Comments”中写入方法的信息(如:This is for test)。(2)点击“OK”进入下一画面。
高效液相色谱法测定手册
高效液相色谱法测定手册 一目的:制定高效液相色谱法,规范高效液相色谱法的测定操作。 二适用范围:适用于高效液相色谱法的测定。 三责任者:品控部。 四正文 1 简述 高效液相色谱法是一种现代液体色谱法,其基本方法是将具一定极性的单一溶剂或不同比例的混合溶液,作为流动相,用泵将流动相注入装有填充剂的色谱柱,注入的供试品被流动相带入柱内进行分离后,各成分先后进入检测器,用记录仪或数据处理装置记录色谱图或进行数据处理,得到测定结果。由于应用了各种特性的微粒填料和加压的液体流动相,本法具有分离性能高,分析速度快的特点。 高效液相色谱法适用于能在特定填充剂的色谱柱上进行分离的药品的分析测定,特别是多组分药品的测定、杂质检查和大分子物质的测定。有的药品需在色谱分离前或后经过衍生化反应方能进行分离或检测。常用的色谱柱填充剂有:硅胶,用于正相色谱;化学键合固定相,根据键合的基团不同可用于反相或正相色谱,其中最常用的是十八烷基硅烷(又称ODS)键合硅胶,可用于反相色谱或离子对色谱;离子交换填料,用于离子交换色谱;具一定孔径的大孔填料,用于排阻色谱。 高效液相色谱仪基本由泵,进样器,色谱柱,检测器和色谱数据处理系统组成。检测器最常用的为可变波长紫外可见光检测器,其他检测器有如示差折光检测器和蒸发光散射检测器等。色谱信息的收集和处理常用积分仪或数据工作站进行。梯度洗脱,可用两台泵或单台泵加比例阀进行程控实现。 2 高效液相色谱仪的使用要求 2.1 按国家技术监督局国家计量检定规程汇编中“实验室液相色谱仪检定规程(JJG705—90)”的规定作定期检定,应符合规定。 2.2 仪器各部件应能正常工作,管路为无死体积连结,流路中无堵塞或漏液,在设定的检测器灵敏度条件下,色谱基线噪音和漂移应能满足分析要求。 2.3 具体仪器在使用前应详细参阅各操作说明书。
ELISA 直接法与间接法的区别
ELISA可用于测定抗原,也可用于测定抗体.在这种测定方法中有三个必要的试剂1)固相的抗菌素原或抗体,即"免疫吸附剂"(immunosorbent);(2)酶标记的抗原或抗体,称为"结合物"(conjugate);(3)酶反应的底物.根据试剂的来源和标本的情况以及检测的具体条件,可设计出各种不类型的检测方法. ELISA可分类是根据抗原抗体的结合情况来分类的。 主要有以下几种类型:(直接法也称一步法) 1 双抗体夹心法测抗原 双抗体夹心法是检测抗原最常用的方法,操作步骤如下: 1) 将特异性抗体与固相载体联结,形成固相抗体.洗涤除去未结合的抗体及杂质. 2) 加受检标本,保温反应.标本中的抗原与固相抗体结合,形成固相抗原抗体复合物.洗涤除去其他未结合物质. 3) 加酶标抗体,保温反应.固相免疫复合物上的抗原与酶标抗体结合.彻底洗涤未结合的酶标抗体.此时固相载体上带有的酶量与标本中受检抗原的量相关. 4) 加底物显色.固相上的酶催化底物成为有色产物.通过比色,测知标本中抗原的量.在临床检验中,此法适用于检验各种蛋白质等大分子抗原,例如HBsAg,HBeAg,AFP,hCG等.只要获得针对受检抗原的异性抗体,就可用于包被固相载体和制备酶结合物而建立此法.如抗体的来源为抗血清,包被和酶标用的抗体最好分别取自不同种属的动物.如应用单克隆抗体,一般选择两个针对抗原上不同决定簇的单抗,分别用于包被固相载体和制备酶结合物.这种双位点夹心法具有很高的特异性,而且可以将受检标本和酶标抗体一起保温反应,作一步检测. 在一步法测定中,当标本中受检抗原的含量很高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成"夹心复合物".类同于沉淀反应中抗原过剩的后带现象,此时反应后显色的吸光值(位于抗原过剩带上)与标准曲线(位于抗体过剩带上)某一抗原浓度的吸光值相同(参见 1.3.2,图1-4),如按常法测读,所得结果将低于实际的含量,这种现象被称为钩状效应(hook effect),因为标准曲线到达高峰后呈钩状弯落.钩状效应严重时,反应甚至可不显色而出现假阴性结果.因此在使用一步法试剂测定标本中含量可异常增高的物质(例如血清中HBsAg,AFP和尿液hCG等)时,应注意可测范围的最高值.用高亲和力的单克隆抗体制备此类试剂可削弱钩状效应. 假使在被测分子的不同位点上含有多个相同的决定簇,例如HBsAg的a决定簇,也可用针对此决定的同一单抗分别包被固相和制备酶结合物.但在HBsAg的检测中应注意亚型问题,HBsAg有adr,adw,ayr,ayw4个亚型,虽然每种亚型均有相同的a决定簇的反应性,这也是用单抗作夹心法应注意的问题. 双抗体夹心法测抗原的另一注意点是类风湿因子(RF)的干扰.RF是一种自身抗体,多为IgM型,能和多种动物IgG的Fc段结合.用作双抗体夹心法检测的血清标本中如含有RF,它可充当抗原成份,同时与固相抗体和酶标抗体结合,表现出假阳性反应.采用F(ab')或Fab片段作酶结合物的试剂,由于去除了Fc段,从而消除RF的干扰.双抗体夹心法ELISA试剂是否受RF的影响,已被列为这类试剂的一项考核指标。 双抗体夹心法适用于测定二价或二价以上的大分子抗原,但不适用于测定半抗原及小分子单价抗原,因其不能形成两位点夹心. 2 双抗原夹心法测抗体 反应模式与双抗体夹心法类似.用特异性抗原进行包被和制备酶结合物,以检测相应的抗体.与间接法测抗体的不同之处为以酶标抗原代替酶标抗抗体.此法中受检标本不需稀释,可直接用于测定,因此其敏感度相对高于间接法.乙肝标志物中抗HBs的检测常采用本法.本法关键在于酶标抗原的制备,应根据抗原结构的不同,寻找合适的标记方法. 3 间接法测抗体 间接法是检测抗体常用的方法.其原理为利用酶标记的抗抗体(抗人免疫球蛋白抗体)以检测与固
(完整)Waters1525-2489高效液相色谱仪操作规程
编写:审核:批准: 日期:日期:日期: 生效日期: 1.目的:规范Waters1525型高效液相色谱仪的操作,确保检测设备安全稳定的运行。 2.范围:适用于Waters1525型高效液相色谱仪的操作使用。 3.职责:检验员负责本规程的执行。 4.操作步骤 4.1开机前检查 流动相对应泵单元放置,检查电源线接口连接完好 4.2色谱柱的安装 安装待测样品所需的色谱柱,注意色谱柱方向。打开柱温箱电源开关,设置柱温箱温度。 4.3开机 4.3.1泵单元 打开泵电源,待自检通过后排气泡。(注:上泵是B泵,一般放置水系流动相;下泵是A泵,一般放置有机系流动相。)拧开上泵排液(空)阀螺旋,用注射器抽去管道及泵头内气泡,然后立即拧紧排液(空)阀螺旋。下泵排气泡操作与上泵相同。 4.3.2打开检测器电源 等待自检通过,大约5min。 4.3.3打开色谱工作站 打开计算机电源,点击桌面图标,进入Breeze2 色谱工作站,用户名输入breeze,点击确定按钮,操作的项目选择“hd”,色谱系统选择“1525/2489”,点击确定。 4.4建立分析方法 点击(调用方法组编辑器向导)图标,点击对话框中的“新建”,在电脑下方任务栏中出现(仪器方法编辑器),点开,设置波长等条件,再点击,设置A、B两泵的流速,然后点击保存图标,在对话框中输入此方法的名称,比
如“亚麻酸方法”,再点击保存。在“新方法组”的对话框中点击图标,选择“亚麻酸方法”,点击两次下一步,再点击完成。 4.5平衡仪器 点击(平衡系统/监视基线图标),在对话框中,选择方法如“亚麻酸方法”,点击设置。等待仪器设置反应,再次点击(平衡系统/监视基线)。等待基线平衡(一般约30-40min)。 4.6进样与数据采集: 基线平衡后(30-40min),点击(中断正在运行的样品组或单进样)图标, 结束平衡。点击(单进样)图标,编辑样品名称、进样体积和运行时间,选择方法组,点击进样即可开始进样。 4.7谱图处理: 点击图标,点,再点,双击所要查看的谱图。建立谱图处理 方法:在通道中选中标准品谱图,双击点开,出现的对话框点击“是”,再点击(处理参数向导),选择“新建处理方法”,点确定,用鼠标左键拖住选择目标峰段,然后点基“下一步”,直到出现,输入目标峰名称后点击“下一步”,直到出现,输入谱图处理方法名称,点击完成,在出现的对话框中点击保存。点击图标,点,再点,选择所需处理的标准品及样品图谱,单击右键,单击处理,选择“使用指定的方法处理”,单击下拉菜单,选择所需方法后点击确定,点击,再点,选择所需查看的图谱双击左键,即可查看目标峰的数据。 4.7结果计算(标准曲线) 进入查询数据,在通道中,选择标准谱图,右击选择改变样品,在其工具栏中点击(量),在对话框中将样品类型选择标准样,点击(从处理方法复制),选择谱图新建的处理方法名,在当前项下,输入组分名称,对应组分的浓度,单位( 标准操作规程 1目的:建立高效液相色谱测定法操作规程,以使检验操作规化。 2适用围:适用于高效液相色谱测定法检验操作全过程。 3责任:QC人员对本SOP实施负责。 4容 高效液相色谱法系采用高压输液泵将规定的流动相泵入装有填充剂的色谱柱,对供试品进行分离测定的色谱方法。注入的供试品,由流动相带入色谱柱,各组分在柱被分离,并进入检测器检测,由积分仪或数据处理系统记录和处理色谱信号。 4.1.对仪器的一般要求和色谱条件 高效液相色谱仪由高压输液泵、进样器、色谱柱、检测器、积分仪或数据处理系统组成。色谱柱径一般为3.9~4.6mm,填充剂粒径为3~10μm。超高效液相色谱仪是适应小粒径(约2μm)填充剂的耐超高压、小进样量、低死体积、高灵敏度检测的高效液相色谱仪。 4.1.1.色谱柱 反相色谱柱:以键合非极性基团的载体为填充剂填充而成的色谱柱。常见的载体有硅胶、聚合物复合硅胶和聚合物等;常用的填充剂有十八烷基硅烷键合硅胶、辛基硅烷键合硅胶和苯基键合硅胶等。 正相色谱柱:用硅胶填充剂,或键合极性基团的硅胶填充而成的色谱柱。常用的填充剂有硅胶、氨基键合硅胶和氰基键合硅胶等。氨基键合硅胶和氰基键合硅胶也可用作反相色谱。离子交换色谱柱:用离子交换填充剂填充而成的色谱柱。有阳离子交换色谱柱和阴离子交换色谱柱。 手性分离色谱柱:用手性填充剂填充而成的色谱柱。 色谱柱的径与长度,填充剂的形状、粒径与粒径分布、孔径、表面积、键合基团的表面覆盖度、载体表面基团残留量,填充的致密与均匀程度等均影响色谱柱的性能,应根据被分 离物质的性质来选择合适的色谱柱。 温度会影响分离效果,品种正文中未指明色谱柱温度时系指室温,应注意室温变化的影响。为改善分离效果可适当提高色谱柱的温度,但一般不宜超过60℃。 残余硅羟基未封闭的硅胶色谱柱,流动相pH值一般应在 2?8之间。残余硅羟基已封闭的硅胶、聚合物复合硅胶或聚合物色谱柱可耐受更广泛pH值的流动相,适合于pH 值小于2或大于8 的流动相。 4.1.2.检测器 最常用的检测器为紫外-可见分光检测器,包括二极管阵列检测器,其他常见的检测器有荧光检测器、蒸发光散射检测器、示差折光检测器、电化学检测器和质谱检测器等。 紫外-可见分光检测器、荧光检测器、电化学检测器为选择性检测器,其响应值不仅与被测物质的量有关,还与其结构有关;蒸发光散射检测器和示差折光检测器为通用检测器,对所有物质均有响应。结构相似的物质在蒸发光散射检测器的响应值几乎仅与被测物质的量有关。 紫外-可见分光检测器、荧光检测器、电化学检测器和示差折光检测器的响应值与被测物质的量在一定围呈线性关系,但蒸发光散射检测器的响应值与被测物质的量通常呈指数关系,一般需经对数转换。 不同的检测器,对流动相的要求不同。紫外-可见分光检测器所用流动相应符合紫外-可见分光光度法(通则0401)项下对溶剂的要求;采用低波长检测时,还应考虑有机溶剂的截止使用波长,并选用色谱级有机溶剂。蒸发光散射检测器和质谱检测器不得使用含不挥发性盐的流动相。 4.1.3.流动相 反相色谱系统的流动相常用甲醇-水系统和乙腈-水系统,用紫外末端波长检测时,宜选用乙腈-水系统。流动相中应尽可能不用缓冲盐,如需用时,应尽可能使用低浓度缓冲盐。用十八烷基硅烷键合硅胶色谱柱时,流动相中有机溶剂一般不低于5%,否则易导致柱效下降、色谱系统不稳定。 正相色谱系统的流动相常用两种或两种以上的有机溶剂,如二氯甲烷和正己烷等。 品种正文项下规定的条件除填充剂种类、流动相组分、检测器类型不得改变外,其余如色谱柱径与长度、填充剂粒径、流动相流速、流动相组分比例、柱温、进样量、检测器灵敏度等,均可适当改变,以达到系统适用性试验的要求。调整流动相组分比例时,当小比例组分的百分比例X小于等于33%时,允许改变围为0.7X?1.3X;当X大于33%时,允许改变围为X—10%?X+10% 。高效液相色谱测定法标准操作规程
