分析化学》下册武汉大学等编(第五版)作业参考答案

《仪器分析》作业参考答案
第2章 光谱分析法导论
2-1 光谱仪一般由几部分组成?它们的作用分别是什么? 参考答案:
(1)稳定的光源系统—提供足够的能量使试样蒸发、原子化、激发,产生光谱; (2)试样引入系统
(3)波长选择系统(单色器、滤光片)—将复合光分解成单色光或有一定宽度的谱带; (4)检测系统—是将光辐射信号转换为可量化输出的信号; (5)信号处理或读出系统—在显示器上显示转化信号。
2-2 单色器由几部分组成,它们的作用分别是什么? 参考答案:
(1)入射狭缝—限制杂散光进入;
(2)准直装置—使光束成平行光线传播,常采用透镜或反射镜; (3)色散装置—将复合光分解为单色光;
(4)聚焦透镜或凹面反射镜—使单色光在单色器的出口曲面上成像; (5)出射狭缝—将额定波长范围的光射出单色器。
2-5 对下列单位进行换算:
(1)150pm Z 射线的波数(cm -
1) (2)Li 的670.7nm 谱线的频率(Hz )
(3)3300 cm -
1波数对应的波长(nm ) (4)Na 的588.995nm 谱线相应的能量(eV ) 参考答案:
(1)1
7110
1067.610
15011
---?=?=
=
cm cm λ
σ (2))(1047.4)(10
7.670100.314
7
10Hz Hz c
?=??==-λν (3))(3030)(1003.3)(3300
1
1
4nm cm cm =?==
=
-ν
λ (4))(1.2)(10
602.110995.588100.310625.619
98
34eV eV c
h E =??????==---λ 2-6 下列种类型跃迁所涉及的能量(eV )范围各是多少?
(1)原子内层电子跃迁; (4)分子振动能级跃迁; (2)原子外层电子跃迁; (5)分子转动能级跃迁; (3)分子的电子跃迁 参考答案
跃迁类型 波长范围 能量范围/eV 原子内层电子跃迁 10-
1 ~ 10nm 1.26×106 ~1.2×102
原子外层电子跃迁 200 ~ 750nm 6~1.7 分子的电子跃迁 200 ~ 750nm 6~1.7 分子振动能级跃迁 0.75 ~ 50μm 1.7~0.02 分子转动能级跃迁
50 ~ 1000μm
2×10-2~4×10-
7
第10章 吸光光度法(上册)
2、某试液用2cm 吸收池测量时,T=60%。若改用1cm 或3cm 吸收池,T 及A 等于多少? 参考答案:
因所用试液未变,即εc 为常数。而A 2cm = -lgT = -lg0.60 = 0.222 根据 A = -lgT =εbc 知
111
.0222.021
2211=?==
cm cm cm cm A b b A lgT 1cm = -0.111 T 1cm = 77% 333
.0222.02
3
2233=?==
cm cm cm cm A b b A lgT 1cm = -0.333 T 1cm = 46%
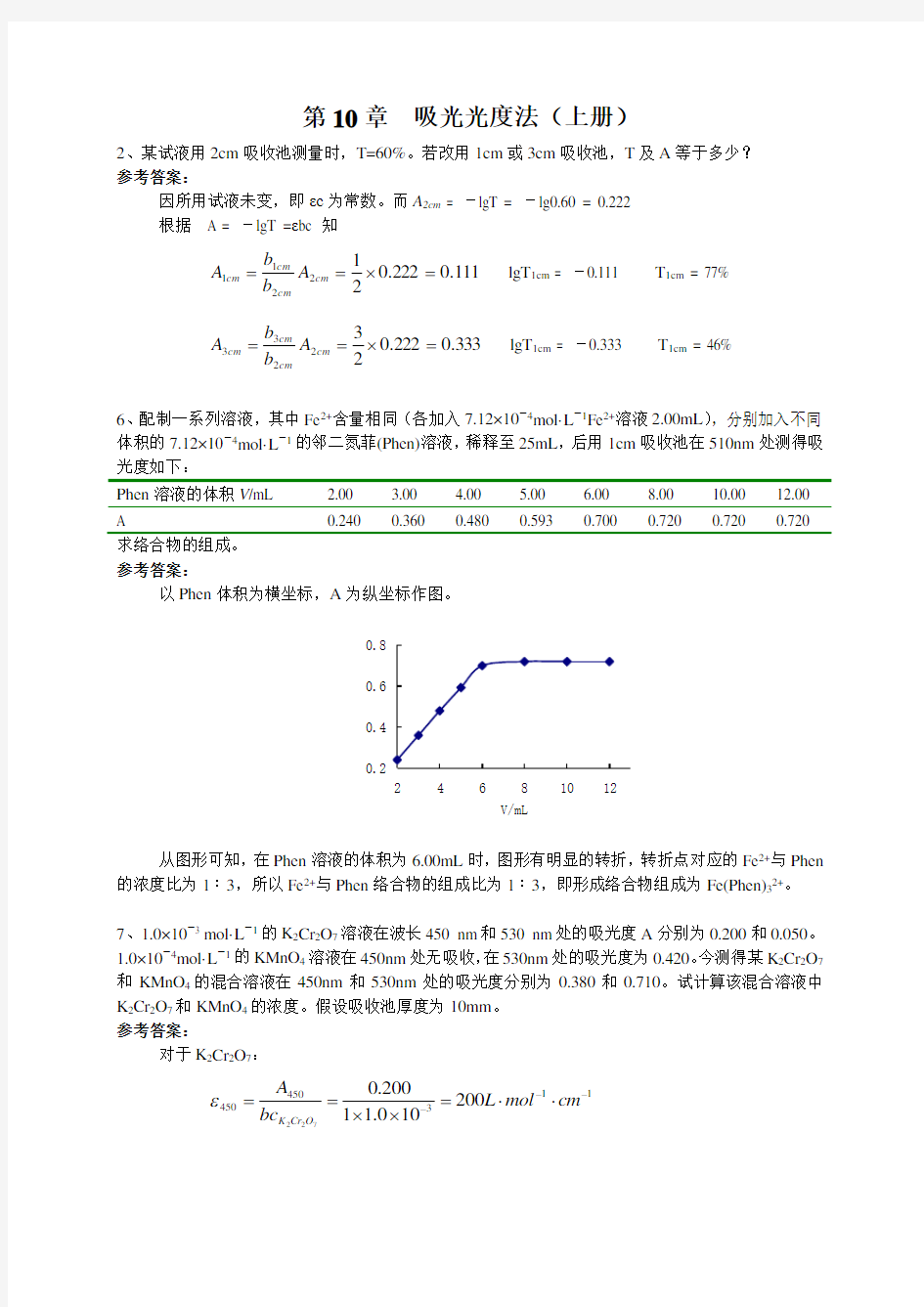
6、配制一系列溶液,其中Fe 2+含量相同(各加入7.12×10-4mol·L -
1Fe 2+溶液2.00mL ),分别加入不同
体积的7.12×10-4mol·L -
1的邻二氮菲(Phen)溶液,稀释至25mL ,后用1cm 吸收池在510nm 处测得吸光度如下:
Phen 溶液的体积V /mL 2.00 3.00 4.00 5.00 6.00 8.00 10.00 12.00 A
0.240
0.360
0.480
0.593
0.700
0.720
0.720
0.720
求络合物的组成。 参考答案:
以Phen 体积为横坐标,A 为纵坐标作图。
0.2
0.40.6
0.82
4
6
810
12
V/mL
A
从图形可知,在Phen 溶液的体积为6.00mL 时,图形有明显的转折,转折点对应的Fe 2+与Phen 的浓度比为1∶3,所以Fe 2+与Phen 络合物的组成比为1∶3,即形成络合物组成为Fe(Phen)32+。
7、1.0×10-3 mol·L -
1的K 2Cr 2O 7溶液在波长450 nm 和530 nm 处的吸光度A 分别为0.200和0.050。
1.0×10-4mol·L -
1的KMnO 4溶液在450nm 处无吸收,在530nm 处的吸光度为0.420。今测得某K 2Cr 2O 7和KMnO 4的混合溶液在450nm 和530nm 处的吸光度分别为0.380和0.710。试计算该混合溶液中K 2Cr 2O 7和KMnO 4的浓度。假设吸收池厚度为10mm 。 参考答案:
对于K 2Cr 2O 7:
1
13
45045020010
0.11200.0722---??=??==
cm mol L bc A O Cr K ε
1
13
5305305010
0.11050.0722---??=??==
cm mol L bc A O Cr K ε 对于KmnO 4: 1134
'530'530
102.410
0.11420.04---???=??==cm mol L bc A KMnO ε
对于混合溶液,因各物质的吸光度具有加和性,由题意得: 7
7227
221102.4150710.01200380.03
KMnO O Cr K O Cr K c c c ???+??=??=
所以
1
4
131046.1109.17722----??=??=L
mol c L mol c KMnO O Cr K
9、以示差吸光光度法测定KMnO 4溶液的浓度,以含锰10.0mg·mL -
1的标准溶液作参比溶液,其对水的透射比为T = 20%,并以此调节透射比为100%,此时测得未知浓度KMnO 4溶液的透射比T x = 40.0%,计算KMnO 4的质量浓度。 参考答案:
以水作参比时,标准溶液的吸光度A s 为 A s =-lgT =-lg 0.200 = 0.699 示差法测定时,试液的吸光度A x 为
A x =-lgT x =-lg 0.400 = 0.398
设标准溶液中锰浓度为c x ,试液与标准溶液中锰的浓度差为⊿c ,则
s
x
s A A c c =
? 所以
169.5699
.0398
.00.10-?=?==
?mL mg A A c c s x s 则KMnO 4的质量浓度为
c x = c s +⊿c = 10.0 + 5.69 = 15.7mg·mL -
1
第9章 紫外可见吸光光度法
9-1 有机化合物分子的电子跃迁有哪几种类型?哪些类型的跃迁能在紫外-可见吸收光谱中反映出来?
参考答案:有机化合物可能的跃有:σ→σ*、σ→π*、π→σ*、n →σ*、π→π*、n →π*。
在紫外-可见吸收光谱中反映出来的跃迁类型有:π→σ*、π→π*、n →π*及电荷转移跃迁。
9-9 单光束、双光束、双波长分光光度计在光路设计上有什么不同?这几种类型的仪器分别由哪几大部件组成?
参考答案:(1)单光束分光光度计:经单色器分光后的一束平行光,轮流通过参比溶液和样品溶液,以进行吸光度的测定;
(2)双波长分光光度计:由同一光源发出的光被分成两束,分别经过两个单色器,得到两束不同波长(λ1和λ2)的单色光,利用切光器使两束光以一定的频率交替照射同一吸收池;
(3)双光束分光光度计:在单色器的后面放置切光器,将光分为两路强度相同的两部分,分别通过参比和样品溶液测定。
三种分析仪器均由:光源、单色器、试样池(吸收池)、检测器和信号指示系统五部分组成。
9-16 已知亚异丙基丙酮(CH 3)2C=CHCOCH 3在各种溶剂中实现n →π*跃迁的紫外光谱特征如下:
溶剂 环已烷 乙醇 甲醇 水 λmax /nm 335 320 312 300
εmax /(L·mol -1·cm -
1)
25 93 93 112 假定这些光谱的移动全部由与溶剂分子生成氢键所产生,试计算在各种极性溶剂中氢键的强度
(kJ·mol -
1)。
参考答案:由于亚异丙基丙酮在极性溶剂中程度时,其中C=O 的π电子可以与溶剂分子形成氢键,当n 电子实现n →π*跃迁时,氢键也随之断裂。吸收波长(335nm )的部分能量是用来破坏氢键,而在非极性溶液中,未形成氢键,也就无需破坏氢键,它所相应的能量全部用来实现跃迁。因此,在两种溶液中所需能量的差值相当于形成氢键的强度。
所以,1mol 的亚异丙基丙酮在溶剂中的能量和氢键强度分别为:
溶剂 环已烷 乙醇 甲醇 水
能量/kJ·mol -
1 λ
hc
E =
356.89 373.62 383.33 398.67 氢键强度/ kJ·mol -
1 E i -E 环已烷
16.73
26.44
41.78
第4章 原子吸收光谱法
4-4 简述原子吸收光谱法进行定量分析的依据及其定量分析的特点。
参考答案:在一定的浓度范围和一定的火焰宽度条件下,当采用锐线光源时,溶液的吸光度与待测元素浓度成正比关系。这就是原子吸收光谱定量分析的依据。
常用两种方法进行定量分析:
(1)标准曲线法:该方法简便、快速,但仅适用于组成简单的试样。
(2)标准加入法:该方法适用于试样组分未知的情况,不适合于曲线斜率过小的情况。 4-5 原子谱线变宽的主要因素有哪些?对原子吸收光谱分析有什么影响?
参考答案:其主要因素影响分别如下:
① 自然宽度:原子吸收线的自然宽度与激发态的平均寿命有关,激发态的原子寿命越长,则
吸收线的自然宽度越窄,其平均寿命约为10-8s 数量级,一般来说,其自然宽度为10-
5nm 数量级;
② 多普勒变宽:是由于原子无规则的热运动而产生的,故又称为热变宽。多普勒变宽随着原子与光源相对运动的方向而变化,基态原子向着光源运动时,它将吸收较长波长的光,反之,原子离开光源方向运动时,它将吸收较短波长的光,由于原子无规则的热运动将导致吸收张变宽,多普
勒变宽的程度大约为10-4~10-
3nm ,原子化温度越高,多普勒变宽越严重;
③ 洛仑兹变宽:被测原子与其他原子或分子相互碰撞,使其基态能级稍有变化,从而导致吸收线变宽;
④ 霍尔兹马克变宽:被测元素激发态原子自身的相互碰撞而引起的变宽; ⑤ 场致变宽:
⑥ 自吸变宽:谱线变宽将使吸光度下降,使测定结果偏小。
4-6 画出原子吸收分光光度计的结构框图,并简要叙述原子吸收分光光度计的工作原理。
参考答案:结构框图如下所示:
工作原理:锐线光源发射出待测元素特征谱线被原子化器中待测元素原子核外层电子吸收后,经光学系统中的单色器,将特征谱线与原子化器过程中产生的复合光谱分散分离后,检测系统将特征谱线强度信号转换成电信号,通过模/数转换器转换成数字信号,计算机光谱工作站对数字信号进行采集、处理与显示,并对分光光度计各系统进行自动控制。
4-7 原子吸收分光光度计有哪些主要性能指标?这些性能指标对原子吸收光谱定量分析有什么影响?
参考答案:光学系统的波长显示值误差、光学系统分辨率、基线的稳定性、吸收灵敏度、精密度和检出限是原子吸收分光光度计的主要性能指标。
(1)吸收谱线的理论波长与仪器光学系统显示波长差值为显示值误差;
(2)光学系统分辨率是单色器对共振吸收线与其他干扰谱分辨能力的一项重要指标;
(3)灵敏度S1%定义为产生1%吸收(即T = 99%,吸光度值A为0.0044)信号时所对应的元素含量。
4-9 原子吸收光谱法存在哪些主要的干扰?如何减少或消除这些干扰?
参考答案:
物理干扰:指试液与标准溶液物理性质有差异而产生的干扰。消除办法:配制与被测试样组成相近的标准溶液或采用标准加入法。若浓度高,还可采用稀释法。
化学干扰:指火焰中由于待测元素与压缩卡的共存元素或火焰成分发生反应,形成难挥发或难分解的化合物而使被测元素的自由原子浓度降低而导致的干扰。消除方法:(1)选择合适的原子化方法;(2)加入释放剂;(3)加入保护剂;(4)加入基体改进剂等。
电离干扰:原子失去一个电子或几个电子后形成离子,同一元素的原子光谱与其离子光谱是不相同的。所以中性原子所能吸收的共振谱线,并不被它的离子吸收。火焰中如果有显著数量的原子电离,将使测得的吸收值降低。消除方法:最常用的方法是加入电离能较低的消电离剂,抑制电离的干扰。
光谱干扰:由于原子吸收光谱较发射光谱简单,谱线少,因而谱线相互重叠的干扰少,绝大多数元素的测定相互之间不会产生谱线重叠的光谱干扰,但仍有少数元素相互间会有某些谱线产生干扰。消除方法:改用其他吸收线作为分析线。
背景吸收也属于光谱干扰,包括分子吸收和光散射两个部分。消除方法:一般采用仪器校正背景方法,有氘灯背景校正、Zeeman效应背景校正、谱线自吸收背景校正和非吸收谱线背景校正技术。
4-14 火焰原子吸收光谱法分析某试样中微量Cu的含量,称取试样0.500g,溶解后定容至100mL容量瓶中作为。分析溶液的配制及测量有吸光度如下表所示(用0.1mol·L-1的HNO3定容),计算试样中Cu的质量分数(%)。
1 2 3
移取试样溶液的体积/mL 0.00 5.00 5.00
加入5.00mg·L-1的Cu2+标准溶液的体积/mL 0.00 0.00 1.00
定容体积/mL 25.00 25.00 25.00
测量的吸光度(A)0.010 0.150 0.375 参考答案:设25.00mL试样溶液中Cu2+质量浓度为ρx。
因在一定条件下,A = KC 所以有:
00
.2500.100.5010
.0375.0010
.0150.0?+
=
--x x
ρρ
2
.0365.0140
.0+=
x x ρρ ρx = 0.124mg·L -
1 故试样中Cu 的质量分数为:
%0124.0%10010500.000.50
.1001000.25124.03
3=???
??=
-Cu ω
第13章 电分析化学导论
13-6 已知下列半电池反应及其标准电极电位为
IO 3- + 6H + + 5e -
= 1/2I 2 + 3H 2O E θ = +1.195V
ICl 2- + e - = 1/2I 2 + 2Cl -
E θ = +1.06V
计算半电池反应:IO 3- + 6H + +2Cl - + 4 e - = ICl 2-
+ 3H 2O 的E θ 值。
参考答案:由热力学公式 ⊿r G m θ = -nF E θ可知:
(1) IO 3- + 6H + + 5e -
= 1/2I 2 + 3H 2O ⊿r G 1θ = -5F E 1θ
(2) ICl 2- + e - = 1/2I 2 + 2Cl -
⊿r G 2θ = -F E 2θ
(3) IO 3- + 6H + +2Cl - + 4 e - = ICl 2-
+ 3H 2O ⊿r G 3θ = -4F E 3θ 因(3)=(1)-(2)得到的,故 ⊿r G 3θ = ⊿r G 1θ-⊿r G 2θ 即 -4F E 3θ = -5F E 1θ + F E 2θ
V E E E 23.14
06
.1195.1545213=-+?-=-+-=
θ
θθ
13-7 已知下列半电池反应及其标准电极电位为
Sb + 3H + + 3 e -
= SbH 3 E θ = -0.51V
计算半电池反应: Sb + 3H 2O + 3 e - = SbH 3 +3OH -
在25℃时的E θ 值。
参考答案:以半电池Sb + 3H + + 3 e - = SbH 3作负极与半电池Sb + 3H 2O + 3 e - = SbH 3 +3OH -
作正极组成原电池,电池反应为:
负极:SbH 3 - 3 e -
= Sb + 3H + E 1θ = -0.51V
正极:Sb + 3H 2O + 3 e - = SbH 3 +3OH -
E 2θ = ?
电池:H 2O = H +(aq) + OH -
(aq) ⊿r G θ = -F E θ = -RTlnK w
所以 E θ = 0.059lg10-
14 = -0.826(V) 又对于电池: E θ = E 2θ - E 1θ
所以 E 2θ = E θ + E 1θ = -0.826-0.51 = -1.34(V)
13-8 电池Hg |Hg 2Cl 2,Cl -
(饱和)|| M n+ | M 为一自发电池,在25℃时其电动势为0.100V ;当M n+的浓
度稀释至原来的1/50时,电池电动势为0.500V 。试求右边半电池的n 值。
参考答案:因电池Hg |Hg 2Cl 2,Cl -
(饱和)|| M n+ | M 为一自发电池,于是得
未稀释前:SCE n M M E M n E E n -+=++1/1]lg[059
.0θ
稀释后: S C E n M
M E M n
E E n -+=++2/2]l g [059.0θ
2
1
21][][lg
059.0++=-n n M M n E E 即 c c
n
50
1lg 059.0050.0100.0=
- 所以 n = 2
13-10 已知下列半反应及其标准电极电位为
Cu 2+ + I - + e -
= CuI E θ = +0.86V
Cu 2+ + e -
= Cu + E θ = +0.159V 试计算CuI 的溶度积常数。
参考答案1:(1)Cu 2+ + I - + e -
= CuI ⊿r G 1θ = -F E 1θ
(2)Cu 2+ + e -
= Cu + ⊿r G 2θ = -F E 2θ
(2)-(1)CuI = Cu + + I -
⊿r G 3θ = -RTlnK sp ⊿r G 3θ = ⊿r G 2θ-⊿r G 1θ
即 -RTlnK sp = -F E 2θ + F E 1θ
84.110592
.086.0159.0303.2)(lg 12-=-=-=RT E E F K sp
θθ
K sp = 1.4×10-
12
参考答案2:两半反应组成电池:CuI(s)|Cu 2+,Cu +
正极反应:Cu 2+ + e -
= Cu +
负极反应:CuI - e - = Cu 2+ + I -
电池反应:CuI = Cu + + I -
sp K nF
RT
E E E ln =-=-+θ
θ
θ
84.110592
.086.0159.0303.2)(lg -=-=-=-+RT E E F K sp
θθ
K sp = 1.4×10-
12
13-13 已知下列半电池反应及其标准电极电位为
HgY 2- + 2e - = Hg + Y 4-
E θ = +0.21V
Hg 2+ + 2e -
= Hg E θ = +0.845V
计算络合物生成反应 Hg 2+ + Y 4- = HgY 2-
的稳定常数的lg K 值(25℃)。
参考答案:两半电极组成电池:Hg | HgY 2-,Y 4-
,Hg 2+ | Hg
正极反应:Hg 2+ + 2e -
= Hg
负极反应:Hg + Y 4― ― 2e - = HgY 2-
电池反应:Hg 2+ + Y 4- = HgY 2-
5.21059
.0)
21.0845.0(2303.2)(lg =-=-=
-+RT E E nF K f θ
θ
13-16 已知Hg 2Cl 2的溶度积为2.0×10
-18
,KCl 的溶解度为330g·L
-1
溶液,V E Hg Hg 8.0/21
+=+θ
,试计
算饱和甘汞电极的电极电位。
参考答案:设计电池:Hg | Hg 22+,Cl -
| Hg 2Cl 2,Hg
正极反应: Hg 2Cl 2 + 2 e - = 2Hg + 2Cl -
负极反应:2Hg - 2 e -
= Hg 22+
电池反应:Hg 2Cl 2 = Hg 22+ + 2Cl -
因 ⊿r G m θ = -n FE θ = -RTlnK sp
所以 sp Hg Hg Hg Cl Hg K E E lg 2
0592
.0//22
22=
-+θ
θ 即
V
E K E Hg Hg sp Hg
Cl Hg 276.080.0100.2lg 20592.0lg 2
0592.018//2222=+?=+=-+
θ
θ
感想:对于有平衡常数(如溶度积常数、络合物的稳定常数、解离常数等),想方设法使电池反应变为求平衡常数的可逆式。即正负极反应式相加即得此式(如13-10、13-13、13-16)!!!!!
第十四章 电位分析法
14-7 计算下列电池的电动势,并标明电极的正负:
S C E L m o l L a F N a F
L m o l N a C l L m o l A g C l Ag ||KF 100.1100.0100.0,1
321
1----????单晶膜| 已知:E AgCl/Ag = 0.2880V ,E SCE = 0.244V 。
参考答案:正极为SCE 电极,负极为Ag -AgCl 电极: E 电极 = E SCE - E 膜 - E 内参比
V
E a a E Ag
AgCl F F SCE 074.02880.0100
.0100.1lg
0592.0244.0lg
0592.03
/((=-?-=--=---内)
外)
14-9 氯离子选择电极的1
3,100.224
--??=--L mol K Pot CrO Cl ,当它用于测定pH 为6.0且含有0.01 mol·L
-1
K 2CrO 4溶液中的5.0 × 10-
4 mol·L
-1
的Cl -
时,估计方法的相对误差有多大?
参考答案:
%
40%100100.5)01.0(100.2%
100%4
2/132/1,24
24
=????=??=
---
-
-
-Cl crO pot CrO Cl a a K 误差
14-10 用氟离子选择电极测定水样中的氟离子,取25.00 mL 水样,加入25.00mL TISAB 溶液,测得
电位值为-0.1372V (vs.SCE );再加入1.00× 10-3 mol·L -1的F -
标准溶液1.00 mL ,测量电位值为-0.1170V ,电位的响应斜率为58.0 mV/pF 。计算水样中的氟离子浓度(需考虑稀释效应)。
参考答案:设水样中F -
的浓度为c x ,依题意则:
E = K + 58lg[
F -
]
加标前: 00
.2500.2500.25lg
582.137++=-x
c K
加标后: 00
.100.2500.251000.100.100.25lg 580.1173
++??++=--x c K
x
x c c 5110250lg
582
.203-?+= c x = 3.13× 10-
5 mol·L -
1
14-13 为了测定Cu(II)-EDTA (CuY 2-
)络合物的稳定常数K 稳,组装了下列电池:
Cu | Cu Y 2-(1.00× 10-4 mol·L -1),Y 4-(1.00× 10-2 mol·L -
1) || SHE 。测得该电池的电动势为0.277V ,请计算络合物的K 稳。
参考答案:络合平衡:Cu 2+ + Y 4- ≒ Cu Y 2-
]
][[]
[422-
+-=Y Cu CuY K 稳
已知: Cu 2+ + 2e -
= Cu V E Cu Cu 340.0/2=+θ
]lg[2
059
.02/2+-+=+Cu E E Cu Cu θ
277.010
00.11000.1lg 2059.0340.002
4
=???--=-=---稳K E E E SHE
K 稳 = 8.20× 1018
14-15 将一钠离子选择电极和一饱和甘汞电极组成电池,测量活度为0.100 mol·L -
1的NaCl 溶液时,得到电动势67.0mV ;当测量相同活度的KCl 溶液时,得到电动势为113.0mV 。
(1)试求选择性系数;
(2)若将电极浸在含NaCl (a = 1.00× 10-3 mol·L -1)和KCl (a = 1.00× 10-2 mol·L -
1)的混合
溶液中,测得的电动势将为何值?
参考答案:(1)因Na -ISE 电极电位为:+-=M ISE a K E lg 0592.0 测定NaCl 溶液:++-=Na Na a K E lg 0592.0 ① 测定KCl 溶液:)lg(0592.0/,'
+
+
+
++++?+-=K Na Z
Z
K pot
K Na Na K a K a K E
++
+
+?-=K pot K Na K a K K E ,lg 0592.0 ② ①-②得:)lg lg (lg 0592.0,pot
K Na K Na K Na K a a E E ++++++---=- 即:)lg 100.0lg 100.0(lg 0592.0113.0067.0,pot
K Na K ++---=-
得:777.2lg ,=++
pot
K Na K 所以:167.0,=+
+
pot
K Na K (2))lg(0592.0/,',+
+
++++++?+-=K Na Z
Z
K pot
K Na Na K Na a K a K E ③
将①中的K 代入③:
V
a K a a E E K Na Z
Z
K pot
K Na Na Na Na K Na 160.0093.0067.010)67.10.1(100
.0lg
0592.0067.0)
100.1167.0100.1lg(0592.0100.0lg 0592.0067.0)
lg(0592.0lg 0592.03
23/,',=+=?++=??+?-+=?+-+=---+
+
+
+
++++++
14-17 用pH 玻璃电极作指示电极,以0.2 mol·L -
1 NaOH 溶液电位滴定0.0
2 mol·L -
1 苯甲酸溶液,从
滴定曲线上求得终点时溶液的pH 为8.22。二分之一终点时溶液的pH 为4.18。试计算苯甲酸的解离常数。
参考答案:滴定一半时,有[A]=[HA],此时 pH = pK a = 4.18 所以苯甲酸的解离常数为:
K a = 6.6× 10-
5
14-19 采用下列反应进行电位滴定时,应选用什么指示电极?并写出滴定方程式:
(1)Ag + + S 2- (2)Ag + + CN -
(3)NaOH + H 2C 2O 4 (4)Fe(CN)63-
+ Co(NH 3)62+ (5)Al 3+ + F -
(6)H +
+
(7)K 4Fe(CN)6 + Zn 2+ (8)H 2Y 2-
+Co 2+
参考答案:
(1)银电极:Ag + + S 2- = Ag 2S (2)银电极:Ag + + CN -
= AgCN
(3)玻璃电极:2NaOH + H 2C 2O 4 = Na 2C 2O 4 + 2H 2O
(4)铂电极:Fe(CN)63- + Co(NH 3)62+ = Fe(CN)64-
+ Co(NH 3)63+
(5)汞电极:Al 3+ + F -
= AlF 3 (6)玻璃电极:
(7)汞电极:2K 4Fe(CN)6 + Zn 2+ = K 2Zn Fe(CN)6
+ 2K +
(8)汞电极:H 2Y 2- +Co 2+ =CoY 2-
+ 2H +
第15章 伏安法与极谱法
参考答案:由公式 i d = 607nD m t c 可得:
i d /c = K m 2/3t 1/6 ① 由B 组数据求得扩散电流常数为: 71.136
.292.386.4/6
13
26
132=?=
=
t
m c i K d
所以:A 组:i d /c = K m 2/3t 1/6 = 1.71×0.9822/3×6.531/6 = 2.31 C 组:i d /c = K m 2/3t 1/6 = 1.71×6.962/3×1.371/6 = 6.55
15-8 Pb(II)在3mol·L -
1盐酸介质中还原时,所产生的极谱波的半波电位为-0.46V 。今在滴汞电极电位为-0.70V 时(已经完全浓差极化),测得下列各溶液的电流值为
溶液
电流i /μA (1)6mol·L -
1HCl 25mL ,稀释至50mL
0.15
(2)6mol·L -
1HCl 25mL ,加试样溶液10.00mL ,稀释至50mL
1.23 (3)6mol·L -1HCl 25mL ,加1×10-3 mol·L -
1 Pb 2+标准溶液5.00mL ,稀释至50mLH
0.94
(1)计算试样溶液中铅的质量浓度(mg·mL -
1计);
(2)在本实验中,除采用通惰性气体除氧外,尚可用什么方法除氧?
参考答案:(1)设试液中Pb(II)浓度为c x ,体积为V x ;加入的标准溶液浓度为c s ,体积为V s ,于是根据i = kc 可知:
V V c k
h h x
x x =-0 V
V c k
h H s
s s =-0
s
s x x s x V c V
c h H h h =--00
00
.510100.1015.094.015.023.13??=---x c
c x = 6.8×10-
4 mol·L -
1
质量浓度为: ρx = 6.8×10-4 mol·L -1×207g·mol -1 = 0.14g·L -1 = 0.14 mg·mL -
1
(2)本实验中所用溶液稀释后,溶液中HCl 的浓度为3mol·L -
1,呈强酸性,故除采用通惰性气体除氧外,尚可用Na 2CO 3或Fe 粉来消除氧的干扰。
15-10 用极谱法测定某溶液中的微量铅。取试液5mL ,加1g·L -
1明胶5mL ,用水稀释至50mL 。倒出部分溶液于电解杯中,通氮气10min ,然后在-0.2~-0.6V 间记录极谱图,得波高50格。另取
5mL 试液,加标准铅溶液(0.50mg·mL -
1)1.00mL ,然后照上述分析步骤同样处理,得波高80格。
(1)解释操作规程中各步骤的作用;
(2)计算压缩卡Pb 2+的含量(以g·L -
1计); (3)能不能用加铁粉、亚硫酸钠或能CO 2除氧? 参考答案:
(1)加入1g·L -
1明胶是为了消除极谱极大,通氮气10min 是为了驱除溶液中的氧,消除氧气还原所产生极谱波的干扰。
(2)设试样中Pb 2+的含量为c x ,则
V
V c k
h x
x = ① V
V c V c k H s
s x x += ②
①÷②得:
s
s x x x x V c V c V c H h
+=
11167.0167.05
)5080(50
00.150.0)(--?=?=?-??=-=
L g mL mg V h H h V c c x s s x
(3)在此介质中不能用铁粉、亚硫酸钠或通CO 2来除氧。
因为在中性介质中加入还原铁粉,不能达到产生H 2除去氧气的效果;Na 2SO 3虽可用于中性介质的溶液中,但这里有可能生成PbSO 3沉淀;通CO 2仅适用于酸性介质中。
15-11 在0.1mol·L -
1 KCl 溶液中,Co(NH 3)63+在滴汞电极上进行下列的电极反应而产生极谱波。
Co(NH 3)63+ + e -
= Co(NH 3)62+ E 1/2 = -0.25V
Co(NH 3)63+ + 2e -
= Co + + 6NH 3 E 1/2 = -1.20V
(1)绘出它们的极谱曲线;
(2)两个波中哪个波较高,为什么? 参考答案: (1)
(2)两个波中II 较高,因为电极II 的半波电位更负。?????
根据尤氏方程:i d =607nD 1/2m 2/3τ1/6c 知,在其它条件不变的情况下,i d ∝ n ,II 电极反应的电子转移数为2比I 多,故其产生的波比I 要高。
以E 对i
i i
d -lg
作图如下:
线性方程为:i
i i
V E d ---=lg
0291.04171.0)( 因斜率
0291.00592
.0=n
n = 2
截距为-0.4171,即E 1/2 = -0.417V
15-17 In 3+在0.1mol·L -1 KClO 4溶液中还原为In(Hg)的可逆波半波电位为-0.55V 。当有0.1mol·L -
1 乙二胺(en )同时存在时,形成的络离子In(en)33+的半波电位向负方向位移0.52V 。计算此络合物的稳定常数。
参考答案:因简单金属离子和络离子的半波电位的关系为:
x f S C c n
p K n E E lg 0592
.0lg 0592.0)()(2/12/1--=- 由已知可知:
1.0lg 3
0592.03lg 30592.052.0?--
-=-f K 所以: K f = 2.76×1029
15-19 在pH = 5的醋酸-醋酸盐缓冲溶液中,IO 3-还原为I -
的极谱波的半波电位为-0.50V(vs.SCE ),试根据Nernst 公式判断极谱波的可逆性。
参考答案:已知电极反应:IO 3- + 6H + + 6e - = 3H 2O + I -的标准电极电位为:E θ
= 1.08V ,当电极电位在半波电位时,有:
E θ
= E 1/2 - Slg[H +] = E 1/2 + S pH ?????????? 所以由已知条件可得:
pH mV pH V S /320/32.05
50
.008.1==+=
所以该电极过程不可逆。
15-20 在0.1mol·L -1 NaOH 介质中,用阴极溶出伏安法测定S 2-
。以悬汞电极为工作电极,在-0.40V 时电解富集,然后溶出。
(1)写出富集和溶出时的电极反应式; (2)画出它的溶出伏安示意图。 参考答案:
(1)溶解: Hg = Hg 2+ + 2e -
Hg 2+ + S 2-
= HgS
溶出: HgS + 2e - = Hg + S 2-
(2)伏安示意图如下:
第16章 电解及库仑分析法
16-8 在1.0mol·L -
1 硝酸介质中,电解0.1 mol·L -
1 Pb 2+以PbO 2析出时,如以电解至尚留下0.01%视为已电解完全,此时工作电极电位的变化值为多大?
参考答案:对于Pb 2+的氧化反应 Pb 2+ + 2H 2O = PbO 2 + 4H + + 2e -
]
[][lg 20592.024
//22
22
+
++=+
+
Pb H E E Pb PbO
Pb PbO
θ
开始电解前:[H +]0 = 1.0mol·L -
1,[Pb 2+]0 = 0.1 mol·L -
1 ,则工作电极电位为:
24
/0][][lg
20592.022
+++=+
Pb H E E Pb PbO
θ
电解完全后:[H +]1 = 1.0 + 0.1×4 = 1.4mol·L -
1,[Pb 2+]1 = 0.1×0.01% = 10-
5mol·L -
1 ,则工作电
极电位为:
1
24
1
/1][][lg 20592.022
+
++=+
Pb H E E Pb PbO
θ
电解完全后,工作电极电位变化值为:
V H Pb Pb H E E E 136.00.11
.010
4.1lg 20592.0][][][][lg 20592.054
4
02124
1
01=?=
?=-=?-++++
16-10在1.0mol·L -1 硫酸介质中,电解1.0mol·L -1 硫酸锌与1mol·L -
1 硫酸镉混合溶液。试问:
(1)电解时,锌与镉何者先析出?
(2)能不能用电解法完全分离锌与镉?电解时,应采用什么电极?
V Pt
H
2.0,2-=η,V H g H 0.1,2-=η,0Zn ≈η,0Cd
≈η
参考答案:
(1)电解时,还原电极上,电极电位最正者(最大)最先析出。 对于Zn 2+: Zn 2+ + 2e -
= Zn V E Zn Zn 7628.0/2-=+θ
V
Zn E E U Zn
Zn Zn Zn Zn d 7628.00.1lg 2
0592
.07628.0]lg[2
0592
.02//,22-=+-=+==++
+θ
对于Cd 2+: Cd 2+ + 2e -
= Cd V E Cd Cd 403.0/2-=+θ
V
Cd E E U Cd
Cd Cd Cd Cd d 403.00.1lg 2
0592
.0403.0]lg[2
0592
.02//,22-=+-=+==++
+θ
由于Cd d U .比Zn d U .要正,所以,电解时镉先析出。
(2)当Cd 2+浓度降低至10-
5 mol·L
-1
时,Cd d U .为:
Zn
d Cd
Cd Cd Cd Cd d U V Cd E E U ,52//,551.010lg 2
0592
.0403.0]lg[2
0592
.022>-=+-=+==-++
+θ
所以能用电解法完全分离。 在铂电极上,氢的析出电位为:
V
H E U Pt H H
H Pt H d 18.02.02lg 0592.00.0]lg[0592.0,/)(,22
2-=-+=++=+
+
ηθ
在汞电极上,氢的析出电位为:
V
H E U Hg H H
H Hg H d 98.00.12lg 0592.00.0]lg[0592.0,/)(,22
2-=-+=++=++
ηθ
因 )(,.)(,22H g H d Cd d Pt H d U U U >>,所以应采用汞电极。
16-11 用控制电位电解法电解0.10 mol·L -
1硫酸铜溶液,如控制电解时的阴极电位为0.10V (vs.SCE ),使电解完成。试计算铜离子的析出百分数。
参考答案:设电解完成时Cu 2+的析出百分数为x ,则溶液中剩余Cu 2+浓度为[Cu 2+](1-x ),于是得:
)1](lg[2
0592
.02//,22x Cu E E U Cu Cu Cu Cu Cu d -+
==+++θ
已知:V E Cu Cu 337.0/2=+θ
,V E U U SCE SCE Cu d Cu d 14.024.010.0)(,,=+-=+=,[Cu 2+]= 0.10 mol·L -
1,代入上式得:
)1(10.0lg 2
0592
.0337.014.0x -?+
= 解之得:x = 0.999998 = 99.9998%
16-14 用控制电位库仑法测定Br -。在100.0mL 酸性试液中进行电解,Br -
在铂阳极上氧化为Br 2,当
电解电流降至接近于零时,测得所消耗的电荷量为105.5C 。试计算试液中Br -
的浓度。
参考答案:由 2Br - - 2e -
= Br 2 可知:
至电解完成时,总共电解的Br -
的物质的量为:
mol F Q n Br 31009.196500
5.105-?===
- 所以Br -
的浓度为: 123
1009.1100
.01009.1---??=?==-
-
L mol V n c Br Br 第18章 色谱法导论
18-5 在某色谱条件下,组分A 的保留时间为18.0min ,组分B 保留时间为25.0min ,其死时间为2min ,试计算:(1)组分B 对A 的相对保留值。(2)组分A ,B 的保留因子。(3)组分B 通过色谱柱在流动相、固定相停留的时间是多少?各占保留时间分数为多少?
参考答案:
(1) 4.10
.20.180
.20.25'1'
21212=--====t t k k K K α
(2) 因M
R t t k '=,所以0.80.20.20.18=-=
A k ,5.120.20
.20.25=-=B k (3) 组分B 通过色谱柱在流动相中停留时间即为死时间t M = 2.0min ,占保留时间的分数为
%8%1000
.250
.2=?;在固定相中停留时间为调整保留时间,即为t R -t M = 25.0-2.0 = 23.0min ,占保留时间的分数为
%92%1000
.250
.23=?。
18-7 在长为2m 的气相色谱柱上,死时间为1min ,某组分的保留时间18min ,色谱峰半高0.5min ,计算:(1)此色谱柱的理论塔板数N ,有效理论塔板数N eff 。(2)每米柱长的理论塔板数。(3)色谱柱的理论塔高H ,有效理论塔板高H eff 。
参考答案:
(1)71805.01854.5254.52
2
2/1=??? ??=???
? ?
??=t
t N R
64045.011854.5254.52
2
2/1'=??? ??-=???
? ?
??=t
t N R
eff
(2)每米柱长得理论塔板数和有效理论塔板数:
359027180
==L N 32022
6404==L N eff (3) mm m N L H 28.0108.27180
2
4=?===
- mm m N L H eff eff 44.0104.46404
24=?===
-
18-10 设气相色谱柱的柱温为180℃时,求得van Deemter 方程中的A = 0.08cm ,B = 0.18cm 2/s ,C = 0.03s 。试计算该色谱柱的最佳流速u opt (cm/s)和对应的最小板高H min (cm)值。
参考答案:
s cm C B u opt /45.203.0/18.0/===
cm BC A H 227.003.008.0208.02min =?+=+=
18-11 在200cm 长的气相色谱填充柱上以氮为载气,改变流动相流速,用甲烷测定死时间t M 为100s ,
50s ,25s ,以苯为溶质测定柱效分别为1098,591,306。试计算:(1)van Deemter 方程中的A (cm ),B (cm 2/s ),C (s )值。(2)最佳流速u opt (cm/s )和最小板高H min (cm )。(3)欲保持柱效为最小板高时的70%~90%,载气流速应控制在多少范围?
参考答案:
(1) H = A + B/u + Cu
因为 M M t L
u u L t =
?=
所以 1821.010*********
/2100200
1111===
===
N L H N s cm u 3384.0591200591/450200
2222===
===N L H N s cm u 6536.0306
200306/825
200
3333===
===N L H N s cm u 由此可得:???
?
?
????
++=++=++=C B A C B A C B A 8816536.04413384.02211821.0
解得: A = 0.0207cm B = 0.0068cm 2/s C = 0.079s (2) s cm C B u opt /2934.0079.0/0068.0/===
cm BC A H 06706.0079.00068.020207.02min =?+=+= (3)保持柱效为最小板高时的70%时,cm H H 0958.07
.006706
.07.0min ===
时, 由 H = A + B/u + Cu 得:
0.0958 = 0.0207 + 0.0068/u + 0.079u 解之得:u 1 = 0.6595cm/s u 2= 0.1013cm/s 保持柱效为最小板高时的90%时,cm H H 0745.09
.006706
.09.0min ===
时, 0.0745 = 0.0207 + 0.0068/u + 0.079u
解之得:u 1’ = 0.5133cm/s u 2’ = 0.1677cm/s
故欲保持柱效为最小板高时的70%~90%,载气流速应控制在0.6595~0.5133cm/s 或0.1013~0.1677cm/s 范围
18-14 在柱长为18cm 的高效液相色谱柱上分离组分A 和B ,其保留时间分别为16.40min 和17.63min ;
色谱峰底宽分别为1.11min 和1.21min ,死时间为1.30min 。试计算:(1)色谱柱的平均理论塔板数N ;(2)平均理论塔板高H ;(3)两组分的分离度R 和分离所需时间;(4)欲实现完全分离,即分离度R=1.5,需柱长和分离时间各多少?
参考答案:
(1)7.349211.140.1616162
2
111=???
???=?
??? ??=W t N R 7.339621.163.1716162
2
2
2
2=??? ???=???
? ??=W
t N R 7.344427.33967.3492221=+=+=
N N N (2)cm N L H 3102.57.3444
18-?===
(3)1.121
.111.1)40.1663.17(2)(21212=+-?=+-=
W W t t R R R ,分离时间即t R 2 = 17.63min
(4)柱长为18cm 时
08.130
.140.1630
.163.17'1'2121=--===R R t t k k α,R = 1.1
得: 3528108.108.11.1161162
2
221
=??
? ??-??=??? ??-=ααR N eff
又因
2
121212???
? ??==R R L L
N N e f f
e f f 所以 cm L 5.33181.15.12
2=???? ??= 656035281.15.12
2=???
?
??=eff N
而 2
'
16???
? ?
?=W
t N R eff
得: m i n
50.2421.14
6560
4
22'2=?=
?=W N t eff R 故分离时间为: t R2 = 24.50 + 1.30 = 25.80
18-16 从分布平衡研究中,测定溶质M 和N 在水和正已烷之间的分布平衡常数(hex O H N M K ]/[][2=分别为6.01和6.20。采用吸附水和硅胶填充柱,以正已烷为流动相分离两组分,已知填充柱的V S /V M 为0.442。试计算:(1)各组分保留因子;(2)两组分间的选择因子;(3)实现两组分间分离度为1.5
需多少理论塔板数?(4)若填充柱的板高H 为2.2×10-
3cm ,需多少色谱柱?(5)如流动相流速为7.10cm/min ,洗出两组分需多少时间?
参考答案:
(1)已知 442.0==M
S M S V V
V V K
k 且 所以,当K = 6.01时,k = 6.01×0.442 = 2.66
当K = 6.20时,k = 6.20×0.442 = 2.74 (2)
03.101
.620
.612===
K K α (3) )1)(1(42
2
k k N R +-=
αα 当R = 1.5时, )74
.2174
.2)(03.1103.1(45.1+-=
N 得: N = 79064 (4)L = N ·H = 79064×2.2×10-
3 = 174cm
(5)
min
5.2410
.779064174
)74.274.21()103.103.1(5.116)1()1(
16222222222=??+-??=+-=Nu
L k k R t R αα
18-20 用归一化法测定石油C 8芳烃馏分中各组分含量,进样分析洗出各组分色谱峰面积和已测定的定量校正因子如下,试计算各组分含量。
组分 乙苯 对二甲苯 间二甲苯 邻二甲苯
峰面积/mm 2
180 92 170 110 f ′
0.97 1.00 0.96 0.98 参考答案:
根据
∑=
i
i i
i i f A f A ω 得: %48.32%10098
.011096.017000.19297.018097
.0180=??+?+?+??=乙苯ω
%11.17%10098
.011096.017000.19297.018000
.192=??+?+?+??=
二甲苯ω %36.30%10098
.011096.017000.19297.018096
.0170=??+?+?+??=
间二甲苯ω %01.20%10098
.011096.017000.19297.018098
.0110=??+?+?+??=
邻二甲苯ω
第19章 气相色谱法
19-3 检测器的性能指标灵敏度与检测限有何区别?
参考答案:灵敏度S 定义为:响应信号变化(⊿R )与通过检测物质量变化(⊿Q )之比;
武汉大学分析化学(第五版)下册答案
仪器分析部分作业题参考答案 第一章 绪论 1-2 1、主要区别:(1)化学分析是利用物质的化学性质进行分析;仪器分析是利用物质的物理或物理化学性质进行分析;(2)化学分析不需要特殊的仪器设备;仪器分析需要特殊的仪器设备;(3)化学分析只能用于组分的定量或定性分析;仪器分析还能用于组分的结构分析;(3)化学分析灵敏度低、选择性差,但测量准确度高,适合于常量组分分析;仪器分析灵敏度高、选择性好,但测量准确度稍差,适合于微量、痕量及超痕量组分的分析。 2、共同点:都是进行组分测量的手段,是分析化学的组成部分。 1-5 分析仪器与仪器分析的区别:分析仪器是实现仪器分析的一种技术设备,是一种装置;仪器分析是利用仪器设备进行组分分析的一种技术手段。 分析仪器与仪器分析的联系:仪器分析需要分析仪器才能达到量测的目的,分析仪器是仪器分析的工具。仪器分析与分析仪器的发展相互促进。 1-7 因为仪器分析直接测量的是物质的各种物理信号而不是其浓度或质量数,而信号与浓度或质量数之间只有在一定的范围内才某种确定的关系,且这种关系还受仪器、方法及样品基体等的影响。因此要进行组分的定量分析,并消除仪器、方法及样品基体等对测量的影响,必须首先建立特定测量条件下信号与浓度或质量数之间的关系,即进行定量分析校正。 第二章光谱分析法导论 2-1 光谱仪的一般组成包括:光源、单色器、样品引入系统、检测器、信号处理与输出装置。各部件的主要作用为: 光源:提供能量使待测组分产生吸收包括激发到高能态; 单色器:将复合光分解为单色光并采集特定波长的光入射样品或检测器;样品引入系统:将样品以合适的方式引入光路中并可以充当样品容器的作用;检测器:将光信号转化为可量化输出的信号 信号处理与输出装置:对信号进行放大、转化、数学处理、滤除噪音,然后以合适的方 式输出。 2-2: 单色器的组成包括:入射狭缝、透镜、单色元件、聚焦透镜、出射狭缝。各部件的主要作用为: 入射狭缝:采集来自光源或样品池的复合光;透镜:将入射狭缝采集的复合光分解为平行光;单色元件:将复合光色散为单色光(即将光按波长排列) 聚焦透镜:将单色元件色散后的具有相同波长的光在单色器的出口曲面上成像;出射狭缝:采集色散后具有特定波长的光入射样品或检测器 2-3 棱镜的分光原理是光的折射。由于不同波长的光在相同介质中有不同的折射率,据此能把不同波长的光分开。光栅的分光原理是光的衍射与干涉的总效果。不同波长的光通过光栅衍射后有不同的衍射角,据此把不同波长的光分开。 2-6
分析化学课后作业答案解析
2014年分析化学课后作业参考答案 P25: 1.指出在下列情况下,各会引起哪种误差?如果是系统误差,应该采用什么方法减免? (1) 砝码被腐蚀; (2) 天平的两臂不等长; (3) 容量瓶和移液管不配套; (4) 试剂中含有微量的被测组分; (5) 天平的零点有微小变动; (6) 读取滴定体积时最后一位数字估计不准; (7) 滴定时不慎从锥形瓶中溅出一滴溶液; (8) 标定HCl 溶液用的NaOH 标准溶液中吸收了CO 2。 答:(1)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (2)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (3)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (4)系统误差中的试剂误差。减免的方法:做空白实验。 (5)随机误差。减免的方法:多读几次取平均值。 (6)随机误差。减免的方法:多读几次取平均值。 (7)过失误差。 (8)系统误差中的试剂误差。减免的方法:做空白实验。 3.滴定管的读数误差为±0.02mL 。如果滴定中用去标准溶液的体积分别为2mL 和20mL 左右,读数的相对误差各是多少?从相对误差的大小说明了什么问题? 解:因滴定管的读数误差为mL 02.0±,故读数的绝对误差mL a 02.0±=E 根据%100?T E = E a r 可得 %1%100202.02±=?±= E mL mL mL r %1.0%1002002.020±=?±=E mL mL mL r 这说明,量取两溶液的绝对误差相等,但他们的相对误差并不相同。也就是说,当被测定的量较大时,测量的相对误差较小,测定的准确程度也就较高。 4.下列数据各包括了几位有效数字? (1)0.0330 (2) 10.030 (3) 0.01020 (4) 8.7×10-5 (5) pKa=4.74 (6) pH=10.00 答:(1)三位有效数字 (2)五位有效数字 (3)四位有效数字 (4) 两位有效数字 (5) 两位有效数字 (6)两位有效数字 9.标定浓度约为0.1mol ·L -1 的NaOH ,欲消耗NaOH 溶液20mL 左右,应称取基准物质H 2C 2O 4·2H 2O 多少克?其称量的相对误差能否达到0. 1%?若不能,可以用什么方法予以改善?若改用邻苯二甲酸氢钾为基准物,结果又如何? 解:根据方程2NaOH+H 2C 2O 4·H 2O==Na 2C 2O 4+3H 2O 可知, 需H 2C 2O 4·H 2O 的质量m 1为:
武汉大学分析化学总结
1. 绝对误差:测量值与真实值之间的差值,即E a=x?x T,误差越小,表示测量值与真实值越接近,准确度越高;反之,误差越大,准确度越低.当测量值大于真实值时,误差为正值,表示测定结果偏高;反之,误差为负值,表示测定结果偏低.相对误差:指绝对误差相 当于真实值的百分率,表示为:E r=E a x T ×100%=x?x T x T ×100%,相对误差有大小,正负之 分. 2. 偏差(d)表示测量值(x)与平均值(x )的差值:d=x?x .平均偏差:单次测定偏差的绝对值的平均值: d=1 d1+d2+?+d n= 1 |d i| n i=1 单次测定结果的相对平均偏差(d r)为:d r=d x ×100%. 3. 单次测定的标准偏差的表达式是: s= (x i?x )2 n i=1 相对标准偏差亦称变异系数:RSD=s r=s x ×100%. 4. 精密度←偏差←偶然误差→增加平行实验次数 ↓ d,s,RSD 准确度←误差←系统误差→针对产生的途径减免 ↓ E a,E r 5. 设测量值为A,B,C,其绝对误差为E A,E B,E C,相对误差为E A A ,E B B ,E C C ,标准偏差为s A,s B,s C,计算 结果用R表示,R的绝对误差为E R,相对误差为E R R ,标准偏差为s R. ⑴系统误差的传递公式 ①加减法:若分析结果的计算公式为R=A+B?C,则E R=E A+E B?E C. 如果有关项有系数,例如R=A+mB?C,则为E R=E A+m E B?E C. ②乘除法:若分析结果的计算公式R=A B C ,则E R R =E A A +E B B ?E C C ,如果计算公式带有系数,如 R=m AB C ,同样可得到E R R =E A A +E B B ?E C C . 即在乘除运算中,分析结果的相对系统误差等于各 测量值相对系统误差的代数和. ③指数关系:若分析结果R与测量值A有如下关系R=m A n,其误差传递关系为E R R =n E A A , 即分析结果的相对系统系统误差为测量值的相对系统误差的指数倍. ④对数关系:若分析结果R与测量值A有下列关系R=mlgA,其误差传递关系式为 E R=0.434m E A A . ⑵随机误差的传递,随机误差用标准偏差s来表示最好,因此均以标准偏差传递.
武大版分析化学(上册)答案
第一章概论 1-3 分析全过程: 取样、处理与分解;试样的分离与富集;分析方法的选择;结果的计算与评价。 1-4 标定碱标准溶液时,邻苯二甲酸氢钾(KHC8H4O4, M=204.23g.mol-1)和二水合草酸(H2C2O4. 2H2O, M=126.07g.mol-1)都可以作为基准物质,你认为选择哪一种更好?为什么? 答:选择邻苯二甲酸氢钾更好。因为邻苯二甲酸氢钾的摩尔质量较大,称量误差较小。 1-5.基准物Na2CO3和Na2B4O7·10H2O都可用于标定HCl溶液的浓度.你认为选择哪一种更好为什么 答:选择Na2B4O7·10H2O更好.因为Na2B4O7·10H2O的摩尔质量较大,称量误差较小 1-6 用基准Na2CO3标定HCl溶液时,下列情况会对HCl的的浓度产生何种影响(偏高、偏低或没有影响)? a. 滴定时速度太快,附在滴定管壁的HCl来不及流下来就读取滴定体积 b. 称取Na2CO3时,实际质量为0.0834g,记录时误记为0.1824g c. 在将HCl标准溶液倒入滴定管之前,没有用HCl溶液荡洗滴定管 d. 锥瓶中的Na2CO3用蒸馏水溶解时,多加了50mL蒸馏水 e. 滴定开始之前,忘记调节零点,HCl溶液的液面高于零点 f. 滴定管活塞漏出HCl溶液 g. 称取Na2CO3时,撇在天平盘上 h. 配制HCl溶液时没有混匀 答:使用Na2CO3标定HCl的浓度时,HCl的浓度计算公式为:c HCl=2m Na2CO3/(M Na2CO3V HCl)。 a. 由于V HCl偏高,c HCl偏低; b. 由于m Na2CO3偏低,c HCl偏低; c. 由于V HCl偏高,c HCl偏低; d. 无影响; e. 因为V HCl偏低,c HCl偏高; f. 因为V HCl偏高,c HCl偏低; g. 由于Na2CO3易吸湿,应用减量法称量。称取Na2CO3时,在天平盘上,Na2CO3会吸湿,使m Na2CO3偏低,最终导致c HCl偏低; h. 溶液没有混匀时,很可能的情况是上层较稀,因此c HCl偏低的可能性较大。 1-7. 若将H2C2O4·2H2O基准物质不密封,长期置于放有干燥剂的干燥器中,用它标定NaOH溶液的浓度时,结果是偏高,偏低,还是无影响 答: 若将未密封H2C2O4·2H2O基准物质长期置于放有干燥剂的干燥器中,会使其失去结晶水.用它标定NaOH 溶液的浓度时,消耗NaOH溶液的体积偏高.根据,最终使结果偏低. 1-8. 假设用HCl标准溶液滴定不纯的Na2CO3试样,若出现7题中所述的情况,将会对分析结果产生何种影
分析化学第三版课后习题答案
第三章 思考题与习题 1.指出在下列情况下,各会引起哪种误差?如果是系统误差,应该采用什么方法减免? 答:(1)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (2)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (3)系统误差中的仪器误差。减免的方法:校准仪器或更换仪器。 (4)系统误差中的试剂误差。减免的方法:做空白实验。 (5)随机误差。 (6)系统误差中的操作误差。减免的方法:多读几次取平均值。 (7)过失误差。 (8)系统误差中的试剂误差。减免的方法:做空白实验。 2解:因分析天平的称量误差为mg 2.0±。故读数的绝对误差g a 0002.0±=E 根据%100?T E = E a r 可得 % 2.0%1001000.00002.01.0±=?±= E g g g r %02.0%1000000.10002.01±=?±= E g g g r 这说明,两物体称量的绝对误差相等,但他们的相对误差并不相同。也就是说,当被测定的量较大时,相对误差就比较小,测定的准确程度也就比较高。 3解:因滴定管的读数误差为mL 02.0±,故读数的绝对误差mL a 02.0±=E 根据%100?T E = E a r 可得 % 1%100202.02±=?±= E mL mL mL r %1.0%1002002.020±=?±= E mL mL mL r 这说明,量取两溶液的绝对误差相等,但他们的相对误差并不相同。也就是说,当被测定的量较大时,测量的相对误差较小,测定的准确程度也就较高。 5答::0.36 应以两位有效数字报出。 6答::应以四位有效数字报出。 7答::应以四位有效数字报出。 8答::甲的报告合理。因为在称样时取了两位有效数字,所以计算结果应和称样时相同,都取两位有效数字。 9 解 : 根 据 方 程 2NaOH+H 2C 2O 4·H 2O==Na 2C 2O 4+4H 2O 可知, 需H 2C 2O 4·H 2O 的质量m 1为: g m 13.007.1262 020 .01.01=??= 相 对 误 差 为 %15.0%10013.00002.01=?= E g g r 则相对误差大于0.1% ,不能用 H 2C 2O 4 ·H 2 O 标定0.1mol ·L -1 的NaOH ,可以 选用相对分子质量大的作为基准物来标定。 若改用KHC 8H 4O 4为基准物时,则有: KHC 8H 4O 4+ NaOH== KNaC 8H 4O 4+H 2O 需KHC 8H 4O 4的质量为m 2 ,则 g m 41.022.2042 020 .01.02=??= %049.0%10041.00002.02=?= E g g r 相对误差小于0.1% ,可以用于标定NaOH 。 10答:乙的准确度和精密度都高。因为从两人的数据可知,他们是用分析天平取样。所
武大版分析化学上册答案
第一章概论 1—3 分析全过程: 取样、处理与分解;试样的分离与富集;分析方法的选择;结果的计算与评价. 1-4 标定碱标准溶液时,邻苯二甲酸氢钾(KHC8H4O4, M=204。23g.mol—1)和二水合草酸(H2C2O4. 2H2O, M=126。07g.mol—1)都可以作为基准物质,你认为选择哪一种更好?为什么? 答:选择邻苯二甲酸氢钾更好。因为邻苯二甲酸氢钾的摩尔质量较大,称量误差较小。 1—5.基准物Na2CO3和Na2B4O7·10H2O都可用于标定HCl溶液的浓度.你认为选择哪一种更好为什么答:选择Na2B4O7·10H2O更好.因为Na2B4O7·10H2O的摩尔质量较大,称量误差较小 1—6 用基准Na2CO3标定HCl溶液时,下列情况会对HCl的的浓度产生何种影响(偏高、偏低或没有影响)? a。滴定时速度太快,附在滴定管壁的HCl来不及流下来就读取滴定体积 b. 称取Na2CO3时,实际质量为0.0834g,记录时误记为0。1824g c. 在将HCl标准溶液倒入滴定管之前,没有用HCl溶液荡洗滴定管 d。锥瓶中的Na2CO3用蒸馏水溶解时,多加了50mL蒸馏水 e。滴定开始之前,忘记调节零点,HCl溶液的液面高于零点 f。滴定管活塞漏出HCl溶液 g. 称取Na2CO3时,撇在天平盘上 h. 配制HCl溶液时没有混匀 答:使用Na2CO3标定HCl的浓度时,HCl的浓度计算公式为:c HCl=2m Na2CO3/(M Na2CO3V HCl)。 a。由于V HCl偏高,c HCl偏低; b. 由于m Na2CO3偏低,c HCl偏低; c. 由于V HCl偏高,c HCl偏低; d. 无影响; e。因为V HCl偏低,c HCl偏高; f. 因为V HCl偏高,c HCl偏低; g. 由于Na2CO3易吸湿,应用减量法称量。称取Na2CO3时,在天平盘上,Na2CO3会吸湿,使m Na2CO3偏低,最终导致c HCl偏低; h. 溶液没有混匀时,很可能的情况是上层较稀,因此c HCl偏低的可能性较大. 1—7. 若将H2C2O4·2H2O基准物质不密封,长期置于放有干燥剂的干燥器中,用它标定NaOH溶液的浓度时,结果是偏高,偏低,还是无影响 答:若将未密封H2C2O4·2H2O基准物质长期置于放有干燥剂的干燥器中,会使其失去结晶水。用它标定NaOH溶液的浓度时,消耗NaOH溶液的体积偏高。根据,最终使结果偏低。 1—8. 假设用HCl标准溶液滴定不纯的Na2CO3试样,若出现7题中所述的情况,将会对分析结果产生何
(完整版)分析化学课后答案--武汉大学--第五版-上册-完整版
第1章 分析化学概论 1. 称取纯金属锌0.3250g ,溶于HCl 后,定量转移并稀释到250mL 容量瓶中,定容,摇匀。 计算Zn 2+溶液的浓度。 解:213 0.325065.39 0.0198825010 Zn c mol L +--= =?g 2. 有0.0982mol/L 的H 2SO 4溶液480mL,现欲使其浓度增至0.1000mol/L 。问应加入0.5000mol/L H 2SO 4的溶液多少毫升? 解:112212()c V c V c V V +=+ 220.0982/0.4800.5000/0.1000/(0.480)mol L L mol L V mol L L V ?+?=?+ 2 2.16V mL = 4.要求在滴定时消耗0.2mol/LNaOH 溶液25~30mL 。问应称取基准试剂邻苯二甲酸氢钾(KHC 8H 4O 4)多少克?如果改用 22422H C O H O ?做基准物质,又应称取多少克? 解: 844:1:1NaOH KHC H O n n = 1110.2/0.025204.22/ 1.0m n M cV M mol L L g mol g ===??= 2220.2/0.030204.22/ 1.2m n M cV M mol L L g mol g ===??= 应称取邻苯二甲酸氢钾1.0~1.2g 22422:2:1 NaOH H C O H O n n ?= 1111 2 1 0.2/0.025126.07/0.32m n M cV M mol L L g mol g == =???=
2221 2 1 0.2/0.030126.07/0.42m n M cV M mol L L g mol g ===???=应称取22422H C O H O ?0.3~0.4g 6.含S 有机试样0.471g ,在氧气中燃烧,使S 氧化为SO 2,用预中和过的H 2O 2将SO 2吸收,全部转化为H 2SO 4,以0.108mol/LKOH 标准溶液滴定至化学计量点,消耗28.2mL 。求试样中S 的质量分数。 解: 2242S SO H SO KOH ::: 100%1 0.108/0.028232.066/2100% 0.47110.3%nM w m mol L L g mol g = ????=?= 8.0.2500g 不纯CaCO 3试样中不含干扰测定的组分。加入25.00mL0.2600mol/LHCl 溶解,煮沸除去CO 2,用0.2450mol/LNaOH 溶液反滴定过量酸,消耗6.50mL ,计算试样中CaCO 3的质量分数。 解: 32CaCO HCl : NaOH HCl : 00 1 ()2100%100%1 (0.2600/0.0250.2450/0.0065)100.09/2100% 0.250098.24%cV cV M nM w m m mol L L mol L L g mol g -=?=??-??=?= 9 今含有 MgSO 4·7H 2O 纯试剂一瓶,设不含其他杂质,但 有部分失水变为MgSO 4·6H 2O ,测定其中Mg 含量后,全部按MgSO 4·7H 2O 计算,得质量分数为100.96%。试计算试剂
分析化学实验课后习题答案
实验四铵盐中氮含量的测定(甲醛法) 思考题: 1.铵盐中氮的测定为何不采用NaOH直接滴定法 答:因NH4+的K a=×10-10,其Ck a<10-8,酸性太弱,所以不能用NaOH直接滴定。 2. 为什么中和甲醛试剂中的甲酸以酚酞作指示剂;而中和铵盐试样中的游离酸则以甲基红作指示剂 答:甲醛试剂中的甲酸以酚酞为指示剂用NaOH可完全将甲酸中和,若以甲基红为指示剂,用NaOH滴定,指示剂变为红色时,溶液的pH值为,而甲酸不能完全中和。铵盐试样中的游离酸若以酚酞为指示剂,用NaOH溶液滴定至粉红色时,铵盐就有少部分被滴定,使测定结果偏高。 中含氮量的测定,能否用甲醛法 答:NH4HCO3中含氮量的测定不能用甲醛法,因用NaOH溶液滴定时,HCO3-中的H+同时被滴定,所以不能用甲醛法测定。 实验五混合碱的分析(双指示剂法) 思考题: 1.用双指示剂法测定混合碱组成的方法原理是什么 答:测混合碱试液,可选用酚酞和甲基橙两种指示剂。以HCl标准溶液连续滴定。滴定的方法原理可图解如下: 2.采用双指示剂法测定混合碱,判断下列五种情况下,混合碱的组成
(1) V 1=0 V 2>0(2)V 1>0 V 2=0(3)V 1>V 2(4)V 1 1. 绝对误差:测量值与真实值之间的差值,即,误差越小,表示测量值与真实值越接近,准确度越高;反之,误差越大,准确度越低.当测量值大于真实值时,误差为正值,表示测定结果偏高;反之,误差为负值,表示测定结果偏低.相对误差:指绝对误差相 当于真实值的百分率,表示为:,相对误差有大小,正负之 分. 2. 偏差(d)表示测量值(x)与平均值()的差值:.平均偏差:单次测定偏差的绝对值的平均值: 单次测定结果的相对平均偏差为:. 3. 单次测定的标准偏差的表达式是: 相对标准偏差亦称变异系数:. 4. 精密度偏差偶然误差增加平行实验次数 准确度误差系统误差针对产生的途径减免 5. 设测量值为A,B,C,其绝对误差为相对误差为,标准偏差为,计算结果用R表示,R的绝对误差为,相对误差为,标准偏差为. ⑴系统误差的传递公式 ①加减法:若分析结果的计算公式为,则. 如果有关项有系数,例如,则为. ②乘除法:若分析结果的计算公式,则,如果计算公式带有系数,如 ,同样可得到. 即在乘除运算中,分析结果的相对系统误差等于各测量值相对系统误差的代数和. ③指数关系:若分析结果R与测量值A有如下关系,其误差传递关系为, 即分析结果的相对系统系统误差为测量值的相对系统误差的指数倍. ④对数关系:若分析结果R与测量值A有下列关系,其误差传递关系式为 . ⑵随机误差的传递,随机误差用标准偏差s来表示最好,因此均以标准偏差传递. ①加减法:若分析结果的计算是为R=A+B-C,则.即在加减运算中,不论是相加还是相减,分析结果的标准偏差的平方(称方差)都等于各测量值的标准差平方和.对于一般情况,,应为. ②乘除法:若分析结果的计算式为,则,即在乘除运算中,不论是相乘还是相除,分析结果的相对标准偏差的平方等于各测量值的相对标准偏差的平方之和.若有关项有系数,例如,其误差传递公式与上式相同. ③指数关系:若关系式为,可得到或. ④对数关系:若关系式为,可得到. 6. 如果分析结果R是A,B,C三个测量数值相加减的结果,例如,则极值误差为 ,即在加减法运算中,分析结果可能的极值误差是各测量值绝对 误差的绝对值加和.如果分析结果R是A,B,C三个测量数值相乘除的结果,例如,则极值误差为,即在乘除运算中,分析结果的极值相对误差等于各测量 值相对误差的绝对值之和. 7. 有效数字问题. 在分析化学中常遇到pH, pM,lgK等对数值,其有效数字位数取决于小数部分(尾数)数字的位数,因整数部分(首数)只代表该数的方次.例如,pH=10.28,换算为浓度时,应为,有效数字的位数是两位,不是四位. “四舍六入五成双”规则规定,当测量值中被修约的数字等于或小于4时,该数字舍去;等于或大于6时,则进位;等于5时,要看5前面的数字,若是奇数则进位,若是偶数则将5舍掉,即修约后末位数字都成为偶数;若5后面还有不是“0”的任何数,则此时无论5的前面是奇数还是偶数,均应进位. 8. 有效数字运算规则: ⑴加减法:几个数据相加或相减时,有效数字位数的保留,应以小数点后位数最少的数据为准,其他的数据均修约到这一位.其根据是小数点后位数最少的那个数的绝对误差最大.注意:先修约,在计算. ⑵几个数字相乘除时,有效数字的位数应以几个数中有效数字位数最少的那个数据为准.其根据是有效数字位数最少的那个数的相对误差最大.同样,先修约,再计算.在乘除法的运算中,经常会遇到9以上的大数,如9.00,9.86它们的相对误差的绝对值约为0.1%,与10.06,12.08这些四位有效数字的数值的相对误差绝对值接近,所以通常将它们当作四位有效数字的数值处理。 9. 频数分布: ⑴离散特性,最好的表示方法是标准偏差s,它更能反映出大的偏差,也即离散程度.当测量次数为无限多次时,其标准偏差称为总体标准偏差,用符号来表示,计算公式为 ,式中的为总体平均值. ⑵集中趋势:当数据无限多时将无限多次测定的平均值称为总体平均值,用符号表示,则 第1章绪论 本章暂未编选章节习题,若有最新习题会及时更新。 第2章 光谱分析法导论 一、选择题 1.原子吸收光谱由下列哪种粒子产生的?( ) A .固态物质中原子的外层电子 B .气态物质中基态原子的外层电子 C .气态物质中激发态原子的外层电子 D .气态物质中基态原子的内层电子 【答案】B 【解析】气态和基态原子核外层电子,按其能量高低分壳层分布而形成量子化的能级,在较低温度下都处于基态能级。处于基态原子核外层电子,如果外界所提供特定能量(E )的光辐射恰好等于核外层电子基态与某一激发态(i )之间的能量差(i E )时,核外层电子将吸收特征能量的光辐射由基态跃迁到相应激发态,从而产生原子吸收光谱。 2.Na 原子下列光谱线间哪个能发生跃迁?( ) 【答案】D 【解析】根据量子力学的原理,电子的跃迁不能在任意两个能级之间进行,而必须遵循一定的“选择定则”,这个定则是:(1)△n=0或任意正整数;(2)△L=±1跃迁只允许在S 项和P 项、P 项和S 项或D 项之间、D 项和P 项或F 项之间等;(3)△S=0,即单重项只能跃迁到单重项,三重项只能跃迁到三重项等;(4)△J=0,±1,但当J =0时,△J=0的跃迁是禁阻的。 3.用波长320nm的入射光激发硫酸奎宁的稀硫酸溶液时,将产生320nm的()。 A.散射光(stray light) B.荧光(fluorescence) C.瑞利光(Reyleigh scattering light) D.拉曼光(Raman scattering light) 【答案】C 【解析】瑞利散射光的波长与入射光波长相同。 4.使用磺基水杨酸分光光度法测定微量时,光度计检测器直接测定的是()。 A.入射光的强度 B.透过光的强度 C.吸收光的强度 D.散射光的强度 【答案】B 【解析】检测器是将透过光的强度转变为电信号。 二、名词解释 振动弛豫 答:振动弛豫是指处于激发态的各振动能级将部分能量损失后,其电子则返回到同一电子激发态的最低振动能级的过程。 武汉大学分析实验习题解答(第二版) 实验3---1 分析天平称量练习 1.称量结果应记录至几位有效数字?为什么?j 小数点后4位.因称量误差≦0.1% 2.称量时,应每次将砝码和物体放在天平盘的中央,为什么? 因为是等臂天平.放在天平盘的中央,才能保证等臂,使称量准确. 3.本实验中要求称量偏差不大于0.4m g,为什么? 因为称量一次,允许产生±0.2 mg的偏差, 用递减称量法称量一份试样时,需要连续两次称取容器+试样的质量,故允许产生±0.4 mg的偏差 实验3---2 滴定分析基本操作练习 1.配制NaOH溶液时,应选用何种天平称取试剂?为什么? 感量为0.1g的台秤.因为是粗配溶液 2.HCI和NaOH溶液能直接配制准确浓度吗?为什么? 不能.因浓HCI易挥发,浓度不确定. NaOH易吸收空气中的CO2和水分. 3.在滴定分析实验中,滴定管和移液管为何需用滴定剂和待移取的溶液润洗几次?锥形瓶是否也要用滴定剂润洗? (1)防止待移取的溶液浓度被稀释(2)不能.相当于多加了滴定剂,在滴定之前, 这部分滴定剂已和待测物质发生了反应,影响分析结果的准确度. 4.HCI和NaOH溶液定量反应完全后,生成NaCI和水,为什么用HCI滴定NaOH时,采用甲基橙指示剂,而用NaOH滴定HCI时,使用酚酞或其它合适的指示剂? 因为用HCI→NaOH 指示剂:甲基橙黄→橙 突跃范围PH=4..3-9.7 PH=4.4 4.0 摇动锥形瓶中的NaOH时, CO2影响大(PH≥5时),用甲基橙可有效消除CO2的影响.用酚酞指示剂,会多消耗NaOH,产生较大误差. 用NaOH →HCI, CO2影响小(滴定管液面与空气接触少), 指示剂:酚酞由无色→红色,易观察;而甲基橙,由红色→黄色,难观察. 实验4---1.食用白醋中醋酸含量的测定 1.与其他基准物质比较,邻苯二甲酸氢钾有什么优点? 邻苯二甲酸氢钾易制得纯品,在空气中不吸水,易保存,摩尔质量大,与NaOH 反应的计量比为1:1 2.称取NaOH及邻苯二甲酸氢钾各用什么天平?为什么? 称取NaOH用台秤.因为是粗配NaOH,且称样量较大. 称取邻苯二甲酸氢钾用分析天平.因为需要准确称量, 且称样量小. 3.已标定的NaOH溶液在保存中吸收了二氧化碳,用它来测定HCI的浓度,若以酚酞为指示剂对测定结果有何影响?改用甲基橙,又如何? 测定C HCI,用酚酞指示剂,偏高(多消耗NaOH) 分析化学武汉大学第五版答案 第3章 分析化学中的误差与数据处理 1.根据有效数字运算规则,计算下列算式: (1)19.469+1.537-0.0386+2.54 (2) 3.6 0.032320.59 2.12345 (3) 1000 0000.11245 .0)32.100.24(00.45??-? (4) pH=0.06,求 [H + ]=? 解:a. 原式=19.47+1.54-0.04+2.54=23.51 b. 原式=3.6×0.032×21×2.1=5.1 c. 原式=45.0022.680.1245 =0.1271 1.0001000 ??? d. [H +]=10-0.06 =0.87( mol/L ) 3.设某痕量组分按下式计算分析结果:m C A -= χ,A 为测量 值,C 为空白值,m 为试样质量。已知 s A =s C =0.1,s m =0.001,A =8.0,C =1.0,m =1.0,求s x 。 解: 2 22222 222()422222220.10.10.001 4.0910()()(8.0 1.0) 1.0 A C x m A C m s s s s s s x A C m A C m --++=+=+=+=?--- 且 8.0 1.0 7.01.0 x -= = 故 424.09107.00.14 x s -=??= 5. 反复称量一个质量为 1.0000g 的物体,若标准偏差为0.4mg ,那么测得值为1.0000 1.0008g 的概率为多 少? 解:由0.4mg σ= 1.0000g μ= 故有 1.0000 1.0000 1.0008 1.0000 0.00040.0004 u --≤≤ ,即 02u ≤≤ , 查表得 P=47.73% 7.要使在置信度为95%时平均值的置信区间不超过± s ,问至少应平行测定几次? 解: x x t s x t n μ=±?=± 查表,得: 5, 2.57, 1.049166, 2.45,0.9261 7 5f t f t ====>====<时n 时n 故至少应平行测定次 9. 测定黄铁矿中硫的质量分数,六次测定结果分别为30.48%, 30.42%, 30.59%, 30.51%, 30.56%, 30.49%,计算置信水平95%时总体平均值的置信区间。 解: 6 1 1i i x x n ==∑ 30.48%30.42%30.59%30.51%30.56%30.49% 30.51% 6 +++++= = 6 2 1 () 1 i i x x s n =--∑ 置信度为95%时: 0.05,5,2.57,30.51% 2.5730.51%0.06%6 f t x t n αμ==±=±=± 11.下列两组实验数据的精密度有无显著性差异(置信度90%)? A :9.56,9.49,9.62,9.51,9.58,9.63 , B :9.33,9.51,9.49,9.51,9.56,9.40 解:a. 6 1 19.57i i x x n == =∑ 分析化学 第5章 酸碱平衡和酸碱滴定法 1.写出下列溶液的质子条件式。 a .c 1 mol·L -l NH 3 + c 2 mol·L -l NH 4Cl ; c .c 1 mol·L -l )H 3PO 4 + c 2 mol·L -l HCOOH ; 解: a. 对于共轭体系,由于构成了缓冲溶液,所以可以将其视为由强酸(HCl 和弱碱(NH 3)反应而来,所以参考水准选为HCl, NH 3和H 2O 质子条件式为:[ H + ] + [NH 4+ ] = [Cl -] + [OH -] 或[ H + ] + [NH 4+ ] = c 2 + [OH -] c. 直接取参考水平:H 3PO 4 , HCOOH , H 2O 质子条件式:[H + ] = [H 2PO 4-] + 2[HPO 42-] + 3[PO 43-] + [HCOO -]+[OH -] 3.计算下列各溶液的pH 。 a .0.050 mol·L -l NaAc ; c .0.10 mol·L -l NH 4CN ; e .0.050 mol·L -l 氨基乙酸; g .0.010 mol·L -l H 2O 2液; i .0.060 mol·L -l HCI 和0.050 mol·L -l 氯乙酸钠(ClCH 2COONa)混合溶液。 解: a.对于醋酸而言,K b = K w / K a = 5.6 ? 10-10 应为cK b = 5.6 ? 10 -10 ? 5 ?10-2 = 2.8 ? 10-11 > 10K w c/K b > 100 故使用最简式; [OH - ] = 105.6100.05-?? = 5.29? 10 -6 pH = 14 – pOH = 8.72 c. NH 4+ K a ’ = 5.6 ? 10-10 HCN K a = 6.2. ? 10-10 cK a ’ > 10K w c > 10 K a 由近似公式可以得到: [H + ] = 'a a K K = 20 6.2 5.610-?? = 5.89? 10-10 pH = 10 – 0.77 = 9.23 e. 氨基乙酸一端羧基显酸性,一端氨基显碱性,K a1 = 4.5? 10-3 , K a2 = 2.5 ? 10-10 c/K a2> 100 且c > 10 K a1 所以[H + ] = 12a a K K = 134.2 2.510-?? = 1.06 ? 10-6 pH = 6-0.03 = 5.97 g. 对于双氧水而言,K a = 1.8 ? 10-12 cK a < 10K w c/K a > 100 所以可以计算氢离子浓度 [H + ] = a w cK K + = 1414 1.810110--?+? = 1.67 ? 10-7 pH = 7 – 0.22 = 6.78 i. 由于ClCH 2COONa + HCl = ClCH 2COOH + NaCl 所以原溶液可以看成0.050mol/L 的ClCH 2COOH 和0.010mo/LHCl 的混合溶液设有x mol/L 的ClCH 2COOH 发生离解,则 ClCH 2 COOH ClCH 2COO - + H + 0.05-x x 0.01+x 所以有(0.01)0.05x x x +- = K a = 1.4 ? 10-3 解得x = 4.4 ? 10-3 mol/L 武汉大学分析化学试卷 武汉大学分析化学试卷篇一:武汉大学分析化学试卷及答案 武汉大学2005-2006学年度第一学期《分析化学》期末 考试试卷(A) 学号姓名院(系)分 数 一.填空(每空1分。共35分)1.写出下列各体系的质子条件式: (1) c1(mol/L) NH4 H2PO4 (2) c1(mol/L)NaAc+ c2(mol/L)H3BO3 2.符合朗伯-比尔定律的有色溶液,当有色物质的浓度增大时,其最大吸收波长,透射比。 3. 检验两组结果是否存在显著性差异采用检验法,检验两组数据的精密度是否存在显著性差异采用检验法。4.二元弱酸H2B,已知pH=1.92时,δH2B =δHB-;pH=6.22时δH2B的pKa1=,pKa2=。 HB- =δ B2- , 则 5.已知??(Fe3+/Fe2+)=0.68V,??(Ce4+/Ce3+)=1.44V,则在1mol/L H2SO4溶液中用0.1000 mol/L Ce4+滴定0.1000 mol/L Fe2+,当滴 定分数为0.5时的电位为,化学计量点电位为,电位突跃范围是。6.以二甲酚橙(XO)为指示剂在六亚甲基四胺缓冲溶液中用Zn2+滴定EDTA,终点时溶液颜色由_________变为__________。7.某溶液含Fe3+10mg,用等体积的有机溶剂萃取一次后,该溶液中剩余0.1mg, 3+ 则Fe在两相中的分配比= 。8.容量分析法中滴定方式 有, ,和。9.I2与Na2S2O3的反应式为。10.以波长为横坐标,吸光度为纵坐标,测量某物质对不同波长光的吸收程度,所获得的曲线称谓;光吸收最大处的波长叫做,可用符号表示。 11.紫外可见分光光度计主要 由, ,, 四部分组成. 12.桑德尔灵敏度以符号表示,等于;桑德尔灵敏度与溶液浓度关,与波长关。13.在纸色谱分离中,是固定相。 14..定量分析过程包 括,, ,和。 二、简答题(每小题4分,共20 分,答在所留空白处)1. 什么是基准物质?什么是标准溶液? 2. 分别简单阐述酸碱滴定指示剂,络合滴定指示剂, 氧化还原滴定指示剂和沉淀滴定指示剂指示滴定终点的原理. 3. 在进行络合滴定时,为什么要加入缓冲溶液控制滴定体系保持一定的pH? 4. 吸光光度法中测量条件的选择应注意哪几点? 分析化学实验报告 陈峻 (贵州大学矿业学院贵州花溪550025) 摘要:熟悉电子天平的原理和使用规则,同时可以学习电子天平的基本操作和常用称量方法;学习利用HCl和NaOH相互滴定,便分别以甲基橙和酚酞为指示剂的滴定终点;通过KHC8H4O4标定NaOH溶液,以学习有机酸摩尔质量的测定方法、熟悉常量法滴定操作并了解基准物质KHC8H4O4的性质及应用;通过对食用醋总浓度的测定,以了解强碱滴定弱酸过程中溶液pH的变化以及指示剂的选择。 关键词:定量分析;电子天平;滴定分析;摩尔质量;滴定;酸度,配制与标定 前言 实验是联系理论与实际的桥梁,学好了各种实验,不仅能使学生掌握基本操作技能,提高动手能力,而且能培养学生实事求是的科学态度和良好的实验习惯,促其形成严格的量的观念。天平是大多数实验都必须用到的器材,学好天平的使用是前提,滴定是分析的基础方法,学好配制与滴定是根本。 (一)、分析天平称量练习 一、实验目的: 1. 熟悉电子分析天平的使用原理和使用规则。 2 . 学习分析天平的基本操作和常用称量法。 二、主要试剂和仪器 石英砂电子分析天平称量瓶烧杯小钥匙 三、实验步骤 1. 国定质量称量(称取0.5000 g 石英砂试样3份) 打开电子天平,待其显示数字后将洁净、干燥的小烧杯放在秤盘上,关好天平门。然后按自动清零键,等待天平显示0.0000 g。若显示其他数字,可再次按清零键,使其显示0.0000 g。 打开天平门,用小钥匙将试样慢慢加到小烧杯中央,直到天平显示0.5000 g。然后关好天平门,看读数是否仍然为0.5000g。若所称量小于该值,可继续加试样;若显示的量超过该值,则需重新称量。每次称量数据应及时记录。 2.递减称量(称取0.30~0.32 g石英砂试样3 份) 按电子天平清零键,使其显示0.0000 g,然后打开天平门,将1个洁净、干燥的小烧杯放在秤盘上,关好天平门,读取并记录其质量。 另取一只洁净、干燥的称量瓶,向其中加入约五分之一体积的石英砂,盖好盖。然后将其置于天平秤盘上,关好天平门,按清零键,使其显示0.0000 g。取出称量瓶,将部分石英砂轻敲至小烧杯中,再称量,看天平读数是否在-0.30~-0.32 g 范围内。若敲出量不够,则继续敲出,直至与从称量瓶中敲出的石英砂量,看其差别是否合乎要求(一般应小于0.4 mg)。若敲出量超过0.32 g,则需重新称量。重复上述操作,称取第二份和第三份试样。 四、实验数据记录表格 表1 固定质量称量 编号 1 2 3 第1章分析化学概论 2. 有0.0982mol/L的H 2SO 4 溶液480mL,现欲使其浓度增至0.1000mol/L。问应加入0.5000mol/L H 2 SO 4 的溶 液多少毫升?解: 4.要求在滴定时消耗0.2mol/LNaOH溶液25~30mL。问应称取基准试剂邻苯二甲酸氢钾(KHC 8H 4 O 4 )多少克? 如果改用做基准物质,又应称取多少克?解: 应称取邻苯二甲酸氢钾1.0~1.2g 应称取0.3~0.4g 6.含S 有机试样0.471g ,在氧气中燃烧,使S 氧化为SO 2,用预中和过的H 2O 2将SO 2吸收,全部转化为H 2SO 4,以0.108mol/LKOH 标准溶液滴定至化学计量点,消耗28.2mL 。求试样中S 的质量分数。 解: 8.0.2500g 不纯CaCO 3试样中不含干扰测定的组分。加入25.00mL0.2600mol/LHCl 溶解,煮沸除去CO 2,用0.2450mol/LNaOH 溶液反滴定过量酸,消耗6.50mL ,计算试样中CaCO 3的质量分数。 解: 10.不纯Sb 2S 30.2513g ,将其置于氧气流中灼烧,产生的SO 2通入FeCl 3溶液中,使Fe 3+还原至Fe 2+,然后用0.02000mol/LKMnO 4标准溶液滴定Fe 2+,消耗溶液31.80mL 。计算试样中Sb 2S 3的质量分数。若以Sb 计,质量分数又为多少? 解: 12. 用纯As 2O 3 标定KMnO 4 溶液的浓度。若0.211 2 g As 2 O 3 在酸性溶液中恰好与36.42 mL KMnO 4 反应。求该 KMnO 4 溶液的浓度。 解:故 14.H 2C 2 O 4 作为还原剂。可与KMnO 4 反应如下: 其两个质子也可被NaOH标准溶液滴定。分别计算0.100mol·L-1NaOH和0.100 mol·L-1 KMnO 4 溶液与500mg H 2C 2 O 4 完全反应所消耗的体积(mL)。 解:最新武汉大学分析化学总结
武汉大学《分析化学》(第5版)(下册)【章节题库】- 第1~9章【圣才出品】
武汉大学分析化学实验习题解答(第二版)
分析化学武汉大学第五版答案
分析化学武汉大学第五版答案
武汉大学分析化学试卷
分析化学实验报告(武汉大学第五版)
武汉大学分析化学第五版课后练习答案
