蛋白保存方法(Protein_stability_and_storage_)

TECHNICAL RESOURCE
Introduction
Proteins comprise an extremely heterogeneous class of biological macromolecules. They are often unstable when not in their native environments, which can vary considerably among cell compartments and extracellular fluids. If certain buffer
conditions are not maintained, extracted proteins may not function properly or remain soluble. Proteins can lose activity as a of the protein and the storage conditions used. Optimal conditions for storage are distinctive to each protein; nevertheless, it is possible to suggest some general guidelines for protein storage and stability.
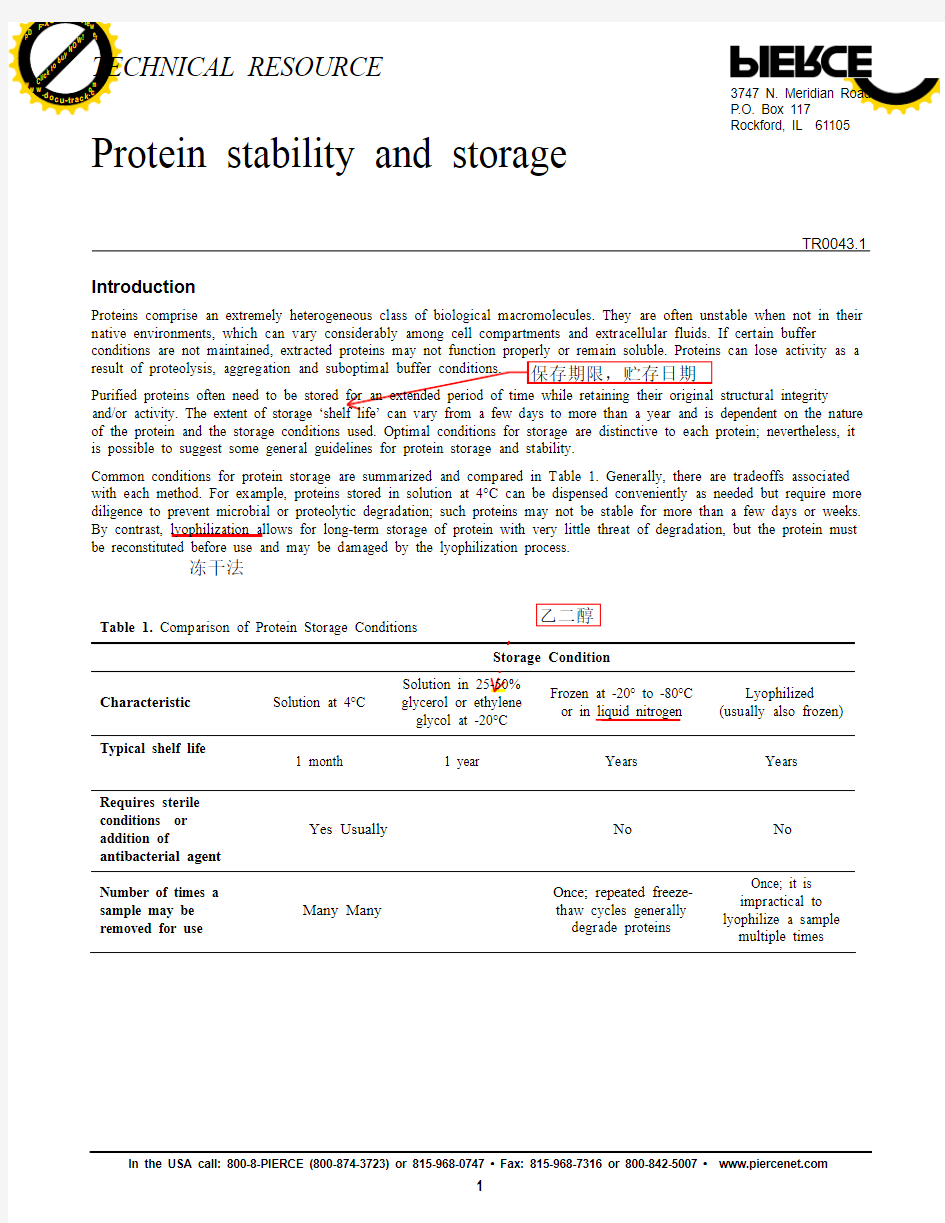
Common conditions for protein storage are summarized and compared in Table 1. Generally, there are tradeoffs associated with each method. For example, proteins stored in solution at 4°C can be dispensed conveniently as needed but require more diligence to prevent microbial or proteolytic degradation; such proteins may not be stable for more than a few days or weeks. By contrast, lyophilization allows for long-term storage of protein with very little threat of degradation, but the protein must be reconstituted before use and may be damaged by the lyophilization process. Table 1. Comparison of Protein Storage Conditions
Characteristic Solution at 4°C
Solution in 25-50% glycerol or ethylene Frozen at -20° to -80°C or in liquid nitrogen
Lyophilized (usually also frozen)
Typical shelf life
1 month
1 year
Years
Years
Requires sterile conditions or addition of
antibacterial agent Yes Usually No No
Number of times a sample may be removed for use Many Many Once; repeated freeze-thaw cycles generally
degrade proteins
impractical to lyophilize a sample multiple times
Protein stability and storage
l t O
w
.d o
c u -t r a c k
.c
C i c k
o b u y
N w
w
o
m
冻干法
Temperature:
Generally, proteins are best stored at ≤ 4°C in clean, autoclaved glassware or polypropylene tubes. Storage at room
temperature often leads to protein degradation and/or inactivity, commonly as a result of microbial growth. For short term storage (1 day to a few weeks), many proteins may be stored in simple buffers at 4°C. Protein Stabilizing Cocktail (Product No. 89806) is a 4X solution that helps to extend the shelf-life of most proteins for storage at 4° C or -20°C compared to storage in simple phosphate or Tris buffers.
For long term storage for 1 month to 1 year, some researchers choose to bead single-use aliquots of the protein in liquid nitrogen for storage in clean plastic containers under liquid nitrogen. This method involves adding the protein solution drop-wise (about 100 μl each) into a pool of liquid nitrogen, then collecting the drop-sized frozen beads and storing them in cryovials under liquid nitrogen.
Frozen at -20°C or -80°C is the more common form of cold protein storage. Because freeze-thaw cycles decrease protein solution will not have to be refrozen. Alternatively, addition of 50% glycerol or ethylene glycol (see Additives section below) will prevent solutions from freezing at -20°C, enabling repeated use from a single stock without warming (i.e., thawing).
Protein Concentration:
Dilute protein solutions (< 1 mg/ml) are more prone to inactivation and loss as a result of low-level binding to the storage vessel. Therefore, it is common practice to add “carrier” or “filler” protein, such as purified bovine serum albumin (BSA) to 1-5 mg/ml (0.1-0.5%), to dilute protein solutions to protect against such degradation and loss.
Additives:
Many compounds may be added to protein solutions to lengthen shelf life: ?
Protein Stabilizing Cocktail (Product No. 89806) is a 4X solution that helps to extend the shelf-life of most proteins for storage at 4°C or -20°C.
? Cryoprotectants such as glycerol or ethylene glycol to a final concentration of 25-50% help to stabilize proteins by preventing the formation of ice crystals at -20°C that destroy protein structure. ? Protease inhibitors prevent proteolytic cleavage of proteins (Table 2).
? Anti-microbial agents such as sodium azide (NaN 3) at a final concentration of 0.02-0.05% (w/v) or thimerosal at a final concentration of 0.01 % (w/v) inhibit microbial growth.
? Metal chelators such as EDTA at a final concentration of 1-5 mM avoid metal-induced oxidation of –SH groups and helps to maintain the protein in a reduced state.
? Reducing agents such a dithiothreitol (DTT) and 2-mercaptoethanol (2-ME) at final concentrations of 1-5 mM also help to maintain the protein in the reduced state by preventing oxidation of cysteines.
Table 2. Common Protease Inhibitors Protease Inhibitor Target Protease Working Concentration Benzamidine Serine proteases 1 mM Pepstatin A Acid proteases 1 μg/ml Leupeptin Thiol proteases 1 μg/ml Aprotinin Serine proteases 5 μg/ml Antipain Thiol proteases 1 μg/ml EDTA and EGTA Metalloproteases 0.1-1 mM
热压处理过的玻璃器皿
反复冻融
稀释的
Antibody stock solutions (e.g., 1 mg/ml) often may be stored at 4°C for days to weeks without significant loss in activity. For increased stability, glycerol or ethylene glycol may be added to a final concentration of 50% and the antibody stored at -20°C. Alternatively, the antibody solution may be stored in small working aliquots at -20°
Generally, antibody conjugates are best stored at -20°C with glycerol or ethylene glycol added at a final concentration of 50%. Although some enzyme conjugates may be stored at -20°C without cryoprotectant, frozen stocks must be as single use aliquots to prevent repeated freeze-thaw cycles; alkaline phosphatase conjugates are particularly sensitive to freezing. Conjugates typically maintain good activity for 1-2 years if stored at -20°C with glycerol or ethylene glycol. However, contaminants in cryoprotectants may affect enzyme activity, and few researchers take steps to ensure the purity of the cryoprotectant used. Pierce offers Ethylene Glycol (Product No. 29810) that is suitable for enzyme storage because impurities have been removed during the manufacturing process. Ethylene glycol does not support microbial growth, making it preferable to glycerol.
Pierce also offers SuperFreeze? (Product No. 31503) and Guardian? (Product No. 37548) Products, which are multi-component cryoprotectants that provide buffered anti-freeze conditions for the storage of horseradish peroxidase (HRP) conjugates. SuperFreeze? Peroxidase Conjugate Stabilizer allows freezer storage of peroxidase conjugates, substituting for glycerol or ethylene glycol and ensuring stable liquid storage at -20°C. Guardian? Peroxidase Conjugate Stabilizer/Diluent allows room temperature or 4°C storage of peroxidase conjugates in diluted form (as low as 10 ng/ml). Working dilutions for ELISA or Western blotting be prepared and stored up to 18 months at 4°C.
Related Pierce Products
89806 Protein Stabilizing Cocktail (4X), 10 ml
29810 Ethylene Glycol (50% aqueous solution), 200 ml
31503 SuperFreeze? Peroxidase Conjugate Stabilizer, 25 ml
37548 Guardian Peroxidase Conjugate Stabilizer/Diluent, 200 ml
37552 Guardian Peroxidase Conjugate Stabilizer/Diluent, 1 liter
78410 Halt? Protease Inhibitor Cocktail kit with EDTA, 2 ml
78415 Halt? Protease Inhibitor Cocktail EDTA free, 1 ml
5 mg
fluoride),
36978 PMSF
(Phenylmethylsulfonyl
?Pierce Biotechnology, Inc., 9/2005. Printed in the USA.
蛋白质的纯化方法
蛋白质纯化的方法 蛋白质的分离纯化方法很多,主要有: (一)根据蛋白质溶解度不同的分离方法 1、蛋白质的盐析 中性盐对蛋白质的溶解度有显著影响,一般在低盐浓度下随着盐浓度升高,蛋白质的溶解度增加,此称盐溶;当盐浓度继续升高时,蛋白质的溶解度不同程度下降并先后析出,这种现象称盐析,将大量盐加到蛋白质溶液中,高浓度的盐离子(如硫酸铵的SO4和NH4)有很强的水化力,可夺取蛋白质分子的水化层,使之“失水”,于是蛋白质胶粒凝结并沉淀析出。盐析时若溶液pH在蛋白质等电点则效果更好。由于各种蛋白质分子颗粒大小、亲水程度不同,故盐析所需的盐浓度也不一样,因此调节混合蛋白质溶液中的中性盐浓度可使各种蛋白质分段沉淀。 影响盐析的因素有:(1)温度:除对温度敏感的蛋白质在低温(4度)操作外,一般可在室温中进行。一般温度低蛋白质溶介度降低。但有的蛋白质(如血红蛋白、肌红蛋白、清蛋白)在较高的温度(25度)比0度时溶解度低,更容易盐析。(2)pH值:大多数蛋白质在等电点时在浓盐溶液中的溶介度最低。(3)蛋白质浓度:蛋白质浓度高时,欲分离的蛋白质常常夹杂着其他蛋白质地一起沉淀出来(共沉现象)。因此在盐析前血清要加等量生理盐水稀释,使蛋白质含量在2.5-3.0%。 蛋白质盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠、磷酸钠等。其中应用最多的硫酸铵,它的优点是温度系数小而溶解度大(25度时饱和溶液为4.1M,即767克/升;0度时饱和溶解度为3.9M,即676克/升),在这一溶解度范围内,许多蛋白质和酶都可以盐析出来;另外硫酸铵分段盐析效果也比其他盐好,不易引起蛋白质变性。硫酸铵溶液的pH常在4.5-5.5之间,当用其他pH值进行盐析时,需用硫酸或氨水调节。 蛋白质在用盐析沉淀分离后,需要将蛋白质中的盐除去,常用的办法是透析,即把蛋白质溶液装入秀析袋内(常用的是玻璃纸),用缓冲液进行透析,并不断的更换缓冲液,因透析所需时间较长,所以最好在低温中进行。此外也可用葡萄糖凝胶G-25或G-50过柱的办法除盐,所用的时间就比较短。
GY001人血白蛋白生产工艺规程
目录 一、人血白蛋白产品概述…………………………………………………………………2页 二、人血白蛋白分离分装工艺流程图及环境区域划分…………………………………5页 三、人血白蛋白生产操作过程及工艺条件………………………………………………7页 四、主要设备一览表及设备生产能力……………………………………………………29页 五、原辅料、包装材料、中间品、原液、半成品、成品质量标准和技术参数……………………30页 六、包装要求、标签、说明书的使用与贮存方法………………………………………47页 七、工艺卫生……………………………………………………………………………48页 八、安全和劳动保护………………………………………………………………………52页 九、劳动组织与岗位定员…………………………………………………………………54页 十、三废处理………………………………………………………………………………56页十一、附录(常用生物制品术语和名词解释) …………………………………………57页十二、附录(常用理化常数、换算表)……………………………………………………59页十三、附页(供修改时登记批准日期、文号和内容用)…………………………………60页
一、产品概述 本品系由乙型肝炎疫苗免疫健康人的血浆经低温乙醇蛋白分离法提取的组分V,经纯化、脱醇、60℃10小时加温灭活病毒后,除菌分装而成的液体制剂。白蛋白含量97%以上,用适量辛酸钠作稳定剂,不含防腐剂和抗生素,专供静脉输注。主要用于治疗创伤性、出血性休克、严重烧伤以及低蛋白血症等。 1 药品名称 通用名:人血白蛋白 英文名:Human Albumin 汉语拼音: Renxue Baidanbai 主要组成成份:人血白蛋白 2 性状 本品为略黏稠,黄色或绿色至棕色澄明液体。不应出现混浊。 3 药理作用 3.1 .增加血容量和维持血浆胶体渗透压:白蛋白占血浆胶体渗透压的80%,主要调节组织与血管之间水分的动态平衡。由于白蛋白分子量较高,与盐类及水分相比,透过膜内速度较慢,使白蛋白的胶体渗透压与毛细管的静力压抗衡,以此维持正常与恒定的血容量;同时在血循环中,1g白蛋白可保留18ml水,每5g白蛋白保留循环内水分的能力约相当于100ml血浆或200ml全血的功能,从而起到增加循环血容量和维持血浆胶体渗透压的作用。 3.2 运输及解毒:白蛋白能结合阴离子也能结合阳离子,可以输送不同的物质,也可以将有毒物质输送到解毒器官。 3.3 营养供给:组织蛋白和血浆蛋白可互相转化,在氮代谢障碍时,白蛋白可作为氮源为组织提供营养。 4 适应症 4.1 失血创伤、烧伤引起的休克。 4.2 脑水肿及损伤引起的颅压升高。 4.3 肝硬化及肾病引起的水肿或腹水。
蛋白质分离纯化的步骤
蛋白质分离纯化的一般程序可分为以下几个步骤: (一)材料的预处理及细胞破碎 分离提纯某一种蛋白质时,首先要把蛋白质从组织或细胞中释放出来并保持原来的天然状态,不丧失活性。所以要采用适当的方法将组织和细胞破碎。常用的破碎组织细胞的方法有: 1. 机械破碎法 这种方法是利用机械力的剪切作用,使细胞破碎。常用设备有,高速组织捣碎机、匀浆器、研钵等。 2. 渗透破碎法 这种方法是在低渗条件使细胞溶胀而破碎。 3. 反复冻融法 生物组织经冻结后,细胞内液结冰膨胀而使细胞胀破。这种方法简单方便,但要注意那些对温度变化敏感的蛋白质不宜采用此法。 4. 超声波法 使用超声波震荡器使细胞膜上所受张力不均而使细胞破碎。 5. 酶法 如用溶菌酶破坏微生物细胞等。 (二)蛋白质的抽提 通常选择适当的缓冲液溶剂把蛋白质提取出来。抽提所用缓冲液的pH、离子强度、组成成分等条件的选择应根据欲制备的蛋白质的性质而定。如膜蛋白的抽提,抽提缓冲液中一般要加入表面活性剂(十二烷基磺酸钠、tritonX-100 等),使膜结构破坏,利于蛋白质与膜分离。在抽提过程中,应注意温度,避免剧烈搅拌等,以防止蛋白质的变性。(三)蛋白质粗制品的获得选用适当的方法将所要的蛋白质与其它杂蛋白分离开来。比较方便的有效方法是根据蛋白质溶解度的差异进行的分离。常用的有下列几种方法: 1.等电点沉淀法不同蛋白质的等电点不同,可用等电点沉淀法使它们相互分离。 2.盐析法 不同蛋白质盐析所需要的盐饱和度不同,所以可通过调节盐浓度将目的蛋白沉淀析出。被盐析沉淀下来的蛋白质仍保持其天然性质,并能再度溶解而不变性。 3.有机溶剂沉淀法 中性有机溶剂如乙醇、丙酮,它们的介电常数比水低。能使大多数球状蛋白质在水溶液中的溶解度降低,进而从溶液中沉淀出来,因此可用来沉淀蛋白质。此外,有机溶剂会破坏蛋白质表面的水化层,促使蛋白质分子变得不稳定而析出。由于有机溶剂会使蛋白质变性,使用该法时,要注意在低温下操作,选择合适的有机溶剂浓度。 (四)样品的进一步分离纯化
生物制品生产用原材料及辅料的质量控制规程推荐WORD范文
生物制品生产用原材料及辅料的质量控制规程 生物制品是采用生物技术制备而成的具有活性的药品。生物制品的生产工艺复杂且易受多种因素影响,生产过程中使用的各种材料来源复杂,可能引入外源因子或毒性化学材料;产品组成成分复杂且一般不能进行终端灭菌,产品的质量控制仅靠成品检定难以保证其安全性和有效性。因此,对生物制品生产用原材料和辅料进行严格的质量控制,是降低制品中外源因子或有毒杂质污染风险,保证生物制品安全有效的必要措施。 本规程是对生物制品生产企业在生物制品生产过程中使用的原材料和辅料质量控制的通用性要求。 一、生物制品生产用原材料 生物制品生产用原材料系指生物制品生产过程中使用的所有生物材料和化学材料。 本规程所述原材料不包括用于生物制品生产的起始原材料(如细胞基质、 菌毒种、生产用人血浆和动物免疫血清等) 1.分类 按照来源可将生物制品生产用原材料分为两大类,一类为生物原材料,主要包括来源于微生物,人和动物细胞、组织、体液成分,以及采用重组技术或生物合成技术生产的生物原材料等;另一类为化学原材料,包括无机和有机化学材料。 2.风险等级分级及用于生产的质量控制要求 根据原材料的来源、生产以及对生物制品潜在的毒性和外源因子污染风险等,将生物制品生产用原材料按风险级别从低到高分为以下四级,各级生物制品原 材料至少应进行的质量控制要求见附表1;对于不同风险级别原材料的质量控制,应充分考虑来源于动物(或人)的生物原材料可能带来的外源因子污染的安全性风险。 生产过程中应避免使用毒性较大的化学原材料,有机溶剂的使用应符合本版药 典附录“残留溶剂检测”的相关要求。 第1级为较低风险的原材料,为已获得上市许可的生物制品或药品无菌制剂。如人血白蛋白、各种氨基酸、抗生素注射剂等。 第2级为低风险原材料,这类原材料为已有国家药品标准、取得国家药品批准文号并按照我国现行药品GMP生产的用于生物制品培养基成分以及提取、纯化、灭活等过程的化学原料药和药用级非动物来源的蛋白水解酶等。 第3级为中等风险等级原材料,这类原材料为非药用,包括生物制品生产用培养基成分、非动物来源蛋白水解酶、用于靶向纯化的单克隆抗体,以及用于 生物制品提取、纯化、灭活的化学试剂等。这类生物制品原材料的质量控制要求应
蛋白质的分离纯化--有机溶剂分离纯化法
蛋白质的分离纯化--有机溶剂分离纯化法 文章出处:朱敏 蛋白质的分离纯化--有机溶剂分离纯化法 有机溶剂能降低溶液的介电常数,从而增加蛋白质分子上不同电荷的引力,导致溶解度降低。有机溶剂与水作用能破坏蛋白质的水化膜,使蛋白质在一定浓度的有机溶剂中沉淀析出。常用的有机溶剂是乙醇和丙酮,由于有机溶剂的加入易引起变性失活,尤其乙醇和水混合释放热量,操作一般宜在低温下进行,且在加入有机溶剂时注意搅拌均匀以免局部浓度过大。用此法所析出的沉淀一般比盐析法易过滤或离心沉降。分离后的蛋白质沉淀应立即用水或缓冲液溶解,以降低有机溶剂的浓度。操作时的pH值大多数控制在待沉淀蛋白质等电点附近。有机溶剂在中性盐存在时能增加蛋白质的溶解度,减少变性和提高分离的效果。一般在有机溶剂沉淀时添加中性盐的浓度在0.05mol左右,过多不仅耗费有机溶剂,而且可能导致沉淀不好.沉淀的条件一经确定,就必须严格控制,才能得到重复性结果.有机溶剂浓度通常以有机溶剂和水容积比或用百分浓度素示.故操作条件比盐析法严格。 许多有机溶剂,如碳链较长的醇,它溶于水,但有限度。其量大到一定程度后则分成两相,一相以水为主,一相以有机溶剂为主。某些第3组分的存在可以改变两相的比例和组成。有许多蛋白质在两相中均能溶解,形成分配。在同一个两相的溶剂系统中,不同的蛋白质有不同的分配系数。根据这一原理,操作全部机械化的有逆流分溶。因要求实验室温度恒定且操作也繁杂,虽一直有人在用但很不普遍。分配层析也是应用这一原理,但在分离纯化蛋白质工作中用得不多,主要是因为多数蛋白质在有机溶剂中,特别是在易与水分相的溶剂中溶解度小且易变性。 疏水层析是近年发展的新方法。它利用蛋白质表面有一部分疏水性,与带有疏水性的载体在高盐浓度时结合。洗脱时将盐浓度逐渐降低,蛋白质因疏水性不同而逐个地先后被洗脱而纯化。此法能分离其它一些方法不易纯化的蛋白质。 利用分子形状和大小不同的分离方法 蛋白质形状有细长的如纤维,有密实的如圆球,形状很不相同。蛋白质的分子量从6000左右开始,有各种大小,大的可以大到几百万。利用这些差别,有几种方法可用来分离蛋白质。 凝胶层析 属最常用的蛋白质分离方法。系混合物随流动相流经装有凝胶作为固定相的层析柱时,混合物中各物质因分子大小不同而被分离的技术。所指凝胶从广义上说是一类具有三维空间多孔网状结构的物质,如天然物质中的马铃薯淀粉及琼脂糖凝胶,人工合成品的葡聚糖凝胶及带离子交换基团的葡聚糖凝胶等。把适当的凝胶颗粒装填到玻璃管中制成层析柱,于柱内加入欲分离的混合物,然后用大量蒸镏水或其它稀溶液洗柱,由于混合物中各物质的分子大小和形状不同,在洗柱过程中,分子量最大的物质不能进入凝胶网孔而沿凝胶颗粒间的空隙最先流出柱外。分子量最小的物质因能进入凝胶网孔而受阻滞,流速缓慢,致使最后流出柱外。整个过程和过滤相似,故又名凝胶过滤、凝胶渗透过滤、分子筛过滤等。由于物质在分离过程中的阻滞减速现象,有人也称之为阻滞扩散层析、排阻层析等。
蛋白纯化的一般原则及方法选择
随着分子生物学的发展,越来越多的科研人员熟练掌握了分子生物学的各种试验技术,并研制成套试剂盒,使基因克隆表达变得越来越容易lIl。但分子生物学的上游工作往往并非是最终目的,分子克隆与表达的关键是要拿到纯的表达产物,以研究其生物学作用,或者大量生产出可用于疾病治疗的生物制品。相对与上游工作来说,分子克隆的下游工作显得更难,蛋白纯化工作非常复杂,除了要保证纯度外,蛋白产品还必须保持其生物学活性。纯化工艺必须能够每次都能产生相同数量和质量的蛋白,重复性良好。这就要求应用适应性非常强的方法而不是用能得到纯蛋白的最好方法去纯化蛋白。在实验室条件下的好方法却可能在大规模生产应用中失败,因为后者要求规模化,且在每日的应用中要有很好的重复性。本文综述了蛋白质纯化的基本原则和各种蛋白纯化技术的原理、优点及局限性,以期对蛋白纯化的方法选择及整体方案的制定提供一定的指导。 1 蛋白纯化的一般原则 蛋白纯化要利用不同蛋白间内在的相似性与差异,利用各种蛋白间的相似性来除去非蛋白物质的污染,而利用各蛋白质的差异将目的蛋白从其他蛋白中纯化出来。每种蛋白间的大小、形状、电荷、疏水性、溶解度和生物学活性都会有差异,利用这些差异可将蛋白从混合物如大肠杆菌裂解物中提取出来得到重组蛋白。蛋白的纯化大致分为粗分离阶段和精细纯化阶段二个阶段。粗分离阶段主要将目的蛋白和其他细胞成分如DNA、RNA等分开,由于此时样本体积大、成分杂,要求所用的树脂高容量、高流速,颗粒大、粒径分布宽.并可 以迅速将蛋白与污染物分开,防止目的蛋白被降解。精细纯化阶段则需要更高的分辨率,此阶段是要把目的蛋白与那些大小及理化性质接近的蛋白区分开来,要用更小的树脂颗粒以提高分辨常用的离子交换柱和疏水柱,应用时要综合考虑树脂的选择性和柱效两个因素。选择性指树脂与目的蛋白结合的特异性,柱效则是指蛋白的各成分逐个从树脂上集中洗脱的能力,洗脱峰越窄,柱效越好。仅有好的选择性,洗脱峰太宽,蛋白照样不能有效分离。 2.各种蛋白纯化方法及优缺点 2.1蛋白沉淀蛋白能溶于水是因为其表面有亲水性氨基酸。在蛋白质的等电点处若溶液的离子强度特别高或特别低,蛋白则倾向于从溶液中析出。硫酸铵是沉淀蛋白质最常用的盐,因为它在冷的缓冲液中溶解性好,冷的缓冲液有利于保护蛋白的活性。硫酸铵分馏常用做纯化的第一步,它可以初步粗提蛋白质,去除非蛋白成分。蛋白质在硫酸铵沉淀中较稳定,可以短期在这种状态下保存中间产物,当前蛋白质纯化多采用这种办法进行粗分离翻。在规模化生产上硫酸铵沉淀方法仍存在一些问题,硫酸铵对不锈钢器具的腐蚀性很强。其他的盐如硫酸钠不存在这种问题,但其纯化效果不如硫酸铵。除了盐析外蛋白还可以用多聚物如PEG 和防冻剂沉淀出来,PEG是一种惰性物质,同硫酸铵一样对蛋白有稳定效果, 在缓慢搅拌下逐渐提高冷的蛋白溶液中的PEG浓度,蛋白沉淀可通过离心或过滤获得,蛋白可在这种状态下长期保存而不损坏。蛋白沉淀对蛋白纯化来说并不是多么好的方法,因为它只能达到几倍的纯化效果,而我们在达到目的前需要上千倍的纯化。其好处是可以把蛋白从混杂有蛋白酶和其他有害杂质的培养基及细胞裂解物中解脱出来。
影响生鲜乳蛋白质含量的因素及调控措施.
影响生鲜乳蛋白质含量的因素及调控措施 刘桂瑞,李正洪,李兆林 摘要:生鲜乳中乳蛋白含量受许多因素的影响,如遗传、生理阶段、环境、疾病及饲养方式等,而奶牛日粮营养成分是影响生鲜乳中乳蛋白含量的主要因素。合理配制平衡日粮 ,对提高乳蛋白含量有重要作用。 关键词:乳蛋白;含量;影响因素 牛奶中蛋白质和脂肪含量是决定牛奶营养价值的重要指标之一。乳蛋白是一种营养价值很高的蛋白质,它的氨基酸含量和构成比例基本上与人体所需氨基酸的数量、比例接近。乳蛋白含量受许多因素的影响,如遗传、生理阶段、环境、疾病及饲养方式等,而奶牛日粮营养是影响生鲜乳中乳蛋白含量的重要因素。合理配制平衡日粮,对提高乳蛋白含量具有重要作用。 1 乳中蛋白质的合成 现已证明,90%以上的乳蛋白是在乳腺中由氨基酸合成。对动物静脉注射14C-标记的氨基酸以及进行动静脉差的测定均证明,酪蛋白、β-乳球蛋白和α-乳清蛋白是由乳腺中的游离氨基酸合成的,而这些氨基酸来自血液。乳腺细胞自身还有合成非必需氨基酸的能力,为合成乳蛋白提供原料。乳腺合成蛋白质的过程与其他组织相同。乳腺细胞合成的大部分蛋白质最终要分泌出去,主要乳蛋白的合成在粗面内质网的核糖体上开始,然后由信号肽引导进入内质网腔,并在内质网和高尔基体内进行磷酸化和糖基化等化学修饰过程,再由分泌泡转送到上皮细胞顶膜,通过胞吐的方式释放到腺泡腔中。这一机制已被广泛接受 收稿日期:2011-03-21(Mercier等,1982[1]。 乳腺是一个合成蛋白质十分活跃的场所。乳蛋白编码基因的表达具有明显的组织特异性和阶段特异性,即乳蛋白质的合成仅在乳腺上皮细胞中进行,表达量高,并且发生在哺乳母体即将分娩之前和分娩之后的相当长一段时间的泌乳期中,乳腺合成
人血白蛋白工艺规程(试行)
目的:规范人血白蛋白的生产和质量管理。 适用范围:适用于生产技术部、质量保证部及各相关部门。 责任人:生产操作人员、质监员、低温车间主任、分包装车间主任、生产技术部长、质量保证部长。 正文: 一、产品概述 1、产品名称人血白蛋白 2、剂型、规格 2.1 剂型:注射剂 2.2 规格 2.2.1 每瓶含蛋白质10g,蛋白质浓度为20%。 2.2.2 每瓶含蛋白质5g,蛋白质浓度为20%。 2.2.3 每瓶含蛋白质2g,蛋白质浓度为20%。 3、处方或工艺配方 3.1 人血白蛋白10g 辛酸钠0.266g 加注射用水至50ml 3.2 人血白蛋白5g 辛酸钠0.133g 加注射用水至25ml 3.3 人血白蛋白2g 辛酸钠0.053g 加注射用水至10ml 处方依据:《中国药典》2005年版三部 4、产品的性状、功能与主治 4.1 性状 本品为略黏稠、黄色或绿色至棕色澄明液体,不应出现浑浊。 4.2 功能与主治 (1)失血创伤、烧伤引起的休克;(2)脑水肿及损伤引起的颅压升高;
(3)肝硬化及肾病引起的水肿或腹水;(4)低蛋白血症的防治; (5)新生儿高胆红素血症;(6)用于心肺分流术、烧伤的辅助治疗、血液透析的辅助治疗和成人呼吸窘迫综合征。 5、批准文号及标准演变情况 5.1 批准文号 10g:国药准字S1******* 5g:国药准字S1******* 2g:国药准字S1******* 5.2 标准演变情况 执行标准由《中国生物制品规程》2000年版《中国药典》2005年版三部 6、保存、运输及有效期 室温(不超过30℃),避光保存和运输。自分装之日起有效期为3年。 二、基本要求 1、厂房设施及生产环境符合《药品生产质量管理规范》(98版)的要求,并取得《GMP 认证证书》。生产用设施及设备应专用,不得与其他制品混用。 2、关键性设备应经验证合格才能投入使用,已投入使用的设备要定期进行再验证或回顾性验证。 3、生产车间的人流、物流分开。人流、物流各行其道,洁净区与非洁净区用明显的色标加以区别。 4、血浆分离用操作间工作(环境)温度控制在0~10℃,防止分离过程中制品温度升高。 5、生产用的水源应符合国家饮用水标准,纯化水、注射用水应符合《中国药典》(2005年版二部)的标准。生产用水的制备、贮存、分配和使用均应符合《药品生产质量管理规范》(98版)的要求。80℃以上保温,65℃以上保温循环或4℃以下保温循环,制备后6小时内使用,制备后4小时内灭菌72小时内使用。注射用水管道、储水罐及盛放制品的反应容器材质应为316L型不锈钢,使用前经钝化处理。注射用水系统及制水工艺需定期进行再验证。 6、直接用于生产的金属器具或玻璃器具等生产用具必须严格清洗和灭菌处理,处理工艺定期进行再验证;生产过程中使用的过滤介质应为无石棉的介质。 7、原料血浆的采集和质量应符合《中国药典》2005年版三部“血液制品原料血浆规程”
蛋白质与酶工程复习题
一.选择题: 1.影响蛋白质化学修饰反应的主要因素有:() 一是蛋白质功能基的反应活性;二是修饰剂的反应活性。 2. 蛋白质化学修饰有以下作用(以酶为例),请指出错误的一条: ( ) (1)改造酶的作用特性(包括改变酶活性、专一性、对效应物响应性能及对辅助因子的要求);(2)提高酶的稳定性;(3)扩大在体内应用可能性(防止在体内非专一性水解、减少和消除免疫原性以利于医疗应用). 3.蛋白质侧链上的巯基在进行烷基化修饰时,常用的烷基化试剂是:() 碘乙酸、碘乙酰胺、N-乙基马来酰亚胺、5,5-二硫 -2- 硝基苯甲酸 4. 下面哪一项叙述是错误的: () 5. 人类基因组计划的启动和草图完成时间在:() 1990年正式启动,2000年6月26日人类基因组工作草图完成。 6. 人类基因组计划的启动到人类基因组序列图测序完成时间在: ( ) 1990年正式启动到2003年4月14日 7. 通过比较两个或多个蛋白质序列的相似区域和保守性位点,确定相互间具有共同功能的序列模式和分子进化关系,进一步分析其结构和功能。此方法为: ( ) 序列两两比对 8. 通过对目标蛋白质进行定位突变或化学修饰改变其结构和功能,为蛋白质分子设计中的:() 称为“小改“,最广泛使用的方法,主要是通过定点突变或盒式替换技术来有目的地改变几个氨基酸残基 9. 通过对来源于不同蛋白质的结构域进行拼接和组装,为蛋白质分子设计中的:()“中改“,”分子剪裁“ 10. 完全从头设计出一种具有特异结构与功能的全新蛋白质,为蛋白质分子设计中的:()“全新蛋白质设计“或”蛋白质从头设计“ 11 下面哪一条不是真核基因在原核中正确表达的必备条件:() 第一,克隆到原核表达系统中的序列必须是去掉内含子的cDNA序列;第二,要用原核的启动子;第三,真核基因可能在表达过程中需要有分子伴侣帮助折叠成正确的构象才会有活性;第四,注意控制表达条件,尽量不要形成包涵体。 12 外源基因在大肠杆菌()高效表达时,常会发生一种特殊的生理现象,形成包涵体。 13 由欧洲生物信息学研究所进行维护和管理的SWISS-PROT数据库:() SWISS-PROT是经过注释的蛋白质序列数据库,由欧洲生物信息学研究所(EBI)维护。数据库由蛋白质序列条目构成,每个条目包含蛋白质序列、引用文献信息、分类学信息、注释等,注释中包括蛋白质的功能、转录后修饰、特殊位点和区域、二级结构、四级结构、与其它序列的相似性、序列残缺与疾病的关系、序列变异体和冲突等信息。SWISS-PROT中尽可能减少了冗余序列,并与其它30多个数据建立了交叉引用,其中包括核酸序列库、蛋白质序列库和蛋白质结构库等。利用序列提取系统(SRS)可以方便地检索SWISS-PROT和其它EBI的数据库。SWISS-PROT只接受直接测序获得的蛋白质序列,序列提交可以在其Web页面上完成。 14 核酸序列数据库GenBank是由:() 美国国立生物技术信息数据库是由美国国立生物技术信息中心(中心(NCBI)维护的一级核酸序列数据库。)维护的一级核酸序列数据库;数据库的数据来源有三种(1)、直接来源于测序工作者提交的序列;(2)、与其它数据机构协作交换的数据;(3)、美国专利局提供的专利数据。
血液制品检查要点 20190615
血液制品检查要点整体结构及示例 一、概述 血液制品临床应用;血液制品定义,分类;当前研究进展。 二、目的 三、原则要求 四、检查依据 五、血液制品生产工艺概述 血液制品生产的基本工艺流程
六、检查要点 6.1质量管理系统 6.1.1质量管理体系的基本要求 企业应当建立药品质量管理体系,运用质量风险管理的方法对质量风险进行评估、控制、沟通、审核,最大限度地降低药品生产过程中的污染、交叉污染以及混淆、差错等风险。对于血液制品而言,应重点关注控制病毒污染、微生物污染的措施。 6.1.2质量管理体系检查要点 现场检查应关注但不限于: 1)机构与人员、培训 应建立有与血液制品生产管理相适应的组织机构,设立独立的质量管理部门; 配备有足够数量及资质的管理和操作人员,并接受必要的培训,建立培训档案; 关键人员符合相应资质要求; 接触血浆的储运、生产、检验、质量管理人员接种相应疫苗的情况; 建立人员卫生管理制度,建立人员健康档案。应当采取适当措施,避免体表有伤口、患有传染病或其他可能污染药品疾病的人员从事直接接触药品的生产。 2)工作职责 应有文件明确规定每个部门和每个岗位的职责,物料放行、血浆放行、产品放行的职责明确。 质量管理部门应当参与所有与质量有关的活动,负责审核与生产、检验和质量保证体系相关的所有程序。 3)文件管理体系: 应对文件管理全过程建立操作规程,并按操作规程制定和管理血液制品生产相关的一系列文件。 质量标准、工艺规程、操作规程、稳定性考察、确认、验证、变更等其他重要文件应当长期保存。 4)风险评估 应建立质量风险管理或风险评估的程序文件,至少在偏差处理、变更控制、制定验证方案等可能出现质量风险的活动中规定须进行风险评估。 5)产品质量回顾分析报告 应对原辅料、生产工艺、检验方法、已批准或备案的药品注册所有等变更进行回顾分析; 应对所有不符合质量标准的批次,重大偏差及相关的调查、所采取的整改措施和预防措施的有效性进行回顾分析; 应对稳定性考察的结果及任何不良趋势,所有因质量原因造成的退货、投诉、召回及调查,相关设备和设施的确认状态进行回顾分析; 应对工艺环境、工艺用水进行回顾分析; 应当对回顾分析的结果进行评估,提出是否需要采取纠正和预防措施或进行再确认或再验证的评估意见及理由,并及时、有效地完成整改。 重点关注工艺稳定性评价及产品质量趋势分析。 6)投诉与药品不良反应监测报告 应当建立药品不良反应报告和监测管理制度,设立专门机构并配备专职人员负责管理。 相应的记录、评估、调查和处理情况,是否启动纠正措施,相关产品的处理。 应按照要求定期向药品监督管理部门报告不良反应情况。 7)退货与召回 退货记录,对因产品质量原因退货的评估(必要时进行延伸检查); 当产品存在安全隐患时,是否及时启动并迅速实施召回程序; 对退货/召回产品的处理; 建立召回管理规程,定期检验召回系统有效性。 8)偏差记录、评估、调查、处理 当发生无菌检查阳性结果和培养基模拟灌装失败、异常结果或趋势、关键设备、
蛋白质的分离纯化和表征
蛋白质的分离纯化和表征 第一节蛋白质的酸碱性质 各个解离基团的pK 值与游离氨基酸的不完全相同。等电点要用等电聚焦等方法测定。 第二节蛋白质分子的大小与形状
一、根据化学组成测定最低相对分子质量 假定某种微量成分只有一个,测出其百分含量后,可用比例式算出最低相对分子质量。 若测出两种微量成分的百分含量,分别用比例式算出的最低相对分子质量不相同时,可计算两个最低相对分子质量近似的最小公倍数。 例题:一种纯酶含亮氨酸(Mr 131)1.65%,含异亮氨酸(Mr131)2.48%,求最低相对分子质量。 解:按照Leu 的百分含量计算,最低Mr X1: X1=(100′ 131)/1.65=7939.4。 按照Ile 的百分含量计算最低Mr X2: X2=(100′ 131)/2.48=5282.3。 由于X1 和X2 数字差异较大,提示这种酶含Leu 和Ile 不止1 个,为了估算Leu 和Ile 的个数,首先计算: X1/X2=7939.4/5282.3≈1.5。 这种酶含任何氨基酸的个数均应是整数,说明该酶至少含有2 个Leu,3 个Ile,其最低相对分子质量为: 7939.4 ′2 =15878.8或5282.3×3=15846.9。 二、渗透压法测定相对分子质量 三、沉降分析法测定相对分子质量
基本原理: (一)离心力(centrifugal force,Fc) 当一个粒子(生物大分子或细胞器)在高速旋转下受到离心力作用时,此离心力“Fc”由下式定义: F=m·a=m·ω2 r a—粒子旋转的加速度,m—沉降粒子的有效质量,ω—粒子旋转的角速度,r—粒子的旋转半径(cm)。 (二)相对离心力(relative centrifugal force,RCF) 由于各种离心机转子的半径或者离心管至旋转轴中心的距离不同,离心力而受变化,因此在文献中常用“相对离心力”或“数字×g”表示离心力,只要RCF 值不变,一个样品可以在不同的离心机上获得相同的结果。 RCF 就是实际离心场转化为重力加速度的倍数。
蛋白质纯化的方法选择
蛋白质纯化的方法选择 随着分子生物学的发展,越来越多的科研人员熟练掌握了分子生物学的各种试验技术,并研制成套试剂盒,使基因克隆表达变得越来越容易。但分子生物学的上游工作往往并非是最终目的,分子克隆与表达的关键是要拿到纯的表达产物,以研究其生物学作用,或者大量生产出可用于疾病治疗的生物制品。相对与上游工作来说,分子克隆的下游工作显得更难,蛋白纯化工作非常复杂,除了要保证纯度外,蛋白产品还必须保持其生物学活性。纯化工艺必须能够每次都能产生相同数量和质量的蛋白,重复性良好。这就要求应用适应性非常强的方法而不是用能得到纯蛋白的最好方法去纯化蛋白。在实验室条件下的好方法却可能在大规模生产应用中失败,因为后者要求规模化,且在每日的应用中要有很好的重复性。本文综述了蛋白质纯化的基本原则和各种蛋白纯化技术的原理、优点及局限性,以期对蛋白纯化的方法选择及整体方案的制定提供一定的指导。 1、蛋白纯化的一般原则 蛋白纯化要利用不同蛋白间内在的相似性与差异,利用各种蛋白间的相似性来除去非蛋白物质的污染,而利用各蛋白质的差异将目的蛋白从其他蛋白中纯化出来。每种蛋白间的大小、形状、电荷、疏水性、溶解度和生物学活性都会有差异,利用这些差异可将蛋白从混合物如大肠杆菌裂解物中提取出来得到重组蛋白。蛋白的纯化大致分为粗分离阶段和精细纯化阶段二个阶段。粗分离阶段主要将目的蛋白和其他细胞成分如DNA、RNA等分开,由于此时样本体积大、成分杂,要求所用的树脂高容量、高流速,颗粒大、粒径分布宽.并可以迅速将蛋白与污染物分开,防止目的蛋白被降解。精细纯化阶段则需要更高的分辨率,此阶段是要把目的蛋白与那些大小及理化性质接近的蛋白区分开来,要用更小的树脂颗粒以提高分辨率,常用离子交换柱和疏水柱,应用时要综合考虑树脂的选择性和柱效两个因素。选择性树脂与目的蛋白结合的特异性,柱效则是指各蛋白成分逐个从树脂上集中洗脱的能力,洗脱峰越窄,柱效越好。仅有好的选择性,洗脱峰太宽,蛋白照样不能有效分离。 2、各种蛋白纯化方法及其优、缺点 2.1 蛋白沉淀蛋白能溶于水是因为其表面有亲水性氨基酸,在蛋白质的等电点处若溶液的离子强度特别高或者特别低,蛋白则倾向于从溶液中析出。硫酸铵是沉淀蛋白最常用的盐,因为它在冷的缓冲液中溶解性好,冷的缓冲液有利于保持目的蛋白的活性。硫酸铵分馏常用作试验室蛋白纯化的第一步,它可以初步粗提蛋白质,去除非蛋白成分。蛋白质在硫酸铵沉淀中较稳定,可以短期在这种状态下保存中间产物,当前蛋白质纯化多采用这种办法进行粗分离翻。在规模化生产上硫酸铵沉淀方法仍存在一些问题,硫酸铵对不锈钢器具的腐蚀性很强。其他的盐如硫酸钠不存在这种问题,但其纯化效果不如硫酸铵。除了盐析外蛋白还可以用多聚物如PEG和防冻剂沉淀出来,PEG是一种惰性物质,同硫酸铵一样对蛋白有稳定效果,在缓慢搅拌下逐渐提高冷的蛋白溶液中的PEG浓度,蛋白沉淀可通过离心或过滤获得,蛋白可在这种状态下长期保存而不损坏。蛋白沉淀对蛋白纯化来说并不是多么好的方法,因为它只能达到几倍的纯化效果,而我们在达到目的前需要上千倍的纯化。其好处是可以把蛋白从混杂有蛋白酶和其他有害杂质的培养基及细胞裂解物中解脱出来。 2.2 缓冲液的更换虽然更换缓冲液不能提高蛋白纯度,但它却在蛋白纯化方案中起着极其重要的作用。不同的蛋白纯化方法需要不同pH及不同离子强度的缓冲液。假如你用硫酸铵将蛋白沉淀出来,毫无疑问蛋白是处在高盐环境中,需要想办法脱盐,可用的方法有利用半透膜透析,通过勤换透析液体去除盐分,此法尚可,但需几个小时,通常要过夜,也难以用于大规模纯化中。新型的设备将透析膜夹在两个板中间,板的一侧加缓冲液,另一侧加需脱盐的蛋白溶液,并在蛋白溶液一侧通过泵加压,可以使两侧溶液在数小时内达到平衡,若增加对蛋白溶液的压力,还可迫使水分和盐更多通过透析膜进入透析液达到对蛋白浓缩的目的。也有出售的脱盐柱,柱内的填料是小孔径的颗粒,蛋白分子不能进入孔内,先于高浓度盐离子从柱中流出,从而使二者分离。蛋白纯化的每一步都会造成目的蛋白的丢失,缓冲液平衡的步骤尤甚。蛋白会结合在任何它能接触的表面上,剪切力、起泡沫和离子强度的快速变化很容易让蛋白失活。 2.3 离子交换色谱这是在所有的蛋白纯化与浓缩方法中最有效方法。基于蛋白与离子交换树脂间的相互电荷作用,通过选择不同的缓冲液,同一种蛋白既可以和阴离子交换树脂(能结合带负电荷的分子)结合,也可以和阳离子交换树脂结合。树脂所用的带电基团有四种:二乙基氨基乙基用于弱的阴离子交换树脂;羧甲基用于弱的阳离子交换树脂;季铵用于强阴离子交换树脂;甲基磺酸酯用于强阳离子交换树脂。蛋白质由氨基酸组成,氨基酸在不同的pH环境中所带总电荷不同。大多数蛋白在生理pH(pH6~8)下带负电荷,需用阴离子交换柱纯化,极端的pH下蛋白会变性失活.应尽量避免。由于在某个特定的pH下不同的蛋白所带电荷数不同,与树脂的结合力也不同,随着缓冲液中盐浓度的增加或pH的变化,蛋白按结合力的强弱被依次洗脱。在工业化生产中更多地是改变盐浓度而不是去改变pH值,因为前者更容易控制。在实验室中几乎总是用盐浓度梯度去洗脱离子交换柱,利用泵的辅助可以使流入柱的缓冲液中盐浓度平稳地上升,当离子强度能够中和蛋白的电荷时,蛋白就被从柱上洗脱下来。但在工业生产中盐浓度很难精确控制,所以常用分步洗脱而不足连续升高的盐梯度。与排阻层析相比,离子交换特异性更好,有更多的参数可以调整以获得最优的纯化效果,树脂也比较便宜。值得一提的是,即便是用最精确控制的条件,仅用离子交换单一的方法也得不到纯的蛋白,还需要其他的纯化步骤。
胶体金法生产工艺规程
胶体金法生产工艺规程集团文件版本号:(M928-T898-M248-WU2669-I2896-DQ586-M1988)
1. 适用范围 适用于乙型肝炎病毒表面抗体检测试剂盒(胶体金法)的生产和质量控制。2. 职责 研发部:制定本规程。 生产管理部:执行本规程 质量管理部:按本规程执行,监督本规程的执行情况。 3. 内容 3.1.依据 《乙型肝炎病毒表面抗体检测试剂(胶体金法)》产品标准 3.2.产品名称、剂型、规格 3.2.1名称: (1) 商品名:乙型肝炎病毒表面抗体检测试剂(胶体金法) (2)英文名:Diagnostic Kit for Antibody to Hepatitis B Surface Antigen(Colloidal Gold Immunochromatagraphic Assay) (3)汉语拼音名:Yixing Ganyan Bingdu Biaomian Kangti Jiance Shiji (jiaotijin Fa) 3.2.2.类型:三类6840体外诊断试剂。 3.2.3.规格:100T/盒(25T/筒*4筒)(无卡);25袋/盒(1支/袋)、50袋/盒(1支/袋) 3.3.产品概述 乙型肝炎病毒表面抗体检测试剂(胶体金法)采用胶体金免疫层析分析原理、双抗原夹心法,在玻璃纤维纸上预包埋金标记重组乙型肝炎病毒表面抗原,在硝酸纤维素膜上检测线(T)和质控线(C)分别包被重组的乙型肝炎病毒表面抗原和羊抗兔IgG。当检测样本为阳性时,样本中的乙肝病毒表面抗体与胶体金标记的重组乙肝病毒表面抗原结合形成复合物,由于层析作用复合物沿纸条向前移动,经过检测线(T)时与预包被的重组乙肝表面抗原反应,形成免疫复合物而显现红色条
蛋白质的分离纯化方法(参考资料)
蛋白质的分离纯化方法 2.1根据分子大小不同进行分离纯化 蛋白质是一种大分子物质,并且不同蛋白质的分子大小不同,因此可以利用一些较简单的方法使蛋白 质和小分子物质分开,并使蛋白质混合物也得到分离。根据蛋白质分子大小不同进行分离的方法主要有透析、超滤、离心和凝胶过滤等。透析和超滤是分离蛋白质时常用的方法。透析是将待分离的混合物放入半透膜制成的透析袋中,再浸入透析液进行分离。超滤是利用离心力或压力强行使水和其它小分子通过半透膜,而蛋白质被截留在半透膜上的过程。这两种方法都可以将蛋白质大分子与以无机盐为主的小分子分开。它们经常和盐析、盐溶方法联合使用,在进行盐析或盐溶后可以利用这两种方法除去引入的无机盐。由于超滤过程中,滤膜表面容易被吸附的蛋白质堵塞,以致超滤速度减慢,截流物质的分子量也越来越小。所以在使用超滤方法时要选择合适的滤膜,也可以选择切向流过滤得到更理想的效果离心也是经常和其它方法联合使用的一种分离蛋白质的方法。当蛋白质和杂质的溶解度不同时可以利用离心的方法将它们分开。例如,在从大米渣中提取蛋白质的实验中,加入纤维素酶和α-淀粉酶进行预处理后,再用离心的方法将有用物质与分解掉的杂质进行初步分离[3]。使蛋白质在具有密度梯度的介质中离心的方法称为密度梯度(区带)离心。常用的密度梯度有蔗糖梯度、聚蔗糖梯度和其它合成材料的密度梯度。可以根据所需密度和渗透压的范围选择合适的密度梯度。密度梯度离心曾用于纯化苏云金芽孢杆菌伴孢晶体蛋白,得到的产品纯度高但产量偏低。蒋辰等[6]通过比较不同密度梯度介质的分离效果,利用溴化钠密度梯度得到了高纯度的苏云金芽孢杆菌伴孢晶体蛋白。凝胶过滤也称凝胶渗透层析,是根据蛋白质分子大小不同分离蛋白质最有效的方法之一。凝胶过滤的原理是当不同蛋白质流经凝胶层析柱时,比凝胶珠孔径大的分子不能进入珠内网状结构,而被排阻在凝胶珠之外,随着溶剂在凝胶珠之间的空隙向下运动并最先流出柱外;反之,比凝胶珠孔径小的分子后流出柱外。目前常用的凝胶有交联葡聚糖凝胶、聚丙烯酰胺凝胶和琼脂糖凝胶等。在甘露糖蛋白提纯的过程中使用凝胶过滤方法可以得到很好的效果,纯度鉴定证明产品为分子量约为32 kDa、成分是多糖∶蛋白质(88∶12)、多糖为甘露糖的单一均匀糖蛋白[1]。凝胶过滤在抗凝血蛋白的提取过程中也被用来除去大多数杂蛋白及小分子的杂质[7]。 2.2 根据溶解度不同进行分离纯化 影响蛋白质溶解度的外部条件有很多,比如溶液的pH值、离子强度、介电常数和温度等。但在同一条件下,不同的蛋白质因其分子结构的不同而有不同的溶解度,根据蛋白质分子结构的特点,适当地改变外部条件,就可以选择性地控制蛋白质混合物中某一成分的溶解度,达到分离纯化蛋白质的目的。常用的方法有等电点沉淀和pH值调节、蛋白质的盐溶和盐析、有机溶剂法、双水相萃取法、反胶团萃取法等。 等电点沉淀和pH值调节是最常用的方法。每种蛋白质都有自己的等电点,而且在等电点时溶解度最
实验十蛋白质的表达、分离纯化和鉴定
实验十蛋白质的表达、分离纯化和鉴定 第一部分蛋白质的表达、分离纯化 目的要求 (1)了解重组蛋白表达的方法和意义。 (2)了解重组蛋白亲和层析分离纯化的方法。 实验原理 目的基因在宿主细胞中的高效表达及表达的重组蛋白的分离纯化对理论研究和实验应用都具有重要的意义。通过表达能探索和研究基因的功能以及基因表达调控的机理,同时目的基因表达出所编码的蛋白质可供作结构与功能的研究。大肠杆菌是目前应用最广泛的蛋白质表达系统,其表达外源基因产物的水平远高于其它表达系统,表达的目的蛋白量甚至能超过细菌总蛋白量的80%。本实验中,携带有目标蛋白基因的质粒在大肠杆菌BL21(DE3)中,在37℃,IPTG诱导下,超量表达携带有6个连续组氨酸残基的重组氯霉素酰基转移酶蛋白,该蛋白N端带有6个连续的组氨酸残基,可通过固相化的镍离子(Ni2+)亲和层析介质加以分离纯化,称为金属熬合亲和层析(MCAC)。蛋白质的纯化程度可通过聚丙烯酰胺凝胶电泳进行分析。 试剂和器材 一、试剂 [1] LB液体培养基:Trytone 10g, yeast extract 5g, NaCl 10g, 用蒸馏水配至1000mL。 [2] 氨苄青霉素:100mg/mL。 [3] 上样缓冲液(GLB):100 mM NaH2PO4, 10 mM Tris, 8M Urea, 1 mM β-巯基乙醇, pH8.0。 [4] 清洗缓冲液(UWB):100 mM NaH2PO4, 10 mM Tris, 8 M Urea, pH6.3。 [5] 洗脱液缓冲液:100 mM NaH2PO4, 10 mM Tris, 8M Urea, 500 mM 咪唑, pH8.0。 [6] IPTG 二、器材 摇床,离心机,层析柱(1 10 cm),蠕动泵 操作方法 一、氯霉素酰基转移酶重组蛋白的诱导 1. 接种含有重组氯霉素酰基转移酶蛋白表达载体的大肠杆菌BL21(DE3)菌株于5mL
细胞规程
生物制品生产和检定用动物细胞基质制备及检定规程本规程适用于人用生物制品生产用动物细胞基质及检定用动物细胞,包括具有细胞库体系的细胞及原代细胞。细胞基质系指可用于生物制品生产的所有动物或人源的连续传代细胞系、二倍体细胞株及原代细胞。 生产非重组制品所用的细胞基质,系指来源于未经修饰的用于制备其主细胞库的细胞系/株和原代细胞。生产重组制品的细胞基质,系指含所需序列的、从单个前体细胞克隆的转染细胞。生产杂交瘤制品的细胞基质,系指通过亲本骨髓瘤细胞系与另一亲本细胞融合的杂交瘤细胞系。 一、对生产用细胞基质总的要求 用于生物制品生产的细胞系/株均须通过全面检定,须具有如下相应资料,并经国务院药品监督管理部门批准。 (一)细胞系/株历史资料 1. 细胞系/株来源资料 应具有细胞系/株来源的相关资料,如细胞系/株制备机构的名称,细胞系/株来源的种属、年龄、性别和健康状况的资料。这些资料最好从细胞来源实验室获得,也可引用正式发表文献。 人源细胞系/株须具有细胞系/株的组织或器官来源、种族及地域来源、年龄、性别及健康状况及病原体检测结果的相关资料。 动物来源的细胞系/株须具有动物种属、种系、饲养条件、组织或器官来源、地域来源、年龄、性别、供体的一般健康状况及病原体检测结果的相关资料。 如采用已建株的细胞系/株,应具有细胞来源的证明资料。应从能够提供初始细胞历史及其溯源性书面证明材料的机构获得,且应提供该细胞在该机构的详细传代记录,包括培养过程中所使用的所有原材料的详细信息,如种类、来源、批号、生产日期及有效期、制备或使用方法、质量标准及检测结果等。 2.细胞系/株培养历史的资料 应具有细胞分离方法、细胞体外培养过程及建立细胞系/株过程的相关资料,包括所使用的物理、化学或生物学手段,外源插入序列,筛选细胞所进行的任何遗传操作或筛选方法、在动物体内传代过程以及细胞生长特征、培养液成分等。同时还应具有细胞鉴别、内源及外源因子检查结果的相关资料。
蛋白质的分离方法
蛋白质的分离方法 蛋白质的分离方法有哪些?他们各依据蛋白质的什么性质或特点?蛋白质的分离纯化方法 分子大小 透析和超过滤:透析指利用蛋白质分子不能通过半透膜而与小分子分离;超滤是利用压力或离心力使小分子溶质通过半透膜而蛋白质被截留在膜上而分离。 密度梯度离心:蛋白质颗粒在具有密度梯度的介质中离心时,质量和密度大的颗粒比质量和密度小的颗粒沉降得快,且每种蛋白质颗粒沉降到与其自身密度相等的介质密度梯度时,即停止不前,最后各种蛋白质在离心管中被分离成不同的区带。 凝胶过滤:即分子排阻层析。凝胶颗粒内部为多孔的网状结构。大分子最先流出层析柱。 溶解度 等电点沉淀和pH控制 盐溶和盐析:中性盐在低浓度时可增加蛋白质的溶解度,即盐溶。原因是蛋白质分子吸附盐类离子后,带电层使蛋白质分子彼此排斥,而与水分子相互作用加强;当离子强度增大到足够高时,此时与蛋白质疏水基团接触的自由水被移去以溶剂化盐离子,导致蛋白质疏水基团暴露,使蛋白质因疏水作用凝聚沉淀。 有机溶剂分级分离法:一是降低介质的介电常数,二是与蛋白质争夺水化水。
温度沉淀:温度对溶解度有影响,低温稳定,高温不稳定。在0~40℃,大部分的球状蛋白质溶解度随温度升高而增加。 电荷 电泳(净电荷、分子大小、形状):区带电泳、聚丙烯酰氨凝胶电泳(PAGE)、毛细管电泳 离子交换层析 等电聚焦:外加电场时,蛋白质混合物在具有pH梯度的介质中移向并聚焦(停留)在等于其等电点的pH处,形成区带。 层析聚焦:层析柱中建立连续的pH梯度,蛋白质样品由柱上端随缓冲液的展开而聚焦在各自的等电点pH处,形成区段。 吸附: 吸附层析,吸附剂(硅石、氧化铝、活性碳)和疏水吸附剂,与待分离分子和杂质分子的吸附与解吸能力不同。 特异亲和力:亲和层析 其它:如高效液相层析(HPLC),快速蛋白液相层析(FPLC)
