有机_无机杂化体系中聚氧化乙烯的受限结晶

第17卷第2期高分子材料科学与工程
V o l
.17,N o .2 2001年3月
POL Y M ER M A T ER I AL S SC IEN CE AND EN G I N EER I N G
M ar .2001
有机 无机杂化体系中聚氧化乙烯的受限结晶
Ξ
蒋世春,董德文,姬相玲,安立佳,姜炳政
(中国科学院长春应用化学研究所高分子物理开放实验室,吉林长春130022)
摘要:通过so l 2gel 技术合成了聚氧化乙烯(PEO )和二氧化硅(Si O 2)的有机2无机杂化材料,通过D SC 和WA XD 方法测试了杂化样品中PEO 的结晶度、结晶结构和(120)晶面的微晶尺寸,说明了PEO 在该杂化体系中的受限结晶行为。
关键词:聚氧化乙烯 二氧化硅杂化;示差扫描量热法;广角X 射线衍射;聚氧化乙烯受限结晶行为中图分类号:O 633.11 文献标识码:A 文章编号:100027555(2001)022*******
提高有机 无机杂化材料的物理性能一直
是有机 无机杂化材料领域发展的推动力,在过去的十多年中,杂化材料的合成和制备引起了人们极大的兴趣并得到迅速发展。大多数杂化材料是通过so l 2gel 技术制备的,这一技术的优点之一是可以近乎完美地将有机2无机材料的优良性能综合在一起,从而得到符合设计需要的材料[1~4]。
聚氧化乙烯作为一种结构简单而又具有代表性的线性高分子,人们已经对它进行了广泛而深入的研究[5~8],最近PEO 杂化材料的研究也方兴未艾,这些研究要么是注重PEO 在相对自由的环境中的行为,要么注重材料的合成方法,对于PEO 在受限环境中的行为涉及较少。我们通过so l 2gel 技术合成PEO Si O 2杂化材料,并研究了PEO 在这一体系中的受限结晶行为。杂化材料的合成过程见Schem e 1,在这一过程中Si O 2形成微孔干凝胶,为PEO 分子运动和链段运动提供了有限的活动空间是本研究的基础。
H ydro lysis :Si (OR )4+H 2O
(HO )Si (OR )3+ROH
(OH )Si (OR )3+H 2O (HO )2Si (OR )2+ROH (OH )2Si (OR )2+H 2O (OH )3Si (OR )+ROH (OH )3Si (OR )+H 2O
Si (OH )4+ROH
A lcoho l conden sati on (A lcoxo lati on ):
≡Si -OR +HO -Si ≡≡Si -O -Si ≡
+ROH W ater conden sati on (oxo lati on ):≡Si -
OH +HO -Si ≡
Si -O -Si ≡+HOH
O vrall reacti on :
Sche me 1 Process of sol -gel and PEO Si O 2hybr id
1 实验部分1.1 原料与仪器
聚氧化乙烯(PEO ):Po lyscience 公司商品,M
{w =19000,M {n =10200;正硅酸乙酯(T EO S ):A ldrich 公司商品;盐酸:分析纯,北
Ξ收稿日期:1999204212;修订日期:1999208204
基金项目:国家自然科学基金和高分子凝聚态基本物理问题资助项目 作者简介:蒋世春(1968-),男,博士生.
京化学试剂厂产品;N ,N 2二甲基甲酰胺(DM F ):北京化工厂产品。
D SC 测试采用Perk in 2
E l m er D SC 27型示差量热扫描仪;广角X 射线衍射测试采用菲利
普公司的PW 21700自动粉末X 射线衍射仪。1.2 样品合成
首先将PEO 溶入DM F 中,配成一定浓度的溶液,在溶液中加入一定摩尔比的T EO S 和水以及催化剂量的盐酸,搅拌后得到均一透明溶液,将溶液保持在40℃直至成为凝胶,将凝胶加热到80℃并控制溶剂的挥发速度,一周后将样品放入80℃的真空烘箱中直到得到衡量样品。
1.3 测试方法
1.3.1 D SC 谱:首先将样品从0℃加热到100℃,升温速率为10℃ m in ,然后将样品从100℃降温至0℃,降温速率为10℃ m in 。1.3.2 W A XD 反射谱图:采用PW 21700自动
粉末X 射线衍射仪,Cu 靶,N i 片滤波,Κ=0.154nm ,电压30kV ,电流20mA
。
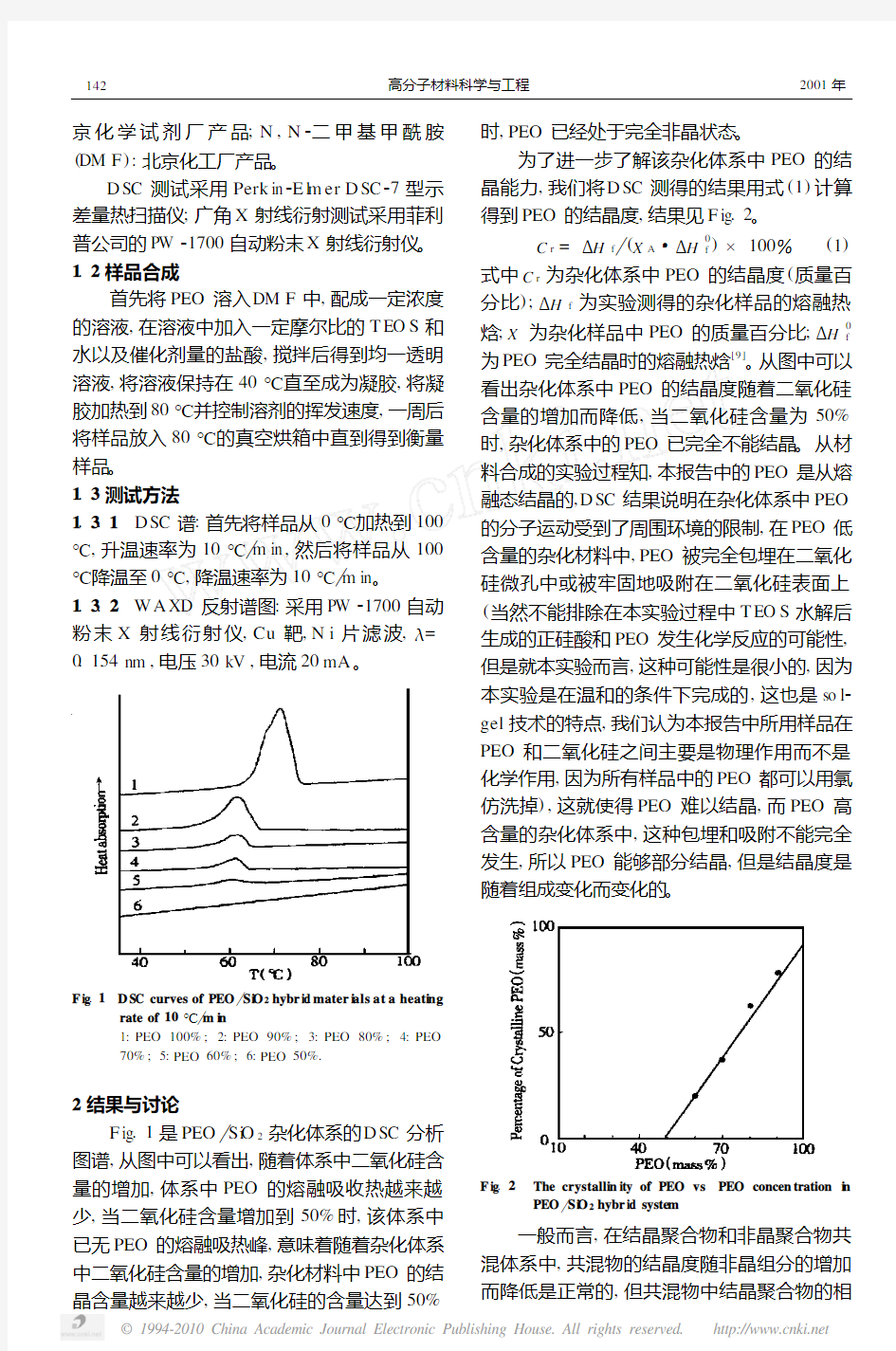
F ig .1 D SC curves of PEO Si O 2hybr id mater i als at a heati ng
rate of 10℃ m i n
1:PEO 100%;2:PEO 90%;3:PEO 80%;4:PEO 70%;5:PEO 60%;6:PEO 50%.
2 结果与讨论
F ig .1是PEO Si O 2杂化体系的D SC 分析
图谱,从图中可以看出,随着体系中二氧化硅含量的增加,体系中PEO 的熔融吸收热越来越少,当二氧化硅含量增加到50%时,该体系中已无PEO 的熔融吸热峰,意味着随着杂化体系中二氧化硅含量的增加,杂化材料中PEO 的结晶含量越来越少,当二氧化硅的含量达到50%
时,PEO 已经处于完全非晶状态。
为了进一步了解该杂化体系中PEO 的结晶能力,我们将D SC 测得的结果用式(1)计算得到PEO 的结晶度,结果见F ig .2。
C r =?H f
(X A ?H 0
f )×100?(1)
式中C r 为杂化体系中PEO 的结晶度(质量百
分比);?H f 为实验测得的杂化样品的熔融热焓;X 为杂化样品中PEO 的质量百分比;?H 0
f 为PEO 完全结晶时的熔融热焓[9]。从图中可以看出杂化体系中PEO 的结晶度随着二氧化硅含量的增加而降低,当二氧化硅含量为50%时,杂化体系中的PEO 已完全不能结晶。从材料合成的实验过程知,本报告中的PEO 是从熔融态结晶的,D SC 结果说明在杂化体系中PEO 的分子运动受到了周围环境的限制,在PEO 低含量的杂化材料中,PEO 被完全包埋在二氧化硅微孔中或被牢固地吸附在二氧化硅表面上(当然不能排除在本实验过程中T EO S 水解后生成的正硅酸和PEO 发生化学反应的可能性,但是就本实验而言,这种可能性是很小的,因为本实验是在温和的条件下完成的,这也是so l 2gel 技术的特点,我们认为本报告中所用样品在PEO 和二氧化硅之间主要是物理作用而不是化学作用,因为所有样品中的PEO 都可以用氯仿洗掉),这就使得PEO 难以结晶,而PEO 高含量的杂化体系中,这种包埋和吸附不能完全发生,所以PEO 能够部分结晶,但是结晶度是随着组成变化而变化的
。
F ig .2 The crystalli n ity of PEO vs
.PEO concen tration i n PEO Si O 2hybr id syste m
一般而言,在结晶聚合物和非晶聚合物共混体系中,共混物的结晶度随非晶组分的增加而降低是正常的,但共混物中结晶聚合物的相
241高分子材料科学与工程2001年
对结晶度却随着非晶组分的增加而增加,当然
增加幅度是很小的。从F ig .2可以看出,在该体系中PEO 的相对结晶度是随着杂化体系中二氧化硅含量的增加而明显地降低,这说明在该杂化体系中PEO 和二氧化硅之间存在着强烈的相互作用,正是由于这种强烈相互作用的存在,使得二氧化硅非但不能诱导PEO 的结晶,反而限制PEO 分子运动和链段运动,这就是PEO 在该杂化体系中不能结晶或结晶度降低的主要原因。
我们假设当杂化体系中PEO 和二氧化硅的质量百分比为1∶1时,PEO 分子运动被完全限制在不能结晶的程度,即杂化体系中二氧化硅能限制等质量的PEO 分子运动,使之不能结晶。从D SC 测试结果和对杂化体系中PEO 相对结晶度的计算结果可知,这种假设是合理的。根据这个假设,杂化体系中的PEO 可以分为受限部分和相对“无扰部分”,杂化体系的结晶正是来自相对“无扰部分”。相对“无扰部分”的结晶度可以用式(2)计算,计算结果见F ig .3。
C ′r =
?H f
[1-
(1-X ) (1-n )] ?H 0
f ×100?
(2)
式中C ′r 为杂化体系中相对
“无扰部分”状态的PEO 结晶度;?H f 为D SC 测得的熔融热焓;X 为杂化体系中PEO 的含量;n 为当杂化体系中PEO 不能结晶时PEO 的含量,这里n =50%;
?H 0
f 为PEO 完全结晶时熔融热焓[9]
。
F ig .3 Crystalli n ity of relative unperturbed PEO vs
.PEO concen tration i n PEO Si O 2hybr id syste m
从计算结果可以看出,在该体系中即使PEO 相对
“无扰部分”的结晶度也不是真正无扰的,这一部分的分子运动也会受到杂化体系
中二氧化硅的影响,只有杂化体系中PEO 的含
量达到90%时,相对“无扰部分”的结晶度与纯PEO 的结晶度相等,都是87%,我们认为该部
分PEO 在该组成以上时是处于无扰状态。杂化体系中PEO 含量低于90%时,即使相对“无扰部分”的PEO 也与二氧化硅之间存在比较强的相互作用,这也是杂化材料具有优良力学性能且无机、有机含量大的主要原因。
F ig .4为D SC 测得的PEO Si O 2杂化体系中结晶PEO 的熔点和结晶温度,该结果表明不同组成的杂化材料中结晶PEO 的熔点和结晶度基本相同,但是都比纯PEO 的熔点和结晶温度要低得多,这说明在杂化体系中的PEO 的分子运动和结晶行为受到二氧化硅的严格限制,使得PEO 的结晶很不完善,不能长成比较大的片晶结构,所以PEO 的熔点和结晶度都低于纯
PEO 。
同时杂化体系中PEO 的熔点和结晶温度基本相同,说明该体系中PEO 结晶部分相对于不同组成而言是相对“无扰部分”。虽然结晶度不同,但是结晶行为都是一样的,这就使得杂化体系中PEO 的熔点和结晶温度都基本相同
。
F ig .4 M elti ng po i n t (■)and crystallization te mperature
(●)of PEO i n PEO Si O 2hybr id syste m vs .PEO mass %
为了进一步考察杂化体系中结晶PEO 的
结晶行为,我们对样品进行了广角X 射线衍射实验,F ig .5为样品的广角X 射线衍射反射图谱。从图中可知,当杂化样品中PEO 和二氧化硅的组成为1∶1时,样品的图谱中无尖锐的衍射峰,说明该样品中的PEO 未结晶,而当样品中的PEO 能结晶时,图谱中的尖锐衍射峰的峰位和纯PEO 的基本相同,所不同的只是峰强和峰的半高宽的变化,这与D SC 的测试结果一致,说明样品中PEO 结晶晶型无改变,这意味
3
41 第2期蒋世春等:有机 无机杂化体系中聚氧化乙烯的受限结晶
着杂化样品中的二氧化硅不能影响PEO 的结晶结构,也不能进入PEO 结晶的晶格中,在这一点上来说,该体系中PEO 的结晶行为还是相对自由的,但是PEO 的结晶度还是受到了限制,我们用Scherrer 方程计算了杂化样品中结晶PEO 的微晶尺寸[10]。
L hkl =5.73(k Κ Βco s Η)(3)式中L 系垂直于反射面(hk l )方向微晶尺寸
(nm );K 通常称为微晶的形状因子,这里K =0.9,Κ为所用单位X 射线波长(nm );Η为布喇格角;B 为实验测得的衍射峰的半高宽;b 0为仪器角度增宽,这里从扫描标准硅的实验中得到b 0=0.15。利用上面对和的定义和对衍射峰形
的假定得到Β2=(B 2-b 2
0)。不同组成比例的样品中垂直于(120)晶面的PEO 微晶尺寸根据方
程计算结果列于
T ab .1。
F ig .5 WAX D pattern s for PEO Si O 2hybr id syste m with dif -feren t mass ratios
A :PEO 50%;
B :PEO 60%;
C :PEO 70%;
D :PEO 80%;
E :PEO 90%;
F :pure PEO .
Tab
.1 Cryst allite size L (120)of PEO i n silica net -work at differen t ratios
PEO (m ass %)2Ηa )(°)
B b )
Βc )
L
(120)
(nm )
10019.090.830.8169.879019.141.561.5535.188019.192.172.1653.727019.222.762.7562.9260
19.14
3.27
3.267
2.46
a )B ragg angle ;
b )m easured half 2w idth of the experi 2
m ental p rofile ;c )pure line broadening .
表中结果说明(120)晶面的PEO 微晶尺寸随着杂化体系中PEO 含量的增加而增大,这正是二氧化硅网络的存在而使得PEO 微晶的生长受到了限制,从而限制了PEO 的宏观结晶度。
参
考
文
献
[1] N ovak B M .A dv .M ater .,1993,5:422.
[2] M ark J E ,L ee C Y C ,B ianconi P A .Ed .H ybrid O r 2
ganic 2Ino rganic Compo sites .A CS Symp .Ser .,W ash 2ington DC ,1995,585:1.
[3] P rakash S S ,B rinker C J ,H urd A J ,et a l .N ature ,
1995,344:439.
[4] B rinker C J ,Scherrer G .So l 2Gel Science ,the Physics
and Chem istry of So l 2Gel P rocessing ,A cadem ic P ress ,N ew Yo rk ,1990.
[5] H uang H H ,O rler B ,W illers G H .M acromo lecules ,
1987,20:1322.
[6] Balijepall S ,Schultz J M .M acromo lecules ,1996,29:
6601.
[7] F londas G ,T sitsilianis C .M acromo lecules ,1997,30:
263.
[8] Zopp i R A ,N unes S P .Po lym er ,1998,39:6195.[9] W underlich B .M acromo lecular Physics ,A cadem ic
P ress ,N ew Yo rk and L ondon ,1973,1:388.
[10] M o Z S,L ee K B,M oon Y B ,et a l .M acromo lecules,
1985,18:1972.
441高分子材料科学与工程2001年
CONF INED CRY STALL IZAT I ON BEHAV I OR OF PEO
IN ORGAN I C -INORGAN I C HY BR I D S Y STE M
J I AN G Sh i 2chun ,DON G D e 2w en ,J I X iang 2ling ,AN L i 2jia ,J I AN G B ing 2zheng
(P olym er P hy sics L abora tory ,Chang chun Institu te of A pp lied
Che m istry A cad e m ia S in ica ,Chang chun 130022,Ch ina )
ABSTRACT :Po ly (ethylene ox ide )(PEO )and silica (Si O 2)o rgan ic 2ino rgan ic hyb rid m aterials have been syn thesized by so l 2gel app roach .T he crystallizati on behavi o r of PEO in hyb rid system has been investigated by D SC and W A XD m ethods .T he resu lt show s that the m ass percen tage of crystalline PEO reduces w ith the increase of silica in PEO and Si O 2o rgan ic 2ino rgan ic hyb rid sam 2p les ,PEO is no t crystallizab le w hen the concen trati on of PEO is low er than 50m ass %in th is system .T he D SC and W A XD resu lts show that the crystalline behavi o r of PEO in PEO Si O 2hy 2b rid system has been rigid confined ,the reason is that PEO is ab so rbed by the m icropo res silica .Keywords :PEO Si O 2hyb rid ;D SC ;W A XD ;confined crystallizati on behavi o r of PEO
(上接第140页。continued from p .140)
INFL UENCE OF THE FL EX IB L E INTERLAY ER ON THE M ECHAN I CAL PROPERT IES OF G LASSM AT RE INFORCED POLY PROPYL ENE COM POSITE
ZHOU X iao 2dong ,L I N Q un 2fang ,GUO W en 2jun ,DA I Gan 2ce
(P olym er P rocessing L ab .E ast Ch ina U n iversity of S ci .and T ech .,S hang ha i 200237,Ch ina )ABSTRACT :T he flex ib le in terlayer w as in troduced in to glass m at reinfo rced po lyp rop ylene com 2po site by the grafting of rubber chain on to fiber su rface .A nd the effect of the k ind and th ickness of flex ib le in terlayer on the in terfacial adhesi on and the m echan ical p roperties of com po sites w as investigated .T he resu lts show that the com po sites having h igh strength and i m p act resistance can be ob tained w hen the rubber chain that is easy to fo r m chem ical bonding w ith fiber su rface and com p atib le w ith m atrix resin is u sed as flex ib le in terlayer .Fu rther m o re ,the th ickness of flex ib le in terlayer affects the m echan ical p rop erties of com po site system .A li m it value ex ists above w h ich the m echan ical p roperties w ill decrease w ith increasing the th ickness .
Keywords :glass fiber ;po lyp ropylene ;in terface ;flex ib le in terlayer ;glass m at reinfo rced ther m o 2p lastic
5
41 第2期蒋世春等:有机 无机杂化体系中聚氧化乙烯的受限结晶
有机合成工艺学作业.doc
有机合成工艺学作业 一、单选题(共10 道试题,共100 分。) 1. 催化加氢是指有机化合物中一个或几个不饱和的官能团在催化剂的作用下与氢气发生加成反应;而催化脱氢是在催化剂的作用下,烃类脱氢生成二种或两种以上新物资,通过加氢和脱氢过程,可以合成氨、(甲醇)、丁二烯、苯乙烯等非常重要的基本有机化工产品。 2. 合成甲醇的产物中,除目的产物外,还含有二甲醚、异丁醇、甲烷等副产物。合成甲醇早期为高压法,由于它存在许多无法克服的缺点,被后来发展起来的低压法所取代,低压法的动力消耗为高压法的(60% )左右。 3. 催化脱氢可以生成高分子材料的重要单体,产量最大、用途最广的两个产品是苯乙烯和(丁二烯)。 4. 合成甲醇的技术自20世纪80年代来主要取得了(三)个新成果。 5. 正丁烯氧化脱氢制丁二烯过程中,主要的副反应有(六)个。 6. 丁二烯的用途较大,目前它的主要来源是裂解副产品混合C4通过特殊精馏得到,西欧和日本的全部、美国(80%)的丁二烯是通过这一途径得到的。 7. 合成甲醇的反应机理有许多学者进行了研究,也有很多报道,归结起来有(三)种假定。 8. 甲醇作为化工原料的用途越来越广,它既可以直接合成汽油,也可以作为无铅汽油的优质添加剂,它的主要原料是合成气,据统计,世界上(80% )的甲醇来源于天然气。 9. 乙苯脱氢制得苯乙烯的工艺进行不断改进,主要从(三)方面着手。 10. 苯乙烯是高分子材料的一种重要单体,由于市场需求旺盛,苯乙烯的产量不断增加,目前生产苯乙烯的主要方法是乙苯脱氢法,主要原料是(乙烯和苯)。 1. 催化自氧化反应的机理属于自由基机理,起决定作用的是(链引发)过程。 2. 氧化反应在化工领域中比较常见,它具有许多特征,综合起来有(四)大特征。 3. 烃类氧化过程中,氧化剂可以在空气、纯氧、过氧化氢和其他过氧化物中选择,目前最常用的是(空气和纯氧)。 4. 异丙苯法生产苯酚和丙酮的工艺流程中,从烷基化反应开始到反应混合物中产品的精制分离,一共需要经过(八)个单元。 5. 催化氧化的技术进展主要体现在(三)个方面。 6. 原料的纯度在生产上也是一个主要操作条件,工艺上用于生产乙醛的原料乙烯要求在(99.5% )以上。 7. 工业上乙烯氧化生成乙醛的过程容易发生爆炸,实际生产过程中,往往通过控制循环气中乙烯和氧气的量来预防爆炸发生,乙烯含量控制在65%左右,氧含量控制在(8%)左右。 8. 丙烯氨氧化制丙烯腈的工艺路线主要有(五)条。 9. 烃类氧化有完全氧化和部分氧化之分,目前全球生产的化学品中,(50%)是通过部分氧化得到的。 10. 在采用共氧化法生产环氧丙烷过程中,联产物量很大,所产联产物是异丁烯和(苯乙烯)。 1. 工业上生产醋酸的方法有(三)种。 2. 以丙烯为原料经羰基合成反应和加氢反应生成1,4-丁二醇的工艺已经由(美国)ARCO 公司实现工业化。 3. 影响氢甲酰化反应的因素很多,主要体现在(三)方面。 4. 由于羰基化反应的应用越来越广泛,它的发展趋势主要体现在(二)个方面。 5. 羰基合成的原料为烯烃和合成气,所得到的产品的碳原子数与原料烯烃的差为(1)。 6. 羰基合成在精细化工中的应用很广,主要在(香料)方面。 7. 甲醇低压羰基合成醋酸在技术经济上的优越性很大,它归纳起来大约有(八)个特点。
高中化学与溴水、高锰酸钾反应的有机物
与溴水、高锰酸钾反应的有机物 在有机反应中常有一些物质与溴水、KMnO4反应。溴水、KMnO4一般是作为氧化剂参与反应的,通常这两种物质用于区别不易被氧化的烷烃、苯和易被氧化的烯烃、炔烃等。氧化剂很多,为什么要选择着这两种呢?主要是这两种氧化剂都有颜色,溴水为橙色,K MnO4为紫红色,反应后两种物质均变成无色,便于检验反应是否发生。 下面就这两种物质与一些烃发生反应归纳一下: 溴水溶液中溶剂为水,溶质为溴单质(还有少量溴与水反应生成的物质);KMnO4溶液中溶剂为水,溶质为KMnO4,为使其氧化性增强,常在其溶液中加些稀硫酸,称为酸性高锰酸钾溶液。 当溴水、KMnO4与一些烃反应时,则首先要搞清楚以下4方面的问题: (1)溶液分层问题: 上述两种物质均为水溶液,与液态烃混合后都要分层,因为烃不溶与水。 (2)液体密度问题: 上述两种水溶液的密度均大于液态烃。因为烃密度小于水,所以分层后,液态烃都在上层。 (3)溶液反应问题: 上述两种物质到底可以和那些烃发生反应呢,应该说烷烃、苯与这两种物质都不反应;烯烃、炔烃与这两种物质都要反应;苯的同系物则与溴水不反应,与酸性高锰酸钾溶液要反应。 (4)溶液萃取问题: 萃取就是用一种溶剂将一种溶液中的溶质从其原来的溶剂中分离出来的过程。所用到的该溶剂成为萃取剂,一般要有以下几个条件:一是被萃取的溶液与其互不相溶,二
是与被萃取的溶液不发生任何反应,三是溶质在萃取剂中的溶解度要远远大于原来溶剂中的溶解度,四是萃取剂一般是易挥发的物质。 在上述溶液混合中烃要与溴水发生萃取过程,但与高锰酸钾溶液不发生萃取,理由是:溴水中的溶质溴单质易溶于有机溶解剂,其在有机溶剂中的溶解度远远大于在水中的溶解度。而高锰酸钾溶液的溶质高锰酸钾是离子化合物,其不溶于有机溶剂,所以也就没有萃取过程的发生。 如果搞清楚上述四个问题后,就不难解决以下问题了。 [例] 溴水、KMnO4溶液分别与己烷、己烯、己炔、苯、甲苯反应的现象 先讨论溴水与上述五中烃反应的现象: (1)溴水与己烷:两溶液混合后,首先是分层,无色己烷在上橙色溴水在下,振荡后,不反应,但要发生萃取,结果因溴单质的转移,己烷呈红棕色,而溴水则几乎为无色。如图1 (2)溴水与己烯:两溶液混合后,首先是分层,无色己烯在上橙色溴水在下,振荡 后,发生反应,就不存在萃取问题。溴与己烯发生加成反应后,溴水层和己烯层均 为无色,但还是出现分层,如图2
有机合成化学_ 有机化学选择题
选择题Ⅱ: 151. 下列哪一种化合物不能用以制取醛酮的衍生物? (A) 羟胺盐酸盐 (B) 2,4-二硝基苯 (C) 氨基脲 (D) 苯肼 152. 下列哪个化合物不能起卤仿反应? (A) CH 3CH(OH)CH 2CH 2CH 3 (B) C 6H 5COCH 3 (C) CH 3CH 2CH 2OH (D) CH 3CHO 153. 下列哪个化合物可以起卤仿反应? (A) CH 3CH 2CH 2OH (B) C 6H 5CH 2CH 2OH (C) CH 3COCH 2CH 2COCH 3 (D) HCHO 154. 乙醛和过量甲醛在NaOH 作用下主要生成: : (A) (B) 155. (C) (D) 156. 用格氏试剂制备1-苯基-2-丙醇,最好采用哪种方案? (A) CH 3CHO + C 6H 5CH 2MgBr (B) C 6H 5CH 2CH 2MgBr + HCHO (C) C 6H 5MgBr + CH 3CH 2CHO (D) C 6H 5MgBr + CH 3COCH 3 157. : (A) C 6H 5CH 2OH C 6H 5COOH (B) C 6H 5CHOHCH 2COOCOCH 3 (C) C 6H 5CH =CHCOOCOCH 3 (D) C 6H 5CH =CHCOOH 158. 在稀碱作用下,下列哪组反应不能进行羟醛缩合反应? (A) HCHO + CH 3CHO (B) CH 3CH 2CHO + ArCHO (C) HCHO + (CH 3)3CCHO (D) ArCH 2CHO + (CH 3)3CCHO (A) (HOCH 2)3CCHO (B) C(CH 2OH)4 (C) CH 3CH CHCHO (D) CH 3CHCH 2CHO OH OH O CH 3 (C 6H 5)2C CH 3 C C 6H 5 O C CH 3C 6H 5 OH (CH 3)2C C 6H 5CH 3 C C 6H 5(CH 3)2C C(C 6H 5)2 C 6H 53O C 6H 5CHO +(CH 3CO)2O
二氧化氯催化氧化处理高浓度有机废水
常温常压二氧化氯催化氧化处理高浓度有机废水 随着现代工业的迅猛发展,各种废水的排放量逐年增加,且大都具有浓度高、生物降解性 差甚至有生物毒性等特点,国内外对此类高浓度难降解有机废水的综合治理都予以高度重视并 制定了更为严格的标准。目前,部分成分简单、生物降解性略好、浓度较低的废水都可通过传 统的工艺得到处理,而浓度高、难以生物降解的废水却很难得到彻底处理,且在经济上也存在 很大困难,如何去除或转化这类废水中的各种有毒物质,不仅是当前国内外水处理领域非常活 跃的研究方向,也是我国21世纪水问题中迫切需要解决的难题之一。 氧化方法是一种“破坏性”技术,具有广谱的去除毒害有机物效果,氧化法能将废水中的 有机污染物氧化或彻底去除。目前氧化方法有:化学氧化法、光化学氧化法、催化湿式氧化法、超临界水氧化法、光化学催化氧化法、生物氧化法等。 化学氧化法通过化学反应毒害有机物被氧化为微毒或无毒的物质,或者转化为容易与水分离的形态,由于氧化剂的不同可分为臭氧、过氧化氢、二氧化氯及高锰酸钾氧化等。湿式氧化 法是在高温高压下,利用氧化剂将废水中的有机物氧化为二氧化碳和水。超临界水氧化技术是 20世纪80年代中期由美国学者Modell提出的一种能够彻底破坏有机物结构的新型氧化技术, 其原理是在超临界水的状态下将废水中所含的有机物用氧化剂迅速分解成水、二氧化碳等简单 无害的小分子化合物。光化学氧化是通过氧化剂在光的辐射下,产生氧化能力较强的自由基而 进行的,根据氧化剂的种类不同,可分为UV/H2 02,u.u03及UV/H2 02 /03等系统。光催化氧化法主要是指UV/Fenton试剂法和半导体光催化氧化。光化学氧化和光催化氧化处理低浓度废水效果较好,工业化较复杂,实际工程应用不多。湿式氧化和催化湿式氧化,具有使高 浓度难降解有机物氧化或偶合,氧化效率高,分解速度快的优点,但是同时还具有催化剂费用 高,反应装置复杂,需要高温高压设备及配套设施,防腐困难等缺点,而且投资大。超临界水 氧化技术目前还处于实验室阶段,工业应用难度较大,而且投资大,运行成本高。 由于以上各种方法对于污染物处理条件的要求很苛刻和实际推广应用方面存在的局限性, 人们为开发不受上述问题影响的方法付出了许多努力。近年来,常温催化氧化技术受到了人们 的广泛关注。催化氧化法的研究核心是寻找性能优良,具有广谱催化作用的催化剂,提高催化 剂的催化效果,减少催化剂的损耗及中毒现象,使其能在工业废水处理中更好地发挥作用。催
湿式催化氧化法处理工业废水
环境保护科学第27卷总第103期2∞1年2月 湿式催化氧化法处理工业废水 ndustrialWastewaterTreatmentwithWettingCatalyticOxidizeMethod 委英半月雨虹(大连市沙河口区环境监洲站大连116021) 鹿政理(大连市环境科学设计研究院) 摘要舟培了有机虞水催化氧化处茬的进展情况庭科研^果. 关■铜穑化曩化催化剂有机废水 A嗨t哺ctTh亡scient讯c弛sHrchanddevelopmentono‘gaIIicwastewatertre^tmentby∞tal”证oxidi钟w强intro-ducedinthepaper. Keyword8cataI”lcoxIdatI佣CataIy8tOr口anIcwastewat钾 1前育 湿式氧化法是将溶解和悬浮在废水中的有机物及还原性无机物通过液相氧化的方法促进氧化降解或水解来降低水中CoD和BOD含量的化学处理方法。由于反应时需加热刭适宜温度以及需在密封容器内进行,故有时也称此法为水热分解法。 湿式催化氧化法是湿式氧化法的发展方向,国外在催化剂的筛选、评价、回收、再生等方面开展了大量的研究工作,并开发建立了一系列的工业规模生产装置。 使用本方法处理工业废水时,需要在较高的温度(约200~250℃)和较高的压力(约50~70大气压)下以水为介质对有机物进行氧化降解的,所以选择适当的耐压反应容器(反应釜)是实验的主要条件之一。设备投资费用较大,要求较高是本法主要不足之一,而运转费用低。处理效率高是本法得以推广的原因. 2研究动态 自从80年代以来一些主要国家如美、德、日等国先后对此工艺及设备进行了系统研究,日本1985年起京都大学、公害资源研究所、大阪工业试验所以及大阪煤气工程公司等单位均参加该项研 收藕日期2000~03—22 —22一究.其主要研究项目有: (1)高浓度悬浮有机物的催化剂的研制及耐用性试验,对高浓度coD及氨类的古悬浮物较步的废水进行长期连续性试验。已进入实用阶段,使用的值化剂为球形或无定型颗粒}对古悬浮钉多的高浓度cOD工业废水研制蜂窝状催化荆,对其成型方法、强度、活性、耐用性等进行研究。 (2)在中试装置内用蜂窝状催化剂以及空塔条件下,研究难分解组分的分解特性。 (3)对湿式催化氧化处理后的工业废水进行膜分离和厌氯处理试验。 湿式催化氧化工艺从设备结构来看主要有固定床和流化床两种,同定床又分气相和液相两种。气相固定床催化氧化工艺是在反应器内进行气液分离。优点是反应压力较低,可避免设备堵塞,转化率较高,一般可达90%以上。液相同定床催化氧化工艺简单,操作方便,使用压力较高,催化剂分离回收有一定困难.漉化床催化氧化工艺可以使催化剂与废水混合均匀,增加反应物与催化剂的接触,设备利用事高I其催化剂的分离回收方法有离子交换法和液相旋流分离法。为了充分利用反应热,使用两殷换热器和气液分离反应器。 通常中问试验的流程见图1。 万方数据
有机化学氧化还原反应教案2
有机化学氧化还原反应教案 一. 教学目标 1. 理解氧化反应、还原反应的实质及发生条件 2. 从加(脱)氢、脱(加)氧和碳原子的氧化数变化两个角度认识还原(氧化)反应。 3. 能够从试剂、条件、产物等不同角度判断有机化学反应类型。 二. 教学重点、难点 从加(脱)氢、脱(加)氧和碳原子的氧化数变化两个角度认识还原(氧化)反应。 三.教学思路分析 先由复习有机化学反应中常见的化学反应类型入手,结合无机化学中的氧化反应和还原反应的概念,自然过渡到有机化学中的氧化反应和还原反应的概念,然后逐步深入分析加(脱)氢、脱(加)氧的本质,结合无机化学中的氧化还原反应的本质和特征,引出氧化数的概念,然后逐渐过渡到也可以从有机化合物中碳原子的氧化数来预测或判断该有机化合物是否有可能发生氧化还原反应。这样做,符合由表及里的认识顺序,更能加深学生对“结构决定性质”的认识。最后结合化学键的类型和氧化数来分析有机反应类型,让学生进一步掌握有机化学反应类型。 四.教学过程 不同的分类标准可以得到不同的结果,如我们初中学习了无机化学反应中的四种基本类型反应,而在高一时又接触了氧化还原反应。我们有机化学也学习了三种基本类型的反应——取代反应、加成反应和消去反应。既然无机化学中有氧化还原反应,那有机反应中有没有呢?如果有,如何表示呢?这就是我们这一节课所要探讨的内容。 板书:有机化学中的氧化反应和还原反应 1.氧化反应 ?定义:有机物化合物分子中增加氧原子或减少氢原子的反应称为氧化反应。 ?常见的氧化反应: ①醛的氧化,如:2CH3CHO + O2→2CH3COOH ②醇的氧化,如:2CH3CH2OH+O2→CH3CHO+2H2O ③有机物的燃烧。 ④烯烃、炔烃、酚、醛等有机物使酸性高锰酸钾溶液褪色。 ⑤含醛基的有机化合物与新制Cu(OH)2悬浊液、银氨溶液的反应 ?常见的氧化剂:氧气、臭氧、酸性高锰酸钾、银氨溶液和新制Cu(OH)2悬浊液等。 2.还原反应 ?定义:有机物化合物分子中增加氢原子或减少氧原子的反应称为还原反应。 ?常见的还原反应: 烯、炔、苯及其同系物、醛、酮、酚、油脂等的催化加氢。 ?常见的还原剂:氢气、氢化铝锂(LiAlH4)和硼氢化钠(NaBH4)等。 3.氧化数 ?定义: 人们根据经验总结出的用于表示分子中某原子所处氧化状态的一种数值。 在有机化合物中,碳原子的最高氧化数为+4,最低氧化数为-4. ?规定: ①氢原子的氧化数为+1,当碳、氧原子上连有一个氢原子的时候,碳、氧等原子的氧化数就为-1 ②若碳原子分别与氧,氮、硫等电负性大的原子以单键、双键、叁键相结合,碳原子的氧化数分别为+1、+2、+3 ③若碳原子与碳原子相连时,其氧化数均为零 ?利用有机物的氧化还原反应可以用氧化数的升降来判断:反应后氧化数升高的有机物,发生了氧化反应;氧化数降低的有机物,则发生了还原反应。氧化数处于最高价的原子只能被还原,处于最低价的原子只能被氧化,介于中间价态的既能被氧化又能被还原。有机物中碳原子的氧化数能否升高或降低是有机物能否发生氧化反应和还原反应的前提。
催化氧化法处理有机废水催化剂的选择应用
?防治技术? 催化氧化法处理有机废水催化剂的选择应用 李启良,陈建林 (南京大学环境学院,江苏南京 210093) 摘 要:催化氧化法是处理难降解有机废水的一项重要的新技术。在对化学氧化法的不断改进中,逐步发展出湿式催化氧化法、光催化氧化法、均相催化氧化法和多相催化氧化法。不同的氧化方法所用的催化剂不相同,有机化合物的种类和结构不同,催化剂与氧化剂之间存在匹配问题,因此对催化剂要进行筛选评价。 关键词:废水处理;催化氧化;催化剂 中图分类号:X703.5;O643.36 文献标识码:A 文章编号:1004-695X(2003)02-0034-03 R evie w on Selection of C atalysis in C atalytic Oxidation LI Qi2liang,CHE N Jian2lin (School o f the Environmental,Nanjing Univer sity,Nanjing,Jiangsu210093,China) Abstract:The treatment of organic wastewater with catalytic oxidation methods is a totally new technology.The paper introduces the progress in the selection of catalysts in the treatment of organic wastewater with four basic catalytic oxidation methods(wet catalytic oxida2 tion,photo catalytic oxidation,hom ogeneous catalytic oxidation and heterogeneous catalytic oxidation).The different kinds and different compositions of organic wastewater should be treated with different catalytic oxidation method,s o it is necessary to study on catalysts match2 ing with different oxidants in treating with specific organic wastewater. K ey w ords:Wastewater treatment;Catalytic oxidation;Catalysts review 对有机化工行业每天排放大量有机废水的处理中,催化氧化法具有独有的优势而成为研究的重点。该法不仅可以改善废水的可生化降解性,在物化和生化处理之间架设了一座桥梁,而且可以作为单独处理工艺来应用,是废水处理的一项新技术,国内外已进行了广泛深入的研究。其中,研究较多的是寻找新型、高效、稳定性好、成本低廉的催化剂。 在对化学氧化法不断改进的过程中,逐步发展了湿式催化氧化等方法[1]。不同的氧化方法应用的催化剂不相同,而且由于氧化催化剂具有选择性,有机化合物的结构和种类不同以及催化剂与氧化剂存在匹配问题,因此要对催化剂进行筛选评价。催化剂一般分为光敏化半导体材料、过渡金属盐及其氧化物和复合氧化物四大类(表1)。在形态上可分为均相和非均相两种;从催化剂的组成又分贵金属和非贵金属两种。作者将分别作评述,并简介催化作用的机理。 1 湿式催化氧化催化剂 湿式催化氧化技术始于20世纪70年代。它 表1 催化氧化法常用催化剂[2] 类 别催化剂 金属盐 PCl2,RuCl3,RbCl3,IrCl4,K2PtO4,NaAuCl4,NH4ReO4, AgNO3,Na2CrO7,Cu(NO3)2,CuS O4,C oCl2,NiS O4, FeS O4,MnS O4,ZnS O4,SnCl2,Na2CO3,Cu(OH)2, Cu(Ⅱ),CuCl2,FeCl2,CuS O4-(NH4)2S O4,MnCl2, Cu(BF4)2,Mn(AC)2 氧化物 W O3,V2O5,M oO3,Z rO4,T aO2,Nb2O5,H fO2ΠOsO4,CuO, Cu2O,C o2O3,NiO,Mn2O3,CeO2,SnO2,Fe2O3 复合 氧化物 CuO-Al2O3,MnO2-Al2O3,CuO-S iO2,CuO-ZnO- Al2O3,RuO2-CeO2,RuO2-Al2O3,RuO2-Z rO2,RuO2 -T iO2,Mn2O3-CeO2,Rh2O-CeO2,PtO-CeO2,IrO2- CeO2,PdO-T iO2,C o3O4-BiO(OH),C o3O4-CeO2, C o3O4-BiO(OH)-CeO2,C o3O4-BiO(OH)-Ln2O3, CuO-ZnO,“OG”,SnO2-Sb2O4,SnO3-M oO3,Fe2O3- Sb2O4,SnO2-FeO3,Fe2O3-Cr2O3,Fe2O3-P2O5,Cu- Mn-Fe氧化物,Cu-Mn氧化物,Cu-Mn-Zn氧化 物,C o-Mn-Zn氧化物,C o-Cu氧化物,Cu-Mn-C o 氧化物 光敏化 半导体T iO2,ZnO,CdS,W O3,Fe2O3 是在高温高压和催化剂作用下,使氧化剂迅速反应分解出活性基团(自由基),进而氧化分解有机物, 最终产物为C O 2 ,H2O及N2等无害物质。其技术的关键是研制高氧化活性、高稳定性的催化剂。 收稿日期:2002-12-13;修订日期:2003-02-18 作者简介:李启良(1973—),男,湖北黄岗人,南京大学在读硕士研究生,主要研究废水处理技术与资源化。 43 第16卷 第2期污染防治技术2003年6月
最新有机化学的氧化还原反应知识讲解
有机化学氧化还原反应总结 一、氧化反应:有机物分子中加入 O 原子或脱去H 原子的反应。 常见的氧化反应: ①醇的氧化 醇→醛 ②醛的氧化 醛→酸 ③有机物的燃烧氧化、与酸性高锰酸钾溶液的强氧化剂氧化。 ④醛类及其含醛基的有机物与新制Cu (OH )2悬浊液、银氨溶液的反应 常见的氧化剂有氧气、酸性高锰酸钾、二氧化锰、臭氧、银氨溶液和新制Cu (OH )2悬浊液 a. 能被酸性KMnO 4氧化的:烯、炔、二烯、油脂(含C==C 的)苯的同系物、酚、 醛、葡萄糖等。 b. 能被银氨溶液或新制备的Cu(OH)2悬浊液氧化的:醛类、甲酸及甲酸酯、葡 萄糖、麦芽糖。 1.高锰酸钾氧化 a.在稀、冷KMnO4(中性或碱性)溶液中生成邻二醇 b.在酸性高锰酸钾溶液中,继续氧化,双键位置发生断裂, 得到酮和羧酸的混合物,如: 炔烃与氧化剂(KMnO4或O3)反应,产物均为羧酸或CO2 2.臭氧化反应: CHR=CR 'R "+O3→RCH=O+R’C=OR” 3.醛的氧化:由于醛的羰基碳上有一个氢原子,所以醛比酮容易氧化,使用弱的氧化剂都能使醛氧化。利用两者氧化性能的区别,可以很迅速的鉴别醛或酮: a 费林试剂(Fehling):以酒石酸盐为络合剂的碱性氢氧化铜溶液(绿色),能与醛作用,铜被还原成红色的氧化亚铜沉淀。 坎尼扎罗(Cannizzaro )反应 不含 氢原子的醛在浓碱存在下可以发生歧化反应,即两个分子醛相互作用,其中一分子醛还原成醇,一个氧化成酸: KMnO 4O H 2CH 3CH 2C=CHCH 3CH 3OH CH 3CH 2CCH 3O CH 3COOH +,,RCHO NaOH Cu(OH)2RCOONa Cu 2O O H 2++++23RCHO Ag(NH 3)2OH RCOONH 4O H 2NH 3+2+++23HCHO NaOH HCOONa HCH 2OH 2浓+
有机合成化学练习题
练习题 1、从苯及不超过3个C 的有机原料合成 Br Br CH 2CH 2CH 3 2、用苯和不超过3个碳的有机物为原料合成 CH 2CH 2CH 3 Br 3、选择合适的试剂合成下面的化合物 C-CH 2CH 3CH 3OH 4、选择合适的试剂合成下面的化合物 CH 2OH NO 2 5、用甲苯为原料合成 Br COOH 6、由指定原料合成下列产物 OH CH 2 7、由指定原料合成下列产物 CHO 8、由乙酰乙酸乙酯合成下列化合物
O CCH 3 9、选择合适的试剂合成下面的化合物 O CH 3CCH 2CH 3CCH 2CH 2CH 2OH O 10、用苯和不超过4个碳的有机物合成 OH O 11、由指定原料合成下列产物 CH 3O 2N CN CH 3 12、由不超过三个碳的有机原料及必要的无机试剂合成下列产物 O CH 3CH 2CHCHCOCH 2CHOCH 2CH 3 OH 3CH 3 13、用不超过4个碳的有机物和适当的无机试剂合成下列化合物 O CH 3CCH 2CH 2CH 2CH 2N CH 3 CH 3 14、用不超过4个碳的有机物合成(4分) O 15、用不超过4个碳的有机物合成 O O CH 2CH 2CH 2CH 3 16、由指定原料合成下列产物(6分) CHCOOH NO 2 NO 2CH 3 17、用不超过4个碳的有机物为原料合成
OH CH 3CH 2CH 2CH 2CHCH 2CH 2CH 2CH 2CH 3 18、由指定原料合成下列产物 CH 3CH 2CH 2Br (CH 3)2CHCOOH 19、选择合适的试剂合成下面的化合物 CH 2OH NO 2 20、由1,3-丙二醇合成螺庚烷酸合成下列化合物 COOH 21、由指定的主要原料出发合成下列化合物 O COOC 2H 5 Ph Ph C HO +CO CH 3 22、由苯及不超过3个C 的有机原料合成下列产物 COOH I CH 2CH 2CH 3 24、用丙二酸二乙酯及不超过4个碳的有机物合成下列化合物(6分) COOH 25、由苯及不超过3个C 的有机原料合成下列产物 Br CH 2CH 2CH 3 26、由丙二酸二乙酯及不超过3个碳的有机物合成下列化合物 O EtO 2C 27、由已二酸及不超过三个碳的有机原料合成下列产物
有机合成工艺优化.doc
有机合成工艺优化方法学---心得 1.合成工艺的优化主要就是反应选择性研究 有机合成工艺优化是物理化学与有机化学相结合的产物,是用化学动力学的方法解决有机合成的实际问题,是将化学动力学的基本概念转化为有机合成的实用技术。 首先分清三个基本概念转化率、选择性、收率。转化率是消耗的原料的摩尔数除于原料的初始摩尔数。选择性为生成目标产物所消耗的原料摩尔数除于消耗的原料的摩尔数。收率为反应生成目标产物所消耗的原料的摩尔数除于原料的初始摩尔数。可见,收率为转化率与选择性的乘积。可以这样理解这三个概念,反应中消耗的原料一部分生成了目标产物,一部分生成了杂质,为有效好的原料依然存在于反应体系中。生成目标产物的那部分原料与消耗的原料之比为选择性,与初始原料之比为收率,消耗的原料与初始原料之比为转化率。 反应的目标是提高收率,但是影响收率的因素较多,使问题复杂化。化学动力学的研究目标是提高选择性,即尽量使消耗的原料转化为主产物。只有温度和浓度是影响选择性的主要因素。在一定转化率下,主副产物之和是一个常数,副产物减少必然带来主产物增加。提高转化率可以采取延长反应时间,升高温度,增加反应物的浓度,从反应体系中移出产物等措施。而选择性虽只是温度和浓度的函数,看似简单,却远比转化率关系复杂。因此将研究复杂的收率问题转化为研究选择性和转化率的问题,可简化研究过程。 2.选择性研究的主要影响因素 提高主反应的选择性就是抑制副反应,副反应不外平行副反应和连串副反应两种类型。平行副反应是指副反应与主反应同时进行,一般消耗一种或几种相同的原料,而连串副反应是指主产物继续与某一组分进行反应。主副反应的竞争是主副反应速度的竞争,反应速度取决于反应的活化能和各反应组分的反应级数,两个因素与温度和各组分的浓度有关。因此选择性取决于温度效应和浓度效应。可是,活化能与反应级数的绝对值很难确定。但是我们没有必要知道它们的绝对值,只需知道主副反应之间活化能的相对大小与主副反应对某一组分的反应级数的相对大小就行了。我们知道,升高温度有利于活化能高的反应,降低温度有利于活化能低的反应,因此选择反应温度条件的理论依据是主副反应活化能的相对大小,而不是绝对大小。 (1)温度范围的选择:在两个反应温度下做同一合成实验时,可以根据监测主副产物的相对含量来判断主副反应活化能的相对大小,由此判断是低温还是高温有利于主反应,从而缩小了温度选择的范围。实际经验中,一般采取极限温度的方式,低温和高温,再加上二者的中间温度,可判断出反应温度对反应选择性的影响趋势。 (2)某一组分浓度的选择:在同一温度下(第一步已经选择好的温度下),将某一组分滴加(此组分为低浓度,其他组分就是高浓度)或一次性加入(此组分为高浓度,其他组分就是低浓度)进行反应,就可根据监测主副产物的相对含量来判断该组分是低浓度还是高浓度有利于主反应。确定了某一组分的浓度影响,接下来就是研究该组分的最佳配比问题。相同的条件下,再确定其他组分浓度的影响。 (3)溶剂的影响: (4)酸碱强度的影响: (5)催化剂的影响: 3.定性反应产物 动力学研究方法要求副反应最小,而其他方法要求主反应最大。因此研究反应的选择性,搞清副反应的产物结构是必要地前提。在条件允许的情况下,应尽量分析反应混合物的全部组分,包括主产物,各种副产物,分析他们在气相色谱、液相色谱或薄层色谱上的相对位
化学氧化还原反应知识点
化学氧化还原反应知识点 1、反应类型: 氧化反应:物质所含元素化合价升高的反应。 还原反应:物质所含元素化合价降低的反应。 氧化还原反应:有元素化合价升高和降低的反应。 2、反应物: 氧化剂:在反应中得到电子的物质 还原剂:在反应中失去电子的物质 3、产物: 氧化产物:失电子被氧化后得到的产物 还原产物:得电子被还原后得到的产物 4、物质性质: 氧化性:氧化剂所表现出得电子的性质 还原性:还原剂所表现出失电子的性质 1、物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。 1元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S 2元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S 3元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S 2、重要的氧化剂 1活泼非金属单质,如F2、Cl2、Br2、O2等。 2元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓 H2SO4,HNO3;KMnO4,KClO3,FeCl3等。 3过氧化物,如Na2O2,H2O2等。
3、重要的还原剂 1金属单质,如Na,K,Zn,Fe等。 2某些非金属单质,如H2,C,Si等。 3元素处于低化合价时的氧化物,如CO,SO2等。 4元素处于低化合价时的酸,如HCl浓,HBr,HI,H2S等。 5元素处于低化合价时的盐,如Na2SO3,FeSO4等。 电子转移的表示方法有双线桥法和单线桥法: 1、双线桥法 要点: 1箭头由反应物中化合价变化元素指向生成物中化合价已经变化了的同一元素。升高、降低各一根箭头,越过方程式中间的等号 2电子转移数目:化合价升高、失电子;化合价降低、得电子。化合价改变元素的原子个数m×每个原子得到或失去电子的个数ne-,即m×ne-。 2、单线桥法 要点: 1线桥从反应物中化合价升高的元素出发,指向反应物中化合价降低的元素,箭头对 准氧化剂中化合价降低的元素,箭头不过“=” 2在线桥上标明转移电子总数,不写得到或失去。 1、价态规律 同种元素,处于最高价态时只具有氧化性。处于最低价态时只具有还原性。处于中间 价态时既有氧化性又有还原性。 2、歧化和归中规律 价态归中规律:同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢, 可相交,不相叉”。 3、反应先后规律 在浓度相差不大的溶液中:
有机合成工艺小试到中试放大之关键
有机合成工艺小试到中试放大之关键 在生产过程中凡直接关系到化学合成反应或生物合成途径的次序,条件(包括物料配比、温度、反应时间、搅拌方式、后处理方法及精制方法等)通称为工 艺条件。 一、研发到生产的三个阶段 1、小试阶段:开发和优化方法 2、中试阶段:验证和使用方法 3、工艺验证/商业化生产阶段:使用方法,并根据变更情况以绝对是否验证 注:批量的讨论:中试批量应不小于大生产批量的十分之一 二、小试阶段 对实验室原有的合成路线和方法进行全面的、系统的改革。在改革的基础上通过实验室批量合成,积累数据,提出一条基本适合于中试生产的合成工艺路线。小试阶段的研究重点应紧紧绕影响工业生产的关键性问题。如缩短合成路线,提高产率,简化操作,降低成本和安全生产等。 1、研究确定一条最佳的合成工艺路线:一条比较成熟的合成工艺路线应该 是:合成步骤短,总产率高,设备技术条件和工艺流程简单,原材料来源充裕而 且便宜。 2、用工业级原料代替化学试剂:实验室小量合成时,常用试剂规格的原料 和溶剂,不仅价格昂贵,也不可能有大量供应。大规模生产应尽量采用化工原料和工业级溶剂。小试阶段应探明,用工业级原料和溶剂对反应有无干扰,对产品的产率和质量有无影响。通过小试研究找出适合于用工业级原料生产的最佳反应 条件和处理方法,达到价廉、优质和高产。 3、原料和溶剂的回收套用:合成反应一般要用大量溶剂,多数情况下反应 前后溶剂没有明显变化,可直接回收套用。有时溶剂中可能含有反应副产物,反应不完全的剩余原料,挥发性杂质,或溶剂的浓度改变,应通过小试研究找出回收处理的办法,并以数据说明,用回收的原料和溶剂不影响产品的质量。原料和溶剂的回收套用,不仅能降低成本,而且有利于三废处理和环境卫生。
我从事有机合成工艺研发工作三年的体会
我从事有机合成工艺研发工作三年的体会 作者:ttyhhecheng(优化合成) 时间过得真快!转眼之间我已经在Bristol-Myers Squibb从事有机合成工艺优化(process R&D)工作三年了,这三年,感谢公司的栽培,我顺利完成了从学校毕业生到有机合成工艺优化专家的转变。因为此前我一直都在学校读书,这个转变对我个人而言也是真正实现学以致用的开端,我在此把三年来的经历和体会作个总结,兴许新的有机合成化学毕业生看了能有所得。 2004年三月,我刚入公司第一天,我就被安排做新API的路线优化和第一批临床原料的合成,虽然这只是一个四步的合成工艺,但在不到三个月的时间,我完成了从最佳工艺路线的挑选,建立各步合成反应中控标准,定型API分离方案,下车间放大生产(1.5kg, 50L) 的所有工作,就这样在很短的时间内对工艺优化所牵涉到的各方面问题有了全面接触,例如如何挑选API路线(我学到的第一课是最短的不一定是最好的),如何运用统计学原理迅速地优化多变量反应,如何运用自下而上的原理帮助确定分离方案,如何处理收率和质量的关系,如何检验工艺的可重复性,等等。。。 现在回想起来,这是一个学习强度非常高的时期,一方面我得做大量实验优化各步工艺,提高我运用合成化学理论知识解决实际问题的能力;另一方面我得迅速熟悉PR&D各部门间交流对话的机制和快节奏的决策过程,定出符合FDAcGMP工业标准的生产放大方案并付诸实施。从我这最初三个月的经历来看,我们部门实行的是通过压担子--在完成任务的同时完成对新人的培养的策略,我个人的成长经历说明这一策略是非常成功的。当然,成功实施这一策略的前提条件是部门内有很好的团队精神,新手能及时地得到资源上,人际关系上的帮助。在此我一方面要感谢公司对我的信任,让我直接负责新API的工艺研发,另一方面,我也要向我的很多同事致以由衷的谢意!我能迅速胜任重担是和他们对我的无私的指导和帮助分不开的。从我个人成长来说,我深切体会到不管在哪里,多做少说是新手树立良好第一印象适应公司氛围的关键,不管是老中老美,大家总还是尊重勤恳干活的人的。 在完成了第一个项目后,领导征询我的意见是否愿意领兵做一个重要的中间体工艺放大工作。这个项目和第一个完全不同,反应了有机合成工艺优化工作的极具挑战性的另一侧面,即如何啃下硬骨头。第一个项目事务繁杂但技术难度并不大,其中的挑战性在于如何依据实际情况分清工作主次,在有限的时间内作出合理决策。这第二个项目的核心内容是技术攻关,即如何将一个非常复杂的化学反应优化放大,完成三百公斤规模的生产。值得一提的是,这个放大生产是要在外包商的车间完成,这其中就还牵涉到如何顺利完成技术转移的任务。当时我工作了还不到四个月,确实并没有体察到完成这个任务所要求的方方面面的能力,只因为对这任务的技术上的挑战性充满兴趣,二话没说就接受了。现在回想起来,那时真有点不知天高地厚,豪气干云的意思,根本没想过万一做不下来会如何如何。 这个中间体的合成包括了三个主要步骤:先是高温(140摄氏度)下进行三加二环加成反应得到消旋产物的dimer,然后将dimer转化成消旋性产物,最后将消旋性产物拆分成所需的旋光性对映体。在我接手之前,通过多批次的办法已经合成过40公斤,这时的平均收率在16%左右。但我的任务是要生产300公斤。从前的工艺是行不通的。主要的问题有:高温下的环加成反应重复性差,收率和立体选择性变化幅度大;需进行两步分离,而消旋性产物盐的分离有极大难度(当时用了两天的离心时间);最后拆分工艺也不稳定,析出的晶体的旋光纯度随结晶时间的延长而逐步下降。所以要顺利实现这个放大,我必需解决这三个技术难题:1,如何确保高温反应的高收率和重现性;2,如何解决中间体的分离难题或者更进一步干脆省略中间体的分离步骤;3,如何建立稳定的拆分工艺。而这三个难题实际上是相关的,第一个难题的解决是解决第二个和第三个难题的基础。明确这个关系后,我们三人攻关小组现聚焦第一关。我们利用了在线红外波谱仪详细研究了高温下环加成反应机理,搞清了反应物配比,浓度,溶剂成分,温度和升温速率等变量对主反应和几个副反应的影响,把反应实时收率从80%提高到95%左右,同时实现了高重复性。第一步的高收率也意味着在这一步产生较低杂质,这样为省略中间体的分离(纯化)步骤奠定了基础,也为建立起稳定的拆分工艺提供了良好原料。就这样,我们用了近五个月的时间,把一个两步分离,平均收率16%的工艺改进成一步分离,单反应罐操作,平均收率30%的稳定工艺,并顺利地实现了对外包商的技术转移和规模生产。 在优化这一复杂反应过程中,方法论方面我有两点重要体会,第一,在技术攻关时,一定要站在战略性的高度来详尽分析各个矛盾,找到主要矛盾,集中所有资源先解决主要矛盾,只有这样才能高屋建瓴,
有机化学的氧化还原反应
有机化学氧化还原反应总结 一、氧化反应:有机物分子中加入O 原子或脱去H 原子的反应。 常见的氧化反应: ①醇的氧化 醇→醛 ②醛的氧化 醛→酸 ③有机物的燃烧氧化、与酸性高锰酸钾溶液的强氧化剂氧化。 ④醛类及其含醛基的有机物与新制Cu (OH )2悬浊液、银氨溶液的反应 常见的氧化剂有氧气、酸性高锰酸钾、二氧化锰、臭氧、银氨溶液和新制Cu (OH )2悬浊液 a. 能被酸性KMnO 4氧化的:烯、炔、二烯、油脂(含C==C 的)苯的同系物、酚、醛、葡萄糖等。 b. 能被银氨溶液或新制备的Cu(OH)2悬浊液氧化的:醛类、甲酸及甲酸酯、葡萄糖、麦芽糖。 1.高锰酸钾氧化 a.在稀、冷KMnO4(中性或碱性)溶液中生成邻二醇 b.在酸性高锰酸钾溶液中,继续氧化,双键位置发生断裂, 得到酮和羧酸的混合物,如: 炔烃与氧化剂(KMnO4或O3)反应,产物均为羧酸或CO2 2.臭氧化反应: CHR=CR 'R "+O3→RCH=O+R’C=OR” 3.醛的氧化:由于醛的羰基碳上有一个氢原子,所以醛比酮容易氧化,使用弱的氧化剂都能使醛氧化。利用两者氧化性能的区别,可以很迅速的鉴别醛或酮: a 费林试剂(Fehling):以酒石酸盐为络合剂的碱性氢氧化铜溶液(绿色),能与醛作用,铜被还原成红色的氧化亚铜沉淀。 坎尼扎罗(Cannizzaro )反应 不含 氢原子的醛在浓碱存在下可以发生歧化反应,即两个分子醛相互作用,其中一分子醛还原成醇,一个氧化成酸: CH 3 CH 2C=CHCH 3 CH 3 CH 3CH 2CCH 3O CH 3 COOH RCHO Ag(NH 3)2RCOONH 4O H 2NH 3HCHO HCOONa HCH 2OH
催化湿式氧化催化剂处理有机废水
催化湿式氧化催化剂处理有机废水 在过去的几十年里,快速的工业化和城市化进程导致石油、化工、制药、纺织等行业大量高毒性难降解的有机化合物废水排放到自然界,对环境安全和人类健康造成严重威胁。随着世界各国对环境治理的日益重视,废水的深度处理技术成为研究的热点。高级氧化技术包括芬顿、湿式空气氧化、双氧水氧化和光催化等是处理高毒性难降解有机污染物的日渐成熟的技术,在废水处理领域应用广泛。 湿式空气氧化(W AO)技术是一种废水处理的高级氧化技术。W AO技术在高温高压下产生诸如径基自由基等活性物种,被认为在处理高浓度有机物废水(化学需氧量(COD)10-100g/L)或难生物直接降解有毒污染物方面具有很大的潜力。W AO工艺可将高毒性难生物降解有机化合物在它们被释放到环境中之前分解成毒性较低、易于处理的小分子有机物。一般来说,这个反应过程在较高温度(200-3259)和压力(5-15MPa)下通过产生活性氧物种来进行。废水在气液固三相反应器中的停留时间在15分钟到120分钟的范围内,COD的去除程度可以通常为75%-90%。 W AO工艺的一个主要缺点是无法实现有机物的完全矿化。一些最初存在于废水中或氧化过程中积聚在液相中的小分子量含氧化合物(例如甲醇、乙酸和丙酸等)很难进一步转化为二氧化碳和水,达到完全矿化。此外,废水中有机氮化合物的主要转化产物为氨,而氨在WAO的运行条件下也很稳定,难以进一步转化处理。这些物质如果想完全转化可能需要更高的反应温度和压力。因此,W AO过程在一些情况下被认为是废水预处理步骤,需要额外的处理过程配合。 为了缓和W AO工艺中严苛的温度和压力操作条件,研究者将催化剂引入到W AO体系中一起使用,这种含催化剂的操作过程被称为催化湿式氧化(CWAO)。在CW AO中,难降解有机化合物在催化剂存在下可以在温和的操作条件(低温和低压)下实现更深度的氧化,从而相比WAO减少了投资和运营成本。与传统的湿空气氧化法相比,催化湿式氧化(CW AO)由于催化剂的存在,反应可以达到较高的氧化速度和程度,人们可以使用较为缓和的反应条件将化学需氧量降低到与非催化过程相同的程度。 一、催化湿式氧化机理 催化湿式氧化是一种在温和条件下处理毒性难降解有机污染物废水最常见的方法。其工艺流程如图1所示。废水加压预热与同等压力的压缩空气混合后进入到反应器中,在反应器内催化剂的作用下发生催化氧化分解。装置开始运行时,在加热设备的作用下达到反应的起始温度,当反应器中催化湿式氧化反应持续进行后,可利用氧化反应放出的热量取代加热来维持反应温度。反应后的气液混合物经过热回收、气液分离后排出。
