漆酶催化活性中心结构及应用的研究进展

第8卷第2期2000年 6月 纤维素科学与技术
Journal of Cellulose Science and T echnology
V ol.8 N o.2
Jun. 2000
综述评论漆酶催化活性中心结构及应用的研究进展Ξ
李光日 余惠生3 付时雨 秦文娟
(中国科学院广州化学研究所纤维素化学开放研究实验室 广州 510650)
文 摘:综述了漆酶催化活性中心结构及应用的研究进展。漆酶的催化
反应发生在铜离子形成的活性中心,但其氧化能力与氨基酸配体有密切
的关系。漆酶可应用于带有羟基或氨基的芳香族单体的聚合反应,偶氮
染料的合成及降解,稠环芳烃的降解去毒等。同时在纸浆的洁净漂白,化
学分析中痕量物质的检测,食品的保鲜及改良和环保等方面有重要应用。
关键词:漆酶,催化活性中心结构
中图法分类号:Q55
0 前 言
漆酶是一类含铜的多酚氧化酶(P—diphenol:oxidoreductase,EC1.10.3.2)。早在1883年,Y oshida从漆树的分泌物中发现了一种蛋白质,它可使油漆迅速固化[1]。1894年Bertrand将这种蛋白质命名为漆酶[2]。随后人们发现这种酶不仅存在于漆树的分泌物中[3~5],而且存在于多种植物[6~8]、昆虫[9,10]和高等真菌中[11~15]。
近年来,漆酶在痕量物质的分析、染料合成与降解、食品性质的改良、环保和皮革工业等领域显示了较高的应用价值。尤其重要的是漆酶在氧化还原介体的协助下具有降解木素的能力[16],可以用于纸浆中残余木素的脱除,有利于发展全无氯的纸浆漂白技术。与传统的氯漂工艺相比,利用漆酶来脱除纸浆中的残余木素,不会产生有毒性的氯酚类化合物,对减少环境污染有着重要的意义。因此漆酶作为一种具有很大的潜在应用价值的酶越来越受到人们的关注。关于漆酶产生方面的研究大多数是以白腐菌为研究对象,只有少数是以细菌[17]为研究对象。王佳玲等人对产漆酶白腐菌菌种,培养方式及产漆酶效果的影响因素等方面做过较为系统的总结[18]。本文将分以下三个方面对近年来有关漆酶的一些研究结果进行扼要的综述。
1 漆酶的催化活性中心结构
漆酶一般以单蛋白体的形式存在,其分子量范围一般是从52K Da到110K Da,也有些漆酶分子的分子量大于110K Da。不同来源的漆酶其分子被不同程度地糖基化,碳水化合物含量占10%~45%(质量分数),一般情况下真菌漆酶的碳水化合物含量要低于植物漆酶的碳水化合物含量[19]。含有糖基的蛋白不易结晶,为了研究漆酶蛋白多肽的
收稿日期:2000-01-06
国家自然科学基金和广东省科学基金资助课题
3通讯联系人
结晶结构,Ducros Valerie 等人首先将Coprinus cinereus 产生的漆酶利用酶法去除了糖基,然后以聚乙二醇为沉淀剂,利用悬滴法把它制作成小片晶体。经过X —射线衍射分析,
发现它们属于空间群P212121,单位晶胞参数为a =4.54nm ,b =8.57nm ,c =14.31nm [20]。
漆酶是一种铜蛋白,每个漆酶蛋白分子中含有四个铜离子[19]
。漆酶分子中的铜离子在催化氧化反应过程中起决定作用。根据磁学和光谱学性质将漆酶分子中的四个铜离子分为三类:Ⅰ型一个,Ⅱ型一个,及Ⅲ型两个。Ⅰ型铜离子是单电子受体,呈顺磁性。若用电子顺磁共振(EPR )谱检测漆酶中的Ⅰ型铜离子,可以检测到很低的超精细
分裂常数(_Az {),依不同来源的漆酶其{Az {值的范围是40~95×10-4cm -1。在
C N -和N -3的存在下这个铜离子的EPR 谱没有明显的变化,因此可以断定这个铜离子深埋在漆酶分子的内部。Ⅰ型铜离子呈蓝色,在λ614nm 处有特征的吸收峰。Ⅱ型铜离子也是单电子受体,呈顺磁性,不显蓝色,亦没有特征的吸收光谱。漆酶分子中的Ⅱ型铜离子是可以被替换的,它的去除对于Ⅰ型铜离子的吸收光谱有微弱的影响。一般
情况下Ⅱ型铜离子的{Az {>140×10-4cm -1。Ⅲ型铜离子是偶合的离子对,是抗磁
性的,因此甚至在室温下也检测不出其EPR 谱。Ⅲ型铜离子在λ330nm 处有宽的吸收峰[19]。
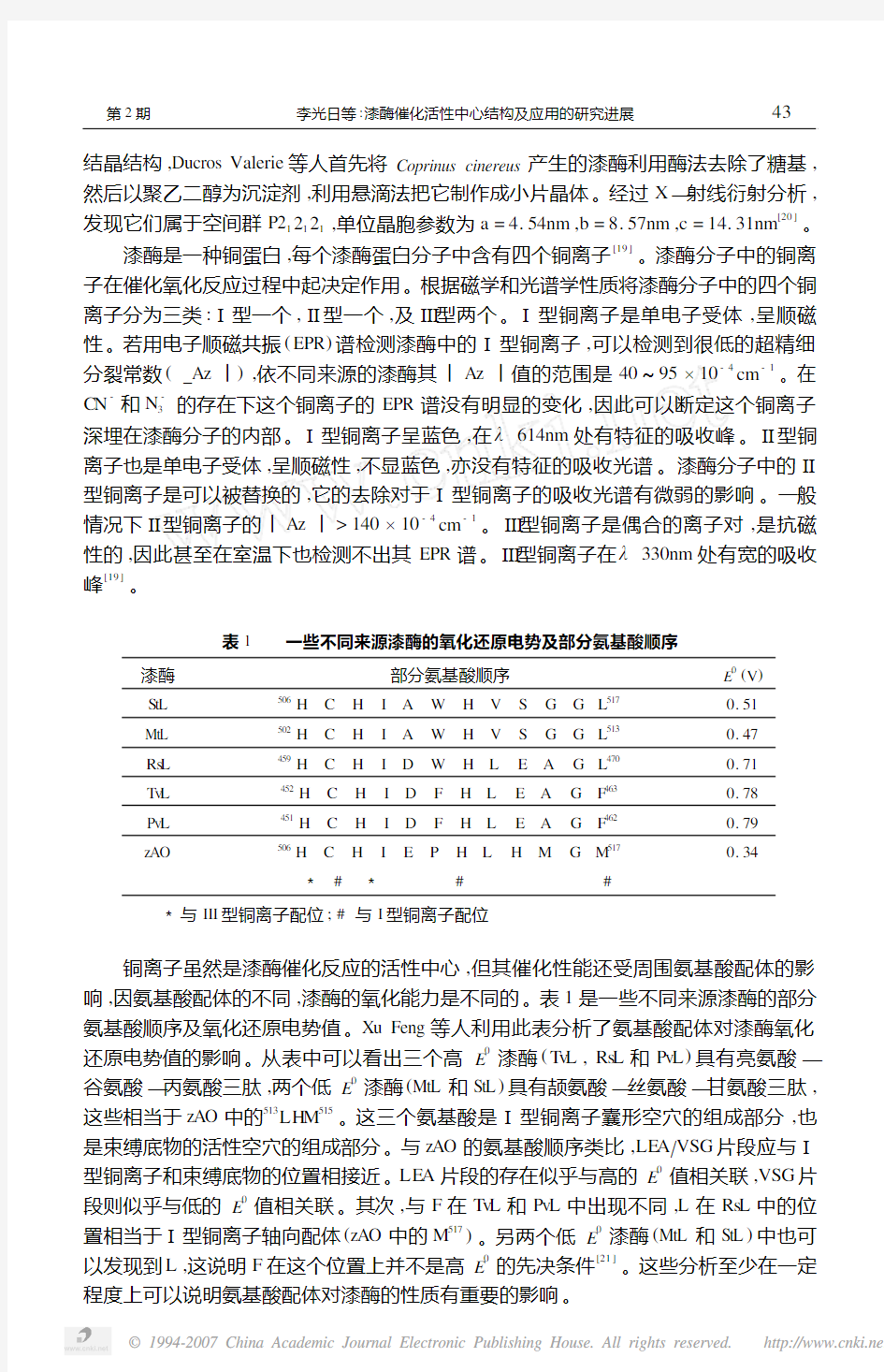
表1 一些不同来源漆酶的氧化还原电势及部分氨基酸顺序
漆酶
部分氨基酸顺序E 0(V )S tL
506 H C H I A W H V S G G L 5170.51MtL
502 H C H I A W H V S G G L 5130.47Rs L
459 H C H I D W H L E A G L 4700.71T v L
452 H C H I D F H L E A G F 4630.78Pv L
451 H C H I D F H L E A G F 4620.79zAO 506 H C H I E P H L H M G M
5170.34 3 # 3 # #
3与III 型铜离子配位;#与I 型铜离子配位
铜离子虽然是漆酶催化反应的活性中心,但其催化性能还受周围氨基酸配体的影响,因氨基酸配体的不同,漆酶的氧化能力是不同的。表1是一些不同来源漆酶的部分氨基酸顺序及氧化还原电势值。Xu Feng 等人利用此表分析了氨基酸配体对漆酶氧化
还原电势值的影响。从表中可以看出三个高E 0漆酶(T v L ,Rs L 和Pv L )具有亮氨酸—
谷氨酸—丙氨酸三肽,两个低E 0漆酶(MtL 和StL )具有颉氨酸—丝氨酸—甘氨酸三肽,
这些相当于zAO 中的513LH M 515。这三个氨基酸是Ⅰ型铜离子囊形空穴的组成部分,也
是束缚底物的活性空穴的组成部分。与zAO 的氨基酸顺序类比,LE A ΠVSG 片段应与Ⅰ
型铜离子和束缚底物的位置相接近。LE A 片段的存在似乎与高的E 0值相关联,VSG 片
段则似乎与低的E 0值相关联。其次,与F 在T v L 和Pv L 中出现不同,L 在Rs L 中的位
置相当于Ⅰ型铜离子轴向配体(zAO 中的M 517)。另两个低E 0漆酶(MtL 和StL )中也可
以发现到L ,这说明F 在这个位置上并不是高E 0的先决条件[21]。这些分析至少在一定
程度上可以说明氨基酸配体对漆酶的性质有重要的影响。
34第2期 李光日等:漆酶催化活性中心结构及应用的研究进展
2 漆酶作为催化剂可催化的化学反应
不同来源的漆酶催化氧化反应的能力是不相同的,其原因是漆酶和底物之间的氧化还原电势差的不同[19]。能被漆酶催化氧化的不同类型的底物主要有酚类及其衍生物,芳胺及其衍生物,羧酸及其衍生物,甾体激素和生物色素,金属有机化合物及其它非酚类底物[如1,2,4,5—四甲氧基苯,1—苯基—2—(3,4—二甲氧基苯基)乙二醇,苯环上连有羟基,烷氧基,氨基的吲哚衍生物],这方面已有综述
[22]
。下面将介绍近年出现
的漆酶催化的新反应。
2.1 合成高分子化合物漆酶可以催化丁香酸的聚合,生成聚(2,6—二甲氧基—1,4—羟亚苯基)[23],漆酶
也可以催化2,6—二甲基苯酚的聚合反应,生成聚(2,6—二甲基—1,4—羟亚苯基)[24]。
在兰格缪尔槽中漆酶可以催化4—四十烷氧基苯酚和六十烷基苯胺为单体的聚合反应,来合成二维电光高分子网络。反应所利用的酶—水溶液—缓冲体系比起传统的大量利用有机溶剂的高分子聚合体系,可以大大减少环境污染
[25]。
2.2 含氨基芳香环染料的合成和降解漆酶催化3—甲基—2—苯并噻唑啉腙和3—二甲基氨基苯甲酸之间的反应,生成兰色吲达胺染料[26]。漆酶可以催化三唑类化合物与氢醌反应,高效率地合成3-取代
的1,2,4—三唑并[4,3—b ][4,1,2]苯并噻二嗪—8—酮[27]。其化学方程式如下:
Chivukula 等人发现Pyricularia oryzae 漆酶可以催化氧化甲基、甲氧基、氯和硝基取代的4—(4′—磺酸基苯偶氮)苯酚等酚偶氮染料。漆酶催化氧化4—(4′—磺酸基苯偶氮)苯酚的2,6—二甲基衍生物为4—磺酸苯基过氧化氢(SPH )和2,6—二甲基—1,4—苯醌。2—甲基和2—甲氧基取代的染料氧化成为SPH 和2—甲基苯醌或2—甲氧基苯醌。2,6—二甲氧基取代的染料被漆酶催化氧化产生六种产物。其中的三种被确定为SPH ,4—羟基苯磺酸和2,6—二甲氧基苯醌。这个反应说明漆酶对偶氮染料有去毒作用[28]。
2.3 降解稠环芳香化合物
漆酶也可以催化稠环芳烃类化合物的氧化。Trametes ver sicolor 产生的粗的漆酶制备物可以催化氧化蒽和致癌物苯并芘。蒽被氧化的主要产物为蒽醌,苯并芘被氧化的
产物有几种[29]。在1—羟基苯并三唑和不饱和类脂类的存在下真菌漆酶能有效地催化
44 纤维素科学与技术 第8卷
氧化菲。经过182h 的反应以后,起初反应的菲的72%被降解,主要反应产物为菲—9,
10—醌和2,2′—联苯甲酸[30]。这些研究显示白腐菌氧化有毒有机污染物多环芳烃时
漆酶起着重要作用。
漆酶也可以在ABTS 的协助下将取代苯甲醇定量地转化为取代苯甲醛[31],在温和
的条件下催化去除甲硫氨酸或色氨酸的苯酰肼保护基团[32],催化4—羟基扁桃酸和2—
(4—羟苯基)甘氨酸的脱羧作用,使它们转化为同一产物4—羟基苯甲醛(H BA ),不继续
转化为其它物质[33],漆酶亦可以催化四氯愈创木酚和四氯儿茶酚的脱氯反应[34]
。
3 漆酶在应用领域的研究
3.1 漆酶应用于纸浆洁净漂白
传统的氯气漂白纸浆的工艺,因产生有毒的氯酚类化合物而带来严重的环境污染,所以成为逐渐被淘汰的工艺。近年来出现的氧,臭氧和过氧化氢漂白工艺,虽然比起传统氯漂工艺减少了给环境带来的污染,但得到的纸浆的粘度,抗张强度等指标不太令人满意,且成本也比较高。因此很多学者把目光投向纸浆的生物漂白上,因为利用酶法对纸浆进行漂白,不会产生有毒物质给环境带来污染,并且不会损伤纸浆中的纤维素和半纤维素组分,可提高纸浆质量。
自从Bourbonnais 和Paice 发现漆酶—ABTS[2,2′-azinobis -(3-ethylbenzthiazoline -
6-sulfonate )]系统有氧化非酚型木素结构单元的能力[16]以来,吸引许多科学家研究利
用漆酶—介体系统漂白纸浆,这些工作主要从漆酶的氧化性能,介体的选择及其作用机理等方面进行。从目前报道结果来看,来自白腐菌的漆酶效果最佳,主要的有效介体有
ABTS ,H BT ,NH A 和紫尿酸等,Call 等人在这方面做过系统总结[35]。广州化学所利用
选育出的白腐菌Panus conchatus 在39℃下发酵稻草得到的漆酶,以ABTS 为氧化还原介体,通过L (酶处理阶段)—Q (螯合阶段)—P (过氧化氢漂白阶段)过程处理芦苇硫酸盐
纸浆,将其卡伯值从原来的17.4降低到4.4[36]。Sealey 等人比较了利用漆酶、漆酶Π
ABTS 和漆酶ΠN —羟基苯并三唑对氧脱木素软木硫酸盐纸浆进行生物漂白时的脱木素效果。最后的结果为仅用漆酶脱木素5%,漆酶ΠABTS 可脱木素35%,漆酶ΠN —羟基苯
并三唑可脱木素55%[37]。Harald Jakob 等人研究发现,对纸浆进行L —E (碱抽提)以后,
可以降低ECF 过程所需要的化学药品量。比起常规的氧漂工艺,生物脱木素可提高30%的效果。他们认为此过程中所需要的介体量较大,若从实用角度考虑,还是不经济。为了达到经济地利用此工艺的目的,仍需开发有高度稳定性和好的反应性的氧化
还原介体[38]。
3.2 漆酶在化学分析方面的应用
酶免疫分析广泛应用在生物科学,医药,食品工业等领域,其优点在于灵敏度高。
Olga V.Skorobogat ′ko 等人[39]成功地将Coriolus hir sutus 产生的漆酶作为免疫分析的新的
标记酶,证明在不同的免疫分析中采用免疫漆酶的共轭体是可行的。漆酶作为标记酶比起过氧化物酶,其优点在于:漆酶接受氧作为第二个底物,因此在反应过程中不失活;在反应介质当中存在各种金属离子时漆酶不敏感(与过氧化物酶比较);以漆酶为基
54第2期 李光日等:漆酶催化活性中心结构及应用的研究进展
64 纤维素科学与技术 第8卷础的免疫分析可以使用过氧化物酶免疫分析的标准试剂和仪器。
将漆酶固定化,利用胶束增强分光荧光测定法可以测定L—抗坏血酸。其原理是漆酶催化氧化邻—苯二胺产生2,3—二氨基吩嗪时受L—抗坏血酸的抑制作用。这个方法可以测定0.02~2.0μgΠm L的L—抗坏血酸,检测极限为0.14μgΠm L[40]。
用四甲基原硅酸酯的水解、缩合Π聚合来合成的含有漆酶的溶胶—凝胶用于生物传感器上。Simkus等人[41,42]设计并测试了两种类型的含有漆酶溶胶—凝胶的光学生物传感器。第一种类型利用的是2~8mm厚的含漆酶的溶胶—凝胶块,观察到它能积聚漆酶底物———2,6—二甲基苯酚被氧化产生的高分子量产物。与均相相比,这可以增加光学生物测试灵敏度10倍。第二种类型的生物传感器利用直径为0.3mm的含漆酶的溶胶—凝胶微粒在流动测定池中进行测定。与第一种传感器相比,这种传感器的响应时间短。此传感器还具有均相测试灵敏度,并且给出线性校准曲线。另外这些含漆酶的溶胶—凝胶也是检测芳香胺的生物传感器,漆酶催化氧化底物2,6—、2,5—和2,4—二甲基苯胺产生的高分子量的有色产物被含漆酶的溶胶—凝胶块积累。这个过程显著增加光学生物检测灵敏度。
漆酶催化氧化5,6—二溴—2,3—二氰氢醌成为5,6—二溴—2,3—二氰半醌的反应中,稀土离子对漆酶活性有抑制作用,抑制程度与稀土离子的浓度成比例。以此为基础设计出的简单,快速的新的在线酶催化动力学分析方法,可以测定水中的痕量稀土离子[43]。漆酶还可以吸附固定于光谱石墨电极上可以作生物传感器检测酚类化合物[44],漆酶与低聚糖脱氢酶的生物传感器用于免疫分析[45]。
3.3 漆酶在食品工业中的应用
以4B—E pi—I DA—Cu2+—螯合物固定在琼脂糖凝胶载体上的漆酶,可以去除苹果汁中的39%的酚类和48%的黄烷醇类,再生的固定化漆酶可以去除34%的酚类和44%的黄烷醇类[46]。固定化漆酶装填在柱子里,处理葡萄酒或葡萄汁,可以有效去除其中的酚类物质[47]。
将漆酶加入到含油的产品(如:含大豆油的色拉调味品)中,可以脱除油中的氧,并且改善香味性质[48]。将Trametes villosa漆酶加入到捣碎的橄榄和水的混合物中,使漆酶酶活达到1UΠg(混合物),则橄榄的苦味明显地降低,颜色也变黑[49]。
3.4 漆酶在环保方面的应用
固定化酶(如:氧化还原酶和水解酶)可用于净化受污染的土壤。G ian freda等人利用沙子,土壤及其混合物研究了Trametes ver sicolor漆酶,辣根过氧化物酶和麦芽酸性磷酸酶固定化于三个天然载体(蒙脱土,高岭土和粉砂壤土)上的活性变化情况,发现固定化的漆酶和过氧化物酶保留了高的活性,然而固定化的酸性磷酸酶显示了活性的降低,过氧化物酶和漆酶对底物的亲和力没有改变,然而固定化的酸性磷酸酶得到的K m值较高。在土壤—沙子混合物中增加土的含量,或增加有机物的含量,则对固定化酶活性有抑制作用。利用固定化的漆酶多次重复处理2,4—二氯苯酚观察固定化酶的再用性,研究发现经几次处理后酶的活力水平有所不同。然而当有土壤存在时,经每次处理后土壤的抑制作用有所下降,这表明所出现的抑制至少部分是来自于土壤。这些研究
显示将固定化酶引入到土壤环境中有催化降解毒物的活性,但它们的持久性受到土壤
组分中的有机或无机物的影响[50]。
利用Trametes ver sicolor 漆酶去除水中的氯酚类化合物时,加入适量的愈创木酚和
2,6—二甲氧基苯酚,能有效地使氯酚类化合物沉淀下来,可提高酶去污效率[51]。另
外,Bollag 等人利用固定化酶处理纸厂废水,能有效地除去其中的甲基酚等毒物[52]。
3.5 漆酶在其它方面的应用
在20~40℃下用漆酶处理红花24h ,可以成倍提高红花素的产率[53]。漆酶作用于
碘化物,可将碘负离子转化为碘[54],用于化妆品和药品当中能脱除黑素[55],也可用于洗
涤剂[56,57],染发剂[58,59]和纺织物染色剂[60]中。漆酶还可用于皮革工业,能使鞣剂更牢固地固定于皮革上[61]。
参 考 文 献
1 Y oshida H.J Chem S oc ,1883,43:472~486
2 Bertrand M D.1894,C.R.A.S.Paris ,118:1215~1218
3 李勇富,郭明高.林产化学与工业,1988,8(2):34~39
4 Osaki S ,Walaas O.Arch Biochem Biophys ,1968,123:638~646
5 Omura T.J Biochem ,1961,50(3):264~271
6 Lehman E ,Harel E ,Mayer A M.Phytochemistry ,1974,13:1713~1717
7 Bar -Nun N ,Mayer A M ,Sharon N.Phytochemistry ,1981,20:402~408
8 Bligny R ,Douce R.Biochem J ,1983,209:489~496
9 Call H P ,Mucke I.J of Biotechnol ,1997,53:163~202
10 Thurston C F.Microbiology ,1994,140:19~26
11 Bock S M.Phytochemistry.1967,6:777~783
12 Fahraeus G,Lgunggren H.Biochim Biophys Acta ,1961,46:23~32
13 M oshach R.Biochim Biophys Acta ,1963,73:204~212
14 Fahraeus G,Reinhammar B.Acta Chimica Scandinacica ,1967,21:2367~2378
15 Arora S ,Sandhu D K.Enzyme Microb T echnol ,1985,7:405~408
16 Bourbonnais R ,Paice M G.FE BS Lett ,1990,267:99~102
17 Faure D ,Bouillant M L ,Jacoud C ,Bally R.Phytochemistry ,1996,42(2):357~35918 王佳玲,余惠生,付时雨,黄秀瑜.微生物学通报,1998,25(4):233~236
19 Jeffrey F D ,K-E L Erikss on.H olz forschung ,1994,48(Suppl ):21~33
20 Ducros Valerie ,Davies G ideon J et al .Acta Crystallogr ,Sect.D :Biol Crystallogr ,1997,D53
(5):605~607
21 Feng Xu ,Randy M.Berka et al .Biochem J ,1998,334:63~70
22 季立才,胡培植.林产化学与工业,1997,17(1):79~84
74第2期 李光日等:漆酶催化活性中心结构及应用的研究进展
84 纤维素科学与技术 第8卷23 Hiroshi Uyama et al.Macrom olecules,1996,29:3053~3054
24 Ry ohei Ikeda et al.Macrom olecules,1996,29:8702~8705
25 Akkara Joseph A,Bruno Fernando et al.P olym Prepr(Am Chem S oc,Div P olym Chem), 1993,34(2):759~760
26 Baker W L,K unamalar Sabapathy et al.Enzyme Microb T echnol.1996,18(2):90~94
27 Bhalero,Uday T.T etrahedron,1994,50(13):4019~4024
28 Chivukula.Appl Environ Microbiol,1995,61(12):4374~4377
29 C ollins,Patrick J et al.Appl Environ Microbiol,1996,62(12):4563~4567
30 Bohmer Siegmund,Messner K urt et al.Biochem Biophys Res C ommun,1998,244(1):233~238
31 P otthast A,R osenau T et al.J M ol Catal A:Chem,1996,108(1):5~9
32 Semenov Anatoly N,Lom onos ova Irina V et al.Biotechnol Bioeng,1993,42(10):1137~1141
33 Agematu Hitosi,Shibam oto Norio et al.Biosci Biotechnol Biochem,1993,57(11):1877~1881
34 Iimura Y,Hartikainen P et al.Appl Microbiol Biotechnol.1996,45(3):434~439
35 Call H P,Mucke I.J of Biotechnology,1997,53:163~202
36 Y u Huisheng,Wang Caihua et al.1997,ISWPC,130:1~3
37 Sealey J,Ragauskas A J.J of W ood Chem and T echnol,1998,18(4):403~406
38 Harald Jacob,Michael Del G ross o et al.Das Papier,1999,2:85~95
39 Olga V,Skorobogat’ko,Andrey L,G indilis et al.Analytical Letters,1993,27(15):2997~3012
40 Huang H ouping,Cai Ruxiu et al.Anal Sci,1997,13(Suppl,Asianalysis I V):67~70
41 Simkus R A,Laurinavicius V.Analytical Letters,1996,29(11):1907~1919
42 Simkus R A,Laurinavicius V.Biologia,1995(1~2):44~46
43 Cai Ruxiu et al.T alanta,1994,41(5):735~738
44 Y aropolov A I,K harybin A N et al.Analytica Chimica Acta,1995,308:137~144
45 Scheller Frieder,W ollenberger Ulla et al.G er O ffen,DE4,314,417(1994)
46 Piacquadio Piera,De Stefano G iovanni et al.Biotechnol T ech,1997,11(7):515~517
47 Brenna Oreste et al.Biotechnol Lett,1994,16(1):35~40
48 Petersen Bent Riber et al.PCT Int.Appl.W O9635,768
49 Nov o Nordisk AΠS.Res Discl,1995,378(37828):676
50 G ian freda Lilina et al.S oil Sci S oc Am J,1994,58(6):1672~1681
51 R oper J,Chadwick,Sarkar Jawed M et al.Water Res,1995,29(12):2720~2724
52 Shuttlewerth KL,Bollag J M.Enzyme Microb T echnol,1986,8(3):189
53 As o T akeshi,Sakota Naoichi.J P08,214,896[96,214,896]
54 Xu Feng.PCT Int.Appl.W O9616,165
55 Matsubara Masaaki,K ashino Y oshinori et al.J P08,217,659[96,217,659]
56 Herbots Ivan,Maurice Alfons Jan.PCT Int.Appl.W O9743,381
57 Herbots Ivan ,Maurice Alfons Jan.PCT Int.Appl.W O9743,383
58 Y oshino T eruhiko.J P09,263,522(1997)
59 S orensen ,Niels Henrik.PCT Int.Appl.W O97,37,633
60 K irk Ole ,Barfoed Martin PCT Int.Appl.W O97,23,685
61 S orensen Niels Henrik ,Ingv orsen K jeld et al .PCT Int.Appl.W O9312,259(1993)
R ecent Advances in Studies on Structure of C atalytic
Active Center and Application of Laccase
Li G uangri Y u Huisheng Fu Shiyu Qin Wenjuan
(Laboratory of Cellulose and Lignocellulosics Chemistry ,G uangzhou Institute of
Chemistry ,Chinese Academy of Sciences ,G uangzhou 510650,China )
Abstract :Recent advances in studies on structure of catalytic active center and application of laccase are reviewed in the present paper.Main catalytic reactions of laccase occur in Cu 2+formed active center ,however the level of redox potential is related to amino acid https://www.360docs.net/doc/0e17218542.html,ccase could catalyze polymerization of aromatic com pounds with hydroxyl or amino groups ,synthesis and degra 2dation of azo dye ,and degradation and detoxification of polyaromatic hydrocarbon ,https://www.360docs.net/doc/0e17218542.html,ccase was used in recent studies for building up total chlorine free (TCF )pulp bleaching system.In ad 2dition ,laccase has been widely used in keeping fresh of foods and environmental protection pro 2cesses.
K eyw ords :laccase ,catalytic active center
94第2期 李光日等:漆酶催化活性中心结构及应用的研究进展
漆酶催化活性中心结构及应用的研究进展
第8卷第2期2000年 6月 纤维素科学与技术 Journal of Cellulose Science and T echnology V ol.8 N o.2 Jun. 2000 综述评论漆酶催化活性中心结构及应用的研究进展Ξ 李光日 余惠生3 付时雨 秦文娟 (中国科学院广州化学研究所纤维素化学开放研究实验室 广州 510650) 文 摘:综述了漆酶催化活性中心结构及应用的研究进展。漆酶的催化 反应发生在铜离子形成的活性中心,但其氧化能力与氨基酸配体有密切 的关系。漆酶可应用于带有羟基或氨基的芳香族单体的聚合反应,偶氮 染料的合成及降解,稠环芳烃的降解去毒等。同时在纸浆的洁净漂白,化 学分析中痕量物质的检测,食品的保鲜及改良和环保等方面有重要应用。 关键词:漆酶,催化活性中心结构 中图法分类号:Q55 0 前 言 漆酶是一类含铜的多酚氧化酶(P—diphenol:oxidoreductase,EC1.10.3.2)。早在1883年,Y oshida从漆树的分泌物中发现了一种蛋白质,它可使油漆迅速固化[1]。1894年Bertrand将这种蛋白质命名为漆酶[2]。随后人们发现这种酶不仅存在于漆树的分泌物中[3~5],而且存在于多种植物[6~8]、昆虫[9,10]和高等真菌中[11~15]。 近年来,漆酶在痕量物质的分析、染料合成与降解、食品性质的改良、环保和皮革工业等领域显示了较高的应用价值。尤其重要的是漆酶在氧化还原介体的协助下具有降解木素的能力[16],可以用于纸浆中残余木素的脱除,有利于发展全无氯的纸浆漂白技术。与传统的氯漂工艺相比,利用漆酶来脱除纸浆中的残余木素,不会产生有毒性的氯酚类化合物,对减少环境污染有着重要的意义。因此漆酶作为一种具有很大的潜在应用价值的酶越来越受到人们的关注。关于漆酶产生方面的研究大多数是以白腐菌为研究对象,只有少数是以细菌[17]为研究对象。王佳玲等人对产漆酶白腐菌菌种,培养方式及产漆酶效果的影响因素等方面做过较为系统的总结[18]。本文将分以下三个方面对近年来有关漆酶的一些研究结果进行扼要的综述。 1 漆酶的催化活性中心结构 漆酶一般以单蛋白体的形式存在,其分子量范围一般是从52K Da到110K Da,也有些漆酶分子的分子量大于110K Da。不同来源的漆酶其分子被不同程度地糖基化,碳水化合物含量占10%~45%(质量分数),一般情况下真菌漆酶的碳水化合物含量要低于植物漆酶的碳水化合物含量[19]。含有糖基的蛋白不易结晶,为了研究漆酶蛋白多肽的 收稿日期:2000-01-06 国家自然科学基金和广东省科学基金资助课题 3通讯联系人
漆酶催化大米蛋白与阿魏酸交联及其结构和抗氧化活性的变化
98 漆酶催化大米蛋白与阿魏酸交联及其结构和抗氧化 活性的变化 贾潇1,赵谋明1,2,贾春晓1,滕建文1,韦保耀1,黄丽1,夏宁1 (1.广西大学轻工与食品工程学院,广西南宁 530004)(2.华南理工大学轻工与食品学院,广东广州 510640) 摘要:本文研究了大米蛋白(Rice protein ,RP )与阿魏酸(Ferulic acid ,FA)的酶法交联及其在水相和乳液中的抗氧化能力,通过HPLC 分析FA 的含量以及SDS-PAGE 、紫外光谱、红外光谱和扫描电子显微镜分析RP 的结构变化。HPLC 分析表明FA 易被漆酶催化氧化,且FA 的氧化产物与RP 的亚基反应,从而引起大米蛋白分子量的增加;随着FA 浓度的增加,RP 的紫外图谱在300~350 nm 处的吸收逐渐增加,交联样品呈现橘黄色,说明氧化阿魏酸能共价结合大米蛋白;RP 与FA 经酶法交联后RP 二级结构发生变化,α-螺旋和β-转角含量分别降低了13%与2%,无规卷曲和β-折叠含量分别提高了11%与4%,蛋白的显微结构从聚集变为松散;FA 与RP 交联产物的清除DPPH 自由基能力和清除ABTS 自由基能力分别从32.31%增加到71.43%和从3.34%增加到77.61%,FA 与RP 交联产物可显著降低乳液中氢过氧化值、TBARS 值、己醛的含量,说明交联可有效提高大米蛋白的抗氧化活性。 关键词:大米蛋白;阿魏酸;酶法交联;抗氧化活性;油脂氧化 文章篇号:1673-9078(2016)11-98-105 DOI: 10.13982/j.mfst.1673-9078.2016.11.015 Laccase-mediated Cross-linking of Rice Protein with Ferulic Acid: Changes in Structural Properties and Antioxidant Activity JIA Xiao 1, ZHAO Mou-ming 1, 2, JIA Chun-xiao 1, TENG Jian-wen 1, WEI Bao-yao 1, HUANG Li 1, XIA Ning 1 (1.College of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China) (2.College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China) Abstract: The enzymatic cross-linking of rice protein (RP) and ferulic acid (FA) and the antioxidant activity of the resultant product in the aqueous phase and emulsion were studied, and the FA content was investigated by high performance liquid chromatography (HPLC). Changes in the structural properties of RP were analyzed by sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE), ultraviolet (UV) spectroscopy, Fourier transformed infrared (FT-IR) spectroscopy, and scanning electron microscopy. HPLC results showed that the FA easily underwent laccase-catalyzed oxidation, and the oxidation product could react with the subunits of RP , resulting in an increase of RP protein molecular weight. With increasing FA concentration, the absorbance band between 300 and 350 nm in the UV/visible spectra of RP gradually increased, and the cross-linked products had an orange-yellow color, indicating that the oxidation products bound covalently to the free amino groups of RP . After the enzymatic cross-linking of RP and FA, the secondary structure of RP changed, the contents of β-turn and α-helix were reduced by 13% and 2%, respectively, the contents of random coil and β-sheet were increased by 11% and 4%, respectively, and the microstructure of RP became loosened from the aggregated state. 2,2-diphenyl-1-picrylhydrazyl (DPPH) and 2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) free radical scavenging abilities of the RP-FA cross-linked product were increased from 32.31% to 71.43% and from 3.34 % to 77.61%, respectively, compared to those of RP . RP-FA cross-linked product could significantly reduce the level of hydroperoxide, 2-thiobarbituric acid reactive substances (TBARS), and hexanal in the emulsion, suggesting that cross-linking of RP can effectively enhance the antioxidant activity of RP . Key words: rice protein; ferulic acid; enzymatic cross-linking; antioxidant activity; oil oxidation 收稿日期:2015-11-26 基金项目:广西科技攻关项目(14122006-2);广西科技攻关项目(14121003-6-1);“广西八桂学者团队项目”及广西高校“广西特色农产品精深加工及安全控制”重点实验室项目资助 作者简介:贾潇(1991-),女,硕士研究生,研究方向:粮食油脂植物蛋白工程 通讯作者:夏宁(1977-),女,博士,副教授,研究方向:粮食油脂植物蛋白工程
生物酶催化技术及活性污泥膨胀技术
生物酶催化技术及活性污泥膨胀技术 [摘要] 本文主要对工业及生活污水处置进行了分析,提出了生物酶催化技术在滞留污水应急处置中的应用,以及从介绍活性污泥膨胀现象的特点及分类,并从温度、营养比例、污泥负荷、DO值、pH值、早期消化等角度进行分析,得出进水水质、运行条件不同,产生污泥膨胀的原因各异的结论。为环境污染应急处置提供了有效措施。 [关键词] 生物酶滞留污水活性污泥;污泥膨胀; [引言] 我国国民经济迅猛发展,城市规模不断扩大,人口数目增长迅速,随之而来是城市、工业、生活污水水量不断加大,水质也越来越复杂,仅仅依靠稀释及水体自净作用处理过污水已经无法满足达标排放要求,会对下游水体产生较大污染和影响。这种情况下,我们就不不采取措施加大对城市生活污水处理力度,以改善不断恶化水环境污染趋势。目前国内现有的常规处理工艺无法应对突发性环境污染造成的超标污染物,深度处理工艺也仅能应对部分超标污染物。而了解了活性污泥的相关原理和方法就能很有效的解决污水的相关问题。活性污泥法自1914年被A1dern发明,由于其经济、可靠的优势而得到广泛应用,并随着实际运行产生了阶段曝气、渐减曝气、AB工艺、A/O工艺、A2/O等系列变形工艺,但无论是哪种改进的活性污泥工艺都会发生污泥膨胀现象,并且活性污泥膨胀现象发生非常广泛,活性污泥膨胀能够降低污泥沉降性能,影响出水水质。因此污泥膨胀成为活性污泥法困扰人们最大的难题之一。如何采用有效的应急处置技术,在最短时间有效去除污染物,已成为当前所面临的新课题。
生物酶催化处理污水技术 1生物酶催化处理污水技术的机理 将生物酶催化技术应用于环境中污染物的去除,不同于普通微生物的系列生物酶技术,是将多种生物酶进行复合,通过生物酶打开污染物中更复杂的化学链,酶分子可以使反应物分子中化学键拉长、扭曲和变形,使他们更容易被水解,因而加速有机物的分解,将其迅速降解为小分子,从高分子有机物降解为低分子有机物或CO2、H2O等无机物,降低 COD值,从而达到去除污染物的目的,并可大大降低污水处理费用。 与其他微生物处理相比,生物酶催化处理法具有催化效能高、反应条件温和、对废水质量及设备情况要求较低,反应速度快,对温度、浓度和有毒物质适应范围广,可以重复使用等优点。 酶催化反应通式: 在酶催化反应中,根据中间产物学说,催化反应可以分为两步进行,反应式如下: E +S → ES → P + E 酶底物中间产物最终产物 酶(E)的作用是:与S暂时结合形成一个新化合物ES,ES的活化状态(过渡态)比无催化剂的该化学反应中反应物活化分子含有的能量低得多。ES再反应产生P,同时释放E。E可与另外的S分子结合,再重复这个循环。降低整个反应所需的活化能,使在单位时间内有更多的分子进行反应,反应速度得以加快。
真菌漆酶的研究进展及其应用前景
万方数据
万方数据
万方数据
真菌漆酶的研究进展及其应用前景 作者:周雪婷, 张跃华, 罗志文, 潘亭如, 缪天琳 作者单位:佳木斯大学,黑龙江佳木斯,154007 刊名: 农业与技术 英文刊名:Agriculture & Technology 年,卷(期):2012,32(9) 参考文献(33条) 1.王光辉;季立才中国漆树漆酶的底物专一性 1989 2.Nina H;Laura-Leena K Crystal structure of a laccase from Melanocarpus albomyces with an intact trinuclear coper site 2002(08) 3.雷福厚;蓝虹云漆树漆酶和真菌漆酶的异同研究[期刊论文]-中国生漆 2003(01) 4.李慧蓉白腐真菌生物学和生物技术 2005 5.Harald Claus Laccases:structure.reactions,distrihution 2004(35) 6.张丽白腐真菌产漆酶对染料废水降解的研究 2004 7.张敏;肖亚中;龚为民真菌漆酶的结构与功能[期刊论文]-生物学杂志 2003(20) 8.Gimifreda L;Xu F;Bollag J-M Laccases:a useful group of oxido reductive enzymes 1999(03) 9.Xu F;Kulys J J;Duke K Redox Chemistry in Laccase-Catalyzed Oxidation of N-Hydroxy Compounds 2000(66) 10.堵国成;赵政;陈坚真菌漆酶的酶活测定及其在织物染料生物脱色中的应用[期刊论文]-江南大学学报(自然科学版) 2003(02) 11.缪静;姜竹茂漆酶的最新研究进展[期刊论文]-烟台师范学院学报(自然科学版) 2001(17) 12.刘尚旭;赖寒木质素降解酶的分子生物学研究进展[期刊论文]-重庆教育学院学报 2001(14) 13.何为;詹怀宇;王习文;伍红一种改进的漆酶酶活检测方法[期刊论文]-华南理工大学学报(自然科学版) 2003(31) 14.季立才;胡培植漆酶结构,功能及应用 1996(18) 15.侯红漫白腐菌Pleurotus ostreatus漆酶及对蒽醌染料和碱木素脱色的研究 2004 16.Huang Z Y;Huang H P;CaiR X Organic solvent enhanced spectrofluorin etric method for determition of laccase activity 1998(01) 17.Badiani M;Felici M;Luna M Laccase assay by means of highperfomance liquid chromatography 1983(02) 18.Wood D.A Production,Purification and Properties of Extracelluar laccase of Agaricus bisporus 1980(17) 19.林俊芳;刘志明;陈晓阳真菌漆酶的酶活测定方法评价[期刊论文]-生物加工过程 2009(04) 20.望天志;李卫莲;万洪文微量热法测定漆酶的活性[期刊论文]-自然杂志 1997(06) 21.Kirk T K;Farrell R L Enzymatic "combustion":The microbial degradation of lignin 1987(10) 22.张爱萍;秦梦华;徐清华漆酶在制浆造纸中的应用研究进展[期刊论文]-中国造纸学报 2004(02) 23.Reid I D Biological pulping in paper manufacture 1991(08) 24.Bergbauer M;Eggert C;Kraepelin G Degradation of chlorinated lignin compounds in a bleach plant effluent by the white-rot fungus Trametes Versicolor 1991(35) 25.林建城酶在食品工业,轻工业和环境保护上的应用分析[期刊论文]-莆田学院学报 2005(02) 26.林鹿;陈嘉翔白腐菌对纸浆CEH漂白废水的脱色、消除毒性和芳香化合物的降解 1996(11) 27.E Rodriguez;MA.Pickard;R Vazquez-Duhalt Industial dye decolorization by laccases from ligninolytic fungi 1999(38) 28.Bollag J M;Myers C Detoxification of aquatic and terrestrial sites through binding of pollutants to humic substances 1992(117-118) 29.Majcherczy A Oxidation of ploycyclic aromatic hydrocarbons (PAH) by laccase of Trametes versicolor 1998(22) 30.刘涛;曹瑞饪漆酶在环境保护领域中的研究及应用进展[期刊论文]-云南环境科学 2005(03) 31.Collins P J;Kotterman M J J;Field J A;Dobson A Oxidation of Anthracene and Benzo[a]pyrene by Laccase from Trametes versicolor[外文期刊] 1996(12)
漆酶在制浆造纸中的应用研究进展
收稿日期:2004 07 19(修改稿) 作者简介:张爱萍,女,1980年生;山东轻工业学院硕士研究生;主要研究方向:纤维资源的制浆造纸特性与生物技术应用。 E mail:zhap@https://www.360docs.net/doc/0e17218542.html, 漆酶在制浆造纸中的应用研究进展 张爱萍 秦梦华 徐清华 (山东轻工业学院制浆造纸工程省级重点学科,山东济南,250100) 摘 要:漆酶是一种多酚氧化酶,参与木素的降解或聚合,具有氧化木素的能力,在制浆造纸中的应用已拓展到脱墨、漂白、制浆、废水处理、增加湿强性能等诸多方面。本文综述了近年来漆酶在制浆造纸工业中的应用研究进展。关键词:漆酶;脱墨;漂白;湿强中图分类号:Q55 文献标识码:A 文章编号:1000 6842(2004)02 0161 05 漆酶是一种含酮的多酚氧化酶(p diphenol oxidore ductase,EC 1 10 3 2),最早是1883年Yoshida 从漆树的分泌物中发现的[1],以后的研究进一步发现漆酶广泛存在于昆虫、植物和真菌中,尤其在一些能够降解天然木素的白腐菌(T versicolo r )中大量存在。 作为一种木素降解酶,漆酶可以降解生物体中的木素。漆酶的氧化还原电势比较低,为300~800m V (对标准氢电极)[2],只能氧化降解木素中的酚型结构单元(图1),而不能氧化占木素90%的非酚型结构。1990年[3] 发现如果有低分子质量的化合物作为氧化还原介体,漆酶能氧化非酚型木素结构(图2),最适合的介体是一些酚型化合物和杂环如卟啉类化合物,这些介体物质有的来自真菌次生代谢产物或木素降解产物,如紫丁香醛和来自P ycno porus cinnabarinus 的3 羟基邻氨基苯甲酸(3 hydroxyanthranilicacid,3 HAA);有的来自人工合成化合物,如AB TS[2,2 联氨 二(3 乙基 苯并噻唑 6 磺酸)]、HB T (1 羟基苯并三唑)、VI O (紫尿酸)、NHA(N 羟基 N 乙酰苯胺)等[4]。据报道,在氧气存在的条件下,漆酶能将介体转化成共介体,由于这种共介体尺寸较小,能够渗透进入纤维而与木素反应,脱木素机理基于自由基的形成[5 6]。目前,漆酶在制浆造纸工业的诸多方面得到了广泛的应用,如二次纤维回用、漂白、制浆、废水处理、纤维性能的改善,湿强剂及纤维板制造等,本文就这些方面的研究进展进行了综述。 1 漆酶在二次纤维回用中的应用 近年来,二次纤维在原料中所占的比例日益增加, 脱墨技术引起了越来越多的关注,酶法脱墨是一种经济有效的脱墨方法,可以减少化学脱墨带来的环境污染,而且酶处理可以改善浆料滤水性能和纸页强度,降 低漂白化学品用量。 图1 漆酶氧化酚型木素结构 图2 漆酶介体体系氧化非酚型木素结构 161 Vol 19,No.2,2004 Transactions of China Pulp and Paper 中 国 造 纸 学 报
漆酶活性检测试剂盒说明书 微量法
漆酶活性检测试剂盒说明书微量法 注意:正式测定之前选择2-3个预期差异大的样本做预测定。 货号:BC1635 规格:100T/96S 产品内容: 提取液:液体110mL×1瓶,4℃保存。 试剂一:液体20mL×1瓶,4℃保存。 试剂二:粉剂×2瓶,4℃避光保存。 产品说明: 漆酶(CE1.10.3.2)是一种含铜的多酚氧化酶,属于铜蓝氧化酶家族,漆酶存在菇、菌及植物中,是一种环保型酶,其独特的催化性质在生物检测中有广泛的应用。 漆酶分解底物ABTS产生ABTS自由基,在420nm处的吸光系数远大于底物ABTS,测定ABTS自由基的增加速率,可计算得漆酶活性。 试验中所需的仪器和试剂: 可见分光光度计/酶标仪、低温离心机、微量玻璃比色皿/96孔板、可调式移液枪、天平、研钵/匀浆器、冰和蒸馏水,水浴锅。 操作步骤: 一、粗酶液提取: (1)组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液),进行冰浴匀浆。10000g4℃离心10min,取上清,置冰上待测。 (2)细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL 提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后4℃,10000g离心10min,取上清置于冰上待测。 (3)培养液:直接检测。
二、测定步骤: 1、分光光度计/酶标仪预热30min以上,调节波长至420nm,分光光度计蒸馏水调零。 2、水浴锅温度调至45℃。 3、工作液的配制:一瓶试剂二用10mL试剂一溶解。现用现配。 4、操作表:在微量玻璃比色皿/96孔板中分别加入下列试剂: 样本名称测定管空白管 样本(μL)30 蒸馏水(μL)-30 工作液(μL)170170 在微量玻璃比色皿/96孔板中分别加入上述试剂,充分混匀后于420nm处测定10s时的吸光值A1,迅速置于45℃水浴3min(酶标仪有控温功能的可以将温度调至45℃),拿出迅 速擦干测定190s时的吸光值A2,计算△A测定管=A2测定-A1测定,△A空白管=A2空白-A1 空白,△A=△A测定管-△A空白管。空白管只需做一次。 三、漆酶活计算 1.按微量玻璃比色皿计算: (1)按蛋白浓度计算 酶活定义:每毫克蛋白每分钟氧化1nmol底物ABTS所需的酶量为一个酶活力单位。 漆酶酶活(U/mg prot)=△A÷(ε×d)×V反总×109÷(V样×Cpr)÷T=61.7×△A÷Cpr (2)按样本质量计算 酶活定义:每克样品每分钟氧化1nmol底物ABTS所需的酶量为一个酶活力单位。 漆酶酶活(U/g鲜重)=△A÷(ε×d)×V反总×109÷(V样×W÷V样总)÷T=61.7×△A÷W (3)按细胞数量计算 酶活定义:每104个细胞每分钟氧化1nmol底物ABTS所需的酶量为一个酶活力单位。 漆酶酶活(U/104cell)=△A÷(ε×d)×V反总×109÷(V样×500÷V样总)÷T=0.123×△A (4)按液体体积计算 酶活定义:每mL液体每分钟氧化1nmol底物ABTS所需的酶量为一个酶活力单位。
漆酶对环境污染物降解的研究
《环境生物技术》论文 ——漆酶对污染物降解的研究 漆酶对环境污染物降解的研究 摘要:漆酶是一种含铜多酚氧化酶,该酶是一种氨基酸残基在500个左右的单体酶,一般都为酸性蛋白,漆酶的应用集中在以下几方面:生物漂白,环境治理,漆酶降解有害物质,工业废水处理;其他方面的应用;等等。本文进行了漆酶对废水降解的初步研究,并对染料废水的降解机理和部分影响因素进行了一定的分析探讨。 关键词:漆酶、应用、降解机理、影响因素。 漆酶是一种含铜的多酚氧化酶,和植物中的抗坏血酸氧化酶、哺乳动物的血浆铜蓝蛋白属铜蓝氧化酶家族中的同一小族,在结构和功能上存在着许多相似之处。它最早是从日本漆树的汁液中发现的,后来也发现其存在于多种植物、昆虫和高等真菌中【1】。不同来源的漆酶具有不同的催化性质.即使是相同来源,比如同一白腐菌菌种,可分泌多种具有不同性质的漆酶组分,包括氧化能力,酶蛋白分子量,最适pH值、底物的专一性等等…,因此所起的作用是各不相同的。在漆酶降解木素方面已进行了较多较深入的研究,漆酶除了能氧化木质素以外,还被证明能催化多种底物,如酚类化合物及其衍生物、芳胺及其衍生物、羧酸及甾体激素等【2】。由于许多漆酶氧化的底物为环境污染物,因此利用白腐真菌产生的漆酶处理印染废水,降解染料化合物的研究在环境保护中具有十分重要的意义。应用漆酶来实现纸浆的生物漂白正是研究的一个热点【3】;另外,漆酶还具有降解氯化有机物去除环境中有毒污染物毒性的作用,本文就漆酶的这一性质做一介绍。
1 漆酶的催化机理 一般认为生物法降解主要有两种机理在起作用:吸附和降解,以降解为主。生物降解又分为两步:一是染料分子吸附到菌体上,部分透过细胞膜进入细胞体内;二是利用微生物产生的酶催化氧化还原染料分子,破坏不饱和共轭体系,达到去色的目的,中间产物进一步氧化还原分解并最终分解为C02和水或转化为所需的营养物质,组成新的原生质【4】。 根据对漆酶光谱学、动力学和晶体衍射的研究,漆酶催化底物的方式可能如下:底物结合于酶活性中心的I型铜原子位点,通过cys.His途径将其传递给三核位点,该位点进一步把电子传递给结合到活性中心的第二底物氧分子,使之还原为水。整个反应过程需要连续的单电子氧化作用来满足漆酶的充分还原,还原态的酶分子再通过四电子转移传递给分子氧,因此漆酶又被称为分子电池。在此过程中,氧还原很可能分两步进行,两个电子转移产生过氧化氢中间体,该中间体在另两单电子作用下被还原为水。 2 漆酶的主要用途 2. 1 环境治理 生物整治包括染料脱色、工业废水处理和土壤修复等领域。因漆酶对底物的专一性要求不高,含介体的酶催化系统能氧化大范围的化合物,所以在环境污染控制中有广泛的应用。由于合成染料广泛的用于印染工业,目前已超过10,000种。合成染料被人们设计成防水、抗光照、抗氧化的生物难降解化合物,以通常的活性污泥方法处理纺织废水很难达到预期目的,同时存在着花费高和污泥再处理的问题。而筛选的染料降解细菌,对降解的染料结构有高度的专一性,不适用于化学结构多样性的纺织废水处理【5】。 由于漆酶具有降解残余木素、氧化去除有毒氯酚化台物的作用.因此不少研究者尝试将漆酶用于处理含酚的工业废水。效果还是比较显著的。木材剥皮废水中含有有色的酚型化台物,使用漆酶处理该废水。通过催化氧化聚合反应,可去除90%以上的鞣酸类和其他酚型化台物,废水经硫酸铝絮凝后,色度下降82%;同样的混台废水经漆酶处理lh随后经硫酸铝絮凝,由色谱分析证实86%的氯代酚,99%的氯代愈疮木酚和80%的氯代香草醛,92%的氯代儿荣酚可被去除掉。漆酶还可以降低造纸厂漂白车间碱抽提段废水,漆酶经固定化后,可进一步提高漆酶处理废水脱色的有效性,每一单位酶活所降低的废水色度值.就白腐菌处理废水与漆酶处理废水的脱色效果比较而言,白腐菌处理3天可使废水脱色30%-50%,与漆酶处理几小时的脱色效果相近。但随着处理时间的延长,白腐菌总的废水脱色率达到70%一80%,比用漆酶处理的废水的脱色率高20%~30%,这可能是由于白腐菌处理时,分泌出的多种酶所起的协同作用。因此结合使用两种或多种酶可能提高处理废水的效果【6】。
真菌漆酶的研究进展
真菌漆酶的研究进展 宋瑞(安徽大学生命科学学院合肥230039) 【摘要】漆酶是一种蓝色多铜氧化酶,和植物中的抗坏血酸氧化酶,哺乳动物的血浆铜蓝蛋白属同族,能够催化多种有机底物和无机底物的氧化[1,2],同时伴随分子氧还原成水。漆酶广泛分布于真菌、高等植物、少量细菌和昆虫中,尤其在白腐真菌中普遍存在。漆酶特有的结构性质和作用机理使其具有巨大的应用价值。本文就真菌漆酶结构,功能的研究进展作一综述,并对其应用作简单介绍。 【关键词】真菌漆酶三维结构功能应用 1真菌漆酶结构特征 1.1 漆酶的组成 漆酶是一种糖蛋白,肽链一般约由500个氨基酸组成[3],糖基含量差异较大,占整个分子质量的10%—80%[4],据相关报道,漆酶的热稳定性可能与其糖基化有关。糖组成包括半乳糖、葡萄糖、甘露糖、岩藻糖、氨基己糖和阿拉伯糖等。Mayer[5]认为漆酶并不均一,它由多条5000~7000分子量的糖肽链基本结构单元组成。由于结构单元之间的缔合度不同,造成了各种漆酶分子量的不同。另外,分子中的糖基的差异,也会引起漆酶的分子量随来源不同会有很大的差异,从59—390ku不等。真菌漆酶约含19种氨基酸,绝大部分为单体酶,但也有例外,如双孢蘑菇和长绒毛栓菌漆酶由两个亚基组成[6],而柄孢壳漆酶I由四个亚基组成。漆酶种类繁多,不同种类的真菌产生的漆酶种类不同,即使同一种真菌在不同环境下也产生不同种漆酶。
1.2漆酶的晶体结构 由于漆酶是含糖蛋白质,且糖质量分数较高,一直以来很难获得X-衍射分析所用的单晶体,因此阻碍了关于漆酶结构的研究进展。1998年第一个漆酶晶体是Ducros V[7]制备的来自灰盖鬼伞(Coprinus cinereusv)T1Cu缺失型漆酶晶体,并分析了其结构。至今为止,Bacillus subtilis(CoA)[8];Melanocarpus albomyces(MaL)[9];Rigidoporus lignosus(RiL)[10];Pycnoporus cinnabaricus(PcL)[11];Coprinus cinereus(CcL)[12]和Trametes versicolor(TvL)[13]漆酶的三维结构已相继被报道。 漆酶分子整体由3个杯状结构域所组成,分别称作结构域A、B、C,每个结构域主要由β-折叠桶,α-螺旋,loop结构所组成。三者紧密结合形成球状结构。这是铜蓝蛋白家族所共有的结构形式[7,9]。分子当中含有二硫键,漆酶种类不同,二硫键数目也不一样,MaL 漆酶分子由3个二硫键,分别是位于结构域A Cys4~Cys12、结构域A和C界面上Cys114~Cys540、结构域C Cys298~Cys332,而CcL,RiL漆酶中则含有两个二硫键。在CcL漆酶分子中,由结构域A的Cys85和结构域B的Cys487形成一个二硫键,另一个二硫键存在于结构域A和结构域B(Cys117—Cys204)之间。一个伸展的loop(氨基酸284—327)连接结构域B和结构域C。Asn343上有N连接的N—乙酰葡萄胺。 1.3 漆酶的催化中心 真菌漆酶分子中一般都含有4个Cu原子,根据磁学和光谱学性
漆酶
漆酶性质及应用 漆酶(1accase)是一种含铜的多酚氧化酶,通常由500个氨基酸单一多肽组成,其中含有19种氨基酸,漆酶有一定的含糖量[1]。真菌漆酶是一种糖蛋白,由肽链、糖配基和Cu2+三个部分组成,分子量在60-390kDa之间[2]。肽链一般由500-550个氨基酸组成[3],糖配基有氨基己糖、葡萄糖、甘露糖、半乳糖、岩藻糖和阿拉伯糖,占整个分子重量的10%-80%。糖配基组成及含量的不同是漆酶分子量存在较大差异的主要原因。 漆酶一般含有4个铜离子(P. radiate漆酶除外,仅含2个铜离子,无3号铜离子)。根据其光谱特征,可划分为3种类型的铜: 1号铜(只有一个铜离子,顺磁性)具有典 型的蓝铜谱带:紫外可见光谱上600nm [ε: 5000 (mol·L-1cm)-1]处出现峰值,在EPR (电子顺磁共振)谱上有一个小的平行超精细耦合结构[A11:(4070) * 10-4cm-1],它参与分子内的电子传递,把电子从底物传递到其他铜原子上; 2号铜(只有一个铜离子,顺磁性)只具一般的EPR谱带(A11>140×10-4m-1); 3号铜由2个3号铜原子通过一个OH桥配位连接起来,组成双核铜区,具有抗磁性,因而在EPR上无谱带,紫外可见光谱上330nm处的肩峰是3号Cu2+的特征峰。漆酶空间结构更详细的资料来自其晶体衍射的研究。含四个铜原子的酶分子是常见的形式,而某些酶蛋白的辅基有例外的情况。Karhunen E[4]等的研究指出,phlebia radiata产生的漆酶中只含有2个铜原子,另外还有一分子的有机小分子辅基吡咯喹琳醌(pyrroloquinolin-equi-none, PQQ),该辅基在分子中扮演类似Ⅲ型铜原子的功能。 漆酶能够催化酚类、芳胺类、羧酸类、甾体类激素、生物色素、金属有机化合物和非酚类物质生成醌类化合物、羰基化合物和水,属于铜蓝氧化酶(或称为铜蓝蛋白酶)中的一小族,广泛存在于真菌、植物和昆虫中,有报道细菌也能产生漆酶I21。漆酶含有的铜离子,它们位于酶的活性位,在氧化反应中能够协同传递电子并将氧还原成水。目前, 研究最多的产漆酶微生物大多是白腐真菌, 主要有黄孢原毛平革菌、彩绒革盖菌、变色栓菌、射脉菌、凤尾菇等。 1883年Yoshida[5]最先从漆树液中发现了漆酶131,后来被Bertranc命名。我国最早研究漆酶的是刘国智、黄葆同等,他们于20世纪50年代末利用漆酶在催化反
真菌漆酶的研究进展及其应用前景_周雪婷
真菌漆酶的研究进展及其应用前景 周雪婷,张跃华* ,罗志文,潘亭如,缪天琳 (佳木斯大学,黑龙江佳木斯154007) 摘 要:漆酶生产菌株多为白腐真菌,常用的漆酶活性测定方法有分光光度法、ABTS 法、微量热法等,其降解工业“三废”中的有毒有害物质被认为是一种效率较高,成本较低的且最有前途的方法,其对环境保护的研究以逐渐成为国内外研究的热点,本文阐述漆酶的性质、活性中心、结构特点以及其在环境治理方面的应用。关键词:漆酶;结构;活性中心;环境修复 中图分类号:X592 文献标识码:A 基金项目:黑龙江省教育厅科学技术研究项目资助(项目编号:12521573) *为本文通讯作者 漆酶最早由Yoshi 从日本紫胶漆树(Rhus vernicifera )漆液 中发现。19世纪末,G .Betranel 首次将能够使生漆固化的活性物质进行分离,命名为“Laccuse ”,即漆酶。漆酶属蓝色多铜氧化酶家族[1,2],与抗坏血酸氧化酶和哺乳动物血浆中铜蛋白同源。人们将自然界中得到的漆酶分为漆树漆酶和真菌漆酶,其中真菌漆酶极具研究价值。漆酶在生物制浆、污水处理、防腐剂、杀虫剂等化工产品的降解效果显著,用于环境保护、环境监测等领域,在食品工业等方面也有应用[3],已逐渐成为自然科学的研究热点之一。漆酶催化氧化不同种类型的底物已达200余种,广泛用于食品、废水处理、造纸等领域。 国内外真菌漆酶研究主要是以担子菌、子囊菌、脉孢霉、柄孢壳菌和曲霉等真菌来研究漆酶的生物学活性,细菌和放线菌的研究较少,现已在细菌生脂固氮螺菌(Azospirillum lipofer -um )中发现了漆酶的存在。而高等担子菌中的研究对象包括白腐真菌、杂色云芝、平菇、变色栓菌,其中白腐真菌所产的漆酶为胞外酶,可作为主要的产酶者和研究对象。1 漆酶的性质1.1 理化性质 漆酶是一种含铜的多酚氧化酶,不同来源的漆酶铜含量也有所不同,多含有4个铜原子[4]。漆酶多为1条多肽链组成的单聚体,由500~550个氨基酸分子所组成,相对分子质量主要集中在50~80kD ,其碳水化合物约占15%~20%,等电点pI 为3~6,反应温度为30~60℃,pH 低的环境,漆酶的生物活性较高[5-7]。1.2 活性中心 漆酶催化中心根据其光谱性质,存在3种不同的功能:1.2.1 Ⅰ型铜 含铜的蓝色蛋白质,Ⅰ型铜与2个组氨酸和1个半胱氨酸配位,紫外可见光谱λ=600nm 时出现峰值,在EPR (电子顺磁共振)谱上有1个平行超精细耦合结构,Ⅰ型铜参与分子内的电子传递,将电子从底物传递到其它铜原子上。1.2.2 Ⅱ型铜 II 型铜与2个组氨酸和1个水分子配位,形成T 型几何结构,没有明显的可见吸收光谱,但有EPR (电子顺磁共振)信号。1.2.3 Ⅲ型铜 与漆酶的催化作用密切相关,经实验研究其为活性中心, 由2个铜原子通过1个-OH 桥配位连接起来组成四面扭曲的四方立体双核铜区结构,铜原子之间具有抗磁性,其距离是0.38n m 。在紫外可见光谱λ=330nm 处有最大吸收峰,在EPR 上无谱带[8~14];为了测定漆酶活性中心,将其经过抑制剂处理后,Ⅲ型铜在EPR 上出现有裂分峰,表明外源性配体与Ⅲ型铜发生了配位,1个Ⅱ型铜和2个Ⅲ型铜形成三核铜簇,双氧还原的反应位置在三核铜簇,此时Ⅲ型铜已结合5个配体,使其氧化性降低,限制了还原,同时也抑制O 进入三核中心区。 另有实验表明,将漆酶晶型结构被完全还原,Ⅰ和Ⅱ型铜的配位环境不变,Ⅲ型铜的-OH 桥配体则在反应中消耗,2个Ⅲ型铜之间距离亦增加[15]。1.3 检测方法 检测漆酶活性方法有分光光度法[16]、ABTS 法、微量热法、测O 2法、高效液相色谱法[17]、极谱法[18]等。AB TS 法测定漆酶,常用醋酸钠溶液作为缓冲溶液,反应体系内ABTS 的浓度为0.5mmol /L 。漆酶对不同种底物的亲和力也有显著地差异,但其对ABTS 的亲和力和催化能力普遍很高,测得的酶活性值也高,此方法反应条件不高,使用安全,常温下性质稳定,测定的OD 值相对稳定而准确[19]。微量热法测定漆酶的活性,利用LKB -2107Batch 型微量热系统,将其温度调至298K ,pH 调至7.4,此方法漆酶的提取物样品用量较少,可直接对酶的悬浮液进行测定,其对反应体系没有任何限制或干扰,适合研究酶促反应中的酶活。分光光度法测定漆酶酶活的基本原理是选定某种漆酶作用的底物,底物在漆酶催化作用下首先形成底物自由基,底物自由基浓度与吸光值成正相关,其在一定的光波波长下存在吸光系数的最大值,依据吸光值随时间变化的关系计算出酶活。分光光度法因其操作简单、快速、较准确、无需配备昂贵仪器设备等特点,得以在漆酶测定实验中广泛应用[20]。 2 漆酶的应用2.1 工业污水治理 真菌降解木质素目前主要集中于生物制浆方面。传统的氯法漂白,在去除纤维原料中木质素的过程中,仍有3%~12%的残留。在漂白废水中会产生大量有毒、有害物质,严重污染 农业与技术 第32卷 第9期 2012年9月 2 AG RIC ULTURE AND LTECHNOLOG Y
漆酶结构与催化机理
漆酶结构与催化机理 万云洋杜予民# (中国石油大学(北京)资源与信息学院北京 102249 #武汉大学资源与环境科学学院武汉 430079) 摘要本文阐述了漆酶的研究进展,对漆酶研究中的铜离子活性中心、三维结构和催化机理研究作重点阐述。 关键词漆酶金属酶三维结构三核中心催化机理 Structure and Catalytic Mechanism of Laccases Wan Yunyang, Du Yumin# (Faculty of Natural Resources and Information Technology, China University of Petroleum, Beijing, 102249; # College of Resource and Environmental Sciences, Wuhan University, Wuhan 430079) Abstract The progress on the research of laccases is reviewed the active centre of copper ions, the three-dimensional structure of protein, and catalytic mechanism are emphasized in this paper. Key words Rhus laccase, Metal enzyme, Three dimensional structure, Trinuclear centre, Catalytic mechanism 漆酶(EC1.10.3.2),(对)-二酚:双氧氧化还原酶,是多铜氧化酶中的一种含铜的糖蛋白氧化酶(表1),按照来源大致可以分为植物漆酶、微生物(包括真菌和细菌)漆酶和动物漆酶[1]。从首次在生漆液成份中发现这种酶成份(1883年)、漆酶(laccase)概念的提出(1898年)与沿用、真菌漆酶的发现、含铜蛋白质和铜活性中心地位的确立,到第一种工业微生物漆酶制剂的应用(1997年)[2],及对漆酶分离纯化[3,4]、晶体结构[5,6]等的研究,已有一百多年的历史,并一直经久不衰,几乎涉及到化学、分析、食品、医疗、生物和环保等各个领域,同时预计它在新兴的蛋白质组学对糖蛋白的研究中也会有一席之地。本文结合自身工作实践,对漆酶研究中的难点热点之一的铜离子中心和高级结构以及其多样化的应用研究作一综述,以期推动漆酶(尤其是植物漆酶)研究的深入发展。 表1 几种益多铜酶 Table 1. Several kinds of blue multicopper enzymes 铜酶作用原子数分子量主要来源 tyrosinase 底物氧化 4 116,000~128,000 植物真菌细菌 Laccase 底物氧化 4 101,000~140,000 50,000~90,000 植物 真菌 Ascorbate oxidase 底物氧化 8 ~140,000 植物 ceruloplasmin Fe2+氧化 8 ~151,000 动物 1漆酶的结构与功能 植物漆酶与其他来源的漆酶有共性也有区别(表1、表2),特别由于真菌漆酶研究的飞速发展,比较借鉴它们的相互特性,对植物漆酶、尤其是漆树漆酶的研究无疑是有益的。从目前的发展来看,由于漆树漆酶本身存在的一些问题,目前尚难以解决,所以漆树漆酶还须同真菌漆酶结合起来研究。比如从表2可见,在底物专一性、pH、p I和分子量上两者都有差异,但一些抑制剂对它们的作用却类似。从目前的研究来看,它们最大的共性可能是具有4个铜离子(但不是绝对)的活性中心相对保守的结构组成。而在氨基酸和糖成分组成上存在着较大的区别。这在下面的论述中也有提及,包括氨基酸,糖链及其组成和空 2006-09-27收稿,2007-04-09接受
