医疗器械类产品安规与EMC标准总结
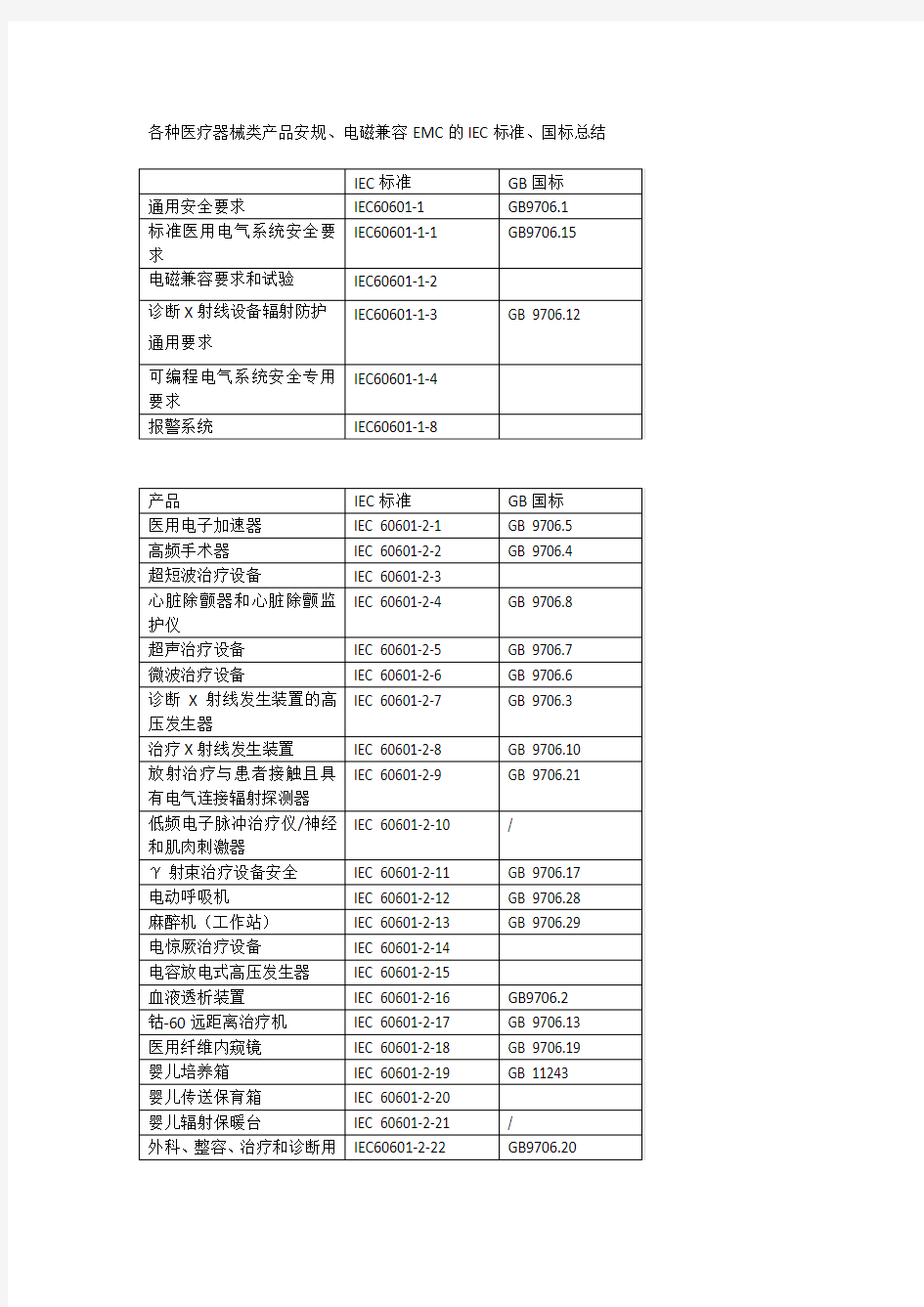

各种医疗器械类产品安规、电磁兼容EMC的IEC标准、国标总结
电磁兼容性EMC
安规要求安全距离知识讲解
安规要求安全距离
1.安規要求安全距離: 2. a.兩線式:一次側、二次側安全距離:5.5mm min.(為防誤差,預留6mm);加1.0mm破溝 則4.5mm min.(為防誤差,預留5mm) 3. b.三線式: 4.一次側、二次側安全距離: 5.5mm min.(為防誤差,預留6mm);加1.0mm破溝則 4.5mm min.(為防誤差,預留5mm) 5.一次側、FG安全距離:3.0mm min.(必須確定為FG,否則仍然要預留6mm;加1.0mm 破溝則5mm) 6. c.ACL、ACN安全距離:2.5mm min.(加1.0mm破溝則1.5mm min.) 7. d.一次側高壓安全距離:1.5mm min. 8. e.保險絲兩端銅箔安全距離:2.5mm min.(加1.0mm破溝則1.5mm min.) 9. 2.PWB製作,佈線最小距離: 10.a.銅箔與銅箔:0.5mm min. 11.b.銅箔與焊點:0.75mm min. 12.c.焊點與焊點:1.0mm min. 13.d.銅箔與板邊:0.25mm min. 14.e.孔邊與孔邊:1.0mm min. 15.f.孔邊與板邊:1.0mm min. 16.3.PWB製作,佈線最小銅箔寬度: 17.a.2oz:0.5mm min.;1oz:0.3mm min. 18.b.電流承受力:1A/1.0mm min.(加錫則可減少為0.5mm min.) 19. 20. 21.電氣要求: 22. 23.1.一次側電流路徑:電路順序;捷徑(越短越佳). 24.2.二次側電流路徑:電路順序;捷徑(越短越佳). 25.3.CY1佈線位置:一次側接近大電容負端;二次側接近變壓器地端. 26.4.回授點佈線位置:正回授端及負回授端接近輸出端. 27.5.符合雷擊測試要求: 28.a.符合L-N 1KV;L(N)-FG 2KV(V 1.2/50uS、I 8/20uS):加07D471 Varistor 29.b.符合L-N 6KV(500A):加07D471 Varistor、LF1加尖端放電、CY1加尖端放電 30.c.符合L-N 6KV(3000A):加07D471 Varistor於Fuse前、LF1加尖端放電再並聯雷擊 管(300V)*2 、CY1加尖端放電 31.IEC 60950 32.IEC 60950 33.空间/沿面距离 (Clearance/Creepage Distances,Clause 2.10, Tables 2H, 2J, 2K and 2L) 34. 35.空间直线距离以峰值电压,根据 Table 2H (primary)、2J (primary additional)、2K (secondary) 计算. 36.沿面爬行距离以RMS电压值,根据 Table 2L 计算,但不小于空间直线距离. 37.250 V 以下时,L 至 N、初级至地:creepage 2.5 mm,clearance 2.0 mm (整流前). 38.250 V 以下时初级至次级:creepage 5 mm,clearance 4 mm.
安规认证-电子产品安规标准
安规认证有以下测试项目: 1、高压测试: Dielectric Voltage withstand test高压测试为一种国际安规认证机构所要求的必测项目,产品须于出厂前座百分比的测试,它对产品而言,为品质的保证及电气安全性的指标,其测试方式是将一高于正常工作电压的异常电压加在产品上测试,并且这个电压须持续一段时间,最后判定只要无绝缘崩溃情形,即可算是通过此测试 2、绝缘阻抗测试 Insulation resistance test绝缘阻抗于相关的两点施加直流电压,最高可达1000伏特,通常使用单位为欧姆,可判定良品及不良品 3、接地阻抗测试 Ground bond test接地阻抗测试为测试产品的接地点,对产品的外壳或者金属部分,施加一个恒流电源来测试两点间的阻抗大小,一般产品规定测试25安培,阻抗不得大于0.1欧姆,而CSA则要求量测40安培检测,可检测出接地点螺丝未锁紧,接地线径太小,接地线路断路等问题 4、泄露电流测试 T ouch current test是指当设备供应电流时,流经设备金属可接触部分经人体至接地部分或可接触部分的电流。 5、输入测试: 安规输入测试目的是考察产品设计时考虑输入是否满足产品在正常工作时,输入电路是否能够承受产品工作时需要的电流。在产品标准里面规定是:最大功耗的输入电流不能大于产品标称值的110%。这个标称值也是告诉用户该产品安全工作需要的最小电流,让用户在使用这个设备前要准备这样的电气环境。 6、安全标识的稳定性测试: 对用户使用安全的警告标识,必须是稳定可靠的,不能因为使用一段时间后,变得模糊不清,而导致用户错误使用,而导致危险,或直接导致危险发生。所以需要测试这个稳定性。在安全标准里面规定是:用水测试15S,然后用汽油测试15S,标识不能模糊不清。 7、电容放电测试: 对一个电源线可以插拔的设备,其电源线经常会被拔出插座,拔出插座的电源插头,经
医疗器械标准大全
企业质量考核所需备案之各医疗器械标准 1.医用电气设备第一部分:安全通用要求-GB 9706.1-1995 2.医用电气设备第一部分:安全通用要求 1.并列标准:医用电气系统安全要求-GB 9706.15-1999 3.医用有机硅材料生物学评价试验方法-GB/T 16175-1996 4.医疗器械生物学评价第1部分:评价与试验-GB/T 16886.1-2001 5.编写和使用医用电气设备教材的导则-GB/Z 17994-1999 6.管理、医疗、护理人员安全使用医用电气设备导则-GB/T 17995-1999 7. 医疗保健产品灭菌生物指示物第1部分:通则-GB 18281.1-2000 8. 最终灭菌医疗器械的包装-GB/T 19633-2005 9. .医疗器械产品图样及设计文件的术语-YY/T 0047-91 10. 医疗器械产品工作图样的基本要求-YY/T 0048-91 1 1. 医疗器械产品图样及设计文件格式-YY/T 0049-91 12医疗器械产品图样及设计文件编号原则-YY/T 0050-91 13. 医疗器械产品图样及其主要设计文件的完整性-YY/T 0051-91 14. 医疗器械产品图样及设计文件的更改办法-YY/T 0052-91 15. 医疗仪器设备用产品铭牌-YY/T 0083-92 16. 质量体系医疗器械GB/T 19002-ISO 9002应用的专用要求-YY/T 0288-1996 17. 医疗器械风险管理对医疗器械的应用-YY/T 0316-2003 18. 医疗器械用于医疗器械标签、标记和提供信息的符号-YY 0466-2003 19. 医疗器械保障医疗器械安全和性能公认基本原则的标准选用指南-YY/T 0467-2003 20. 命名用于管理资料交流的医疗器械命名系统规范-YY/T 0468-2003
医疗器械注册产品标准(完整样本模板)
医疗器械注册专员培训 YZB 标准名称 (企业单位名称)发布
前言 XXX产品是我公司开发的新产品。目前该产品尚无国家标准、行业标准,为规范产品的技术特性,确保产品的安全有效,特制订本注册产品标准,做为生产质量控制的依据。 XXX产品注册产品标准引用了GB191《包装储运图示标志》,GBT14710《医用电气设备环境要求及试验方法》,GB9706.1《医用电气设备第一部分:安全通用要求》等标准中的内容。本标准的安全要求全面贯彻了GB9706.1—1995。并将其列入本标准附录A(规范性附录)。 本标准的附录A是规范性附录 本注册标准由天津市XXXXXXX公司提出并负责起草。 本注册标准主要起草人:XXX。 本注册标准首次发布于200X年XX月。 本注册标准由天津市XXXX(企业名称)法定代表人批准,并对所规定的内容负责。
标准名称 1 范围 本标准规定了XXX产品的结构和基本参数、要求、试验方法、检验规则、标志、包装、运输、贮存。 本标准适用于XXX产品(以下简称XX)。该产品供医疗单位_____( 用途 )___________________。 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB/T 191—2000 包装储运图示标本 GB 9706.1—1995 医用电器设备第一部分:安全通用要求 GB/T 14710—1993 医用电器设备环境要求及试验方法 3 结构和基本参数 3.1 结构:XXX产品由主机、控制部分、输出部分组成。
医疗器械标志、标签要求.doc
医疗器械标志、标签要求 医疗器械处黄荣建 二〇〇六年三月 一、范围 为医疗器械的安全和有效使用,给使 用者和其他人员规定了用于提供医疗器械 重要信息的标志、标识,主要由下列人员使 用。 ???? 医疗器械制造商 ???? 医疗器械使用者 ???? 负责医疗器械产品上市后监督的人员 ???? 主管部门、检测机构、认证机构等 二、依据 ???? 法律、法规 《医疗器械监督管理条例》 《医疗器械说明书、标签、包装标识》 ???? 国家标准、行业标准 通用标准 专用标准 产品标准 ???? 企业标准(注册产品标准) 标识、标签和使用说明书。 附录A安全要求中“外部标记”。(医用电气产 品) 通用标准 ?GB/T191-2000《包装储运图示标志》
?YY0466-2003《医疗器械用于医疗器械标签、标记和提供信息的符号》 ?YY/T0313-1998《医用高分子制品包装、标志、运输和贮存》?GB9706.1-1995《医用电气设备第一部分:安全通用要求》 ?YY91099-1999《医用X线设备标志、包装、运输和贮存》 专用标准 ?YY0089-1992《病人监护系统专用安全要求》 ?YY0319-2000《医用电气设备第二部分:医疗诊断用磁共振设备安全专用要求》 ?GB9706.X-XXXX《医用电气设备第X部分:XX设备安全专用要求》 ?YY0290.4-1997《人工晶体第4部分:标签和资料》 ?YY/T0486-2004《激光手术专用气管插管标志和提供信息的要求》 产品标准 ?GB8369-2005《一次性使用输血器》 ?GB10152《B型超声诊断设备》 ?YY0460-2003《超声洁牙设备》 医用高分子制品标志 ?单包装或初包装宜有下列标志: —产品名称、型号或规格; —制造厂名称、地址和商标; —生产批号或日期。 ?无菌产品的单包装或初包装还宜有下列标志:
药品、医疗器械产品注册收费标准
附件1 药品、医疗器械产品注册收费标准 一、药品注册费 国务院食品药品监督管理部门和省级食品药品监督管理部门依照法定职责,对新药临床试验申请、生产申请、仿制药申请、补充申请和再注册申请开展行政受理、现场检查/核查、技术审评等注册工作,并按标准收取有关费用。具体收费标准如下: 药品注册费标准 单位:万元 注:1.药品注册收费按一个原料药或一个制剂为一个品种计收,如再增加一种规格,则按相应类别增收20%注册费。 2.《药品注册管理办法》中属于省级食品药品监督管理部门备案或国务院食品药品监督管理部门直接备案的药品补充申请事项,不收取补充申请注册费,如此类申请经审核认为申请内容需要技术审评的,申请人应按照需要技术审评的补充申请的收费标准补交费用。 3.申请一次性进口药品的,收取药品注册费0.20万元。 4.进口药品注册收费标准在国内相应注册收费标准基础上加收国内外检查交通费、住宿费和伙食费等差额。 5.港、澳、台药品注册收费标准按进口药品注册收费标准执行。 6.药品注册加急费收费标准另行制定。 —3 —
二、医疗器械产品注册费 国务院食品药品监督管理部门和省级食品药品监督管理部门依照法定职责,对第二类、第三类医疗器械产品首次注册、变更注册、延续注册申请以及第三类高风险医疗器械临床试验申请开展行政受理、质量管理体系核查、技术审评等注册工作,并按标准收取有关费用。具体收费标准如下: 医疗器械产品注册费标准 单位:万元 注:1.医疗器械产品注册收费按《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》确定的注册单元计收。 2.《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》中属于备案的登记事项变更申请,不收取变更注册申请费。 3.进口医疗器械产品首次注册收费标准在境内相应注册收费标准基础上加收境内外 检查交通费、住宿费和伙食费等差额。 4. 港、澳、台医疗器械产品注册收费标准按进口医疗器械产品注册收费标准执行。 5.医疗器械产品注册加急费收费标准另行制定。 —4 —
安规定义
安规定义(一) 电气额定值(Equipment Electrical Ratings) ●额定电压(Rated Supply Voltage) ●额定电流(Rated Current Consumption) ●额定负载阻抗(Rated load Impedance)。 ●连接到主电源(Directly Connected to supply Mains) 以上参数由产品生产者设定。 产品移动性(Equipment Mobility) ●可移动式产品(Movable Equipment) 小于18公斤且非固定式产品, 或有轮子或小脚轮者。 ●手握式产品(Hand-Held Equipment) 有提把, 或正常使用时为手持者。 ●不可移动式产品(Stationary Equipment) 不为可移动式产品者。 ●固定(静立)式产品(Fixed Equipment) 不移动式产品, 且固定或锁于定位者。 ●置入式产品(Equipment for Building-in) 设计为置入预设凹槽或墙内, 通常并非每一面均有外壳。 ●直接插入式产品(Direct Plug-In Equipment) 无电源线, 电源插头直接置于外壳者。 产品型式(Equipment Class) ●1类设备Class I 接地型产品(电源插头为三插式<英规插头除外>)。 ●2类设备Class II 无接地型产品(电源插头为二插式, ●3类设备Class III SELV型产品(无primary component,
电源连接方式(Connection to the Supply) ●A型可插式(Pluggable Type A ) 以非工业用之插头(NEMA 1-15, 5-15, 6-15) 连接至墙壁插座之产品。 ●B型可插式(Pluggable Type B) 以工业用(IEC309)之插头连接至室内插座之产品。 ●永久连接式(Permanent Connected) 以接线端子台配线至室内电源之产品。 ●可分离式(Detachable Power Supply Cord) 电源线有接头, 可分离插取式。 ●不可分离式(Non-Detachable Power Supply Cord) 电源线直接固定至机台内, 不可分离插取式。 电子设备的安全试验 2006-02-07 16:48:27 安规与电磁兼容网来源:作者: 摘要:在实践的基础上,参照有关安全试验规范,归纳出电子设备安全试验的基本原则及其试验项目和试验要求。关键词:电子设备;安全试验;试验规范 引言 就电子设备的质量和可靠性而言,我们的设备在电磁兼容等方面取得了较全面、深入的进步;然而在安全试验和设计方面差距仍较大。只有先深刻理解了关于安全试验的标准与要求,才可能有针对性地做出设计和改进。 1 电子产品安规试验的一般原则要求 试验之前应理解如下一些原则要求。 1)产品安全测试前,应首先确认设备的移动性、设备对电击的保护类型、与电源连接的方式、以及污染的等级等; 2)列出所有经过认证或未经认证的安规元器件的清单,确定是否应作为设备的一个组成部分,承受规范规定的有关试验; 3)除另有说明外均为型式试验,应在一个样品上进行,该样品应承受全部有关试验; 4)如果设备的设计和结构已清楚地表明某一试验对设备不适用,则该试验就不应进行; 5)当元器件未由公认的试验机构认证,该元器件应作为设备的一个组成部分,承受本规范规定的有关试验;当元器件已由公认的试验机构认证,符合与有关的国家标准或IEC元器件标准相协调的某一标准时,不承受有关的国家标准或IEC元器件标准中规定的那部分试验; 6)跨接在危险电路和安全电路间的封闭和密封的零部件、及灌封零部件,应承受相应的温度循环试验和潮湿处理试验,然后再进行抗电强度试验,检验其是否能提供足够的绝缘; 7)MOS器件和IGBT器件的封装材料属于已认证的材料,不进行耐热、防火及抗电强度的试验。 2 电子产品安全试验项目与要求
医疗器械注册产品标准(完整样本模板)
精品文档 YZB 标准名称 (企业单位名称)发布
前言 XXX产品是我公司开发的新产品。目前该产品尚无国家标准、行业标准,为规范产品的技术特性,确保产品的安全有效,特制订本注册产品标准,做为生产质量控制的依据。 XXX产品注册产品标准引用了GB191《包装储运图示标志》,GBT14710《医用电气设备环境要求及试验方法》,GB9706.1《医用电气设备第一部分:安全通用要求》等标准中的内容。本标准的安全要求全面贯彻了GB9706.1—1995。并将其列入本标准附录A(规范性附录)。 本标准的附录A是规范性附录 本注册标准由天津市XXXXXXX公司提出并负责起草。 本注册标准主要起草人:XXX。 本注册标准首次发布于200X年XX月。 本注册标准由天津市XXXX(企业名称)法定代表人批准,并对所规定的内容负责。
标准名称 1 范围 本标准规定了XXX产品的结构和基本参数、要求、试验方法、检验规则、标志、包装、运输、贮存。 本标准适用于XXX产品(以下简称XX)。该产品供医疗单位_____( 用途)___________________。 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB/T 191—2000 包装储运图示标本 GB 9706.1—1995 医用电器设备第一部分:安全通用要求 GB/T 14710—1993 医用电器设备环境要求及试验方法 3 结构和基本参数 3.1 结构:XXX产品由主机、控制部分、输出部分组成。 3.2 XXX产品的型号为:XX-XX-XX XX-XX-XX (对符号的解释)设计序号(产品规格)(罗马字母) (对符号的解释)产品分类(英文字母) (对符号的解释)企业名称简称(以汉字拼音字头) 3.3 XXX产品的基本参数 3.3.1 3.3.2 4 要求 4.1 XXX产品的工作条件 a)温度:5℃—40℃ b)相对湿度:不大于80% c)电源电压:AC220V±22V d)频率:50Hz±1Hz 4.2 性能指标: 4.2.1 XXX产品工作时噪声不大于60dB(A) 4.2.2 牵引力设置范围: 4.2.3 牵引治疗时间: 4.2.4 预置指示力示值与实际作用力误差: 4.2.5 预置指示时间与实际有效时间误差不大于±5% 4.3 安全
电子产品结构设计指引
电子产品的结构设计过程 一个完整产品的结构设计过程 目录 一、ID造型 (2) 二、建摸阶段, (2) 三、初始造型阶段 (2) 四、建摸阶段第四步,位置检查,一般元件的摆放是有位置要求 (3) 五、谈一下自主设计方式,就是上面的A方案 (3) 六、举例说明 (3) 七、建模完成 (3) 八、一款收录机产品开发过程: (8) 九、设计开发补充 (8) 十、**厂的流程: (9)
一、ID造型 一个完整产品的设计过程,是从ID造型开始的,收到客户的原始资料(可以是草图,也可以是文字说明),ID即开始外形的设计;ID绘制满足客户要求的外形图方案,交客户确认,逐步修改直至客户认同;也有的公司是ID绘制几种草案,由客户选定一种,ID再在此草案基础上绘制外形图;外形图的类型,可以是2D 的工程图,含必要的投影视图;也可以是JPG彩图;不管是哪一种,一般需注名整体尺寸,至于表面工艺的要求则根据实际情况,尽量完整;外形图确定以后,接下来的工作就是结构设计工程师(以下简称MD)的了;顺便提一下,如果客户的创意比较完整,有的公司就不用ID直接用MD做外形图; 如果产品对内部结构有明确的要求,有的公司在ID绘制外形图同时MD就要参与进来协助外形的调整; MD开始启动,先是资料核对,ID给MD的资料可以是JPG彩图,MD将彩图导入PROE 后描线;ID给MD的资料还可以是IGES线画图,MD将IGES线画图导入PROE后描线,这种方法精度较高; 二、建摸阶段, 以我的工作方法为例,MD根据ID提供的资料,先绘制一个基本形状(我习惯用BASE 作为文件名);BASE就象大楼的基石,所有的表面元件都要以BASE的曲面作为参考依据;所以MD做3D的BASE和ID做的有所不同,ID侧重造型,不必理会拔模角度,而MD不但要在BASE里做出拔模角度,还要清楚各个零件的装配关系,建议结构部的同事之间做一下小范围的沟通,交换一下意见,以免走弯路; 具体做法是 1、先导入ID提供的文件,要尊重ID的设计意图,不能随意更改; 2、描线,PROE是参数化的设计工具,描线的目的在于方便测量和修改; 3、绘制曲面,曲面要和实体尽量一致,也是后续拆图的依据,可以的话尽量整合成封 4、闭曲面局部不顺畅的曲面还可以用曲面造型来修补; 5、BASE完成,请ID确认一下,这一步不要省略建摸阶段第二步,在BASE的基础上取面,拆画出各个零部件,拆分方式以ID的外形图为依据; 6、面/底壳,电池门只需做初步外形,里面掏完薄壳即可; 我做MP3,MP4的面/底壳壁厚取1.50mm,手机面/底壳壁厚取2.00mm,挂墙钟面/底壳壁厚取2.50mm,防水产品面/底壳壁厚可以取3.00mm; 另外面/底壳壁厚 4.00mm的医疗器械我也做过,是客人担心强度一再坚持的,其实3.00mm已经非常保险了,壁厚太厚很容易缩水,也容易产生内应力引起变形,担心强度不足完全可以通过在内部拉加强筋解决,效果远好过单一的增加壁厚; 建摸阶段第三步,制作装配图,将拆画出各个零部件按装配顺序分别引入,选择参考中心重合的对齐方式;放入电子方案,如LCD,LED,BATTERY,COB。将各个零部件引入装配图时,根据需要将有些零部件先做成一个组件,然后再把组件引入装配图时。 例如做翻盖手机时,总装配图里只有两个组件,上盖是一个组件,下盖是一个组件。上盖组件里面又分为A壳组件,B壳组件和LCD组件。下盖组件里面又分为C壳组件,D壳组件,主板组件和电池组件等。还可以再往下分 三、初始造型阶段 分三个方面: A:由造型工程师设计出产品的整体造型(ODM);可由客户选择方案或自主开发。 B: 客户提供设计资料,例如:IGS档(居多)或者是图片(OEM)。 C: 由原有的外形的基础上更改;可由客户选择方案或自主开发。
Ⅱ类申请医疗器械注册证申请流程
II类申请医疗器械注册证申请流程 一、非体外诊断医疗器械申请材料目录: 资料编号1、医疗器械注册申请表; 资料编号2、医疗器械生产企业资格证明; 资料编号 3 、产品技术报告; 资料编号 4 、安全风险分析报告; 资料编号5、适用的产品标准及说明;(应有检测机构签章) 资料编号6、产品性能自测报告; 资料编号7、有承检资质的医疗器械检测机构出具的产品注册检测报告;(原件) 资料编号8、医疗器械临床试验资料;(原件,具体提交方式见《注册管理办法》附件12) 资料编号9、医疗器械说明书; 资料编号10、产品生产质量体系考核(认证)的有效证明文件;(原件) 资料编号11 、所提交材料真实性的自我保证声明。 二、非体外诊断医疗器械申请材料要求: (一)申报资料的一般要求: 1、格式要求:(1)申请材料的同一项目的填写应一致;(2)申请材料应使用A4 规格纸张打印;(3)申请材料应清晰、整洁,每份申请材料均应装订并加盖企业公章,并按照申请材料目录的顺序装订成册;(4)在每项文件的第一页作一标签,或用带标签的隔页纸分隔,并标明项目编号;(5)用档案袋将报送的材料装好,档案袋需使用封面(格式见“档案袋封面格 式.doc”),在袋面标明生产企业名称、地址、产品名称、联系人及电话,并加注申请材料审核的医疗器械注册申请事务人员姓名(需亲笔签名),联系方式,如是医疗器械注册专员请提供姓名(需亲笔签名)、联系方式及备案凭证号。 2、医疗器械注册申请表、产品标准一式两份,其他资料各一份。(附件1?附件5另附, 无需与整套申请材料一起装订) 3、各项(上市批件、标准、检测报告、说明书)申报资料中的产品名称应与申请表中填写的产品名称实质性内容相对应。若有商品名,应标注商品名。申报资料应当使用中文,根据外文资料翻译的申报资料,应当同时提供原文。 4、申报资料受理后,企业不得自行补充申请,但属于《医疗器械注册管理办法》第三十八条规
电子产品的安全距离及其相关安全要求
电子产品的安全距离及其相关安全要求 所谓安全距离,就是为保护人在使用电子产品的时候,危险电压带电部分与人不能轻易接 触到,也不能让它来引起危险导致威胁人身安全。 必须在一般情况下,安全距离是在产品设计中最重要的部分之一。检查安全距离从设计阶段开始。结构检查人员会首先检查PCB板上的安全距离(最好拿空的PCB板用透明薄尺或游标卡尺来测量),之后,就是检查危险电压带电部分与其它部分(如外壳、安全电压部分等)距离等等。总之,一切关乎与安全的部分都要测量,特别重点会在电源部分。 具体参考各种安全标准: IEC60950\ IEC60065\UL60950\GB8898\GB4943等 以下引自其他文章: 安全距离包括电气间隙(空间距离),爬电距离(沿面距离)和绝缘穿透距离 1、电气间隙:两相邻导体或一个导体与相邻电机壳表面的沿空气测量的最短距离。 2、爬电距离:两相邻导体或一个导体与相邻电机壳表面的沿绝绝缘表面测量的最短距离。 电气间隙的决定: 根据测量的工作电压及绝缘等级,即可决定距离 一次侧线路之电气间隙尺寸要求,见表3及表4 二次侧线路之电气间隙尺寸要求见表5 但通常:一次侧交流部分:保险丝前L—N≥2.5mm,L.N PE(大地)≥2.5mm,保险丝 装置之后可不做要求,但尽可能保持一定距离以避免发生短路损坏电源。 一次侧交流对直流部分≥2.0mm 一次侧直流地对大地≥2.5mm (一次侧浮接地对大地) 一次侧部分对二次侧部分≥4.0mm,跨接于一二次侧之间之元器件 二次侧部分之电隙间隙≥0.5mm即可 二次侧地对大地≥1.0mm即可 附注:决定是否符合要求前,内部零件应先施于10N力,外壳施以30N力,以减少其距离,使确认为最糟情况下,空间距离仍符合规定。 爬电距离的决定: 根据工作电压及绝缘等级,查表6可决定其爬电距离 但通常:一次侧交流部分:保险丝前L—N≥2.5mm,L.N---大地 ≥2.5mm,保险丝 之后可不做要求,但尽量保持一定距离以避免短路损坏电源。 一次侧交流对直流部分≥2.0mm 一次侧直流地对地≥4.0mm如一次侧地对大地 一次侧对二次侧≥6.4mm,如光耦、Y电容等元器零件脚间距≤6.4mm要开槽。 二次侧部分之间≥0.5mm即可 二次侧地对大地≥2.0mm以上 变压器两级间≥8.0mm以上 3、绝缘穿透距离: 应根据工作电压和绝缘应用场合符合下列规定: ——对工作电压不超过50V(71V交流峰值或直流值),无厚度要求; ——附加绝缘最小厚度应为0.4mm; ——当加强绝缘不承受在正常温度下可能会导致该绝缘材料变形或性能降低的任何机械应
中国医疗器械产品标准
YZB 医疗器械注册产品标准 YZB/苏(常)XXXX-200X 标准名称 标准英文名称(进口产品) 200X-XX-XX 发布200X-XX-XX 实施 X X X X (企业)发布
前言 XXX(产品名称)目前尚无国家标准和行业标准,根据《医疗器械标准管理办法》,特制定本标准,作为企业生产、监督的依据。 本标准的编写符合GB/T1.1-2000、GB/T1.2-2002和《医疗器械注册产品标准编写规范》的有关要求。 本标准的附录X是规范性附录; 本标准的附录X是资料性附录。 本标准由XXXXXXXXX(企业名称)提出。 本标准由XXXXXXXXX(企业名称)负责起草。 本标准主要起草人:XXX、XXX。 本标准首次发布时间:200X年X月。
XXXXXXXXX(标准名称) 1 范围 本标准规定了XXXXX的分类和标识、要求、试验方法、标志、使用说明书、包装、运输、储存的要求。 本标准适用于XXXXX(以下简称XXX)。该产品用于XXXXXXXXXXXXXXXXXXXXXXXX。 2 规范性引用文件 下列文件中的条款通过本标准的引用而成为本标准的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB XXXX-XXXX XXXXXXX YY XXXX-XXXX XXXXXXX ISO XXXXX-X:XXXXX XXXXX 3 分类和标记 3.1 分类 (产品的组成、结构、型式,结构、型式可用图表示、规格尺寸可列表表示) 3.2 标记 (为符合标准要求的产品(系列)建立一个分类、型号、产品代码) 4 要求 4.1外观 4.2尺寸 4.3 物理(或机械)性能 如强度、硬度、弹性、耐热性、耐磨性等。 4.4 使用性能 4.5 化学性能 如还原物质(易氧化物)、金属离子、酸碱度、蒸发残渣、紫外吸光度、环氧乙烷残留量等。 4.6 生物性能 如无菌、热原、溶血、刺激、致敏等(按GB/T16886.1) 4.7 安全性能 GB 9706医用电气设备通用安全要求系列标准; GB/T16886医疗器械生物学评价系列标准; YY/T口腔材料生物学评价系列标准; 及其他安全要求。 4.8 其他方面的要求 5 试验方法 5.1 外观 5.2 尺寸
二类医疗器械注册所需资料及详细步骤
二类医疗器械注册所需资料及详细步骤 所需资料: 1、医疗器械注册申请表 2、医疗器械生产企业资格证明 3、产品技术报告 4、安全风险分析报告 5、适用的产品标准及说明 6、产品性能自测报告 7、有承检资质的医疗器械检测机构出具的产品注册检测 报告 8、医疗器械临床试验资料 9、医疗器械说明书 10、产品生产质量体系考核(认证)的有效证明文件 11、所提交材料真实性的自我保证声明 注册步骤: a)产品技术报告(产品名称、产品型号/规格及其划分说明; 性能指标:能客观判定的成品的功能性、安全性指标及质量控制相关指标,符合国家标准/行业标准,但不包括产品设计开发的评价性内容;检验方法:具有可重现性和可操作性。) b)注册检测(要求检测公司具有相应的检测资质,我方提供
技术相关资料、注册检验的样品及产品技术;检测公测出检测报告和预评价报告) c)临床试验(临床试验;临床试验合同或协议、临床试验方 案、临床试验报告) d)产品生产质量体系考核(认证)的有效证明文件 e)安全风险分析报告、产品性能自测报告…….. 备注: 医疗器械注册申请表(包括电子版和纸质版,已有表格)、医疗器械生产企业资格证明(生产许可证和营业执照)、 安全风险分析报告(包括能量危害、生物学危害、环境危害、有关使用的危害和由功能失效、维护不周及老化引起的危害等方面的风险分析、风险控制与防范措施等,有相应的表格)、适用的产品标准及说明(产品的标准可为国家标准、行业标准或注册产品标准文本;采用国家和行业标准的,要提交所采纳的国家标准或行业标准的有效文本及采标说明,采用注册产品标准作为产品标准的,提交注册产品标准正式文本及其编制说明) 产品性能自测报告(产品标准中要求的出厂检测,包括产品名称、规格型号、产品编号或批号、生产日期、样品数量、抽样基数;检测依据、检测项目、标准要求、检测结果、结果判定、检验人员、审核人员及盖章、检验日期等;如属于
医疗器械软件产品注册标准模板
目次 目次 (1) 前言 (4) 1.范围 (4) 2.规范性引用文件 (4) 3.分类 (4) 3.1术语与定义................................................................................................................ 错误!未定义书签。 3.2管理分类 (4) 3.3命名与型号 (4) 3.4组成 (4) 4.要求 (4) 4.1产品说明要求 (4) 4.1.1可用性 (4) 4.1.2内容 (4) 4.1.3标识和标示 (5) 4.1.4功能性陈述 (6) 4.1.4.1功能概述 (6) 4.1.4.1.1远程会诊系统 (6) 4.1.4.1.2双向转诊系统............................................................................................ 错误!未定义书签。 4.1.4.1.3计费系统.................................................................................................... 错误!未定义书签。 4.1.4.1.4医疗资源共享系统.................................................................................... 错误!未定义书签。 4.1.4.1.5管理系统.................................................................................................... 错误!未定义书签。 4.1.4.2 产品的功能........................................................................................................... 错误!未定义书签。 4.1.4.3当有软件组件的选项和版本时,应指明。 (6) 4.1.4.4功能性限制 .................................................................................................... 错误!未定义书签。 4.1.4.5对未授权访问的预防措施 (6) 4.1.5可靠性陈述 (6) 4.1.6易用性陈述 (6) 4.1.7效率陈述 (7) 4.1.8维护性陈述 (7) 4.1.9可移植性陈述 (7) 4.2用户文档集要求 (7) 4.2.1完备性 (7) 4.2.2正确性 (8) 4.2.3一致性 (8) 4.2.4易理解性 (8)
电子产品的安全距离及其相关安全要求
电子产品的安全距离及其相关安全要求 LG GROUP system office room 【LGA16H-LGYY-LGUA8Q8-LGA162】
话题:电子产品的安全距离及其相关安全要求 所谓安全距离,就是为保护人在使用电子产品的时候,危险电压带电部分与人不能轻易接触到,也不能让它来引起危险导致威胁人身安全。 因此必须在一般情况下,安全距离是在产品设计中最重要的部分之一。检查安全距离从设计阶段开始。结构检查人员会首先检查PCB板上的安全距离(最好拿空的PCB板用透明薄尺或游标卡尺来测量),之后,就是检查危险电压带电部分与其它部分(如外壳、安全电压部分等)距离等等。总之,一切关乎与安全的部分都要测量,特别重点会在电源部分。 具体参考各种安全标准: IEC60950\ IEC60065\UL60950\GB8898\GB4943等 以下引自其他文章: 安全距离包括电气间隙(空间距离),爬电距离(沿面距离)和绝缘穿透距离 1、电气间隙:两相邻导体或一个导体与相邻电机壳表面的沿空气测量的最短距离。 2、爬电距离:两相邻导体或一个导体与相邻电机壳表面的沿绝绝缘表面测量的最短距离。 电气间隙的决定: 根据测量的工作电压及绝缘等级,即可决定距离 一次侧线路之电气间隙尺寸要求,见表3及表4 二次侧线路之电气间隙尺寸要求见表5 但通常:一次侧交流部分:保险丝前L—N≥, PE(大地)≥,保险丝 装置之后可不做要求,但尽可能保持一定距离以避免发生短路损坏电源。 一次侧交流对直流部分≥ 一次侧直流地对大地≥ (一次侧浮接地对大地) 一次侧部分对二次侧部分≥,跨接于一二次侧之间之元器件 二次侧部分之电隙间隙≥即可 二次侧地对大地≥即可 附注:决定是否符合要求前,内部零件应先施于10N力,外壳施以30N力,以减少其距离,使确认为最糟情况下,空间距离仍符合规定。 爬电距离的决定: 根据工作电压及绝缘等级,查表6可决定其爬电距离 但通常:(1)、一次侧交流部分:保险丝前L—N≥,大地≥,保险丝 之后可不做要求,但尽量保持一定距离以避免短路损坏电源。 ( 2)、一次侧交流对直流部分≥ ( 3)、一次侧直流地对地≥如一次侧地对大地 ( 4)、一次侧对二次侧≥,如光耦、Y电容等元器零件脚间距≤要开 槽。 ( 5)、二次侧部分之间≥即可
医疗器械产品标准
YZB 医疗器械注册产品标准 病床 2011-03-11发布2011-03-11实施 杭州临安庄盛工贸有限公司发布
前言 为确保“饮料”系列产品出厂成品质量,维护消费者权益,同时达到加强管理、降低成本、提高经济效益目的,本着“有标可依”原则,于2004年12月18日发布了河北公司企业标准Q/《饮料》,现决定从2005年1月28日起执行。 本标准由河北公司提出。 本标准由技术部起草并负责解释。 本标准由河北公司技术部发布。 本标准修改权属 本标准起草人:
饮料 1.范围 本标准规定了饮料的产品分类、技术要求、试验方法、检验规则和标志、包装、运输、贮存等要求。 本标准适用以为原料,添加或不添加食品添加剂与辅料,经,而制成的饮料。 2.规范性引用文件 下列文件中的条款,通过本标准的引用而成为本标准的条款。凡是注目期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本标准。 GB1354-86大米 GB2760食品添加剂使用卫生标准 GB/T5009.5食品中蛋白质的测定方法 GB/T5009.7食品中还原糖的测定方法 GB/T5009.8食品中蔗糖的测定方法 GB/T5009.46乳与乳制品卫生标准的分析方法 GB7718食品标签通用标准 GB/T10790软饮料的检验规则、标志、包装、运输、贮存 GB4789.2食品卫生微生物学检验菌落总数测定 GB4789.3食品卫生微生物学检验大肠菌群测定 GB4789.4食品卫生微生物学检验沙门氏菌检验 GB4789.5食品卫生微生物学检验志贺氏菌检验 GB4789.10食品卫生微生物学检验金黄色葡萄球菌检验 GB4789.11食品卫生微生物学检验溶血性链球菌检验 GB4789.18食品卫生微生物学检验乳与乳制品检验 GB/T5009.11食品中总砷的测定方法 GB/T5009.12食品中总铅的测定方法 GB/T5009.17食品中总汞的测定方法 GB/T5009.19食品中六六六、滴滴涕残留量的测定方法 GB/T5009.24食品中黄曲霉毒素M1和B1的测定方法 GB/T4789.34食品卫生微生物学检验双歧杆菌检验
医疗器械软件产品注册标准模板
目次 目次..................................................................... 错误!未定义书签。前言............................................................... 错误!未定义书签。 1.范围............................................................... 错误!未定义书签。 2.规范性引用文件..................................................... 错误!未定义书签。 3.分类............................................................... 错误!未定义书签。 术语与定义........................................................ 错误!未定义书签。 管理分类.......................................................... 错误!未定义书签。 命名与型号........................................................ 错误!未定义书签。 组成.............................................................. 错误!未定义书签。 4.要求............................................................... 错误!未定义书签。 产品说明要求...................................................... 错误!未定义书签。 可用性.......................................................... 错误!未定义书签。 内容............................................................ 错误!未定义书签。 标识和标示...................................................... 错误!未定义书签。 功能性陈述...................................................... 错误!未定义书签。 功能概述 .................................................... 错误!未定义书签。 远程会诊系统.............................................. 错误!未定义书签。 双向转诊系统.............................................. 错误!未定义书签。 计费系统.................................................. 错误!未定义书签。 医疗资源共享系统.......................................... 错误!未定义书签。 管理系统.................................................. 错误!未定义书签。 产品的功能........................................................ 错误!未定义书签。 当有软件组件的选项和版本时,应指明。........................ 错误!未定义书签。 功能性限制 .................................................. 错误!未定义书签。 对未授权访问的预防措施...................................... 错误!未定义书签。 可靠性陈述...................................................... 错误!未定义书签。 易用性陈述...................................................... 错误!未定义书签。 效率陈述........................................................ 错误!未定义书签。 维护性陈述...................................................... 错误!未定义书签。 可移植性陈述.................................................... 错误!未定义书签。 用户文档集要求.................................................... 错误!未定义书签。 完备性.......................................................... 错误!未定义书签。 正确性.......................................................... 错误!未定义书签。 一致性.......................................................... 错误!未定义书签。 易理解性........................................................ 错误!未定义书签。
