酚酞在不同pH值溶液中的颜色
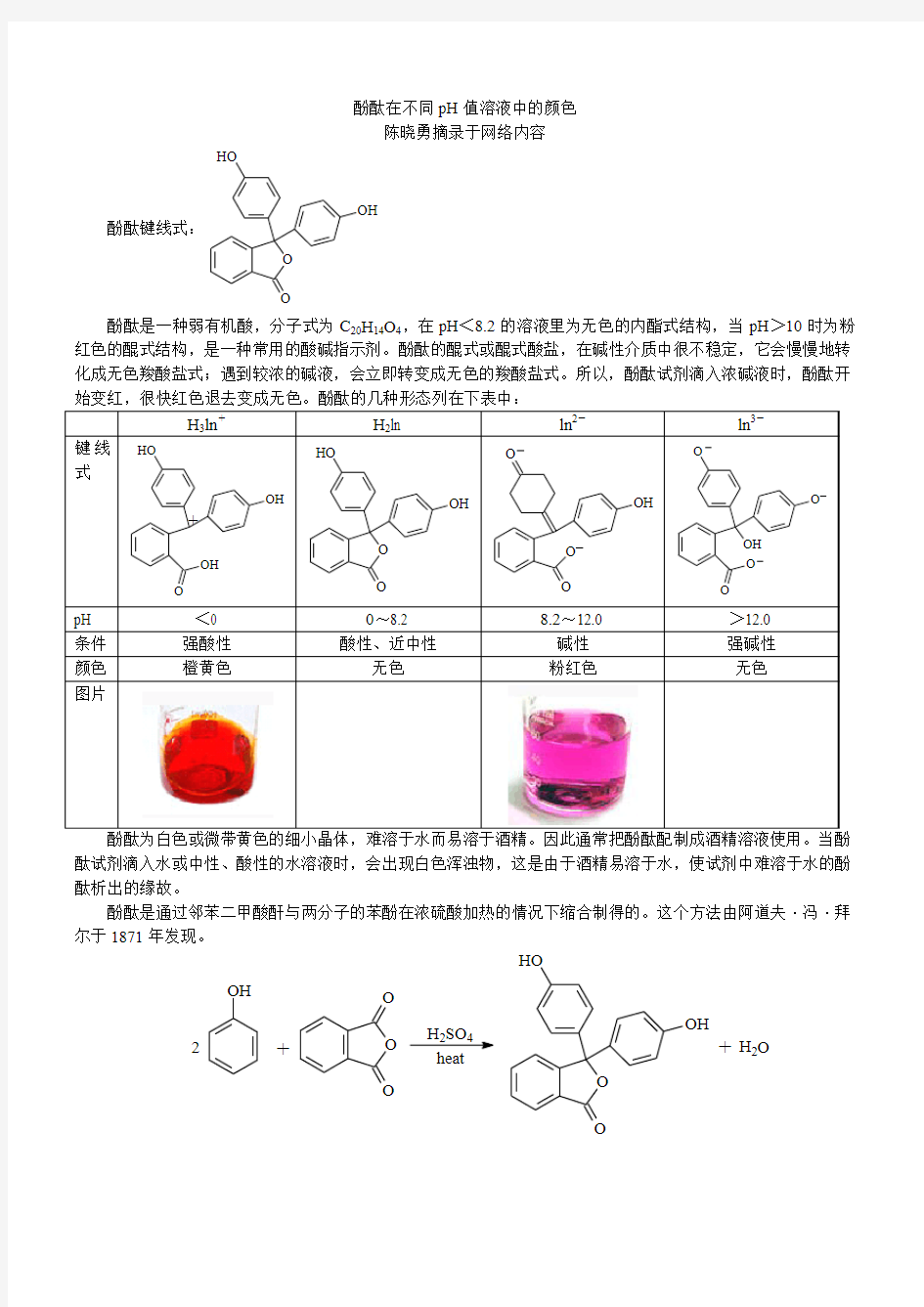
酚酞在不同pH 值溶液中的颜色
陈晓勇摘录于网络内容
酚酞键线式:
O O
HO
OH
酚酞是一种弱有机酸,分子式为C 20H 14O 4,在pH <8.2的溶液里为无色的内酯式结构,当pH >10时为粉红色的醌式结构,是一种常用的酸碱指示剂。酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液,会立即转变成无色的羧酸盐式。所以,酚酞试剂滴入浓碱液时,酚酞开
酚酞为白色或微带黄色的细小晶体,难溶于水而易溶于酒精。因此通常把酚酞配制成酒精溶液使用。当酚酞试剂滴入水或中性、酸性的水溶液时,会出现白色浑浊物,这是由于酒精易溶于水,使试剂中难溶于水的酚酞析出的缘故。
酚酞是通过邻苯二甲酸酐与两分子的苯酚在浓硫酸加热的情况下缩合制得的。这个方法由阿道夫·冯·拜尔于1871年发现。
O O
HO
OH
OH O O O
+
2
H 2SO 4+H 2O
人教版高中化学溶液pH的计算
人教版高中化学溶液 p H的计算 集团公司文件内部编码:(TTT-UUTT-MMYB-URTTY-ITTLTY-
溶液pH的计算 一、强酸(碱)与弱碱(酸)等体积混合后,溶液的酸碱性 pH之和为14,谁弱显谁性;两者等浓度,谁强显谁性。 即室温下,pH之和为14的酸与碱等体积混合反应后,溶液的酸碱性由弱的一方决定;等浓度的同元酸与碱等体积混合反应后,溶液的酸碱性由强的一方决定。 二、溶液pH的计算 酸按酸,碱按碱,酸碱中和求过量,无限稀释7为限。 若溶液显酸性,用溶液中的c(H+)来计算; 若溶液显碱性,先求溶液中的c(OH-),再由c(H+)= ) 0(- H C K w求出c(H+),最后用pH=-lgc(H+),求出pH 三、酸碱中和反应pH的计算 将强酸、强碱溶液以某体积之比混合,若混合液呈中性,则c(H+) 酸:c(OH-) 碱 、V 酸 :V 碱、 pH 酸+pH 碱 有如下规律(25℃): 因c(H+) 酸×V 酸 =c(OH-) 碱 ×V 碱 ,故有 酸 碱 酸 V V ) c(OH ) c(H碱 - = + 。在碱溶液中c(OH-) 碱= 碱 ) c(H 1014 + - , 将其代入上 式得c(H+) 酸×c(H+) 碱 = 酸 碱 V V 1014? - ,两边取负对数得pH 酸 +pH 碱 =14-lg 酸 V V碱。例如: 四、单一溶液的pH计算 1、强酸溶液如H n A溶液,设浓度为cmol/L,c(H+)=ncmol/L,pH=-lgc(H+)=-lg(nc) 2、强碱溶液如B(OH) n 溶液,设浓度为cmol/L,c(H+)= nc 14 10-mol/L,pH=- lgc(H+)=14+lg(nc)
各种PH值的磷酸盐缓冲液配制
各种PH值的磷酸盐缓冲液配制 2011-07-12 18:34:35 来源:生物秀知道浏览次数:1196 网友评论0 条 磷酸盐缓冲液 取磷酸二氢钠38.0g,与磷酸氢二钠5.04g,加水使成1000ml,即得。 磷酸盐缓冲液(pH2.0) 甲液:取磷酸16.6ml,加水至1000ml,摇匀。乙液:取磷酸氢二钠71.63g,加水使溶解成1000ml。取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。 磷酸盐缓冲液(pH2.5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至2.5,用水稀释至1000ml。 磷酸盐缓冲液(pH5.0) 取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液调节pH值至5.0,即得。 磷酸盐缓冲液(pH5.8) 取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解成1000ml,即得。 磷酸盐缓冲液(pH6.5) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH6.6) 取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g,加水使溶解成400ml,即得。 磷酸盐缓冲液(含胰酶)(pH6.8) 取磷酸二氢钾6.8g,加水500ml使溶解,用0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。 磷酸盐缓冲液(pH6.8) 取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化钠溶液118ml,用水稀释至1000ml,摇匀,即得。
pH标准溶液(pH6.86525) 分别称取先在110~130干燥2~3h的磷酸二氢钾(KH2PO4)3.388g和磷酸氢二钠(Na2HPO4)3.533g溶于水并在容量瓶中稀释至1L 磷酸盐缓冲液(pH7.0) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH7.2) 取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。磷酸盐缓冲液(pH7.3) 取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶解成1000ml,调节pH值至7.3,即得。 磷酸盐缓冲液(pH7.4) 取磷酸二氢钾1.36g,加0.1mol/L氢氧化钠溶液79ml,用水稀释至200ml,即得。 磷酸盐缓冲液(pH7.6) 取磷酸二氢钾27.22g,加水使溶解成1000ml,取50ml,加0.2mol/L氢氧化钠溶液42.4ml,再加水稀释至200ml,即得。 磷酸盐缓冲液(pH7.8) 甲液:取磷酸氢二钠35.9g,加水溶解,并稀释至500ml。 乙液:取磷酸二氢钠2.76g,加水溶解,并稀释至100ml。取上述甲液91.5ml与乙液8.5ml混合,摇匀,即得。 磷酸盐缓冲液(pH7.8~8.0) 取磷酸氢二钾5.59g与磷酸二氢钾0.41g,加水使溶解成1000ml,即得。 pH标准溶液(pH9.18025) 为了使晶体具有一定的组成应称取与饱和溴化钠(或氯化钠加蔗糖)溶液(室温)共同放置在干燥器中平衡两昼夜的硼砂3.80g溶于水并在容量瓶中稀释至lL。磷酸氢二钠应该用PH基准级的,是无水的.现在有卖现成的PH基准级混合磷酸盐
ph计标准溶液配制
中国PH计校正溶液配置的标准方法 一、引言:根据目前市场的应用情况看来,中国即我国国内使用的PH计校正的缓冲溶液有三种,即标称pH4 ,pH7 和pH9的三种缓冲溶液,分别学名为如下,笔者根据多项资料整理可得,为的是您能方便快速弄明白这些问题,详情: 1)pH4:邻苯二甲酸氢钾溶液; 2)pH7:磷酸二氢钾和磷酸氢二钠混合盐溶液; 3)pH9:硼砂溶液; 接下来介绍以上3种溶液的主要配置简单方法。 二、PH计校正溶液配置的标准方法 1)pH4,邻苯二甲酸氢钾标准缓冲液: 精密称取在115±5℃干燥2~3小时的邻苯二甲酸氢钾[KHC8H4O4],加水使溶解并稀释至1000ml。 2)pH7,磷酸盐标准缓冲液: 精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠与磷酸二氢钾,加水使溶解并稀释至1000ml。 另补充:磷酸盐标准缓冲液精密称取在115±5℃干燥2~3小时的无水磷酸氢二钠与磷酸二氢钾,加水使溶解并稀释至1000ml。 3)pH9,硼砂标准缓冲液: 精密称取硼砂[Na2B4O7·10H2O](注意:避免风化),加水使溶解并稀释至1000ml,置聚乙烯塑料瓶中,密塞,避免与空气中二氧化碳接触。 总结:从现在使用PH计来看,中国境内即国产的PH计或者是酸度计,它的校正缓冲液拥有的情况有两种: 1)即标准溶液是可以在市场上买到的,一般是在聚乙烯瓶中密闭保存的。在室温条件下标准溶液一般以保存1~2个月为宜,当发现有浑浊、发霉或沉淀现象时,不能继续使用。在4℃冰箱内存放,且用过的标准溶液不允许再倒回。 2)还可以自己买缓冲剂回去配置得。但一般厂家发货时,由于国家规定发货时有的不准有液体或药物存在,所以只能是带有的是干燥的PH缓冲剂,客户使用时需要自己配置,只
溶液pH计算方法
第三讲 有关pH 的计算方法 根据pH =-lgc(H +),因此计算溶液的pH 的实质是计算溶液中H + 的浓度。 一、单一溶液pH 的计算 1.强酸溶液的pH 计算方法是:根据酸的浓度先求出强酸溶液中的c(H +),然后对其取负对数,就可求 得pH 。 2.强碱溶液的pH 计算方法是:根据碱的浓度先求出强碱溶液中的c(OH -),然后利用该温度下的Kw 求 出c(H +),然后求pH 。 3.其它溶液的pH 计算方法是:想办法求出溶液中的c(H +)然后取负对数 二、稀释型(指单一溶质加水稀释或相当于水的稀释作用) 实质:稀释前后酸或碱的物质的量不变。一般计算公式:C 1V 1=C 2V 2,据此求出稀释后酸或碱的物质 的量的浓度。 特殊结论: ⒈若为酸:强酸,PH =a,稀释10n 倍,PH =a+n ;若为弱酸,PH =a,稀释10n 倍,a < PH <a+n ; 若酸的溶液无限稀释,则无论酸的强弱,PH 一律接近于7 ⒉若为碱:强碱,PH =a,稀释10n 倍, PH =a -n ;弱碱,PH =a,稀释10n 倍, a -n. < PH <a ; 若碱的溶液无限稀释,则无论碱的强弱,PH 一律接近于7。 三、混合型(多种溶液混合) (1)强酸混合后溶液的pH 求算的方法是:先求出混合后的c(H+)混, 即:()()()121212c H V c H V c H V V +++ +混+=,再根据公式pH=-lgc(H +)求pH 。 (2)强碱混合后溶液的pH 求算的方法是:先求出混合后的c(OH -)混 即:()()()121212c OH V c OH V c OH V V ---+混+=,再通过KW求出c(H +),最后求pH 。 (3)强酸和强碱溶液混合 这里的混合,实为中和,要发生反应:H ++OH -=H 2O,中和后溶液的pH 有三种情况: ①若恰好中和,pH =7 ②若酸有剩,根据中和后剩余的c(H +),即()()1212 12 c H V c OH V c(H )V V +-+=+(过)-,再求pH 。 ③若碱有剩,根据中和后剩余的c(OH -),即()()1212()12c OH V c H V c(OH )V V -+-= +过-,然后通过KW求出 c(H +),最后求pH 。 【课后练习】 1. 下列各种溶液中,可能大量共存的离子组是( ) A. pH=0的溶液中:Fe 2+、NO 3-、SO 42-、I -
溶液PH的计算方法.
溶 液 PH 的 计 算 方 法 内蒙古赤峰市松山区当铺地中学024045白广福 众所周知,溶液的酸碱度可用c(H +)或c(OH -)表示,但当我们遇到较稀的溶液时,这时再用 C(H +)或C(OH -)表示是很不方便的,为此丹麦化学家索伦森提出了PH 。它的定义为氢离子浓 度的负常用对数.PH=-lgc(H +)。在高中阶段,以水的电离和溶液PH 计算为考查内容的试题 能有效的测试考生的判断、推理、运算等思维能力;在近几年的高考试题中也是屡见不鲜。 下面介绍几种关于溶液PH 的计算方法。 1、单一溶液PH 的计算 (1)强酸溶液:如H n A,设物质的量浓度为cmoL/L,则c(H +)=ncmoL/L, PH=-lgc(H +)= - lgnc 例1、求0.1 mo1/L 盐酸溶液的pH ? 解析:盐酸是强酸,所以 0.1moL/L 盐酸的c(H +)为0.1moL/L ,带入PH=-lgc(H +)即得PH=1 (2)强碱溶液,如B(OH)n,设溶液物质的量浓度为cmoL/L,则c(H +)=14 10nc -moL/L,PH=-lgc(H +)=14+lgnc 2、两两混合溶液的PH 计算 (1)强酸与强酸混合 由C(H + )混=112212()()c H V c H V V V ++++先求出混合后的C(H +)混,再根据公式求出PH. 技巧一:若两强酸等体积混合,可用速算法:混合后的PH 等于混合前溶液PH 小的加0.3如: (2)强碱与强碱混合 由c(OH - )混=112212()()c OH V c OH V V V --++先求出混合后C(OH -),再通过K w 求出(H +). 技巧二:若两强碱溶液等体积混合,可采用速算法:混合扣溶液的PH 等于混合前溶液PH 大的减去0.3. 例2、(93年高考题)25mLPH=10的氢氧化钾溶液跟50mLPH=10的氢氧化钡溶液混合, 混合液的PH 是( ) A、9.7 B 、10 C 、10.3 D 、10.7 解析:根据技巧二、可得出答案为B (3)强酸与强碱混合 强酸与强碱混合实质为中和反应,可以有以下三种情况: ①若恰好中和,PH=7。 例3、(04年全国新老课程11题)1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完 全反应,则该碱溶液的pH 等于( ) A 。9.0 B 。9.5 C 。10.5 D 。11.0 解析:因为是恰好中和,则中和后溶液的PH=7,设碱的PH=X,则有 2.5141101010X --?=?,解得X=10.5,答案为C。 ②若酸剩余,先求出中和后剩余的c(H +),再求出PH ③若碱剩余,先求出中和后剩余的c(OH -), 再通过K w 求出c(H +),最后求PH。 3、溶液稀释后的PH求法
pH缓冲液的配制
【引用】常用pH缓冲溶液的配制和pH值 2011-05-13 20:01:24| 分类:生物|字号订阅 本文引用自DSC《常用pH缓冲溶液的配制和pH值》
一、常用溶液的配制(文章来自:医药园(https://www.360docs.net/doc/358716628.html,) 整理:zfg) (一)溶液配制注意事项 1.药品要有较好的质量试剂分为优级纯(保证试剂,Guaranteed reagent,G.R.)、分析试剂(Antalytical reagent,A.R.)化学纯(Chemical pure,C.P.)和实验试剂(Laboratory reagent,L.R.)等等。工业用的化学试剂,杂质较多,只在个别情况下应用,如配洗液用的硫酸、配干燥剂的氯化钙等。 2.药品称量要精确。 3.配制试剂用水应用新鲜的去离子水或双蒸馏水,比电阻值在50万欧姆以上,pH在5.5~7.0之间才可应用,在组织培养等特殊用途时应注意此项要求,配制一般化验用溶液只要求用双蒸馏水或去离子水。 4.配好后的溶液,应立即除菌处理(如高压灭菌、抽滤或加抑菌物质),以防杂菌生长。 (二)0.067(1/15)Mol/L磷酸缓冲液 1.1/15Mol/L磷酸二氢钾溶液的配制:称取磷酸二氢钾(KH2PO4,A.R.)9.08g,用蒸馏水溶解后,倾入1 000ml容量瓶内,再稀释至刻度(1 000ml)。 2.1/15Mol/L磷酸二氢钠溶液的配制:称取无水磷酸氢二钠(Na2HPO4,A.R.)9.47g (或者Na2HPO4·2H2O 11.87g)用蒸馏水溶解后,放入1 000ml容量瓶内,再加蒸馏水稀释至刻度(1 000ml)。 3.按附表的比例,配制成不同pH值的缓冲溶液。
溶液的酸碱性及pH的计算
溶液的酸碱性及pH的计算 班级姓名座号 1.下列说法中正确的是() A.某溶液中c(H+)=c(OH-)=10-8 mol·L-1,该溶液呈中性 B.溶液中若c(H+)>10-7 mol·L-1,则c(H+)>c(OH-),溶液显酸性 C.c(H+)越大,则pH越大,溶液的酸性越强 D.pH为0的溶液,其中只有H+,无OH- 2.常温下某溶液中由水电离出的c(H+))为1.0×10-12 mol·L-1,下列说法正确的是() A.一定是酸的溶液B.一定是碱的溶液 C.一定是碱性溶液D.可能是酸性溶液也可能是碱性溶液 3.室温时,pH=6的H2SO4加水稀释1 000倍,溶液中() A.pH=9 B.pH≈7 C.c(OH-)=1×10-11 mol·L-1 D.c(H+)=2×10-9 mol·L-1 4.常温下等体积混合0.1 mol·L-1的盐酸和0.06 mol·L-1的Ba(OH)2溶液后,溶液的pH等于() A.2.0B.12.3 C.1.7 D.12.0 5.常温时,下列叙述正确的是() A.稀释pH=3的醋酸,溶液中所有离子的浓度均降低 B.等体积pH均为3的H2SO4和醋酸溶液,完全反应时消耗的NaOH的物质的量不同 C.pH均为11的NaOH和NH3·H2O溶液中,水的电离程度不相同 D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 6.室温下,pH=4的盐酸和pH=10的氨水等体积混合后,所得溶液的pH值()A.一定大于7 B.一定等于7 C.一定小于7 D.可能大于7 7.25 ℃时,等体积硫酸和氢氧化钠溶液混合后,若溶液呈现中性,则混合前硫酸的pH和氢氧化钠溶液的pH之间应满足的关系是() A.pHH2SO4+pH NaOH>14 B.pHH2SO4+pH NaOH<14
溶液PH值计算经典习题
溶液PH值计算习题 练习: 1?在25°C某稀溶液中,由水电离产生的c (H+) =10-13mol/L,下列有关溶液的叙述正确的是(CD) A ?该溶液一定呈酸性 B ?该溶液一定呈碱性 C ?该溶液的pH可能约为1 D ?该溶液的pH可能约为13 / \ 2. 250C时,10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH与强碱的pH之间应满足的关系是什么? ( pH酸+pH碱=15) 3. 在800C时,纯水的pH小于7,为什么?(因为水的电离过程是吸热过程, 所以升高温度,平衡右移,使c (H+) =c (OH— ) >10—7 mol/L,所以pH小于7) =4的盐酸用水稀释100倍、1000倍、10000倍,pH值各为多少? 5. 在LHCl中,由水电离出来的[H+]为多少? 6. 某溶液中由水电离产生的[H+]= 1 >10- 10mol/L,则该溶液的pH值可能是? 7. 某盐酸中1>0-x mol/L,某氨水的pH为y,已知:x+y = 14,且y>11,将上述两 溶液分别取等体积,充分混合后,所的溶液中各离子浓度由大到小的顺序是? =5的强酸与pH = 11的强碱溶液混合至pH=7,求酸碱的体积比? 课堂练习1: 1. 室温下,在pH=12的某溶液中,由水电离出来的c(OH-)为()。 (A)X10-7 mol L-1(B) X10-6 mol L-1(C) X10-2 mol L-" (D) X10-12 mol L-1 2. 25T时,某溶液中,由水电离出的c(H+)=1X10-12 mol L-1,则该溶液的pH可 能是( )。 (A) 12(B) 7 (C) 6 (D) 2
缓冲溶液【(最全)常见缓冲溶液配制方法】
缓冲溶液【(最全)常见缓冲溶液配制方法】常见缓冲溶液配制 乙醇-醋酸铵缓冲液(pH3.7):取5mol/L醋酸溶液15.0ml,加乙醇60ml和水20ml,用10mol/L氢氧化铵溶液调节pH值至3.7,用水稀释至1000ml。 三羟甲基氨基甲烷缓冲液(pH8.0):取三羟甲基氨基甲烷12.14g,加水800ml,搅拌溶解,并稀释至1000ml,用6mol/L盐酸溶液调节pH值至8.0。 三羟甲基氨基甲烷缓冲液(pH8.1):取氯化钙0.294g,加 0.2mol/L三羟甲基氨基甲烷溶液40ml使溶解,用1mol/L盐酸溶液 调节pH值至8.1,加水稀释至100ml。 三羟甲基氨基甲烷缓冲液(pH9.0):取三羟甲基氨基甲烷6.06g,加盐酸赖氨酸3.65g,氯化钠5.8g,乙二胺四醋酸二钠0.37g,再加水溶解使成1000ml,调节pH值至9.0。 乌洛托品缓冲液:取乌洛托品75g,加水溶解后,加浓氨溶液4.2ml,再用水稀释至250ml。
巴比妥缓冲液(pH7.4):取巴比妥钠4.42g,加水使溶解并稀释至400ml,用2mol/L盐酸溶液调节pH值至7.4,滤过。 巴比妥缓冲液(pH8.6):取巴比妥5.52g与巴比妥钠30.9g,加水使溶解成2000ml。 巴比妥-氯化钠缓冲液(pH7.8):取巴比妥钠5.05g,加氯化钠3.7g及水适量使溶解,另取明胶0.5g加水适量,加热溶解后并入上述溶液中。然后用0.2mol/L盐酸溶液调节pH值至7.8,再用水稀释至500ml。 甲酸钠缓冲液(pH3.3):取2mol/L甲酸溶液25ml,加酚酞指示液1滴,用2mol/L氢氧化钠溶液中和,再加入2mol/L甲酸溶液75ml,用水稀释至200ml,调节pH值至3.25~3.30。 邻苯二甲酸盐缓冲液(pH5.6):取邻苯二甲酸氢钾10g,加水900ml,搅拌使溶解,用氢氧化钠试液(必要时用稀盐酸)调节pH值至5.6,加水稀释至1000ml,混匀。 枸橼酸盐缓冲液:取枸橼酸4.2g,加1mol/L的20%乙醇制氢氧化钠溶液40ml使溶解,再用20%乙醇稀释至100ml。
PH计校准及缓冲液配置 (1)
标准缓冲溶液(均用pH标准缓冲物质配制) 1.1 苯二甲酸氢钾标准缓冲溶液:c(KHC8H4O4)=0.05 mol/L(25℃时,pH=4.003)。 苯二甲酸氢钾的pH标准缓冲物质,有小塑料袋和瓶装两种,配制方法如下: a)袋装配制法:在250 mL(或500 mL)量瓶中(根据袋中标准缓冲物质量,选择量瓶大小),按袋上的说明配制成所需的浓度。保存于聚乙烯瓶中。 b)瓶装配制法:称取5.10 g苯二甲酸氢钾(KHC8H4O4预先在115℃±5℃,烘2~3 h,于干燥器中冷却),溶于水并稀释至500 mL,混匀。保存于聚乙烯瓶中。 1.2 0.025 mol/L磷酸二氢钾(KH2PO4)和0.025 mol/L磷酸氢二钠(Na2HPO4)混合标准缓冲溶液(25℃时,pH=6.864): 磷酸二氢钾和磷酸氢二钠的pH标准缓冲物质,有小塑料袋装(混合磷酸盐)和瓶装(两种pH 标准缓冲物质分别包装)两种。配制方法如下: a)袋装配制法:在量瓶(根据袋上说明确定量瓶大小)中按袋上说明配制成所需浓度后,保存于聚乙烯瓶中。 b)瓶装配制法:迅速称取3.40 g磷酸二氢钾(KH2PO4)和3.55 g磷酸氢二钠(Na2HPO4)(均预先在115±5℃烘2~3 h,于干燥器中冷却)溶于蒸馏水,转入1 000 mL量瓶中,加水至标线,混匀。 1.3 0.008 695 mol/L磷酸二氢钾(KH2PO4)和0.030 43 mol/L磷酸氢二钠(Na2HPO4)标准混合缓冲溶液(25℃时,pH=7.413): 磷酸二氢钾和磷酸氢二钠两种pH标准缓冲物质分别用瓶包装,配制方法如下:迅速称取1.18 g磷酸二氢钾和4.31 g磷酸氢二钠(均预先在115℃±5℃烘2~3 h,于干燥器中冷却),溶于水,全量移入1 000 mL量瓶中,加水至标线,混匀。保存于聚乙烯瓶中。 1.4 硼砂标准缓中溶液:c(Na2B4O7·10H2O)=0.010 mol/L(25℃时,pHs=9.182)。 硼砂的pH标准缓冲物质也有塑料袋装和瓶装两种,配制方法如下: a)袋装配制法: 在500 mL量瓶中,按袋上说明配制成所需浓度后,分装于5个100 mL聚乙烯瓶中,瓶口用石蜡熔封。 b)瓶装配制法: 称取1.91 g硼砂(预先在盛有蔗糖饱和溶液的干燥器中平衡两昼夜),溶于刚煮沸冷却的蒸馏水,全量转入500 mL量瓶中,加水至标线,混匀。分装于5个100 mL聚乙烯瓶中,瓶口用石蜡熔封,有效期为三个月,经常使用的缓冲溶液,每周更换一次。 各种标准缓冲溶液的pH值随温度的变化而变化。0~45℃的pH值列于表21中。 1.5 饱和氯化钾溶液: 称取40 g氯化钾,加100 mL水,充分搅拌后盛于试剂瓶中(此溶液应与氯化钾固体共存)。 温度,℃苯二甲酸氢钾混合磷酸盐磷酸盐硼砂 0 4.006 6.981 7.534 7.534 5 3.999 6.949 7.500 9.391 10 3.996 6.921 7.472 9.330 20 3.998 6.879 7.429 9.226 25 4.003 6.864 7.413 9.182 30 4.010 6.852 7.400 9.142 35 4.019 6.844 7.389 9.105 40 4.029 6.838 7.380 9.072
溶液PH计算-教案
教学过程: 一、回顾:溶液pH的定义表达式,求算简单pH,突出抓住c(H+)计算。 二、知识讲解: 溶液PH计算的整体思路是: 1、根据pH的定义pH=-lgc(H+),溶液PH计算的核心是确定溶液中的c(H+)相对大小。 2、根据pH定义pH=-lgc(H+)的引申,溶液的pOH=-lgc(OH-),溶液pOH计算的核心是确定溶液中的c(OH-)相对大小,再根据pH+pOH=-lgK w得出pH 3、在溶液pH的计算时,当两种溶液的浓度相差100及其以上,浓度相差悬殊,浓度较小的pH可以忽略不计。
若该溶液是酸性溶液,必先确定c(H+),再进行pH的计算;若该溶液是碱性溶液,必先确定c(OH-),可根据c(H+)·c(OH-)=K w换算成c(H+),再求pH,或由引用pH定义,由c(OH-)直接求pOH,再根据pH+pOH=-lgK w,换算出pH。 等物质的量浓度的下列物质,求其pH或pOH 例1:求室温条件下 0.005mol/L的H2SO4溶液的pH值 解: ∵ C(H2SO4) = 0.005mol/L ∴ [H+] = 0.005×2 = 0.01 mol/L pH = -lg[H+] = -lg0.01 = 2 例2:求室温条件下 0.005mol/L的Ba(OH)2溶液的pH值 解: ∵ C(Ba(OH)2) = 0.005mol/L ∴ [OH-] = 0.005×2 = 0.01mol/L [H+] = Kw/[OH-] = 10-14/0.01 = 10-12mol/L ∴ PH = -lg[H+] = -lg10-12 = 12 例3:已知室温条件下,某溶液的pH = 4,求此溶液中H+和OH-的浓度. 解: ∵PH =4 = -lg[H+] = 4 ∴[H+] = 10-4mol/L [OH-] = Kw/[H+] = 10-14/10-4= 10-10mol/L 例4:25℃时,0.1mol/L某一元弱酸的电离度为1%,求此溶液的pH值. 解: [H+] = cα= 0.1mol/L ×1% = 10-3 mol/L pH = 3 例5:25℃时,0.1mol/L某一元弱碱的电离度为1%,求此溶液的PH值. 解: [OH-] = cα= 0.1mol/L ×1% = 10-3 mol/L [H+] = Kw/[OH-] = 10-14/10-3= 10-11mol/L pH = 11
酸碱溶液pH值的计算方法
酸碱溶液pH值的计算 一、质子条件:(质子平衡方程). 许多化学反应都与介质的pH值有关,酸碱滴定过程更需要了解溶液的pH值。酸碱反应的实质是质子转移,当反应达到平衡时,酸失去质子的数目必然等于碱得质子的数目, 这种由酸碱得失质子相等的原则而列出的失质子产物与得质子产物的浓度关系称为质子平衡式,用PBE(proton balance equation)符号表示。 质子条件的两种写法: 1.由溶液中各组分得失质子的关系列出质子条件: 质子条件是反映溶液中质子转移的平衡关系,又具体表现在反应达到平衡时,得失质子后产物浓度的关系式上。因此也可以通过得失质子产物的浓度关系来计量得失质子的物质的量,而直接列出质子条件。这种方法首先遇到的问题是确定体系中那些是得失质子产物。为此就要设定一个判断的标准——质子参考水准,又称零水准。与零水准相比较,多了质子的就是得质子产物。通常,都以质子转移直接有关的溶质(或其某些组分)和溶剂(质子溶剂)作为参考水准。 例如:一元弱酸HA的水溶液。 其中大量存在并与质子转移有关的物质是 所以,写质子方程的方法是: ①由酸碱平衡体系中选取质子参考水准(或质子基准物质),参考水准通常是起始的酸碱组分和溶剂。 ②以零水准为基准,将溶液中其它可能存在的组分与之比较,看哪些是得质子的,哪些是失质子的,绘出得失质子示意图。 ③根据得失质子等衡原理,写出PBE,正确的PBE应不含有基准物质本身的有关项。 ④在处理多级离解的物质时,有些酸碱物质与质子参考水准相比,质子转移数可能大于1,这时,应在其浓度之前乘以相应的系数。 例2. c mol/L Na2HPO4溶液 例3. Na2S溶液
溶液pH的计算方法
高二化学选修4 1 溶 液 pH 的 计 算 方 法 温故:溶液的酸碱度可用c(H +)或c(OH -)表示,但当我们遇到较稀的溶液时,这时再用C(H +)或C(OH -)表示是很不方便的,为此丹麦化学家索伦森提出了PH 。它的定义为 .即pH = 。 知新:下面介绍几种关于溶液PH 的计算方法。 计算原理: 酸性溶液:先求c(H +)→pH =-lgc(H +) 碱性溶液:先求C(OH -)→c(H +)→pH =-lgc(H +) 1、单一溶液PH 的计算 (1)强酸溶液:如H n A,设物质的量浓度为cmoL/L, 则c(H +)= moL/L, pH =-lgc(H +)= 例1、 0.1 mo1/L 盐酸溶液的pH = ,0.1 mo1/L 盐酸溶液的pH = 。 (2)强碱溶液,如B(OH)n,设溶液物质的量浓度为cmoL/L, 则c(H +)= moL/L,pH =-lgc(H +)= 2、两两混合溶液的PH 计算 (1)强酸与强酸混合 由C(H + )混=112212()()c H V c H V V V ++++先求出混合后的C(H +)混,再根据公式求出pH. 例2.pH =1盐酸溶液和pH =3的硫酸溶液等体积混合,混合溶液的pH = 技巧一:若两强酸等体积混合,可用速算法: pH 混=pH 小+0.3 (2)强碱与强碱混合 由c(OH - )混=112212()()c OH V c OH V V V --++先求出混合后C(OH -),再通过K w 求(H +). 例3、25mLpH =10的氢氧化钾溶液跟50mLpH =10的氢氧化钡溶液混合,混合液的pH 是( ) A、9.7 B 、10 C 、10.3 D 、10.7 例4.pH =11NaOH 溶液和pH =13的KOH 溶液等体积混合,混合溶液的pH = 技巧二:若两强碱溶液等体积混合, pH 混=pH 大-0.3 (3)强酸与强碱混合 强酸与强碱混合实质为中和反应,可以有以下三种情况: ①若恰好中和,p H=7。 例5、1体积pH =2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH 等于( ) A 、9.0 B 、9.5 C 、10.5 D 、11.0 ②若酸剩余,先求出中和后剩余的c(H +),再求出p H 例6.pH =5的盐酸和pH =9的氢氧化钠溶液以体积比11∶9混合,混合液的
pH标准缓冲溶液的详细说明
pH标准缓冲溶液的详细说明 1、什么是pH计的标准缓冲溶液?有什么特点? pH缓冲溶液是一种能使pH值保持稳定的溶液。如果向这种溶液中加入少量的酸或碱,或者在溶液中的化学反应产生少量的酸或碱,以及将溶液适当稀释,这个溶液的pH值基本上稳定不变,这种能对抗少量酸或碱或稀释,而使pH值不易发生变化的溶液就称为pH缓冲溶液。 pH计标准缓冲溶液具有以下特点: (1)标准溶液的pH值是已知的,并达到规定的准确度; (2)标准溶液的pH值有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数; (3)溶液的制备方法简单; 2、对于PH计,pH缓冲溶液主要作用是什么? ⑴pH测量前标定校准pH计 ⑵用以检定pH计的准确性,例如用pH6.86和pH4.00标定pH计后,将pH 电极插入pH9.18溶液中,检查仪器显示值和标准溶液的pHs值是否一致; ⑶在一般精度测量时检查pH计是否需要重新标定。pH计标定并使用后也许会产生漂移或变化,因此在测试前将电极插入与被测溶液比较接近的标准缓冲液中,根据误差大小确定是否需要重新标定。 ⑷检测pH电极的性能 3、如何配制pH标准缓冲溶液? 对于一般的pH测量,可使用成套的pH缓冲试剂(可配制250ml),配制溶液时,应使用去离子水,并预先煮沸15~30分钟,以除去溶解的二氧化碳。剪开塑料袋将试剂倒入烧杯中,用适量去离子水使之溶解,并冲洗包装袋,再倒入250ml容量瓶中,稀释至刻度,充分摇匀即可。 4、如何正确保存和使用pH缓冲溶液; 缓冲溶液配制后,应装在玻璃瓶或聚乙烯瓶中(碱性的pH缓冲液如pH9.1 8、pH10.01、pH12.46等,应装在聚乙烯瓶中)瓶盖严密盖紧,在冰箱中低温(5~10℃)保存,一般可使用二个月左右,如发现有混浊、发霉或沉淀等现象,不能继续使用。使用时,应准备几个50ml的聚乙烯小瓶,将大瓶中的缓冲溶液倒入小瓶中,并在环境温度下放置1~2小时,等温度平衡后再使用。使用后不得再倒回大瓶中,以免污染,小瓶中的缓冲溶液在>10℃的环境条件下可以使用2~3天,一般pH7.00、pH6.86及pH4.00三种溶液使用时间可以长一些,pH9.18和pH10.01溶液由于吸收空气中的CO2,其p H值比较容易变化。
混和溶液pH值的计算方法
)/(2102 ][2][2 2L m ol H K H K c K a a a -++==?=?=混 15.22101][12=-=-=-+g H g 混混和溶液pH 值的计算方法 混和溶液pH 值的计算,考查知识点较多,本文作一系统归纳分析。 一、酸或碱和稀释 分析:强酸、强碱与水混和,其pH 值由公式: 例1 pH = 2的醋酸稀释一倍后,其溶液pH 值为多少? 解:pH = 2 ∴[H +]混 ∴pH 二、强酸与弱酸或强碱与弱碱的混和 分析:因弱酸存在电离平衡,混和溶液pH 值应根据强酸中H +对弱酸的同离子效应来计算。强碱与弱碱混和与上述分析相似。 例2 0.2mol/L 盐酸和0.2mol/L 醋酸以1:3的体积比混和后,其pH 为多少? (K a = 1.75×10-5) 解:混和后盐酸浓度为 . ][,][:,,;][][,][][来计算公式值由 弱碱与水混和弱酸来计算混混混混混碱碱混酸酸混c K OH c K H pH V V OH OH V V H H b a ?=?=?=?=-+--++a a a K H c K H c c K H L mol H 2][][][) /(10][2 2 2+++-+==∴?==混 ) /(15.04 2.03)/(05.04 2.01L m ol L m ol =?=?醋酸浓度为
水解 +4NH CH 3COOH ==== CH 3COO - + H + 平衡浓度:0.15 - x x X + 0.05 ∴pH = -1g [H +]总 = -1g0.05 = 1.31 强酸与强酸或强碱与强碱的混和,pH 值的计算较为简单,这里不再赘述。 三、酸与碱的混和 1、强酸与弱碱的混和 分析:有三种情况。①强酸过量,则混和溶液的pH 值由剩余强酸决定;②弱碱过量,则为剩余弱碱与生成盐构成缓冲溶液的pH 值;③恰好反应完,即为生成盐溶液的pH 值。 例3 0.4mol/L 盐酸和0.2mol/L 氨水等体积混和后溶液pH 值为多少? (K b = 1.77×10-5) 解:从反应 NH 3·H 2O+HC1 =NH 4C1+H 2O 可知盐酸过剩,其剩余盐酸浓度为 (0.4 - 0.2)/ 2 = 0.1 (mol / L) ∵盐酸存在抑制了 ∴混和后[H +]总 = 0.1mol / L pH = -1g0.1 = 1 若此题的盐酸与氨水浓度互换,则变为:剩余氨水为(0.4 - 0.2)/ 2 = 0.1 (mol / L),生成NH 4C1浓度为0.2 / 2 = 0.1 (mol / L),则混和液pH 值为构成NH 3·H 2O — NH 4C1缓冲溶液为pH 值: 平衡浓度:0.1- x 0.1 + x x x x x x x x K a -≈+∴∴-?+=15.0,05.005.0,) 15.0()05.0(很小 同离子效应 15 .0≈a a K x x K 315 .005.0=∴= ∴) /(1075.135L mol -??=5 1075.1305.0][-+??+=∴总H 05 .0≈- ++??OH NH O H NH 423
药典规定关于缓冲液的配置
缓冲液(2005年版二部) 附录ⅩⅤ D 缓冲液 磷酸盐缓冲液(pH2.0) 甲液:取磷酸16.6ml,加水至1000ml,摇匀。乙液: 取磷酸氢二钠71.63g,加水使溶解成1000ml。取上述甲液72.5ml与乙液27.5ml混合,摇匀,即得。 磷酸盐缓冲液(pH2.5) 取磷酸二氢钾100g,加水800ml,用盐酸调节pH至 2.5,用水稀释至1000ml。 磷酸盐缓冲液(pH5.0) 取0.2mol/L磷酸二氢钠溶液一定量,用氢氧化钠试液 调节pH值至5.0,即得。 磷酸盐缓冲液(pH5.8) 取磷酸二氢钾8.34g与磷酸氢二钾0.87g,加水使溶解 成1000ml,即得。 磷酸盐缓冲液(pH6.5) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液15.2ml, 用水稀释至100ml,即得。 磷酸盐缓冲液(pH6.6) 取磷酸二氢钠1.74g、磷酸氢二钠2.7g与氯化钠1.7g, 加水使溶解成400ml,即得。 磷酸盐缓冲液(含胰酶)(pH6.8) 取磷酸二氢钾6.8g,加水500ml使溶解,用 0.1mol/L氢氧化钠溶液调节pH值至6.8;另取胰酶10g,加水适量使溶解,将两液混合后,加水稀释至1000ml,即得。 磷酸盐缓冲液(pH6.8) 取0.2mol/L磷酸二氢钾溶液250ml,加0.2mol/L氢氧化 钠溶液118ml,用水稀释至1000ml,摇匀,即得。 磷酸盐缓冲液(pH7.0) 取磷酸二氢钾0.68g,加0.1mol/L氢氧化钠溶液29.1ml,用水稀释至100ml,即得。 磷酸盐缓冲液(pH7.2) 取0.2mol/L磷酸二氢钾溶液50ml与0.2mol/L氢氧化钠溶液35ml,加新沸过的冷水稀释至200ml,摇匀,即得。 磷酸盐缓冲液(pH7.3) 取磷酸氢二钠1.9734g与磷酸二氢钾0.2245g,加水使溶 解成1000ml,调节pH值至7.3,即得。 磷酸盐缓冲液(pH7.4) 取磷酸二氢钾1.36g,加0.1mol/L氢氧化钠溶液79ml,用水稀释至200ml,即得。 磷酸盐缓冲液(pH7.6) 取磷酸二氢钾27.22g,加水使溶解成1000ml,取50ml,加0.2mol/L氢氧化钠溶液42.4ml,再加水稀释至200ml,即得。
PH缓冲溶液配制方法
PH3-10缓冲溶液的配制方法 Na 2HPO 4分子量 = 14.98,0.2 mol/L 溶液为28.40克 /升。 Na 2HPO 4·2H 2O 分子量 = 178.05,0.2 mol/L 溶液含35.01克/升。 C 4H 2O 7·H 2O 分子量 = 210.14,0.1 mol/L 溶液为21.01克/升。 ① 使用时可以每升中加入1克克酚,若最后pH 值有变化,再用少量50% 氢氧化钠溶 液或浓盐酸调节,冰箱保存。 3. 甘氨酸–盐酸缓冲液(0.05mol/L )
4.邻苯二甲酸–盐酸缓冲液(0.05 mol/L) 邻苯二甲酸氢钾分子量= 204.23,0.2 mol/L邻苯二甲酸氢溶液含40.85克/升 柠檬酸C6H8O7·H2O:分子量210.14,0.1 mol/L溶液为21.01克/升。 柠檬酸钠Na3 C6H5O7·2H2O:分子量294.12,0.1 mol/L溶液为29.41克/升。 柠檬酸C6H8O7·H2O: 2.1g 柠檬酸钠Na3 C6H5O7·2H2O: 2.94g H2O: 100 ml 6.乙酸–乙酸钠缓冲液(0.2 mol/L) Na2Ac·3H2O分子量= 136.09,0.2 mol/L溶液为27.22克/升。
7.磷酸盐缓冲液 Na 2HPO 4·2H 2O 分子量 = 178.05 ,0.2 mol/L 溶液为85.61克/升。 Na 2HPO 4·12H 2O 分子量 = 358.22,0.2 mol/L 溶液为71.64克/升。 Na 2HPO 4·2H 2O 分子量 = 156.03,0.2 mol/L 溶液为31.21克/升。 Na 2HPO 4·2H 2O 分子量 = 178.05,1/15M 溶液为11.876克/升。 KH 2PO 4分子量 = 136.09,1/15M 溶液为9.078克/升。 8.磷酸二氢钾–氢氧化钠缓冲液(0.05M )
化学实验报告实验__缓冲溶液的配制及ph测定
实 验 报 告 姓名: 班级: 同组人: 自评成绩: 项目: 缓冲溶液的配制及pH 测定 课程: 学号: 一、实验目的 1. 学会标准缓冲溶液的配制方法,并验证其性质。 2. 掌握酸度计测定溶液pH 的方法。 二、实验原理 1.缓冲原理 缓冲溶液具有抵抗外来少量酸、碱或稀释的干扰,而保持其本身pH 基本不变的能力。缓冲溶液由共轭酸碱对组成,其中共轭酸是抗碱成分,共轭碱是抗酸成分,缓冲溶液的pH 可通过亨德森-哈塞尔巴赫方程计算。 pH = pKa + lg [][] HB B - 在配制缓冲溶液时,若使用相同浓度的共轭酸和共轭碱,则它们的缓冲比等于体积 比。 pH = pKa + lg HB B V V - 配制一定pH 的缓冲溶液的原则:选择合适的缓冲系,使缓冲系共轭酸的p K a 尽可能与所配缓冲溶液的pH 相等或接近,以保证缓冲系在总浓度一定时,具有较大的缓冲能力;配制缓冲溶液要有适当的总浓度,一般情况下,缓冲溶液的总浓度宜选在~L 之间; 按上面简化公式计算出- B V 和HB V 的体积并进行配制。 三、仪器和药品 仪器: 精密pH 试纸,pHs-3C 型酸度计,玻璃电极或pH 复合电极,塑料烧杯,温度计。 试剂:L 的HAc 、NaAc 、NaOH 、HCl 溶液,L 的Na 2HPO 4、KH 2PO 4溶液,1%HCl 溶液,1%NaOH 溶液待测pH 溶液,饱和氯化钾溶液。
pH=的标准缓冲溶液:称取在110℃烘干的分析纯邻苯二甲酸氢钾10.21g,溶于蒸馏水中,再定容至1000mL。 pH=的标准缓冲溶液:称取在110℃烘干的分析纯磷酸二氢钾3.39g和磷酸二氢钠3.53g,溶于蒸馏水中,再定容至1000mL。 pH=的标准缓冲溶液:称取分析纯硼砂3.81g,用蒸馏水溶解后定容至1000mL。四、内容及步骤 1. 缓冲溶液的配制 (1)计算配制100mL pH=的缓冲溶液需要L HAc溶液和L NaAc溶液体积(已知HAc 的p K a=。根据计算出的用量,用吸量管吸取两种溶液置于100mL烧杯中,混匀,用酸度计测定其pH。若pH不等于,可用几滴LNaOH或L NaAc溶液调节使溶液的pH为后,备用待测。 (2)计算配制pH=的缓冲溶液100mL需要的L Na2HPO4和L KH2PO4溶液的体积(H3PO4的p K a2=。根据计算用量,用碱式滴定管放取Na2HPO4溶液,用吸量管吸取KH2PO4溶液置于100mL烧杯中,混匀,用酸度计测定其pH。若pH不等于,用几滴L NaOH或2mol/L KH2PO4溶液调节至后,备用待测。 2. 缓冲溶液的性质 (1)缓冲溶液的抗酸作用:取三支试管,分别加入3mL上述配制的pH为、的缓冲溶液和蒸馏水,各加入2滴L HCl溶液,用酸度计或精密pH试纸测定其pH,并解释实验现象。 (2)缓冲溶液的抗碱作用:取三支试管,分别加入3mL上述配制的pH为、的缓冲溶液和蒸馏水,各加入2滴L NaOH溶液,用酸度计或精密pH试纸测定其pH,并解释实验现象。 (3)缓冲溶液的抗稀释作用:取四支试管,分别加入上述配制的pH为、的缓冲溶液、L的NaOH、HCl溶液,各加入5mL蒸馏水,振荡试管,用酸度计或精密pH试纸测定
缓冲溶液pH值计算公式(学习资料)
缓冲溶液pH值计算公式 裴老师教你学化学 许多化学反应(包括生物化学反应)需要在一定的pH值范围内进行,然而某些反应有H+或OH-的生成或消耗,溶液的pH值会随反应的进行而发生变化,从而影响反应的正常进行。在这种情况下,就要借助缓冲溶液来稳定溶液的pH 值,以维持反应的正常进行。在无机化学的教学中,为了使学生根据反应所要控制的pH值范围,能正确选择和配制缓冲溶液,就需要要求学生对缓冲溶液pH 值的计算公式熟练掌握并能灵活应用。 缓冲溶液pH值的计算公式,根据缓冲溶液的组成大致可分为两大类型。 1 由弱酸及弱酸盐组成的缓冲溶液 设弱酸的浓度为C酸(mol·L-1),弱酸盐的浓度为C盐(mol·L-1),在溶液中存在下列平衡: HA H+ + A- [1](P78) 平衡时:C酸-x xC盐+x Ka°= x(C盐+x)/(C酸-x) x = [H+]= Ka°(C酸-x)/(C盐+x) 由于Ka°值较小,且因存在同离子效应,此时x很小,因而C酸-x≈C酸,C盐+x≈C盐,所以 [H+]= Ka°C酸/ C盐 将该式两边取负对数: -log[H+]=-logKa°-logC酸/ C盐,所以
pH = pKa°-logC酸/ C盐 (1) 这就是计算一元弱酸及弱酸盐组成的缓冲溶液pH值的通式。 2 由弱碱及弱碱盐组成的缓冲溶液 设弱碱的浓度为C碱(mol·L-1),弱碱盐的浓度为C碱(mol·L-1),在溶液中存在下列平衡: B + H2O BH+ + OH- [2]( P140) 平衡时:C碱-x C盐+xx Kb°= x(C盐+x)/ (C碱-x) x = [OH-]= Kb°(C碱-x)/ (C盐+x) 由于Kb°较小,且因存在同离子效应此时x很小,因此C碱-x≈C碱,C 盐+x≈C盐,所以,[OH-]= Kb°C碱/ C盐将该式两边取负对数:-log[OH-]=-logKb°-logC碱/ C盐 pOH = p Kb°-logC碱/ C盐 又因pH = 14 - pOH,所以 pH = 14 -pKb°+ logC碱/ C盐 (2) 这就是计算一元弱碱及弱碱盐组成的缓冲溶液pH值的通式。 以上两种类型的缓冲溶液由于组成不同,其计算pH值的公式也不相同。这就给教师的教学和学生的学习带来一定困难。如果我们将这两种不同类型的缓冲溶液用酸碱质子理论进行处理,就可将这两种计算pH值的公式统一起来。讨
