电子排布式、电子排布图、原子结构示意图比较大全
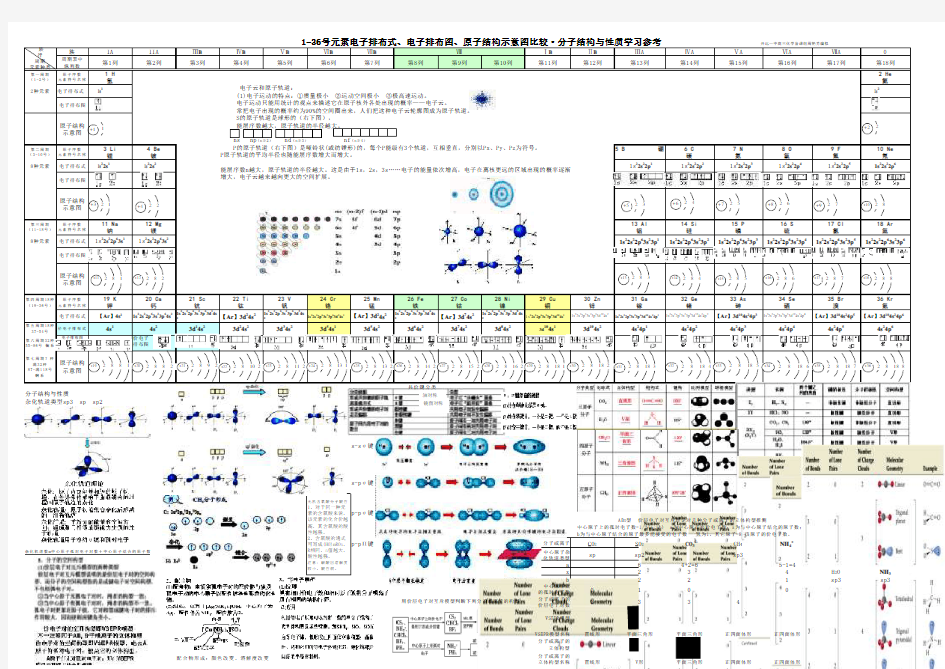

族
IA IIA ⅢB ⅣB ⅤB ⅥB ⅦB ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 周期表中纵列数
第1列第2列
第3列
第4列
第5列
第6列
第7列
第8列
第9列
第10列
第11列
第12列
第13列
第14列
第15列
第16列
第17列
第一周期(1-2号)
原子序数元素符号名称
1 H 氢
2种元素电子排布式 1s 1
电子排布图
原子结构示意图
第二周期(3-10号)
原子序数元素符号名称
3 Li 锂
4 Be 铍
5 B 硼
6 C 碳
7 N 氮
8 O 氧
9 F 氟8种元素电子排布式 1s 22s 1
1s 22s 2
1s 22s 22p 1
1s 22s 22p 2
1s 22s 22p 3
1s 22s 22p 4
1s 22s 22p 5
电子排布图
原子结构示意图
第三周期(11-18号)
原子序数元素符号名称
11 Na 钠12 Mg 镁13 Al 铝14 Si 硅15 P 磷16 S 硫17 Cl 氯8种元素电子排布式1s 22s 22p 63s 1
1s 22s 22p 63s 2
1s 22s 22p 63s 23p 1
1s 22s 22p 63s 23p 2
1s 22s 22p 63s 23p 3
1s 22s 22p 63s 23p 4
1s 22s 22p 63s 23p 5
电子排布图
原子结构示意图
第四周期18种(19-36号)
原子序数元素符号名称
19 K 钾
20 Ca 钙
21 Sc 钪
22 Ti 钛23 V 钒24 Cr 铬25 Mn 锰26 Fe 铁
27 Co 钴28 Ni 镍29 Cu 铜30 Zn 锌
31 Ga 镓
32 Ge 锗
33 As 砷
34 Se 硒
35 Br 溴
电子排布式
【Ar 】4s 1
1s 22s 22p 63s 23p 64s 2
1s 22s 22p 63s 23p 63d 14s 2
【Ar 】3d 24s 2
1s 22s 22p 63s 23p 63d 34s 21s 22s 22p 63s 23p 63d 54s 1【Ar 】3d 24s 2
1s 22s 22p 63s 23p 63d 64s 2
【Ar 】3d 74s 2
1s 22s 22p 63s 23p 63d 84s 21s 22s 22p 63s 23p 63d 104s 1
1s 22s 22p 63s 23p 63d 104s 2
1s 22s 22p 63s 23p 63d 104s 24p 1
1s 22s 22p 63s 23p 63d 104s 24p 2
【Ar 】3d 104s 24p 3
1s 22s 22p 63s 23p 63d 104s 24p 4
【Ar 】3d 104s 24p 5
第五周期18种37-54号价电子排布式
4s 1
4s 23d 14s 23d 24s 2
3d 34s 23d 54s 13d 54s 2
3d 64s 23d 74s 2
3d 84s 2
3d
10
4s 13d 104s 24s 24p 14s 24p 24s 24p 34s 24p 44s 24p 5
第六周期32种55-86号 镧系电子排布图
价电子排布图
第七周期?种
满32种87-满118号
锕系
原子结构示意图
共价键分类
s-s σ键
s-p σ键
p-p σ键
p-p Π键
分子或离子
CO 2SO 2 CO 32-CH 4NH 4+ 中心原子杂化
轨道类型
sp
sp2sp3
a 64+2=65-1=4x 234H 2O b
2
21sp3
中心原子上的
孤对电子数
0100
分子或离子的
价层电子对数
2
3
3
4
VSEPR模型名称直线形
平面三角形平面三角形正四面体形正四面体形
分子或离子的 立
体构型名称
直线形V形平面三角形正四面体形正四面体形形成配合物的条件:①配位体有孤电子对;②中心原子有空轨道。
法二:价层电子对数=(中心原子价层电子数+配原子数×n+电荷数)/2 说明:配原子为H,X-F,Cl,Br,I n=1;配原子为O,S n=0;配原子为N n=-1。 电荷数:带正电减带负电加。
配合物形成:颜色改变、溶解度改变
无机含氧酸分子酸性
1、对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
2、含氧酸的通式可写成(HO)mROn,R相同,n值越大,酸性越强。
注意:碳酸因溶解度较小,酸性弱。
开远一中高三化学备课组周艳芳编拟
Ⅷ 电子云和原子轨道:
(1)电子运动的特点:①质量极小 ②运动空间极小 ③极高速运动。
电子运动只能用统计的观点来描述它在原子核外各处出现的概率——电子云。
常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图成为原子轨道。 S的原子轨道是球形的(右下图), 能层序数越大,原子轨道的半径越大。
ns np (n≥2) nd (n≥3) nf (n≥4)
P的原子轨道(右下图)是哑铃状(或纺锤形)的,每个P能级有3个轨道,互相垂直,分别以Px、Py、Pz为符号。P原子轨道的平均半径也随能层序数增大而增大。
能层序数n越大,原子轨道的半径越大。这是由于1s,2s,3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。
分子结构与性质
杂化轨道类型sp3 sp sp2
中心原子上的孤对电子数=1/2(a-xb) a为中心原子的价电子数;x为与中心原子结合的原子数;用价层电子对互斥模型判断下列分子或离子的构型
VSEPR模型杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数
b为与中心原子结合的原子最多能接受的电子数 氢为1,其它原子=8-该原子的价电子数。
AB X 型 价层电子对互斥理论对几种分子或离子的立体构型推测
族行周期元素种类
分子或离子的 立
体构型
+1
1
+3
21
+11
281
+19
2881
+4
22+5
23
+6
24
+7
25+8
26
+9
27
+17
287
+16
286
+15
285
+14
284
+13
283
+12
282
+20
2882
+21
2892
+22
28102
+23
28112
+24
28131
+25
28132
+26
28142
+27
28152
+28
28162
+29
28181
+30
28182
+31
28183
+32
28184
+33
28185
+34
28186
+35
28187
轴对称镜面对称
0第18列 2 He 氦
1s 2
10 Ne 氖
1s 22s 2
2p 6
18 Ar 氩1s 2
2s 22p 63s 23p 6
36 Kr 氪
【
Ar 】
3d 104s 24p 6
4s 24p 6
NH 3sp3
;配原子为O,S n=0;配原子为N n=-1。 电荷数:带正电减带负电加。
开远一中高三化学备课组周艳芳编拟
+10
28
+2
2
+18
288
+36
28188
