1-36号元素轨道图
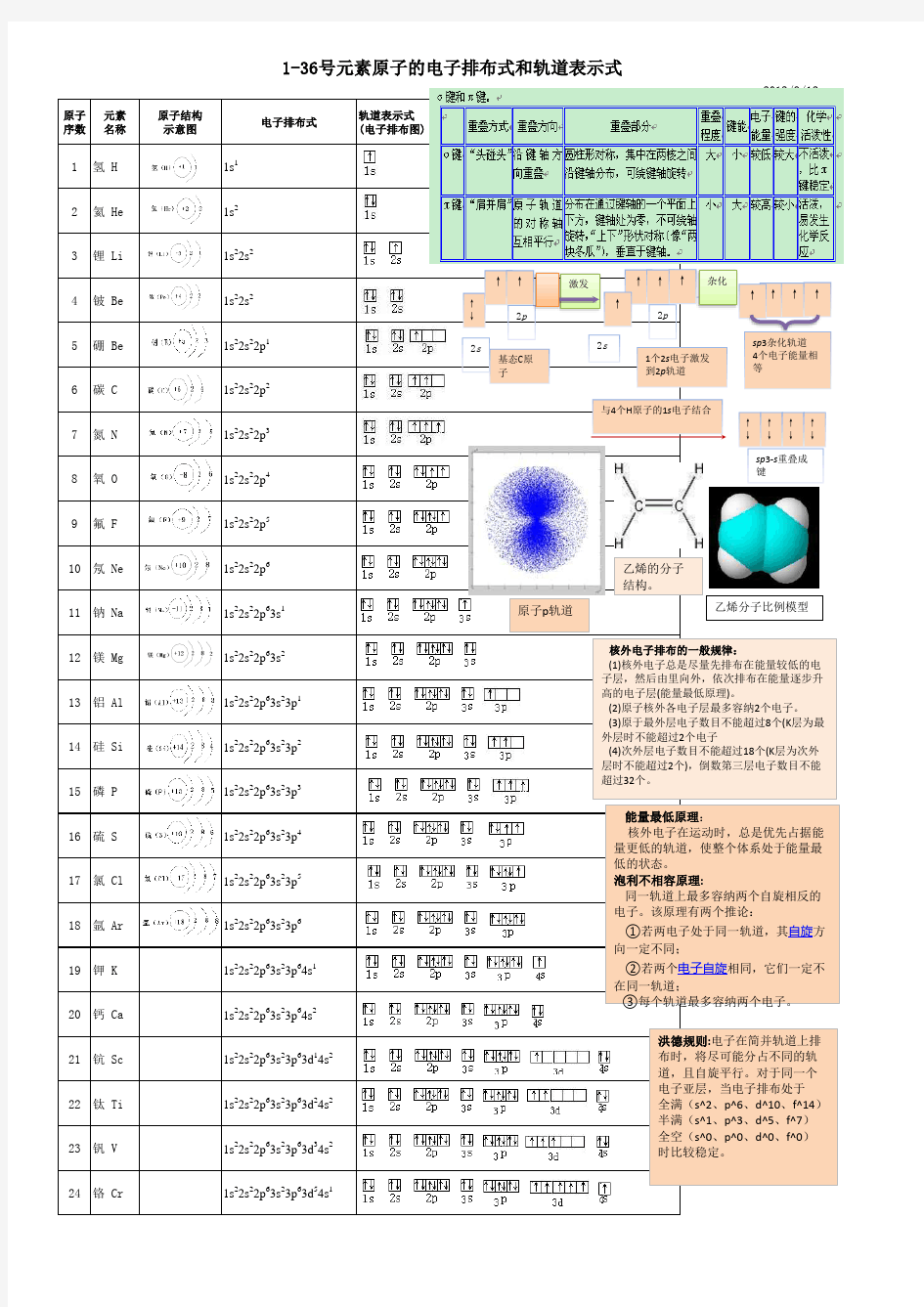

原子序数
元素名称
原子结构示意图
电子排布式
轨道表示式(电子排布图)
1氢 H
1s 12氦 He
1s 23锂 Li
1s 22s 2
4铍 Be
1s 22s 25硼 Be
1s 22s 22p 16碳 C
1s 22s 22p 2
7氮 N
1s 22s 22p
3
8氧 O
1s 2
2s 2
2p
4
9氟 F
1s 22s 22p 5
10氖 Ne
1s 2
2s 2
2p
6
11钠 Na
1s 22s 22p 63s 112镁 Mg
1s 22s 22p 63s 213铝 Al
1s 22s 22p 63s 23p 114硅 Si
1s 22s 22p 63s 23p 215磷 P
1s 22s 22p 63s 23p 316硫 S
1s 22s 22p 63s 23p 4
17氯 Cl
1s 2
2s 2
2p 6
3s 2
3p
5
18氩 Ar
1s 2
2s 2
2p 6
3s 2
3p
6
19钾 K
1s 22s 22p 63s 23p 64s 120钙 Ca
1s 22s 22p 63s 23p 64s 221钪 Sc
1s 22s 22p 63s 23p 63d 14s 222钛 Ti
1s 22s 22p 63s 23p 63d 24s 223钒 V
1s 22s 22p 63s 23p 63d 34s 224铬 Cr
1s 22s 22p 63s 23p 63d 54s 125锰 Mn
1s 22s 22p 63s 23p 63d 54s 2
1-36号元素原子的电子排布式和轨道表示式
能量最低原理:
核外电子在运动时,总是优先占据能量更低的轨道,使整个体系处于能量最低的状态。
泡利不相容原理:
同一轨道上最多容纳两个自旋相反的电子。该原理有两个推论:
①若两电子处于同一轨道,其自旋方向一定不同;
②若两个电子自旋相同,它们一定不在同一轨道;
③每个轨道最多容纳两个电子。
洪德规则:电子在简并轨道上排布时,将尽可能分占不同的轨道,且自旋平行。对于同一个电子亚层,当电子排布处于全满(s^2、p^6、d^10、f^14)半满(s^1、p^3、d^5、f^7)全空(s^0、p^0、d^0、f^0)时比较稳定。
核外电子排布的一般规律:
(1)核外电子总是尽量先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
(2)原子核外各电子层最多容纳2个电子。(3)原于最外层电子数目不能超过8个(K 层为最外层时不能超过2个电子
(4)次外层电子数目不能超过18个(K 层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
电离能:气态电中性基态原子失去一个电子,转化为气态基态正离子所需要的最低能量叫第一电离能。
激发
杂化
↑↑sp 3杂化轨道4个电子能量相等
↑
↑↑
2s
↑↑
2p
基态C 原
2s
↑↑2p
↑
↑
1个2s 电子激发到2p 轨道
与4个H 原子的1s 电子结合
↑↑↑↑
sp 3-s 重叠成
乙烯分子比例模型
原子p 轨道
乙烯的分子结构。
26铁 Fe
1s 22s 22p 63s 23p 63d 64s 2
27钴 Co
1s 2
2s 2
2p 6
3s 2
3p 6
3d 7
4s
2
28镍 Ni
1s 22s 22p 63s 23p 63d 84s 229铜 Cu
1s 22s 22p 63s 23p 63d 104s 1
30锌 Zn
1s 2
2s 2
2p 6
3s 2
3p 6
3d 10
4s
2
31镓 Ga
1s 22s 22p 63s 23p 63d 104s 24p 1
32锗 Ge
1s 2
2s 2
2p 6
3s 2
3p 6
3d 10
4s 2
4p
2
33砷 As
1s 2
2s 2
2p 6
3s 2
3p 6
3d 10
4s 2
4p
3
34硒 Se
1s 2
2s 2
2p 6
3s 2
3p 6
3d 10
4s 2
4p
4
35溴 Br
1s 22s 22p 63s 23p 63d 104s 24p 536氪 Kr
1s 22s 22p 63s 23p 63d 104s 24p 6
价键法(VB 法)价键理论一:1、要点:
⑴、共价键的形成条件:①、先决条件:原子具有未成对电子;②、配对电子参与成键的原子轨道要满足对称匹配、能量相近以及最大重叠的原则;③、两原子具有成单的自旋相反的电子配对,服从保里不相容原理。
⑵、共价键的本质:是由于原子相互接近时轨道重叠,原子间通过共用自旋相反的电子使能量降低而成键。
⑶、共价键的特征:①、饱和性,一个原子有几个未成对电子(包括激发后形成的未成对电子),便和几个自旋相反的电子配对成键;而未成对电子数是有限的,故形成化学键的数目是有限的。②、根据原子轨道最大重叠原理,原子轨道沿其角度分布最大值方向重叠,即共价键具有一定的方向性。
⑷、共价键的类型:单键、双键和叁键。
杂化轨道:轨道的相互叠加过程叫原子轨道的杂化。原子轨道叠加后产生的新的原子轨道叫杂化轨道。
⑴在形成分子(主要是化合物)时,同一原子中能量相近的原子轨道(一般为同一能级组的原子轨道) 相互叠加(杂化)形成一组的新的原子轨道。
⑵杂化轨道比原来的轨道成键能力强,形成的化学键键能大,使生成的分子更稳定。由于成键原子轨道杂化后,轨道角度分布图的形状发生了变化(形状是一头大,一头小),杂化轨道在某些方向上的角度分布,比未杂化的p 轨道和s 轨道的角度分布大得多,它的大头在成键时与原来的轨道相比能够形成更大的重叠,因此杂化轨道比原有的原子轨道成键能力更强。
⑶形成的杂化轨道之间应尽可能地满足最小排斥原理(化学键间排斥力越小,体系越稳定),为满足最小排斥原理, 杂化轨道之间的夹角应达到最大。
⑷分子的空间构型主要取决于分子中σ键形成的骨架,杂化轨道形成的键为σ键,所以,杂化轨道的类型与分子的空间构型相关。
杂化的规律:
杂化前后轨道数目不变,空间取向改变;
杂化轨道能与周围原子形成更强的σ键,或安排孤对电子,而不会以空的杂化轨道存在。
杂化后轨道伸展方向、形状发生改变,成键能力增强,成键能力大小顺序(s 成分越多
成键能力越强)sp 杂化轨道的特点: ①、所组成的几个杂化轨道具有相同的能量;②、形成的杂化轨道数目等于原有的原子轨道数目;③、杂化轨道的空间伸展方向一定(亦即,杂化轨道的方向不是任意的,杂化轨道之间有一定的夹角);④、杂化轨道的成分:每个杂化轨道的成分之和为1;每个参加杂化的原子轨道,在所有杂化轨道中的成分之和为1(单位轨道的贡献)。 子所需要的最低能量叫第一电离能。符号:“I 1”,单位:Kj/mol^-1。“气态”、“电中性”、“基态”是保证最低能量的条件。[规律] 1.总体上金属元素第一电离能较小非金属元素第一电离能较大. 2.同周期元素第一电离能从左到右有增大的趋势 3.同主族元素第一电离能从上到下逐渐减小 4.同一周期第一电离能最小的是碱金属元素,最大的是稀有气体元素。 5.第一电离能越小,越易失电子,金属的活泼性就越强。 电负性:电负性是分子中某元素的原子对成键电子对的吸引力大小的量度。符号:X ,没有单位。电负性越大,对键合电子的吸引力越大。 金属元素越容易失电子,对键合电子的吸引能力越小,电负性越小,其金属性越强;非金属元素越容易得电子,对键合电子的吸引能力越大,电负性越大,其非金属性越强;故可以用电负性来度量金属性与非金属性的强弱。周期表从左到右,元素的电负性逐渐变大;周期表从上到下,元素的电负性逐渐变小。电负性的大小可以作为判断元素金属性和非金属性强弱的尺度。金属的电负性一般小于1.8,非金属的电负性一般大于1.8,而位于非金属三角区边界的“类金属”的电负性则在1.8左右,他们既有金属性又有非金属性。 sp3、sp2和sp 三种杂化轨道在空间的排布示意图。 sp 杂化轨道 sp 2杂化轨道 sp 3 杂化轨道 sp 3d 2杂化轨道 S Px Py Pz dz 2 dxy dxz dyz 。 。, ; ,
