同分异构体同系物同位素同素异形体区别
同位素、同素异形体、同系物、同分异构体区别
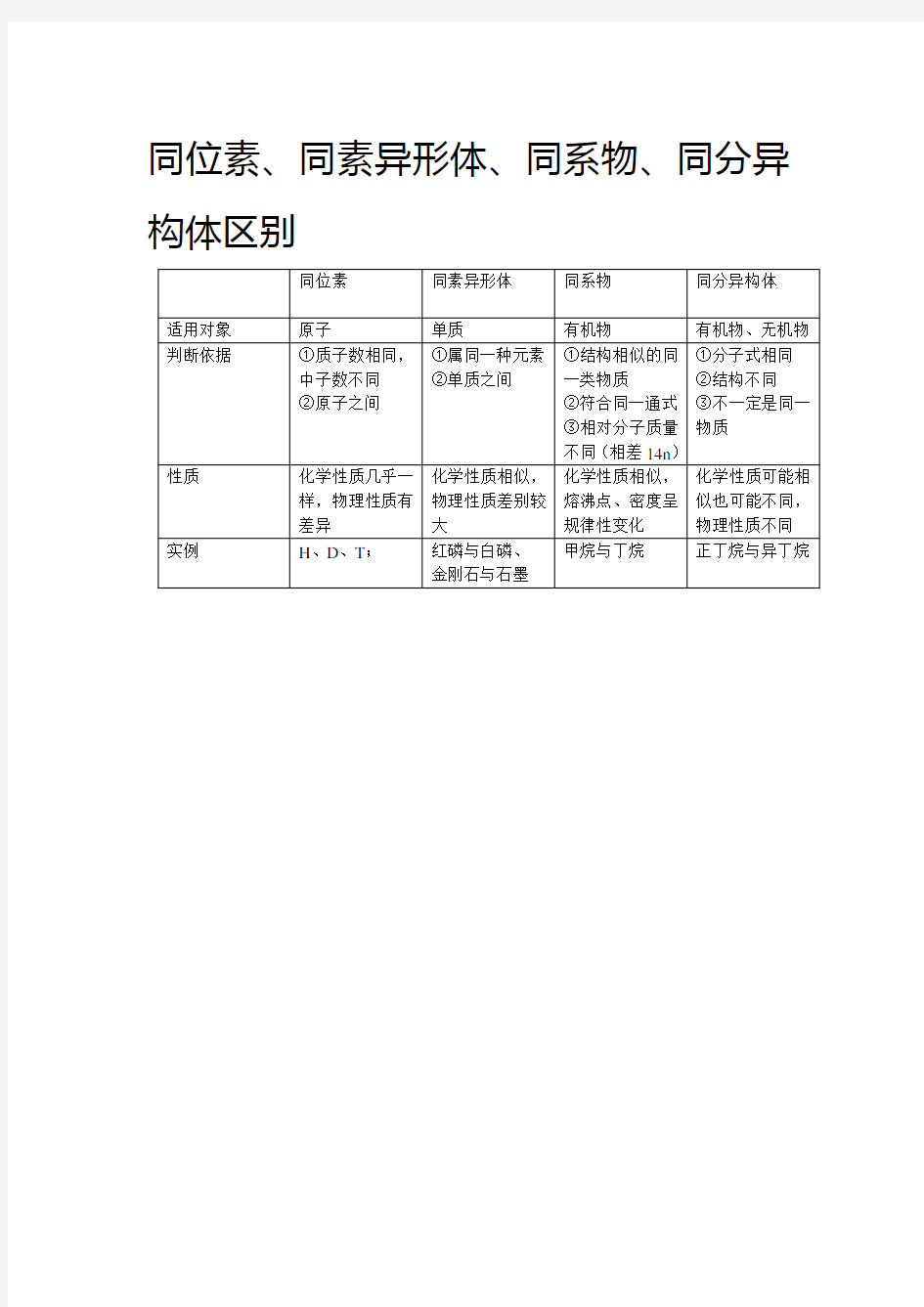
同位素同素异形体同系物同分异构体适用对象原子单质有机物有机物、无机物
判断依据①质子数相同,
中子数不同
②原子之间①属同一种元素
②单质之间
①结构相似的同
一类物质
②符合同一通式
③相对分子质量
不同(相差14n)
①分子式相同
②结构不同
③不一定是同一
物质
性质化学性质几乎一
样,物理性质有
差异化学性质相似,
物理性质差别较
大
化学性质相似,
熔沸点、密度呈
规律性变化
化学性质可能相
似也可能不同,
物理性质不同
实例H、D、T;红磷与白磷、
金刚石与石墨
甲烷与丁烷正丁烷与异丁烷
同系物同分异构体练习题
同系物同分异构体练习 题 SANY标准化小组 #QS8QHH-HHGX8Q8-GNHHJ8-HHMHGN#
1.下列化学式中,只表示一种纯净物的是 ( B ) A .C B . C 3H 8 C .C 2H 4O D .C 3H 6 2.当今化学界关注的热点之一的C 60,它可以看成是金刚石的 ( A ) A .同素异形体 B .同分异构体 C .同位素 D .同系物 3.下列各组物质中互为同分异构体的是 ( D ) A .1H 与2H B .O 2与O 3 C .乙烯与丙烯 D .正丁烷与异丁烷 4.下列各组物质中一定互为同系物的是 ( A ) A .CH 4、C 3H 8 B . C 2H 4、C 3H 6 C . C 2H 2、C 6H 6 D . C 2H 2、C 6H 6 5.下列各组物质中,互为同系物的是 ( ) A — OH 与— CH 3 B . HCOOCH 3 与CH 3COOH C —2CH 3—CH=CH 2 D .C 6H 5OH 与C 6H 5CH 2OH 61种一氯代物,该烃的分子式可以是(C ) A .C 3H 8 B .C 4H 10 C .C 5H 12 D .C 6H 14 7、位上有—C 4H 94种异构体 CH 3CH 2CH 2CH 2—NH 2、(CH 3)2CHCH 2—NH 2、 、 ; 8、某有机物与H 2按1:1物质的量比加成后生成的产物结构为: CH 3 CH 3—CH —CH 2—CH —C —CH 2—CH 3 OH CH 3 OH 则该有机物可能的结构有( 5 )种(说明 羟基与碳碳双双键的结构不稳定)。 9、对复杂的有机物的结构,可以用“键线式”简化表示。如有机物CH 2=CH —CHO 可以简写成 C H 2O 。则与键线式为O CH 3 的物质互为同分 异构体的是 () A —OCH 2CH 3 B C ——CH 3 10C 8H 8CCl 4溶液褪色;它的分子中碳环 上的1个氢原子被氯取代后的有机生成物只有一种。这种环状化合物可能是 ( C )
同分异构体和同系物专题
同系物和同分异构体 【考纲要求】 1.搞清同系物、同分异构体的概念;把握两者的判断标准;认识并掌握同系物、同分异构体的特点和一般规律。 2.了解有机物化合物数目众多和同分异构现象普遍存在的本质原因。 理解同分异构、同系物等概念,能够辨认同分异构体、同系物,能够书写、补写同分异构体及同分异构体种。 【知识要点讲解】 一、同系物、 1.同系物定义:结构相似,在分子组成上相差一个或若干个“CH2” 原子团的化合物的互称。 注明:结构相似,就是所含官能团的种类和数目完全相同。即属于 同类物质。因此:通式相同,化学性质相似,物理性质不同,最简 式不一定相同。 例1.下列各组物质,其中属于同系物关系的是: (1)乙烯和苯乙烯(2)丙烯酸和油酸(3)乙醇和丙二醇(4) 丁二烯与异戊二烯(5)蔗糖与麦芽糖 A.(1)(3)(5) B.(2)(4) C.(1)(2)(4)(5) D.(1)(2)(4)二.同分异构体 1、同分异构体的概念: 凡分子式相同,但分子结构不同的化合物互称同分异构体。同分异构体可以属于同一类物质,也可以属于不同类物质。可以是有机物,也可以是无机物。 例2.下列各组物质中,两者互为同分异构体的是:() ①CuSO4·3H2O和CuSO4·5H2O ②NH4CNO和CO(NH2)2 ③C2H5NO2和NH2CH2COOH④[Pt(H2O)4]Cl3和[Pt(H2O)2Cl2]·2H2O·Cl A.①②③B.②③④C.②③D.③④ 2、同分异构体的书写规律:
(1)碳链异构(2)位置(官能团位置)异构(3)类别异构(又称官能团异 构) 类别异构的常见情况 烯烃——环烷烃炔烃——二烯烃 苯及苯的同系物——多烯饱和一元醇和醚 酚类——芳香醇——芳香醚醛——酮——烯醇 羧酸——酯——羟基醛硝基化合物——氨基酸 葡萄糖——果糖蔗糖——麦芽糖 三、【易错指津】 1.缺乏空间感受,导致同分异构体的重复计数。 如:二氯甲烷误认为有同分异构体。 2.向缺乏“等效变换”的观念,不会巧断异构体数目。 如:由二氯苯(C6H4Cl2)的同分异构体有3种,即可推知四氯苯(C6H Cl4)的同分异构体也必有3种(4个H原子与4个Cl原子的“等效变2 换”)。 3.判断同系物要点: ①同系物通式一定相同。 ②通式相同不一定是同系物。 ③同系物组成元素种类必须相同。 ④同系物是结构相似,不是相同,如CH3CH2CH3和(CH3)4C前者无支 链,后者有支链能互称同系物(结构相似不一定完全相同)。 ⑤在分子组成上必须相差一个或几个CH2原子团,但通式相同组成上相 差若干个CH2原子团不一定是同系物,如CH3CH2Br和CH3CH2CH2Cl都是卤代烃,且结构相差一个CH2原子团不是同系物。 例3:含碳原子个数为10或小于10的烷烃中,其一卤代烷烃不存在同分异构体的烷烃共有( ) A. 2种 B. 3种 C. 4种 D. 5种 例4:萘分子中有两个氢原子分别被溴原子取代后所形成的化合物的数目有( ) A. 5 B. 7 C. 8 D. 10
同系物及同分异构体知识规律总结
同系物及同分异构体知识规律总结 一、同系物的判断规律 1.一差(分子组成差若干个CH2) 2.两同(同通式,同结构) 3.三注意 (1)必为同一类物质; (2)结构相似(即有相似的原子连接方式或相同的官能团种类 和数目); (3)同系物间物理性不同化学性相似。 因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物。 二、同分异构体的种类 1.碳链异构 2.位置异构 3.官能团异构(类别异构) 常见的类别异构(详写下表)
常见的类别异构 与 与CH2=CHCH=CH CH3COOH、HCOOCH3与 CH3CH2—NO
三、同分异构体的书写规律 1.主链由长到短,支链由整到散,位置由心到边,排列由对到邻到间。 2.按照碳链异构→位置异构→官能团异构的顺序书写,也可按官能团异构→碳链异构→位置异构顺序书写,不管按哪种方法书写都必须防止漏写和重写。 四、同分异构体数目的判断方法 1.记忆法记住已掌握的常见的异构体数。例如: (1)凡只含一个碳原子的分子均无异构;甲烷、乙烷、新戊烷(看作CH4的四甲基取代物),2,2,3,3-四甲基丁烷(看作乙烷的六甲基取代物)、苯、环己烷、C2H2、C2H4等分子的一卤代物只有一种; (2)丁烷、丁炔、丙基、丙醇有2种; (3)戊烷、丁烯有3种; (4)丁基、C8H10(芳烃)有4种; (5)己烷、C7H8O(含苯环)有5种; 2.基元法例如:丁基有4种,丁醇、丁醛都有4种 3.替代法例如:二氯苯C6H4Cl2有3种,四氯苯也为3种(将H 替代Cl);又如:CH4的一氯代物只有一种,新戊烷C(CH3)4的一氯代物也只有一种。 4.对称法(又称等效氢法)等效氢法的判断可按下列有三点进行:(1)同一碳原子上的氢原子是等效的;
同位素、同素异形体、同系物、同分异构体和同种物质的比较练习题
同位素、同素异形体、同系物、同分异构体和同种物质的比较同位素同素异形体同系物同分异构体 定义质子数相同,中子数不 同的原子(核素) 由同一种元素组成 的不同单质 结构相似,分子组 成相差一个或若 干个CH2基团的物 质 分子式相同,结 构不同的化合 物 对象原子单质有机化合物化合物(有机、 无机) 化学式元素符号表示不同 元素符号表示相 同,分子式可以不 同 不同相同 结构电子层结构相同,原子 核结构不同 单质的组成或结构 不同 相似不同 性质物理性质不同,化学性 质相同 物理性质不同,化 学性质相同 物理性质不同,化 学性质相似 物理性质不同, 化学性质不一 定相同 举例、、 或H、D、T O2和O3、金刚石和 石墨、红磷和白磷 注意:H2和D2不是 甲烷和正戊烷 甲烷和新戊烷 正戊烷、异戊 烷、新戊烷 强化练习: 1、有下列各组微粒或物物质 A、O 2和O 3 B、C和 C C、CH 3 CH 2 CH 2 CH 3 和 CH 3 CH 2 CH(CH 3 ) CH 3 D、Cl—CH 2—Cl和H—CCl 2 —H E、CH 3 CH 2 CH 2 CH 3 和CH 3 —CH(CH 3 )—CH 3 (1)组两种微粒互为同位素;(2)组两种物质互为同素异形体;(3)组两种物质属于同系物;(4)组两物质互为同分异构体;(5)组两物质是同一物质。
2、在热核反应中没有中子辐射,作为能源时不会污染环境。月球上 的储量足够人类使用1000年,地球上含量很少。和两者互为() A.同素异形体B.同位素C.同系物D.同分异构体 3、美国和墨西哥研究人员将普通纳米银微粒分散到纳米泡沫碳(碳的第五种单质形态)中,得到不同形状的纳米银微粒,该纳米银微粒能有效杀死艾滋病病毒(HIV-1)。纳米泡沫碳与金刚石的关系是() A.同素异形体 B.同分异构体 C.同系物 D.同位素 4.下列各对物质中属于同分异构体的是()。 A.C与 C B.O 2与O 3 5.下列各组物质中一定互为同系物的是()。 A.C 3H 8 、C 8 H 18 B. C 2 H 4 、C 3 H 6 C. C 2 H 2 、C 6 H 6 D. C 8 H 10 、C 6 H 6
同系物和同分异构体
专题三同系物和同分异构体 考纲要求: 1、了解同分异构现象普遍存在的本质原因。 2、掌握同分异构和同系物的概念,会辨认同系物和列举同分异构体。 知识点: 一、同系物: 1、定义: 2、同系物的判断规律 (1)一差(分子组成差一个或若干个CH2); (2)二同(同通式,同结构); (3)三注意:①必为同一类物质 ②结构相似(有相似的原子连接方式或相同的官能团种类和数目) ③同系物间物理性质不同,化学性质相似,因此,具有相同通式的有机物除烷 烃外都不能确定是不是同系物。 二、同分异构体 1 概念辩析(同分异构、同一种物质、同系物) 同分异构:化合物具有相同的分子式,但结构不同的现象称为同分异构现象。具有同分异构现象的化合物互称为同分异构体。在中学阶段,引起同分异构的原因主要有三种:碳架异构、位置异构和官能团异构。识别两者是否是同分异构体,首先要查碳原子数,判别分子式是否相同,然后再看结构式。在分子式相同的情况下,若结构不同,则两者必为同分异构体。 同一种物质:两者不仅分子式相同,而且结构也完全相同,则为同一种物质。同一种物质应具有相同的物理参数,如有相同的熔沸点。判断两结构是否相同方法有二:(1)将分子整体翻转或沿对称要素(面、线)旋转后能“重合”者;(2)用系统命名法命名,所得名称相同者。 同系物:结构相似,在分子组成上相差一个或几个CH2原子团的物质互称同系物。结构相似是指分子中含有官能团的种类和数目都要相同。如乙醇与丙醇为同系物,但乙二醇与丙三醇就不属同系物了。 若已知两结构式要判断它们是否具有相同的分子式,数不饱和度要比数氢原子数目快捷得多。在C、O、N、Cl等原子数对应相同的前提下,不饱和度相同的,分子式一定相同。如: Cl HO Cl O 两者C、O、Cl原子数相同,不饱度都是4,所以两结构式具有相同的分子式。而结构显然不同,因此两者应为同分异构体。 对于稠环芳香烃利用公用边数目来确定两个已知结构式的关系则很方便。在苯环数相同的前提下,若公用边数相同,且各苯环排列顺序又相同,则两者表示的是同一种物质;若公用边数相同,且各苯环排列顺序不相同,则两者表示的是同分异构体;若公用边数不同,则两者即不是同分异构体,也不是同一物物质。 [练1-1]下列4式表示的是棉子象鼻虫的四种的信息素的结构简式,其中互为同分异构体是(③④)
同位素同素异形体同系物同分异构体和同种物质的比较概念辨析
同位素同素异形体同系物同分异构体和同种物质的比较概念辨析 化学基本概念反映化学物质的本质属性,是化学的基础。明确概念的涵与外延,是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。同位素、同素异形体、同系物、同分异构体和同一种物质等化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别加以详细的说明。 对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同: 同位素同素异形体同系物同分异构体 定义质子数相同,中子数不同 的原子(核素) 由同一种元素组成的 不同单质 结构相似,分子组成 相差一个或若干个 CH2基团的物质 分子式相同,结构 不同的化合物 对象原子单质化合物化合物 化学式元素符号表示不同,如 、、 元素符号表示相同, 分子式可以不同,如 O2和O3 不同相同 结构电子层结构相同,原子核 结构不同 单质的组成或结构不 同 相似不同 性质物理性质不同,化学性质 相同 物理性质不同,化学 性质相同 物理性质不同,化学 性质相似 物理性质不同,化 学性质不一定相 同 说明: 1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数 不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。 2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。 同素异形体的形成方式有三种: (1)组成分子的原子数目不同,例如:O2和O3。 (2)晶格中原子的排列方式不同,例如:金刚石和石墨。 (3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。 注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同 素异形体。
同系物及同分异构体
同系物及同分异构体 教学目标 知识技能:通过同系物和同分异构体的专题复习,巩固同系物和同分异构体的概念、书写、判断、确定等;了解同系物化学性质的相似性及物理性质的递变性,了解同分异构体的较常见的题型。 能力培养:培养学生认真审题、有序思维、准确判断推理的能力,培养学生对“信息知识”的自学能力。 科学思想:学会多层面、多角度地分析和看待问题;形成尊重事实、尊重科学的学风。 科学品质:对学生进行严谨求实、认真仔细的科学态度教育;强化参与活动的乐趣及获得成功的体验。 科学方法:感性认识与理性认识相互转化,透过现象抓本质的方法。 重点、难点同系物判断,同分异构体的辨析能力。 教学过程设计 教师活动 【引言】本节课我们重点复习有机化学的同系物、同分异构体的有关内容。 【板书】有机化学同系物、同分异构体专题复习 一、同系物、同分异构体的概念 【设问】1.中学阶段我们已学习过的涉及“同”字的概念主要有哪几个? 2.同学们能否设计一个表格或方案将这几个概念所涉及的有关内容进行比较?请同学们思考并设计。 学生活动
明确复习重点。 做笔记、思考。 回忆、思考、发言。 回答:(1)含“同”的概念主要有四个:同位素、同素异形体、同系物、同分异构体。 方案之一: 指导学生: 1.用实物投影仪展示学生们的设计方案。 2.展示经大家补充修改的方案。 【讲述】同学们根据方案的要求将表格中的各项内容自己整理进行复习。 【提示】这部分内容课前已布置预习作业。
指导学生: 1.完成表格中的各项内容达到复习巩固的目的。 2.及时订正学生回答中的不准确内容,或找学生评价或订正相关内容。 【讲述】本节课的复习重点是同系物和同分异构体,现就这两个概念我们进一步深入进行讨论。 【讲述】首先我们就“同系物”的有关内容讨论下列问题。请同学们分小组讨论5min 并推荐代表发言。
最新同系物及同分异构体
同系物及同分异构体
同系物及同分异构体 教学目标 知识技能:通过同系物和同分异构体的专题复习,巩固同系物和同分异构体的概念、书写、判断、确定等;了解同系物化学性质的相似性及物理性质的递变性,了解同分异构体的较常见的题型。 能力培养:培养学生认真审题、有序思维、准确判断推理的能力,培养学生对“信息知识”的自学能力。 科学思想:学会多层面、多角度地分析和看待问题;形成尊重事实、尊重科学的学风。 科学品质:对学生进行严谨求实、认真仔细的科学态度教育;强化参与活动的乐趣及获得成功的体验。 科学方法:感性认识与理性认识相互转化,透过现象抓本质的方法。 重点、难点同系物判断,同分异构体的辨析能力。 教学过程设计 仅供学习与交流,如有侵权请联系网站删除谢谢23
教师活动 【引言】本节课我们重点复习有机化学的同系物、同分异构体的有关内容。 【板书】有机化学同系物、同分异构体专题复习 一、同系物、同分异构体的概念 【设问】1.中学阶段我们已学习过的涉及“同”字的概念主要有哪几个? 2.同学们能否设计一个表格或方案将这几个概念所涉及的有关内容进行比较?请同学们思考并设计。 学生活动 明确复习重点。 做笔记、思考。 回忆、思考、发言。 回答:(1)含“同”的概念主要有四个:同位素、同素异形体、同系物、同分异构体。 方案之一: 仅供学习与交流,如有侵权请联系网站删除谢谢23
指导学生: 1.用实物投影仪展示学生们的设计方案。 2.展示经大家补充修改的方案。 【讲述】同学们根据方案的要求将表格中的各项内容自己整理进行复习。 【提示】这部分内容课前已布置预习作业。 仅供学习与交流,如有侵权请联系网站删除谢谢23
高中化学专题同系物与同分异构体
专题十三:同系物及同分异构体 班级姓名学号 【专题目标】 1.了解有机化合物数目众多和异构现象普遍存在的本质原因,碳原子彼此连接的可能形式; 2.理解同系列及同分异构的概念; 3.能够识别结构简式中各原子的连接次序和方式; 4.能够辨认同系物和列举异构体。 【知识规律总结】 一、同系物的判断规律 1.一差(分子组成差一个或若干个CH2) 2.二同(同通式,同结构) 3.三注意 (1)必为同一类物质 (2)结构相似(有相似的原子连接方式或相同的官能团种类和数目) (3)同系物间物理性质不同化学性质相同 因此,具有相同通式的有机物除烷烃外都不能确定是不是同系物。 二、同分异构体的种类 1.碳链异构 2.位置异构 三、同分异构体的书写规律
1.主链由长到短,支链由大到小,位置由心到边,排列由对到邻到间 2.按照碳链异构位置异构官能团异构的顺序书写,也可按照官能团异构碳链异构位置异构的顺序书写,不管按照那种方法书写都必须防止漏写和从写 四、分异构体数目的判断方法 1.记忆法记住已掌握的常见的异构体数。例如: (1)凡只含一个碳原子的分子均无异构,甲烷、乙烷、新戊烷(看作CH4的四甲基取代物)、2,2,3,3—四甲基丁烷(看作乙烷的六甲基取代物)、苯、 环己烷、乙炔、乙烯等分子一卤代物只有一种; (2)丁烷、丁炔、丙基、丙醇有2种; (3)戊烷、丁烯、戊炔有3种; (4)丁基C8H10有4种; (5)己烷、C7H8O(含苯环)有5种; (6)戊基、C9H12有8种; 2.基元法例如:丁基有4种,丁醇、丁醛都有4种; 3.替元法例如:C6H4Cl2有3种,C6H2Cl4有3种(将H替代Cl); 4.对称法(又称等效氢法)判断方法如下: (1)同一C 原子上的氢原子是等效 (2)同一C 原子所连甲基上的氢原子是等效氯 (3)处于镜面对称位置上的氢原子是等效 【经典题型】 题型一:确定异构体的数目 例1 某烃的一种同分异构只能生成1种一氯代物,该烃的分子式可以是()A.C3H8B.C4H10C.C5H12D.C6H14 解析:分析C3H8、C4H10、、C6H14各种结构,生成的一氯代物不只1种。从CH4、C2H6的一氯代物只有1种,得出正确答案为C。 题型二:列举同分异构的结构 例 2 液晶是一种新型材料。MBBA是一种研究得较多的液晶化合物。它可以看作是由醛A和胺B去水缩合的产物。 CH32CH2CH2CH3(MBBA) CH32CH2CH2CH3 醛A 胺 (1)位上有—C4H9的苯胺可能有4种异构体,它们是: CH3CH2CH2CH2NH2、(CH3)2CHCH2—NH2、、;
同系物与同分异构体
同系物与同分异构体 一、同系物 1.概念:结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物。 结构相似是指必须是同类物质,即有机物官能团的种类 ..要.相同;组成上相差一个或若干个 ..和个数 CH2原子团是指其通式必须相同。只有同时具备二条件的有机物才互为同系物。 2.同系物的判断方法 判断有机物是否是同系物需要注意以下三点: a、同系物必须符合同一通式 ...........,但通式相同的不一定是同系物,如有机物的同分异构体均不是同系物。 b、同系物结构一定相似, ..........但结构相似的不一定是同系物,如有机物的碳链异构和位置异构体。 c、同系物的分子组成上相差一个或若干个“ ...,.例如苯酚与苯甲醇在分子组成上相差一个..................CH..2.”.原子团 “CH2”原子团,但它们不是同一类物质,所以也不是同系物。 二、同分异构现象及同分异构体 1.概念:具有相同的分子式而又具有不同结构的化合物互称为同分异构体。 2.同分异构体的特点: (1)同分异构体具有相同的分子式、相同的最简式、相同的式量和相同的元素组成。分子式相同是前提条件。 (2)结构不同指的是:①碳链骨架不同;②官能团在碳链上的位置不同;③官能团的种类不同。 同分异构体也存在于无机物和有机物之间,无机物与无机物之间(了解即可)。如:尿素CO(NH2)2和氰酸铵NH4CNO互为同分异构体。 3.同分异构体的书写 同分异构体的书写通常是按碳链异构→位置异构→类别异构的顺序书写,若不按一定的顺序书写容易漏写和重写,如写分子式为C5H10的同分异构体。 ⑴碳链异构: ①CH2==CHCH2CH2CH3 1—戊烯 ②CH2==C(CH3)CH2CH3 2—甲基—1—丁烯 ③CH2==CHCH(CH3)CH3 3—甲基—1—丁烯 ⑵位置异构: ①CH3CH==CHCH2CH3 2—戊烯 ②(CH3)2C==CHCH3 2—甲基—2—丁烯 ⑶类别异构: ①环戊烷②甲基环丁烷③1,1—二甲基环丙烷④1,2—二甲基环丙烷⑤乙基环丙烷 碳链异构3种,位置异构2种,类别异构5种,总共十种。 4、同分异构体的种类: ⑴碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。如C5H12有三种同分异构体, 即正戊烷、异戊烷和新戊烷。 ⑵位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。如1—丁烯与2—丁烯、1—丙 醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。 ⑶异类异构:指官能团不同而造成的异构,也叫官能团异构。如1—丁炔与1,3—丁二烯、丙烯与环 丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。 ⑷其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中 屡有涉及。 5、各类有机物异构体情况: ⑴ C n H2n+2:只能是烷烃,而且只有碳链异构。如CH3(CH2)3CH3、CH3CH(CH3)CH2CH3、C(CH3)4
高中化学 同位素 同素异形体 同系物 同分异构体和同种物质的比较概念辨析 新人教版
(概念辩析)同位素、同素异形体、同系物、同分异构体和同种物质的 比较 。同位素、同素异形体、同系物和同分异构体的比较 化学基本概念反映化学物质的本质属性,是化学的基础。明确概念的内涵与外延, 是正确把握知识的要素,也是正确判断和推理的基础,因此在概念的教学中,让学生掌握、运用概念,尤为重要。同位素、同素异形体、同系物、同分异构体和同一种物质等 化学中几个经常用到的概念,也是一些同学经常混淆的概念,下面就这几个概念的区别 加以详细的说明。 对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同: 同位素同素异形体同系物同分异构体 定义质子数相同,中子数不 同的原子(核素) 由同一种元素组成 的不同单质 结构相似,分子组 成相差一个或若 干个CH2基团的物 质 分子式相同,结 构不同的化合 物 对象原子单质化合物化合物 化学式元素符号表示不同,如 、、 元素符号表示相 同,分子式可以不 同,如O2和O3 不同相同 结构电子层结构相同,原子 核结构不同 单质的组成或结构 不同 相似不同 性质物理性质不同,化学性 质相同 物理性质不同,化 学性质相同 物理性质不同,化 学性质相似 物理性质不同, 化学性质不一 定相同 说明: 1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。 2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。如金刚石和石墨的导电性、硬度均不同,虽
同系物同分异构体专题
同系物同分异构体专题 [复习要点] 1.有机化合物种类繁多的缘故。 2.有机化合物的命名。 3.同系物的判定规律:两同、一差、两注意 4.同分异构体 (1)含义 (2)种类——碳链异构、官能团位置异构、物类异构 (3)书写规律 [方法指导] 1.同分异构体的书写 试题特点:限制一定条件,在限定的范畴内书写或补写几种同分异构体 解题思路:第一明确限定范畴,然后在所限定范畴内按官能团异构——碳链异构——位置异构的顺序书写或补写,也可通过分析已知的几个同分异构体的结构特点找出规律补写所缺的种类。 例1、已知某有机物分子中含有2个—CH3,1个—CH2—,2个—CH—,2个—OH,该有机物可能有,分别写出它们的结构简式。 例2、液晶是一种新型材料,A和胺B :CH3O CH=N)3CH3 醛A :CH3O CHO 胺B:CH3NH2 (1)对位上有—C4H9的苯胺可能有4CH3 (CH2)3NH2 , (CH3)2CH CH2NH2 , , 。(2)醛6种,它们 COOCH3OOCCH3,HCOO CH3,HCOO 3 , 2.判定是否同分异构体 试题特点:给出几种有机物的结构简式,分析每组物质的结构特点,判定是否为同分异构体。 解题思路:先看分子式相同,再看结构不同。注意考虑:a.原子或原子团连接顺序 b.原子的空间排列形状c.辨别是否为同一种物质。 例3、下列物质为同分异构体的一组是()
F Cl A.Cl—C—Cl ,Cl—C—F B.CH3CH2NO2,H2N—CH2—COOH F F CH3 C.[ CH—CH2 ] n , [ CH—CH] n D.CH3CH2C(CH3)2CH2CH3 , CH3CH2—C—CH3 C2H5CH3 CH32H5 例4、已知乙烯分子平面构型,1,2—二氯乙烯有两种不同的空间结构(如下图所示),下列物质能形成上述空间异构体的是()Cl H Cl Cl A . 1,1—二氯乙烯 B . 丙烯C= C C=C C . 2—丁烯 D . 1—丁烯H Cl H H 3.同分异构体种类的确定 试题特点:一是已知有机物结构确定取代产物的同分异构体种类,二是已知某物质某种取代物异构体数来确定其另一种取代物种数 解题方法:一数分析有机物结构特点,确定不同位置H原子种数再确定取代产物数目,二是找出取代物H原子数与取代基团关系,不必写出异构体 例5、(1)萘)分子中的两个氢原子分别被溴取代,所形成化合物的数目有种。 (2)萘分子中的两个氢原子分别被—X,—Y取代后,可能生成种不同结构的有机物。 例6.(1)已知A为,苯环上的二溴代物有9种。A分子苯环上的四溴代物有种; 3 (2)已知丁基(—C4H9)共有4种,不必试写即可判定分子式为C5H10O的醛有种。4.由加成产物确定原不饱和有机物同分异构体数目 例7、某有机物与H2加成按1:1进行,其产物是CH3CHCH2CH(CH3)C(CH3)CH2CH3,则该有机物可能的结构有种。OH OH [巩固训练] 1.某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式能够是……………………()A. C3H8 B. C4H10 C.C5H22 D.C6H14 2.邻甲基苯甲酸有多种同分异构体,其中属于酯类且结构中含有苯环的同分异构体有几种()A. 3 B . 4 C . 5 D . 6 3.甲苯苯环上的H原子被式量为43的烃基取代,所得的一元取代物有几种………………()A. 1 B . 3 C . 4 D . 6 4.C6H14的各种同分异构体中,所含甲基数目和它的一氯取代物的数目与下列叙述相符的是()A. 2个-CH3,能生成4种一氯代物 B . 3个-CH3,能生成4种一氯代物 C . 3个-CH3,能生成5种一氯代物 D . 4个-CH3,能生成4种一氯代物 5. () ①CH2—CH3 ②③CH3 CH3 ④CH3 CH2=—CH—CH—CH3CH3—CH—CH—CH—CH3 CH3 CH3 3 CH32—CH3 A. ①② B . ②③ C . ③④ D . ①④ 6.分子式为C4H8O2的某有机物分子中含有一个羰基和一个羟基(—OH),此有机物既能发生银镜
同系物和同分异构体教案
同系物和同分异构体 1、互为同分异构体的物质不可能 ( ) A、具有相同的相对分子质量 B、具有相同的结构 C、具有相同的通式 D、具有相同的分子式 2.下列化学式中,只表示一种纯净物的是() A、C 3 H 6 B、C 3 H 8 C、C 7 H 8 D、C 2 H 4 O 2 3.下列各组物质中,互为同系物的是() A —OH—CH 3 B、HCOOCH 3 与CH 3 COOC 3 H 7 C—CH=CH 2 与CH 3 —CH=CH 2 D、C 6 H 5 OH与C 6 H 5 CH 2 OH 4.下列各组物质中一定互为同系物的是() A.C 3 H 8 、C 8 H 18 B. C 2 H 4 、C 3 H 6 C. C 2 H 2 、C 6 H 6 D. C 8 H 10 、C 6 H 6 5、下列说法正确的是() A、戊烷有2种同分异构体 B、C 4 H 8 只有3种属于烯烃的同分异构体 C、C 4 H 9 Cl有5种同分异构体 D、C 8 H 10 中只有三种属于芳香烃的同分异构体 6、主链含5个碳原子,有甲基、乙基2个支链的烷烃有() A. 2种 B. 3种 C. 4种 D. 5种 7、某烃的一种同分异构只能生成1种一氯代物,该烃的分子式可以是() A.C 3 H 8 B.C 4 H 10 C.C 5 H 12 D.C 6 H 14 8、与互为同分异构体的芳香族化合物最多有() A、3 C、5种D、6种 9、蒽的一氯取代物其同分异构体的种类有() A、 2种 B、 3种 C、 4种 D、 5种 10、对复杂的有机物的结构,可以用“键线式”简化表示。如有机物CH 2 =CH—CHO ,可以简写成C H2。则与键线式为 O CH3 的物质互为同分异构体的是() A—OCH 2 CH 3 —CHO C—COOH D—CH 3
高考化学一轮复习 同系物及同分异构体教学案
"高考化学一轮复习同系物及同分异构体教学案" 教学目标 知识技能:通过同系物和同分异构体的专题复习,巩固同系物和同分异构体的概念、书写、判断、确定等;了解同系物化学性质的相似性及物理性质的递变性,了解同分异构体的较常见的题型。 能力培养:培养学生认真审题、有序思维、准确判断推理的能力,培养学生对“信息知识”的自学能力。 科学思想:学会多层面、多角度地分析和看待问题;形成尊重事实、尊重科学的学风。 科学品质:对学生进行严谨求实、认真仔细的科学态度教育;强化参与活动的乐趣及获得成功的体验。 科学方法:感性认识与理性认识相互转化,透过现象抓本质的方法。 重点、难点同系物判断,同分异构体的辨析能力。 教学过程设计 教师活动 【引言】本节课我们重点复习有机化学的同系物、同分异构体的有关内容。 【板书】有机化学同系物、同分异构体专题复习 一、同系物、同分异构体的概念 【设问】1.中学阶段我们已学习过的涉及“同”字的概念主要有哪几个? 2.同学们能否设计一个表格或方案将这几个概念所涉及的有关内容进行比较?请同学们思考并设计。 学生活动 明确复习重点。 做笔记、思考。 回忆、思考、发言。
方案之一: 指导学生: 1.用实物投影仪展示学生们的设计方案。 2.展示经大家补充修改的方案。 【讲述】同学们根据方案的要求将表格中的各项内容自己整理进行复习。【提示】这部分内容课前已布置预习作业。
指导学生: 1.完成表格中的各项内容达到复习巩固的目的。 2.及时订正学生回答中的不准确内容,或找学生评价或订正相关内容。 【讲述】本节课的复习重点是同系物和同分异构体,现就这两个概念我们进一步深入进行讨论。 【讲述】首先我们就“同系物”的有关内容讨论下列问题。请同学们分小组讨论5min 并推荐代表发言。 【投影】 讨论题: 1.同系物是否必须符合同一通式?举例说明。
同系物和同分异构体
课题: 同系物和同分异构体 【考纲要求】 1. 掌握有机同分异构体的概念并能书写简单的同分异构体。 2. 能区分同位素、同分异构体、同系物、同素异形体。 【教学过程】 一.同分异构体: (一)有机物种类繁多的原因 1.有机化合物分子中都含有碳原子,碳原子的最外层有 电子,可以与其它原子形成 共价键。 2.碳原子还可以 形成构成碳链或碳环。 3.碳原子可以形成单键或 键或 键。 (二)有机化合物的同分异构现象和同分异构体。 1同分异构现象:化合物具有相同的 ,但 不同,因而产生了 上的差异的现象。 2同分异体: 。 3同分异构体的类别: (1) 。 (2) 。 (3) 。 二.同系物: 1.同系物概念: 。 2.同分异构体: 。 3.同位素: 。 4.同素异形体: 。 【典型例题】 例1 下列各对物质中属于同分异构体的是( ) 例2 1,2,3- 是苯基,环用键线表示, C 、H 原子都未画出
个异构体: 据此,可判断1,2,3,4,5-五氯环戊烷(假定五个碳原子也处于同一平面上)的异构体数目是( ) A.4 B.5 C.6 D.7 例3 化合物丙由如下反应: 其不意 得到丙的 结构简式不可能的是( ) A.CH 3CH 2CHBrCH 2Br B.CH 3CH(CH 2Br)2 C.CH 3CHBrCHBrCH 3 D.(CH 3)2CBrCH 2Br 例4 某烃的一种同分异构体只能生成一种一氯代物,该烃的分子式可以是( ) A.C 3H 8 B.C 4H 10 C.C 5H 12 D.C 6H 14 例 5 用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为( ) A.3 B.4 C.5 D.6 例6 烷基取代苯(C 6H 5-R )可以被KMnO 4的酸性溶液氧化成(C 6H 5COOH )。但若烷基R 中直接与苯环连接的碳原子上没有C —H 键,则不容易被氧化得到,现有分子式是C 11H 16的一烷基取代苯,已知它可以被氧化为苯甲酸的异构体有7种,其中的3种是: 请写出其他四种的结构简式: , , , 。 例7 如果定义有机物的同系列是一系列的结构式符合A[W]n B(其中n =0,1,2,3…)的化合物)。式中A 、B 是任意一种基团(或氢原子),W 为2价的有机基团,又称为该同系列的系差。同系列化合物的性质往往呈现规律性的变化。下列四种化合物中,不可..称为同系列的是( ) A .CH 3CH 2CH 2CH 3 CH 3CH 2CH 2CH 2CH 3 CH 3CH 2CH 2CH 2CH 2CH 3 B .CH 3CH=CHCHO CH 3CH=CHCH=CHCHO CH 3(CH=CH)3CHO C .CH 3CH 2CH 3 CH 3CHClCH 2CH 3 CH 3CHClCH 2CHClCH 3 D .ClCH 2CHClCCl 3 ClCH 2CHClCH 2CHClCCl 3 ClCH 2CHClCH 2CHClCH 2CHClCCl 3 或Al 2O 3,Br 2,CC 丙 乙 C 4H 8Br C 4H 10C 4H H 2SO 4(浓),Δ
浙江省高中化学学考专题练习考点:同位素、同素异形体、同分异构体、同系物
浙江省高中化学专题练习 考点09同位素、同素异形体、同分异构体、同系物1.(浙江202001学考)9.下列说法不正确 ... 的是 A.1H和2H互为同位素B.红磷和白磷互为同素异形体 C.C2H5OH和CH3OCH3互为同分异构体D.C2H2和C6H6互为同系物2.(浙江201906学考)9.下列说法不正确的是 A.12C 和14C 互为同位素 B.甲烷和丁烷互为同系物 C.乙醇和二甲醚互为同分异构体 D.Na2O 和N a2O2 互为同素异形体 3.(浙江201901学考)9.下列说法不正确 ... 的是 A. 16O和18O互为同位素 B. 金刚石和足球烯互为同素异形体 C. C2H6和C3H6互为同系物 D. C2H5OH和CH3OCH3互为同分异构体 4.(浙江201811与201804选考合编)11.下列说法不正确 ... 的是 A.18O和16O是质子数相同的两种核素 B.H C F Cl Cl和 Cl C F Cl H为同一物质 C.CH3CH2CH2CH2CH3和CH3CH2CH CH3 3互为同分异构体 D.CH3CH2OH和CH2CH CH2 具有相同的官能团,互为同系物 5.(浙江201806学考)9.下列说法正确的是 A.1H2和2H2互为同素异形体B.CH3Cl和CH2Cl2互为同系物 C.C60和C70互为同位素D.C2H6和C3H8均不存在同分异构现象6.(浙江201711学考)11.下列说法正确的是 A.18 8 O表示中子数为10的氧元素的一种核素 B.金刚石和石墨互为同素异形体,两者之间不能相互转化
C.CH3COOH和CH3COOCH3互为同系物 D.C6H14的同分异构体有4种,其熔点各不相同 7.(浙江201704学考)11.下列说法正确的是 A.金刚石和石墨互为同分异构体,熔点和硬度都很高 B.氕、氘、氚是氢元素的三种核素,质子数都为1 C.乙醇和二甲醚(CH3—O—CH3)互为同系物 D.C4H10的一氯取代物只有一种 8.(浙江201610学考)11.下列说法不正确的是() A.614C表示质子数为6、中子数为8的核素B.甲醇(CH3OH)和甘油()互为同系物 C.C5H12的同分异构体有3种,其沸点各不相同D.CH3CH2CH2CH(CH3)2的名称是2-甲基戊烷 的是 9.(浙江201604学考)10.下列说法不正确 ... A.126C和146C是同一种核素 B.红磷和白磷互为同素异形体 C.CH3COOCH2CH3和CH3CH2COOCH3是不同种物质 D.CH3CH2OH可以看成是由-C2H5和-OH两种基团组成 的是 10.(浙江201510学考)9.下列说法不正确 ... A.核素2 H的中子数是0 B.12C和14C互为同位素 1 C.金刚石、石墨和富勒烯互为同素异形体D.CH3CH2OH和CH3OCH3互为同分异构体11.下列各组中,互称为同位素的是
人教版高中化学选修5有机化学基础专题训练题(五)同系物及同分异构体(含答案解析)
人教版高中化学选修5有机化学基础专题训练题(五)同系物及同分异构体(含答案解析) 1.下列物质进行一氯取代反应后,只能生成四种沸点不同产物的烃是 A.(CH3)2CHCH2CH2CH3B.(CH3CH2)2CHCH3 C.(CH3)2CHCH(CH3)2D.(CH3)3CCH2CH3 2.某烃的一种同分异构体只能生成一种一氯化物,该烃的分子式可以是 A.C5H12B.C4H10C.C3H8D.C6H14 3.能发生银镜反应,并与丙酸互为同分异构体的是 A.丙醛B.丙酸铵C.甲酸乙酯D.甲酸甲酯 4.相对分子质量为100的烃,主链为5个碳原子的同分异构体有 A.3种B.4种C.5种D.6种 5.分子中有一个氢原子被氯原子取代生成两种同分异构体的是 A.乙烷B.丙烷C.环丙烷D.苯 6.C3H8的分子中有两个氢原子被氯原子取代,可能的同分异构体有 A.3种B.4种C.5种D.6种 7.分子中有3个-CH3的C7H16其可能的结构有 A.3种B.4种C.5种D.6种 8.某苯的衍生物,含有两个互为对位的取代基,其分子式为C8H10O,其中不溶解于NaOH 溶液的该衍生物的结构式有 A.1种B.2种C.3种D.4种 9.已知甲苯的一氯代物有4种,则甲苯与氢气完全加成后的产物的一氯化物应该具有的种类数是 A.2种B.4种C.5种D.7种 10.1-丙醇的蒸气和空气混合,通过灼热的铜网生成一种化合物,和该化合物互为同分异 构体的是 11.已知丁基共有四种.不必试写,立即可断定分子式为C5H10O的醛应有 (A)3种(B)4种(C)5种(D)6种 CH3 H3C 12.已知C12H12的烃分子结构表示为:,它在苯环上的二溴代物有9种,则其环上的四溴代物是种 13.乙醇和甲醚互为同分异构体的下列事实中,最能说明二者结构式不同的是 A.乙醇溶于水,而甲醚不溶于水 B.乙醇跟金属钠反应放出氢气,而甲醚不能 C.甲醚比乙醇更易溶于油脂类物质中 D.把1份乙醇加入6份浓H2SO4,当加热到140℃时,可生成乙醚 根据以下叙述,回答第14和15题 苯并[a]芘是强致癌物质(存在于烟囱灰、煤焦油、燃烧烟草的烟雾和内燃机的尾气中)。它的分子由5个苯环并合而成,其结构可以表示为(I)和(II)式,这两者是等同的。现有结构式(A)-(D),其中
同位素-同素异形体-同系物-同分异构体的异同
张浩祥 对于同位素、同素异形体、同系物和同分异构体这四个概念,学习时应着重从其定义、对象、化学式、结构和性质等方面进行比较,抓住各自的不同点,从而理解和掌握。这几个概念都表明了事物之间的关系,下表列出了比较了它们的异同: 同位素:质子数相同,中子数不同的原子(核素)对象原子 同素异形体:由同一种元素组成的不同单质。对象单质 同系物; 结构相似,分子组成相差一个或若干个CH2基团的物质对象化合物 同分异构体: 分子式相同,结构不同的化合物对象化合物 说明: 1、同位素的对象是原子,在元素周期表上占有同一位置,化学性质基本相同,但原子质量或质量数不同,从而其质谱行为、放射性转变和物理性质(例如在气态下的扩散本领)有所差异。 2、同素异形体的对象是单质,同素异形体的组成元素相同,结构不同,物理性质差异较大,化学性质有相似性,但也有差异。如金刚石和石墨的导电性、硬度均不同,虽都能与氧气反应生成CO2,由于反应的热效应不同,二者的稳定性不同(石墨比金刚石能量低,石墨比金刚石稳定)。同素异形体的形成方式有三种: (1)组成分子的原子数目不同,例如:O2和O3 。 (2)晶格中原子的排列方式不同,例如:金刚石和石墨。 (3)晶格中分子排列的方式不同,例如:正交硫和单斜硫(高中不要求此种)。 注意:同素异形体指的是由同种元素形成的结构不同的单质,如H2和D2的结构相同,不属于同素异形体。 3、同系物的对象是有机化合物,属于同系物的有机物必须结构相似,在有机物的分类中,属于同一类物质,通式相同,化学性质相似,差异是分子式不同,相对分子质量不同,在组成上相差一个或若干个CH2原子团,相对分子质量相差14的整数倍,如分子中含碳原子数不同的烷烃之间就属于同系物。 (1)结构相似指的是组成元素相同,官能团的类别、官能团的数目及连接方式均相同。结构相似不一定是完全相同,如CH3CH2CH3和(CH3)4C,前者无支链,后者有支链,但二者仍为同系物。 (2)通式相同,但通式相同不一定是同系物。例如:乙醇与乙醚它们的通式都是CnH2n+2O,但他们官能团类别不同,不是同系物。又如:乙烯与环丁烷,它们的通式都是CnH2n,但不是同系物。 (3) 在分子组成上必须相差一个或若干个CH2原子团。但分子组成上相差一个或若干个CH2原子团的物质却不一定是同系物,如CH3CH2Br和CH3CH2CH2Cl都是卤代烃,且组成相差一个CH2原子团,但二者不是同系物。 (4)同系物具有相似的化学性质,物理性质有一定的递变规律,如随碳原子个数的增多,同系物的熔、沸点逐渐升高;如果碳原子个数相同,则有支链的熔、沸点低,且支链越对称,熔、沸点越低。如沸点:正戊烷>异戊烷>新戊烷。同系物的密度一般随着碳原子个数的增多而增大。 4、同分异构体的对象是化合物,属于同分异构体的物质必须化学式相同,结构不同,因而性质不同。具有“五同一异”,即同分子式、同最简式、同元素、同相对原子式量、同质量分数、结构不同。属于同分异构体的物质可以是有机物,如正丁烷和异丁烷;可以是有机物和无机物,如氰酸铵和尿素;也可以是无机物,如[Pu(H2O)4]Cl3和[Pu(H2O)2Cl2]·2H2O·Cl。 在有机物中,很多物质都存在同分异构体,中学阶段涉及的同分异构体常见的有以下几类:(1)碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。如C5H12有三种同分
