Fe助剂对Cu_ZrO_2甲醇水蒸气重整制氢催化剂的影响

文章编号:0253-2409(2002)05-0429-04
收稿日期:2002-06-20;修回日期:2002-09-10 基金项目:山西省自然科学基金(20001019)
作者简介:李永红(1965-),女,山西代县人,副研究员,应用化学专业。E -mail:Ree yh @sohu com
Fe 助剂对Cu ZrO 2甲醇水蒸气重整制氢催化剂的影响
李永红,任 杰,孙予罕
(中国科学院山西煤炭化学研究所煤转化国家重点实验室,山西太原 030001)
摘 要:利用XRD 、TPR 和EXAFS 等手段,研究了Fe 助剂对Cu Fe 2O 3 ZrO 2催化剂物化特性的影响,同时研究了对甲醇水蒸气重整反应活性和选择性的影响。结果表明,Fe 对Cu ZrO 2催化剂结构有一定的修饰作用。添加Fe 助剂后,铜的分散度提高,催化剂的起始还原温度提前,还原温度区间缩短;同时甲醇水蒸气重整制氢反应催化活性上升,氢选择性提高,产物中CO 含量降低,但铁铜比应有一最佳值。关键词:甲醇水蒸气;制氢;Fe 助剂;Cu ZrO 2催化剂中图分类号:0643 36 文献标识码:A
在甲醇水蒸气重整制氢的反应中,研究较多的是铜基催化剂,特别是Cu ZnO Al 2O 3催化剂
[1~3]
。
但Cu ZnO Al 2O 3催化剂的热稳定性差,为进一步改善其催化性能,人们主要从两个方面着手[4,5]
:一方面,通过添加助剂以提高热稳定性;另一方面,通过变换制备方式改善催化性能。近年来,ZrO 2作为一种新型催化材料,因其具有良好的热稳定性,而倍受关注。Breena 等人研究发现[6]
,含ZrO 2的Cu ZnO Al 2O 3催化剂对甲醇水蒸气重整制氢反应具有较高的活性和稳定性,同时对其反应机理进行了研究[7]
,认为:在Cu ZnO Zr O 2 Al 2O 3催化剂上,只有甲醇完全转化后,CO 才通过水煤气转换的逆反应而形成。前面已报道了Cu La 2O 3 ZrO 2催化剂用于甲醇水蒸气重整制氢反应中具有较高的反应活性和选择性[8]
。本文利用XRD 、TPR 、EXAFS 等手段考察了Fe 对Cu ZrO 2催化剂中铜的分散状态、还原性能和铜的配位环境,以及对甲醇水蒸气重整制氢反应的反应活性和选择性的影响。
1 实验部分
1 1 催化剂的制备 采用并流共沉淀法制备催化剂,所用前驱物为硝酸铜、硝酸铁、氧氯化锆,用碳酸钠溶液作为沉淀剂,在恒温、搅拌和一定PH 值下进行沉淀,经老化、洗涤、烘干和400 焙烧后,将催化剂破碎至20目~40目待用。催化剂的组成和编号为:CZ:n (Fe ) n (Cu)=0;CF -3:n (Fe ) n (Cu)=0 03;CF -6:n (Fe) n (Cu)=0 06;C F -9:n (Fe) n
(Cu)=0 09;CF -15:n(Fe) n(Cu)=0 15。1 2 催化剂的表征 催化剂晶相结构在日本理学
D Ma x - A 型衍射仪上测定,CuK 特征射线照射,Ni 滤玻片,管电压40kV,管电流30mA 。TPR 试验在不锈钢微反上进行,催化剂装填量为50mg(40目~60目),用氢含量为5%的氢氩混合气,流量为40mL min,以10K min 的升温速率从333K 升至723K,其氢消耗信号用热导检测器检测。样品的EXAFS Cu K 边吸收(北京同步辐射国家实验室XAFS 实验站测定),储存环能量为2 2eV,平均电流约50m A 。1 3 催化剂的活性评价及测试 催化剂活性评价采用常压连续流动固定床反应器,内径为 8mm 。先对催化剂进行预还原处理,还原条件为:氢气流量为50mL min,程序升温至350 ,在该温度下还原活化催化剂2h 后,临氢降温至180 ,切换成甲醇和水混合液进行反应。反应产物经冰水浴冷却后,用GC-920气相色谱仪的热导检测器通过六通阀进行气体样品的在线分析,液体样品用氢火焰检测器进行分析。
2 结果与讨论
2 1 催化剂的还原性质 不同催化剂的TPR 谱图见图1。由图1可知,Cu ZrO 2催化剂主要呈现两个还原峰,低温还原峰和高温还原峰。一般认为,以ZrO 2为载体的铜基催化剂,低温还原峰对应于高分散于载体表面CuO 的还原峰,高温还原峰对应于体
相的较难还原的CuO 的还原峰[9,10]
。添加不同含量
第30卷2002年
第5期
10 月
燃 料 化 学 学 报
JOURNAL OF FUEL C HE MIS TRY AND TECHNOLOGY
Vol 30 No 5Oct 2002
的Fe 助剂后,催化剂的TPR 谱图发生了明显变化。当n(Fe) n(Cu)<0 06时,TPR 谱图中仍出现两个还原峰,但催化剂还原温度有所降低,低温还原峰面积增大,同时高温还原峰温提前;当n(Fe) n(Cu)>0 06时,催化剂的起始温度和还原温度区间与CF -6相似,但低温还原峰和高温还原峰明显发生重叠。表明Fe 的加入有助于提高C uO 的分散度。此外由于CuO 与Fe 2O 3之间相互作用,削弱了Cu O 键,在还原过程中,H 2容易进攻其中的O 2-
离子,使得还
原过程容易进行
[11]
,这在本研究中得到进一步证
实。当Fe 加入过量时,
上述作用不明显。
图1 不同组成催化剂的TPR 谱图Figure 1 TPR profiles of catalysts
2 2 催化剂的晶相结构 催化剂的XRD 结果见图2。由图2可知,在无Fe 助剂的Cu ZrO 2催化剂中,CuO 特征衍射峰强度较高。Fe 助剂的加入,在不同程度上影响了CuO 的分散状态。随着Fe 加入量的
增加,CuO 特征峰强度逐渐宽化减弱,当n (Fe) n (Cu)>0 06时,催化剂的XRD 谱图的衍射峰变得较为弥散。由此可见,Fe 对铜具有助分散作用,这与TPR
结果是一致的。
图2 催化剂的XRD 谱图Figure 2 The XRD pattems of catalysts
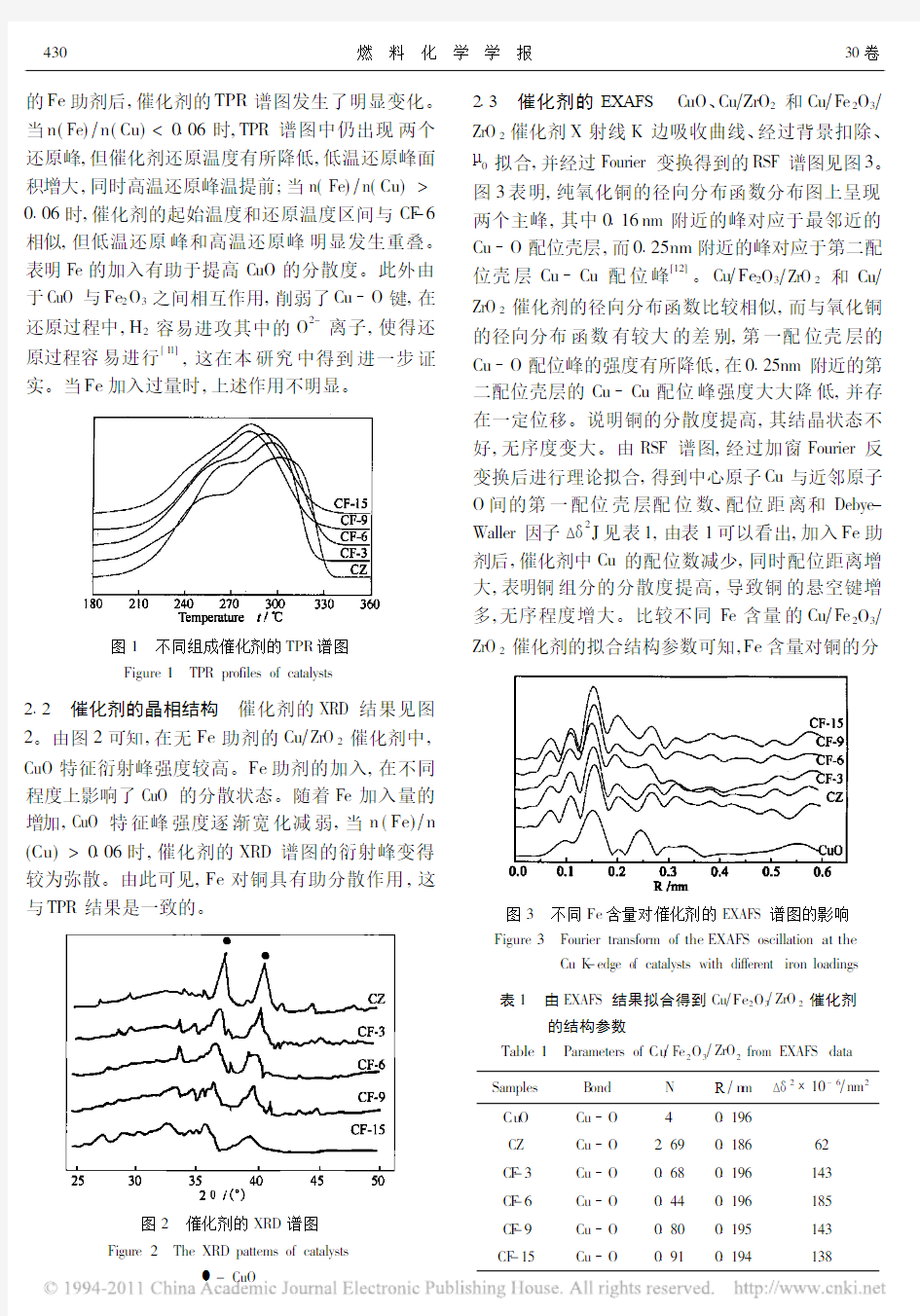
-CuO
2 3 催化剂的EXAFS C uO 、Cu ZrO 2和Cu Fe 2O 3 ZrO 2催化剂X 射线K 边吸收曲线、经过背景扣除、 0拟合,并经过Fourier 变换得到的RSF 谱图见图3。图3表明,纯氧化铜的径向分布函数分布图上呈现两个主峰,其中0 16nm 附近的峰对应于最邻近的Cu O 配位壳层,而0 25nm 附近的峰对应于第二配位壳层Cu Cu 配位峰
[12]
。C u Fe 2O 3 ZrO 2和Cu
ZrO 2催化剂的径向分布函数比较相似,而与氧化铜的径向分布函数有较大的差别,第一配位壳层的Cu O 配位峰的强度有所降低,在0 25nm 附近的第
二配位壳层的Cu Cu 配位峰强度大大降低,并存在一定位移。说明铜的分散度提高,其结晶状态不好,无序度变大。由RSF 谱图,经过加窗Fourier 反变换后进行理论拟合,得到中心原子Cu 与近邻原子O 间的第一配位壳层配位数、配位距离和Debye -Waller 因子 2
J 见表1,由表1可以看出,加入Fe 助剂后,催化剂中Cu 的配位数减少,同时配位距离增大,表明铜组分的分散度提高,导致铜的悬空键增多,无序程度增大。比较不同Fe 含量的Cu Fe 2O 3
ZrO 2催化剂的拟合结构参数可知,Fe 含量对铜的分
图3 不同Fe 含量对催化剂的EXAFS 谱图的影响Figure 3 Fourier transform of the EXAFS oscillation at the Cu K -edge of catalysts with different iron loadings 表1 由EXAFS 结果拟合得到Cu Fe 2O 3 ZrO 2催化剂 的结构参数
Table 1 Parameters of Cu Fe 2O 3 ZrO 2from EXAFS data Samples B ond N R n m 2 10-6 nm 2
Cu O Cu O 40 196CZ Cu O 2 690 18662C F -3Cu O 0 680 196143C F -6
Cu O 0 440 196185C F -9Cu O 0 800 195143CF -15
Cu O
0 91
0 194
138430 燃 料 化 学 学 报30卷
散能力次序为:CF -6>CF -3>C F -9>CF -15>CZ,这与催化剂对甲醇水蒸气重整的反应活性次序相同,说明铜的分散度与催化剂活性有较好的相关性。2 4 Fe 助剂对催化剂甲醇水蒸气重整制氢反应性
能的影响 不同Fe 含量催化剂对甲醇水蒸气重整制氢反应催化性能的影响见表2。由表2可见:Fe 助剂的加入,明显提高了Cu ZrO 2催化剂对甲醇水蒸气重整制氢的反应活性,同时提高了对氢气的选择性,降低了反应产物中C O 的浓度。当n(Fe) n (C u)<0 06时,甲醇转化率和氢气选择性显著提高;当n(Fe) n(Cu)>0 06时,催化剂活性趋于平稳,较n(Fe) n(Cu)=0 06时甲醇转化率有所降低,但氢气选择性提高,混合气中C O 的浓度降低。这与Fe 和Cu 对C O 的吸附能力有关,Klier
[13]
指出,金
属对CO 的吸附有离解化学吸附和非离解化学吸附两种,而它们的本质区别在于对C O 吸附的强弱,可用CO 在金属上的吸附热来反映,金属元素Cu 和Fe,对C O 的吸附热分别为25 1Kcal mol 和33 2Kcal mol,很明显,Fe 对C O 的化学吸附较强,即使在室温条件下也是离解化学吸附,因而Fe 的加入有利于促进C O 键断裂,即有利于C O+H 2O CO 2+H 2
的反应向正方向进行。因此,添加适量的Fe 助剂,有助于提高Cu ZrO 2催化剂对甲醇水蒸气重整制氢的反应活性和氢气的选择性,但随Fe 助剂加入量的增加,将使催化剂对甲醇的裂解活性降低,却可提高
氢气的选择性,降低产物中CO 的含量。在此表明Fe 对水-气转换反应有促进作用。有关甲醇重整反应和水-汽变换反应在Cu Fe 2O 3 ZrO 2催化剂上的竞争反应和作用机理还有待进一步研究。
表2 Fe 含量对催化性能的影响
Table 2 Effect of Fe content on the catalytic properties
Sample n(Fe) n(Cu)(atom ratio)X CH 3
OH %Y H
2
mol mol of
CH 3OH
S H 2 %
C co %CZ 064 221 7892 172 08CF -30 0378 852 3097 030 76CF -60 06
84 012 4597 260 70CF -90 0972 592 1297 430 64CF -15
0 15
72 56
2 13
97 950 52
Reaction condition:220 ;n(H 2O ) n (C H 3OH )=1 1;GHSV=1 5h -1
X C H 3OH :conversion of methanol;Y H 2:yield of hydrogen;S H 2:selectivity of hydrogen;C CO :CO content
参考文献
[1] Idem R O,Bakhshi N N Production of hydrogen from methanol 1 Catalyst characterization studies[J] Ind Eng Chem Res ,1994,
33:2047-2055
[2] Peppley B A ,Amphlett J C,Kearns L M,et al Methano-l stream reforming on Cu ZnO Al 2O 3[J] Appl Catal ,1999,179:21-49 [3] 蒋元力,黄 强,王福安,等 在Cu ZnO Al 2O 3催化剂上进行甲醇蒸气重整的动力学研究[J] 燃料化学学报,2001,29
(4):347-350
(JIANG Yuan -li,HUANG Qiang,WANG Fu -an,et al Kinetic study of methanol steam reforming over Cu ZnO Al 2O 3catalysis[J] Jou rna l o f Fuel Chemistry and T echnology (Chinese ),2001,29(4):347-350 )
[4] 蔡迎春,刘淑文,徐贤伦,等 CuO -Zn O -La 2O 3-Al 2O 3催化剂上的甲醇水蒸气重整[J] 分子催化,2001,15(2):152
-154 (CAI Ying -chun,LIU Shu -wen,XU Xian -lun,et al Steam reformi ng of methanol over CuO -Zn O -La 2O 3-Al 2O 3catalyst[J] Journal o f Molecula r Catalysis (Chinese ),2001,15(2):152-154 )
[5] 陈 兵,董新法,林维明 甲醇水蒸气转化催化剂性能研究[J] 石油化工,2000,29(9):661-663
(C HEN Bing ,DONG Xi n -fa,LIN We-i ming Properties of catalys ts for stream reforming of methanol[J] Petro Chemical Technology (Chinese ),2000,29(9):661-663 )
[6] Breen J P,Ross J R H Methanol reforming for fue-l cell applications:Development of Zirconia -containi ng Cu Zn Al catalysts[J] Catal
Today ,1999,51:521-533
[7] Breen J P,Meunier F C,Ross J R H Mechanistic aspects of the steam reforming of methanol over a CuO ZnO ZrO 2 Al 2O 3catalyst[J]
Chem Commun ,1999,22:2247-2248
[8] 李永红,任 杰,孙予罕 低温高活性甲醇水蒸气重整制氢催化剂的研究[J] 天然气化工,2001,26(1):5-8
(LI Yong -hong,REN Jie,S UN Yu -han Production of hydrogen from the low -temperature methano-l stream reforming[J] Natur Gas Chemicat I n dustry (Chinese ),2001,26(1):5-8 )
[9] 周仁贤,陈 平,郑小明,等 Cu ZrO 2活性组分与载体相互作用及其TPR 特性[J] 物理化学学报,1996,12(5):464-467
4315期
李永红等:Fe 助剂对Cu ZrO 2甲醇水蒸气重整制氢催化剂的影响
(ZHOU Ren -xian,CHEN Pin,ZHENG Xiao -mi ng ,et al The in teraction between active phase and support and the TPR characteristics on Cu ZrO 2catalyst[J] A cta Phys -Chim Sinica (Chinese ),1996,12(5):464-467 )
[10] 吴贵升,任 杰,孙予罕 铜含量对Cu ZrO 2和Cu -La 2O 3 ZrO 2催化剂性能影响[J] 燃料化学学报,1999,27(6):501-504
(WU Gu -i sheng,REN Jie,SUN Yu -han Effect of copper content on performance of Cu ZrO 2and Cu -La 2O 3 ZrO 2[J] Journal of Fu -e l Chemistry and Technology (Chinese ),1999,27(6):501-504 )
[11] 徐 杰,王文详 CuO -Fe 2O 3体系的相互作用[J] 催化学报,1992,13(6):420-424
(XU Jie,WANG Wen -xiang The interaction in CuO -Fe 2O 3System[J] Chinese J ournal of Catalysis (Chinese ),1992,13(6):420-424 )
[12] Asuaki Okamoto,Hideki Gotoh,Satohiro Yoshida Zirconia -supported copper catalysts for NO -CO reaction:Surface copper species on
zirconia[J] J Che m Soc Fra da y Trans Phys Chem &Chem Ph ys ,1997,93:3879-3885
[13] Klier K Catalysis of Organic Reactions,Chemical Industries Series Vol 5[M] New York:Heinz Heinemann Inc ,1981 195-198
EFFEC T OF IRON ON Cu ZrO 2C ATALYSTS IN
PRODUC TION OF HYDROGEN FROM METHANOL -STEAM REFORMING
LI Yong -hong,RE N Jie,SUN Yu -han
(State Key Laboratory of Coal Conve rsion ,Institute of Coal Che mistry ,Chinese Aca dem y o f Sciences ,Taiyuan 030001,China )
Abstract :The perfor mance of Fe modified Cu ZrO 2catalysts was characterized by means of XRD,TPR,EXAFS,and tested by methano-l steam reforming The XRD results showed that the dispersion of copper was improved by the addition
of iron promoter It was found from TPR that the onset te mperature of reduc tion was downward shifted and the duration of reduction process was shortened after iron addition Furthermore,it was obtained for reaction testing that the catalytic ac -tivity,as well as the selectivity of hydrogen over iron promoted Cu ZrO 2catalysts were also increased In terms of activity and selectivity,the catalyst with Fe C u molar ratio of 0 06was the optimal value of the promoter content Key words :methano-l steam reforming;hydrogen;iron promoter;Cu ZrO 2catalysts
Foundation item :Natural Science Foundation of Shanxi Province (20001019).
Author introduction :LI Yong -hong (1965-),female,applied chemistry specialty E -mail:Ree yh @sohu com
432 燃 料 化 学 学 报30卷
甲醇水蒸汽重整制氢催化剂甲醇还原方案
甲醇水蒸汽重整制氢催化剂甲醇还原方案 甲醇水蒸汽重整制氢催化剂的还原活化原则上应用H2还原剂,可以得到高的催化活性,在对转化率要求不太严格的情况下可以采用甲醇作为还原剂,但可能造成约10%活性损失。 催化剂的装填采用阶梯式装填方式可得到较好的温度分布。可以用相应颗粒大小的石英砂作为补充以形成催化剂的梯度分布,由入口到出口阶梯式增加催化剂的用量。 催化剂的还原温度和使用温度对催化剂的活性及寿命影响很大,严禁出现超温现象。当温度>320℃易形成积碳,铜烧结,催化剂的活性显著降低甚至失活。 现根据适当的资料就甲醇作为还原剂,提供如下方案以供参考。 1,催化剂的升温 1.1升温介质 通常情况下应用氮气作为升温介质,当氮气不便时也可应用空气作为升温介质。但还原阶 段的升温应用还原剂的气态组分作为升温用介质。 1.2升温的空速 考虑到小反应器,由于放热量有限,拟采用相对较小的空速,一般为2.0~4.0h-1。还原初期,当反应放热较大时,宜采用较低的空速,以方便温度的控制。 1.3升温中注意事项 MW-612型催化剂在升温过程中,于50~130℃之间可能发生温升较慢的现象,这是因为催 化剂在脱除制备过程中加入的物理水有关。 1.4催化剂的还原 MW-612型催化剂的H2还原的特点是速度快,当利用甲醇还原时,受甲醇分子结构的影响,需采用较高的甲醇分压以利于甲醇的渗透和与催化剂表面的接触,所以适当的提高系统压力对催化剂还原时有益和必须的。还原实践证明,进口温度为180℃,催化剂可在较低甲醇浓度下完成还原反应。 1.4.1还原剂 甲醇水,甲醇:水=1:0.2~1,甲醇中不含氯、硫和油,水用去离子水。 1.4.2甲醇与水的比,刚开始时,利用较小的液空速,较高的甲醇含量,以利于氧化铜的还原和水分的排除,随着还原反应的进行,逐渐提高水的比例。甲醇、水的比例可根据流量泵的流量来调整,计量应准确,应根据反应床层的温度变化随时调整,防止催化剂床层飞温,造成催化剂活性的降低。 1.4.3还原温度
制氢方法
工业制氢方法概述 世界上大多数氢气通过天然气、丙烷、或者石脑油重整制得。经过高温重整或部分氧化重整,天然气中的主要成分甲烷被分解成 H2、 CO2、CO 。这种路线占目前工业方法的 80 %, 其制氢产率为 70 %—90 %。烃类重整制氢技术已经相当成熟,从提高重整效率,增强对负载变换的适应能力,降低生产成本等方面考虑,催化重整技术不断得到发展,产生了不少改进的重整工艺 , 其中包括可再生重整、平板式重整、螺旋式重整、强化燃烧重整等。煤直接液化工艺中一个重要单元就是的单元就是加氢液化,下面着重介绍几种工业上制氢工艺: 一、烃类蒸汽转化法 蒸汽转化法可以采用从天然气到石油脑的所有轻烃为原料。主要利用高温下水蒸气和烃类发生反应。转化生成物主要为氢、一氧化碳和二氧化碳。该过程需要消耗大量的能量,只不过要脱除或分离二氧化碳是件很麻烦的事,虽然目前分离二氧化碳的方法在不断推出,如变压吸附法( PSA)、吸收法( 包括物理吸收和化学吸收法),低温蒸馏法,膜分离法等等,然而,二氧化碳的处理仍是很费脑筋,若是直接排入大气,势必造成环境污染。 二、烃类分解生成氢气和炭黑的制氢方法 该方法是将烃类分子进行热分解,产物为氢气和炭黑,炭黑可用于橡胶工业及其它行业中,同时避免了二氧化碳的排放。目前,主要有如下两种方法用于烃类分解制取氢气和炭黑。 ( 1 ) 热裂解法:将烃类原料在无氧( 隔绝空气),无火焰的条件下,热分解为氢气和炭黑。生产装置中可设置两台裂解炉,炉内衬耐火材料并用耐火砖砌成花格成方型通道,生产时,先通入空气和燃料气在炉内燃烧并加热格子砖,然后停止通空气和燃料气,用格子砖蓄存的热量裂解通入的原料气,生成氢气和炭黑,两台炉子轮流进行蓄热和裂解,循环操作,将炭黑与气相分离后气体经提纯后可得纯氢,其中氢含量依原料不同而异,例如原料为天然气,其氢含量可达 85 % 以上。 天然气高温热裂解制氢技术,其主要优点在于制取高纯度氢气的同时,不向大气排放二氧化碳,而是制得更有经济价值、易于储存且可用于未来碳资源的固体碳,减轻了环境的温室效应。除了间歇反应有人曾做过天然气连续裂解的尝试。天然气催化裂解可以提高裂解速度,生成的纳米碳也能催化甲烷裂解过程。甲烷分解反应吸热 kJ/mol,因此最少需要甲烷燃烧( 887kJ/mol ) 的9 % 来提供反应所需热量。该方法技术较简单 , 经济上也还合适。 ( 2 ) 等离子体法:在反应器中装有等离子体炬,提供能量使原料发生热分解。等离子气是氢气,可以在过程中循环使用,因此,除了原料和等离子体炬所需的电源外不需要额外能量源。用高温产品加热原料使其达到规定的要求,多余的热量可以用来生成蒸汽。在规模较大的装置中,用多余的热量发电也是可行的。由于回收了过程的热量,从而降低了整个过程的能量消耗。等离子体法原料的适应性强,几乎所有的烃类,从天然气到重质油都可作为制氢原料,原料的改变,仅仅会影响产品中的氢气和炭黑的比例,此外,装置的生产规模可大可小。 三、烃类部分氧化法
制氢技术比较及分析报告
制氢技术综述&制氢技术路线选择 一、工业制氢技术综述 1.工业制氢方案 工业制氢方案很多,主要有以下几类: (1)化石燃料制氢:天然气制氢、煤炭制氢等。 (2)富氢气体制氢:合成氨生产尾气制氢、炼油厂回收富氢气体制氢、氯碱厂回收副产氢制氢、焦炉煤气中氢的回收利用等。 (3)甲醇制氢:甲醇分解制氢、甲醇水蒸汽重整制氢、甲醇部分氧化制氢、甲醇转化制氢。 (4)水解制氢:电解水、碱性电解、聚合电解质薄膜电解、高温电解、光电 解、生物光解、热化学水解。 (5)生物质制氢。 (6)生物制氢。 2.工业制氢方案对比选择 (1)煤炭制氢制取过程比天然气制氢复杂,得到的氢气成本也高。 (2)由于生物制氢、生物质制氢和富氢气体制氢等方法制取的氢气杂质含量高、纯度较低,不能达到GT等技术提供商的氢气纯度要求。 (3)国内多晶硅绝大多数都采用的是水电解制氢,只有中能用的是天然气制氢,而国外应用的更多是甲醇制氢,因此,我们重点选择以下三类方案进行对比: (A)天然气制氢 (B)甲醇制氢 (C)水电解制氢 3. 天然气制氢
(1)天然气部分氧化制氢因需要大量纯氧增加了昂贵的空分装置投资和制氧成本。 (2)天然气自热重整制氢由于自热重整反应器中强放热反应和强吸热反应分步进行,因此反应器仍需耐高温的不修锈钢管做反应器,这就使得天然气自热重整反应过程具有装置投资高,生产能力低的特点。 (3)天然气绝热转化制氢大部分原料反应本质为部分氧化反应。 (4)天然气高温裂解制氢其关键问题是,所产生的碳能够具有特定的重要
用途和广阔的市场前景。否则,若大量氢所副产的碳不能得到很好应用,必将限制其规模的扩大。 (5)天然气水蒸汽重整制氢,该工艺连续运行, 设备紧凑, 单系列能力较大, 原料费用较低。 因此选用天然气水蒸汽重整制氢进行方案对比。 4.甲醇制氢 (1)甲醇分解制氢,该反应是合成气制甲醇的逆反应,在低温时会产生少量的二甲醚。 (2)甲醇水蒸汽重整制氢,是甲醇制氢法中氢含量最高的反应。这种装置已经广泛使用于航空航天、精细化工、制药、小型石化、特种玻璃、特种钢铁等
甲醇水蒸汽重整制氢催化剂的研究
收稿日期:!""#$"%$&’;作者简介:张晓阳(’()#$ ),男,工程师,电话"!*$*%(#!("),电邮+,-. !/’/0-1023/45。甲醇水蒸汽重整制氢催化剂的研究 张晓阳 (西南化工研究设计院,成都#’"!!% )摘要:对67$8-$9’催化剂上甲醇水蒸汽重整制氢进行了研究,结合燃料电池对氢气中一氧化碳含量的特殊要求,并模拟工业装置测试,讨论了催化剂主成分含量、反应温度、反应压力、液空速等对一氧化碳含量和催化剂时空收率的影响,提出了适合燃料电池使用的甲醇水蒸汽重整制氢催化剂。 关键词:甲醇;蒸汽重整;制氢;燃料电池;催化剂中图分类号::;!’ 文献标识码:9 文章编号:’""’$(!’((!""))"’$’"$"< 近年来,燃料电池的迅猛发展和商业化的进程影响了整个世界,其高效节能,以及零排放或接近零排放的良好环境性能,使之成为当今世界能源和交通领域开发的热点。燃料电池可提供可移动电能这一点在野外作业和燃料电池汽车方面的应用尤为突出。目前要实现燃料电池的商业化,主要问题是解决氢源问题和降低成本,而氢源技术已成为燃料电池商业化的技术瓶颈。氢燃料来源主要有两种,一是直接用氢,二是甲醇制氢技术,这两种方法又存在诸多不同的技术路线,因此什么样的氢源最适合用于燃料电池汽车的问题一直以来都是争论的焦点。 直接用氢技术存在储氢量和储氢方法的限制,因此开发大功率的燃料电池仍存在很大的难度,甲醇制氢技术在原料的供应方面有很大的优势。目前采用的甲醇制氢技术主要有甲醇部分氧化制氢和甲醇水蒸汽重整制氢,前者的优点在于基本不需要提供外来热源,但催化剂的时空收率相对与后者比较相对较低,且存在反应温度较高和催化剂寿命较短的缺点,因此在燃料电池的应用上存在一定的问题。甲醇水蒸汽重整制氢在催化剂上可分为铂系贵金属和铜系催化剂两种,国外对铂系贵金属催化剂的研究比较多,但由于其成本较高在燃料电池汽车方面使用有很大的困难,仅适合于手机、手提电脑等小规模用电。铜系催化剂时空收率比较高,成本较低,更适合大功率的燃料电池,因此国内外对铜系催化剂 的研究也十分活跃 [’]。’实验部分 ’=’催化剂的制备 取配制好的67(>?&)!?&@!?、9’(>?&)& ?(@!?和8-(>?&)!?#@! ?混合溶液预热后置于原料罐中,取>,!6?&溶液置于另一原料罐中,控制反应温度在)"A 左右,并在不断搅拌下,将两者并流到三口烧瓶中,调节B @C )="左右,搅拌老化!D ,洗涤过滤至滤液为中性,’’"A 烘干并在<""A 煅烧 二甲醚重整制氢技术 摘要:本文总结和评述了二甲醚重整制氢技术的研究进展,包括二甲醚重整制氢的方法以及重整催化剂等,并指出催化剂的新型制备方法与等离子体重整技术。重点介绍了二甲醚部分氧化重整制氢的实验方案。 关键词:二甲醚;催化剂;重整;氢气 一、前言 能源是人类生存不可或缺的物质基础,是社会经济向前发展的动力。经济的飞速发展带来了能源短缺和环境污染的双重危机,为此世界各国都在积是极进行可再生能源的研究,特别是以氢为燃料的燃料电池汽车得到迅速发展。H2密度最小的气体,无色无味,难溶于水,具有可燃性;但氢气的使用尚存在运输及储存等问题,解决方法之一是寻找一种液体原料实现小规模现场制氢或车载制氢。二甲醚由于具有含氢量高,无毒、无“三致”作用,环境友好,易于存储和运输,且与液化石油气(LPG)相似等优点,从而成为一种理想的用于现场重整制氢的液体原料,其相关研究也成为近期的热点。 近年来,为应对日益严峻的能源危机和环境污染,氢作为一种绿色能源受到世界各国的广泛关注。氢燃烧只产生水,具有能量密度高、无污染等优点,而且二甲醚重整制氢能有效地解决氢的运输和储存等问题,技术也成熟。与甲醇重整制氢相比,二甲醚重整制氢则具有较多优势:①二甲醚含氢量高,无毒,友好环境,易液化,方便运输和储存;②二甲醚物理性质与液化石油气相近,可利用现有液化石油气的基础设施;③二甲醚的来源多样化且较为经济,大规模应用不会受到限制。近年来,二甲醚(dimethyl ether,DME)已成为石油替代产品和新型二次能源的热点研究方向,引起欧美、日韩等国政府和专家高度关注与重视,并已经取得了很多成果。我国的能源资源的特点是“富煤、少油、有气”,同时二甲醚可从煤、天然气和生物质制得,所以发展二甲醚经济体系对于我国经济发展、环境保护与生态平衡具有重大战略意义[1-2]。 二、综述 本文总结了二甲醚重整制氢技术的研究进展,包括二甲醚重整制氢的方法以及重整催化剂等,并简要分析了各种二甲醚重整方法应用于车载重整器的可能性,指出催化剂的新型制备方法与等离 天然气制氢工艺与技术 利用天然气制氢,存在成本低,规模效应显著等优点,研究和开发更为先进的天然气制氢新工艺技术是解决廉价氢源的重要保证。天然气作为优质、洁净的工业能源,在我国能源发展过程中具有重要的战略意义。因为天然气不仅是人们日常生活的重要燃料,同时也是众多化工次产品的基础性原料。 天然气制氢就是众多天然气产品中的一种,辽河油田作为全国第三大油气田,本身就具有丰富的天然气资源,特别是从事油气集中处理企业,我们在油气生产过程中,能够生产出相当规模的伴生干气,对于天然气深加工具有得天独厚的条件,对于推进天然气制氢工艺的开发推广具有更为广泛的实际意义。 1 天然气制氢的选择理论分析 氢作为一种二次化工产品,在医药、精细化工、电子电气等行业具有广泛的用途。特别是氢作为燃料电池的首选燃料,在未来交通和发电领域将具有广阔的市场前景,在未来能源结构中将占有越来越重要的位置。采用传统制氢的方法,如轻烃水蒸气转化制氢、水电解制氢、甲醇裂解制氢、煤汽化制氢、氨分解制氢等,技术相对成熟,但是,存在成本高、产出率低、人工效率低等“一高两低”的问题。辽河油田在油气生产过程中,有干气、石脑油等烃类资源伴生,采用此类方法生产氢,可以实现资源的利用率最大化,而且伴生天然气的主要成分是甲烷,利用烃类蒸汽转化即可制成氢,且生产纯度高,生产效率高。 2 天然气制氢工艺原理 天然气的主要加工过程包括常减压蒸馏、催化裂化、催化重整和芳烃生产。同时,包括天然气开采、集输和净化。在一定的压力和一定的高温及催化剂作用下,天然气中烷烃和水蒸气发生化学反应。转化气经过费锅换热、进入变换炉使CO变换成H2和CO2。再经过换热、冷凝、汽水分离,通过程序控制将气体依序通过装有三种特定吸附剂的吸附塔,由变压吸附(PSA)升压吸附N2、CO、CH4、CO2提取产品氢气。降压解析放出杂质并使吸附剂得到再生. 反应式:CH4+H2O→CO+3H2-Q CO+H2O→CO2+H2+Q 主要技术指标。压力: 1.0-2.5MPa;天然气单耗: 0.5-0.56Nm3/ Nm3氢气;电耗: 0.8-1.5/ Nm3氢气;规模: 1000 Nm3/h ~100000 Nm3/h;纯度: 符合工业氢、纯氢(GB/T7445-1995);年运行时间: 大于8000h。 3、天然气水蒸汽重整制氢需解决的关键问题 制氢技术比较及分析 WEIHUA system office room 【WEIHUA 16H-WEIHUA WEIHUA8Q8- 制氢技术综述&制氢技术路线选择 一、工业制氢技术综述 1.工业制氢方案 工业制氢方案很多,主要有以下几类: (1)化石燃料制氢:天然气制氢、煤炭制氢等。 (2)富氢气体制氢:合成氨生产尾气制氢、炼油厂回收富氢气体制氢、氯碱厂回收副产氢制氢、焦炉煤气中氢的回收利用等。 (3)甲醇制氢:甲醇分解制氢、甲醇水蒸汽重整制氢、甲醇部分氧化制氢、甲醇转化制氢。 (4)水解制氢:电解水、碱性电解、聚合电解质薄膜电解、高温电解、光电 解、生物光解、热化学水解。 (5)生物质制氢。 (6)生物制氢。 2.工业制氢方案对比选择 (1)煤炭制氢制取过程比天然气制氢复杂,得到的氢气成本也高。 (2)由于生物制氢、生物质制氢和富氢气体制氢等方法制取的氢气杂质含量高、纯度较低,不能达到GT等技术提供商的氢气纯度要求。 (3)国内多晶硅绝大多数都采用的是水电解制氢,只有中能用的是天然气制氢,而国外应用的更多是甲醇制氢,因此,我们重点选择以下三类方案进行对比: (A)天然气制氢 (B)甲醇制氢 (C)水电解制氢 3. 天然气制氢 (1)天然气部分氧化制氢因需要大量纯氧增加了昂贵的空分装置投资和制氧成本。 (2)天然气自热重整制氢由于自热重整反应器中强放热反应和强吸热反应分步进行,因此反应器仍需耐高温的不修锈钢管做反应器,这就使得天然气自热重整反应过程具有装置投资高,生产能力低的特点。 (3)天然气绝热转化制氢大部分原料反应本质为部分氧化反应。 (4)天然气高温裂解制氢其关键问题是,所产生的碳能够具有特定的重要用途和广阔的市场前景。否则,若大量氢所副产的碳不能得到很好应用,必将限制其规模的扩大。 (5)天然气水蒸汽重整制氢,该工艺连续运行, 设备紧凑, 单系列能力较大, 原料费用较低。 因此选用天然气水蒸汽重整制氢进行方案对比。 4.甲醇制氢 简述各种制氢的技术的特点和原理 答: 1.化石燃料制氢:制氢的物理化学基础为碳和氧气是燃烧反应,甲烷燃烧和碳氢化合物的不完全燃烧、碳与水蒸气的反应、碳与二氧化碳的反应、碳氢化合物的分解。 【1】天然气制氢技术:天然水蒸气重整制氢转化率最高,耗能耗气高,生产成本高,设备昂贵,制氢过程慢,且该过程中有大量温室气体二氧化碳的排放。水蒸气重整制氢需要催化剂,催化剂主要有两种:非贵金属催化剂,如镍;贵金属催化剂,如铂。通常以氧化镁为载体。 (1)天然气部分氧化制氢:甲烷的氧化反应能为氧化制氢提供热量,无需再提供热源和催化剂。为提高转化率以及防止颗粒状的奤烟尘的生成,通常反应温度高于1300到1500摄氏度。由于温度过高容易出现局部高温热点,易造成固体碳沉积。所以还是需要催化剂来降低反应温度。该催化剂主要采用金属组分负载在载体的负载型金属催化剂。金属组分通常为镍,然而镍成本高且易造成碳沉积。由于部分氧化制氢是放热反应,与水蒸气重整法相比反应速率更快。部分氧化法可利用自身产生的热量,无需外界供应但转化率较低。 (2)天然气自热重整制氢:在部分氧化反应中引入蒸汽,在部分氧化过程中产生热量,在蒸汽重整中吸收热量,使放热的部分氧化重整和吸热的蒸汽重整结合,并控制放热和吸热,使其达到平衡的自热式重整法。自热式重整法反应器内有两个区域,一个是氧化区,在该区内发生部分氧化重整,使用氧化催化剂,促使反应速率加快,反应放热也加快,热量提供给催化区内的水蒸气重整;另一个区域是催化区,发生天然气水蒸气重整,不需要外界提供热源。该设计减少了启动热源以及启动时间。与天然气水蒸气重整相比,自热式重整的启动和停止更加的迅速。与部分氧化重整相比,转化率较高,可产生更多的氢气。此外,自热重整设备相对紧凑,所以该方法具有较好的市场潜力。 (3)天然气催化裂解:甲烷在一定条件下分解成碳和氢气,为吸热反应,能耗大。 【2】煤制氢技术:煤的气化,碳和氧气生成一氧化碳,一氧化碳和氧气反应生成二氧化碳。碳和水蒸气反应生成一氧化碳和氢气(水煤气),吸热反应;一氧化碳再和水蒸气反应生成二氧化碳和氢气,放热反应。气化炉内引入的空气或者氧气量控制精确,比例较小,燃料可以完全燃烧。“部分氧化”过程提供热量。 特点:成本低廉,工艺成熟,但较为污染环境。 (1)煤的直接制氢:煤的焦化,高温干馏,煤在隔绝空气的条件下,在900到1000摄氏度以下制取焦炭,副产品为含氢的焦炉煤气。 煤的气化:煤在高温常压或加压条件下与气化剂(水、氧气和空气)反应,转化成富含氢气的气体产物。工艺流程:煤料进入气化炉内,经炉壁分散后,与经过空气分离设备(空分机)制得的氧气反应,产生部分热量,此氧气量要精确控制,使少量燃料完全燃烧,提供热量。该热量提供给煤和水蒸气的气化反应,制取煤气,煤气中含有氢、一氧化碳、二氧化碳以及一些杂质气体。混合气体经过净化后进入一氧化碳变化器与水蒸气继续反应,产生氢气和二氧化碳。再经过二氧化碳脱除后,采用变压吸附技术,将氢气浓度提高到三个九以上。(2)煤的间接制氢工艺:将煤转化为甲醇,再由甲醇重整制氢。 甲醇重整制氢技术主要包括:水蒸气重整制氢、部分氧化重整制氢和自热重整制氢。水蒸气重整制氢的原理为甲醇水蒸气重整制氢反应式。部分氧化重整制氢的原理为甲醇水蒸气重整制氢反应式、甲醇部分氧化反应式和甲醇裂解反应式。甲醇自热重整制氢的原理为水蒸气重整制氢反应式、甲醇裂解反应式和甲醇氧化燃烧反应。 2.电解水制氢 (1)碱性电解槽电解水制氢:在温度为50-80摄氏度,气体压力为0.1-3MPa下。水在阴极被分解成氢离子和氢氧根离子,然后氢离子得到电子形成氢原子,进一步生产氢气。氢氧根二甲醚重整制氢技术
天然气制氢工艺与技术
制氢技术比较及分析修订稿
制氢技术方面
