配合物稳定常数
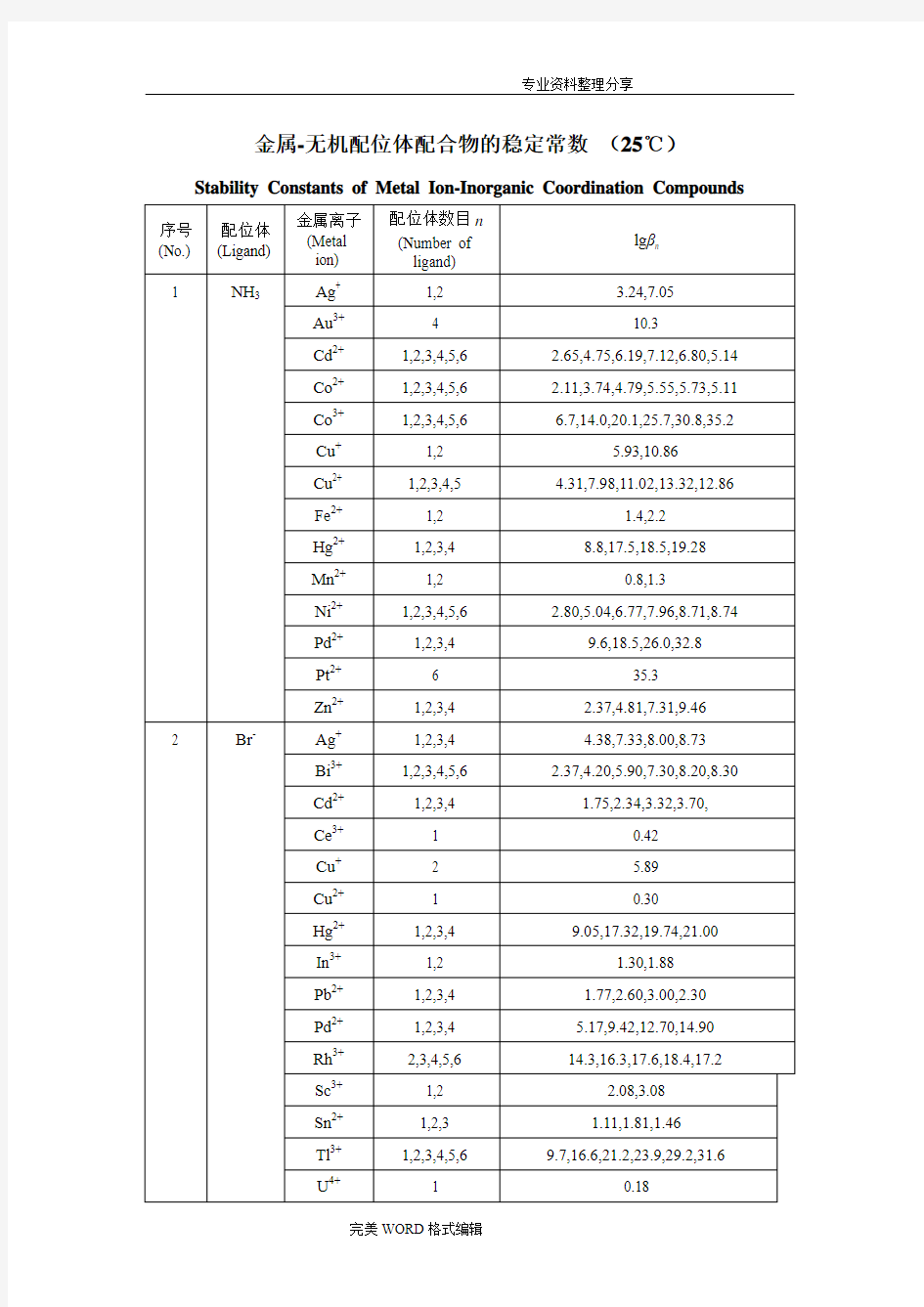

金属-无机配位体配合物的稳定常数(25℃)Stability Constants of Metal Ion-Inorganic Coordination Compounds
金属-有机配位体配合物的稳定常数(25℃)
(表中离子强度都是在有限的范围内,I≈0。)
Stability Constants of Metal Ion-Organic Coordination Compounds
EDTA的lgαY(H)值
lgαY(H) Values of EDTA
完美WORD格式编辑
完美WORD格式编辑
2络合物组成和不稳定常数的测定-----等摩尔系列法
韩山师范学院化学系化学专业物化实验课实验报告 班级学号姓名同组评分 实验日期:室温气压教师 实验题目:络合物组成和不稳定常数的测定-----等摩尔系列法 实验目的: 1.学会用等摩尔系列法测定络合物组成、不稳定常数的基本原理和实验方法。 2.计算络合反应的标准自由能变化。 3.熟练掌握测定溶液pH值和光密度的操作技术。 实验原理: 络合物MA n在水溶液中的络合与解离反应式为: M+nA MA n 达到平衡时,K不稳=[M][A]n [MA n] 式中,K不稳为络合物不稳定常数,[M]、[A]和[MAn]分别为络合平衡时 金属离子、配位体和络合物的浓度、n为络合物的配位数。 在络合反应中,常伴有颜色的明显变化,因此研究这些络合物的吸收光谱可以测定它们的组成和不稳定常数。测定方法较多,本实验采用应用最广的等摩尔 系列法测定Cu(Ⅱ)-磺基水杨酸络合物的组成和不稳定常数。 1、络合物组成的测定 在维持金属离子M和配位体A总浓度不变的条件下,取相同浓度的M溶液和 A溶液配成一系列CM/(CM+CA)不同的溶液,这一系列溶液称为等摩尔 系列溶液,当所生成的络合物MAn的浓度最大时,络合物的配位数n可按下 述简单关系直接由溶液的组成求得 n=C A/CM 显然,通过测定某一随络合物含发生相应变化的物理量,例如光密度D的变 化,作出组成-性质图,从曲线的极大点便可直接得到络合物的组成。 络合物的浓度和光密度的关系符合朗伯-比尔定律: D=lgI0/I=acl 利用分光光度计或光谱仪测定溶液光密度D与浓度c的关系,即可求得络合 物的组成,不同络合物的组成-光密度图具有不同的形式。 2、不稳定常数的测定 在络合物明显解离的情形下,用等摩尔系列法得到的曲线,并作切线交于N 点。设在N点的光密度为D0,曲线2的极大的光密度为D,则络合物的解离 度为: α=解离部分/总浓度 =(总浓度-络合物浓度)/总浓度 =(D0-D)/D0 对于MA型络合物的K不稳=cα2/(1-α),故将该络合物浓度c及上面求 出的α代入此式即可算出不稳定常数。 当络合物解离度很小时,此法不易得到准备结果,此时,可在 ΔD-CM/(CM+CM)曲线上找出光密度相等的两点,在对应两点的溶液
6分光光度法测的络合物的稳定常数
实验六 分光光度法测的配合物的稳定常数 一、目的与要求 1.掌握连续法测定配合物组成及稳定常数的方法; 2.掌握分光光度计的使用方法; 3.用分光光度法中的连续变化法测的Fe +3与钛铁试剂形成配合物的组成及稳定常数。 二、预习与思考 1.了解连续法测的配合物组成及稳定常数的基本原理; 2.预习7200型分光光度计的构造原理和使用方法; 3.思考 (1) 怎样求配位数n ?如何计算配合物稳定常数? (2) 测定λmax 的目的是什么?如何决定配合物最大吸收波长? (3) 使用分光光度计时应注意什么?比色皿大小如何选择? 三、实验原理 溶液中金属离子M 和配位体L 形成配合物,其反应式为: n ML nL M ?→←+ 当达到络合平衡时: n ML n M L C K C C = (6.1) 式中:K 为配合物稳定常数;C M 为络合平衡时金属离子的浓度(严格应为活度);C L 为络合平衡时的配位体浓度;C MLn 为络合平衡时的配合物浓度;n 为配合物的配位数。 配合物稳定常数不仅反映了它在溶液中的热力学稳定性,而且对配合物的实际应用,特别是在分析化学方法中具有重要的参考价值。 显然,如能通过实验测得公式(6.1)中右边各项浓度及n 值,则就能算得K 值。本实验采用分光光度来测定上列这些参数。 1. 分光光度法的实验原理: 让可见光中各种波长单色光分别、依次透过有机物或无机物的溶液,其中某些波长的光即被吸收,使得透过的光形成吸收谱带。如图П-6-1所示,这种吸收谱带对于结构不同的物质具有不同的特性,因而就可以对不同产物进行鉴定分析。 根据比尔定律,一定波长的入射光强I 0 与透射光强I 之间的关系: kcd e I I -=0 (6.2)
配位化合物习题及解析
《配位化合物》作业参考解析 1. 下列说法正确的是 A. 配合物的内界和外界之间主要以共价键相结合 B. 中心原子与配体之间形成配位键 C. 配合物的中心原子都是阳离子 D. 螯合物中不含有离子键 【B】A、D:一般认为配合物的内界和外界之间主要以离子键相结合,因此螯合物中内界和外界之间是可以存在离子键的;C:中心原子可以是阳离子,也可以是中性原子,例如[Ni(CO)4];B:中心原子与配体化合时,中心原子提供杂化过的空轨道,配体提供孤对电子,而形成配位键。 2. 下列配合物命名不正确的是 A. [Co(H2O)(NH3)3Cl2]Cl 氯化二氯·三氨·一水合钴(Ⅲ) B. [Cr(NH3)6][Co(CN)6] 六氰合钴(Ⅲ)酸六氨合铬(Ⅲ) C. K[Co(NO2)3Cl3] 三硝基·三氯合钴(Ⅲ)酸钾 D. H2[PtCl6] 六氯合铂(Ⅳ)酸 【C】根据配体命名顺序,先无机后有机,先阴离子后中性分子,同类配体根据配位原子在字母表中的先后顺序进行命名。对于C中的配合物而言,NO2-以N原子为配位原子时,命名为硝基,带一个负电荷,氯离子也是阴离子,同类配体,根据配位原子在字母表中的先后顺序,Cl-离子在前,NO2-离子在后,因此该配合物应该命名为“三氯·三硝基合钴(Ⅲ)酸钾”。 3. 下列配离子具有正方形或者八面体形结构,其中CO32-最有可能作为双齿配体的是 A. [Co(NH3)4(CO3)]+ B. [Co(NH3)5(CO3)]+ C. [Pt(en)(NH3)(CO3)] D. [Pt(en)2(NH3)(CO3)]2+ 【A】根据题意,配离子具有正方形结构时,配位数为4,形成四个配位键;具有八面体结构时,配位数为6,形成6个配位键。B:[Co(NH3)5(CO3)]+ 配离子中,已有5个氨作为配体,氨是单齿配体,形成5个配位键,因此该配离子中,CO32-离子只能是单齿配体,这样就形成了6个配位键;C:[Pt(en)(NH3)(CO3)] 配合物中,乙二胺(en)为双齿配体,形成2个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了4个配位键;D:[Pt(en)2(NH3)(CO3)]2+ 配离子中,乙二胺(en)为双齿配体,2个en形成4个配位键,氨为单齿配体,形成1个配位键,因此CO32-离子只能是单齿配体,这样就形成了6个配位键;A:[Co(NH3)4(CO3)]+ 配离子中有4个氨为配体,形成4个配位键,因此CO32-离子必须是双齿配体,这样就形成了4个配位键,如果CO32-离子是单齿配体,那么配离子的配位数为5,这与题意不符。 4. 下列分子或者离子的中心原子发生了dsp2杂化的是 A. BF3 B. [Zn(NH3)4]2+ (μ = 0 ) C. [Ni(CN)4]2-(μ = 0 ) D. 【C】A:BF3分子为正三角形,中心原子B发生sp2杂化;[Zn(NH3)4]2+ (μ = 0 )的配位数为4,中心原子提供4个杂化空轨道,由于Zn2+离子的价层电子排布为3d10,d轨道已经全部排满电子,因此只会发生sp3杂化,形成四个杂化轨道;D:NH4+离子是正面体结构,因此中心原子N原子发生了sp3杂化;C:[Ni(CN)4]2-(μ = 0 )的配位数为4,中心原子提供4个杂
配位化合物知识点讲解(教师版)
1、配位化合物 (1)概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。 作为电子对接受体的金属离子或原子称为中心离子(原子),又称配合物的形成体,作为电子对给予体的分子或离子称为配体。 [Cu(H2O)4]2+的空间结构为平面正方形。 (2)配合物的结构 [Cu(NH3)4]SO4为例说明。 注意:离子型配合物是由内界和外界组成,内界由中心离子和配体组成。 (3)配合物的命名: 例如:[Cu(NH3)4]SO4硫酸四氨合铜 练习:对下列配合物进行命名 [Cu(NH3)4]Cl2K3[Fe(SCN)6] Na3[AlF6] 3、几种常见的配合物 实验:硫酸四氨合铜的制备。 现象:向CuSO4溶液中加入氨水,生成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液。再加入乙醇,析出深蓝色的晶体。 有关反应的离子方程式为:Cu2++2NH3·H2O=Cu(OH)2↓+2OH- Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 蓝色沉淀深蓝色溶液 在[Cu(NH3)4]2+里,中心离子是Cu2+,配体是NH3,NH3分子的氮原子给出孤电子对,以配位键形成了[Cu(NH3)4]2+: [Cu(NH3)4]2+的空间结构为平面正方形。 实验:硫氰化铁的制备。向氯化铁溶液中滴加硫氰化钾溶液。 现象:形成血红色溶液。有关反应的化学方程式为:FeCl3+3KSCN=Fe(SCN)3+3KCl
Fe(SCN)3呈血红色,它是一种配合物。上述实验可用于鉴定溶液中存在Fe3+。 呈血红色的是一系列配合物:Fe(SCN)2+、Fe(SCN)2+、Fe(SCN)3、Fe(SCN)4-、Fe(SCN)52-、Fe(SCN)63-,配位数从1~6。 注意:配位键的强度有大有小,因而有的配合物很稳定,有的不很稳定。许多过渡金属离子对多种配体具有很强的结合力,因而,过渡金属配合物远比主族金属配合物多。 [随堂练习] 1.铵根离子中存在的化学键类型按离子键、共价键和配位键分类,应含有() A.离子键和共价键B.离子键和配位键 C.配位键和共价键D.离子键答案:C 2.下列属于配合物的是() A.NH4Cl B.Na2CO3·10H2O C.CuSO4·5H2O D.Co(NH3)6Cl3 答案:CD 3.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是() ①H2O ②NH3③F-④CN-⑤CO A.①②B.①②③ C.①②④D.①②③④⑤答案:D 4.配合物在许多方面有着广泛的应用。下列叙述不正确的是() A.以Mg2+为中心的大环配合物叶绿素能催化光合作用 B.Fe2+的卟啉配合物是输送O2的血红素 C.[Ag(NH3)2]+是化学镀银的有效成分 D.向溶液中逐滴加入氨水,可除去硫酸锌溶液中的Cu2+ 答案:D 5.下列微粒:①H3O+②NH4+③CH3COO-④NH3⑤CH4中含有配位键的是() A.①②B.①③ C.④⑤D.②④答案:A 6.下列不属于配位化合物的是() A.六氟和铝酸钠B.氢氧化二氨合银(银氨溶液)C.六氰合铁酸钾D.十二水硫酸铝钾答案:D 7.指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数及配位原子。 8.亚硝酸根NO2-作为配体,有两种方式。其一是氮原子提供孤对电子与中心原子配位;另一是氧原子提供孤对电子与中心原子配位。前者称为硝基,后者称为亚硝酸根。 [Co(NH3)5NO2]Cl2就有两种存在形式,试画出这两种形式的配离子的结构式。
配位键训练题
第2课时配位键 1.了解简单配位键的概念及形成实质和配位化合物在生物、化学等领域的广泛应用。 2.知道配位键的形成条件及简单配位键的形成表示。 一、配位键的含义 氨分子中,氮原子的三个未成对电子分别与一个氢原子的电子配对形成共价键,氮原子上还存在未成键的①孤对电子,形成铵根离子时,氨分子中的②孤对电子所在的轨道将与H+的1s空轨道重叠,使③孤对电子为氮原子、氢原子所共用,从而形成一种新的化学键叫④配位键。N中,4个N—H键性质⑤相同。 二、配位键的形成条件 形成配位键的一方(如A)是能够提供⑥孤对电子的原子,另一方(如B)是具有⑦能够接受孤对电子的空轨道的原子。配位键通常用符号⑧A→B表示。配位键与共价键的差别是形成配位键的共用电子对是由⑨一方提供而不是⑩双方共同提供的。 三、配位化合物 ①向硝酸银溶液中加入氨水,首先形成白色难溶物,继续加入氨水,难溶物溶解,得到一种称为氢氧化 二氨合银的物质,其化学式为[Ag(NH3)2]OH,其中含有的配位键可表示为H3N → Ag+。 ②向硫酸铜溶液中加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,得到一种称为硫酸四氨合 铜的物质,其化学式为[Cu(NH3)4]SO4,其中含有的配位键可表示为H3N → Cu2+。 1.配位键与共价键有什么区别? 【答案】共价键是成键原子分别提供一个电子成键,配位键是配体提供一对电子,受体提供空轨道成键。 2.配位键是电子云重叠形成的吗? 【答案】不是;配位键是孤对电子的电子云与空轨道重叠形成的。 3.为什么过渡金属容易形成配位键? 【答案】因为过渡金属有空轨道。 1.在N中存在4个N—H共价键,则下列说法正确的是( )。
紫外-可见分光光度法测定某有色配合物的络合比及其稳定常数分解
3.通过阅读教材及查阅相关资料,探讨如何采用紫外-可见分光光度法测定某有色配合物的络合比及其稳定常数?如何测定某染料的离解常数?请各举一例说明! 解.1.配合物组分及其稳定性常数的测定 分光光度法是测定配合物组成及稳定常数常用及有效的方法之一。主要有摩尔比法、等摩尔连续变化法等. 1. 摩尔比法(也称为饱和法) 它是根据金属离子M与配位体R显色过程中被饱和的原则来测定配合物组成及稳定常数的方法。设配合反应为: M + nR = MR n 若M与R均不干扰MR n的吸收,且其分析浓度分别为C M,C R。那么固定金属离子M的浓度,改变配位体R的浓度,可得到一系列C R/ C M 值不同的溶液。在适宜波长下测定各溶液的吸光度,然后以吸光度A 对C R/C M作图(图1)。当加入的配位体R还没有使M定量转化为MR n 时,曲线处于直线阶段;当加入的配位体R已使M定量转化为MR n并稍有了过量时,曲线便出现转折;加入的R继续过量,曲线便成水平直线。转折点所对应的摩尔比数便是配合物的组成比。若配合物较稳定,则转折点明显;反之则不明显,这时可用外推法求得两直线的交点。
图1 摩尔比法 此法简便,适合于离解度小、组成比高的配合物组成的测定。 若形成的配合物稳定,可得到两条相交于转折点的直线,若稳定性较差,则得图1的曲线。由于配合物的离解,使吸光度减小A'至A,A'减小的程度取决于配合物的稳定性。稳定常数表示为: 设配合物不离解时在转折点处的浓度为C,配合物的离解度为α,则达到平衡时
则 式中。 在转折点处可求得n,吸光度A由实验测得,A'由外推法求得,则 2. 等摩尔连续变化法(又称Job法) 设配合反应为: M + nR = MR n 设C M与C R分别为溶液中M与R物质的量浓度(原始浓度),配置一系列溶液,保持C M+C R=C(C值恒定)。改变C M与C R的相对比值,在MR n 的吸收波长下测定各溶液的吸光度A。当A值达到最大时,即MR n浓度最大,该溶液中C M/C R比值即为配合物的组成比。如以吸光度A为纵坐标,C M/C比值为横坐标作图,即绘出连续变化法曲线(图2)。由
(新人教版)配位键疑难释疑
配位键疑难释疑 配位键及配位化合物知识尽管在教材中所占内容不多,但它常常与化学键、轨道杂化及物质性质等内容结合在一起设计问题,因而明晰配位键的本质、存在、形成条件等相关内容具有很重要的意义。 一、配位键与共价键的本质是否相同 原子之间形成共价键时,若共用电子对只是由一方原子提供电子,而非来 自双方原子,这样的共价键就称为配位键,故配位键一定是共价键,也就具有 共价键的特征:方向性与饱和性,所以说配位键与共价键没有本质上的差异。共价键不一定是配位键,关键是看共用电子对的来源是一个成键原子还是两个 成键原子提供的,若是由成键的一个原子单方面提供的则为配位键,若是由成 键双方原子共同提供的则是普通共价键,所以说配位键与共价键只是在形成过 程上有所不同而已。如浓氨水与盐酸反应生成氯化铵,因氨气分子中的 氮原子有一对孤电子,氢离子有空轨道,故H+与氨气通过配位键结合成铵根离 子,尽管铵根离子中4个氮氢键的形成过程不同,但实验证明 这4个氮氢键的性质完全相同,没有任何差异,这也进一步证明配位键与共价 键是没有本质区别的。 二、形成配位键有何条件 配位键是一种特殊的共价键,并不是任意的两个原子相遇就能形成。它要求成键的两个原子中一个原子A有孤对电子,另一个原子B有接受孤对电子的“空轨道”,所以配位键的表示方法为A →B,A称为配体,B称为中心原子或离子。有时为了增强成键能力,中心原子或离子B利用能量相近的空轨道进行杂化后,再来接收以配体原子A的孤电子对。配位键既可以存在于分子中(如H2SO4等),又可以存在于离子之中(如铵根离子、水合氢离子等),如图所示:
、例1:气态氯化铝(Al 2Cl 6 )是具有配位键的化合物,分子中原子之间的关系 如图示,请在图中标出你认为是配位键的斜线加上箭头。 解析:配位键是指成键双方一方提供空轨道一方提供孤对电子。C1元素最外层有7个电子通过1个共用电子对就可以形成8电子稳定结构。所以氯化铝(A12Cl6)中与两个铝形成共价健的氯原子中,有一条是配位键,氯原子提供电子,铝提供空轨道。 答案: 三、含有配位键的化合物就是配位化合物吗 配位化合物一般指由过渡金属的原子或离子(价电子层的部分d轨道和s、p 轨道是空轨道)与含有孤对电子的分子(如CO、NH3、H2O)或离子(如Cl-、CN-、 2 NO等)通过配位键结合形成的化合物。显然含有配位键的化合物就不一定是配位化合物,如上述提到的硫酸及铵盐等化合物中尽管有配位键,但由于没有过渡金属的原子或离子,故它们也就不是配位化合物。当然含有过渡金属离子的化合物也不一定是配位化合物,如氯化铁、硫酸锌等化合物就不是配位化合物。现以配位化合物[Co(NH3)6]Cl3为例说明配位化合物的结构与名称
配合物的稳定常数的测定
配合物的组成和不稳定常数的测定 (物理化学李俊) 一、目的要求 1.掌握用分光光度法测定配合物组成及稳定常数的基本原理和方法。 2.通过实验,掌握测量原理和分光光度计的使用方法, 二、实验原理 1,用等摩尔连续递变法测定配合物的组成 “递变法”实际上是一种物理化学分析方法。可用来研究当两个组分混合时,是否发生化合,配合,缔合等作用,以及测定两者之间的化学比。其原理是:在保持总浓度不变的前提下,依次逐渐改变体系中两个组分的比值,并测定不同摩尔分数时的某一物理化学参量。 在本实验中就是测定不同摩尔分数时溶液的光密度值D,作光密度对摩尔分数的曲线图,如图3-1,所示。从曲线上光密度的极大值D极大所对应的摩尔分数值,即可求出配位数n值。 为了配制溶浓时方便,通常取相同摩尔浓度的金属离子M溶液和配位体L溶液。在维持总体积不变的条件下,按不同的体积比配成一系列混合溶液。这样体积比亦就是摩尔分数之比。 设X L为D极大时L溶液的体积分数: M溶液的体积分数为: 则配合物的配位数为: 若溶液中只有配合物MLn具有颜色,则溶液的D与MLn的含量成正比。从D-X图上曲线的极大位置即可直接求出n,但当配制成的溶液中除配合物外,尚有金属离子M及配位体L 与配合物在同一波长λ最大下也存在一定程度的吸收时,所观察到的光密度D并不完全由配
合物MLn的吸收所引起,必须加以校正。所以选择适当的波长范围,仅使配合物MLn有吸收,M和L都不吸收或极少吸收。 2.配合物平衡常数的测定 假定配合物中心离子浓度不变,而渐增加配位体浓度,随着配位体浓度的改变,中心离 子被配成MLn,溶液的光密度值D不断升高。当中心离子被完全配合后,如继续增加配位体的浓度,则溶液的光密度值D趋于恒定,如图3-2。 设配合物在稀溶液中有如下解离平衡存在: 最初浓度 平衡浓度 式中,n-配位数,已由实验确定; a-解离度: C-配合物未解离时的浓度(在本实验中亦为M完全配合时的配合物浓度)。
磺基水杨酸铜配合物组成和稳定常数的测定
磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定 实验目的 1.掌握用比色法测定配合物的组成和配离子的稳定常数的原理和方法。 2.进一步学习分光光度计的使用及有关实验数据的处理方法。 实验原理 磺基水杨酸( ,简式为H3R)的一级电离常数K1θ=3×10-3与 Fe3+可以形成稳定的配合物,因溶液的pH不同,形在配合物的组成也不同。 磺基水杨酸溶液是无色的,Fe3+的浓度很稀时也可以认为是无色的,它们在pH 值为2~3时,生成紫红色的螯合物(有一个配位体),反应可表示如下: pH值为4~9时,生成红色螯合物(有2个配位体);pH值为9~11.5时,生成黄色螯合物(有3个配位体);pH>12时,有色螯合物,被破坏而生成Fe(OH)3沉淀。 测定配合物的组成常用光度计,其前提条件是溶液中的中心离子和配位体都为无色,只有它们所形成的配合物有色。本实验是在pH值为2~3的条件下,用光度法测定上述配合物的组成和稳定常数的,如前所述,测定的前提条件是基本满足的;实验中用高氯酸(HClO4)来控制溶液的pH值和作空白溶液(其优点主要是ClO4-不易与金属离子配合)。由朗伯—比尔定律可知,所测溶液的吸光度在液层厚度一定时,只与配离子的浓度成正比。通过对溶液吸光度的测定,可以求出该配离子的组成。 下面介绍一种常用的测定方法: 等摩尔系列法:即用一定波长的单色光,测定一系列变化组分的溶液的吸光度(中心离子M和配体R的总摩尔数保持不变,而M和R的摩尔分数连续变化)。显然,在这一系列的溶液中,有一些溶液中金属离子是过量的,而另一些溶液中配体是过量的;在这两部分溶液中,配离子的浓度都不可能达到最大值;只有当溶液离子与配体的摩尔数之比与配离子的组成一致时;配离子的浓度才能最大。由于中心离子和配体基本无色,只有配离子有色,所以配离子的浓度越大,溶液颜色越深,其吸光度也就越大,若以吸光度对配体的摩尔分数作图,则从图上最大吸收峰处可以求得配合物的组成n值,如图所示,根据最大吸收处:
湿法冶金配位化学(中南大学) 配合物稳定常数的测定
湿法冶金配位化学(中南大学)配合物稳定常数的测定
第七章配合物稳定常数的测定 配合物稳定常数是判断溶液中配合物稳定性的重要数据。 早期的测定方法是:测得的是配合物的积累稳定常数 实验方法上分: 传统的方法有: 1电位法 1)电动势法 2)pH-电位法 2分光光度法 3溶剂萃取法 4离子交换法 5极谱法 现代的方法: 1核磁共振法 2顺磁共振法 3折射法 4直接量热法 5测温滴定量热法 数据处理方法上的进展: 1提出了测定稳定常数的比较普遍适用的数
据处理方法 2计算机的引入, 3数学方法在测定稳定常数时的应用: 1)最小二乘法 2)加权最小二乘法 测定的稳定常数一般为浓度稳定常数: 在一定离子强度下的稳定常数, 离子强度的支持电解质有: NaClO4 KNO3 NaNO3 KCl NaCl 对于稳定常数大者,采用较小的离子强度 对于稳定常数小者,采用较大的离子强度 实验方法上分: A 直接测出参与某一反应的物种的平衡浓度, pH电位法,电动势法,极谱法,溶剂萃 取法,离子交换法。 B 测出体系的物理化学性质来间接求出各物种 的浓度,如光密度(分光光度法),量热 法等。 本课程主要介绍电动势法和pH-电位法。
第一节 用于测定配离子稳定常数时的函数 用有关的实验方法测定配离子的稳定常数时,将 有关数据,通过适当的函数,与待求的稳定常数联系起来,经过一定的数据处理,有图解或计算可求出稳定常数。 1 Fronaeus 函数 Fronaeus 函数又称为成配度,和前面的副反 应系数αM 的形式是一样的,通常用Y 0表示: Y 0= ] [][M M T 即αM 对于形成配合物的体系,因有: M +iL=ML I i i i L M ML ]][[][= β [ML I ]=βI [M][L]I 而[M]T =∑=+n i i ML 1][1 Y 0=] [] [...][][][2 M ML n ML ML M n ++++ =1+∑=n i i i L 1 ][β Y 0仅仅是游离配体浓度[L]的函数。 2 生成函数n (Bjerrum 函数) 生成函数n 表示已与中心离子M 配位的配体数目的平 均值。
分光光度法测定络合物的组成及稳定常数
分光光度法测定络合物的组成及稳定常数(综合型) 实验目的 1、掌握分光光度法测定络合物组成及稳定常数的基本原理和方法。 2、计算络合反应的标准自由能变化。 3、学会使用分光光度计。 实验原理 溶液中金属离子M 和配位体L 形成MLn 络合物。其反应式为:MLn nL M =+,当达到平衡时,其络合稳定常数为: n L M MLn K ] ][[][= ……… (1-1) 式中:K 为络合物的稳定常数,][MLn 、][M 、][L 分别为络合平衡时络合物、金属离子和配位体的浓度(严格的说(1-1)式中各浓度值应以活度来代替),n 为络合物的配位数。 显然,如果通过实验能测得(1-1)式中右边各项的浓度及n 值,则就能算得K 值。本实验采用分光光度法来测定这些参数。 1.分光光度法的实验原理 让可见光中各种波长的单色光分别地、依次透过溶液,其中某些波长的光即被吸收,使得透过的光形成了吸收谱带(或称吸收曲线),因而可以对不同的物质进行鉴定分析,这是定性分析的基础。 根据朗伯—比耳定律,入射光强0I 与投射光强I 之间有如下关系: klc e I I -=0 ……… (1-2) D klc I I ==0ln ……… (1-3) 式中:D 称为光密度(或吸光度);k 为吸光系数,对于一定溶质,溶剂及一定波长的入射 光k 为常数;c 为溶液的浓度;l 为比色皿(液层)厚度;0 I I 称透光率。 从(1-3)式看出,在固定液层厚度l 和入射光波长的条件下,光密度D 与溶液浓度成正比。选择入射光波长,使它对被测物质即具有一定的灵敏度,又使溶液中其它物质的干扰为最小,做被测物质的C D -标准工作曲线,然后测定被测溶液的光密度,根据光密度的大小即可在标准工作曲线上求得相应的浓度值,这是定量分析的基础。 2.络合物组成的测定 本实验采用等摩尔连续变化法测定络合物的组成,其原理如下:在保持总摩尔数不变的情况下,依次改变体系中两组分摩尔分数的比值,配制一系列摩尔分数不同的溶液,测量这一系列溶液的光密度D 值。做光密度D -摩尔分数x 曲线如图5-2所示,从曲线上光密度的极大之max D 所对应的摩尔分数值,即可求出n 值。
分光光度法测定络合物的组成及稳定常数
分光光度法测定络合物的组成及稳定常数
————————————————————————————————作者:————————————————————————————————日期:
分光光度法测定络合物的组成及稳定常数(综合型) 实验目的 1、掌握分光光度法测定络合物组成及稳定常数的基本原理和方法。 2、计算络合反应的标准自由能变化。 3、学会使用分光光度计。 实验原理 溶液中金属离子M 和配位体L 形成MLn 络合物。其反应式为:MLn nL M =+,当达到平衡时,其络合稳定常数为: n L M MLn K ] ][[] [= ……… (1-1) 式中:K 为络合物的稳定常数,][MLn 、][M 、][L 分别为络合平衡时络合物、金属离子和配位体的浓度(严格的说(1-1)式中各浓度值应以活度来代替),n 为络合物的配位数。 显然,如果通过实验能测得(1-1)式中右边各项的浓度及n 值,则就能算得K 值。本实验采用分光光度法来测定这些参数。 1.分光光度法的实验原理 让可见光中各种波长的单色光分别地、依次透过溶液,其中某些波长的光即被吸收,使得透过的光形成了吸收谱带(或称吸收曲线),因而可以对不同的物质进行鉴定分析,这是定性分析的基础。 根据朗伯—比耳定律,入射光强0I 与投射光强I 之间有如下关系: klc e I I -=0 ……… (1-2) D klc I I ==0 ln ……… (1-3) 式中:D 称为光密度(或吸光度);k 为吸光系数,对于一定溶质,溶剂及一定波长的入射光k 为常数;c 为溶液的浓度;l 为比色皿(液层)厚度;0I I 称透光率。 从(1-3)式看出,在固定液层厚度l 和入射光波长的条件下,光密度D 与溶液浓度成正比。选择入射光波长,使它对被测物质即具有一定的灵敏度,又使溶液中其它物质的干扰为最小,做被测物质的C D -标准工作曲线,然后测定被测溶液的光密度,根据光密度的大小即可在标准工作曲线上求得相应的浓度值,这是定量分析的基础。 2.络合物组成的测定 本实验采用等摩尔连续变化法测定络合物的组成,其原理如下:在保持总摩尔数不变的情况下,依次改变体系中两组分摩尔分数的比值,配制一系列摩尔分数不同的溶液,测量这一系列溶液的光密度D 值。做光密度D -摩尔分数x 曲线如图5-2所示,从曲线上光密度的极大之max D 所对应的摩尔分数值,即可求出n 值。
配合物稳定常数
配合物稳定常数
————————————————————————————————作者:————————————————————————————————日期: ?
配合物稳定常数 Stability Constants of Coordination Compounds 络合反应的平衡常数用配合物稳定常数表示,又称配合物形成常数。此常数值越大,说明形成的配合物越稳定。其倒数用来表示配合物的解离程度,称为配合物的不稳定常数。以下表格中,表(1)中除特别说明外是在25℃下,离子强度I =0;表(2)中离子强度都是在有限的范围内,I ≈0。表中βn表示累积稳定常数。 金属-无机配位体配合物的稳定常数 Stability Constants ofMetalIon-InorganicCoordination Compounds 序号(No.) 配位体(L igand) 金属离子 (Metal ion) 配位体数目n (Number of li gand) lgβn 1NH3Ag+ 1,2 3.24,7.05 Au3+ 4 10.3 Cd2+1,2,3,4,5,6 2.65,4.75,6.19,7.12,6.80,5.14 Co2+1,2,3,4,5,6 2.11,3.74,4.79,5.55,5.73,5.11 Co3+1,2,3,4,5,6 6.7,14.0,20.1,25.7,30.8,35.2 Cu+1,2 5.93,10.86 Cu2+1,2,3,4,5 4.31,7.98,11.02,13.32,12.86 Fe2+1,21.4,2.2 Hg2+1,2,3,4 8.8,17.5,18.5,19.28 Mn2+1,2 0.8,1.3 Ni2+1,2,3,4,5,62.80,5.04,6.77,7.96,8.71,8.74 Pd2+1,2,3,4 9.6,18.5,26.0,32.8 Pt2+ 6 35.3 Zn2+1,2,3,4 2.37,4.81,7.31,9.46 2 Br-Ag+1,2,3,4 4.38,7.33,8.00,8.73 Bi3+1,2,3,4,5,6 2.37,4.20,5.90,7.30,8.20,8.30 Cd2+1,2,3,4 1.75,2.34,3.32,3.70, Ce3+10.42 Cu+ 2 5.89 Cu2+10.30
配合物稳定常数的测定
第七章配合物稳定常数的测定 配合物稳定常数是判断溶液中配合物稳定性的重要数据。 早期的测定方法是:测得的是配合物的积累稳定常数 实验方法上分: 传统的方法有: 1电位法 1)电动势法 2)pH-电位法 2分光光度法 3溶剂萃取法 4离子交换法 5极谱法 现代的方法: 1核磁共振法 2顺磁共振法 3折射法 4直接量热法 5测温滴定量热法 数据处理方法上的进展: 1提出了测定稳定常数的比较普遍适用的数据处理方法 2计算机的引入, 3数学方法在测定稳定常数时的应用: 1)最小二乘法 2)加权最小二乘法 测定的稳定常数一般为浓度稳定常数: 在一定离子强度下的稳定常数, 离子强度的支持电解质有: NaClO4 KNO3 NaNO3 KCl NaCl 对于稳定常数大者,采用较小的离子强度 对于稳定常数小者,采用较大的离子强度 实验方法上分: A 直接测出参与某一反应的物种的平衡浓度,pH电位法,电动势法,极谱法,溶剂萃取法,离子交换法。 B 测出体系的物理化学性质来间接求出各物种的浓度,如光密度(分光光度法),量热法等。 本课程主要介绍电动势法和pH-电位法。 第一节用于测定配离子稳定常数时的函数 用有关的实验方法测定配离子的稳定常数时,将有关数据,通过适当的函数,与待求的稳定常数联系起来,经过一定的数据处理,有图解或计算可求出稳定常数。 1Fronaeus函数 Fronaeus函数又称为成配度,和前面的副反应系数αM的形式是一样的,通常用Y0表示:
Y 0= ] [][M M T 即αM 对于形成配合物的体系,因有: M +iL=ML I i i i L M ML ]][[] [= β [ML I ]=βI [M][L]I 而[M]T =∑=+ n i i ML 1 ][1 Y 0= ] [] [...][][][2M ML n ML ML M n ++++ =1+ ∑=n i i i L 1 ] [β Y 0仅仅是游离配体浓度[L]的函数。 2 生成函数n (Bjerrum 函数) 生成函数n 表示已与中心离子M 配位的配体数目的平均值。 中心离子的总浓度 体的总浓度 已配位于中心离子的配= n 对于M 与配体L 形成单核配离子体系来说,已与中心离子配位的配体的总浓度为: [ML]+2[ML 2]+3[ML 3]+….+n[ML n ],中心离子的总浓度为[M]T , 则有: ] [....][][] [...][2][2n n ML ML M ML n ML ML n ++++++= 将有关稳定常数的表达式代入,则有: n n n n L L L n L L n ] [...][1][...][2][1221βββββ++++++= 小结:生成函数n 只是[L]的函数。 实际上与金属离子配位的配体的浓度由下式表达: 1 L 不加质子的情况 [L]T =[L]+ ∑=n i i ML i 1][ 即分子= ∑=n i i ML i 1 ][=[L]T -[L]
磺基水杨酸合铁Ⅲ配合物的组成及稳定常数的测定
《工程化学实验》备课笔记 磺基水杨酸合铁(Ⅲ)配合物的组成及稳定常数的测定 实验目的 1.掌握用比色法测定配合物的组成和配离子的稳定常数的原理和方法。 2.进一步学习分光光度计的使用及有关实验数据的处理方法。 实验原理 磺基水杨酸( ,简式为H3R)的一级电离常数K1θ=3×10-3与 Fe3+可以形成稳定的配合物,因溶液的pH不同,形在配合物的组成也不同。 磺基水杨酸溶液是无色的,Fe3+的浓度很稀时也可以认为是无色的,它们在pH 值为2~3时,生成紫红色的螯合物(有一个配位体),反应可表示如下: pH值为4~9时,生成红色螯合物(有2个配位体);pH值为9~11.5时,生成黄色螯合物(有3个配位体);pH>12时,有色螯合物,被破坏而生成Fe(OH)3沉淀。 测定配合物的组成常用光度计,其前提条件是溶液中的中心离子和配位体都为无色,只有它们所形成的配合物有色。本实验是在pH值为2~3的条件下,用光度法测定上述配合物的组成和稳定常数的,如前所述,测定的前提条件是基本满足的;实验中用高氯酸(HClO4)来控制溶液的pH值和作空白溶液(其优点主要是ClO4-不易与金属离子配合)。由朗伯—比尔定律可知,所测溶液的吸光度在液层厚度一定时,只与配离子的浓度成正比。通过对溶液吸光度的测定,可以求出该配离子的组成。 下面介绍一种常用的测定方法: 等摩尔系列法:即用一定波长的单色光,测定一系列变化组分的溶液的吸光度(中心离子M和配体R的总摩尔数保持不变,而M和R的摩尔分数连续变化)。显然,在这一系列的溶液中,有一些溶液中金属离子是过量的,而另一些溶液中配体是过量的;在这两部分溶液中,配离子的浓度都不可能达到最大值;只有当溶液离子与配体的摩尔数之比与配离子的组成一致时;配离子的浓度才能最大。由于中心离子和配体基本无色,只有配离子有色,所以配离子的浓度越大,溶液颜色越深,其吸光度也就越大,若以吸光度对配体的摩尔分数作图,则从图上最大吸收峰处可以求得配合物的组成n值,如图所示,根据最大吸收处: 等摩尔系列法
主客体络合物稳定常数的测定
以八元瓜环为代表的主客体配合物的研究 摘要:利用1H NMR技术荧光光谱法,对八元瓜环与多种啡咯啉及衍生物相互作用形成 的主客体配合物实体的结构进行了考察。研究结果显示,1,10-啡咯啉及其异构体1,7-啡咯啉4,7-啡咯啉的盐酸盐“钻”进八元瓜环内腔,形成2︰1自组装主客体包结物;2,9-二甲基-1,10-啡咯啉的盐酸盐部分进入八元瓜环形成一种比较稳定的主客体配合物;而4,7-二甲基-1,10-啡咯啉3,4,7,8-四甲基-1,10-啡咯啉以两种不同的堆砌方式部分进入八元瓜环内腔,形成包结比也是2︰1的两种较稳定的自组装主客体配合物异构体。 关键词:1H NMR技术;荧光光谱法;八元瓜环;啡咯啉异构体及衍生物;主客体包结物 正文 分子容器是指一类具有刚性中空结构,其内部孔洞能容纳其他分子的化合物,若当孔洞端口复以其他分子,则形成所谓的分子胶囊壳。通常,分子容器容纳较小的分子分子复以分子容器端口形成分子胶囊壳是通过诸如氢键,偶极力,色散力,Van der Waals力等各种分子间弱相互作用而达成的。自从1981年Freeman确定了六元瓜环的晶体结构,以及1998~1999年,Day和Kim同时发现和确定的五、七、八及十等多元瓜环(分别记为Q[5],Q[6],Q[7],Q[8](见结构图1), 图1.多元瓜环结构图 Q[10])以来,以不同瓜环容纳较小分子的研究报道逐年增多。其中Q[5]包结的氮氧以及氩等气体分子是最小的客体分子,而Q[5]本身被包结在Q[10]中使之成为目前所报道的最大的客体分子,其间Q[6]可包结呋喃、二氧六环等各种有机小分子,特别是近年来,Q[7]包结四氯化锡分子以及Q[8]包结四亚乙基四胺的金属配合物的报道,使瓜环成为能装载各种不同大小和性质各异的化合物分子的分子容器。另一方面,覆以金属离子“盖子”的瓜环分子胶囊或分子胶囊壳则主要以Q[6]的报道居多。最近,我们研究组首次报道了以六次甲基四胺分子覆于Q[5]以及Q[7]端口的有机小分子与瓜环自组装形成的分子胶囊或分子胶囊壳。这些研究结果大大丰富了主客体化学超分子化学的研究内容。同时也使瓜环这一新型的大环化合物主体迅速融入当前发展如火如荼的大环化学超分子化学等前沿学科之中。考虑到稠环化合物通常具有特殊的电化学或光化学性质,本文选择了稠环化合物啡咯啉及其衍生物为客体,利用1H NMR技术以及荧光光谱方法研究Q[8]与它们相互作用形成自组装实体的结构特征以及光学
高考新突破物质结构与性质选修大题:高考突破配位键及
高考突破配位键及配位化合物 专项练习 1.气态氯化铝(Al2Cl6)是具有配位键的化合物,分子中原子间成键的关系如下图所示.请将图中,你认为是配位键的斜线上加上箭头。
【答案】 2.①AlCl3在NaCl、KCl融熔盐中能形成Al2Cl7-,其结构如图所示。其中Al原子的杂化轨道类型为,配位键数目为。 【答案】sp3 2 3.在CrCl3的水溶液中,一定条件下存在组成为[CrCl n(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H),可发生离子交换反应: [CrCl n(H2O)6-n]x++xR-H→R x[CrCl n(H2O)6-n]+xH+ 交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成。 将含0.0015 mol [CrCl n(H2O)6-n]x+的溶液,与R-H完全交换后,中和生成的H+需浓度为0.1200 mol·L-1 NaOH溶液25.00 ml,可知该配离子的化学式为。 【答案】[CrCl(H2O)5]2+ 【解析】(3)根据提供数据,该配离子通过离子交换树脂后生成的n(H+)= 0.1200mol/L×0.025L=0.003mol,则1:x=0.0015:0.003,解得x=2。则该配离子的化学式为[CrCl(H2O)5]2+。 4.元素W(Cu)的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式 是,它可与浓盐酸发生非氧化还原反应,生成配合物H n WCl3,反应的化学方程式为。 【答案】CuCl CuCl+2HCl=H2CuCl3 (或CuCl+2HCl=H2[CuCl3]) 5.金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是,反应的化学方应程式为。
分光光度法测定络合物的稳定常数实验报告
分光光度法测定络合物的稳定常数 一、实验目的: 1、掌握用分光光度法测定络合物组成及稳定常数的基本原理和方法; 2、学会使用721(722)型分光光度计。 二、实验原理 溶液中金属离子M 和配位体L 形成络合物MLn ,其反应式为: M + nL === MLn 当达到络合平衡时,其络合稳定常数为: n L M MLn C C C K ?= (4-1) 式中:K 为稳定常数;C M 为络合平衡时金属离子的浓度; C L 为络合平衡时 配位体浓度; C MLn 为络合平衡时络合物的浓度;n 为络合物的配位数。 在维持金属离子及配位体总摩尔数不变的条件下,改变金属离子和配位体摩尔分数的比值,并测定不同摩尔分数比值时的某一物理化学参量,在本实验中测定吸光度A ,作摩尔分数~吸光度曲线,如图4-1所示。 图4-1 摩尔分数与吸光度图 图4-2 吸光度与溶液组成图 从曲线上吸光度的最大值所对应的摩尔分数值可求出n 值。为了配制溶液的方便,通常取相同摩尔浓度的金属离子M 溶液和配位体L 溶液,维持总体积不变,按不同体积比配制一系列混合溶液,则它们的体积比亦为摩尔比,若X V 为A max 时所取L 溶液的体积分数,即:
M L L V V V V X += (4-2) V V X X n -=1 (4-3) 络合物在可见光某个波长区域有强烈吸收,而金属离子和配位体几乎不 被吸收,那么就可以用分光光度法测定其组成和稳定常数,本实验就是用的 这种方法。 根据比耳定律,入射光I 0和透射光强I 之间有下列关系: )exp(0kcd I I -= (4-4) 即 kcd I I =0ln 令 kcd I I A ==0lg 式中:A 为吸光度;k 为吸收系数,对于一定溶剂、溶质及一定波长的入射 光k 为常数; d 为溶液层厚度;c 为样品浓度;I 0/I 为透射比。 在维持总体积不变的条件下,配制一系列体积比不同的溶液,用V L /V M 为7/3 的溶液测其最大吸收峰,找出络合物ML n 有最大吸收,而M 和L 几乎不吸收的波 长数值。固定该波长,测定一系列溶液的A ,作A ~x 曲线,求出n 。 络合物组成确定后,可根据下述方法确定络合物的稳定常数K : 设开始时金属离子M 和配位体L 的体积摩尔浓度分别为a 和b ,而达到平衡 时络合物的浓度为x ,则: n nx b x a x K ))((--= (4-5) 溶液的吸光度正比于络合物浓度,若在金属离子和配位体总浓度不相同的条 件下,在同一坐标上分别作吸光度对两个不同总摩尔数的溶液组成曲线,在这两条线上找出光密度相同的点(见图12-2),则此二点上对应的溶液的络合物浓度应相同。设对应于二条曲线的起始金属离子M 、配位体L 的浓度分别为a 1、b 1与 a 2、 b 2。则
