电导法测定弱电解质的电离常数实验数据处理
五、实验数据记录与处理
1、作图法求K ΘHAc 。
(1)根据公式:
2
)()/(1
1m HAc m m m K c c ∞Θ
Θ∞ΛΛ+Λ=Λ
如果以1/Λm 对cΛm 作图,截距即为1/Λ∞m ,由直线的斜率和截距即可求得K Θ
HAc 。
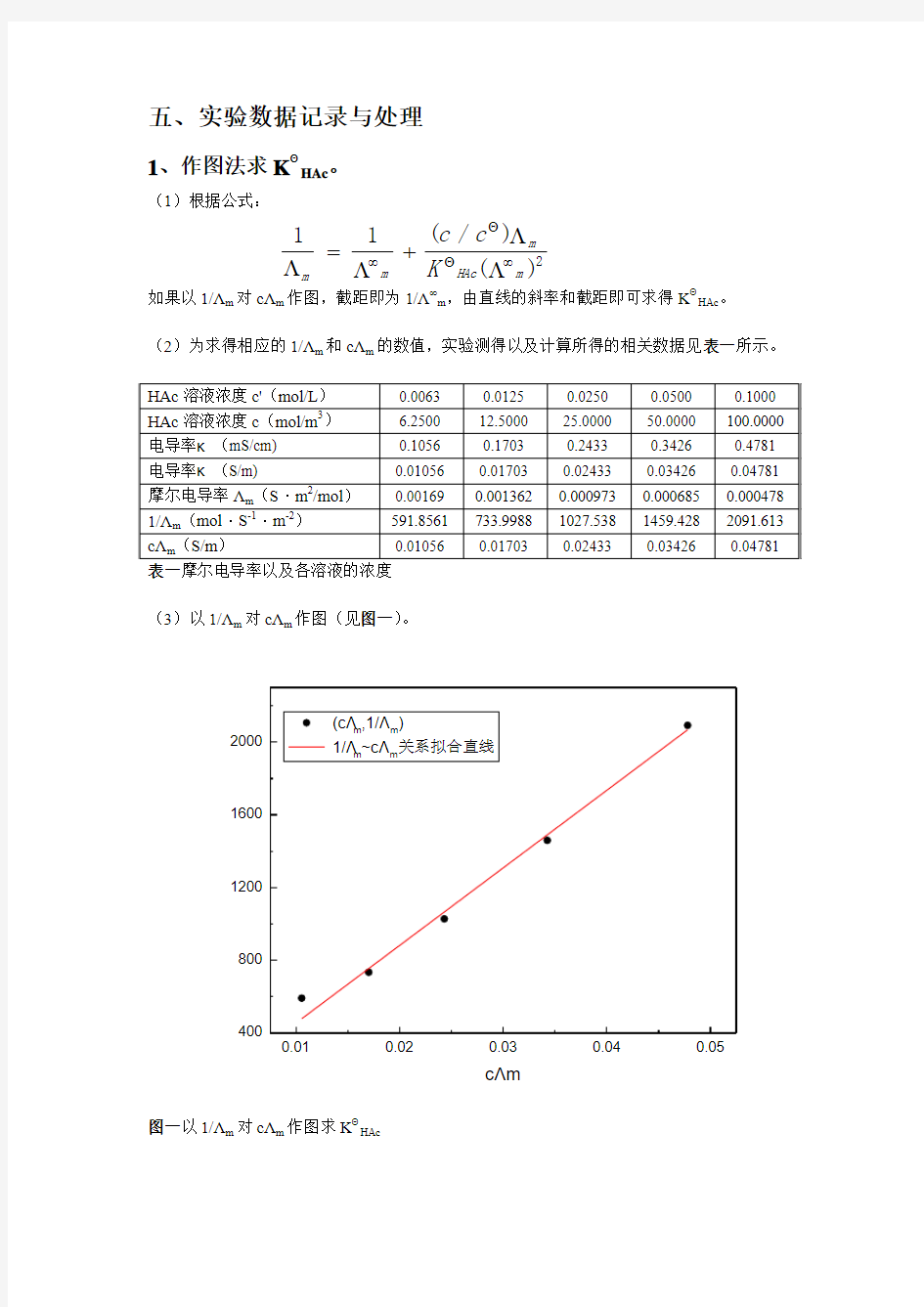
(2)为求得相应的1/Λm 和cΛm 的数值,实验测得以及计算所得的相关数据见表一所示。
表一摩尔电导率以及各溶液的浓度
(3)以1/Λm 对cΛm 作图(见图一)。
1/Λm
cΛm
图一以1/Λm 对cΛm 作图求K Θ
HAc
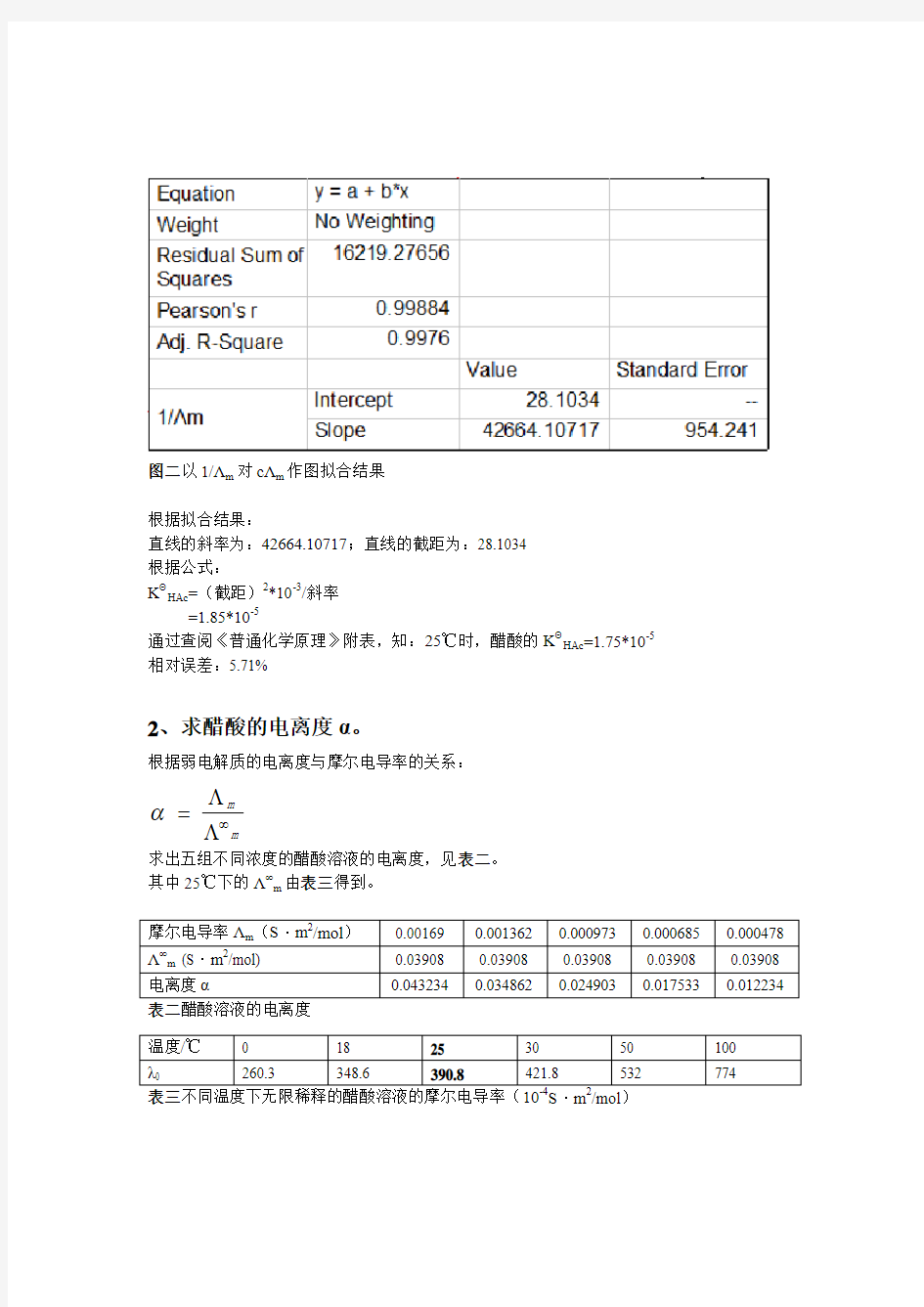
图二以1/Λm 对cΛm 作图拟合结果
根据拟合结果:
直线的斜率为:42664.10717;直线的截距为:28.1034 根据公式: K Θ
HAc =(截距)2*10-3/斜率 =1.85*10-5
通过查阅《普通化学原理》附表,知:25℃时,醋酸的K Θ
HAc =1.75*10-5 相对误差:5.71%
2、求醋酸的电离度α。
根据弱电解质的电离度与摩尔电导率的关系:
m
m ∞
Λ
Λ=
α
求出五组不同浓度的醋酸溶液的电离度,见表二。 其中25℃下的Λ∞m 由表三得到。
表二醋酸溶液的电离度
3、计算法求K ΘHAc
根据公式:
)
()/(2
m m m m
HAc c c K Λ-ΛΛΛ=
∞∞ΘΘ
通过计算的方法求得K Θ
HAc ,与作图法以及标准值比较,相关数据见表四。
表四计算的方法求得K HAc
根据计算的结果,只有c/16的K Θ
HAc 与其他数据相差较大,这与通过作图拟合时的数据一致,通过图一中对无根数据的拟合,可以看出也是c/16的数据点偏离拟合直线比较多,应该是实验误差所致。
4、对第一次实验数据的处理以及处理结果。
注:本次实验我们小组测量了两次,原因是第一次实验测量的数据通过拟合直线虽然斜率是可靠的,但是其截距是负值,这与直线方程的截距物理意义不符合,通过询问前面几组的数据,我们发现用右侧仪器的小组数据都出现了这样一个问题,因此我们决定用另外一个仪器第二次测量。
(1)实验数据:
表五第一次测量的实验数据及相关计算数值
(2)作图法求K Θ
HAc
1
/
Λ
m
cΛm
图三第一次实验数据以1/Λm对cΛm作图求KΘHAc
图四第一次实验数据以1/Λm对cΛm作图拟合结果
根据拟合结果:
直线的斜率为:36293.42452;直线的截距为:-266.69365
根据公式:
因为截距为负值无法加入计算,因此用表三中25℃时的摩尔电导率代入计算:求得KΘHAc=(1/0.03908)2/斜率=1.80*10-5
通过查阅《普通化学原理》附表,知:25℃时,醋酸的KΘHAc=1.75*10-5
相对误差:2.86%
人教版化学选修4第三章第一节 弱电解质的电离习题讲解学习
人教版化学选修4第三章第一节弱电解质的电离习题
第三章水溶液中的离子平衡 第一节弱电解质的电离 A组 1.下列叙述正确的是( ) A.盐酸能导电,盐酸是电解质 B.固体氯化钠不导电,氯化钠是非电解质 C.CO2的水溶液能导电,但CO2是非电解质 D.氯水能导电,所以Cl2是电解质 解析:盐酸虽然能导电,但它是混合物,既不是电解质也不是非电解质,A错。固体氯化钠不导电,但其在水溶液和熔融状态下都导电,所以氯化钠是电解质,B错。CO2的水溶液能导电,原因是CO2与水反应生成了电解质H2CO3而导电,所以CO2是非电解质,C对。氯水能导电,原因是Cl2与水反应生成了电解质HCl和HClO,Cl2是单质,既不是电解质也不是非电解质,D错。 答案:C 2.下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( ) A B C D 强电解质 Fe NaCl CaCO3HNO3 弱电解质 CH3COOH NH3H3PO4Fe(OH)3 非电解质C12H22O11 (蔗糖) BaSO4 C2H5OH (酒精) H2O 解析:铁既不是电解质,也不是非电解质,A项错误。NH3是非电解质,B项错误。碳酸钙是盐,为强电解质;磷酸是中强酸,是弱电解质;乙醇是非电解质,C项正确。H2O是弱电解质,D项错误。 答案:C 3.(双选)醋酸的下列性质中,可以证明它是弱电解质的是( ) A.1 mol·L-1的醋酸溶液中c(H+)=10-2 mol·L-1 B.醋酸以任意比与H2O互溶 C.10 mL 1 mol·L-1的醋酸恰好与10 mL 1 mol·L-1的NaOH溶液完全反应 D.在相同条件下,醋酸溶液的导电性比盐酸的弱 解析:A项中,若醋酸完全电离,则c(H+)=1 mol·L-1,而现在c(H+)=0.01 mol·L-1,故醋酸仅部分电离,为弱电解质。选项C是与强碱能进行到底的反应,不能说明其电离程度。选项D是在相同条件下,即同温、同浓度下的比较,导电性弱,说明溶液中离子浓度小,即电离程度小,盐酸中的HCl是完全电离的,故说明醋酸是部分电离,为弱电解质。 答案:AD 4.用水稀释0.1 mol·L-1的CH3COOH溶液,其中随水的量增加而增大的是( ) ①c(H+) ②n(H+) ③ ④⑤c(CH3COO-) A.①②③ B.②③ C.④⑤ D.③⑤ 解析:在加水稀释时,CH3COOH的电离程度增大,电离出的n(H+)的总量增大,但电离出的c(H+)和c(CH3COO-)是减小的;而由于n(H+)的总量增加,c(H+)减少的比c(CH3COOH)的要少,故 是增大的。 答案:B 5.将1 mol冰醋酸加入到一定量的蒸馏水中最终得到1 L溶液。下列各项中,表明已达到电离平衡状态的是( )
高考化学试题含解析——弱电解质的电离
跟踪检测(二十五) 弱电解质的电离 1.(2018·济宁模拟)醋酸溶液中存在电离平衡CH 3COOH H ++CH 3COO -,下列叙述不正确的是( ) A .升高温度,平衡正向移动,醋酸的电离常数K a 值增大 B .0.10 mol·L -1的CH 3COOH 溶液中加水稀释,溶液中c (OH - )增大 C .CH 3COOH 溶液中加少量的CH 3COONa 固体,平衡逆向移动 D .25 ℃时,欲使醋酸溶液pH 、电离常数K a 和电离程度都减小,可加入少量冰醋酸 解析:选D A 项,醋酸的电离吸热,升高温度促进电离,导致电离常数增大,正确;B 项,加水稀释促进电离,溶液中c (H +)减小,c (OH -)增大,正确;C 项,向醋酸溶液中加入CH 3COONa 固体,c (CH 3COO -)增大,平衡逆向移动,正确;D 项,温度不变,电离常数不变,错误。 2.下列关于电离常数的说法正确的是( ) A .电离常数随着弱电解质浓度的增大而增大 B .CH 3COOH 的电离常数表达式为K a = c (CH 3COOH )c (H +)·c (CH 3COO -) C .电离常数只受温度影响,与浓度无关 D .CH 3COOH 溶液中加入少量CH 3COONa 固体,电离常数减小 解析:选C 电离常数是温度函数只与温度有关,故A 、D 错误,C 正确;电离常数是弱电解质达到电离平衡时,电离产生的离子浓度的乘积与未电离的电解质分子的浓度的比。 因此CH 3COOH 的电离常数表达式为K a =c (H +)·c (CH 3COO -)c (CH 3COOH ) ,B 错误。 3.(2018·房山区模拟)将0.1 mol·L -1的NH 3·H 2O 溶液加水稀释,下列说法正确的是 ( ) A.c (NH +4)c (NH 3·H 2O ) 的值减小 B .OH -的物质的量减小 C.c (NH +4)·c (OH -)c (NH 3·H 2O ) 的值减小 D .NH +4的浓度减小 解析:选D 在NH 3·H 2O 溶液中,存在电离平衡;NH 3·H 2O NH +4+OH -,当加水稀释时,电离平衡正向移动,使电离出的n (NH +4)增大,溶液中的n (NH 3·H 2O)减小,则
电导的测定及其应用实验报告.doc
电导的测定及其应用 一、实验目的 1、测量KCl水溶液的电导率,求算它的无限稀释摩尔电导率。 2、用电导法测量醋酸在水溶液中的解离平衡常数。 3、掌握恒温水槽及电导率仪的使用方法。 二、实验原理 1、电导G可表示为:(1) 式中,k为电导率,电极间距离为l,电极面积为A,l/A为电导池常数Kcell,单位为m-1。 本实验是用一种已知电导率值的溶液先求出Kcell,然后把欲测溶液放入该电导池测出其电导值G,根据(1)式求出电导率k。 摩尔电导率与电导率的关系:(2) 式中C为该溶液的浓度,单位为mol·m-3。 2、总是随着溶液的浓度降低而增大的。 对强电解质稀溶液,(3) 式中是溶液在无限稀释时的极限摩尔电导率。A为常数,故将对c作图得到的直线外推至C=0处,可求得。 3、对弱电解质溶液,(4) 式中、分别表示正、负离子的无限稀释摩尔电导率。 在弱电解质的稀薄溶液中,解离度与摩尔电导率的关系为:(5) 对于HAc,(6) HAc的可通过下式求得: 把(4)代入(1)得:或 以C对作图,其直线的斜率为,如知道值,就可算出K o 三、实验仪器、试剂 仪器:梅特勒326电导率仪1台,电导电极1台,量杯(50ml)2只,移液管(25ml)3只,洗瓶1只,洗耳球1只 试剂:10.00(mol·m-3)KCl溶液,100.0(mol·m-3)HAc溶液,电导水 四、实验步骤
1、打开电导率仪开关,预热5min。 2、KCl溶液电导率测定: ⑴用移液管准确移取10.00(mol·m-3)KCl溶液25.00 ml于洁净、干燥的量杯中,测定其电导率3次,取平均值。 ⑵再用移液管准确移取25.00 ml电导水,置于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。 ⑶用移液管准确移出25.00 ml上述量杯中的溶液,弃去;再准确移入25.00 ml电导水,只于上述量杯中;搅拌均匀后,测定其电导率3次,取平均值。 ⑷重复⑶的步骤2次。 ⑸倾去电导池中的KCl溶液,用电导水洗净量杯和电极,量杯放回烘箱,电极用滤纸吸干 3、HAc溶液和电导水的电导率测定: ⑴用移液管准确移入100.0(mol·m-3)HAc溶液25.00 ml,置于洁净、干燥的量杯中,测定其电导率3次,取平均值。 ⑵再用移液管移入25.00 ml已恒温的电导水,置于量杯中,搅拌均匀后,测定其电导率3次,取平均值。 ⑶用移液管准确移出25.00 ml上述量杯中的溶液,弃去;再移入25.00 ml电导水,搅拌均匀,测定其电导率3次,取平均值。 ⑷再用移液管准确移入25.00 ml电导水,置于量杯中,搅拌均匀,测定其电导率3次,取平均值。 ⑸倾去电导池中的HAc溶液,用电导水洗净量杯和电极;然后注入电导水,测定电导水的电导率3次,取平均值。 ⑹倾去电导池中的电导水,量杯放回烘箱,电极用滤纸吸干,关闭电源。 五、数据记录与处理 1、大气压:102.08kPa 室温:17.5℃实验温度:25℃ 已知:25℃时10.00(mol·m-3)KCl溶液k=0.1413S·m-1;25℃时无限稀释的HAc水溶液的摩尔电导率=3.907*10-2(S·m2·m-1) ⑴测定KCl溶液的电导率: ⑵测定HAc溶液的电导率: 电导水的电导率k(H2O)/ (S·m-1):7 *10-4S·m-1
弱电解质电离习题
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,溶液的pH值随溶液体积变化的曲线如右图所示。据图判断正确的是( ) A.Ⅱ为盐酸稀释时的pH值变化曲线 B.b点溶液的导电性比c点溶液的导电性强 C.a点K W的数值比c点K W的数值大 D.b点酸的总浓度大于a点酸的总浓度 下列关于强、弱电解质的叙述中正确的是( ) A.强电解质都是离子化合物,弱电解质都是共价化合物 B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子D.强电解质的导电能力强,弱电解质的导电能力弱 根据以下事实得出的判断一定正确的是( ) A.HA的酸性比HB的强,则HA溶液的pH比HB溶液的小 B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大 D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强对室温下pH相同、体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
A.加适量的醋酸钠晶体后,两溶液的pH均增大 B.使温度都升高20℃后,两溶液的pH均不变 C.加水稀释2倍后,两溶液的pH均减小 D.加足量的锌充分反应后,两溶液中产生的氢气一样多 列叙述中,能说明某物质是弱电解质的是( ) A.熔化时不导电 B.不是离子化合物,而是极性共价化合物 C.水溶液的导电能力很差 D.溶液中溶质分子和溶质电离出的离子共存 现有等pH或等物质的量浓度的盐酸和醋酸溶液,分别加入足量镁产生的体积(同温同压下测定)的变化图示如下: H 2 其中正确的是( ) A.①③ B.②④ C.①②③④ D.都不对 下列关于盐酸与醋酸两种稀溶液的说法正确的是( ) A.相同浓度的两溶液中c(H+)相同 B.100 mL mol·L-1的两溶液能中和等物质的量的氢氧化钠 C.pH=3的两溶液稀释100倍,pH都为5 D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小 已知室温时, mol/L某一元酸HA在水中有%发生电离,下列叙述错误的是( ) A.该溶液的pH=4 B.升高温度,溶液的pH增大 C.此酸的电离平衡常数约为1×10-7
实验九电导法测定弱电解质的解离平衡常数
实验十一 电导率的测定及应用 一 实验目的 1. 测定KCl 水溶液的电导率,求算它的无限稀释摩尔电导率; 2. 用电导法测定醋酸在水溶液中的解离平衡常数; 3. 掌握DDS 一11A 型电导率仪的测量原理和使用方法; 二 实验原理 1. 电解质溶液的导电能力通常用电导G 来表示,它的单位是西门子(Siemens),用符号S (西)表示。若将某.电解质溶液放入两平行电极之间,设电极间距为l ,电极面积为A ,则电导可表示为: G =к l A (11一1) (11一1)式中,к为该电解质溶液的电导率,单位为S ·m -1,它的数值与温度、溶液组成及电解质种类有关;l/A 称为电导池常数;它的单位为m -1。 在讨论电解质溶液的导电能力时,常用摩尔电导率Λm 这个物理量,它与电导率к、溶液浓度c 之间的关系如下: Λm =к/c (11一2) 摩尔电导率的单位为S ·m 2·mol -1. 2. Λm 总是随溶液浓度的降低而增大。对强电解质稀溶液而言,其变化规律用科尔劳施(Kohlrausch)经验公式表示: c A m m -Λ=Λ∞ (11一3) (11一3)式中,Λ m ∞ 为无限稀释摩尔电导率。对特定的电解质和溶剂来说,在一定温度下, A 是一个常数。所以将Λ m 对c 作图得到的直线外推,可求得该强电解质溶液无限稀释摩 尔电导率 Λm ∞ 。 3. 对弱电解质,其Λm ∞ 无法利用(11一3)式通过实验直接测定,而是根据离子独立运动定律,应用强电解质无限稀释摩尔电导率计算出弱电解质无限稀释摩尔电导率,也可以从正、负两种离子的无限稀释摩尔电导率加和求得: ∞ --∞++∞Λ+Λ=Λ,,m m m νν (11一4) (11一4)式中,∞+Λ,m ,∞ -Λ,m 分别表示正、负离子的无限稀释摩尔电导率。不同温度下醋酸溶液Λ m ∞ 见表11一1。 表11一1不同温度下醋酸溶液的Λ m ∞
-实验_电导法测定乙酸电离平衡常数
实验六 电导法测定乙酸电离平衡常数 报告人: 同组人: 实验时间2010年06月12日 一.实验目的: 1.掌握电导、电导率、摩尔电导率的概念以及它们之间的相互关系。 3.掌握电导法测定弱电解质电离平衡常数的原理。 二.实验原理: 1.电离平衡常数K c 的测定原理 在弱电解质溶液中,只有已经电离的部分才能承担传递电量的任务。在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为∞∧m ,可以用离子的极限摩尔电导率相加而得。而一定浓度下电解质的摩尔电导率∧m 与无限稀释的溶液的摩尔电导率∞∧m 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。二者之间有如下近似关系: ∞∧ ∧= m m α (1) 式中为弱电解质的电离度。 对AB 型弱电解质,如乙酸(即醋酸),在溶液中电离达到平衡时,其电离平衡常数K c 与浓度c 和电离度α的关系推导如下: CH 3COOH →CH 3COO - + H + 起始浓度 c 0 0 平衡浓度 c (1-α) c α c α 则 a ca K c -=12 (2) 以式(1)代入上式得:) (Λm m 2ΛΛΛc K m m c -=∞∞ (3) 因此,只要知道∧m ∞ 和∧m 就可以算得该浓度下醋酸的电离常数K c 。 将式(2)整理后还可得: (4) 由上式可知,m m 1/Λm 作图可得一条直线,由 直线斜率可测出在一定浓度范围内c K 的平均值。 2.摩尔电导率∧m 的测定原理 电导是电阻的倒数,用G 表示,单位S (西门子)。电导率则为电阻率的倒数,用k 表 示,单位为G·m -1 。 摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m 的两个电极之间,这时所具有的电导称为摩尔电导率。摩尔电导率与电导率之间有如下的关系。 ∧m = κ/c (5) 式中c 为溶液中物质的量浓度,单位为mol·m -3 。 在电导池中,电导的大小与两极之间的距离l 成反比,与电极的面积A 成正比。 G = κA/ l (6) 由(6)式可得 κ=K cell G (7)
弱电解质的电离精讲精练习与习题
弱电解质的电离(讲义) 一、知识点睛 1.弱电解质的电离平衡 (1)电离平衡常数(简称电离常数) ①定义 在一定条件下达到电离平衡时,弱电解质电离形成 的各种离子的浓度的乘积与溶液中未电离的分子的浓度之比是一个 常数。 ②表达式(以弱电解质CH3COOH电离为例) K=______________________ a.K只受温度影响,在稀溶液中与溶液浓度无关。 b.K表征了弱电解质的电离能力,相同温度下,K越大,电离程度越大。 c.弱酸的电离常数用K a表示,弱碱的电离常数用K b表示,K a或K b 越大,酸性或碱性越强。 d.多元弱酸的电离常数用K a1、K a2……表示,以第一步电离为主,酸性强弱由第一步电离决定。 (2)影响电离平衡的外界因素 ①温度 升高温度,平衡向_____移动,电离程度_____; 降低温度,平衡向_____移动,电离程度_____。 ②浓度 溶液越稀,电离程度越大。稀释溶液,平衡向_____移动,电离程度 _____,但各离子浓度一般会减小。 ③外加试剂 加入某种强电解质(其中含有弱电解质的组成离子),平衡向_____ 移动,电离程度_____; 加入能与弱电解质电离出的离子反应的物质,平衡向_____移动,电 离程度_____。 2.酸、碱稀释后pH的变化规律 (1)强酸,每稀释10n倍,pH增大n个单位; 弱酸,每稀释10n倍,pH增大,但小于n个单位。 (2)强碱,每稀释10n倍,pH减小n个单位; 弱碱,每稀释10n倍,pH减小,但小于n个单位。 注:①pH相同的强酸与弱酸(强碱与弱碱)稀释相同的倍数时,pH变化不同,弱酸(弱碱)的变化程度小。
实验六:电导法测弱电解质HAc的电离平衡常数
实验六:电导法测弱电解质得电离平衡常数 一、实验目得: 1、掌握惠斯登电桥法测定电导得原理。 2、学会实验测量得操作技术。 3、学会图解法求算解离度,了解电导测定得应用。 二、实验原理: 电解质溶液得导电能力由电导G来量度,它就是电阻得倒数,即: 电导得单位就是“西门子”,符号为“S”,。 将电解质溶液放入两平行电极之间,若两电极距离为l,电极面积为A,则溶液得电导为: 式中电导率,其物理意义就是l=1m,A=1m2时溶液得电导,其单位为S·m-1。定义电导池系数 则 通常将一个电导率已知得电解质溶液注入电导池中,测其电导,根据上式即可求出K cell。 在研究电解质溶液得导电能力时,经常使用摩尔电导率,其定义为: 式中c为电解质溶液得浓度,得单位就是:S·m2·mol-1。 对于弱电解质(例如醋酸)来说,由于其电导率很小,所以测得得溶液得电导率应包括水得电导率,即 电解质溶液就是由正、负离子得迁移来传递电流得,在弱电解质溶液中,只有解离部分得离子才对电导有贡献,而在无限稀释得溶液中,电解质全部解离,其摩尔电导率就是正、负离子得极限摩尔电导率之与。即 式中ν+,ν-分别为正、负离子得化学计量数,可查表得到。 与得差别来自两个因素,一就是电解质得不完全电离,二就是离子间得相互作用。若溶液中离子浓度很低,彼此相隔较远,相互作用力可以忽略,则与之间得关系可表示为: (推导) 式中α为弱电解质得解离度。 醋酸在水溶液中有下列平衡: 其解离平衡常数为
(推导) 将代入上式整理可得 此式称为奥斯特瓦尔德(Ostwald)稀释定律。改写成线性方程为: 以对作图得一直线,斜率为,截距为,由此可求得与(推导) : 整理可得: 电解质溶液得电导通常利用惠斯登(Wheatston)电桥测量, 但测量时不能用直流电源,因直流电流通过溶液时,导致电化 学反应发生,不但使电极附近溶液得浓度改变引起浓差极化, 还会改变两极得本质。因此必须采用较高频率得交流电,其 频率通常选为1000Hz。另外,构成电导池得两极采用惰性铂 电极,以免电极与溶液间发生化学反应。 惠斯登电桥得线路如图8-1所示,其中S为交流信号发生器, R1、R2与R3就是三个可变交流变阻箱得阻值,R x为待测溶液得阻值,H为耳机(或示波器),C1为在R3上并联得可变电容器,以实现容抗平衡。测定时,调节R1、R2、R3与C1,使H中无电流通过,此时电桥达到了平衡。则有: 即 R x得倒数即为溶液得电导,即 由于温度对溶液得电导有影响,因此实验应在恒温条件下进行。 本实验通过测定0、02mol KCl溶液得电阻,求得电导池系数通过测定水、醋酸溶液得电导G,分别求出其电导率 根据两式计算出各浓度醋酸溶液得,最后以 三、仪器与药品 交流信号发生器1台 恒温槽1台(图) 示波器1台(图) 可变电阻箱1个(图) 电导电极1个(图) 电导池1个(图) 10mL移液管2支 0、02 mol·dm-3氯化钾溶液、0、1 mol·dm-3乙酸溶液、电导水
(完整版)弱电解质的电离练习题(带答案)
弱电解质的电离 山海2012-11-30 一、选择题 1.下列说法下列正确的是 A 、强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子 B 、强电解质的水溶液导电性强于弱电解质的水溶液 C 、强电解质都是离子化合物,弱电解质都是共价化合物 D 、强电解质易溶于水,弱电解质难溶于水 2. 已知HClO 是比H 2CO 3还弱的酸,氯水中存在下列平衡:Cl 2+H 2O HCl+HClO ,HClO H ++ClO — ,达平衡后,要使HClO 浓度增加,可加入 A 、H 2S B 、CaCO 3 C 、HCl D 、NaOH 3.将浓度为0.1mol ·L -1 HF 溶液加水不断稀释,下列各量始终保持增大的是 A. c (H +) B. )(HF K a C. )()(+-H c F c D. )()(HF c H c + 4.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电 能力变化如图所示,下列说法正确的是( ) A. a 、b 、c 三点溶液的pH :c 弱电解质的电离测试题及 答案 Revised by Jack on December 14,2020 弱电解质的电离练习一 1、下列物质是电解质的是() A、硫酸溶液 B、食盐 C、酒精 D、铜 2、下列电离方程式中正确的是() A、NH 3·H 2 O == NH 4 ++OH- B、NaHCO 3 == Na++HCO 3 - C、H 2S ≒ 2H++S2- D、KClO 3 == K++Cl-+3O2- 3、下物质分类组合正确的是() A B C D 强电解质:HBr FeCl3 H3PO4 Ca(OH)2 弱电解质:HF HCOOH BaSO4 HI 非电解质:CCl4 Cu H2O C2H5OH 4、下列叙述中,能说明某化合物一定是弱电解质的是:() A、该化合物水溶液不导电; B、该化合物饱和溶液导电能力较弱 C、.该化合物在熔融时不导电; D、该化合物溶于水中发生电离,溶质离子浓度小于溶质分子浓度 5、关于强弱电解质的导电性的正确说法是() A、由离子浓度决定; B、没有本质区别; C、强电解质溶液导电能力强,弱电解质溶液导电能力弱; D、导电性强的溶液里自由移动的离子数目一定比导电性弱的溶液里自由移 动的离子数多 6、某固体化合物A不导电,但熔化或溶于水都能完全电离,下列关于A的说法 中正确的是() A、A为非电解质 B、A是强电解质 C、A是分子晶体 D、A为弱电解质 7、下列反应的离子方程式可用H=+OH-=H 2 O表示的有() A、盐酸和氨水反应 B、稀硝酸和氢氧化钾溶液反应 C、碳酸氢钠溶液和氢氧化钠溶液反应 D、硫酸溶液和氢氧化钡溶液反应 8、在KHSO 4 的稀溶液和熔融状态下都存在的离子是() A、H+ B、HSO 4- C、SO 4 2- D、K+ 弱电解质的电离练习二 1、下列说法正确的是() A、强酸、强碱都是强电解质; B、可溶性碱都是强电解质; C、不溶于水的化合物都是弱电解质或非电解质; D、能导电的物质都是电解质 2、在水溶液或熔化状态下能导电的叫电解质;在不能 导电的化合物叫非电解质。电解质可分为和。在水溶液中能称为强电解质,和绝大多数盐属于强电解质。在水溶液中称为弱电解质,弱酸、弱碱属于。 电导测定的应用 基本原理: 1.弱电解质电离常数的测定 本实验是通过对不同浓度HAc溶液的电导率的测定来确定电离平衡常数 对于HAc,在溶液中电离达到平衡时,电离平衡常数Kc与原始浓度C和电离度α有以下关系: HAc H+ + Ac- t=0 C 0 0 C(1-α) Cα Cα t=t 平衡 K= (Cα)2 =Cα 2 (1) C(1-α) 1-α 当T一定时,K一般为常数,因此,在确定c之后,可通过电解质α的测定求得K。电离度α等于浓度为c时的摩尔电导率Λm与溶液无限稀释时的摩尔电导率之比,即 α=Λm/Λ∞m (2) 将(2)代入(1) K= CΛ2m/ [Λ∞m(Λ∞m-Λm)] (3) 整理得 CΛm = K(Λ∞m)2 (4) Λm- KΛ∞m 以CΛm对1/Λm作图,其直线的斜率为K(Λ∞m)2 ,如知道Λ∞m值(可有文献查得),就可算出K。 文献:25℃时无限稀释的HAc水溶液的摩尔电导率=3.907*10-2(S·m2·m-1) 电解质溶液的导电能力通常用电导G来表示,若将电解质溶液放入两平行电极之间,设电极的面积为A,两电极的间的距离为l,则溶液的电导G为: G = к(A / l) (5) 即к= G * 1 / A = G K cell 来表示,它的式中к为该溶液的电导率,其单位是S.m-1;l/A为电导池常数,以K cell 单位为m-1。 由于电极的l和A不易精确测量,因此在实验中用一种已知电导率的溶液先求出电导池的常数Kcell,然后再把欲测的的溶液放入该电导池中测出其电导值,在根据上式求出其电导率。 在讨论电解质溶液的电导能力时常用摩尔电导率(Λm)这个物理量。摩尔电导率与电导率的关系: 3-1《弱电解质的电离》课时练 双基练习 1.下列状态时,不能导电的电解质是() A.液态氯化氢 B.熔融食盐 C.胆矾晶体D.氯水 解析:氯水是混合物,能导电;熔融的食盐能导电。 答案:AC 2.下列电解方程式书写错误的是() A.(NH4)2SO4溶于水:(NH4)2SO4===2NH+4+SO2-4 B.H3PO4溶于水:H3PO43H++PO3-4 C.HF溶于水:HF H++F- D.NaHS溶于水:NaHS===Na++HS-,HS-H++S2- 解析:H3PO4溶于水要分步电离:H3PO4H++H2PO-4、H2PO-4 H++HPO2-4、HPO2-4H++PO3-4。 答案:B 3.下列物质中的分类组合正确的是() 解析:CaCO3应为强电解质,Cu既不是电解质,也不是非电解质, H2O是极弱的电解质。 答案:AD 4.关于强、弱电解质叙述正确的是() A.强电解质都是离子化合物,弱电解质都是共价化合物 B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物 C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子 D.强电解质的水溶液导电能力强,弱电解质的水溶液导电能力弱 解析:A项,部分共价化合物是强电解质;B项强电解质有些是难溶性的,如BaSO4;C项,强电解质在水中完全电离无溶质分子,弱电解质在水中部分电离,有溶质分子。D项,水溶液的导电能力取决于溶液中离子浓度大小,与电解质的强弱无关。 答案:C 5.(2011·广东模拟)下列对氨水溶液中存在的电离平衡NH3·H2O NH+4+OH-叙述正确的是() A.加水后,溶液中n(OH-)增大 B.加入少量浓盐酸,溶液中c(OH-)增大 C.加入少量浓NaOH溶液,电离平衡向正反应方向移动 D.加入少量NH4Cl固体,溶液中c(NH+4)减少 解析:A项加水使NH3·H2O电离,使n(OH-)增大;B项加入少量浓盐酸使c(OH-)减小;C项加入浓NaOH溶液,平衡向左移动;D项,加NH4Cl固体,c(NH+4)增大。 电导法测定酶活力 摘要 我们已经测定了脲酶,脂肪酶,葡萄糖苷酶水解过程中的电导率的变化,这些变化严格地与前两个体系中碳酸铵的释放和第三个体系中氨基的数目成正比。电导率的方法运用在酶和各种生理液浓度的测定中。 引言 Sjoquist,Oker-Blom,Henri,des Bancels 和Bayliss 证实了用电导法测定酶活性的可能性。最近,Northrop在他的课程中也用了这种方法研究胃蛋白酶,测定了卵蛋白盐酸盐的的水解,解释了水解底物的依赖性电离,并研究有关机制的胰蛋白酶消化的动力学。Euler 欧拉一直采用这种方法研究甘肽的水解。Bayliss通过研究脲酶,脂肪酶,葡萄糖苷酶的行为证实了电导率的可能性,但没有报道过任何与这些系统相关的研究。 以电导判断为目的,酶反应可以归类为:(1)那些释放强烈电子的,(2)释放那些弱离的电解质,(3)那些传统被认为非电解质的。脲脲酶,sinigrin- myrosin,和丙酮醛-乙二醛是属于第一类,而蛋白质水解系统,会有氨基酸的产生,属于第二类。第三组的代表是碳水化合物和大多数的葡萄糖苷酶,作用于他们各自的底物,释放糖类。该反应属于第一组,显然最适合电导研究。第二组反应有一定的局限性和一定的困难,但是随后能使用一个敏感的设备。第三组反应,就目前来说,超过了其研究的范围,在他们的使用范围内,有一定的优势,在硼酸盐,硫酸盐,和钼酸存在条件下,多元醇像糖一样表现出导电性增强。 最强烈的反对意见,提出了该方法不能研究缓冲系统。反应过程中不仅有因为反应的变化,而且有水解产物的累积,为了确定酶的活性,我们必须关注最初阶段的反应过程,使干扰因素控制在最小值。在这段阶段,电导率的方法也许是唯一一个有任何的优势且可以应用方法。因为它能够给人们提供早期反应阶段的大量数值。由于在这些反应中介质的pH值很少有变化,Northrop在pH值6.2至6.4胰蛋白酶明胶的水解不伴pH值的改变而改变。在低浓度电解质中杂质的存在不影响测量,因为可以选择适当的电导率细胞给出须需要的精度。 与其他物理方法相比,电导率测量有着在反应过程中不受干扰和能适用于极小批量底物中的优势。 实验部分 用目前的方法对脲-脲酶,精氨酸-精氨酸酶-脲酶,蛋白胨-胰蛋白酶-激酶和杨素- 苦杏仁酶进行了研究。 通常采用Kohlrausch电桥法测量电导率。一个校准Kohlrausch滑线,4号电阻箱和一个Arrhenius-Ostwald细胞组成了电路的元件。一个5毫升整数倍的底物溶液对工作是必要的。采用铂电极,提供的细胞是在水中浸泡,恒温维持在30.0 ℃±0.1 ℃。当高频电流源和一个电话的听筒用于零点检测时,提供1000 Hz的音频振荡器被使用。该导电细胞的电容通过一个与电阻箱并联的的空气冷凝器平衡。在反应开始,在很短的时间间隔内读数,后来时间间隔较长。利用相对应的酶底物浓度,大量的实验同时在单一的反应容器进行时。对在一定的时间间隔内从反应容器中倒出的等份反应混合物进行分析。因此该反应过程可由一个完全独立的化学方法而知。 脲-脲酶。利用丙酮使一个百分之一的尿素溶液(Kahlbaum)和大豆脲酶的水溶液沉淀。由Sastri 1935年提出的方法有碳酸铵的释放,包括在丙酮中用标准酒精盐酸溶液(0.1 N)滴定等份反应混合物。 精氨酸-精氨酸酶-脲酶。精氨酸碳酸盐是在5%的d-精氨酸中通入二氧化碳至饱和制备而成的。过量的二氧化碳是通过电解溶液中的氢冒泡而赶出的。因此获得的精氨酸碳酸盐溶液呈稳定电导率值。水溶性萃取液丙酮使公羊肝中的提取物沉淀,因此可作为精氨酸酶的来源。因为脲酶几乎瞬间水解、随着精氨酸分解逐步释放,我们需要使用过多的脲酶以确保反 实验二 电导法测定弱电解质的电离常数 一、实验目的 1. 掌握电导测量的原理和方法。 2. 学会使用 DDS-11A 型电导率仪,测定弱电解质电离平衡常数的方法。 二、实验原理 AB 型(如HAc )弱电解质在溶液中的电离达到平衡时, HAc = H + + Ac - c(1-αc ) cαc cαc 其电离平衡常数(K c )与浓度(c )、电离度(αc )之间有如下的关系: c c c c K αα-=12 (1) 在一定温度下K c 是常数,因此可以通过测定AB 型弱电解质在不同浓度时的αc ,代入上式就可以求出K c 。 醋酸溶液的电离度可用电导法测定,溶液的电导用电导率仪测定。测定溶液的电导,要将被测溶液注入电导池中,如图1所示。 图1 浸入式电导池 若两电极间距离为l ,电极的面积为A ,则溶液电导G 为: G=К A/1 式中:К为电导率。电解质溶液的电导率不仅与温度有关,还与溶液的浓度有关。因此常用摩尔电导m λ来衡量电解质溶液的导电能力。m λ与К之间的关系为: m λ=10-3К/c 式中m λ的单位是S·m 2·mol -1,К的单位为S·m -1,c 的单位为mol·dm -3。 对于弱电解质,电离度αc 等于浓度为c 时的摩尔电导(m λ)和溶液在无限稀释时的摩尔电导(∞ m λ )之比,即: ∞ =m m c λλα (2) 将式(2)代入式(1): ) (2 m m m m c c c K λλλλ-=∞∞ c m κλ= ∞∞-?=m c m c K c K λκ λκ2 )( 以κ对 κ c 作图应为一直线,其斜率为2 )(∞m c K λ ,截距为)(∞ m c K λ ,根 据斜率和截距可算出 K c 和 ∞m λ 。 三、仪器及试剂 仪器:恒温装置 1套,DDS-11A 型电导率仪,电导电极,移液管(25 ml 、5 ml 和 1 ml 各 1支),容量瓶(50 ml 5只),250 ml 烧杯1只,洗耳球1只。 药品:0.0100 mol?dm -3 KCl 溶液(KCl 于110℃烘4h ),0.1000 mol?dm -3 HAc 溶液,电导水。 实验6 表面活性剂CMC值的测定——电导法 一、实验目的: 1、学习并掌握表面活性剂CMC值的电导测定方法; 2、了解表面活性剂的性质与应用; 3、学习电导法测定十二烷基硫酸钠的cmc,了解表面活性剂的特性及胶束形成原理; 4、掌握DDS-11A型电导率仪和恒温槽的使用方法。 二、实验原理: 具有明显“两亲”性质的分子,既含有亲油的足够长的烃基,又含有亲水的极性基团。由这一类分子组成的物质称为表面活性剂,见图1(a)。 表面活性剂为了使自己成为溶液中的稳定分子,有可能采取的两种途径:一是当它们以低浓度存在于某一体系中时,可被吸附在该体系的表面上,采取极性基团向着水,非极性基团脱离水的表面定向,形成定向排列的单分子膜,从而使表面自由能明显降低,见图1(c);二是在表面活性剂溶液中,当溶液浓度增大到一定值时,表面活性剂离子或分子不但在表面聚集而形成单分子层,而且在溶液本体内部也三三两两的以憎水基相互靠拢,聚在一起形成胶束。胶束可以成球状、棒状或层状。形成胶束的最低浓度称为临界胶束浓度(Critical Micelle Concentration, CMC),如图1(b)。 (a) (b) (c) 图1 CMC是表面活性剂的一种重要量度,CMC越小,则表示这种表面活性剂形成胶束所需浓度越低,达到表面(界面)饱和吸附的浓度越低,只有溶液浓度稍高于CMC时,才能充分发挥表面活性剂的作用。比如图2的洗涤去污过程。目前表面活性剂广泛用于石油、纺织、农药、采矿、食品、民用洗涤等各个领域,具有润湿、乳化、洗涤、发泡等重要作用。 图2 表面活性剂的洗涤原理图 由于溶液的结构发生改变,表面活性剂溶液的许多物理化学性质(如表面张力,电导.渗透压,浊度,光学性质等)都会随着胶团的出现而发生突变,原则上,这些物理化学性质随浓度的变化都可以用于测定CMC,常用的方法有表面张力法、电导法、染料法等。本实验采用电导法来测定表面活性剂的CMC值。在溶液中对电导有贡献的主要是带长链烷基的表面活性剂离子和相应的反离子,而胶束的贡献则极为微小。从离子贡献大小来考虑,反离子大于表面活性剂离子。对于浓度低于cmc的表面活性剂稀溶液,电导率的变化规律与强电解质一样,摩尔电导率λm与c、电导率κ与c均成线性关系。当溶液浓度达CMC时,随着溶液中表面活性剂浓度的增加,单体的浓度不再变化,增加的是胶束的个数,由于对电导贡献大的反离子固定于胶束的表面,它们对电导的贡献明显下降,电导率随溶液浓度增加的趋势将会变缓,这就是确定CMC的依据。 因此利用离子型表面活性剂水溶液的电导率随浓度的变化关系,作κ- c曲线,由曲线的转折点求出CMC值。 三、仪器与试剂: L十二烷基硫酸钠溶液; LKCl标准溶液;50ml容量瓶11;50mL烧杯一个;移液管一支);电导率仪一台,恒温槽一台。 四、实验步骤: 1、打开电导率仪开关,预热15min,用KCl标准溶液校正电极常数。 2、调节恒温槽温度为25度。 3、分别移取、、、、、、、、、、的L的十二烷基硫酸钠溶液,定容到50mL 。配制成浓度为×10-3、×10-3、×10-3、×10-3、×10-3、×10-2、×10-2、×10-2、×10-2、×10-2、×10-2mol/L的待测溶液。 电导法测定弱电解质的电离平衡常数及数据处 理 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-NUT108】 电导法测定醋酸电离常数 一、实验目的 1.了解溶液电导、电导率和摩尔电导率的概念; 2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。 二、实验原理 电解质溶液是靠正、负离子的迁移来传递电流。而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得。 一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ∞m是有差别的。这由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。所以,Λm通常称为表观摩尔电导率。 Λ m /Λ∞m=α(U++ U-)/(U+∞+ U-∞) 若U+= U-,,U+∞=U-∞则 Λ m /Λ∞m=α 式中α为电离度。 AB型弱电解质在溶液中电离达到平衡时,电离平衡常数K a,起始浓度C0,电离度α有以下关系:+ + B- 起始浓度mol/L:C0 0 0 平衡浓度mol/L:C0·(1-α) αC0 αC0 K c =[c(A+)/c][c(B-)/c]/[c(AB)/c]=C0α2/(1-α)=C0Λm2/[cΛ∞m(Λ∞m- Λ m )] 根据离子独立定律,Λ∞m可以从离子的无限稀释的摩尔电导率计算出来。 Λ m 可以从电导率的测定求得,然后求出K a。 Λ m C /c =Λ∞m2K c/Λm-Λ∞m K c 通过Λm C0/c ~1/Λm作图,由直线斜率=Λ∞m2K c,可求出K c。 三、仪器与试剂 DDS-11A(T)型电导率仪1台;恒温槽1套;L醋酸溶液。 四、实验步骤 培优教育一对一辅导教案讲义 在电解质溶液中,由于由水电离出来的H+ 和OH-的浓度始终相等,可依此列出质子守恒式。 如小苏打溶液中:c(OH-)=c(H+)+c(H2CO3)-c(CO32-)。 溶液中离子浓度的大小比较的规律: (1)多元弱酸溶液:多元弱酸分步电离且一步比一步更难电离。 如H3PO4溶液:c(H+)>c(H2PO4-)>c(HPO42-)>c(PO43-)。 (2)多元弱酸的正盐溶液:多元弱酸根离子分步水解且一步比一步更难水解。 如K2S溶液:c(K+)>c(S2-)>c(OH-)>c(HS-)>c(H+)。 (3)不同溶液中同一离子浓度的大小比较:要考虑溶液中其他离子对其的影响。 如在相同物质的量浓度的下列溶液中①NH4Cl、②CH3COONH4、③NH4HSO4,c(NH4+)由大到小的顺序是: ③>①>②。 (4)混合溶液中各离子浓度的大小比较:要考虑溶液中发生的水解平衡、电离平衡等。 如在0.1mol·L-1的NH4Cl溶液和0.1mol·L-1的氨水混合溶液中,各离子浓度由大到小的顺序是:c(NH4+)> c(Cl-)>c(OH-)>c(H+)。这是由于在该溶液中,NH3·H20的电离与NH4+的水解互相抑制,但NH3·H20的电离程度大于NH4+的水解程度。 一元强酸和一元弱酸的比较(以盐酸和醋酸为例) 1.同体积、等物质的量浓度的盐酸和醋酸 H+的物质的量浓度C(H+)酸性强弱 中和碱的能力(消耗相 同的碱液的多少) 与相同的活泼金属反 应的起始速率 产生H2 的总量 HCl大强大 CH3C OOH 小弱 相同 小 相等 2.同体积、H+的物质的量浓度相等(即PH相同)的盐酸和醋酸 溶质的物质的量浓度 C(酸)酸性 强弱 中和碱的能力(消耗 相同的碱液的多少) 与相同的活泼金属反 应过程中的平均速率 产生H2的总 量 HCl小弱小少 CH3COOH大相同 强大多 加水稀释后溶液pH的计算要注意三点 1.对于强酸溶液或弱酸溶液,每稀释10倍,pH是否都增加1个单位?对于强碱溶液或弱碱溶液,每稀释10倍,pH是否都减小1个单位? 对于强酸溶液,每稀释10倍,pH增大1个单位;对于弱酸溶液,每稀释10倍,pH增大不足1个单位.对于 电导法测定醋酸电离常数 一、实验目的 1.了解溶液电导、电导率和摩尔电导率的概念; 2.测量电解质溶液的摩尔电导率,并计算弱电解质溶液的电离常数。 二、实验原理 电解质溶液是靠正、负离子的迁移来传递电流。而弱电解质溶液中,只有已电离部分才能承担传递电量的任务。在无限稀释的溶液中可以认为电解质已全部电离,此时溶液的摩尔电导率为Λ∞m,而且可用离子极限摩尔电导率相加而得。 一定浓度下的摩尔电导率Λm与无限稀释的溶液中摩尔电导率Λ∞m是有差别的。这由两个因素造成,一是电解质溶液的不完全离解,二是离子间存在着相互作用力。所以,Λm通常称为表观摩尔电导率。 Λm/Λ∞m=α(U++ U-)/(U+∞+ U-∞) 若U+= U-,,U+∞=U-∞则 Λm/Λ∞m=α 式中α为电离度。 AB型弱电解质在溶液中电离达到平衡时,电离平衡常数 K a?,起始浓度C0,度α有以下关系:AB A+ + B- 起始浓度mol/L : C 0 0 0 平衡浓度mol/L : C 0·(1-α) αC 0 αC 0 K c ?=[c (A +)/c ?][c (B -)/c ?]/[c (AB)/c ?]=C 0α2/(1-α)=C 0 Λ m 2/[c ?Λ ∞ m (Λ ∞ m -Λm )] 根据离子独立定律,Λ ∞ m 可以从离子的无限稀释的摩尔电导 率计算出来。Λm 可以从电导率的测定求得,然后求出K a ?。 Λm C 0/c ? =Λ ∞ m 2K c ? /Λ m -Λ ∞ m K c ? 通过Λm C 0/c ? ~1/Λm 作图,由直线斜率=Λ∞ m 2K c ?,可求出K c ?。 三、仪器与试剂 DDS-11A(T)型电导率仪1台;恒温槽1套;0.1000mol/L 醋酸溶液。 四、实验步骤 1.调整恒温槽温度为25℃±0.3℃。 2.用洗净、烘干的义形管1支,加入20.00mL 的0.1000mol/L 醋酸溶液,测其电导率。 3.用吸取醋酸的移液管从电导池中吸出10.00mL 醋酸溶液弃去,用另一支移液管取10.00mL 电导水注入电导池,混合均匀,温度恒定后,测其电导率,如此操作,共稀释4次。 4.倒去醋酸溶液,洗净电导池,最后用电导水淋洗。注入20mL 电导水,测其电导率。 五、实验注意事项 1.本实验配制溶液时,均需用电导水。 2.温度对电导有较大影响,所以整个实验必须在同一温度下进行。每次用电导水稀释溶液时,需温度相同。因此可以预先把电导水装入锥形瓶,置于恒温槽中恒温。 六、数据记录及处理 第一次实验:实验温度:25.2℃,电导池常数K (l/A):0.94 m -1,Λ ∞ m =390.72 s.cm 2/mol -1 表1 醋酸电离常数的测定弱电解质的电离测试题及答案
电导测定的基本原理
弱电解质的电离练习题及答案解析
电导法测定酶活力
实验2 电导法测定弱电解质的电离常数
实验6__表面活性剂CMC值的测定——电导法
电导法测定弱电解质的电离平衡常数及数据处理完整版
(完整版)弱电解质的电离平衡溶液的酸碱性知识点及练习,推荐文档
电导法测定弱电解质的电离平衡常数及数据处理
