生物化学实验五——醋酸纤维素薄膜电泳法分离血清蛋白 山东大学实验报告

实验五醋酸纤维素薄膜电泳法分离血清蛋白
13生物基地 201300140059 刘洋 2015-04-29
同组者:张奕
一、实验目的
掌握醋酸纤维素薄膜电泳法分离血清蛋白的原理和方法。
二、实验原理
蛋白质是两性电解质。在pH值小于其等电点的溶液中,蛋白质为正离子,在电场中向阴极移动;在pH值大于其等电点的溶液中,蛋白质为负离子,在电场中向阳极移动。血清中含有数种蛋白质,它们所具有的可解离基团不同,在同一pH的溶液中,所带净电荷不同,故可利用电泳法将它们分离。
血清中含有清蛋白、α-球蛋白、β-球蛋白、γ-球蛋白等,各种蛋白质由于氨基酸祖坟、立体构象、相对分子质量、等电点及形状不同,在电场中迁移速度不同。由表可知,血清中5种蛋白质的等电点大部分低于pH值7.0,所以在pH8.6的缓冲液中,它们都电离成
在一定范围内,蛋白质的含量与结合的燃染料量成正比,故可将蛋白质区带剪下,分别用0.4mol/L NaOH溶液浸洗下来,进行比色,测定其相对含量。也可以将染色后的薄膜直接用光密度计扫描,测定其相对含量。
肾病、弥漫性肝损害、肝硬化、原发性肝癌、多发性骨髓瘤、慢性炎症、妊娠等都可以使白蛋白下降。肾病时α1、α2、β球蛋白升高,γ-球蛋白降低。肝硬化时α2、β-球蛋白降低,而α1、γ-球蛋白升高。
三、实验器材
1.醋酸纤维薄膜(2cm*8cm)
2.人血清;
3.烧杯及培养皿数只;
4.点样器;
5.镊子;
6.玻璃棒;
7.电吹风;
8.恒温水浴锅;
9.电泳槽;
10.直流稳压电泳仪;
11.剪刀
四、实验试剂
1.巴比妥-巴比妥钠缓冲液
2.染色液(可重复使用,使用后回收)
3.漂洗液(100ml每组):95%乙醇45ml,冰醋酸5ml,水50ml
4.透明液(20ml每组):无水乙醇14ml,冰醋酸6ml
5.健康人血清(新鲜,无溶血现象)
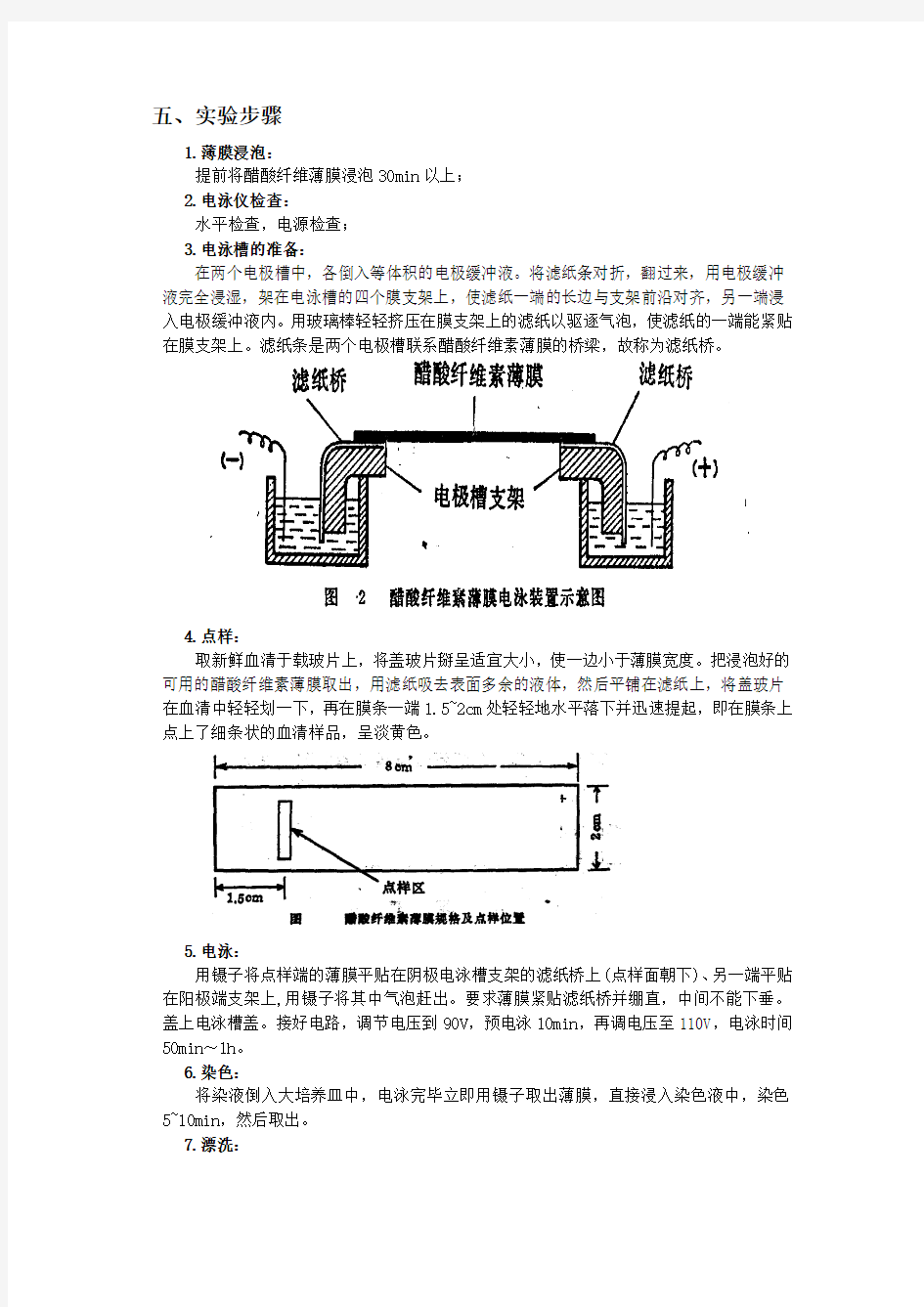
五、实验步骤
1.薄膜浸泡:
提前将醋酸纤维薄膜浸泡30min以上;
2.电泳仪检查:
水平检查,电源检查;
3.电泳槽的准备:
在两个电极槽中,各倒入等体积的电极缓冲液。将滤纸条对折,翻过来,用电极缓冲液完全浸湿,架在电泳槽的四个膜支架上,使滤纸一端的长边与支架前沿对齐,另一端浸入电极缓冲液内。用玻璃棒轻轻挤压在膜支架上的滤纸以驱逐气泡,使滤纸的一端能紧贴在膜支架上。滤纸条是两个电极槽联系醋酸纤维素薄膜的桥梁,故称为滤纸桥。
4.点样:
取新鲜血清于载玻片上,将盖玻片掰呈适宜大小,使一边小于薄膜宽度。把浸泡好的可用的醋酸纤维素薄膜取出,用滤纸吸去表面多余的液体,然后平铺在滤纸上,将盖玻片在血清中轻轻划一下,再在膜条一端1.5~2cm处轻轻地水平落下并迅速提起,即在膜条上点上了细条状的血清样品,呈淡黄色。
5.电泳:
用镊子将点样端的薄膜平贴在阴极电泳槽支架的滤纸桥上(点样面朝下)、另一端平贴在阳极端支架上,用镊子将其中气泡赶出。要求薄膜紧贴滤纸桥并绷直,中间不能下垂。盖上电泳槽盖。接好电路,调节电压到90V,预电泳10min,再调电压至110V,电泳时间50min~1h。
6.染色:
将染液倒入大培养皿中,电泳完毕立即用镊子取出薄膜,直接浸入染色液中,染色5~10min,然后取出。
7.漂洗:
配制好漂洗液,将染色完毕的薄膜自染液中取出,直接放入漂洗液中,连续更换几次漂洗液,直到薄膜背景几乎无色为止。 8.透明:
配制好透明液,用镊子将薄膜取出,贴在容器壁上(烧杯壁或培养皿上等),注意不可有气泡,用吹风机稍吹干薄膜,用胶头滴管淋洗薄膜,至薄膜透明,再用吹风机将薄膜彻底吹干,此时薄膜透明,小心将薄膜自容器壁上取下。
六、注意事项
1.点样应细窄、均匀、集中。点样量不宜过多,点样位置要合适。
2.两电泳槽内缓冲液面应在同一水平面,否则会因虹吸影响电泳效果。
3.醋酸纤维素薄膜一定要充分浸透后才能点样。点样后电泳槽一定要密闭。电流不宜过大,以防止薄膜干燥,电泳图谱出现条痕。
七、实验结果
染色后的薄膜上应显现清楚的五条区带。从正极端起,依次为清蛋白、α1球蛋白、α2球蛋白、β球蛋白和γ球蛋白。
然而由于一些问题,实际实验中得到的条带如下:
八、讨论与结论
本次实验得到的电泳带从效果来看不是太好,主要的问题有以下几个: 1.有些电泳带参差不齐;
2.个别电泳带的两条带之间界限不明显;
分析可能导致实验失败或误差的原因有以下几点:
1.将薄膜表面吸干时吸的太干或吸的不完全。因为点样时应将膜片表面多余的缓冲液用滤纸吸去,以免缓冲液太多引起样品扩散。但也不能吸得太干,太干则样品不易进入薄膜的网孔内,而造成电泳起始点参差不齐,影响分离效果。吸水量以不干不湿为宜;
2.用镊子取薄膜并吸干、点样的过程中,薄膜可能受到了异物污染;
3.缓冲液选择浓度不合适。因为缓冲液浓度过低,则区带泳动速度快,并由于扩散变宽;缓冲液浓度过高,则区带泳动速度慢,区带分布过于集中不易分辨;
4.电流强度控制的不好,因为电流强度高,尤其在温度较高的环境中,可引起蛋白质变性或由于热效应引起缓冲液中水分蒸发,使缓冲液浓度增加,造成膜片干涸。电流过低,则样品泳动速度慢且易扩散;
5.染色时间控制不合适。因为时间长,薄膜底色深不易脱去;时间短,着色浅不宜区分,或造成条带染色不均。
正
血清蛋白醋酸纤维薄膜电泳及其定量 实验报告
生物化学实验报告 姓名: 学号: 专业年级: 组别: 生物化学与分子生物学实验教学中心 实验名称血清蛋白醋酸纤维薄膜电泳及其定量 实验日期实验地点 合作者指导老师 评分教师签名批改日期 一、实验目得 1、1、学习醋酸纤维薄膜电泳得基本原理与操作方法; 1、2、了解电泳技术得一般原理; 1、3、掌握电泳分离血清蛋白质及其定性定量得方法。 二、实验原理 2、1、血清中各种蛋白质得等电点不同,一般都低于pH7、4。它们在pH8、6得缓冲液中均解离带负电荷,在电场中向正极移动.由于血清中各种蛋白质分子大小、形状及所带得电荷量不同,在醋酸纤维素薄膜上电泳得速度也不同。因此可以将它们分离
为清蛋白(Albumin)、α1-球蛋白、α2-球蛋白、β-球蛋白、γ-球蛋白5条区带. 2、2、血清中不同蛋白质得等电点、分子量及含量 血清蛋白质等电点分子量占总蛋白 得% 清蛋白4、6469,000 57~72 α1-球蛋白5、06 200,000 2~5 α2—球蛋白 5、06 300,000 4~9 β-球蛋白 5、12 90,000~150,000 6、5~12 γ—球蛋白 6、85~7、3 156,000~950,000 12~20 缓冲液pH=8、6,pI<pH. 血清蛋白带负电荷,在电场中向正极移动。 预测血清蛋白电泳区带图 血清蛋白依次分为清蛋白,球蛋白得α1、α2、β、γ五个区带 2、3、①膜条经过氨基黑10B染色后显出清晰色带;②各色带蛋白质含量与染料结 合量基本成正比;③可将各色带剪开,分别溶于碱性溶液中;④用分光光度法计算各种 蛋白质得百分数。
三、材料与方法: 3、1、实验材料: 3、1、1、实验试剂:①样品:健康人血清(新鲜、无溶血);②巴比妥—巴比妥钠缓冲液(pH8、6,离子强度0、06mol/L);③氨基黑10B染色液;④漂洗液;⑤洗脱液:0、4mol/NaOH溶液。 3、1、2、实验器材:①V-1100分光光度计(×1);②恒温水浴箱(×1); ③试管(×6)、试管架(×1);④1000μL加样枪(×1)、加样枪架(×1);⑤醋酸纤维薄膜(2cm*8cm,厚度120μm);⑥培养皿(×5);⑦点样器或载玻片(×1);⑧平头镊子(×2);⑨剪刀(×1);⑩电泳槽(×1);?直流稳压电泳仪(×1) 3、2、实验步骤
生物化学实验六——酵母RNA的提取与含量测定 山东大学实验报告
实验六——酵母RNA的提取与含量测定 13生物基地 201300140059 刘洋 2015-05-10 同组者:张奕 一、实验目的 1.掌握稀碱法提取酵母RNA的原理和方法。 2.掌握紫外分光光度计的使用。 3.了解和掌握紫外吸收法测定RNA浓度的原理。 二、实验原理 酵母核酸中RNA含量较多,DNA则少于2%。RNA可溶于碱性溶液,当碱被中和后,可加乙醇使其沉淀,由此即可得到RNA制品。但是用碱液提取的RNA有不同的降解。 核酸及其衍生物,核苷酸、核苷、嘌呤和嘧啶有吸收紫外光的性质,其吸收高峰在260nm 左右,且一定浓度范围内其浓度与吸光度成正比(浓度为5μg/ml—45μg/ml吸光度与浓度成正比),利用此性质,可用RNA标准液绘制RNA吸光标准曲线(标准曲线的斜率为0.022-0.024左右),测定样品RNA浓度。由于蛋白质在280nm的光吸收,对核酸测定有一定的干扰作用,最大吸收峰在280nm处,原因是蛋白质组成中常含有酪氨酸和色氨酸等芳香族氨基酸。所以如果有蛋白质的干扰必须得先测260nm处的吸光度,再测280nm处的吸光度,通过计算消除其对核酸的影响。 三、实验器材 干酵母粉 电子天平 量筒 容量瓶100ml 磁力搅拌器 试管 100℃水浴锅pH试纸(pH1-14)烧杯 离心机 722型分光光度计锥形瓶 离心管 四、实验试剂 0.2%氢氧化钠溶液95%乙醇 无水乙醚酸性乙醇(5ml浓Hcl加入到500ml95%乙醇中混匀)RNA标准蛋白溶液(200μg/ml)
1.RNA的提取 (1)称取4g干酵母粉,放入200ml锥形瓶中,加入40ml0.2%的氢氧化钠溶液混匀,在沸水浴中煮沸30min中并冷却; (2)冷却后,把液体倒入离心管中,在4000r/min的条件下离心15min; (3)离心后留上清液加入95%的酸性乙醇40ml,边加边搅拌,静置5min左右,再4000r/min的条件下离心5min; (4)离心后保留沉淀,用20ml 95%乙醇分两次洗涤沉淀,每次洗后在3000r/min的条件下离心5min; (5)离心后的沉淀再用无水乙醇10ml洗涤两次,每次用3000r/min离心5min; (6)离心结束后,收集沉淀与滤纸上,称重备用。 2.RNA样液的配制 (1)取粗RNA0.2-0.25g与烧杯中,加入5mlNaOH溶液,搅拌,溶解,调成糊状。 (2)再加入蒸馏水40ml,搅拌混匀,调PH至7.0后,放入100ml容量瓶中定容。 (3)再分3-4次分别取2ml定容后溶液于100ml容量瓶中继续定容待测,并且把容量瓶依次编号为A、B、C。 3.RNA标准曲线的绘制 (1)取洁净的试管,依次标号为1-10、A、B、C后,按照下表分别往各试管中加所需液体,并用磁力搅拌器混匀。 (2)混匀后以0号试管为参比液,在260nm下测各试管的吸光度A,并根据0-9试管的吸光值绘制出RNA标准曲线,并最终得出样品的浓度。 六、注意事项 1.离心机的使用,使用前一定要将两离心液(包括外壳)在天平上调平,对称放置在离 心机上,防止力臂不对称而损坏离心机。 2.紫外分光光度计的使用,要先预热10分钟,往比色皿中到液体只需到三分之二即可, 防止液体溢出腐蚀仪器,爱护仪器。
(完整word版)生物化学实验知识点整理,推荐文档
生物化学实验知识点整理 实验一 还原糖的测定、实验二 粮食中总糖含量的测定 1.还原糖测定的原理 3,5-二硝基水杨酸与还原糖溶液共热后被还原成棕色的氨基化合物,在550nm 处测定光的吸收增加量,得出该溶液的浓度,从而计算得到还原糖的含量 2.总糖测定原理 多糖为非还原糖,可用酸将多糖和寡糖水解成具有还原性的单糖,在利用还原糖的性质进行测定,这样就可以分别求出总糖和还原糖的含量 3.电子天平使用 4.冷凝回流的作用: 使HCl 冷凝回流至锥形瓶中,防止HCl 挥发,从而降低HCl 的浓度。 5.多糖水解方法: 加酸进行水解 6.怎样检验淀粉都已经水解: 加入1-2滴碘液,如果立即变蓝则说明没有完全水解,反之,则说明已经完全水解。 7.各支试管中溶液的浓度计算 8.NaOH 用量:HCl NaOH n n = 9.不能中途换分光光度计,因为不同的分光光度计的光源发光强度不同 10.分光光度计的原理:在通常情况下,原子处于基态,当通过基态原子的某辐射线所具有的能量(或频率)恰好符合该原子从基态跃迁到激发态所需的能量(或频率)时,该基态原子就会从入射辐射中吸收能量,产生原子吸收光谱。原子的能级是量子化的,所以原子对不同频率辐射的吸收也是有选择的。这种选择吸收的定量关系服从式/E h hc νλ?==。 实验证明,在一定浓度范围内,物质的吸光度A 与吸光样品的浓度c 及厚度L 的乘积成正比,这就是光的吸收定律,也称为郎伯-比尔定律 分光光度计就是以郎伯比尔定律为原理,来测定浓度 11.为什么要水解多糖才能用DNS 因为DNS 只能与还原糖溶液在加热的条件下反应生成棕红色的氨基化合物,不能与没有还原性的多糖反应。 12.为什么要乘以0.9 以0.9才能得到多糖的含量。 13.为什么要中和后再测? 因为DNS 要在中性或微碱性的环境下与葡萄糖反应 实验三 蛋白质的水解和纸色谱法分离氨基酸、实验四 考马斯亮蓝法测定蛋白质浓度 1.纸色谱分离氨基酸分离原理 由于各氨基酸在固定相(水)和流动相(有机溶剂)中的分配系数不同,从而移动速度不同,经过一段时间后,不同的氨基酸将存在于不同的部位,达到分离的目的。 2.天然氨基酸为L 型 3.酸式水解的优点是:是保持氨基酸的旋光性不变,原来是L 型,水解后还是L 型,由于甘氨酸所有的R 基团是氢原子,所以它不是L 型
生物化学实验的答案
生物化学实验的答案 Document number【980KGB-6898YT-769T8CB-246UT-18GG08】
生物化学实验的答案 一、理论考试部分 1.醋酸纤维薄膜电泳时,点样的一端应靠近电极的哪一端为什么 2. 答:负极。因为血清中各种蛋白质在PH为8.6的环境中均带负电,根据同性相吸,异性相斥原理,点样端在负极时蛋白质向正极泳动从而实现蛋白质分离。 3.用分光光度计测定物质含量时,设置空白对照管的意义是什么? 答:空白对照是为了排除溶剂对吸光度的影响。溶液的吸光度表示物质对光的吸收程度,但是作为溶剂也能吸收,反射和透射一部分的光,因此必须以相同的溶剂设置对照,排除溶剂对吸光度的影响。 4.简述血清蛋白的醋酸纤维薄膜电泳的原理? 答:血清蛋白中各种蛋白质离子在电场力的作用下向着与自身电荷相反的方向涌动,而各种蛋白质等电点不同,且在PH为8.6时所带电荷不同,分子大小不等,形状各有差异,所以在同一电泳下永动速度不同从而实现分离。 5.何谓R f值?影响R f值的主要因素是什么? 答:Rf是原点到层析中心的距离与原点到溶剂前沿的距离之比。Rf的大小与物质的结构,性质,溶剂系统,层析滤纸的质量和层析温度有关, 6.什么是盐析盐析会引起蛋白质变性吗一般我们用什么试剂做盐析的实验 答:盐析是指当溶液中的中性盐持续增加时,蛋白质的溶解度下降,当中性盐的浓度达到一定程度的时候,蛋白质从溶液中析出的现象。盐析不会引起蛋白质的变性。一般用饱和硫酸铵溶液进行盐析。 7.简述DNS法测定还原糖浓度的实验原理? 答:还原糖与DNS在碱性条件下加热被氧化成糖酸,而DNS被还原为棕红色的3-氨基-5-硝基水杨酸。在一定范围内还原糖的量与3-氨基-5硝基水杨酸颜色的深浅成正比,用分光光度计测出溶液的吸光度,通过查对标准曲线可计算出3-氨基-5硝基水杨酸的浓度,从而得出还原糖的浓度。 8.依据我们所做的实验,说明影响蛋白质沉淀的因素是什么影响蛋白质变性的因素是什 么沉淀和变性有何联系 答:水溶液中的蛋白质分子由于表面形成水化层和双电层从而形成稳定的亲水胶体颗粒,在一定的理化因素影响下蛋白质颗粒因失去电荷和脱水而沉淀。这些因素包括溶液的酸碱度、盐溶液的浓度、温度、重金属离子以及有机溶剂等。变性蛋白质不一定沉淀,沉淀的蛋白质不一定变性。 8. 什么是碘值脂肪的不饱和程度越大,碘值越大吗在测定碘值的实验中,氯仿的作用是什么 答:每100g脂肪所吸收的碘的克数,即脂肪的碘值。脂肪的不饱和度越大,碘值就越大。氯仿作为溶剂,去溶解脂肪。
血清蛋白质醋酸纤维薄膜电泳实验报告
血清蛋白质醋酸纤维薄膜电泳实验报告 实验名称血清蛋白醋酸纤维薄膜电泳及其定量 实验日期实验地点xx实验室 合作者xxx 指导老师xxx 评分教师签名批改日期 一、实验目的 1.1.学习醋酸纤维薄膜电泳的基本原理和操作方法; 1.2.了解电泳技术的一般原理; 1.3.掌握电泳分离血清蛋白质及其定性定量的方法。 二、实验原理 2.1.血清中各种蛋白质的等电点不同,一般都低于pH7.4。它们在pH8.6的缓冲液中均解离带负电荷,在电场中向正极移动。由于血清中各种蛋白质分子大小、形状及所带的电荷量不同,在醋酸纤维素薄膜上电泳的速度也不同。 血清蛋白质等电点分子量占总蛋白的% 清蛋白 4.64 69,000 57~72 α1-球蛋白 5.06 200,000 2~5 α2-球蛋白 5.06 300,000 4~9 β-球蛋白 5.12 90,000~150,000 6.5~12 γ-球蛋白 6.85~7.3 156,000~950,000 12~20 缓冲液pH=8.6,pI<pH。
血清蛋白带负电荷,在电场中向正极移动。 预测血清蛋白电泳区带图 血清蛋白依次分为清蛋白,球蛋白的α1、α2、β、γ五个区带 2.3.①膜条经过氨基黑10B染色后显出清晰色带;②各色带蛋白质含量与染料结合量基本成正比;③可将各色带剪开,分别溶于碱性溶液中;④用分光光度法计算各种蛋白质的百分数。 三、材料与方法: 3.1.实验材料: 3.1.1.实验试剂:①样品:健康人血清(新鲜、无溶血);②巴比妥-巴比妥钠缓冲液(pH8.6,离子强度0.06mol/L);③氨基黑10B染色液;④漂洗液;⑤洗脱液:0.4mol/NaOH溶液。 3.1.2.实验器材:①V-1100分光光度计(×1);②恒温水浴箱(×1);③试管(×6)、试管架(×1);④1000μL加样枪(×1)、加样枪架(×1);⑤醋酸纤维薄膜(2cm*8cm,厚度120μm);⑥培养皿(×5);⑦点样器或载玻片(×1);⑧平头镊子(×2);⑨剪刀(×1);⑩电泳槽(×1);?直流稳压电泳仪(×1) 3.2.实验步骤 1.准备与点样:①取2×8cm的膜条;②亚光面距一端1.5cm处取一点样线;③充分浸透在巴比妥缓冲液中;④取出膜条,用滤纸吸去多余的缓冲液;⑤点样器下端粘上薄层血清;⑥垂直点样。 点样示意图:
山东大学操作系统实验报告4进程同步实验
山东大学操作系统实验报告4进程同步实验
计算机科学与技术学院实验报告 实验题目:实验四、进程同步实验学号: 日期:20120409 班级:计基地12 姓名: 实验目的: 加深对并发协作进程同步与互斥概念的理解,观察和体验并发进程同步与互斥 操作的效果,分析与研究经典进程同步与互斥问题的实际解决方案。了解 Linux 系统中 IPC 进程同步工具的用法,练习并发协作进程的同步与互斥操作的编程与调试技术。 实验内容: 抽烟者问题。假设一个系统中有三个抽烟者进程,每个抽烟者不断地卷烟并抽烟。抽烟者卷起并抽掉一颗烟需要有三种材料:烟草、纸和胶水。一个抽烟者有烟草,一个有纸,另一个有胶水。系统中还有两个供应者进程,它们无限地供应所有三种材料,但每次仅轮流提供三种材料中的两种。得到缺失的两种材料的抽烟者在卷起并抽掉一颗烟后会发信号通知供应者,让它继续提供另外的两种材料。这一过程重复进行。请用以上介绍的 IPC 同步机制编程,实现该问题要求的功能。 硬件环境: 处理器:Intel? Core?i3-2350M CPU @ 2.30GHz ×4 图形:Intel? Sandybridge Mobile x86/MMX/SSE2 内存:4G 操作系统:32位 磁盘:20.1 GB 软件环境: ubuntu13.04 实验步骤: (1)新建定义了producer和consumer共用的IPC函数原型和变量的ipc.h文件。
(2)新建ipc.c文件,编写producer和consumer 共用的IPC的具体相应函数。 (3)新建Producer文件,首先定义producer 的一些行为,利用系统调用,建立共享内存区域,设定其长度并获取共享内存的首地址。然后设定生产者互斥与同步的信号灯,并为他们设置相应的初值。当有生产者进程在运行而其他生产者请求时,相应的信号灯就会阻止他,当共享内存区域已满时,信号等也会提示生产者不能再往共享内存中放入内容。 (4)新建Consumer文件,定义consumer的一些行为,利用系统调用来创建共享内存区域,并设定他的长度并获取共享内存的首地址。然后设定消费者互斥与同步的信号灯,并为他们设置相应的初值。当有消费进程在运行而其他消费者请求时,相应的信号灯就会阻止它,当共享内存区域已空时,信号等也会提示生产者不能再从共享内存中取出相应的内容。 运行的消费者应该与相应的生产者对应起来,只有这样运行结果才会正确。
生化实验操作考核要点(新)
【实验操作考核要点】 一、目的要求 1.掌握组织样品的制备方法,了解其注意事项。 2.了解肝糖原提取、糖原和葡萄糖鉴定与蒽酮比色测定糖原含量的原理和注意事项,掌握其操作方法。 3.正确操作使用刻度吸管和可调微量移液器。 4.熟练运用溶液混匀的各种方法(视具体情况,采用合适的混匀方法)。 5.正确掌握溶液转移的操作。 6.正确操作使用分光光度计。 二、操作考核内容 按百分制计。 1.吸量管操作(20分); 2.可调式微量移液器操作(20分); 3.溶液混匀操作(视具体情况,采用合适的混匀方法)(15分); 4.溶液转移操作(10分); 5.分光光度计比色操作(25分)。 6.整体表现(10分)。 三、操作考核标准 (一)吸量管操作(20分,每项操作5分) 1.执管 要求右手拿吸量管,左手拿橡皮球,只能用食指而不能用拇指按压吸量管上口来调节吸取液量的刻度;吸液、排液整个操作过程吸量管应始终保持垂直。 2.坐姿 要求腰、背保持竖直,看刻度时眼睛保持平视。 3.吸取溶液 吸量管插入液面深度约0.5cm,不能一插到底,也不能插入过浅而吸进空气致使溶液进入橡皮球内;调控吸量管吸取液量的刻度时,吸量管尖应离开液面靠在容器内壁上。 4.排出液体
吸量管尖应靠上受纳容器内壁,让管内溶液自然流出。不能用橡皮球吹压,而且在流净后吸量管尖停靠受纳容器内壁至少3秒。 (二)可调式微量移液器操作(20分,每项操作5分) 1.设定容量值 转动加样器的调节旋钮,反时针方向转动旋钮,可提高设定取液量。顺时针方向转动旋钮,可降低设定取液量。在调整设定移液量的旋钮时,不要用力过猛,并应注意使取液器显示的数值不超过其可调范围。 2.吸液 (1)选择合适的吸头安放在取液套筒上,稍加扭转压紧吸嘴使之与套筒之间无空气间隙; (2)把按钮压至第一停点,垂直握持加样器,使吸头浸入液面下2~3毫米处,然后缓慢平稳地松开按钮,吸入液体,等一秒钟,然后将吸头提离液面,贴壁停留2-3秒,使管尖外侧的液滴滑落。 3.放液 (1)将吸头口贴到容器内壁底部并保持100°~40°倾斜; (2)平稳地把按钮压到第一停点,等一秒钟后再把按钮压到第二停点以排出剩余液体; (3)压住按钮,同时提起加样器,使吸头贴容器壁擦过,再松开按钮。按吸头弹射器除去吸头。 4.压放按钮时保持平稳;加样器不得倒转;吸头中有液体时不可将加样器平放。取液器吸嘴为一次性使用。实验完毕,将取液器读数调至最大量程值,竖立放于支架上。 (三)溶液的混匀(操作流程中下划实线的三处,每项操作5分,共15分)1.肝糖原的提取与鉴定操作中,肝匀浆上清液中加5ml 95%乙醇后的混匀最好用倾倒混匀,也可用滴管或吸量管吸、吹混匀,或用玻璃棒搅拌混匀。 2.肝糖原定量测定中,肝组织消化液沸水浴后全部转入100 ml容量瓶,加水至刻线后的混匀应采用倒转混匀。 3.肝糖原定量测定中,加蒽酮溶液后的混匀,可将试管倾斜约45o再作旋转混匀。因蒽酮溶液(浓硫酸配制)比重大于样品水溶液很多,一加入便沉于管
生物化学实验理论考试题答案
生物化学实验理论考试题答案 1.醋酸纤维薄膜电泳时点样端应靠近电极的哪一端,为什么? 答;电泳时点样端应靠近负极,因为血清中各种蛋白质在PH为8.6的环境中均带负电,根据同性相吸,异性相斥原理,点样端在负极时蛋白质向正极泳动从而实现蛋白质分离。 2.用分光光度计测定物质含量时,设置空白对照管的作用,为什么? 答;空白对照是为了排除溶剂对吸光度的影响。溶液的吸光度表示物质对光的吸收程度,但是作为溶剂也能吸收,反射和透射一部分的光,因此必须以相同的溶剂设置对照,排除溶剂对吸光度的影响。 3.简述血清蛋白的醋酸纤维薄膜的电泳原理? 答;血清蛋白中各种蛋白质离子在电场力的作用下向着与自身电荷相反的方向涌动,而各种蛋白质等电点不同,且在PH为8.6时所带电荷不同,分子大小不等,形状各有差异,所以在同一电泳下永动速度不同从而实现分离。 4.何谓Rf值?影响Rf值的因素? 答;Rf是原点到层析中心的距离与原点到溶剂前沿的距离之比。Rf的大小与物质的结构,性质,溶剂系统,层析滤纸的质量和层析温度有关,对同一种物质来讲Rf是一个常量。 5.什么是盐析?盐析会引起蛋白质的变性吗?一般用什么试剂? 答;盐析是指当溶液中的中性盐持续增加时,蛋白质的溶解度下降,当中性盐的浓度达到一定程度的时候,蛋白质从溶液中析出的现象。盐析不会引起蛋白质的变性,因为蛋白质的结构并未发生改变,去掉引起盐析的因素蛋白质仍能溶解;一般用饱和硫酸铵溶液进行盐析 6.简述DNS法测定还原糖浓度的实验原理? 答;还原糖与DNS在碱性条件下加热被氧化成糖酸,而DNS被还原为棕红色的3-氨基-5-硝基水杨酸。在一定范围内还原糖的量与3-氨基-5硝基水杨酸颜色的深浅成正比,用分光光度计测出溶液的吸光度,通过查对标准曲线可计算出3-氨基-5硝基水杨酸的浓度,从而得出还原糖的浓度。 7.影响蛋白质沉淀的因素是什么?沉淀和变性有什么联系? 答;水溶液中的蛋白质分子由于表面形成水化层和双电层从而形成稳定的亲水胶
正确分析血清蛋白电泳扫描图
正确分析血清蛋白电泳扫描图 苏洁平,张晓静 (吉林大学中日联谊医院,吉林长春130031) 血清蛋白电泳虽然是一个传统的检验项目,但目前在临床上对一些疾病的诊断(如对肝病、肾病、多发性骨髓瘤,以及一些自身免疫性疾病等)仍起着不可替代的作用。血清蛋白电泳就是根据血清中各组分蛋白质分子量的不同,将各组分蛋白质分离开, 分子大的泳动慢、分子小的泳动快,依次分为白蛋白、α12球蛋白、α22球蛋白、β2球蛋白(有时可出现前β2球蛋白带区属正常)和γ2球蛋白5个带区(或6个带区)[1,2]。常见几种疾病的蛋白电泳变化见表1。 表1 几种常见疾病的血清蛋白电泳扫描图的变化特征 病名白蛋白 球蛋白 α 12球蛋白α22球蛋白β2球蛋白γ2球蛋白 肾病↓↓↑↑↑↑↓弥慢性肝损伤↓↓↑↓↓↑肝硬化↓↓↓↓β2γ桥原发性肝癌↓↓AFP↑多发性骨髓瘤↓↓↑↑↑慢性炎症↓↑↑↑妊娠↓↑↓无丙种球蛋白血症↓↓双血蛋白血症双峰 注:↑轻度增高,↑↑明显增高,↓轻度降低,↓↓明显降低 下面对几种血清蛋白电泳扫描图作简要说明[3,4]。 1 图1:为正常人血清蛋白电泳扫描图,由左至右为白蛋白峰、α12球蛋白峰、α22球蛋白峰、β2球蛋白峰、γ2球蛋白峰。其含量分别为52%~63%,4%~5%, 6%~9%,9%~12%,15%~23%。 2 图2及图3:见增高的γ2球蛋白峰。肝病患者病程较长,当白蛋白和α12球蛋白降低,γ2球蛋白增高,提示病情较重。当肝细胞严重受损时,β2球蛋白可降低,重症肝炎转为肝坏死后γ2球蛋白增高。 3 图4:可见β区到γ区连续一片,难以分开,是由于IgA、IgM、IgG同时增高所致,称β2γ桥。β2γ桥为肝硬化所独有的特点。如伴有α12球蛋白、α22球蛋白降低即可诊断肝硬化。若治疗后白蛋白回升,标志治疗有效。 4 图5:见明显增高的α22球蛋白峰,β2球蛋白峰同时增高,而白蛋白峰明显减低。由于肾病患者长期丢失白蛋白,故血清中的蛋白明显减少。肾病综合征时高血脂症的发生与肝脏合成脂蛋白增加及脂蛋白分解减少有关,参与脂类分解代谢的某些酶的辅助因子从尿中丢失以致脂蛋白分解减弱,血中胆固醇、甘油三酯明显增高。α22球蛋白、β2球蛋白均是脂蛋白运输载体,为脂蛋白的主要成分。所以肾病患者血清蛋白电泳会出现白蛋白峰减低,α22球蛋白、β2球蛋白峰增高现象。 5 图6及图7:为典型的M峰。由于多发性骨髓瘤患者浆细胞浸润,血清IgM显著增多。γ2球蛋白的主要组成为免疫球蛋白、抗体、补体等,所以在β2球蛋白区和γ2球蛋白区有一明显M带。在扫描图上出现M峰,可分为β型和γ型两种。为多发性骨髓瘤的一项重要诊断指标。 6 图8:见明显降低的γ2球蛋白峰,主要见于体液免疫功能低下患者。 7 其它异常区带: — 2 5 3 —Chin J Lab Diagn,August,2003,V ol7,N o14
山东大学信息安全实验报告
山东大学软件学院 信息安全导论课程实验报告 学号:201300301385 姓名:周强班级: 2013级八班 实验题目:缓冲区溢出实验 实验学时:日期: 实验目的: (1)了解缓冲区溢出的原理 (2)利用缓冲区溢出现象构造攻击场景 (3)进一步思考如何防范基于缓冲区溢出的攻击 硬件环境: 软件环境: WindowsXP操作系统 VS2008 实验步骤与内容: (1)了解缓冲区溢出的原理 缓冲区溢出简单来说就是计算机对接收的输入数据没有进行有效的检测(理情况下是程序检测数据长度并不允许输入超过缓冲区长度的字符),向缓冲区内填充数据时超过了缓冲区本身的容量,而导致数据溢出到被分配空间之外的内存空间,使得溢出的数据覆盖了其他内存空间的数据。 看一个代码实例,程序如下: void function(char *str) { char buffer[16]; strcpy(buffer,str); } 上面的strcpy()将直接把str中的内容copy到buffer中。这样只要str的长度大于16,就会造成buffer的溢出,使程序运行出错。
(2)利用缓冲区溢出现象构造攻击场景 首先打开Microsoft Visual C++,新建工程和cpp文件,复制实验指导书的代码进行编译连接: 单击运行按钮,然后第1次输入“zhouqianga”,第2次输入2个“ga”,即可看到输出“correct”。
按F10开始进行逐步调试: 当第一次执行gets()函数之前,内存情况如下图所示
在最新的版本中gets被认为是不安全的,gets从标准输入设备读字符串函数。可以无限读取,不会判断上限,以回车结束读取,所以程序员应该确保buffer的空间足够大,以便在执行读操作时不发生溢出。现在都被要求改为get_s。来防止溢出。 如下图所示。 (3)学习例子程序2:数据被执行 在xp系统下,直接运行Exploit-1.1.exe,如下图所示:
生物化学实验重点试题
一、解词 1、总氮量水中各种形态无机和有机氮的总量 2、酶的抑制作用是指在某个酶促反应系统中,某种低相对分子质量的物质加入后,导致酶活力降低的过程。 3、酶的最适温度酶催化活性最高时的温度 4、蛋白质的等电点每个蛋白都存在一个pH使它的表面净电荷为零即等电点 5、盐析增加中性盐浓度使蛋白质、气体、未带电分子溶解度降低的现象 6、蛋白质变性蛋白质在某些物理和化学因素作用下其特定的空间构象被改变,从而导致其理化性质的改变和生物活性的丧失6、酶的专一性酶对底物及其催化反应的严格选择性通常酶只能催化一种化学反应或一类相似的反应 7、激活剂能提高酶活性的物质大部分是离子或简单的有机化合物 8、抑制剂凡能使酶催化活性下降而不引起酶蛋白变性的物质 9、酶催化特定化学反应的蛋白质、RNA或其复合体 二、填空 1、球蛋白可在半饱和中性硫酸铵溶液中析出,清蛋白可在高盐浓度溶液中析出。 2、在PH3.0、和9.5时的电场中,卵清蛋白(PI4.6)移动方向分别为负移 动,正移动。 3、唾液淀粉酶的最适温度是37 4、还原糖与本乃狄试剂共热现象生成生成砖红色沉淀。 5、维生素C也称抗坏血酸,它具有很强还原性 6、用苔黑酚浓盐酸溶液可以鉴定核糖核酸 7、当溶液的PH低于蛋白质等电点时,蛋白质分子带正电荷;当溶液的 PH大于蛋白质等电点时,蛋白质分子带负电荷; 10.凯氏定氮法测定蛋白质含量消化终点颜色为清澈的蓝紫色色。 11.蛋白质变性的实质是空间结构被破坏。 12.常用的RNA提取方法有苯酚法、、高盐法等。 13、维持蛋白质亲水胶体稳定的因素是蛋白质颗粒表面的电荷层 和水化膜、 14、蛋白质在等电点时,主要以两性离子离子形式存在;当溶液的P H>PI 时,蛋白质分子以负离子形式存在;当溶液的P H<PI时,蛋白质分子带正离子形式存在。 15、蛋白质分子中氮的平均含量为 5.16% ,样品中的蛋白质含量常以测 氮量乘以 6.25 、即 6 。 三、选择 1、盐析法沉淀蛋白质的原理( ) A 与蛋白质结合成不溶性蛋白盐 B 次级键断裂蛋白质的构象改变 C 中和电荷,破坏水化膜 D 调节蛋白质溶液的等电点 2、以下哪项不是酶的特性() A 酶是生物催化剂,催化效率极高 B 易受Ph,温度等外界因素的影响 C 能加速化学反应但不改变反应平衡点 D 有高度特异性 3、RNA和DNA的最大紫外吸收值是在() A 280nm B 260nm C 510nm D 620nm 4、.凯氏定氮法使用的混合催化剂硫酸钾-硫酸铜配比为() A 1:3 B 5:1 C 3:1 D 1:1
生物化学实验习题及参考答案
生物化学实验习题及解答 一、名词解释 1、pI; 2、层析; 3、透析; 4、SDS-聚丙烯酰氨凝胶电泳; 5、蛋白质变性; 6、复性; 7、Tm 值; 8、同工酶; 9、Km值; 10、DNA变性;11、退火;12、增色效应 二、基础理论单项选择题 1、用下列方法测定蛋白质含量,哪一种方法需要完整的肽键() A、双缩脲反应 B、凯氏定氮 C、紫外吸收 D、羧肽酶法 2、下列哪组反应是错误的() A、葡萄糖——Molish反应 B、胆固醇——Libermann-Burchard反应 C、色氨酸——坂口(Sakaguchi)反应 D、氨基酸——茚三酮反应 3、Sanger试剂是() A、苯异硫氰酸 B、2,4-二硝基氟苯 C、丹磺酰氯 D、?-巯基乙醇 4、肽键在下列哪个波长具有最大光吸收() A、215nm B、260nm C、280nm D、340nm 5、下列蛋白质组分中,哪一种在280nm具有最大的光吸收() A、色氨酸的吲哚基 B、酪氨酸的酚环 C、苯丙氨酸的苯环 D、半胱氨酸的硫原子 6、SDS凝胶电泳测定蛋白质的相对分子量是根据各种蛋白质() A、在一定pH值条件下所带的净电荷的不同 B、分子大小不同 C、分子极性不同 D、溶解度不同 7、蛋白质用硫酸铵沉淀后,可选用透析法除去硫酸铵。硫酸铵是否从透析袋中除净,你选用下列哪一种试剂检查() A、茚三酮试剂 B、奈氏试剂 C、双缩脲试剂 D、Folin-酚试剂 8、蛋白质变性是由于() A、一级结构改变 B、亚基解聚 C、空间构象破坏 D、辅基脱落 9、用生牛奶或生蛋清解救重金属盐中毒是依据蛋白质具有() A、胶体性 B、粘性 C、变性作用? D、沉淀作用? 10、有关变性的错误描述为() A、蛋白质变性后,其一级结构和空间结构改变 B、蛋白质变性后,其理化性质和生物学活性改 变C、加热、紫外线照射、超声波等可以引起蛋白质变性D、变性蛋白质粘度增加,易被酶水解,易沉淀 11、双链DNA热变性后() A、黏度下降 B、沉降系数下降 C、浮力密度下降 D、紫外吸收下降 12、酶的活化和去活化循环中,酶的磷酸化和去磷酸化位点通常在酶的哪一种氨基酸残基上()
-生物化学实验--聚丙烯酰胺凝胶电泳法分离血清蛋白质
-生物化学实验--聚丙烯酰胺凝胶电泳法分离血清蛋白质
————————————————————————————————作者:————————————————————————————————日期:
聚丙烯酰胺凝胶电泳法分离血清蛋白质 【目的】 1 .掌握圆盘电泳分离血清蛋白的操作技术。 2 .熟悉聚丙烯酰胺凝胶电泳的原理。 【原理】 带电粒子在电场中向着与其自身电荷方向相反的电极移动,称为电泳。聚丙烯酰胺凝胶电泳( PAGE )就是以聚丙烯酰胺凝胶作为电泳介质的电泳。在电泳时,蛋白质在介质中的移动速率与其分子的大小,形状和所带的电荷量有关。 聚丙烯酰胺凝胶是一种人工合成的凝胶,是由丙烯酰胺( Acr )单体和少量交联剂 N,N- 亚甲基双丙烯酰胺( Bis )在催化剂过硫酸铵( Ap )和加速剂四甲基乙二胺( TEMED )的作用下发生聚合反应而制得的(其化学结构式见第 2 篇第 1 章)。 聚丙烯酰胺凝胶具有网状结构,其网眼的孔径大小可用改变凝胶液中单体的浓度或单体与交联剂的比例来加以控制。根据血清蛋白分子量的大小,学生实验一般选用 7 %聚丙烯酰胺凝胶分离血清蛋白质。 不连续聚丙烯酰胺凝胶电泳利用浓缩效应、分子筛效应和电荷效应的三重作用分离物质(见第 2 篇第 1 章),使样品分离效果好,分辨率较高。一般醋酸纤维薄膜电泳只能把血清蛋白质分离出 5 ~ 7 条带,而聚丙烯酰胺凝胶电泳却能分离出十几条到几十条来(图 3-4 ),是目前较好的支持介质,应用十分广泛。
图 3-4 血清蛋白聚丙烯酰胺凝胶电泳图谱 根据凝胶支持物的形状不同,分为垂直板电泳和盘状电泳两种,二者原理相同。本实验采用的盘状电泳是在直立的玻璃管中,以孔径大小不同的聚丙烯酰胺凝胶作为支持物,采用电泳基质的不连续体系,使样品在不连续的两相间积聚浓缩(浓缩效应)成厚度为 10 -2 cm 的起始区带,然后再利用分子筛效应和电荷效应的双重作用在分离胶中进行电泳分离。 【器材】 1 .电泳仪 直流稳压电源,电压 400 ~ 500V ,电流 50mA 。 2 .垂直管型圆盘电泳装置 目前这类装置的种类很多,可根据不同的实验要求选择其中的一种。这类装置均由两个基本的部分组成,一部分为载胶玻璃管,须选用内径均匀( 5 ~ 6mm ) , 外径 7 ~ 8mm ,长 80 ~ 100mm 的玻璃管作为材料,也可以使用更细的玻璃管。另一部分为电泳液槽,可分为上下两槽。电泳时,上下两槽通过凝胶柱沟通电流(图 3-5 )。 图 3-5 聚丙烯酰胺凝胶圆盘电泳示意图 (A 为正面, B 为剖面 ) 3 .大号试管和中号试管 4 .微量移液器 5 . 5ml 注射器和 9 号注射针头 6 .洗耳球、滤纸条、封口膜等
山东大学-中间件实验报告
山东大学软件学院 中间件技术课程实验报告
onResize(); }, error : function(e) { alert('初始化数据错误!'); } }); }); 并从bootstrap上找一些已经写好的布局,作为参考。加入到网页的界面中。 一、数据库操作的封装 1、AutoCreateDB——自动创建数据库 (1)可以根据下列query的结果判断数据库是否存在: Object obj = dao.QueryOnly("SELECT COUNT(*) FROM INFORMATION_SCHEMA.SCHEMATA WHERE SCHEMA_NAME=?",new Object[] { DATABASE }); 不存在则创建数据库,则执行executeCreate方法。 (2)AutoCreateDB自动创建数据库的表 遍历表,对于数据库中的每一个表,都执行“检测、若不存在则创建”操作,可以根据该query的结果判断数据库的表是否存在,不存在则创建数据库表,则执行executeCreate方法。 2、JdbcDao数据库相关操作 (1)在JdbcDao 中定义应用与数据库建立连接,其相关参数从 config.properties中获取: /**获取Connection连接*/ public Connection getConnection(){ Connection conn = null; System.out.println(JDBC_URL); System.out.println(USER_NAME); System.out.println(USER_PWD); try { conn = DriverManager.getConnection(JDBC_URL,USER_NAME,USER_PWD);
生物化学实验练习题及参考答案[1]
生物化学实验 一、名词解释: 分配层析法电泳同工酶酶活性分光光度法层析技术比活力 二、填空题: 1. 测定蛋白质含量的方法有,,和。 2. CAT能把H2O2分解为H2O和O2,其活性大小以来表示,当CAT与H2O2反应结束,再用测定未分解的H2O2。 3. 聚丙烯酰胺凝胶电泳是以作为载体的一种区带电泳,这种凝胶是由和交联剂在催化剂作用下聚合而成。化学聚合法一般用来制备_____________胶,其自由基的引发剂是,催化剂是______________;光聚合法适于制备大孔径的_________________胶,催化剂是______________。 4.层析技术按分离过程所主要依据的物理化学性质进行分类,可分成以下几种:_______________,_______________,_______________,_______________和________________。 5. 使用离心机离心样品前,必须使离心管__________且对称放入离心机。 6. 米氏常数可近似表示酶和底物亲合力,Km愈小,表示E对S的亲合力愈,Km愈大,表示E对S 的亲合力愈。 7. 分光光度计在使用之前必须预热,注意预热及样品槽空时必须_________(打开、合上)样品池翻盖。 8. CAT是植物体内重要的酶促防御系统之一,其活性高低与植物的密切相关。 9. 纸层析实验中,____________形成固定相,____________流动相。 10. 聚丙烯酰胺凝胶是是由和交联剂在催化剂作用下聚合而成的,在具有自由基团体系时,两者就聚合。引发产生自由基的方法有两种:和。11. 层析技术按按固定相的使用形式进行分类,可分成以下几种:_______________,_______________,_______________和________________。 三、问答题: 1、简述4种测定蛋白质含量的方法及其原理。 2、简述不连续聚丙烯酰胺凝胶电泳中的三个不连续及三种物理效应。 3、试分析影响电泳的主要因素有哪些? 参考答案: 生物化学实验 一、名词解释: 1、电泳:指带电粒子在电场中向与其自身所带电荷相反的电极方向移动的现象。 2、同工酶:指催化同一种化学反应,但其酶蛋白本身的分子结构组成却有所不同的一组酶。 3、分配层析法:用物质在两种或两种以上不同的混合溶剂中的分配系数不同,而达到分离目的的一种实验方法。
生物化学实验的答案
生物化学实验的答案 一、理论考试部分 1.醋酸纤维薄膜电泳时,点样的一端应靠近电极的哪一端?为什么? 答:负极。因为血清中各种蛋白质在PH 为的环境中均带负电,根据同性相吸,异性相斥原理,点样端在负极时蛋白质向正极泳动从而实现蛋白质分离。 2.用分光光度计测定物质含量时,设置空白对照管的意义是什么? 答:空白对照是为了排除溶剂对吸光度的影响。溶液的吸光度表示物质对光的吸收程度,但是作为溶剂也能吸收,反射和透射一部分的光,因此必须以相同的溶剂设置对照,排除溶剂对吸光度的影响。 3.简述血清蛋白的醋酸纤维薄膜电泳的原理? 答:血清蛋白中各种蛋白质离子在电场力的作用下向着与自身电荷相反的方向涌动,而各种蛋白质等电点不同,且在PH为时所带电荷不同,分子大小不等,形状各有差异,所以在同一电泳下永动速度不同从而实现分离。 4.xxR f 值?影响R f 值的主要因素是什么? 答:Rf是原点到层析中心的距离与原点到溶剂前沿的距离之比。Rf的大小与物质的结构,性质,溶剂系统,层析滤纸的质量和层析温度有关, 5.什么是盐析?盐析会引起蛋白质变性吗?一般我们用什么试剂做盐析的实验? 答:盐析是指当溶液中的中性盐持续增加时,蛋白质的溶解度下降,当中性盐的浓度达到一定程度的时候,蛋白质从溶液中析出的现象。盐析不会引起蛋白质的变性。一般用饱和硫酸铵溶液进行盐析。 6?简述DNS法测定还原糖浓度的实验原理? 答:还原糖与DNS在碱性条件下加热被氧化成糖酸,而DNS被还原为棕红色的
3-氨基-5-硝基水杨酸。在一定范围内还原糖的量与3-氨基-5 硝基水杨酸颜色的深浅成正比,用分光光度计测出溶液的吸光度,通过查对标准曲线可计算出3-氨基-5 硝基水杨酸的浓度,从而得出还原糖的浓度。 7.依据我们所做的实验,说明影响蛋白质沉淀的因素是什么?影响蛋白质变 性的因素是什么?沉 xx 变性有何联系? 答:水溶液中的蛋白质分子由于表面形成水化层和双电层从而形成稳定的亲水胶体颗粒,在一定的理化因素影响下蛋白质颗粒因失去电荷和脱水而沉淀。这些因素包括溶液的酸碱度、盐溶液的浓度、温度、重金属离子以及有机溶剂等。变性蛋白质不一定沉淀,沉淀的蛋白质不一定变性。 8.什么是碘值?脂肪的不饱和程度越大,碘值越大吗?在测定碘值的实验中,氯仿的作用是什么? 答:每100g 脂肪所吸收的碘的克数,即脂肪的碘值。脂肪的不饱和度越大,碘值就越大。氯仿作为溶剂,去溶解脂肪。 9.简述薄层层析法分离糖类的原理?答:薄层层析的实质就是吸附层析,也就 是在铺有吸附剂的薄层上,经过反 复地被吸附剂吸附以及被扩展剂扩展的过程。而吸附剂对不同的物质的吸附力不同,从而使糖在薄层上的泳动速度不同达到分离的目的。 10.等电点的定义?蛋白质在等电点时有哪些特点? 答:当溶液的PH为一定数值时,其中的蛋白质正负电荷相等,即净电荷为 零,此时的PH值就是该蛋白质等电点。蛋白质在等电点时的溶解度最小。 11.在蛋白质显色实验的黄色反应中,反应原理是什么?实验结果为什么会出现深浅不一的黄色?
山东大学软件测试实验报告
实验一。黑盒测试 一、等价类划分 电话号码问题某城市电话号码由三部分组成。它们的名称和内容分别是: (1)地区码:空白或三位数字; (2)前缀:非'0'或'1'的三位数字; (3)后缀:4 位数字。 假定被测程序能接受一切符合上述规定的电话号码,拒绝所有不符合规定的电话号码。根据该程序的规格说明,作等价类的划分,并设计测试方案。 根据题目,分别将地区码、前缀、后缀进行分类,分析结果如下: 输入有效等价类编号无效等价类编号 地区码空白 1 包含其他字符 3 三位数字 2 少于三位 4 多于三位 5 前缀非0或 非1的三位数6 包含其他字符8 包含0的三位数9 包含1的三位数10 少于三位数11 多于三位数12 后缀四位数字7 包含其他字符13 少于四位数14 多于四位数15 根据上图的分析,可的测试用例 测试数据预期结果覆盖类地区码前缀后缀 空白555 4344 接受(有效)1、6、7 232545 4343 接受(有效)2、6、7 A23 322 4343 拒绝(无效) 3 21322 4343 拒绝(无效) 4 2323322 4343 拒绝(无效) 5 232 32A4343 拒绝(无效)8 232 208 4343 拒绝(无效)9 232 1114343 拒绝(无效)10
232 32 4343 拒绝(无效)11 232 322224343 拒绝(无效)12 232 322 4AS2 拒绝(无效)13 232 322 434拒绝(无效)14 232 322 434311拒绝(无效)15 三角形问题根据下面给出的规格说明,利用等价类划分的方法,给出足够的测试用例。一个程序读入三个整数。把此三个数值看成是一个三角形的三个边。这个程序要打印出信息,说明不是三角形、三角形是三边不等的、是等腰的、还是等边的。 分析题目中给出和隐含的对输入条件的要求: (1)整数(2)三个数(3)非零数(4)正数 (5)两边之和大于第三边(6)等腰(7)等边 如果 a 、 b 、 c 满足条件( 1 ) ~ ( 4 ),则输出下列四种情况之一: 1)如果不满足条件(5),则程序输出为 " 非三角形 " 。 2)如果三条边相等即满足条件(7),则程序输出为 " 等边三角形 " 。 3)如果只有两条边相等、即满足条件(6),则程序输出为 " 等腰三角形 " 。 4)如果三条边都不相等,则程序输出为 " 一般三角形 " 。 列出等价类表并编号
