化学竞赛·原子结构分子结构专题检测.

原子结构分子结构专题检测
姓名班级
H
1.008相对原子质量
He 4.003
Li 6.941
Be
9.012
B
10.81
C
12.01
N
14.01
O
16.00
F
19.00
Ne
20.18
Na 22.99
Mg
24.31
Al
26.98
Si
28.09
P
30.97
S
32.07
Cl
35.45
Ar
39.95
K 39.10
Ca
40.08
Sc
44.96
Ti
47.88
V
50.94
Cr
52.00
Mn
54.94
Fe
55.85
Co
58.93
Ni
58.69
Cu
63.55
Zn
65.39
Ga
69.72
Ge
72.61
As
74.92
Se
78.96
Br
79.90
Kr
83.80
Rb 85.47
Sr
87.62
Y
88.91
Zr
91.22
Nb
92.91
Mo
95.94
Tc
[98]
Ru
101.1
Rh
102.9
Pd
106.4
Ag
107.9
Cd
112.4
In
114.8
Sn
118.7
Sb
121.8
Te
127.6
I
126.9
Xe
131.3
Cs 132.9
Ba
137.3
La-
Lu
Hf
178.5
Ta
180.9
W
183.8
Re
186.2
Os
190.2
Ir
192.2
Pt
195.1
Au
197.0
Hg
200.6
Tl
204.4
Pb
207.2
Bi
209.0
Po
[210]
At
[210]
Rn
[222]
Fr [223]
Ra
[226]
Ac-
La Rf Db Sg Bh Hs Mt Ds
La系La
138.9
Ce
140.1
Pr
140.9
Nd
144.2
Pm
144.9
Sm
150.4
Eu
152.0
Gd
157.3
Tb
158.9
Dy
162.5
Ho
164.9
Er
167.3
Tm
168.9
Tb
173.0
Lu
175.0
一、(2009年全国高中学生化学竞赛省级赛区1)
(1)分别画出BF3和N(CH3)3的分子构型,指出中心原子的杂化轨道类型。
(2)分别画出F3B-N(CH3)3和F4Si-N(CH3)3的分子构型,并指出分子中Si和B的杂化轨道类型。(3)BeCl2是共价分子,可以以单体、二聚体和多聚体形式存在。分别画出它们的结构简式,并指出Be 的杂化轨道类型。
二、(2010年全国高中学生化学竞赛省级赛区1)
(1)2009年10月合成了第117号元素,从此填满了周期表第七周期所有空格,是元素周期系发展的一个里程碑。117号元素是用249Bk轰击48Ca靶合成的,总共得到6个117号元素的原子,其中1个原子经p 次α衰变得到270Db后发生裂变;5个原子则经q次α衰变得到281Rg后发生裂变。用元素周期表上的117号元素符号,写出得到117号元素的核反应方程式(在元素符号的左上角和左下角分别标出质量数和原子序数)。
(2)写出下列结构的中心原子的杂化轨道类型:
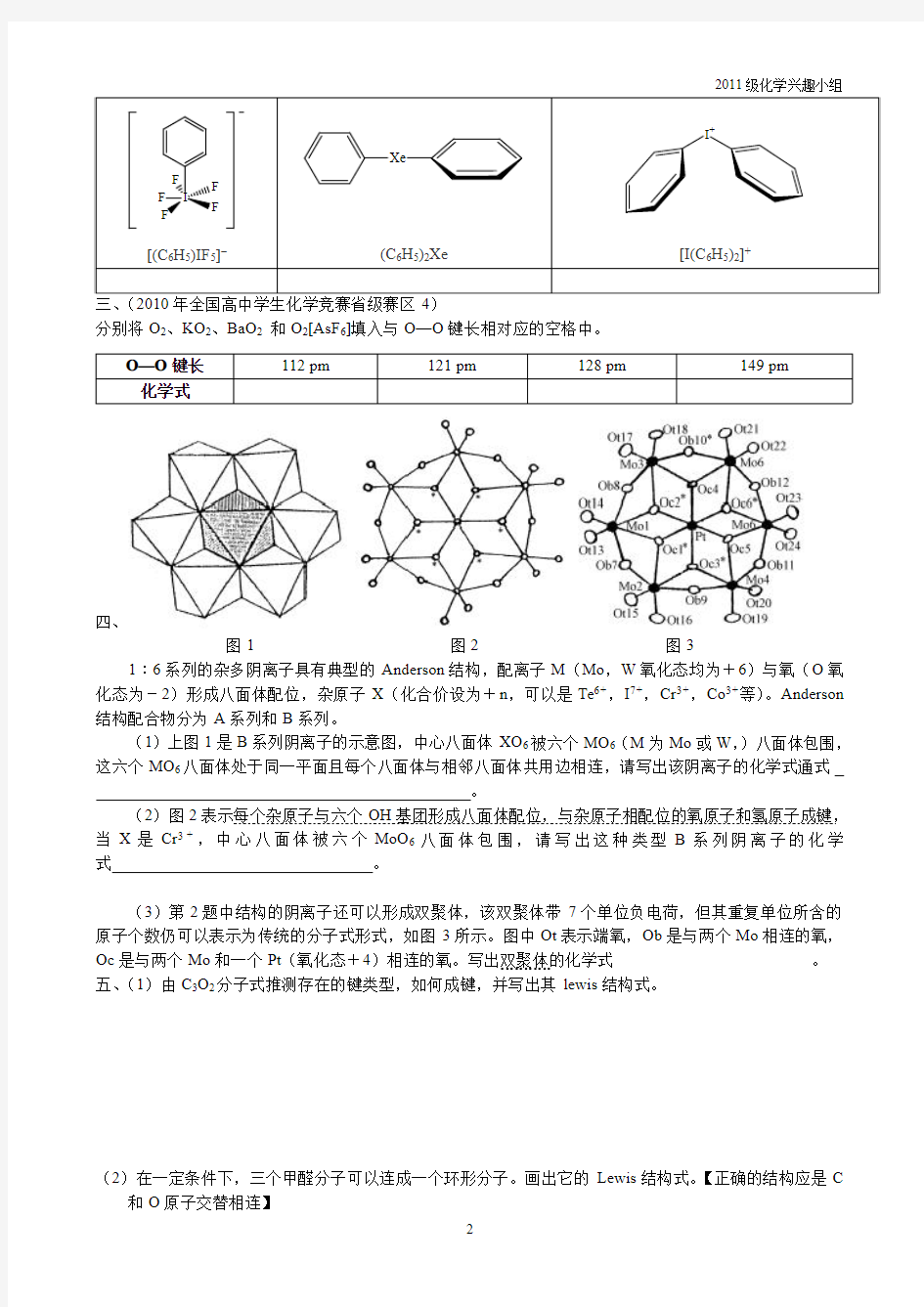
三、(2010年全国高中学生化学竞赛省级赛区4)
分别将O2、KO2、BaO2和O2[AsF6]填入与O—O键长相对应的空格中。
O—O键长112pm121pm128pm149pm
化学式
四、
图1图2图3
1︰6系列的杂多阴离子具有典型的Anderson结构,配离子M(Mo,W氧化态均为+6)与氧(O氧化态为-2)形成八面体配位,杂原子X(化合价设为+n,可以是Te6+,I7+,Cr3+,Co3+等)。Anderson 结构配合物分为A系列和B系列。
(1)上图1是B系列阴离子的示意图,中心八面体XO6被六个MO6(M为Mo或W,)八面体包围,这六个MO6八面体处于同一平面且每个八面体与相邻八面体共用边相连,请写出该阴离子的化学式通式
。
(2)图2表示每个杂原子与六个OH基团形成八面体配位,与杂原子相配位的氧原子和氢原子成键,当X是Cr3+,中心八面体被六个MoO6八面体包围,请写出这种类型B系列阴离子的化学式。
(3)第2题中结构的阴离子还可以形成双聚体,该双聚体带7个单位负电荷,但其重复单位所含的原子个数仍可以表示为传统的分子式形式,如图3所示。图中Ot表示端氧,Ob是与两个Mo相连的氧,Oc是与两个Mo和一个Pt(氧化态+4)相连的氧。写出双聚体的化学式。五、(1)由C3O2分子式推测存在的键类型,如何成键,并写出其lewis结构式。
(2)在一定条件下,三个甲醛分子可以连成一个环形分子。画出它的Lewis结构式。【正确的结构应是C 和O原子交替相连】
(3)为何下列各对分子的偶极矩明显的不同?请说明理由。
①OF2(μ=1.00×10-30C·m),BeF2(μ=0)
②PF3(μ=3.43×10-30C·m),BF3(μ=0)
③NH3(μ=4.93×10-30C·m),NF3(μ=0.67×10-30C·m)
六、美国科学杂志世界上科学界最权威最精英的杂志之一。下面这幅分子结构模型图正是2004年4月30号出版的《SCIENCE》杂志上的图片,报道的是,中国科学家首次成功合成新型稳定小富勒烯C50Cl10,这项研究是富勒烯科学的重要突破。该项工作是在厦门大学化学系郑兰荪院士的领导和组织下完成的,武汉物数所参与了其中部分工作并做出了特殊贡献。该成果的论文“Capturing the labile fullerene[50]as C50Cl10”。C50Cl10也是具有完美对称的分子,C50Cl10的研究有着极为重要的科学价值。
现根据其信息,试完成以下两小题。
(1)厦门大学郑兰荪院士合成的C50Cl10富勒烯足球状分子含氯衍生物,50个碳原子组成若干个正六边形和正五边形,其中碳均为四价。有关C50Cl10的说法正确的是()
A C50Cl10与C60互为同素异形体
B C50Cl10分子中共用电子对数目为105个
C C50Cl10摩尔质量为955g
D C50Cl10分子中含有55个碳碳单键
(2)不饱和度Ω是确定有机物分子结构的重要方法,不饱和度也称为缺氢指数,当分子中每产生一个C=C或每形成一个单键的环,就会产生一个不饱和度,足球烯C60的不饱和度为61。有机物分子中的卤素原子取代基,可视作氢原子计算Ω。
试回答下列:立体封闭有机物分子(多面体或笼状结构)也可确定不饱和度,如:①立方烷:面数为6,Ω=5②棱晶烷:面数为5,Ω=4③金刚烷面数为4,Ω=3。
则C
50Cl
10
结构中面数为:,不饱和度Ω为:。
七、多面体几何学和化学的关系日益显得重要。在实习中,示出了五种正多面体的图形和性质,介绍了多面体通用的Euler公式[顶角数(V)+面数(F)=棱边数(E)+2],讨论了等径圆球密堆积中的四面体和八面体空隙的几何学等,帮助读者在了解有关化合物的结构和性质上打下一定的基础。随着球碳(如C60,C70等)的出现,单质硼中B12单元和B60壳层结构的测定,以及包合物和原子簇化合物中呈现的种种多面体的结构,又吸引读者进一步学习多面体的结构的兴趣。试回答下面有关多面体几何学的问题:(1)当多面体只由五边形面(F5)和六边形面(F6)组成,每个顶点都连接3条棱时,试证明不论由多少个顶点组成多面体,其中五边形面的数目总是12个。
(2)已知C60分子是个具有足球外形的32面体,试计算其价键结构式中的C-C单键数目,C=C双键数目和σ键数目。
(3)已知C80,C82和C84都能包合金属原子,形成Ca@C80,Ba@C80,Ca@C82,La@C82,Ca@C84。,La@C84等分子。试分别计算C80,C82和C84分子中含有六边形面的数目。
八、(1)XeF2和PCl5两种分子没有极性,而XeO3分子则是极性分子,试画出这三种分子的结构。
(2)磷的氯化物有PCl3和PCl5,氮的氯化物只有NCl3,为什么没有NCl5?
(3)磷在氯气中燃烧可生成三氯化磷,五氯化磷。现有足量白磷在氯气(其分子有三种不同的相对分子质量)中燃烧时,其产物共有几种不同分子。
(4)利用价电子对互斥理论说明AsH3,ClF3,SO3,SO32-,CH3+和CH3-等分子和离子的几何形状,并指出哪些分子有偶极矩。
(5)已知硫和氯以不同的性质形成S2Cl2、SCl2和SCl4。试画出这些分子的Lewis结构式,并用VSEPR 理论预测它们的形状?
九、(1)判断对错,指出理由:化合价一般比形式电荷小。
(2)所有原子序数Z为奇数的原子一定至少有一个未成对电子,试说明原子序数为偶数的原子可能含有未成对电子吗?如果肯定,请给出前三个周期元素中的全部例子。
(3)第一过度系元素中哪些原子是反磁性的?写出他们的电子构造式。
(4)最先出现g亚层的主量子数为多少?但该主量子数代表的周期元素并未有元素在g亚层排电子,原因何在。
(5)对于气相反应K+F==K++F-,如果控制反应条件使生成的正负离子不再进一步化合,此过程△H=91k J·mol-1。已知K的电离能为4.34ev,求F的电子亲和能为多少?
十、(第20届国际化学奥林匹克竞赛(IChO)试题)在我们这个三维空间世界里的周期系是根据4个量子数建立的,即n=1,2,3,……,l=0,1,……,n-1,m=±1,±2,……±l。如果我们搬到一个想象的“平面世界”去,那是一个二维世界,那里的周期系是根据三个量子数建立的,即n=1,2,3…;m=0,±1,±2,…±(n-1);m
=±1/2。
s
这个“平面世界”里的m所代表的意义,相当于三维世界中l和m
二者的作用(例如:用它也能
l
表示s、p、d…能级)。不过我们在普通三维世界中的基本原理和方法对这个二维的“平面世界”是适用的,下面几个问题都与这个“平面世界”有关。
a)画出“平面世界”周期表前四个周期。在其中按照核电荷标明原子序数,并用原子序数(Z)当做元素符号。写出每一元素的电子构型。
b)画出n=2各元素的杂化轨道。在“平面世界”中的有机化学是以哪一种元素为基础的?指出乙烷、乙烯和环已烷分别与在“平面世界”中的什么化合物对应(用数字表示元素符号)。
c)在这个“平面世界”中,有哪些规则和三维世界中所用的8电子和18电子规则(s、p、d轨道电子和)相当?
d)画图说明n=2的几个“平面世界”元素的第一电离能的变化趋势。在“平面世界”周期表中,画出元素的电负性增长方向。
e)画出“平面世界”中n=2的各元素的电中性、同核双原子分子的分子轨道能级图。其中哪些分子是稳定的?
f)n=2的各元素分别与最轻的元素(Z=1)形成简单的二元化合物。用原子序数做为元素符号,画出它们的Lewis结构式,并画出它们的几何构型,指出分别与它们中每一化合物相应的三维世界中的化合物。
十一、(1988年全国化学竞赛冬令营试题)向硫酸四氨合铜的水溶液中通入二氧化硫至溶液呈微酸性,生成白色沉淀A。元素分析表明A含Cu、N、S、H、O五种元素,而且物质的量比C︰N︰S=1︰1︰1。激光拉曼光谱和红外光谱显示A的晶体里有一种呈三角锥体和一种呈正四面体的离子(或分子)。磁性实验指出A呈逆磁性。
(1)写出A的化学式。
(2)写出生成A的配平的化学反应方程式。
(3)将A和足量的10mol?L-1的硫酸混合微热,生成沉淀B、气体C和溶液D。B是主要产物,尽管它是常见物质,本法制得的呈超细粉末状,有重要用途。写出这个反应式并配平。
(4)按(3)操作得到的B的最大理论产率有多大?
(5)有人设计了在密闭容器里使A和硫酸反应,结果是B的产率大大超过按(4)的估计。问:在这种设计的操作下,B的最大理论产率有多大?试对此作出解释。
十二、(湖南省化学竞赛培训试题)铬(Cr)位于周期表中ⅥB族元素,化合价可以是
O→+6的整数价态。H2CrO2可写成(HO)2O2Cr,它与NaOH反应可看作羟基H被NaOH
中的Na+所取代,成为(NaO)2O2Cr,其结构式可写成右图形式。试回答下列问题:
(1)今有一铬化合物,化学式为Na3CrO8,请确定Cr的化合价,并画出它的结构式;
(2)某含氧酸的化学式为H2XO2n-1,其相对应价态的X氧化物可能是()
A X2O
B XO2
C XO3
D X2O7
十三、(四川省化学竞赛集训题)无机化合物甲、乙分别由三种元素组成。组成甲、乙化合物的元素的特征电子排布都可表示如下:as a、bs b bp b、cs c cp2c。甲是一种溶解度较小的化合物,却可溶于乙的水溶液。由此可知甲、乙的化学式分别是、;甲溶于乙的水溶液化学方程式为。
十四、(2010年化学岛题09)
(1)假设SNF,NSF,SFN都存在,试比较它们的稳定性顺序。
(2)(1999年广东省化学竞赛试题)NSF是一种不稳定化合物,它可以三聚为A,也可以结合一个F‐,生成B,还可以失去一个F‐,生成C。
(a)画出A,B,C的路易斯结构式。
(b)预期A,B,C中哪一个N-S键最长?哪一个N-S键最短?为什么?
(c)假设有NSF的同分异构体存在[SNF],请按照(a)、(b)内容回答问题。
十五、(1989年全国化学竞赛试题)某温、某压下取三份等体积无色气体A,于25、80及90℃测得其摩尔质量分别为58.0、20.6、20.0克/摩尔。于25、80、90℃下各取l1dm3(气体压力相同)上述无色气体分别溶于10dm3水中,形成的溶液均显酸性。
1.无色气体为;
2.各温度下摩尔质量不同的可能原因是:
3.若三份溶液的体积相同(设:溶解后溶液温度也相同),其摩尔浓度的比值是多少?
十六、根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
元素代号I1I2I3I4
Q2080400061009400
R500460069009500
S7401500770010500
T5801800270011600
U420310044005900
(1)在周期表中,最可能处于同一族的是()
A、Q和R
B、S和T
C、T和U
D、R和T
E、R和U
(2)电解它们的熔融氯化物,阴极电极反应式最可能正确的是()
A Q2++2e-→Q
B R2++2e-→R
C S3++3e-→S
D T3++3e-→T
E U2++2e-→U
(3)它们的氯化物的化学式,最可能正确的是()
A QCl2
B RCl
C SCl3
D TCl
E UCl4
(4)S元素最可能是()
A S区元素B稀有气体元素C p区元素
D过渡金属E d区元素
(5)下列元素中,化学性质和物理性质最像Q元素的是()
A硼(1s22s22p1)B铍(1s22s2)C锂(1s22s1)
D氢(1s1)E氦(1s2)
四、(1)[X n+M6O24](12-n)-
(2)[CrMo6O24H6]3-
(3)[H9(PtMo6O24)2]7-
五、(1)C3O2分子中的碳原子都是以sp杂化轨道成键,分子结构为直线状O=C=C=C=O。
(2)
(3)1)OF2是V形分子,BeF2是线型分子
(2)PF3是锥型分子,BF3是平面正三形分子;
(3)SF4是四方锥,SnF4为正四面体
(4)
六、(1)B、D(这是一道与高科技新材料相关的化学试题,因前者是化合物,后者是单质,故选项A显
然不正确;由于碳最外层四个电子均成成键,每个氯原子最外只有一个电子参与成键,故共用电子对数目(4×50+10)÷2=105,故B正确。C中摩尔质量的单位应为g/mol,故C不正确。D中对于单纯的C50而言,从图中看出,从每个碳出发形成三个棱,总棱数应为:50×3÷2=75;为满足碳四价,三个棱中必是一个双键两个单键,故单键数为:75×2/3=50,C50Cl10可看作有5个双键与10个氯原子(或5个氯分子)与环上五个碳碳加成得到,加成后又生成了五个单键,故C50Cl10单键数为:50+5=55)
(2)C50Cl10分子为27面体
七、(1)按Euler公式:F+V—E+2(1)
按题意:F5+F6+V=E+2(2)
由于每个顶点连接3条棱,每条棱由2个顶点连成,得:3V—2E(3)
五边形面和六边形面分别由5个和6个顶点形成,得:5F5+6F6=3V(4)
将(3)代人(2)式,得:F5+F6+V=1.5V+2(5)
将(4)代人(5)式,得:5F5+6F6=6F5+6F6-12
由此即得:F5=12
(2)C60分子有32个面,F5=12,F6=20,按Euler公式,棱数E为:
E=60+32-2=90
由于每个C原子参与形成2个C-C单键和1个C=C双键,双键数是单键数的一半。分子中有60个C -C单键,30个C=C双键。不论C-C单键或C=C双键中都有1个C-Cσ键,所以σ键数目为90个。(3)按Euler公式:F+V=E-2
在球碳分子中,每个顶点连接3条棱,每条棱由2个顶点连成,得3V=2E。代入
F+V=1.5V+2(6)
F=0.5V+2=F5+F6
C80:F=0.5×80+2=42,F6=42-12=30
C82:F=0.5×82+2=43,F6=43-12=31
C84:F=0.5×4+2=44,F6=44-12=32
(4)气体水合物晶体的结构,可看作由五边形面和六边形面组成的多面体,其中包合气体小分子(如CH4),
多面体共面连接而成晶体。试求512,51262,51263等三种多面体(512指含12个五边形面的多面体,51262指含12个五边形面和2个六边形面的多面体)各由几个H2O分子组成?作图表示这些多面体的结构。(4)由H2O分子通过O-H…O氢键形成的多面体结构,每个H2O分子通过氢键连接成棱,每条棱由2个H2O分子组成。由上面(6)式推得:
V=2F-4=2(F5+F6)-4
512:V=5F5-4=2×12-4=20,由20个H2O分子组成,如下图(a)
51262:V=2(12+2)-4=24,由24个H2O分子组成,如下图(b)
51263:V=2(12+3)-4=26,由26个H2O分子组成,如下图(c)
八、F-Xe-F直线型三角双锥三角锥
N原子最外层无d轨道,不能发生sp3d杂化,故无NCl512种
(3)按上题的思路和方法,尤其要考虑“肥大”的孤对电子对对相邻电子对有较大排斥作用这一因素,即可推测出各分子和离子的几何形状,进而判断出分子是否有偶极矩。结果列于下表:
表中ClF3分子中Cl原子周围的5对价电子按三方双锥分布,可能的形状有下面三种:
(A)和(B)相比,(B)有Ip-Ip(孤对-孤对)排斥作用代替(A)的Ip-bp(孤对一键对)相互作用,故(A)比(B)稳定。(A)和(C)比较,(C)有2个Ip-bp相互作用代替了(A)的2个bp-bp相互作用,故(A)最稳定。
(4)
在S2Cl2(a)中,每一个S有4个VSEPR数。因此ClSS的键角大约是109.5°(硫的未成对电子的排斥会使这个值略小一些),该分子不是直线形。SS键可以自由旋转使这个分子没有固定的构型。
在SCl2(b)中,S也有4个VSEPR数。因此ClSCl的键角略小于109°。该分子是弯曲的。
在SCl4(c)中,S有5个VSEPR数,其中之一是未共享电子对一定处于三角双锥的一个三角截面上,并与两个成键电子成90°角,见图(d)。而不会像图(e)中描述的,未共享电子对处于轴线位置,与三个成键电子成90°角。
(d)(e)
SCl4的立体结构式
十、1a)
b)三维空间与“平面世界”相应的元素(n≤3)
c)n=2元素的杂化轨道
“平面世界”有机化学是以元素5为基础的。
“平面世界”中不可能有芳香族化合物。
d)“平面世界”中6电子、10电子规则分别和三维空间中8电子、18电子规则相当。
e)“平面世界”(n=2)元素的第一电离能(I)变化趋势和电负性增长方向。
E)
f)
g)“平面世界”中n=2元素和最轻元素化合物的路易斯结构、几何构型及三维空间中相应
的化合物
十二、+5(2)B、C
十三、BeCO3H2CO3BeCO3+H2CO3=Be(HCO3)2
十四、
十五、1.HF
2.HF以氢键结合之故。
3.在稀溶液中其摩尔浓度之比(25、80、90℃)为:2.90︰1.03︰1.00
十六、(1)E(2)D(3)B(4)A(5)E
高中化学竞赛-晶体结构-10年真题加完整答案
(2000)4.理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚 MgO单晶如附图1所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面 是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶 的八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。(6分) 【答案】 ; 所有原子都是Mg(3分)所有原子都是O(3分) 注:画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。 (2000)5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角 和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。 【答案】Ti14C13(2分)说明:凡按晶胞计算原子者得零分。 (2001)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。 5-1 由图5-1可确定硼化镁的化学式为:。 5-2 在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。 图5-1硼化镁的晶体结构示意图 第5题(5分)5-1 MgB2(2分)(注:给出最简式才得分)
或 a = b ≠ c,c轴向上(3分) 5-2 (注:任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。) (2001)第10题(5分)最近有人用一种称为“超酸”的化合物H(CB11H6Cl6) 和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]-。回答如下问题: 10-1 以上反应看起来很陌生,但反应类型上却可以跟中学化学课本中的一个化学反应相比拟,后者是:。 10-2 上述阴离子[CB11H6Cl6]-的结构可以跟图10-1的硼二十面体相比拟,也是一个闭合的纳米笼,而且,[CB11H6Cl6]-离子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过。请在图10-1右边的图上添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子。 图10-1 第10题(5分)NH3+HCl = NH4Cl (2分) (注:答其他非质子转移的任何“化合反应”得1分)。(3分)(注:硼上氢氯互换如参考图形仍按正确论,但上下的C、B分别连接H和Cl,不允许互换。) (2001)第11题(10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则: 11-1 第二层离子有个,离中心离子的距离为 d,它们是离子。 11-2 已知在晶体中Na+离子的半径为116pm,Cl-离子的半径为167pm,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。 11-3 纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。
2019—2020学年第一学期高中化学竞赛知识点化学竞赛大纲 初赛基本要求
高中化学竞赛知识点 有机是大头,命名结构性质都可以出题,还可以和配合物晶体结合,《有机化学》(北大出的)要求的都要掌握,再做做关于合成、性质的题,推荐丁漪出的《化学竞赛教程》(最好用解答的那本),好好研究一下。 结构式重点和难点。有多做一些分子结构配合物结构的题,基本的知识掌握了,这两块应该没太大问题。晶体很难,即使做很多题也不一定可以掌握,但基本的份不可以丢。原子结构已经很多年没有考了,如果再考肯定考分析信息的能力,应该不会很难。滴定每年会有一道大题。而且越来越重视,如果运气好只是一道高中就会的计算,但运气不好的化就会遇到《分析化学》里的内容。化学平衡考的比较简单,但要有备无患。电化学可能会出难题,多看一下《无机化学》,会有启发。有效数字不可以不注意,大学和高中的要求不同,改卷老师都遵循大学的标准,只有规范才能不丢无谓的分。物理化学和溶液已经多年未考,但热力学的内容是决赛里的难点,看自己有没有必要学这个了。作为一个过来人,还有几个建议:如果你是分析型的。就多做一些题,做题可以让水平提高很多,如果是记忆型的,就多看看书,尤其是有机无机,虽然每年都出一些新信息,但它的模型在书上都能找到。最后祝你取得好成绩。 附化学竞赛大纲(一般不会改动) 说明: 1. 本基本要求旨在明确全国高中学生化学竞赛初赛及决赛试题的知识水平,作为试题命题的依据。本基本要求不包括国家代表队选手选拔赛的要求。 2. 现行中学化学教学大纲、普通高中化学课程标准及高考说明规定的内容均属初赛要求。高中数学、物理、生物、地理与环境科学等学科的基本内容(包括与化学相关的我国基本国情、宇宙、地球的基本知识等)也是本化学竞赛的内容。初赛基本要求对某些化学原理的定量关系、物质结构、立体化学和有机化学作适当补充,一般说来,补充的内容是中学化学内容的自然生长点。 3. 决赛基本要求在初赛基本要求的基础上作适当补充和提高。 4. 全国高中学生化学竞赛是学生在教师指导下的研究性学习,是一种课外活动。针对竞赛的课外活动的总时数是制定竞赛基本要求的重要制约因素。本基本要求估计初赛基本要求需40单元(每单元3小时)的课外活动(注:40单元是按高一、高二两年约40周,每周一单元计算的);决赛基本要求需追加30单元课外活动(其中实验至少10单元)(注:30单元是按10、11和12月共三个月约14周,每周2~3个单元计算的)。 5. 最近三年同一级别竞赛试题所涉及的符合本基本要求的知识自动成为下届竞赛的要求。 6. 本基本要求若有必要做出调整,在竞赛前4个月发出通知。新基本要求启用后,原基本要求自动失效。 初赛基本要求 1. 有效数字在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液管、滴定管、容量瓶等等)测量数据的有效数字。数字运算的约化规则和运算结果的有效数字。实验方法对有效数字的制约。 2. 气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。分压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3. 溶液溶液浓度。溶解度。浓度和溶解度的单位与换算。溶液配制(仪器的选择)。重结晶方法以及溶质/溶剂相对量的估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤
高中化学竞赛模拟试题(二)
高中化学竞赛模拟试题(二) 第1题(7分) 完成下列各步反应的化学反应式 1.由AgCl 制备AgNO 3:将AgCl 溶解在氨水中,电解,所得产物溶于硝酸; 2.由Hg 2Cl 2得到Hg :浓硝酸氧化,加热至干,溶于热水后电解; 第2题(8分) 钢中加入微量钒可起到脱氧和脱氮的作用,改善钢的性能。 测定钢中钒含量的步骤如下:钢试样用硫磷混合酸分解,钒以四价形式存在。再用KMnO 4将其氧化为五价,过量的KMnO 4用NaNO 2除去,过量的NaNO 2用尿素除去。五价钒与N -苯甲酰-N -苯基羟胺在3.5~5mol/L 盐酸介质中以1︰2形成紫红色单核电中性配合物,比色测定。 回答如下问题: 1.高价钒在酸性溶液中通常以含氧阳离子的形式存在。写出钒与浓硫酸作用的反应方程式。 2.以反应方程式表示上述测定过程中KMnO 4、NaNO 2和尿素的作用。 第3题(8分) 黄金的提取通常采用氰化-氧化法。 (1)氰化法是向含氰化钠的矿粉(Au 粉)混合液中鼓入空气,将金转移到溶液,再用锌粉还原提取Au 。试写出反应过程的离子方程式,计算两个反应的平衡常数。 (已知:Ф0Au +/Au =1.68V ,Ф0O 2/OH -=0.401V ,Ф0Zn 2+/Zn =-0.70V ,K 稳Au(CN)2-=2.0×1038 K 稳Zn(OH)4 2-=1.0×1016) (2)为保护环境,必须对含CN -废水进行处理,请设计两个原理不同的处理方案。比较它们的优缺 第4题(6分) 1.用通用的符号和式子说明所谓的过氧化合物,写出四种过氧化合物的化学式。 2.过氧化钙由于具有稳定性好,无毒,且具有长期放氧的特点,使之成为一种应用广泛的多功能的无机过氧化物,主要用于消毒杀菌。定量测定过氧化钙(Ⅱ)中过氧化物含量,通常先用适当的酸使过氧化钙分解,然后采用高锰酸钾法或碘量法测定以上分解产物。请写出这两种方法的化学方程第5题完成下列各化学反应方程式(11分): 1 三硫化二砷溶于硫化钠溶液。
2020届高中化学竞赛辅导(一)原子结构元素周期律
2020届高中化学竞赛辅导(一)原子结构元素周期 律 原子结构元素周期系 一.〔4分〕某元素的离子R2+有5个电子层,最外层有2个电子,R(NO3)2是它的一种常见盐。R的元素符号是,R元素在周期表中的位置是,配制澄清R(NO3)2溶液的方法是。 二.〔2分〕235 92U原子吸取一个慢中子后,分裂成136 54 Xe和90 38 Sr,写出核反应方程式。 三.〔7分〕有人建议依照〝最高价阳离子〞电子排布的相似性和差异性来分主副族。例如:S、Cr规定为ⅥA族;Se规定为ⅥB族。 1.写出S、Cr、Se最高价阳离子的电子构型; 2.周期数和每周期元素个数是否发生变化; 3.新旧周期表中哪些族的元素是统一的〔即完全相同〕 4.不同的新的主、副族元素在原周期表的基础上做如何样的变动? 四.美国和俄罗斯科学家组成的一个研究小组10月16日宣布,他们成功制造出了门捷列夫元素周期表中的118号元素。他们通过设在俄罗斯杜布纳的U400回旋加速器实验设备,两次将许多钙-48离子加速,用来轰击人造元素锎〔Cf〕-249,从而制造出3颗新原子:每颗新原子的原子核包含118个质子和179个中子。118号元素原子存在时刻仅为0.9毫秒。研究人员观看到了118号元素原子的〝衰变链〞过程,证实了新元素的存在。其衰变过程中依次开释出一种相同的粒子后得到116、114、112号元素,112号元素最终裂变为两颗大小差不多的其他原子。 1.指出118号元素在周期表中的位置; 2.写出合成118号元素的核反应方程式; 3.指出衰变过程中112号元素模样的质量数。 五.〔4分〕2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X和Y。 X是用高能48Ca撞击243 93Am靶得到的。通过100微秒,X发生α-衰变,得到Y。然后Y连 续发生4次α-衰变,转变为质量数为268的第105号元素Db的同位素。以X和Y的原子序数为新元素的代号〔左上角标注该核素的质量数〕,写出上述合成新元素X和Y的核反应方程式。
全国高中学生化学竞赛决赛(冬令营)理论试题及答案
2004 年全国高中学生化学竞赛决赛理论试题及答案 第一题 ( 6分)选取表 1 中的合适物质的字母代号( A ~ H )填人相应标题(① 一⑧)后的括号中(单选),并按要求填空。 表 1 字母所代表的物质 A B C D E F G H + NO + NO N 2O 3 N 2H 4 NH 3 N 2O 4 H 2N 2O 2 NH 2OH ① ( )不是平面分子,其衍生物用作高能燃料。 ② ( )存在两种异构体,其中一种异构体的结构为。 ③ ( )具有线型结构, Lewis 结构式中每个键的键级为 2.0 。 ④ ( )是无色的,平面分子,它的一种等电子体是。 ⑤ ( )既有酸性,又有碱性,可作制冷剂。 ⑥ ( )既有酸性,又有碱性;既是氧化剂,又是还原剂,主要做剂。 ⑦ ( )是顺磁性分子。 ⑧ ( )水溶液会分解生成 N 20, 反应式为。 第二题 (6分)图 1是元素的△ f G m /F 一 Z 图,它是以元素的不同氧化态 Z 与对应物 图中各物种的△ f G m /F 的数值如表 2 所示。 f m A X - X 2 HXO HXO 2 XO 3- XO 4- F -3.06 0 / / / / 种的△ f G m /F 在热力学标准态 p H =0 或 pH == 14 的对画图。图中任何两种物种联 线的斜率在数值上等于相应电对的标准电极电势 ψA 或 ψB ,A 、 B 分别表示 pH = 0 (实线)和 pH = 14(虚线)。
⒈用上表提供的数据计算: ψA (IO 3/I ) ψB (IO 3/I ) ψA (ClO 4/HClO 2) ⒉由上述信息回答:对同一氧化态的卤素,其含氧酸的氧化能力是大于、等于 还是小于其含氧酸盐的氧化性。 ⒊溴在自然界中主要存在于海水中,每吨海水约含 0.14 kg 溴。 Br 2 的沸点为 58.78 ℃;溴在水中的溶解度 3.58 g/100 g H 20( 20 ℃)。利用本题的信息说明如何 从海水中提取 Br 2,写出相应的化学方程式,并用方框图表达流程。 第三题 (6 分)过氧乙酸是一种广谱消毒剂,可用过氧化氢与乙酸反应制取,调 节乙酸和过氧化氢的浓度可得到不同浓度的过氧乙酸。 过氧乙酸含量的分析方法如下: 准确称取 0.5027 g 过氧乙酸试样,置于预先盛有 H 2SO 4溶液和 2~3 滴 1 mol/L MnSO 4溶液并已冷却至 0.02366 mol/L KMnO 4 标准溶液滴定至溶液呈浅粉色( mol/LNa 2S 2O 3标准溶液滴定, 接近终点时加人 3 mL 0.5 %淀粉指示剂, 继续滴定至 蓝色消失,并保持 30s 不重新显色,为终点,消耗了 Na 2S 2O 3 23.61 mL 。 ⒈写出与测定有关的化学方程式。 ⒉计算过氧乙酸的质量分数 (要求 3 位有效数字; 过氧乙酸的摩尔质量为 76 .05 g/mol )。 ⒊本法的 KMnO 4 滴定不同于常规方法,为什么? ⒋简述为什么此法实验结果只能达到 3 位有效数字。 ⒌过氧乙酸不稳定,易受热分解。写出热分解反应方程式。 第四题 ( 8分)日本的白川英树等于 1977 年首先合成出带有金属光泽的聚乙炔薄 膜,发现它具有导电性。这是世界上第一个导电高分子聚合物。研究者为此获得了 2000 年诺贝尔化学奖。 ⒈写出聚乙炔分子的顺式和反式两种构型。 ⒉ . 若把聚乙炔分子看成一维晶体,指出该晶体的结构基元。 ⒊假设有一种聚 40 mLH 20、 5 mol 3 mol/L 5℃的碘量瓶中,摇匀,用 30 s 不退色),消耗了 12.49 mL; 随即加人 10 mL 20 % KI 溶液和 2~ 3 滴( NH 4) 2 MoO 4 溶液(起催化作用并减 轻溶液的颜色),轻轻摇匀,加塞,在暗处放置 5 min ~ 10 min ,用 0.1018
高中化学竞赛之分子结构
高中化学竞赛之分子结构 一、选择题 1、下列分子结构中各原子的最外层电子都满足8电子稳定结构的是 A.SF6B.XeF2C.CS2D.CH4 2、下列温室气体中,和CO2一样,既是非极性分子,所有的原子又都达到8电子稳定结构的是 A.N2O B.CF2=CF2C.CCl2F2D.SF6 3、NH3、H2S等是极性分子,CO2、BF3、CCl4等是极性键构成的非极性分子。根据上述实例可推出AB n型分子是非极性分子的经验规律是: A.分子中不能含有氢原子 B.在A B n分子中A原子无孤对电子 C.在AB n分子中A的相对原子质量应小于B的相对质量 D.分子中每个共价键的键长应相等 4、电子总数相等的微粒称等电子体,下列各组微粒不属于等电子体的是 A.Mg2+和Al3+B.NO和CO C.Ca2+和S2-D.H2O和NH4+ 5、近年来,科学家合成了一种具有“二重结构”的球形分子。它是把足球型分子C60,容纳在足球型分子Si60中,外层的Si与里面的C以共价键结合。下列关于这种物质的叙述中正确的是A.是化合物B.是混合物C.不含极性键D.含有离子键 6、AB n型分子中,若A原子的最外层未达到稳定结构,则该分子被称为缺电子分子。下列分子属于缺电子分子的是 A.CO2B.BeCl2C.BF3D.PCl5 7、最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羧基硫(COS),已知羧基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法正确的是 A.羰基硫的属于非极性分子B.羰基硫沸点比CO2低 C.羰基硫的电子式为:D.羰基硫分子中三个原子处于同一直线上 8、近年来科学家发现有100个碳原子构成一个具有完美对称性的C100原子团,其中每个碳原子仍可形成4个化学键。最内层是由20个碳原子构成的正十二面体(即每个碳与其它三个碳相连)。外层的60个碳原子形成12个分立的正五边形(即每个碳原子与其它2个碳相连)。处于中间层次的碳原子连接内外层碳原子。当它与氢或氟形成分子时,其分子式为 A.C100H20和C100F20B.C100H60和C100F60 C.C100H12和C100F12D.C100H40和C100F40 9、根据等电子原理:由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是 A.CO和N2B.O3和NO2-C.CO2和N2O D.N2H4和C2H4 10、S8分子的空间几何构型呈皇冠型(。下列分子中,与S8分子具有相同的几何构型 的是 A.Se n S8-n B.(S NH)4C.(NSH)4D.S4N4 11、通常把原子数和电子数均相等的分子或离子称为等电子体。人们发现等电子体间的结构和性质相似,下列有关说法中正确的是 A.B3N3H6是由极性键组成的非极性分子 B.B3N3H6能发生加成反应和取代反应 C.B3N3H6具有碱性 D.B3N3H6各原子不在同一平面上 12、已知PCl5是三角双锥几何构型,若Cl元素有两种稳定的同位素,则PCl5的不同分子种数(包括
(完整word版)初三化学竞赛试题
初中化学应用知识竞赛初赛样题 考试时间:60分钟,总分:100分; 姓名评分 相对原子质量H—1 C—12 O—16 Na—23 Mg—24 S—32 Cl—35.5 K—39 Ca—40 Cu--64 一、精挑细选,每小题有1个或2个正确的答案哦!(每小题2分,共30分) 1、健康的食品关系千家万户,下列有关做法中,合理的是 A.用工业石蜡或滑石粉给瓜子“抛光、美容” B.用“明胶+色素”制作“人造鱼翅” C.用适量的小苏打使面包松软可口D.将过期奶粉掺入合格奶粉继续售卖 2、下列关于环境保护问题的叙述中,错误的是() A.“绿色化学”是指对环境产生负面影响的化学 B.“白色污染”主要是指白色粉尘等对环境造成的污染 C.“温室气体”主要是指二氧化碳、甲烷等气体 D.“酸雨”是由大气中含硫和和氮的氧化物等导致的 3、元素X 的氢氧化物的化学式为X(OH)m ,元素Y 的钾盐的化学式为KnY,则X与Y 两元素组成化合物的化学式为() A.XmYn B. YmXn C. XnYm D. YnXm 4、近年来赤潮在我国时有发生,当赤潮发生时,海水中的某些微小浮游生物大量繁殖,使水体呈红、紫等颜色,并对生物造成危害。下列说法中,不正确的是() A.赤潮是水体富营养化的结果 B.含磷洗衣粉广泛使用与排放是发生赤潮的主要原因之一 C.在封闭的海湾更易发生赤潮D.赤潮的发生是与人类活动无关的自然现象 5、已知镁在空气中燃烧时,会发生如下两个反应 3Mg+N2=Mg3N22Mg+O2=2MgO 则24g镁在空气中完全燃烧所得产物的质量为( ) A.等于33.3g B.等于40g C.33.3g---40g 之间D.小于33.3g或大于40g 6、原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2―1.下列有关X的说法不正确的是( ) A、X能形成化学式为X(OH)3的物质B.X可能形成化学式为KXO3的物质 C.X原子的最外层电子数和核电荷数肯定为奇数 D.X能与某些金属元素形成化合物 7、氢气将是一种很有前途的新能源。以水为原料大量制取氢气最理想的途径是 A、由热电站提供电力电解水 B、改进以焦碳和水制水煤气的方法 C、利用太阳能分解水 D、使赤热的铁和水反应生成氢气 8、下列说法中正确的是()
高中化学 原子结构
原子结构 1、用玻尔理论解释: (1)氢原子光谱产生的原因。 (2)氢原子光谱为什么是分立的线状光谱? (3)氢原子光谱中,每条谱线都有确定的频率。 (4)可见光区,氢原子光谱从Hα到Hδ等谱线间的距离为什么越来越小? 2、举例说明下列概念: ①量子和量子化; ②能级; ③基态、激发态; ④玻尔半径; ⑤连续光谱与线状光谱; 3、欲使氢原子基态能级上的一个电子电离,形成H+需要多大的能量? 4、计算电子从n=3能级跃迁到n=2能级时,产生的谱线Hα的波长,并与实验测定值λ=656.210纳米(1 纳米=10-9米)相比较。 5、说明下列名词和概念; (1)波粒二象性; (2)微观粒子; 6、试由电子衍射图象说明下列关系: (1)衍射强度与电子出现几率的关系; (2)衍射强度与电子波强度的关系; (3)电子波强度与电子出现几率的关系; (4)利用德布罗依关系式计算质量为2.5×10-2公斤,运动速度为300米/秒的子弹所具有的波长。计算质量为9.1×10-31公斤,运动速度为1.5×106米/秒的电子所具有的波长。计算结果说明了什么?(何种物质显波性)。 7、解释下列名词和概念 (1)波函数 (2)电子云 (3)几率和几率密度 (4)ψ和|ψ|2 8、举例说明下列名词的含意: ①能级;
② 简并轨道(等价轨道) 9、下列说法是否正确?应如何改正? ①“s 电子绕核旋转,其轨道为一园圈,而p 电子是∞字形的”。 ②“主量子数为3时,有3s 、3p ,3d ,3f 四条轨道”。 ③“多电子原子轨道能级与氢原子的相同。” 10、指出下列各组量子数所表示的电子运动状态。 ① 5,0,0,+ 21 ② 4,1,0,- 2 1 11、有无以下运动状态?为什么?应怎样改正? ① n=1, l=1, m=0。 ② n=2, l=0, m=±1。 ③ n=3, l=3, m=±3。 ④ n=4, l=3, m=±2。 12、在某元素原子的某一电子层中,角量子数为2的能级中,原子轨道中几个?并画出该能级下的原子轨道的角度分布图。 13、写出一列各组中缺少的量子数。 ① n=?, l=2, m=0, m s =+ 2 1。 ② n=4, l=?, m=0, m s =?。 ③ n=3, l=1, m=?, m s =- 2 1。 ④ n=2, l=?, m=1, m s =- 2 1。 15、原子核外电子的排布有哪些原则?写出下面元素的电子构型及价电子构型,并指出它们处于周期表中第几周期,第几族,常见化合价。 ① 11 Na ② 18 Ar ③ 16 S ④ 56 Ba ⑤ 24 Cr ⑥ 26 Fe ⑦ 29 Cu ⑧ 53 I ⑨ 82 Pb ⑩ 19 K 16、说明稀有气体、主族元素、过渡元素的电子构型特点。 17、具有下列外电子构型的原子属于周期表中哪一个区,并指出该元素的原子序数、
高中化学竞赛题-分子的结构
中学化学竞赛试题资源库——分子的结构 A组 1.下列分子中所有原子都满足最外层为8电子结构的是 A BeCl2 B PCl3 C PCl5 D N2O 2.下列分子结构中各原子的最外层电子都满足8电子稳定结构的是 A SF6 B XeF2 C CS2 D CH4 3.下列分子中,所有原子的最外层均为8电子结的是 A BeCl2 B H2S C NCl3 D SF6 4.下列分子中所有原子都满足最外层为8电子结构的是 A SiCl4 B H2O C BF3 D PCl5 5.下列分子中,所有原子都满足最外层为8电子结构的是 A BF3 B PCl5 C HCl D CF2Cl2 6.下列各分子中所有原子都满足最外层为8电子结构的是 A C2H4 B BeCl2 C PCl5 D CCl4 7.下列各分子中,所有原子都满足最外层为8电子结构的是 A H2O B BF3 C CCl4 D PCl5 8.下列分子中所有的原子都满足最外层8电子结构的是 A 次氯酸 B 二氟化硫 C 三氟化硼 D 氯化硫(S2Cl2) 9.下列温室气体中,和CO2一样,既是非极性分子,所有的原子又都达到8电子稳定结构的是 A N2O B CF2=CF2 C CCl2F2 D SF6 10.下列微粒中碳原子都满足最外层为8电子结构的是 A 甲基(—CH3) B 碳正离子(CH3+) C 碳负离子(CH3-) D 碳烯(∶CH2) 11.下列分子中所有原子都满足最外层8电子结构的是 A 六氟化氙(XeF6) B 次氯酸(HClO) C 二硫化碳(CS2) D 三氟化硼(BF3) 12.六氧化四磷的分子结构中只含有单键,且每个原子的最外层都满足8电子结构,则该分子中含有的共价键的数目是 A 10 B 12 C 24 D 28 13.具有极性键的非极性分子是 A CS2 B H2S C Cl2 D NH3 14.下列分子中,具有极性键而不是极性分子的是 A H2O B HF C CO D CO2 15.下列分子有极性的是 A CH≡CH B C CH3Cl D N2 16.只含极性键的非极性分子是 ①BF3(平面正三角型分子)②CCl4(正四面体型分子)③NH3
高中化学竞赛专题考试—分子结构(含答案)
高中化学竞赛专题考试——分子结构1 (路易斯结构式、共振式、VSPER 理论) 1.008 Zr Nb Mo Tc Ru Rh P d Ag Cd In Sn Sb Te I Hf Ta W Re Os Ir P t Au Hg Tl P b Bi P o At Ac-Lr H Li Be B C N O F Na Mg Al Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr Ba Ra Y La Lu -6.9419.01222.9924.31 39.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0 106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.003 20.18 39.9583.80 131.3 [222]He Ne Ar Kr Xe Rn 相对原子质量 Rf Db Sg Bh Hs Mt 一. 选择题(每题只有一个正确选项,每题2分,共50分) 1. 根据鲍林近似能级图,在多电子原子中,基态时,下列电子均处于一定的能级,其中占据能级最高轨道的电子是: ( ) A 2,1,,+1/2 B 3,1,,+1/2 C 3,2,,+1/2 D 4,0,0, 2. 下列离子的电子构型可以用[Ar]3d 6表示的是 ( ) A Mn 2+ B Fe 3+ C Co 3+ D Ni 2+ 3. 下列离子半径变小的顺序正确的是 ( ) A F ->Na +>Mg 2+Al 3+ B Na +>Mg 2+>Al 3+>F - C Al 3+>Mg 2+>Na +>F - D F ->Al 3+>Mg 2+>Na + 4. 下列元素的原子中,第一电离能最大的是 ( ) A Be B B C C D N 5. 下列物质中,含极性键的非极性分子是 ( ) A H 2O B HCl C SO 3 D NO 2 6. 下列分子中,没有配位键的是 ( ) A CO B (BeCl 2)2 C CH 3OBF 3 D N 2H 4 7. NO 3— 合理的共振式总数为 ( ) A 1 B 2 C 3 D 4 8.下列分子中,键级等于零的是 ( ) A .O 2 B. F 2 C. N 2 D. Ne 2 9.原子轨道沿两核连线以“肩并肩”方式进行重叠的是 ( ) A. б键 B. 氢键 C. π键 D. 离子键 10. 下列物种中,键长最短的是 ( ) A O 2 B O 2+ C O 2— D O 22— 11. 下列化合物中,极性最大的是 ( ) A CS 2 B H 2O C SO 3 D SnCl 4 12. 下列物种中,既是路易斯酸,也是路易斯碱的是 ( ) ACCl 4 B SOCl 2 C NH 2— D Hg 2+ 13. 估计下列分子中,键角最小的是 ( ) ( ) A NH 3 B PH 3 C AsH 3 D SbH 3 14.估计下列分子或离子中,键角最小的是 ( ) A NH 3 B NO 3— C NF 3 D NCl 3
化学竞赛试题及答案
第一题单项选择题(共25题) 1 .下列化合物,在 NaOH 溶液中溶解度最大的是 ( ) [A]. PbCrO4 [B] . Ag2CrO4 [C] . BaCrO4 [D] . CaCrO4 2 .向酸性K2Cr2O7溶液中加入 H2O2,却未观察到蓝色物质生成, 其原因肯定是( [A].未加入乙醚,因 CrO5与乙醚的加合物为蓝色 [B].未加入戊醇,因 醇中显蓝色 [C].未将溶液调至碱性,因 或)H2O2浓度过稀 3 .实验室配制洗液,最好的方法是 ( [A].向饱和 K2Cr2O7溶液中加入浓硫酸 ) CrO5萃取到戊 CrO5在酸性介质中分解 [D].因K2Cr2O7 (和/ ) [B].将 K2Cr2O7溶于热的浓硫酸 [C].将 K2Cr2O7溶于1 : 1硫酸[D].将 K2Cr2O7与浓硫酸共热 4 .滴加0.1mol -L-1 CaCl2溶液没有沉淀生成,再滴加氨水有白色沉淀生成, 该溶液是() [A] . Na3PO4 [B] . Na2HPO4 [C] . NaH2PO4 5 .从滴瓶中取少量试剂加入试管的正确操作是 ( [A].将试管倾斜,滴管口贴在试管壁,再缓慢滴入试剂 口约半厘米处缓慢滴入试剂 [D].以上三种溶液均可 ) [B].将试管倾斜,滴管口距试管 [C].将试管垂直,滴管口伸入试管内半厘米再缓慢滴入试剂 [D].将试管垂直,滴管口贴在试管壁,再缓慢滴入试剂 6 .制备下列气体时可以使用启普发生器的是 ( ) [A].高锰酸钾晶体与盐酸反应制氯气 [B].块状二氧化锰与浓盐酸反应制氯气 碳酸钾与盐酸反应制二氧化碳 [D].块状硫化亚铁与稀硫酸反应制备硫化氢 7 .实验室用浓盐酸与二氧化锰反应制备氯气,欲使氯气纯化则应依次通过 [A].饱和氯化钠和浓硫酸 [B].浓硫酸和饱和氯化钠 [C].氢氧化钙固体和浓硫酸 和氯化钠和氢氧化钙固体 8 .使用煤气灯涉及的操作有: ①打开煤气灯开关;②关闭空气入口;③擦燃火柴; 燃煤气灯;⑤调节煤气灯火焰。点燃煤气灯时操作顺序正确的是 [A].①②③④⑤ [B].②①③④⑤ [C].②③①④⑤ 9 .能将 Cr3+和Zn2+离子分离的溶液是 ( [A] . NaOH [B] . NH3 - H2O [C] . Na2CO3 10 .下列配制溶液的方法中,不正确的是 ( ) [A] . SnCl2溶液:将SnCl2溶于稀盐酸后加入锡粒 酸后放入铁钉 [C] . Hg(NO3)2溶液:将Hg(NO3)2 溶液:将FeCI3溶于稀盐酸 11 .由二氧化锰制锰酸钾,应选择的试剂是 [A].王水 + KCl 12 .向酸性的 ( ) [A] . NaOH 溶液 ( ) [D].③②①④⑤ KI [B]. Cl2 + KCl 溶液中滴加过量的 [B]. KI 溶液 [C].无水 ( ) [D].饱 ④点 ) [D]. NaHC03 [B]. FeSO4 溶液:将 溶于稀硝酸后加入少量 FeSO4溶于稀硫 Hg [D]. FeCl3 ( [C].浓 H2SO4 + KC1O3 H2O2有灰黑色沉淀生成,不能使该沉淀消失的是 [D]. KOH + KC1O3 13 .将少量KMnO4晶体放入干燥的试管中, 逐滴加入水,最先观察到溶液的颜色是 ( [A].粉红 [B].紫色 [C].绿色 14 .将新生成的下列化合物在空气中放置,颜色最不易发生变化的是 [A] . Fe(OH)2 [B] . Ni(OH)2 [C] . Mn (OH)2 15 .与浓盐酸作用有氯气生成的是 ( ) [A] . Fe2O3 [B] . Pb2O3 [C] . Sb2O3 [D]. 16 .向Hg2(NO3)2溶液中滴加氨水时生成物的颜色是 [C].稀 HNO3 [D] . NaClO 溶液 在煤气灯上小火加热一段时间后冷却至室温, ) [D].黄色 ( ) [D] . Co(OH)2 Bi2O3 ( )
版全国高中化学竞赛考纲
全国高中学生化学竞赛基本要求 1.本基本要求旨在明确全国高中学生化学竞赛初赛及决赛试题的知识水平,作为试题命题的依据。本基本要求不包括国家代表队选手选拔赛的要求。 2.现行中学化学教学大纲、普通高中化学课程标准及高考说明规定的内容均属初赛要求。高中数学、物理、生物、地理与环境科学等学科的基本内容(包括与化学相关的我国基本国情、宇宙、地球的基本知识等)也是化学竞赛的内容。初赛基本要求对某些化学原理的定量关系、物质结构、立体化学和有机化学作适当补充,一般说来,补充的内容是中学化学内容的自然生长点。 3.决赛基本要求是在初赛基本要求的基础上作适当补充和提高。 4.全国高中学生化学竞赛是学生在教师指导下的研究性学习,是一种课外活动。针对竞赛的课外活动的总时数是制定竞赛基本要求的重要制约因素。本基本要求估计初赛基本要求需40单元(每单元3小时)的课外活动(注:40单元是按高一、高二两年约40周,每周一单元计算的);决赛基本要求需追加30单元课外活动(其中实验至少10单元)(注:30单元是按10、11和12月共三个月约14周,每周2~3个单元计算的)。 5.最近三年同一级别竞赛试题涉及符合本基本要求的知识自动成为下届竞赛的要求。 6.本基本要求若有必要做出调整,在竞赛前4个月发出通知。新基本要求启用后,原基本要求自动失效。 初赛基本要求: 1.有效数字在化学计算和化学实验中正确使用有效数字。定量仪器(天平、量筒、移液管、滴定管、容量瓶等等)测量数据的有效数字。数字运算的约化规则和运算结果的有效数字。实验方法对有效数字的制约。 2.气体理想气体标准状况(态)。理想气体状态方程。气体常量R。体系标准压力。分压定律。气体相对分子质量测定原理。气体溶解度(亨利定律)。 3.溶液溶液浓度。溶解度。浓度与溶解度的单位与换算。溶液配制(仪器的选择)。重结晶的方法及溶质/溶剂相对量的估算。过滤与洗涤(洗涤液选择、洗涤方式选择)。重结晶和洗涤溶剂(包括混合溶剂)的选择。胶体。分散相和连续相。胶体的形成和破坏。胶体的分类。胶体的基本结构。 4.容量分析被测物、基准物质、标准溶液、指示剂、滴定反应等基本概念。酸碱滴定曲线(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。酸碱滴定指示剂的选择。以高锰酸钾、重铬酸钾、硫代硫酸钠、EDTA为标准溶液的基本滴定反应。分析结果的计算。分析结果的准确度和精密度。 5.原子结构核外电子运动状态: 用s、p、d等来表示基态构型(包括中性原子、正离子和负离子)核外电子排布。电离能、电子亲合能、电负性。
化学竞赛晶体结构综合例题
晶体结构综合例题 一.有一立方晶系的离子晶体,其结构如右图所示,试回答: 1.晶体所属的点阵形式及结构基元; 2.已知=169,=181,试问此两种离于联合组成了何种型式 的密堆积; 3.2+处在何种空隙里? 4.指出各离子的配位情况? 解:1. 立方P,3 ; 2. A1型(立方面心)堆积, +,-离子半径大致相近; 3. 八面体空隙中; 4. 2+周围-配位数6,+配位数8;-周围2+配位数2,+配位数4;+周围-配位数12,2+配位数8。 二.黄铜矿是最重要的铜矿,全世界的2/3的铜是由它提炼 的。 1.右图为黄铜矿的晶胞。计算晶胞中各种原子的数目,写出 黄铜矿的化学式; 2.在高温下,黄铜矿晶体中的金属离子可以发生迁移。若铁 原子与铜原子发生完全无序的置换,可将它们视作等同的金属离 子,请说出它的晶胞。 3.在无序的高温型结构中,硫原子作什么类型的堆积? 金属原子占据什么类型的空隙?该空隙被金属原子占据的分数是 多少? 4.计算黄铜矿晶体的密度; (晶胞参数:52.4,103.0;相对 原子量:63.5 55.84 S 32.06)。 解:1. 各种原子的数目, , S: 4, 4, 8; 黄铜矿的化学式2 ; 2.它的晶胞与晶胞相同;但金属离子随机性为50%; (如图); 3.硫原子作A1型(立方F)堆积; 金属原子占据四面体空 隙; 该空隙被金属原子占据的分数1/2; 4.容易计算黄铜矿晶体的密度4.313 . 1/21/2 S
三.冰晶石(36)用作电解法炼铝的助熔剂。冰晶石晶胞是以大阴离子(63- )构成的面 心立方晶格,+ 可看作是填充在晶格的空隙中,已知冰晶石的密度为2.953,—F 键长181 ,相对原子质量: 23.0; 27.0;F 19.0。 1.指出63- 配离子中心离子的杂化轨道类型、配离子空间构型和所属分子点群。 2.指出36的点阵形式;阴离子作何种形式的堆积,阳离子占据何种空隙及占有率;写出它们的分数坐标。 3.计算冰晶石晶体的晶胞参数。 4. 计算+ 的半径。 解:1. 63- 配离子中心离子的杂化轨道类型为 3d 2杂化; 配离子空间构型为正八面体; 所属分子点群为 。 2. 36的点阵形式为立方F ;阴离子作A 1型堆积,阳离子占据100%八面体空及 100%四面体空隙;它们的分数坐标为 63-: (0,0,0) (1/2,1/2,0) (1/2,0,1/2) (0,1/2,1/2)(1分); : (1/4,1/4,1/4) (1/4,1/4,3/4) (1/4,3/4,1/4) (1/4,3/4,3/4) (3/4,1/4,1/4) (3/4,1/4,3/4) (3/4,3/4,1/4) (3/4,3/4,3/4) (1/2,1/2,1/2) (0,0,1/2) (0,1/2,0) (1/2,0,0). 3.晶胞内含4个[36]单元,36摩尔质量为210。设晶胞边长为a ,则95.21 1002.642103 23=???a 780 4. 181, 按四面体空隙计算 pm R a 1564 3 =--;按八面体空隙计算为209(舍去); 真实值为157. 四.合金可看作由下图所示的a 、b 两种原子层交替堆积排列而成:a 是由和共同组成的层,层中-之间由实线相连;b 是完全由原子组成的层,-之间也由实线相连。图中由虚线勾出的六角形,表示由这两种层平行堆积时垂直于层的相对位置。c 是由a 和b 两种原子层交替堆积成的晶体结构图。在这结构中:同一层的-为294;相邻两层的-为327。 1.确定该合金的化学式; 2.有几个原子配位(周围的原子数,不一定要等距最近); 的配位情况如何,列式计算的平均配位数; 3.该晶体属何种晶系;写出各原子的分数坐标;计算晶胞参数。 4.计算该合金的密度( 40.1 63.5) 5.计算、原子半径。
【精品】全国初中化学竞赛试题及答案
全国初中化学竞赛 可能用到的相对原子质量 H:1 C:12 N:14 O:16 Na:23 Mg:24 Al:27 S:32 Cl:35.5 K:39 Ca:40 Fe:56 Cu:64 Zn:65 Ag:108 Cd:112 Sn:119 Ba:137 Pb:207 Si:28 一、选择题(本题包括15个小题,每小题2分,共30分。每小题有1个或2个选项符合题意。 1.我国“化学”一词最早出于《化学鉴原》(1871年)。该书把一种元素翻译为“矽(xi)”。在地壳里,“矽”的含量在所有元素含量中占第二位,现代把这种“矽”元素命名为 A .锡 B.硒 C.氧 D.硅 2.人们可从铁钛矿(主要成分FeTiO3)制取金属钛(Ti),其在一定条件下的主要反应有: ①FeTiO3+H2 = Fe+TiO2+H2O;②TiO2+2C+2Cl2=TiCl4+2CO;③TiCl4+2Mg=2MgCl2+Ti 下列叙述正确的是 A . 反应①中的H2被氧化 B. 反应②中钛元素的化合价升高 C. 反应③是复分解反应 D. 反应②Cl2中的“Cl”得到电子 3.正常人胃液的pH在0.3~1.2之间。用以治疗胃酸过多的药物中常含MgCO3、NaHCO3、酒石酸钠等,这主要是由于 A.碳酸、酒石酸都不是强酸 B.酒石酸是营养品 C.Na2+、Mg2+都是人体必需的元素 D . MgCO3、NaHCO3与胃酸作用生成CO2,服药后有喝汽水的感觉 4.下列制取物质的设计中,不可能 ...实现的是
5.两个或多个同种含氧酸分子之间可以脱水形成相对分子质量更大的酸,如磷酸H3PO4可形成H4P2O7或H5P3O10等。下列物质不属于硫酸(H2SO4)脱水后形成的是 A. H2S2O7 B. H2S3O10 C. H2S2O8 D. H2S4O13 6.“碳捕捉技术”是指通过一定的方法,将工业生产中产生的CO2分离出来进行储存和利用。常利用NaOH 溶液来“捕捉”CO2,过程如下图所示(部分条件及物质未标出)。 下列有关该方法的叙述中正确的是 A.该方法的优点是能耗小 B.该方法可减少碳排放 C.整个过程中,只有一种物质可以循环利用 D.“反应分离”中,分离物质的基本操作是蒸发、结晶 7.已知复分解反应2CH3COOH+Na2CO3=2CH3COONa+H2O+CO2↑可进行。在常温下,测得相同浓度的 下列六种溶液的pH: NaHCO3Na2CO3NaClO NaCN 溶质CH3COON a pH 8.8 8.6 11.6 10.3 11.1 表中数据揭示出复分解反应的一条规律,即碱性较强的物质发生类似反应可以生成碱性弱的物质。依照该 规律,请你判断下列反应不能成立的是 A. CO2+H2O+2NaClO=Na2CO3+2HClO B. CO2+H2O+NaClO=NaHCO3+HClO C. CH3COOH+NaCN=CH3COONa+HCN D. NaClO+CH3COOH=HClO+CH3COONa 8.为测定气球内的气体成分,有学生用超薄材料制成的气球按右图装置进行实验。开始 时气球沉于烧杯底部,打开开关后,过一会儿气球从烧杯底部慢慢浮起,最后悬于烧杯 口。气球内可能的气体是
2007年全国高中学生化学竞赛试题及详解
2007年全国高中学生化学竞赛(省级赛区)试题 (时间:3小时满分:100分) 第1题(12分) 通常,硅不与水反应,然而,弱碱性水溶液能使一定量的硅溶解,生成Si(OH)4。 1-1已知反应分两步进行,试用化学方程式表示上述溶解过程。 早在上世纪50年代就发现了CH5+的存在,人们曾提出该离子结构的多种假设,然而,直至1999年,才在低温下获得该离子的振动-转动光谱,并由此提出该离子的如下结构模型:氢原子围绕着碳原子快速转动;所有C-H键的键长相等。 1-2该离子的结构能否用经典的共价键理论说明?简述理由。 1-3该离子是()。 A.质子酸 B.路易斯酸 C.自由基 D.亲核试剂 2003年5月报道,在石油中发现了一种新的烷烃分子,因其结构类似于金刚石,被称为“分子钻石”,若能合成,有可能用做合成纳米材料的理想模板。该分子的结构简图如下: 1-4该分子的分子式为; 1-5该分子有无对称中心? 1-6该分子有几种不同级的碳原子? 1-7该分子有无手性碳原子? 1-8该分子有无手性? 第2题(5分) 羟胺和用同位素标记氮原子(N﹡)的亚硝酸在不同介质中发生反应,方程式如下: NH2OH+HN﹡O2→ A+H2O NH2OH+HN﹡O2→ B+H2O A、B脱水都能形成N2O,由A得到N﹡NO和NN﹡O,而由B只得到NN﹡O。 请分别写出A和B的路易斯结构式。 第3题(8分)
3-1 以“”表示空层,A、B、C表示Cl-离子层,a、b、c表示Mg2+离子层,给出三方层型结构的堆积方式。 3-2计算一个六方晶胞中“MgCl2”的单元数。 3-3 假定将该晶体中所有八面体空隙皆填满Mg2+离子,将是哪种晶体结构类型? 第4题(7分) 化合物A是一种热稳定性较差的无水的弱酸钠盐。用如下方法对其进行分析:将A与惰性填料混合均匀制成样品,加热至400℃,记录含A量不同的样品的质量损失(%),结果列于下表: 利用上述信息,通过作图,推断化合物A的化学式,并给出计算过程。 第5题(10分) 甲苯与干燥氯气在光照下反应生成氯化苄,用下列方法分析粗产品的纯度:称取0.255g样品,与25 mL 4mol·L-1氢氧化钠水溶液在100 mL圆底烧瓶中混合,加热回流1小时;冷至室温,加入50 mL20%硝酸后,用25.00mL 0.1000mol·L-1硝酸银水溶液处理,再用0.1000mol·L-1NH4SCN水溶液滴定剩余的硝酸银,以硫酸铁铵为指示剂,消耗了6.75 mL。 5-1 写出分析过程的反应方程式。 5-2 计算样品中氯化苄的质量分数(%)。 5-3 通常,上述测定结果高于样品中氯化苄的实际含量,指出原因。 5-4 上述分析方法是否适用于氯苯的纯度分析?请说明理由。
