碎米荠硒多糖的分离纯化及光谱分析

碎米荠硒多糖的分离纯化及光谱分析
石宝霞1,车会莲1,赵利霞2,谭 军3,*,潘思轶3,汪兴平4,柳 玉1
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.北京市食品酿造研究所,北京 100050;
3.华中农业大学食品科技学院,湖北 武汉 430070;4.湖北民族学院,湖北 恩施 445000)
摘 要:本研究利用DEAE-Cellulose-52离子交换层析技术,采用步进式洗脱模式成功地将碎米荠硒多糖粗品进行Sephadex G-200葡聚糖凝胶柱层析,得到四种均一的硒多糖,SDS-PAGE电泳法鉴定其纯度。并采用紫外分光光度计、傅立叶变换红外光谱仪对硒多糖的结构进行了分析。关键词:硒多糖;分离纯化;红外光谱
Study on Purification and Spectra Analysis of Cardamine Urbaniana O.E. Schlz-Selenium Polysaccharide
SHI Bao-xia1,CHE Hui-lian1,ZHAO Li-xia2,TAN Jun3,*,PAN Si-yi3,WANG Xing-ping4,LIU Yu1(1.College of Food Science and Nutritional Engineering, Chinese Agricultural University, Beijing 100083, China;
2.Beijing Food Brewing Institute, Beijing 100050, China;
3.College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China;4. Hubei Institute for Nationalities, Enshi 445000, China)
Abstract :DEAE-Cellulose-52 ion-exchange chromatography was used to separate CUS-SeP. It was successful to obtain fourfractions, by the step gradient elution. PE was further purified by SephdexG-200. Electrophoresis was applied to identify thepurity of PE, and identified to be electrophoresis grade purity. The structure characteristics of CUS-SeP were analysed with UVand FTIR.
Key words:selenium polysaccharide;purification;spectra analysis
中图分类号:TQ929.2 文献标识码:A 文章编号:1002-6630(2007)06-0298-05
收稿日期:2007-02-01 *通讯作者
作者简介:石宝霞(1966-),女,研究方向为食品科学。
碎米荠(Cardamine Urbaniana O.E. Schlz)属于十字花科,碎米荠属,又名菜子七、半边菜,为民间常用药物,也是富硒地带-恩施地区广泛生长的植物资源,具有很高的药用价值和食用价值[1]
。硒是生命活
动的必需元素,缺硒可导致机体胆固醇酯合成和分泌
增加
[2]
。其存在形式有无机硒和有机硒两种,常见的无
机硒有亚硒酸钠和硒酸钠,有机硒主要是硒蛋白和硒多糖。硒多糖是硒与多糖有机结合的有机硒化合物,具有硒和多糖的双重生理功能[3],是一种较好的补硒剂。目前对碎米荠的开发利用的研究尚无报道,国内外对天然植物中硒多糖的研究还处于起步阶段
[4-5]
。
本研究在对碎米荠根硒多糖体物进行分离纯化的基础上,对碎米荠硒多糖的进了紫外、红外光谱分析,为进一步进行碎米荠硒多糖的结构研究奠定了基础,也为碎米荠硒多糖的生物活性研究提供了重要依据。1
材料与方法
1.1材料与仪器1.1.1
材料
碎米荠根:采集于湖北恩施自治州富硒地带,多
年生老根洗净晒干后粉碎。1.1.2
试剂
葡萄糖标准品 Sigma公司,硫酸、苯酚、氯仿、正丁醇、乙醇、乙醚、硝酸、高氯酸均为市售分析纯试剂。1.1.3
仪器
SD-250涡轮式粉碎机 浙江省嵊县特种粉碎设备厂;全波长分光光度计 上海分析仪器厂;RE52-99旋转蒸发器 上海亚荣生化仪器厂;ALPHAL-2真空冷冻干燥机 德国;自动柱层析仪 瑞典;紫外可见记录光谱仪 日本岛津公司;红外分光光谱仪 日本。1.2方法
1.2.1
碎米荠硒多糖的制备
华中碎米荠硒多糖的制备[6]:准确称取一定量的碎米荠根的粉末,按需要加入一定体积的水,在一定的温度下恒温提取一段时间,过滤,滤渣用适量的水洗涤、过滤相应的次数后,合并几次的提取液,减压浓缩,Sevag除蛋白后,脱色、醇沉分级,真空冷冻干燥后醇洗,除去小分子和游离的无机硒,用石油醚脱脂,真空冷冻干燥后得硒多糖粗提物。
1.2.2碎米荠硒多糖的分级纯化
采用纤维素DEAE-52柱层析进行硒多糖分级[7],分级条件为:18mm×600mm层析柱,依次用蒸馏水、0.1mol/L氢氧化钠洗脱,上样浓度300mg/ml,上样体积
2ml,流速15ml/h,洗脱的溶液用部分收集器分部收集,每管收集2.5ml。用硫酸-苯酚法489.8nm处跟踪检测,洗脱至多糖溶液呈现阴性。
以含糖量为纵坐标和收集管数为横坐标作图,得到洗脱曲线,确定含糖量。收集多糖反应呈现阳性的硒多糖溶液进行透析48h后,冷冻干燥浓缩,取分级后的硒多糖用Sephadex G-200分级纯化,上样浓度10mg/ml,上样体积1ml,流速9ml/h,每管收集1.5ml,得到分子量分布更加集中的硒多糖。
1.2.3SDS-PAGE电泳法检测硒多糖纯度
采用SDS-PAGE不连续体系的垂直板电泳检测得到的碎米荠硒多糖纯度[8],分离胶浓度为10%,浓缩胶浓度为5%,电极缓冲液pH为8.3,Tris-NH4Cl-0.1% SDS缓冲液,样品为5mg/ml,每孔进样量为50μl,样品在浓缩胶段电压为90V,进入分离胶后变为110V,电泳4h,用过碘酸-希夫试剂对硒多糖染色。
硒多糖的染色方法:SDS-PAGE后的凝胶用乙酸/甲醇/水(10:35:35)固定1h,将凝胶浸泡在过碘酸溶液中约1h,弃去溶液,用水略微漂洗后,加入50ml偏亚硫酸钠溶液,凝胶变成黄色,10min后更换50ml偏亚硫酸钠,再过10min,即能完全脱色,脱色后的凝胶置于希夫试剂中,直至有红色条带出现。
1.2.4紫外光谱分析
准确称取碎米荠硒多糖标准品CUS-SeP-A、CUS-SeP-B、CUS-SeP-C、CUS-SeP-D各25mg,蒸馏水定容至50ml。紫外可见记录光谱仪190~400nm扫描测定硒多糖(0.5mg/ml)溶液的紫外吸收光谱。
1.2.5红外光谱分析
碎米荠硒多糖CUS-SeP-A、CUS-SeP-B、CUS-SeP-C、CUS-SeP-D经KBr压片,红外光谱仪扫描分析,扫描范围为4000~400cm-1,得到其红外光谱[9]。
2结果与分析
2.1DEAE-Cellulose 52阴离子交换层析结果
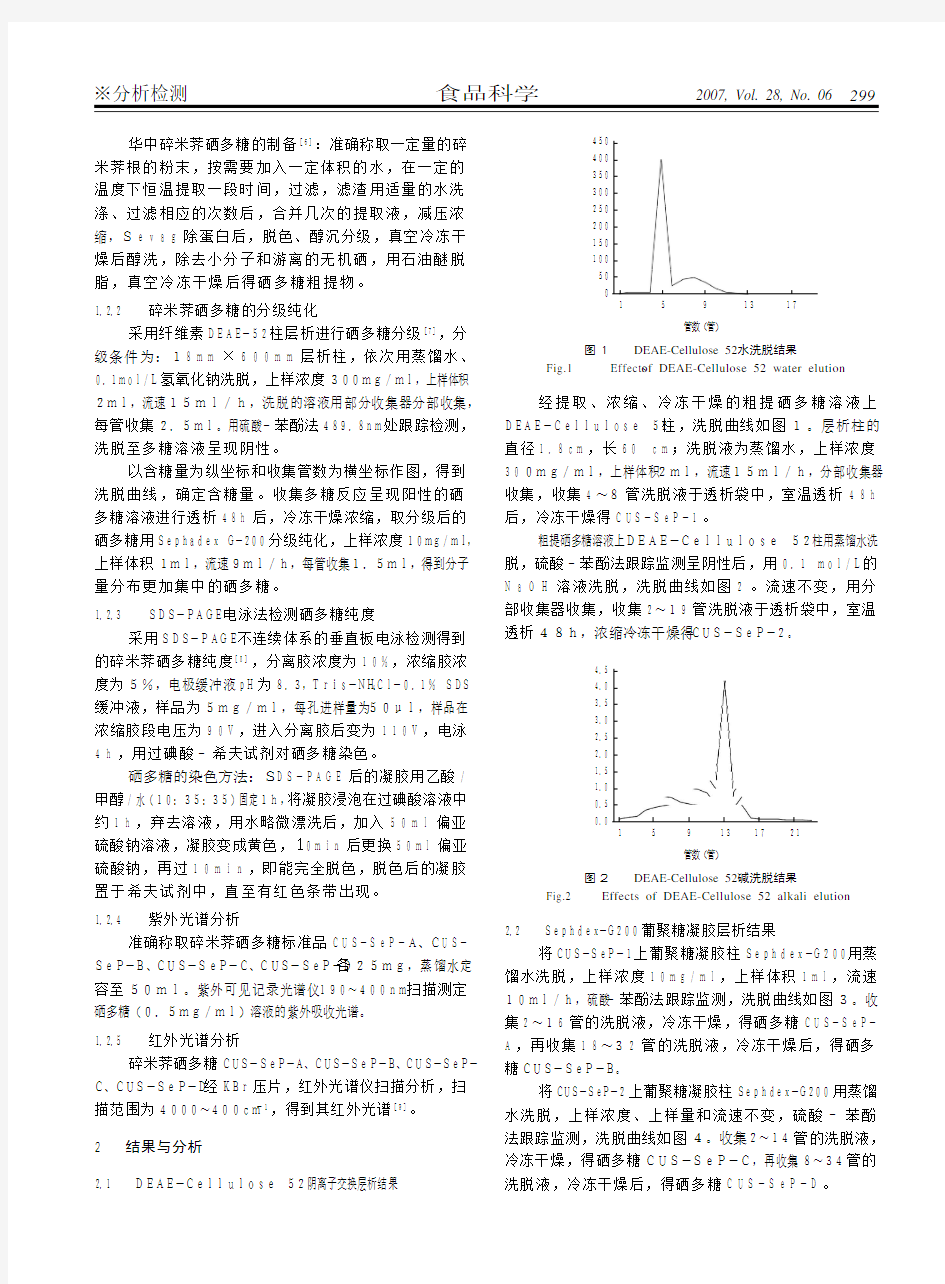
经提取、浓缩、冷冻干燥的粗提硒多糖溶液上DEAE-Cellulose 52柱,洗脱曲线如图1。层析柱的直径1.8cm,长60 cm;洗脱液为蒸馏水,上样浓度300mg/ml,上样体积2ml,流速15ml/h,分部收集器收集,收集4~8管洗脱液于透析袋中,室温透析48h后,冷冻干燥得CUS-SeP-1。
粗提硒多糖溶液上DEAE-Cellulose 52柱用蒸馏水洗脱,硫酸-苯酚法跟踪监测呈阴性后,用0.1 mol/L的NaOH溶液洗脱,洗脱曲线如图2。流速不变,用分部收集器收集,收集2~19管洗脱液于透析袋中,室温透析48h,浓缩冷冻干燥得CUS-SeP-2。
图1 DEAE-Cellulose 52水洗脱结果
Fig.1 Effects of DEAE-Cellulose 52 water elution
450
400
350
300
250
200
150
100
50
0
1
5
913
17
硒
多
糖
浓
度
(
m
g
/
m
l
)
管数(管)
图2 DEAE-Cellulose 52碱洗脱结果
Fig.2 Effects of DEAE-Cellulose 52 alkali elution
4.5
4.0
3.5
3.0
2.5
2.0
1.5
1.0
0.5
0.0
159131721
硒
多
糖
浓
度
(
m
g
/
m
l
)
管数(管)
2.2Sephdex-G200葡聚糖凝胶层析结果
将CUS-SeP-1上葡聚糖凝胶柱Sephdex-G200用蒸馏水洗脱,上样浓度10mg/ml,上样体积1ml,流速10ml/h,硫酸-苯酚法跟踪监测,洗脱曲线如图3。收集2~16管的洗脱液,冷冻干燥,得硒多糖CUS-SeP-A,再收集18~32管的洗脱液,冷冻干燥后,得硒多糖CUS-SeP-B。
将CUS-SeP-2上葡聚糖凝胶柱Sephdex-G200用蒸馏水洗脱,上样浓度、上样量和流速不变,硫酸-苯酚法跟踪监测,洗脱曲线如图4。收集2~14管的洗脱液,冷冻干燥,得硒多糖CUS-SeP-C,再收集18~34管的洗脱液,冷冻干燥后,得硒多糖CUS-SeP-D。
2.3SDS-PAGE电泳
四种硒多糖经不连续的垂直板电泳后,用希夫试剂
染色,结果见图5,胶带均出现单一斑点,可以确定
四种硒多糖成分单一,为高纯度均一的硒多糖。
图3 水洗部分洗脱结果Fig.3 Effects of water elution
1.21.0
0.8
0.6
0.40.2
0.0
1
5
9
13
17
21
25
29
33
硒多糖浓度(mg/ml)
管数(管)
图4 碱洗部分Sephadex-G200洗脱结果Fig.4 Effects of Sephadex-G200 alkali elution
0.160.140.120.100.080.060.040.020.00
1
5
9
1317212529
33
硒多
糖
浓
度
(
m
g
/
ml
)
管数(管)
图5 硒多糖的电SDS-PAGE 图谱
Fig.5 Electrophoresis pattern of SDS-PAGE of polysaccharides
containing selenium
2.4紫外光谱分析
碎米荠硒多糖各级水溶液的紫外光谱图见图6,四
种硒多糖的紫外光谱是典型的硒多糖吸收曲线,且四种硒多糖在280nm和260nm附近均未见蛋白质和核酸的特征吸收峰,表明硒多糖提取物中蛋白质含量较低,有文献认为可以通过在280nm处是否有吸收峰来判断多糖
1.000
0190
260400
CUS-SeP1
波长(nm)
1.000
01.000
0190
260400
CUS-SeP2
波长(nm)
1.000
0190
260400
波长(nm)
图6 碎米荠硒多糖水溶液的紫外光谱图
Fig.6 Ultra-violet spectrogram of water-solution of Cardamine
Urbaniana O.E. Schlz-selenium polysaccharide
1.000
0190
260400
CUS-SeP3
波长(nm)
1.000
0提取物中是否含蛋白质,这种判断依据是不可靠的,因为纯度较低的硒多糖,也可能由于杂质的影响而出现吸收峰[10]。
2.5
碎米荠硒多糖的红外光谱分析
根据葡萄多糖四个级分的红外光谱分析(波数
4000~200cm-1 中红外区)可知,如图7~图10,该多
糖是一个成分较为复杂的杂多糖。从特征吸收波数可知,在3400cm
-1
有一特征峰,O-H的伸缩振动在
3600~3200cm-1出现一种宽峰,N-H也在这个区域有伸缩振动,官能团分析可知,在该糖中可能存在O-H和N-H;在波数2922cm-1处有一特征峰,其吸收峰较弱是一种分子中C-H
键的变角振动引起;在波数
4000
300020001000
波数(cm
-1
)
74706662585450464238透光率(%)
3430.18
2922.21
2361.232339.14
1623.561420.371105.091137.67
669.45594.36470
图7 CUS-SeP-A 的红外光谱图Fig.7 Infrared spectrogram of
CUS-SeP-A 4000
300020001000
波数(cm-1)
7065605550454035302520透光率(%)
3434.60
2926.632851.53
2361.231619.141420.37
1120.00
868.22
612.02
466.26
图10 CUS-SeP-D 的红外光谱图Fig.10 Infrared spectrogram of CUS-SeP-D
2334.72
2340cm-1左右时形成的峰,可能为结晶水结构引起的吸收峰;在1640~1630cm-1间有一特征峰,可能是C=O基,各种糖的水化物均有1665~1635cm-1的吸收峰,非水化物则无此吸收峰,多糖中的乙酰氨基(-NH2COCH3)的C=O伸缩振动在1620cm-1附近出现;波数在1583cm-1附近的吸收峰可能为-COO伸缩振动引起的,研究表明[11-13],血清多糖、甲壳素、硫酸软骨素-玻璃酸(糖醛酸)的糖都具有乙酰氨基,而其中的N-H变角振动出现在1560~1508cm-1,而具有与硫酸基(Na盐形式)结合
的
-
NH-的肝素在这个区域内没有吸收峰,因此可推测该糖也有乙酰氨基;在1398~1420cm-1处有吸收峰,可
能为C-O伸缩振动引起的在多糖的结构中可能有-COOH
的结构;在1240~1040cm-1间有特征峰。可能为O-H变角振动引起的,可能有-OH的官能团;在1100cm-1处有一吸收峰,可能是由C-O伸缩振动引起的,为C-O-
C(脂肪醚)、C-O-C(环内醚)的结构;在460~670cm-1间有一特征峰为对称环伸缩振动引起的,可能有Se=O或Se-H结构。3
结 论
本研究通过柱层析(阴离子交换柱层析,葡聚糖凝胶柱层析),在实验室摸索出了一套适合于分离纯化碎米荠硒多糖的层析方法,在实验室条件下制得了四种均一硒多糖,并根据硒多糖的特性,利用不连续的垂直板电泳法和希夫试剂染色法鉴定了碎米荠硒多糖的纯
度,经紫外光谱分析得知四种硒多糖的紫外光谱是典型的硒多糖吸收曲线,且四种硒多糖在280nm和260nm附近均未见蛋白质和核酸的特征吸收峰,经红外光谱分析,四种硒多糖主要含有α-糖苷键,也有的含有少量的β-糖苷键,为对硒多糖结构、性质及生物学功能的进一步研究和开发提供了参考数据和思路。
参考文献:
[1]
崔乔, 尚德静, 邹霞. 硒多糖的研究进展[J].
中国生化药物杂志, 2003,
4000
300020001000
波数(cm-1)
55
45352515
5-53421.35
2365.642339.14
1583.801415.95
1155.34
996.32
625.28
图8 CUS-SeP-B 的红外光谱图Fig.8 Infrared spectrogram of CUS-SeP-B 透光率(%)
4000
300020001000
波数(cm-1)
58545046
42383430
26223412.52
2922.212851.53
2361.232334.72
1155.811398.281627.981115.581075.83616.44
图9 CUS-SeP-C 的红外光谱图Fig.9 Infrared spectrogram of CUS-SeP-C
1027.24透光率(%)
微波消解光度法测定奶粉中的磷
李巧玲1,陈则华1,2
(1.河北科技大学生物科学与工程学院,河北 石家庄 050018;2.华南理工大学轻工与食品学院,广东 广州 510640)
摘 要:样品预处理在分析测定过程中具有十分重要的作用。本研究探讨了一种新兴的样品预处理方法——微波消解法在奶粉分析中的应用。考察了微波消解时溶剂的用量、消解液体积、消解时间、功率和压力对消解效果的影响,选择了微波消解的最佳工作参数。与传统方法相比,该方法具有省时、省酸,操作简单,减少沾污,改善工作环境等优点,是一种有效的实用方法。
关键词:微波消解;奶粉;磷
Application of Microwave Digestion for Photometric Determination of Phosphorus in Milk Power Sample
LI Qiao-ling1,CHEN Ze-hua1,2
(1.College of Biology Science and Engineering, Hebei University of Science and Technology, Shijiazhuang 050018, China;
2.College of Light Industry and Food Sciences, South China University of Technology, Guangzhou 510640, China)
Abstract :The pretreatment of the sample plays very important role in analyzing and determining trace elements. This paperreported that in the photometric determination of phosphorus in milk power, sample is improved with microwave digestiontechnique. The parameters such as reagent proportion, solution volume, time, pressure, microwave digestion power are optimized.Compared with the traditional dissolution method, the microwave digestion technique has the predominant features of less acidused and less time needed. In addition, environmental contamination is remarkably reduced.
Key words:microwave digestion;milk powder;phosphorus
中图分类号:O652.4 文献标识码:A 文章编号:1002-6630(2007)06-0302-04
收稿日期:2005-12-09
作者简介:李巧玲(1973-),女,副教授,博士,研究方向为食品安全与检测。
24(3): 155-157.
[2]黄峙, 郑文杰, 郭宝江. 含硒生物大分子化和物研究进展[J]. 海南大学学报: 自然科学版, 2001, 19(2): 169-175.
[3]陈春英, 丁玉强, ELMAHADI E A, 等. 箬叶多糖的分离纯化及其理化性质的研究[J]. 中国生物化学与分子生物学报, 1998, 14(4): 422-431.[4]张驰, 刘信平, 周大寨, 等. 中国板党中硒多糖提取分离技术研究[J].食品科学, 2006, 21(7): 314-318.
[5]陈国静, 焦志勤, 姚月梅. 香菇硒多糖抗氧化作用的研究[J]. 中国医药导报, 2006, 3(17): 9-10.
[6]温磊, 尚德静, 王伟. 灵芝硒多糖的制备及其分离纯化[J]. 中国食用菌, 2005, 24(6): 44-46.
[7]孙元琳, 顾小红, 汤坚, 等. 当归水溶性多糖的分离、纯化及结构初步分析[J]. 食品与生物技术学报, 2006, 25(1): 1-4.
[8]张德华. 夏枯草多糖的提取、分离与纯化技术研究[J]. 生物学杂志,
2006, 23(3): 39-41.
[9]张威, 王敏, 朱劲华, 等. 硒化紫球藻胞外多糖组成与结构的初步分析[J]. 天然产物研究与开发, 2006, 18(6): 964-967.
[10]方旭波, 江波, 王晓岚. 白骨壤酸性多糖的分离纯化及抗补体活性研究[J]. 林产化学与工业, 2006, 26(4): 100-104.
[11]KACURAKOVA M, CAPEK P, SASINKOVA V, et al. FT-IR study ofplant cell wall model compounds: pectic polysaccharides and hemicel-luloses[J]. Carbohydrate Polymer, 2000, 43: 195-203.
[12]COIMBRAMA, BARROSA, BARROSM, et al. Multivariate analysisof uronic acid and neutral sugars in whole pectic samples by FT-IRspectroscopy[J]. Carbohydrate Polymer, 1998, 37: 241-248.
[13]GNANASAMBANDAM R, PROCTOR A. Determination of pectindegree of esterification by diffuse reflectance Fourier transform infraredspectroscopy[J]. Food Chemistry, 2000, 68: 327-332.
奶粉是一种老幼皆宜的食品。随着人民生活水平的提高,奶粉的消费量越来越大,人们对其营养成分的要求也越来越高,并且对其中微量元素的含量也提出了新的要求。因此,奶粉中微量元素的测定显得越来越重要。但是在测定过程中,测量误差往往来源于前处理过程——样品的消化。传统上样品的消化有湿法消化和干法消化[1],这两种方法共同的缺点是耗时长,耗费的劳动力大,容易造成样品沾污和损失。而微波消
药用植物硒多糖的研究进展
药用植物硒多糖的研究进展 药用植物硒多糖的研究进展本文关键词:多糖,研究进展,药用植物 药用植物硒多糖的研究进展本文简介:摘要:硒多糖是一种通过多糖与硒的结合且具备硒和多糖两者活性的有机硒化合物。硒多糖的生物活性普遍高于硒和多糖,且更易于被机体吸收和利用,因此硒多糖在免疫调节、抗肿瘤、抗氧化、抗衰老等方面具有广泛的应用。由于硒多糖独特的药理活性,药用植物硒多糖也因此逐渐成为研究热点。但是目前已发现的硒多糖种类较少,同时 药用植物硒多糖的研究进展本文内容: 摘要:硒多糖是一种通过多糖与硒的结合且具备硒和多糖两者活性的有机硒化合物。硒多糖的生物活性普遍高于硒和多糖,且更易于被机体吸收和利用,因此硒多糖在免疫调节、抗肿瘤、抗氧化、抗衰老等方面具有广泛的应用。由于硒多糖独特的药理活性,药用植物硒多糖也因此逐渐成为研究热点。但是目前已发现的硒多糖种类较少,
同时其多糖的结构十分复杂,对硒多糖化学结构以及体内作用机制尚不完全清楚,仍有待进一步的研究。该文系统的介绍了药用植物硒多糖的主要来源,以及已发现的药用植物硒多糖的主要结构及其生理活性,旨在为硒多糖的进一步研究和应用提供理论依据。 关键词:硒多糖;药用植物;生理活性;抗氧化;抗肿瘤; 药用植物是指含有防治疾病的特殊化学成分(生物活性化合物)且具有一定医疗用途的植物[1].多糖为药用植物的主要活性成分之一,它可以通过与硒的结合形成同时具备硒和多糖两者活性的有机硒化合物--硒多糖。硒多糖在抗氧化、抗肿瘤、提高机体免疫力、降血糖血脂、抗重金属、抗菌等方面具有广泛的应用,但其化学结构具有复杂性、来源具有多样性,因此药用植物硒多糖成为了研究热点和难点。本文将从药用植物多糖的来源、纯化分离、结构及其生理活性等方面进行综述,旨在为硒多糖的进一步开发和利用提供参考依据。 1药用植物多糖研究 药用植物中有效化学成分十分复杂,主要有生物碱、苷类、多糖、氨基酸、蛋白质和油脂等。它们各具有特殊的生理功能,其中很多是临床上的重要药物。随着分子生物学的发展,科学界逐渐认识到多糖、蛋白质和多核苷酸是极为重要的生物大分子,在生物体生长发育中起
植物多糖分离纯化
食品分离技术作业 姓名_______________ 院系_______________ 专业班级_______________ 学号_______________ 时间___年___月___日
摘要 本文简要地介绍了植物多糖提取的两种方法:溶液提取法和部分沉淀法,对于影响多糖提取的不同因子选取不同方法;从多个方面介绍了多糖提取后的分离、纯化方法,及其分离纯化原理和主要步骤,并在最后对分离方法的可行性做出评价。 关键词:植物多糖分离纯化溶剂提取法部分沉淀法 植物多糖的分离纯化 一、多糖的物化性质 A.分子结构:多糖在溶液状态下有着高级结构,代表活性状态。不同植物提取的多糖, 一级结构上有很太差异,采用酸解、色谱、质谱、红外光谱、核磁共振等手段,可以确定单糖的组成及取代基团。 B.溶解性:难溶于冷水,在热水或碱液中可溶。不溶于丙酮、乙醇、正丁酵、乙醚、醋 酸乙酯等有机溶剂 C.热稳定性:热不稳定,当温度大于4O℃时,分解加快。 D.酸碱稳定性:pH小于5时开始降解,小于3时有20%降解;大于7时氧化加快。 E.化学性质:与硫酸蒽酮、硫酸苯酚反应阳性,常用于定量分析;可与部分有机、无机 离子络合,如与十六烷基三溴化铵(CTAB)、氢氧化钡等结合沉淀 F. 二、植物多糖的提取 多糖不同的植物中,有着不同的含量和贮存位置,因此针对不同的植物有着不同的分离方法。 图1:不同植物中多糖的提取方法
A.溶剂提取法 a)水提法 水对植物组织的穿透力强,提取效率高,在生产上使用安全、经济。用水作溶剂来提取多糖时,可以用热水浸煮提取,也可以用冷水浸提。一般植物多糖提取采用热水浸提法,该法所得多糖提取液可直接或离心除去小溶物;或者利用多糖不溶于高浓度乙醇的性质,沉淀提纯多糖;但由于不同性质或不同相对分子质量的多糖沉淀所需乙醇浓度不同,它也可以用于样品中不同多糖组分的分级分离;还可按多糖不同性质在粗分阶段利用混合溶剂提取法对植物中不同的多糖进行分离;其中,以乙醇沉淀最为普遍。但以根茎为主的植物体,细胞壁多糖含量高,热水直接提取率不高。此时为破坏细胞壁,增加多糖的溶出,有两种处理方法:一为酶解,二为弱碱溶解。 图2:加水比对多糖提取的影响[1] b)酸碱提法[2] 有些多糖适合用稀酸提取,并且能得到更高的提取率。但酸提法只在一些特定的植物多糖提取中占有优势,目前报道的并不多。而且即使有优势,在操作上还应严格控制酸度,因为酸性条件下可能引起多糖中糖苷键的断裂。 有些多糖在碱液中有更高的提取率,尤其是提取含有糖醛酸的多糖及酸性多糖。采用的稀碱多位为0.1mol/L氢氧化钠、氢氧化钾,为防止多糖降解,常通以氮气或加入硼氢化钠或硼氢化钾。同样,碱提优势也是因多糖类的不同而异。与酸提类似,碱提中碱的浓度也应得到有效控制,因为有些多糖在碱性较强时会水解。另外,稀酸、稀碱提取液应迅速中和或迅速透析,浓缩与醇析而获得多糖沉淀。 图3:热碱提取多糖结果[3] c)生物酶提取法[4] 酶技术是近年来广泛应用到有效成份提取中的一项生物技术,在多糖的提取过程中,使用酶可降低提取条件,在比较温和的条件中分解植物组织,加速多糖的释放或提取。此外,使用酶还可分解提取液中淀粉、果胶、蛋白质等的产物,常用的酶有蛋白酶,纤维素酶,果胶酶等。 B.部分沉淀法 a)金属盐沉淀法
多糖的分离纯化及生理作用
多糖的分离纯化及生理作用 多糖包括植物多糖、动物多糖和微生物多糖。人们已发现多糖不仅是机体的能量来源和骨架成分,而月还具有多糖具有抗感染、抗放射、抗凝血、降血糖、降血脂、促进核酸与蛋白质的生物合成作用等多种生物活性。 多糖的提取和纯化 1. 多糖的提取 1.1 热水浸提法:其步骤为:原料→粉碎→脱脂→粗提(2-3次)→吸滤或离心→沉淀→洗涤→干燥 首先除去表面脂肪。原料经粉碎后加入甲醇、乙醚、乙醇、丙酮或1:1的乙醇乙醚混合液,水浴加热搅拌或回流1-3小时,脱脂后过滤得到的残渣一般用水作溶剂(也有用氢氧化钾碱性水液、氯化钠水液、1%醋酸和1%苯酚或0.1-1M氢氧化钠作为提取溶剂)提取多糖。温度控制在90-100℃,搅拌4-6小时,反复提取2-3次。得到的多糖提取液大多较粘稠,可进行吸滤。也可用离心法将不溶性杂质除去,将滤液或上清液混合(得到的多糖若为碱性则需要中和)。然后浓缩,再加入2-5倍低级醇(甲醇或乙醇)沉淀多糖;也可加入费林氏溶液或硫酸铵或溴化十六烷基三甲基铵等,与多糖物质结合生成不溶性络合物或盐类沉淀。然后依次用乙醇、丙酮和乙醚洗涤。将洗干后疏松的多糖迅速转入装有五氧化二磷和氢氧化钠的真空干燥器中减压干燥(若沉淀的多糖为胶状或具粘着性时,可直接冷冻干燥),干燥后可得粉末状的粗多糖。 1.2 微波辅助提取法: 其原理为利用不同极性的介质对微波能的不同吸收程度,使基体物质中的某些区域和萃取体系中的某些组分被选择性加热,从而使萃取物质从基体或体系中分离出来,进入到介电常数小,微波吸收能力较差的萃取剂中。由于微波能极大加速细胞壁的破裂,因而应用于中草药中有效成分的提取能极大加快提取速度,增加提取产率。而且由于其选择性好,提取后基体能保持良好的性状,提取液也较一般的提取方法澄清。聂金源等在柴胡多糖和黄酮化合物的提取[18]中对微波辅助提取法、超声辅助法和索氏提取法进行比较,发现微波辅助提取法所需时间最短(10min),多糖的提取率最高(28.46%)。 1.3 超声辅助法: 其原理是利用超声波的空化作用加速植物有效成分的浸出提取,另外超声波的次级效应,如机械振动、乳化、扩散、击碎、化学效应等也能加速欲提取成分的扩散释放并充分与溶剂混合,利于提取[16]。超声波辅助法与常规提取法相比,具有提取时间短、产率高、无需加热等优点[17]。 1.4 索氏提取法: 将植物粉末置于索氏提取器中,加入石油醚,60℃-90℃条件下提取至无色(一般为6小时)。过滤,滤渣挥发干燥完溶媒后加入80%乙醇,再提取6小时,过滤,滤渣乙醇挥发干燥后加蒸馏水。回流提取2次,趁热过滤,滤液减压浓缩,再除蛋白,醇沉,除色素。60℃干燥,称重。 1.5 醇提法: 先后将90%和50%乙醇加入植物粉末中,振荡充分再抽滤。滤液中加入足量无水乙醇,至于4℃冰箱中过夜。减压抽滤,再除去色素,得多糖粗品,在60℃通风干燥箱中干燥,再置干燥皿中恒重保存。 醇提法方法简单,易于操作,但提取率较低,乙醇使用量大,不宜大规模提取使用。 2.多糖的纯化方法纯化是将多糖混合物分离为单一多糖的过程,纯化的方法主要有以下几种: 2.1 分部沉淀法根据各种多糖在不同浓度的低级醇或丙酮中具有不同溶解度的性质,逐次按比例由小到大加入甲醇或乙醇或丙酮,收集不同浓度下析出的沉淀,经反复溶解与沉淀后,直到测得的物理常数恒定(最常用的是比旋光度测定或电泳检查)。这种方法适合于分离各种溶解度相差较大的多糖。为
多糖分离纯化的基本原则和方法
多糖分离纯化的基本原则和方法 多聚糖(polysaccharide),简称多糖,常由一百个以上甚至几千个单糖基通过糖苷键连接而成的,其性质已大不同于单糖,如甜味和强的还原性已经消失,广泛存在于动物细胞膜和植物、微生物的细胞壁中,是构成生命的四大基本物质之一,与生命功能的维持密切相关。近年来,大量研究表明多糖除了有增强免疫功能、抗肿瘤作用、抗氧化、抗衰老、消化系统保护作用的生物学效应外,还有抗菌、抗病毒、降血糖、降血脂、抗辐射、抗凝血等作用。 1、基本原则 在不破坏多糖活性的前提下进行多糖的分离纯化。尽量不引入新的杂质,或引入的新杂志易于除去,如小分子盐类可经过透析作用除去,铵根离子可通过加热挥发除去等[1]。 2、分离纯化方法 多糖的生物活性倍受关注,但不少多糖的提取方法和工艺尚未成熟,基于效率、成本多方面的考虑,各种方法的开发、比较、分析是研究工作的焦点之一。目前多糖提取方法主要有溶剂提取法、酸提法、碱提法、酶解法、超滤法、超声法、微波法、超临界流体萃取法。首先要根据多糖的存在形式及提取部位不同,决定在提取之前是否做预处理:提取时需注意对一些含脂较高的根、茎、叶、花、果及种子类,在用水提取前,应先加入甲醇或l:l的乙醇乙醚混合溶液或石油醚进行脱脂,而对含色素较高的根、茎、叶、果实类,需进行脱色处理。 2.1多糖的提取与分离方法 由于各类多糖的性质及来源不同,所以提取方法也各有所异,主要归纳为以下几类: 第一类难溶于水,可溶于稀碱液的主要是胶类,如木聚糖及半乳糖等。原料粉碎后用0.5mol/L NaOH水溶液提取,提取液经中和及浓缩等步骤,最后加入乙醇,即得粗糖沉淀物。 第二类易溶于温水,难溶于冷水的多糖,可用70~80℃热水提取,提取液用氯仿:正丁醇(4:1)混合除去蛋白质,经透析、浓缩后再加入乙醇即得粗多糖产物[2]。 第三类粘多糖的提取。在组织中,粘多糖与蛋白质以共价键结合,故提取
枸杞多糖分离纯化及性质研究
第25卷 第3期 2008年6月 黑龙江大学自然科学学报JOURNAL OF NAT URAL SC I E NCE OF HE I L ONGJ I A NG UN I V ERSI TY Vol 125No 13 June,2008 枸杞多糖分离纯化及性质研究 张 晶1,2, 韩喜江1, 李艳波2 (1.哈尔滨工业大学化学系,哈尔滨150001;2.哈尔滨学院生化学院,哈尔滨150080) 摘 要:对东北枸杞中提取的多糖,通过DEAE -cellul ose (OH -)色谱柱和Sephadex G -100 凝胶色谱柱进行了分离纯化,通过凝胶色谱和液相色谱对其纯度进行了鉴定,并通过红外光谱初步分析了其基团构成。 关键词:枸杞多糖;分离纯化;纯度鉴定 中图分类号:R28412,TS244文献标志码:A 文章编号:1001-7011(2008)03-0377-04 收稿日期:2008-01-16 作者简介:张 晶(1973-),女,实验师,硕士,主要研究方向:应用化学、食品化学 0 引 言 枸杞是一种食药两用植物,具有多种药理作用和生理功能。枸杞多糖是枸杞中的主要活性成分之一,其中有关枸杞多糖的化学、药理与临床研究十分瞩目,已有不少研究报道枸杞多糖具有增强免疫力、抗癌、防衰 老、抗疲劳、降血压、降血糖、抑制肿瘤生长和细胞突变等作用[1-2]。鉴于枸杞多糖具有多种药理作用和生理 功能,因此,对其提取分离方法及纯化的研究显得尤为重要[3]。本文重点对牡丹江地区枸杞多糖的分离纯 化及组成结构作了初步探讨。 1 实验材料和方法 111 材料与仪器 牡丹江地区枸杞子;其它试剂均为分析纯。自动部分收集器,台式干燥箱,紫外分光光度计,Perkin -El 2mer 红外光谱仪,Aglilent 1100液相色谱仪等。 112 枸杞多糖提取 称取100g 枸杞子60℃烘干,放置干燥器18h 后粉碎,称取10g 干燥的枸杞粉,用氯仿-甲醇(2∶1)300mL,用索氏回流装置于60℃回流脱脂。残渣风干后,加入适量水,在100℃,料水比1∶15条件下水浴提取4h,抽滤,将滤液蒸发浓缩为原体积的1/4后,将浓缩液滴入3倍体积的95%乙醇中,静置,抽滤,固形物 分别用95%乙醇、无水乙醇、丙酮洗涤,水浴加热干燥得枸杞粗多糖[4]。 113 枸杞多糖分离纯化 11311 DEAE -cellul ose (OH -)色谱柱层析 将分离提取的枸杞粗多糖110g 溶于水,上DEAE -cellul ose (OH -)色谱柱,梯度洗脱法洗脱各级分,洗 脱液分别为蒸馏水、011mo1?L -1,0125mol ?L -1和015mol ?L -1NaCl,011mol ?L -1Na OH 各100mL,流 速为30滴每分钟,自动部分收集器收集洗脱液,将收集到的样品溶液分别在280nm 波长下比色,然后用硫 酸一蒽酮法测定总糖含量。以试管数目为横坐标,以吸光度为纵坐标作DE AE -cellul ose (OH -)色谱柱洗脱 曲线图。分别合并各主峰溶液,浓缩,流水透析,冷冻干燥,得LBP -1,LBP -2,LBP -3和LBP -4.11312 Sephadex G -100凝胶色谱柱。 收集多糖含量最多的组分,进行凝胶色谱分离。流速为013mL ?m in -1,每支试管接收3mL 洗脱液,硫 酸一蒽酮法检测多糖洗脱状况。以洗脱管数为横坐标,吸光值为纵坐标作流出曲线,合并主峰溶液,浓缩,流水透析,冷冻干燥。
多糖的提取和纯化
多糖的提取和纯化目前,真菌多糖的提取可从子实体和采用深层培养发酵液的菌丝中分离获得,但以从子实体中提取多糖为主。首先是将子实体粉碎,加入甲醇或乙醇乙醚1:1混合液,水浴加热搅拌1一3小时除去表面脂肪。其次是用残渣提取多糖,常用的方法有不同温度下的水提法、稀酸提法、冷热稀碱提法。水提法采用的较多,适合于提取水溶性多糖。稀酸提取法适用于提取酸溶性多糖、时间宜短,温度不超过50℃,以防止糖昔键断裂。稀碱法适合于提取碱溶性糖。然后除去小分子杂质,常采用透析法,将多糖提取液置于半透膜透析袋中,逆向流水透析1一3天。第四步是沉淀多糖。大部分多糖在有机溶剂中的溶解度极小,所以可用有机溶剂来沉淀。常用4一5倍低级醇、丙酮,一般在pH=7.0左右沉淀多糖,制得粗多糖。最后是除去蛋白质。除去多糖中的蛋白质常用的方法是三氯醋酸法。得到的溶液基本上是没有蛋白质与小分子杂质的多糖混合物或单一多糖。 多糖的纯化是将多糖混合物分离为单一的多糖。纯化方法很多,主要纯化方法有:(l)分步沉淀法根据不同多糖在不同浓度的低级醇或酮中具有不同溶解度的性质,逐次按比例由小而大加入这些醇或酮分步沉淀。此法适用于分离各种溶解度相差较大的多糖。(2)盐析法根据不同多糖在不同浓度盐中具有不同溶解度而分离。 纯度鉴定和分子量测定多糖纯度标准不能用通常化合物纯度标准来衡量,因为我们所说的多糖纯品实质上是一定分子量范围内的均一组成。因此,测得的分子量一般为平均分子量。过去常用粘度法、蒸气压渗透计法、沉降法、超速离心法、光散射法等测定高分子化合物分子量的方法测定真菌多糖的分子量,但由于这些方法测定起来比较麻烦,且误差较大,现多数已不采用。目前实验室常用的方法为凝胶过滤法和高压液相色谱法,对于分子量小于1百万的多糖用高压液相法为最好。 1.2.1发酵、提取 取香菇465菌株斜面菌种接人摇瓶培养基中振荡培养,逐级扩大培养至10O0L,25℃下通 气培养72h,压滤,得香菇深层培养菌丝体。 上述菌丝体经水洗涤后,用3倍量热水(90一100℃)浸取3h,浸取液经浓缩加3倍量95肠乙 醇,离心得乙醇沉淀物一Le[‘’。 1.2。2分离、纯化 取Le上样于DEAE一纤维素柱上,用O。Olmol/L pH 6.95 Tris-HCI缓冲液洗脱,洗脱液分 部收集,分别用UV(280nm)和酚硫酸法测定其吸收值(A值),合并吸收峰重叠的洗脱液,经浓 缩、透析、冻干得淡黄色絮状物Le一2· Le一2进一步用DEAE一纤维素(DE52型)分离,先用pH7.8的0.oosmol/L硼酸缓冲液洗脱, 后用含lmol/L NaCI的o.Zmol/L硼酸缓冲液洗脱.各洗脱液按上法用UV230nm和酚硫酸法 检测,分别收集既含肤又含糖的洗脱液.用o.005mol/L硼酸缓冲液洗脱的组分为Le一2一1,用含 lmol/L NaCI的硼酸缓冲液洗脱的组分称Le一2一2o 1.2.3鉴定 1.2.3.1纯度 (l)HPLC法将样品配成1%浓度后进样.进样量20召L。流动相:0.002mol/L NaAc;
多糖的分离纯化
多糖的提取和纯化 多糖的提取和纯化 摘要本文较详细地介绍了多糖的提取和纯化方法,为多糖的研究和生产提供参考依据。 关键词多糖;提取;纯化;活性炭 多糖(polysacharides,PS),又称多聚糖,是由10个以上的单糖通过苷键连接而成的,具有广泛生物活性的天然大分子化合物。它广泛分布于自然界高等植物、藻类、微生物(细菌和真菌)与动物体内。20世纪60年代以来,人们逐渐发现多糖具有复杂的、多方面的生物活性和功能[1]:(1)多糖可作为广谱免疫促进剂,具有免疫调节功能,能治疗风湿病、慢性病毒性肝炎、癌症等免疫系统疾病,甚至能抗AIDS病毒[2]。如甘草多糖具有明显的抗病毒和抗肿瘤作用[10],黑木耳多糖、银杏外种皮多糖和芦荟多糖可抗肿瘤和增强人体免疫功能[3-5]。 (2)多糖具有抗感染、抗放射、抗凝血、降血糖、降血脂、促进核酸与蛋白质的生物合成作用。如柴胡多糖具有抗辐射,增强免疫功能等生物学作用[6],麦冬多糖具有降血糖及免疫增强作用[7-8],动物黏多糖具有抗凝血、降血脂等功能[9]。(3)多糖能控制细胞分裂和分化,调节细胞的生长与衰老。如爬山虎多糖具有抗病毒和抗衰老作用[10],银杏外种皮粗多糖具有抗衰老、抗过敏、降血脂、止咳祛痰、减肥等功能[11]。 另外,多糖作为药物,其毒性极小,因而多糖的研究已引起人们极大的兴趣。由于多糖具有的生物活性与其结构紧密相关,而多糖的结构又是相当复杂的,所以在这一领域的研究相对缓慢。但人们在多糖的分离提取与纯化方面已做出了不少工作。 1. 多糖的提取[12] 1.1 热水浸提法: 1.1.1多糖提取条件的优选 根据文献报道[13]:影响热水浸提多糖的因素主要有提取时间、提取次数、溶剂体积、浸提温度、pH值、醇析浓度和植物颗粒大小等。在试验前对上述多种因素利用正交实验法做出优选,才能选出最佳提取方案。 1.1.2其步骤为:原料→粉碎→脱脂→粗提(2-3次)→吸滤或离心→沉淀→洗涤→干燥 首先除去表面脂肪。原料经粉碎后加入甲醇、乙醚、乙醇、丙酮或1:1的乙醇乙醚混合液,水浴加热搅拌或回流1-3小时,脱脂后过滤得到的残渣一般用水作溶剂(也有用氢氧化钾碱性水液、氯化钠水液、1%醋酸和1%苯酚或0.1-1M 氢氧化钠作为提取溶剂)提取多糖。温度控制在90-100℃,搅拌4-6小时,反复提取2-3次。得到的多糖提取液大多较粘稠,可进行吸滤。也可用离心法
多糖的提取分离方法
生物活性多糖主要有真菌多糖、植物多糖、动物多糖大类. 多糖地提取首先要根据多糖地存在形式及提取部位,决定在提取之前是否做预处理. 动物多糖和微生物多糖多有脂质包围,一般需要先加入丙酮、乙醚、乙醇或乙醇乙醚地混合液进行回流脱脂,释放多糖. 植物多糖提取时需注意一些含脂较高地根、茎、叶、花、果及种子类,在提取前,应先用低极性地有机溶剂对原料进行脱脂预处理,目前多糖地提取方法主要有溶剂提取法、生物提取法、强化提取法等. .溶剂法 ..水提醇沉法 水提醇沉法是提取多糖最常用地一种方法. 多糖是极性大分子化合物,提取时应选择 水、醇等极性强地溶剂. 用水作溶剂来提取多糖时,可以用热水浸煮提取,也可以用冷水浸提渗滤,然后将提取液浓缩后,在浓缩液中加乙醇,使其最终体积分数达到左右,利用多糖不溶于乙醇地性质,使多糖从提取液中沉淀出来,室温静置,多糖地质量分数和得率均较高. 影响多糖提取率地因素有:水地用量、提取温度、浸提固液比、提取时间以及提取次数等. 文档收集自网络,仅用于个人学习 水提醇沉法提取多糖不需特殊设备,生产工艺成本低,安全,适合工业化大生产,是一种可取地提取方法.但由于水地极性大,容易把蛋白质、苷类等水溶性地成分浸提出来,从而使提取液存放时腐败变质,为后续地分离带来困难,且该法提取比较耗时,提取率也不高.文档收集自网络,仅用于个人学习 ..酸提法 为了提高多糖地提取率,在水提醇沉法地基础上发展了酸提取法. 如某些含葡萄糖醛酸等酸性基团地多糖在较低值下难以溶解,可用乙酸或盐酸使提取液成酸性,再加乙醇使多糖沉淀析出,也可加入铜盐等生成不溶性络合物或盐类沉淀而析出.文档收集自网络,仅用于个人学习 由于+地存在抑制了酸性杂质地溶出,稀酸提取法提取得到地多糖产品纯度相对较高,但在酸性条件下可能引起多糖中糖苷键地断裂,且酸会对容器造成腐蚀,除弱酸外,一般不宜采用. 因此酸提法也存在一定地不足之处.文档收集自网络,仅用于个人学习 ..碱提法 多糖在碱性溶液中稳定,碱有利于酸性多糖地浸出,可提高多糖地收率,缩短提取时间,但提取液中含有其它杂质,使粘度过大,过滤困难,且浸提液有较浓地碱味,溶液颜色呈黄色,这样会影响成品地风味和色泽.文档收集自网络,仅用于个人学习 ..超临界流体萃取法 超临界流体萃取技术是近年来发展起来地一种新地提取分离技术. 超临界流 体是指物质处于临界温度和临界压力以上时地状态,这种流体兼有液体和气体地特点,密度大,粘稠度小,有极高地溶解,渗透到提取材料地基质中,发挥非常有效地萃取功能. 而且这种溶解能力随着压力地升高而增大,提取结束后,再通过减压将其释放出来,具有保持有效成分地活性和无溶剂残留等优点. 由于地超临界条件(=.℃,=.)容易达到,常用于超临界萃取地溶剂,在压力为~时地超临界足以溶解任何非极性、中极性化合物,在加入改性剂后则可溶解极性化物.文档收集自网络,仅用于个人学习 该法地缺点是设备复杂,运行成本高,提取范围有限. .酶解法 ..单一酶解法 单一酶解法指地是使用一种酶来提取多糖,从而提高提取率地生物技术. 其中经常使 用地酶有蛋白酶、纤维素酶等. 蛋白酶对植物细胞中游离地蛋白质具有分解作用,使其结构变得松散;蛋白酶还会使糖蛋白和蛋白聚糖中游离地蛋白质水解,降低它们对原料地结合力,
多糖的分离纯化
1.2.2 离子交换层析鹿茸多糖初级分离纯化采用DEAE-52 离子交换柱。称取鹿茸多糖80mg,溶于10mL 蒸馏水中,4000r /min 离心10min,取上清液样,依次用蒸馏水,0.3、0.5、0.7、1mol /L NaCl 溶液梯度洗脱,流速控制为0.5mL /min,分管收集,每管5mL,苯酚硫酸法跟踪检测多糖含量,绘制洗脱曲线,合并同一吸收峰的洗脱液,蒸馏水透析24h,减压浓缩,冷冻干燥,即得DEAE-52 纯化多糖。 1.2.3 凝胶排阻层析鹿茸多糖进一步分离纯化采用Sepharose CL-6B 凝胶排阻层析柱。将经DEAE-52 分离后的多糖溶于蒸馏水,浓度为10mg /mL,以2mL /次上样,蒸馏水洗脱,流速控制为30mL /h,每管5mL,苯酚硫酸法跟踪检测,绘制洗脱曲线,收集、合并相同洗脱组分,透析,冷冻干燥即得SepharoseCL-6B纯化多糖。 1.2.4 鹿茸多糖紫外扫描将Sepharose CL-6B 纯化后精制多糖配 成一定浓度溶液,190~400nm 下进行紫外光谱扫描,以蒸馏水作空白。 2.2.4粗多糖的分离纯化 2.2.4.1粗多糖的离子柱层析 取水提粗多糖样品和碱提水溶性多糖样品溶于蒸馏水中,配制成20mg/mL的溶液,4000印m离心10min,取上清液用DEAE一SepharoseFastFlow离子柱层析(2.6-40cm)进行初步分离,上样量为25mL"首先以蒸馏水洗脱,再用0.1,0.2,0.4,0.6,2mol几的NaCI进行梯度洗脱,自动部分收集仪分步收集流分,洗脱液每10mL收集一管,苯酚硫酸法检测,根据糖显色反应结果合并相同流分"
多糖的分离纯化及分析
多糖的分离纯化及分析 一、多糖的提取方法 (一)溶剂提取法 1、水提法 水提醇沉法是提取多糖最常用的一种方法.多糖是极性大分子化合物,提取时应选择水、醇等极性强的溶剂.用水作溶剂来提取多糖时,可以用热水浸煮提取,也可以用冷水浸提渗滤,然后将提取液浓缩后,在浓缩液中加乙醇,使其最终体积分数达到70%左右,利用多糖不溶于乙醇的性质,使多糖从提取液中沉淀出来,室温静置5h,多糖的质量分数和得率均较高. 2、酸碱提法 有些多糖适合用稀酸提取,并且能得到更高的提取率。有些多糖在碱液中有更高的提取率,尤其是提取含有糖醛酸的多糖及酸性多糖。与酸提类似,碱提中碱的浓度也应得到有效控制,因为有些多糖在碱性较强时会水解。 3、超临界流体萃取法 超临界流体萃取技术是近年来发展起来的一种新的提取分离技术. (二)生物酶提取法 酶技术是近年来广泛应用到有效成份提取中的一项生物技术,在多糖的提取过程中,使用酶可降低提取条件,在比较温和的条件中分解植物组织,加速多糖的释放或提取。此外,使用酶还可分解提取液中淀粉、果胶、蛋白质等的产物,常用的酶有蛋白酶,纤维素酶,果胶酶等。 (三)超声提取法 超声波是一种高频率的机械波,其主要原理是利用超声波产生的“空化作用”对细胞膜的破坏,有利用植物有效成分的释放,而且超声波能形成强大的冲击波或高速射流,有效地减小、消除与水相之间的阻滞层,加大了传质效率,有助于溶质的扩散。超声波提取与传统的提取方法相比,有提取效率高、时间短、耗能低等优点。 (四)微波提取 微波是频率介于300MHz和300GHz之间的非电离电磁波,微波提取的原理是微射线辐射于溶剂并透过细胞壁到达细胞内部,由于溶剂及细胞液吸收微波能细胞内部温度升高,压力增大,当压力超过细胞壁的承受能力时,细胞壁破裂,位于细胞内部的有效成份从细胞中释放出来,传递转移到溶剂周围被溶剂溶解。 二、多糖的分离纯化 (一)多糖的分离 采用一般方法提取的多糖通常是多糖的混合物,分级的方法可达到纯化的目的.可按溶解性不同进行分级、按分子大小和形状分级(如分级沉淀、超滤、分子筛、层析等),也可按分子所带基团的性质分级. 1、按溶解性不同分离 (1)分步沉淀法 分步沉淀法是根据不同多糖在不同浓度低级醇、酮中具有不同溶解度的性质,从小到大按比例加入甲醇或乙醇或丙酮进行分步沉淀. (2)盐析法 盐析法是根据不同多糖在不同盐浓度中溶解度不同而将其分离的一种方法。常用的盐析剂有氯化钠、氯化钾、硫酸铵等,其中以硫酸铵最佳。
多糖的提取和纯化
多糖的提取和纯化 多糖的提取和纯化多糖的提取和纯化摘要本文较 详细地介绍了多糖的提取和纯化方法,为多糖的研究和生产提供参考依据。关键词多糖;提取;纯化;活性炭多糖(polysacharides,PS),又称多聚糖,是由10个以上的单糖通过苷键连接而成的,具有广泛生物活性的天然大分子化合物。它广泛分布于自然界高等植物、藻类、微生物(细菌和真菌)与动物体内。20世纪60年代以来,人们逐渐发现多糖具有复杂的、多方面的生物活性和功能[1]:(1)多糖可作为广谱免疫促进剂,具有免疫调节功能,能治疗风湿病、慢性病毒性肝炎、癌症等免疫系统疾病,甚至能抗AIDS病毒[2]。如甘草多糖具有明显的抗病毒和抗肿瘤作用[10],黑木耳多糖、银杏外种皮多糖和芦荟多糖可抗肿瘤和增强人体免疫功能[3-5]。(2)多糖具有抗感染、抗放射、抗凝血、降血糖、降血脂、促进核酸与蛋白质的生物合成作用。如柴胡多糖具有抗辐射,增强免疫功能等生物学作用[6],麦冬多糖具有降血糖及免疫增强作用[7-8],动物黏多糖具有抗凝血、降血脂等功能[9]。(3)多糖能控制细胞分裂和分化,调节细胞的生长与衰老。如爬山虎多糖具有抗病毒和抗衰老作用[10],银杏外种皮粗多糖具有抗衰老、抗过敏、降血脂、止咳祛痰、减肥等功能[11]。另外,多糖作为药物,其毒性极小,因而多糖
的研究已引起人们极大的兴趣。由于多糖具有的生物活性与其结构紧密相关,而多糖的结构又是相当复杂的,所以在这一领域的研究相对缓慢。但人们在多糖的分离提取与纯化方面已做出了不少工作。1. 多糖的提取[12]1.1 热水浸提法:1.1.1多糖提取条件的优选根据文献报道[13]:影响热水浸提多糖的因素主要有提取时间、提取次数、溶剂体积、浸提温度、pH值、醇析浓度和植物颗粒大小等。在试验前对上述多种因素利用正交实验法做出优选,才能选出最佳提取方案。1.1.2其步骤为:原料→粉碎→脱脂→粗提(2-3次)→吸滤或离心→沉淀→洗涤→干燥首先除去表面脂肪。原料经粉碎后加入甲醇、乙醚、乙醇、丙酮或1:1的乙醇乙醚混合液,水浴加热搅拌或回流1-3小时,脱脂后过滤得到的残渣一般用水作溶剂(也有用氢氧化钾碱性水液、氯化钠水液、1%醋酸和1%苯酚或0.1-1M氢氧化钠作为提取溶剂)提取多糖。温度控制在90-100℃,搅拌4-6小时,反复提取2-3次。得到的多糖提取液大多较粘稠,可进行吸滤。也可用离心法将不溶性杂质除去,将滤液或上清液混合(得到的多糖若为碱性则需要中和)。然后浓缩,再加入2 -5倍低级醇(甲醇或乙醇)沉淀多糖;也可加入费林氏溶液或硫酸铵或溴化十六烷基三甲基铵等,与多糖物质结合生成不溶性络合物或盐类沉淀。然后依次用乙醇、丙酮和乙醚洗涤。将洗干后疏松的多糖迅速转入装有五氧化二磷和氢氧
多糖的分离和纯化
一、多糖的分离和纯化 多糖是极性极大的大分子化合物,提取时一般先将原料脱脂、脱色,然后用水、盐或稀碱水在不同温度下提取。提取物浓缩后加沉淀剂(乙醇、丙酮等)离心沉淀,沉淀部分可反复多次离心沉淀,以除去部分水溶性色素等杂质。 1.除蛋白 用水或稀碱提取的多糖常含有蛋白质,常用的除蛋白质的方法有Sevag 法、三氟三氯乙烷法、三氯乙酸法等。前两种多用于微生物多糖,后者多用于植物多糖。 Sevag 法是经典的除蛋白质方法,复杂、费时,且样品损失较大。冯建林等比较了Sevag 法、三氟三氯乙烷法、三氯乙酸法、硫酸铵法及木瓜蛋白酶复合酶法除蛋白的效果,从蛋白残留量和多糖的得率两方面评价.认为三氯乙酸法最好,但三氯乙酸仍不能完全除去蛋白,建议三氯乙酸法和Sevag 法结合使用。 2.脱色 多糖中常含有一些色素(游离色素或结合色素),根据其不同性质采取不同的去除方 法。常用的脱色方法有离子交换法、氧化法、金属络合物法、吸附法(纤维素、硅藻土、高岭土、活性炭等)。 D EA E一纤维素是目前最常用的脱色方法,通过离子交换柱不仅达到脱色目的,而且可以进行多糖的分离。 H2 O2:是一种氧化脱色剂,浓度不宜过高,宜在低温下进行,否则引起多糖的降解。 对于同时含有游离蛋白质和色素的多糖,可通过生成金属络合物的方法同时除去蛋白和色素,即加入费林试剂生成不溶性络合物,经分离后用阴离子交换树脂分解络合物。 吸附脱色法也常用,如通过活性炭、高岭土、硅藻土柱达到脱色的目的。 3.多糖的分级 采用一般方法提取的多糖,通常是多糖的混合物,即是多分散性的,其不均一性表现在化学组成、聚合度、分子形状等的不同。 分级可以达到纯化的目的,可按分子大小和形状分级(如分级沉淀、超滤、分子筛、层析等),也可按分子所带基团的性质分级(如按电荷性质分级的电泳、离子交换层析等)。(1)分级沉淀 利用分子大小和溶解度不同进行分离,常用的有两种方法,即有机溶剂沉淀法和季 铵盐或硫酸铵法。Ba(O H )2、Ca(O H )2等也常用于酸性多糖的分级。 (2)柱层析法 柱层析法较常用,也可分为两类。 一类是只有分子筛作用的一般凝胶柱层析,如Sephadex、Saphrose、Bio gel等; 一类是离子交换层析,这种分级不仅按电荷性质不同,同时也有分子筛作用,如带负电荷的多糖可在阴离子型的D EA E一纤维素柱或D EA E—Sephadex 柱上达到分级;酸性多糖可在阳离子型的羧甲基(CM —Sephades)或黄乙基(SE—Sephadex)等凝胶柱上分离。这种离子交换树脂常用水、不同浓度和种类的缓冲溶液或酸碱液洗脱得以分级。检测手段国内仍沿用经典的酚一硫酸法,国外用LKB 柱层析系统,用比旋度、视差折光及紫外检测器,各组分的峰位自动记录,分离效果好且方便。 (3)透析、超滤及超速离心 选用不同规格的超滤膜和透析袋进行超滤和透析以及一定条件下的超速离心操作,可按分子大小将多糖样品分级,超滤和透析更常用于除去小分子物质。 (4) 区带电泳 区带电泳主要按多糖的电荷性质不同分级,常用的有聚丙烯酰胺凝胶电泳、乙酸纤维素薄膜电泳。
多糖的提取分离及纯化研究
多糖的提取分离及纯化研究 李云梅 (黑龙江大庆市第四医院,黑龙江,大庆,163000) 摘要 对多糖的认识备受关注,常用的提取方法有:溶剂提取法、酸提取法、碱提取法、酶解法、超滤、超声波、微波、超临界流体萃取;分离纯化技术有:沉淀法、柱层析。本文对以上种实验方法做一简单介绍。 关键词 多糖;提取;分离;纯化 中图分类号 R282.6 文献标识码 B 文章编号 1007-8517(2009)14-0135-01 1多糖的提取 1.1溶剂提取法溶剂提取法[1]是从植物中提取多糖的常用方法。它利用多糖不溶于乙醇的性质在提取液中加乙醇、甲醇或丙酮使多糖从提取液中沉淀出来,达到初步纯化的目的。溶剂提取法一般遵循相似相溶原则。 1.2酸提法酸提法操作上应严格控制酸度,因为酸性较强条件下可能引起多糖中糖苷键断裂,,而且易对容器造成腐蚀,故除弱酸外,一般不宜采用,所以有关这方面的报道比较少,但有研究证明羊栖菜多糖[3],大豆多糖[4],香菇多糖[5]采用稀酸提取效果较佳.。用稀酸提取时时间宜短,温度最好不高于50 。 1.3碱提法有些多糖在碱液中有更高的提取率,尤其是提取含有糖醛酸的多糖,但不适合提取含硫酸基的酸性多糖。碱提过程中防止多糖降解,常通以氮气或加入硼氢化钠或硼氢化钾。同时,还应控制碱的浓度,因为有些多糖在碱性较强时会水解。 1.4酶解法酶是生物催化剂,能降低化学反应的活化能,加速反应,在多糖的提取过程中,利用酶促反应,降低体系中的活化能,使反应在较低能量水平上进行,在比较温和的条件中分解植物组织,加速多糖的释放或提取.常用的生物催化剂有蛋白酶、纤维素酶、果胶酶等. 1.5超滤法超滤是一种加压膜分离技术,即在一定的压力下,使小分子溶质和溶剂穿过一定孔径的特制的薄膜,而使大分子溶质不能透过,留在膜的一边,从而使大分子物质得到了部分的纯化。 1.6超声法超声提取又称超声波萃取、超声波辅助萃取,是一种物理破碎过程,其基本原理是利用超声波辐射产生的空化作用、机械作用及热学作用,其中最重要的是超声波空化作用,形成高温和高压的环境,增加物质分子运动的频率和速度、溶剂的穿透力,从而加速目标成分进入溶剂,提高提取率[2]。 1.7微波法微波提取法作为一种新型的萃取技术,是根据不同物质吸收微波能力的差异使得基体物质的某些区域或萃取体系中的某些组分被选择性加热,从而使得被萃取物质从基体或体系中分离,进入到介电常数较小、微波吸收能力相对差的萃取剂中,达到提取的目的。 1.8超临界流体萃取法超临界流体萃取法的技术就是利用超临界流体为溶剂,从固体或液体中萃取出某些有效组分,并进行分离的一种技术。 2多糖的分离纯化2.1除蛋白通过上述方法制得的多糖一般为粗多糖,含有较多的蛋白质,。需要除蛋白,除蛋白的方法通常有Sevage 法、三氯乙酸法、酶解法、三氟三氯乙烷法等。 2.1.1Sev age法Sevag e法是除蛋白的经典方法,主要是利用蛋白质在氯仿中变性的特点,用氯仿:正丁醇=5:1或4:1的二元溶剂体系按1:5加入到多糖提取液中,混合物经剧烈振摇后离心,蛋白质与氯仿-正丁醇生成凝胶物而分离,分去水层和溶剂层交界处的变性蛋白质。 2.1.2三氯乙酸法三氯乙酸法利用三氯乙酸,在低温下搅拌加入到多糖提取液中,直到溶液不再继续混浊为止离心弃沉淀,即可达到脱蛋白的目的。存在于溶液中的三氯乙酸经中和后,通过透析或超滤等方法除去。 2.1.3酶解法酶法提取是根据植物细胞壁的构成,利用酶反应所具有高度专一性的特点,选择相应的酶,将细胞壁的组成成分(纤维素、半纤维素和果胶质)水解或降解,破坏细胞壁结构,使细胞内的成分溶解、混悬或胶溶于溶剂中,从而达到提取目的,且有利于提高成分的提取率。 2.1.4三氟三氯乙烷法三氟三氯乙烷法将三氯乙烷按1: 1的比例加到多糖提取液中,在低温下搅拌约10m i n,离心得上层水层,水层继续用上述方法处理几次即得,此法效率较高,但因其易挥发,不宜大量应用。 2.2脱色在多糖提取过程中,由于氧化作用会有色素生成,色素的存在会影响多糖的色谱分析和性质测定。 2.3分离纯化 2.3.1沉淀法 2.3.1.1分部沉淀法利用不同分子量的多糖在不同浓度低级醇或低级酮中的溶解性不同的原理,逐步提高溶液中醇或酮中的浓度,使不同组分的多糖依分子量由大到小的顺序分级沉淀可达到纯化的目的。 2.3.1.2季胺盐沉淀法根据季胺盐能与酸性多糖形成不溶性化合物的性质,以分离酸性多糖。一般地说,酸性强或分子量大的多糖首先沉淀出来。2.3.1.3盐析法盐析法的机理是当溶液中有一定的离子浓度,醇析时多糖能完全沉淀出来。不同的多糖在不同浓度盐溶液中溶解度不同,常用的盐析剂N aC l、K C l和(NH 4 ) 2 SO 4 等,其中以(NH 4 ) 2 SO 4 效果最佳。 2.3.1.4超滤法一种用于分子分离的膜分离方法,利用不同孔径的超滤膜排阻不同分子量的多糖,达到分离。常用的有醋酸纤维素膜,聚砜酰胺膜等。该方法操作条件温和,不需要添加化学试剂,适用于热敏药物。 135 经验交流 中国民族民间医药 E xperi en ces C o mm un i cate C h i nese J ou rnal of E t hno m ed ici ne and E thnophar macy
多糖的分离纯化及药理作用
多糖的分离纯化及药理作用多糖包括植物多糖、动物多糖和微生物多糖。人们已发现多糖不仅是机体的能量来源和骨架成分,而月还具有抗肿瘤、抗衰老、抗病毒、免疫调节及降血糖等多种生物活性。 1.板栗多糖的分离纯化及抗氧化活性研究 1. 1板栗多糖的提取及纯化 (1)板栗粗多糖的提取 称取原料粉末50 g,加入去离子水1000 ml在100℃水浴中回流2h.先用纱布过滤,然后离心除去不溶物质。将提取液减压浓缩至约200 ml然后将体积比为4: 1的三氯甲烷/正丁醇混合液等体积加入多糖溶液中。振荡30 min后,静置,除去中间层变性蛋白质,并收集上层清液,重复以上操作3次去除蛋白。 向滤液中加入95%乙醇至含乙醇量达到80%,边加边搅拌,得灰白色絮状沉淀。静置6h后,倾出上层清液,余下进行离心分离沉淀,回收上层乙醇溶液。固体部分用少量无水乙醇洗涤2次,再用无水乙醚洗涤2次,自然晾干即为粗多糖(CPS)。 (2)板栗粗多糖的纯化 将二乙胺基乙基纤维素(DE-A E- 52)处理后填充3. 0 x 50 cm层析柱,用2倍量蒸馏水平衡。取0. 5 g多糖用蒸馏水溶解后上样,蒸馏水洗脱后分别用0. 1. 0. 3. 0. 5 mol/ L氯化钠溶液梯度洗脱,洗脱液流速为60 ml/ h 分部收集,每管10 ml隔管取0. 2 ml洗脱液用苯酚-硫酸法检测洗脱液中多糖的含量。以480 nm处吸收值为纵坐,分部收集的管数为横坐标,做出多糖的洗脱曲线。 将柱层析分出的各个组分分别合并收集,减压浓缩至100 ~ 200 ml,自来水流水透析48 h,去离子水透析24 h,每4—6 h换一次水。离心除去不溶性杂质后,用4倍体积的95%乙醇进行沉淀,固体部分用少量无水乙醇洗涤2次,再用无水乙醚洗涤2次,自然晾干后得纯化多糖( CPS1) 2胡萝卜多糖的分离纯化及抑制小鼠酒精肝损伤作用研究 2.1胡萝卜粗多糖的制备 (1)将胡萝卜洗净,切丝,于50℃烘干,粉碎。按料液比1:10,超声波处理时间为25 min,超声波功率800 W,纤维素酶用量为0.8 %(w/w),酶解温度50℃,酶解pH为4.5 ,酶解时间50 min. 6层纱布过滤,4500 r/min离心15min,取上清液,浓缩,用3倍量浓缩体积的95%乙醉沉淀24 h, 4500 r/min离心10 min,收集沉淀,冷冻干燥,得到胡萝卜粗多糖 2.2胡萝卜多糖的分离纯化
多糖的分离纯化及药理作用
多糖的分离纯化及药理作用 多糖包括植物多糖、动物多糖和微生物多糖。人们已发现多糖不仅是机体的能量来源和骨架成分,而月还具有抗肿瘤、抗衰老、抗病毒、免疫调节及降血糖等多种生物活性。 1.板栗多糖的分离纯化及抗氧化活性研究 1. 1板栗多糖的提取及纯化 (1)板栗粗多糖的提取 称取原料粉末50 g,加入去离子水1000 ml在100℃水浴中回流2h.先用纱布过滤,然后离心除去不溶物质。将提取液减压浓缩至约200 ml然后将体积比为4: 1的三氯甲烷/正丁醇混合液等体积加入多糖溶液中。振荡30 min后,静置,除去中间层变性蛋白质,并收集上层清液,重复以上操作3次去除蛋白。 向滤液中加入95%乙醇至含乙醇量达到80%,边加边搅拌,得灰白色絮状沉淀。静置6h后,倾出上层清液,余下进行离心分离沉淀,回收上层乙醇溶液。固体部分用少量无水乙醇洗涤2次,再用无水乙醚洗涤2次,自然晾干即为粗多糖(CPS)。 (2)板栗粗多糖的纯化 将二乙胺基乙基纤维素(DE-A E- 52)处理后填充3. 0 x 50 cm层析柱,用2倍量蒸馏水平衡。取0. 5 g多糖用蒸馏水溶解后上样,蒸馏水洗脱后分别用0. 1. 0. 3. 0. 5 mol/ L氯化钠溶液梯度洗脱,洗脱液流速为60 ml/ h分部收集,每管10 ml 隔管取0. 2 ml洗脱液用苯酚-硫酸法检测洗脱液中多糖的含量。以480 nm处吸收值为纵坐,分部收集的管数为横坐标,做出多糖的洗脱曲线。 将柱层析分出的各个组分分别合并收集,减压浓缩至100 ~ 200 ml,自来水流水透析48 h,去离子水透析24 h,每4—6 h换一次水。离心除去不溶性杂质后,用4倍体积的95%乙醇进行沉淀,固体部分用少量无水乙醇洗涤2次,再用无水乙醚洗涤2次,自然晾干后得纯化多糖( CPS1) 2胡萝卜多糖的分离纯化及抑制小鼠酒精肝损伤作用研究 2.1胡萝卜粗多糖的制备 (1)将胡萝卜洗净,切丝,于50℃烘干,粉碎。按料液比1:10,超声波处理时间为25 min,超声波功率800 W,纤维素酶用量为0.8 % (w/w),酶解温度50℃,酶解pH为4.5 ,酶解时间50 min. 6层纱布过滤,4500 r/min离心15min,取上清液,浓缩,用3倍量浓缩体积的95%乙醉沉淀24 h, 4500 r/min离心10 min,收集沉淀,冷冻干燥,得到胡萝卜粗多糖 2.2胡萝卜多糖的分离纯化 胡萝卜粗多糖经除蛋自后,既得精制胡萝卜多糖CP。采用DEAE-cellulose 52柱层析对精制胡萝卜多糖进行初步分级分离,为获得精制多糖,将分离所得组分分别经过SephadexG-100凝胶柱层析进一步纯化. 3玉米花粉多糖的分离纯化 3. 1玉米花粉多糖提取 预处理过的玉米花粉加水,在一20℃冷冻24 h以上(或加碱或不作处理),取出后迅速加人到60 0C以上的热水中搅拌,使花粉内部的物质自萌发孔处溢出,经真空抽滤或离心收集滤液;滤渣再经此操作数次。合并提取液并浓缩。浓缩液加3~5倍体积95%以上乙醇,收集沉淀物,经过低温真空干燥或常压80℃干燥,即为玉米花粉粗多糖PPM 。3. 2玉米花粉多糖纯化 PPM通过Savag法脱蛋白后透析、离心。上清液加人乙醇使之体积分数达到30%,离心得沉淀PPMA;继续向上清液中加乙醇使之体积分数达到60%,离心得沉淀PPMB;再向溶液中继续加乙醇使之体积分数达到75%,离心得沉淀PPMC。然后将PPMC经过DEAE-Sephadex A-25柱层析,得到多糖PPMC-1。后者再用DEAE-Sepha-dex U-200凝胶柱层析,进行纯度鉴定。 3. 3玉米花粉多糖的理化性质 玉米花粉多糖为淡黄色絮状固体,可溶于水,溶解性随PPMC, PPMB, PPMA依次增加,各级分都不溶于乙醇、丙酮、乙醚等有机溶剂。3种多糖与碘化钾的反应均不显蓝色,说明是非淀粉类多糖。3种多糖的斐林试剂反应及三氯化铁反应为阴性,说明它们都不含单糖和多酚类物质。而CTAB反应、考马斯亮蓝反应和260 nm吸收均为阳性,说明3
