改进TRIpure法提取小鼠肝脏组织总RNA

文章编号:1006-3110(2008)01-0019-03=论著>改进T RIpure法提取小鼠肝脏组织总RNA
易尚辉1,易银沙1,周鑫2,袁炳秋2,许丹1,吕媛1
摘要:目的改进从新鲜动物组织中提取、鉴定纯度及完整性较高总R NA的技术方法。方法参考1987年Chomczynski P等人提出的RNA提取方法,对组织RNA提取的操作步骤进行调整改进以获得稳定良好的RN A,并对常规琼脂糖凝胶电泳做适当改进用于鉴定RN A的质量。结果用该法提取的总R NA进行电泳后,可见28S、18S、5S三条清晰的RNA条带,其中28S条带的亮度约为18S条带的2倍,用紫外分光光度计检测RNA的纯度,O D260/O D280值为1.8~2.0,表明RNA没有被蛋白质或苯酚污染。这些结果显示RNA未降解并有较好的完整性,全部操作过程可在2h 内完成。结论用改进方法提取的新鲜组织RN A质量稳定,电泳鉴定快速可靠。
关键词:T R Ipure;总RN A;提取;肝组织
中图分类号:R-332文献标识码:A
Isolation of Total RNA from Rat Liver Tissue by Improved Trizol Method Y I Shang-hui,YI y in-sha,ZHOU Xin,et al.(Medical College o f Hunan Normal University,Changsha410006,Hunan,China)
Abstract:Objective To improve a technique that is em ployed to isol ate and i dentify hi gh purity and i ntegri ty of total R N A extracted from fresh animal tissue.Methods R eferring to the R N A isolati on method proposed by C hom czynski P (1987),we i m proved the pr otocol of RN A i s olation.F urtherm ore,we adj us ted the conventi onal agarose gel electrophoresis to be better used to identi fy the R N A quality.Results When total RN A,extracted by use of the m ethod,was used for elec-trophoresis,it clearly showed three R NA bands of28S,18S,and5S.The bri ghtnes s of28S RN A was twice as l ight as that of 18S R N A in the electrophoresis m ap.Purity analys i s of total RN A was conducted with UV spectrophotometer.T he value of OD260/OD280varied from1.8to2.0,which indi cated that the R NA was not contaminated by proteins or phenol.The results indi cated that the total R NA was complete and not degraded;and the entire procedure can be completed within2hrs.C on-clusions The quali ty of RN A isolated from fresh tissue obtained by the improved method is stable,and electrophores i s m ethod i s r apid and reliable.
Key words:TR Ipure;Total RN A;I s olation;Liver ti ss ue
随着分子生物学技术的发展,RN A提取技术逐渐成为分子生物学技术和现代临床医学科研技术的重要的基础组成部分。目前普遍采用的是先将组织或细胞用含有胍类等强烈蛋白质变性剂的变性液处理后,再根据蛋白质、DNA及RN A的分子量不同,在氯化铯、氯化锂等溶液中进行梯度离心,沉淀得到R NA。或者根据DNA和RNA在酸性酚溶液中的溶解度不同,组织或细胞用变性液处理后,再用酸性酚和氯仿抽提的酸性硫氰酸胍-酚-氯仿一步法(又称为/一步法0或acid-guanidine -phenol-chloroform AG PC法)是1987年Chom-czynski等基金项目:科技部创新基金资助项目(05C26224301139);湖南省自然科学基金资助项目(06JJ4033),湖南省教育厅基金资助项目(07C569, 07C585)
作者单位:1湖南师范大学(湖南长沙410006);2长沙赢润生物技术有限公司
作者简介:易尚辉(1967-),硕士,讲师,主要从事公共卫生研究工作。通讯作者:吕媛(1965-),女,博士研究生,教授。提出的[1]。该方法的优点是有强烈的蛋白变性剂,它能强烈抑制材料及提取液中的Rnase的活性。收获的非降解RNA产量大、纯度高,不需超速离心或多步酚)氯仿抽提,抽提时间缩短至4h,得到广泛的应用,并有成熟的产品(T rizol等)供应,是最常使用的方法。但在提取组织,尤其是从富含蛋白质组织中抽提R NA时,往往蛋白质抽提不净,影响RNA质量,而且T r izol 试剂价格昂贵[2~4]。我们拟在1987年Chomczy nski建立的一步法基础上,参照F奥斯伯,RE金斯顿,JG塞得曼等编写的5精编分子生物学实验指南6同时借鉴国内外的研究进展[5],对试剂配方、提取组织RNA操作步骤、电泳鉴定方法等方面进行尝试改进,以期获得质量稳定的总RN A。
1材料与试剂
1.1实验动物雄性健康SD小鼠,清洁级,体重(20?2)g,购自广州中医药大学实验动物中心。
1.2主要试剂R NA提取试剂为本实验室一步法RN A提取
试剂-T RIpure 。该试剂为本实验室采用异硫氰酸胍、十二烷基肌氨酸钠、B -巯基乙醇等国产试剂配制而成。变性液(含4M 异硫氰酸胍,25mM 枸橼酸钠,0.5%十二烷基肌酸钠及0.1M 二硫基乙醇)、2M 醋酸钠和水饱和酚组成的体积比为10:1:10的混合物。T rizol 法中的T rizo l 购自美国Ambiogen 公司。1.3
实验方法
1.3.1 T rizol 法
在研钵中加入T rizol(每50g 或100g 组织
加1ml T rizol)和适量的液氮,将肝脏组织样品迅速研磨成匀浆。将匀浆转移至1.5ml Ep 管中,4e 离心10000rpm/min,10min 。取上清液,加入0.2ml 氯仿:异戊醇,充分混匀摇振10s,冰浴15min 。4e 离心10000rpm/min,20min 。移取上层水相至另一Ep 管中,加入等体积的异丙醇,混匀后静置30min 沉淀R NA 。4e 离心12000rpm/min,15min 。弃上清液,加入70%乙醇1ml,洗涤RNA 沉淀物,4e 10000rpm/min,离心10min 。弃上清液,自然晾干沉淀,用适量的DEPC 水溶解,取2L l 检测完整性,取5L l 检测其纯度。加入100L l 无R Nase 水重悬R NA 。1.3.2
改进T RIpure 法
在研钵中加入变性液(每50g 或
100g 组织加1ml 变性液)和适量的液氮,将肝脏组织样品迅速研磨成匀浆。加入2M 醋酸钠(pH4.0)100L l,充分混匀。再加入1ml 水饱和苯酚,充分混匀。将匀浆样品在15e ~30e 条件下孵育5min 以使蛋白质完全分解。每1ml T R Ipure 加0.2ml 氯仿:异戊醇。盖紧样品管盖,用力摇晃15s,并将其在30e 下孵育20min,在4e 下以12000@g 的离心力高速冷冻离心15min,离心后,混合物分为三层,下层苯酚-氯仿层,中间层蛋白层,上层无色的水样层,RNA 无一例外的存在于水样层中。水样层的容量大约为所加T RIpure 容量的60%。将上层水样层转移至一干净离心管中,加入约1ml 异丙醇和高盐(0.8M 柠檬酸钠和1.2M N aCl)的混合溶液,上下颠倒离心管混匀10s 。12000r pm/min,4e 离心10min,弃上清。加入1ml 75%的
乙醇洗涤沉淀,离心弃上清。加入1ml 无水乙醇洗涤沉淀,离心后用10L l 吸头彻底吸弃残余液体。自然晾干沉淀,用适量的DEPC 水溶解,取2L l 检测完整性,取5L l 检测其纯度。1.3.3 总R NA 浓度及纯度检测
RNA 纯度用A260/A280
紫外光检测,完整性用琼脂糖凝胶电泳检测。T r izol 法使用T BE 电泳缓冲液,改进T R Ipure 法使用T AE 电泳缓冲液。2 结果
2.1 总RNA 纯度比较
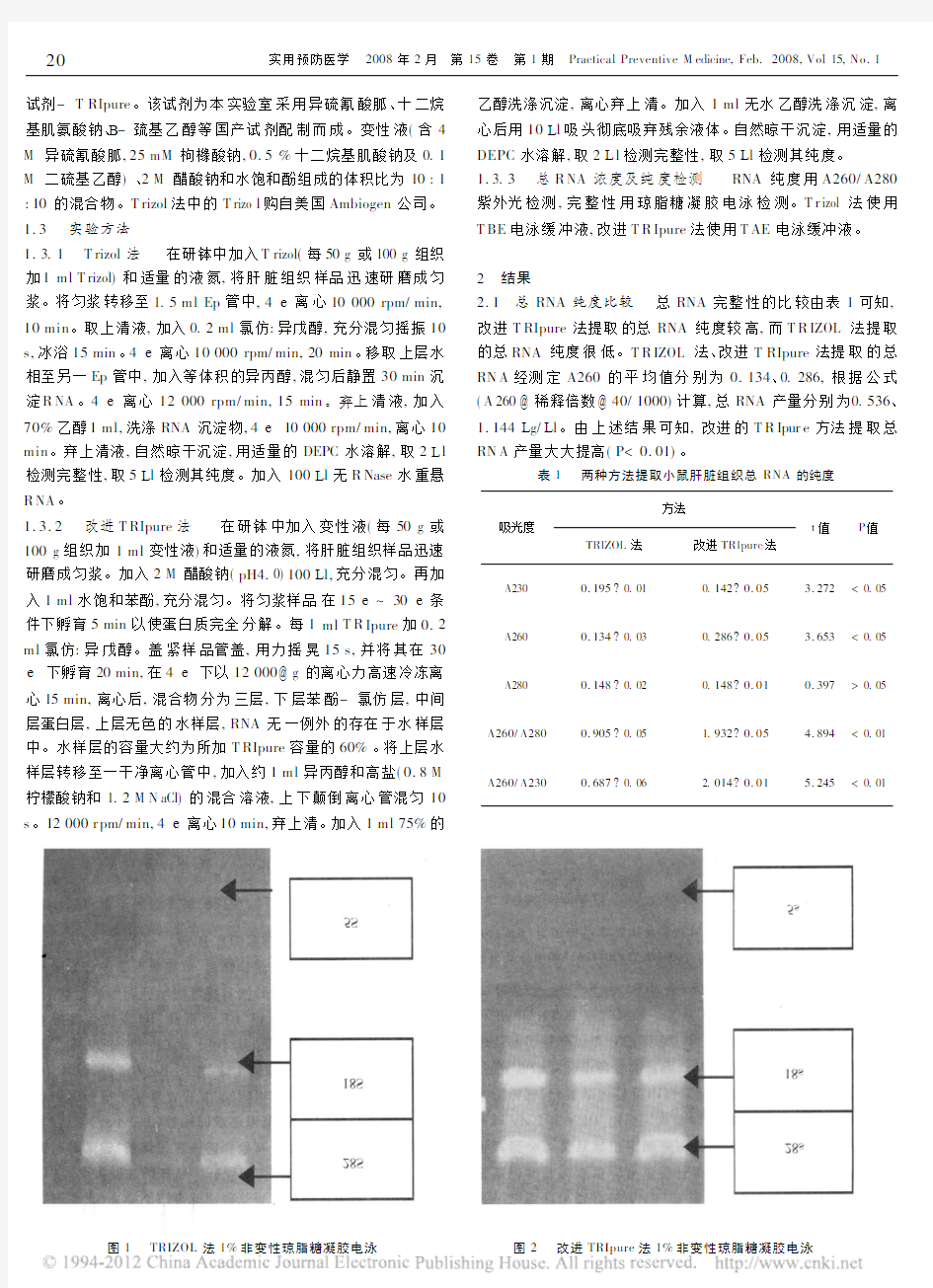
总RNA 完整性的比较由表1可知,
改进T RIpure 法提取的总RNA 纯度较高,而T R IZOL 法提取的总RNA 纯度很低。T R IZOL 法、改进T RIpure 法提取的总RN A 经测定A260的平均值分别为0.134、0.286,根据公式(A 260@稀释倍数@40/1000)计算,总RNA 产量分别为0.536、1.144L g/L l 。由上述结果可知,改进的T R Ipur e 方法提取总RN A 产量大大提高(P<0.01)。
表1
两种方法提取小鼠肝脏组织总RNA 的纯度
吸光度
方法
TRIZOL 法
改进TRIpure 法t 值P 值
A230
0.195?0.01
0.142?0.05
3.272<0.05
A2600.134?0.030.286?0.05 3.653<0.05
A2800.148?0.020.148?0.010.397>0.05
A260/A2800.905?0.05 1.932?0.05 4.894<0.01
A260/A2300.687?0.06 2.014?0.01 5.245<0.
01
图1 TRIZOL 法1%非变性琼脂糖凝胶电泳图2 改进TRIpure 法1%非变性琼脂糖凝胶电泳
2.2总RN A完整性的比较在小鼠肝脏总RNA提取过程中,应用T R IZOL法发现所得RN A沉淀呈浅黄色,说明其中有多酚类物质没有全部除去,改进T R Ipure法提取的总RNA则呈白色絮状。由图1电泳结果明显可见T R IZOL法提取方法提取的总RNA的三条条带较模糊且亮度较暗,说明其提取的总R NA不完整且产量低,而由图2改进T RIpure法提取的总RN A 可见清晰的条带,它们分别为5、18、28srRNA。其中28srRN A 亮度为18srRNA的两倍,5srRN A隐约可见,表明这两种方法提取的小鼠肝脏总RNA比较完整。
3讨论
一步法提取RNA的基本原理是生物样本在酸性溶液状态下,其RN A,DN A和蛋白质可以释放和分离,DNA和蛋白质分别进入有机相的上下层,而R NA留在水相[6,7]。主要包括以下三个步骤:一是使核蛋白复合体充分变性,实现核蛋白与核酸分离;二是抑制内源和外源RN A酶的活性,防止R NA降解;三是将RNA与DNA、蛋白质等分离开来,其中以第二步最为重要。在改进的实验过程中我们添加了如下实验步骤:在水样层中加入0.25ml异丙醇后再加入0.25ml的高盐溶液(0.8M柠檬酸钠和1.2M N aCl)[8,9]。将终溶液混匀,离心并继续进行前述的抽提操作。这一沉淀法能有效地析出RN A,而多糖和蛋白多糖仍以可溶的形式留在溶液中。另外核酸是来源于肝脏这种杂质比较多的样品,因此需要在加入75%乙醇之前,再将离心管短暂离心后,用移液器将残留液体彻底吸出,否则,75%的乙醇非常容易将残留液体中的多糖等杂质给沉淀下来。这样洗涤的目的,是确保小分子物的残留低于10万分之一(最大残留不高于10uM级)。
目前用于正式实验前检测核酸质量的方法,一是电泳,二是紫外分光光度仪。电泳检测的主要是核酸的完整性和大小,只要核酸不是太小或者太大(超出电泳分离范围),该方法还是非常可信的,但电泳也可能提供某些杂质污染的信息,这需要一定的经验来识别。紫外分光光度仪检测的是纯度和核酸含量,由于紫外分光光度仪不能确保非常准确,灵敏度又非常高,所以提供的结果并不十分可信。若同时进行紫外和电泳检测,综合二者的结果,可以做出一个更合理的判断。RNA质量如何、是否被降解通常采用甲醛变性琼脂糖凝胶电泳方法来鉴定。此电泳的主要目的之一是为N orther nblot之用。但在RN A的其他用途中,如cDNA合成和寡聚(Olig dT)纤维素选择分离mRNA等实验中要对RNA进行质量鉴定,此方法就显得繁琐、费时、费力,而用常规琼脂糖凝胶电泳R NA会水解而达不到鉴定的目的,如果用本研究改进的1%琼脂糖凝胶方法电泳鉴定,简单、高效、经济实用,并且能达到同用甲醛变性琼脂糖凝胶电泳相同的实验效果[10],为最大限度降低R NA在电泳时被降解。在常规琼脂糖凝胶电泳的基础上进行如下改进:1电泳RNA所用器械如制胶的模具、梳子、电泳槽等用肥皂粉洗干净后用双蒸水冲洗2遍后在室温晾干备用。o用新的1@T AE配制1%琼脂糖凝胶,倒胶时溴化乙锭(EB)直接加入凝胶中。?制备好的琼脂糖凝胶板放入电泳槽后再加入经高压灭菌过的1@T AE,液面只能刚好同胶面平齐,缓冲液不要淹过胶面。?点样时,样品RNA每10L l加入2L l上样缓冲液,上样缓冲液是用DEPC处理的水配制的30%甘油,目的也是为了在RNA样品中避免加入其他试剂时造成R Nase的污染[11]。
本实验室研究结果表明:对于样品杂质比较多的组织,如肝脏组织而言,采用Chomczynski一步法不能有效地从这些细胞中分离出R NA,因此我们在实验过程中从试剂的配制、RN A提取过程以及电泳鉴定方法上对其加以改进,使操作步骤更为简便,同时获得质量稳定的RNA,为进行后续的分子生物学研究打下基础。该方法在可以得到质量较高的RN A的同时,因配制T R Ipure所需试剂均为国产试剂,大大降低了试剂的费用,值得推广应用。
[参考文献]
[1]Chomczynski,P.&Sacchi,N.Single-step method of RNAisolationby
acid guanidi nium-thiocyanate-phenol-chloroformextraction[J].
Anal.Biochem,1987,162:156-159.Article PubM ed ISI ChemPort1 [2]张君诚,魏彦飞,唐荣华,等.花生幼胚RNA提取方法研究[J].福
建农林大学学报(自然科学版),2004,33(1):1-41
[3]李杰之,常晓彤,林坚,等.从动物组织提取高纯度总RN A方法的
改进及应用[J].生物技术通讯,2002,05(03):46-03.
[4]杨建雄.生物化学与分子生物学实验技术教程[M].北京:科学出
版社,2002157.
[5]F奥斯伯,RE金斯顿,JG塞得曼,等.精编分子生物学实验指南
[M].颜子颖,王海林译.北京:科学出版社,20011123-126.
[6]Chevillard S.A method for sequenti al extraction of RNA and DNA from
the sample,special ly designed for alimited s upply of biological material [J].Biotechniques,1993,1:2224.
[7]J萨姆布鲁克,E弗里奇,T曼尼蒂斯.分子克隆实验指南[M].第2
版.北京:科学出版社,1992.366-369.
[8]曹廷兵,叶治家,巩燕,等.一种快速鉴定RNA质量的方法[J].第三
军医大学学报,2002,24(8):992-993.
[9]王晋,王建民,苟元彬,等1改进Tripure法提取鉴定小鼠组织总
RNA[J].中国临床康复,2007,10(25):07-10.
[10]胡冬贵,黎青,华小云.真核细胞质总RNA快速提取和鉴定技术的
改进[J].中华医学遗传学杂志,1996,13(3):179.
[11]Chomczynski P.A reagent for the single step simultaneous isol ation of
RNA,DNA and proteins from cell and tissuesamples[J].Biotechniques, 1993,15:523-537.
(收稿日期:2007-12-20)
取小鼠脑组织
丁香园上面总结的方法,排版有点乱。 其实过程与大鼠近似,我的经验是: 1. 材料准备;大剪刀、眼科剪、眼科镊、大镊子、滤纸、竹签等; 2. 步骤:处死小鼠,取头颅; 剪开皮肤,漏出颅骨; 用大尖镊子夹住两侧眼眶,用眼科剪稍剪除颅骨中线; 再用眼科镊夹住颅骨从内向外夹,从下向上逐步去除颅骨; 当全脑露出时,再用眼科镊去除脑膜和血管; 然后用竹签从嗅球处向下取出全脑,即可。 3. 注意事项:用力轻柔,否则容易弄破脑部; 用剪刀剪颅骨时,一定要贴壁向上剪,否则容易剪破脑部; 去除脑膜时,不能硬拉,否则容易弄破大脑; 取出全脑时应把头顶朝下,用竹签轻轻取出,离桌面也不要太远、高; 若留病理,建议一定要取完整无损的大脑。 做免疫组化的话,稍微麻烦一点儿,因为脑组织含水量多,要固定的好,就需要先灌注。先麻醉小鼠 剪开胸腔,找到心脏,从心尖入针,剪开右心耳 先用生理盐水灌注直到从心耳流出来的水清亮了 再改用固定液(一般是4%多聚甲醛)灌注至小鼠四肢僵硬 小鼠只需要用注射器就行了,我做的25~35g的小鼠一般用50mLNS+30mL多聚甲醛。具体步骤:常规麻醉小鼠,将其固定,用剪刀剪开胸部皮肤,暴露出皮下组织,剪开时注意钝性分离,以免误伤。然后用镊子提起剑突,用剪刀剪开胸腔,剪断两侧肋骨,暴露整个胸腔,小心误伤肺及心脏、大血管。用镊子撕开心包膜,暴露心脏,用眼科剪剪开右心耳,然后提起心尖将准备好的生理盐水注射器插入左心室,注射,注射时小心针头滑脱。生理盐水灌流至肺和肝的颜色都变成灰白色即可。然后用多聚甲醛灌流,针孔最好是同一个,多聚灌流时小鼠四肢会抽搐,待抽搐结束,小鼠僵硬即可。取下小鼠,用剪刀在颈部离断头颅,用剪刀在小鼠头颅中间皮肤剪一刀,将两边皮肤向下翻用手捏住,暴露整个颅骨,用眼科剪从脊髓端插入椎孔,沿着颅正中线剪开颅骨,注意剪刀向上翘一些,以免误伤脑组织,剪开后用弯眼科镊分离颅骨,小心分离,直至暴露整个大脑,然后用弯镊伸入颅底离断颅底神经,就可以取出整个脑子了。放多聚里固定24h后包埋切片即可。 具体操作如下: 实验操作步骤: 1) 小鼠称重,以每克小鼠0.0025ml 4%戊巴比妥钠剂量的实施腹腔麻醉。也可以用10%的水合氯醛,3-5ul/g腹腔注射麻醉。 2) 将麻醉的小鼠仰放在操作台上,去毛。 3) 解剖小鼠,暴露心脏。 4) 找到心尖部,左手用镊子提起心尖部,右手或左手将灌流针刺破心尖部进针约0.5cm(最好是用小点的针头,用止血钳固定针尖,剪开右心耳。 5) 将灌流器的导管部开口放到生理盐水中里,打开灌流器灌流,直到从右心耳流出的液体为无色,同时小鼠肝脏色淡,肠管肿胀为止,停止灌流。没有灌流器的用注射器或者吊瓶都可以。
17动物组织蛋白提取
1.组织块迅速置于预冷的生理盐水中,洗去表面的血迹,将组织称量后切成较小的组织块(0.2-1.0g),放入组织匀浆器中,按组织100mg:提取试剂体积1ml的比例加入相应体积的蛋白提取试剂(需提前加入酶抑制剂)进行匀浆,至组织研磨完全。 2.超声处理(同细胞蛋白样品的制备),处理完后置冰上裂解4-5小时。 3.10000 g/min离心10min,取中层溶液,加入等体积的蛋白上样缓冲液(2X),或1/4体积蛋白上样缓冲液(5x)(AR1112),置100℃水浴箱沸水浴中变性5分钟。 1、动物肝脏直接放入研钵中,加入少量液氮,迅速研磨,待组织变软,再加少量液氮,再研磨,如此三次。 2、称量约40mg研磨组织,加入200 ul预冷的组织蛋白抽提试剂,冰上孵育20分钟。 3、10,000×g 离心15分钟。 4、收集上清,进行下一步的实验。 手工匀浆:将剪碎的组织倒入玻璃匀浆管中,再将剩余的1/3匀浆介质或生理盐水冲洗残留在烧杯中的碎组织块,一起倒入匀浆管中进行匀浆,左手持匀浆管将下端插入盛有冰水混合物的器皿中,右手将捣杆垂直插入套管中,上下转动研磨数十次(6~8分钟),充分研碎,使组织匀浆化。 机器匀浆:用组织捣碎机10000~15000r/min上下研磨制成10%组织匀浆,也可用内切式组织匀浆机制备(匀浆时间10秒/次,间隙30秒,连续3~5次,在冰水中进行),皮肤、肌肉组织等可延长匀浆时间。 超声粉碎:用超声粉碎机进行粉碎,可用Soniprep150型超声波发生器以振幅14微米超声处理30秒使细胞破碎,也可用国产超声波发生仪,用40安培,5秒/次,间隙10秒反复3~5次。 反复冻融:培养或者分离的细胞可以用以上的方法匀浆,也可以反复冻溶3次左右(即让细胞加适量的低渗液或者双蒸水放低温冰箱中结冰,溶解,再结冰,再溶解,反复3次左右),但有部分酶活力会受影响。 ①吸取培养基,预冷PBS清洗细胞三次,细胞刮刮脱细胞,收集至离心管,1000rpm离心5分钟。洗涤后的细胞转移至洁净EP管,②冰上操作,配制细胞裂解液,1ml Lysis,Buffer 中加入10 μl磷酸酶抑制剂、1 μl蛋白酶抑制剂、5μl 100mM的PMSF。混匀后冰上保存数分钟待用。③在洗涤好的细胞中按照每107个细胞加入1ml细胞裂解液的比例,加入细胞裂解液。200μl移液器反复吹打,至蛋白析出。④4℃摇床,温和振摇15分钟。⑤14000rpm,4℃离心15分钟,上清即为细胞全蛋白提取物。⑥BCA法测蛋白浓度。蛋白分装后保存于-70℃冰箱,避免反复冻融。提取细胞全蛋白整个过程中所有使用的物品及试剂均需预冷,防止蛋白降解。 细胞提取步骤 1. 冰上操作,向细胞沉淀中加入200ul细胞裂解液,2μl 100mM的PMSF。 2. 200μl移液器反复吹打,至溶液变得粘稠。 3. 4℃摇床,温和振摇30min。 4. 15000rpm,4℃离心15min,上清即为细胞全蛋白提取物 5. 蛋白分装后保存于-70℃冰箱,避免反复冻融。
小鼠睾丸支持细胞分离培养
小鼠睾丸支持细胞分离培养 一、材料和器械: 1、材料:小白鼠(18~ 20 日龄)1只 2、配液: PBS 1L,高压灭菌 细胞洗液:DMEM+双抗 消化液:0 25% ( 质量分数) 胰蛋白酶,0 1%( 质量分数) 胶原酶 细胞培养液:DMEM+10%FBS+双抗 3、器械: 镊子、手术剪、手术刀各3-4把,高压灭菌 500mL烧杯2个,高压灭菌 25 mL离心管、5 mL离心管各20个,高压灭菌 酒精棉一瓶 细胞培养皿若干 冰块若干 二、操作步骤: 1、处死小鼠颈椎脱臼法处死; 2、消毒置于含75% ( 体积分数) 乙醇平皿中浸泡2 min, 然后置于超净台上; 3、取睾丸用中剪剪开下腹部皮肤, 眼科剪从下腹部附睾部剪断精索, 取出双侧睾丸, 放入含预冷细胞洗液的培养皿中; 4、取实质修剪睾丸附带的精索。剥除睾丸被膜, 将睾丸实质剪成约1 mm 1 mm 1 mm 碎块, 静置3~ 4 min; 5、消化转入25mL 离心管中。吸出上层细胞洗液, 每只睾丸加入1 5mL 37 预温的0 25% ( 质量分数) 胰蛋白酶,37 高速振荡消化15~ 20min, 直到残存的间质消化成粘液状, 可见成片断的曲细精管; 6、终止消化加入入少许血清终止消化,; 7、离心1000 r/ min离心5 min, 倾去上层胰酶。加入DMEM/ F12 培养基重悬, 1000r/min 离心5min。倾去上层培养液; 8、再消化每只睾丸加入1 mL 37 预温的0 1%( 质量分数) 胶原酶, 37 低速
缓慢振荡消化20~ 25min; 9、铜网过滤取滤液800 r/ min 离心5min, 2 次去除胶原酶, 用培养液洗涤; 10、接种往离心管加入细胞培养液5ml左右,吹打均匀,接种到两个30细胞培养皿中,补加培养液到培养皿1/3~1/2,培养皿标记显微观察后放入36CO2培养箱培养。 三、换液纯化,计数结果鉴定
小鼠睾丸发育过程中Si1基因表达的研究
云南大学学报(自然科学版),2007,29(2):208~212CN53-1045/N ISSN0258-7971 JournalofYunnanUniversit y Ξ 小鼠睾丸发育过程中Si1基因表达的研究 罗 兰1,2,李水冰1,余 敏1,谭德勇1 (1.云南大学生命科学学院生物化学与分子生物学实验室,云南昆明 650091; 2.昆明医学院基础医学院细胞生物学暨医学遗传学教研室,云南昆明 650031) 摘要:以1天龄、未成熟(3周龄)、成熟期(10周龄以上)的昆明正常小鼠睾丸组织为实验材料,利用地高辛标记的Si1基因探针在其组织切片上进行DNA-mRNA分子原位杂交,探讨Si1基因在小鼠睾丸发育过程中的表达变化.同时,分别在生后15,20d及25d的昆明小鼠睾丸组织切片上进行凋亡细胞原位检测,验证小鼠睾丸上述发育时期的细胞凋亡情况.结果发现:①Si1基因在1天龄小鼠的睾丸组织生精上皮内无杂交信号; 在未成熟小鼠的睾丸组织部分生精上皮内有极强的杂交信号;在成熟小鼠的睾丸组织生精上皮内无杂交信号. ②小鼠睾丸组织生精上皮内,凋亡细胞数从生后第15~20天呈增加趋势,于生后第20天出现峰值,生后第25 天又降低.上述结果表明Si1基因可能参与了小鼠睾丸的发育过程,在小鼠睾丸发育的特定时期发挥作用,由于Si1基因的表达与小鼠生精细胞凋亡发生的时期同步,表明该基因可能与小鼠睾丸发育过程中的细胞凋亡有关. 关键词:小鼠;睾丸;Si1基因;基因表达;凋亡 中图分类号:Q344.13 文献标识码:A 文章编号:0258-7971(2007)02-0208-05 Si1基因是一个新的功能基因(GenBank接受号:AY050169),目前对于Si1基因的功能还知之甚少,以往的研究中表明它与细胞周期的增殖调控有关,可能是一个细胞生长抑制基因,即一个细胞周期负调控基因[1].在肿瘤中,一个SNP位点被发现,该位点在非肿瘤人群中的分布频率为14%,而在肠癌中的分布频率达到51.5%.表明该基因与肠癌有密切关系[2]. 生殖细胞的发育是一个极为特殊的分化过程,也是一个极特殊的细胞周期运行过程.在这一过程中,既有生殖细胞本身的频频分裂增殖,又有其不断地发育分化和死亡[3].研究细胞周期调控基因在生殖细胞发育过程中的表达既可探讨生殖细胞的发育机制,也可从另一个角度探讨细胞周期调控机制,并可探讨细胞周期调控基因在生殖细胞发育过程中的生理功能.此外,近年来的研究表明,小鼠睾丸发育过程不仅存在细胞的生长和分化过程,也涉及了生精细胞的退化过程.有形态学及生化研究表明,生精细胞的退化主要通过细胞凋亡来实现[4].有学者对不同发育阶段小鼠生精细胞的凋亡作了系统的研究,发现凋亡细胞数从生后1d到生后3周有增加的趋势,于生后第3周出现峰值,之后降低[5]. Si1基因既然与细胞周期和肿瘤发生有关[1,2],它与发育过程也许有一定的联系.探讨Si1基因在小鼠睾丸生殖细胞发育过程中的表达,对探讨小鼠睾丸中生殖细胞发育的分子机制有重要的参考意义.由于小鼠睾丸生精细胞在发育过程中存在退化,因此本文同时考察小鼠睾丸生精细胞发育过程的凋亡,以探讨Si1基因与生精细胞凋亡过程的联系. 1 材料与方法 1.1 生物学材料 Ξ收稿日期:2006-06-10 基金项目:国家自然科学基金资助项目(39960030,30360040);云南省应用基础研究基金资助项目(1999C002Z). 作者简介:罗 兰(1973-),女,湖南人,硕士,主要从事细胞生物学及医学遗传学方面的研究.
小鼠肝脏取材步骤
小鼠肝脏组织取材步骤 小鼠肝脏组织取材步骤,并列出完成此次实验所需要的试剂、仪器、材料等相关物品及实验人员安排情况。 材料:小鼠 试剂:DMEM 戊巴比妥钠 75%酒精 PBS 器械消毒液戊二醛 仪器:解剖台备皮刀弯盘组织剪眼科剪手术刀柄刀片血管钳眼科镊 培养皿无菌手套 实验人员安排:小鼠养殖管理组准备工作组实验操作组 实验步骤: 1. 取材前夜禁食,自由饮水。 2. 小鼠称重,按照50mg/kg的比例用5ml的注射器配合针头抽取戊巴比妥钠备用。 3. 正左手的小指和无名指抓住大鼠的尾巴,另外三个手指抓住大鼠的颈部,使大鼠头部向向下。这样腹腔中的器官就会自然倒向胸部,防止注射器刺入时损伤大肠、小肠等器官。右手持注射器,从腹部近腿根处刺入后再腹部皮下穿行深入,动作轻柔,缓慢注射。注射完药物后,缓缓拔出针头,手指按住针口对小鼠腹部轻柔按摩,促进麻醉药物的吸收,掐小鼠尾部检测小鼠麻醉程度。 4.将小鼠四肢固定于解剖台上,暴露小鼠整个胸部和腹部,修剪去腹部毛发,75%酒精消毒。 5.沿腹侧正中线自阴茎上源由下而上剪开腹部皮肤直至剑突,向两侧钝性剥开皮肤与皮下组织,暴露腹壁浅肌层。沿白线钝性分离腹壁肌肉,剪开腹膜,暴露腹腔,将肝脏向上翻起,显露肝门,眼科剪剪除肝脏周围结缔组织和血管。 6.结扎剪断肝门管道系统,钝锐结合完整取出大鼠肝脏,放置于无菌培养皿,生理盐水冲洗,称重并记录。①切取肝左叶约1mm×1mm×1mm组织3块,3-戊二醛磷酸盐缓冲液(PBS0.01mol/LP pH 7.4)或4-戊二醛固定;②左叶肝组织浸入多聚甲醛或福尔马林液中固定;③右叶肝组织称重记录分装后全部放置于无菌冻存管液氮冰冻保存备用。 7.切取肝左叶约1mm×1mm×1mm组织3块,3-戊二醛磷酸盐缓冲液(PBS0.01mol/LP pH7.4)或4-戊二醛固定;左叶肝组织浸入多聚甲醛或福尔马林液中固定;右叶肝组织称重记录分装后全部放置于无菌冻存管液氮冰冻保存备用。
实验四 肝组织中核酸的提取和鉴定
实验四 肝组织中核酸的提取和鉴定 【目的】 验证核酸的三大组成成分。熟悉组织中核酸的提取与鉴定的基本操作方法。 【原理】 动物组织细胞中的核糖核酸(RNA )与脱氧核糖核酸(DNA )大部分与蛋白质结合而形成核蛋白。被三氯醋酸沉淀的核蛋白,先用95%的乙醇加热去除附着在沉淀上的脂类杂质,再用1.7mol/L NaCl 溶液提取出核酸的钠盐,然后加入乙醇即可使核酸钠盐沉淀析出。 RNA 与DNA 均可被硫酸水解产生磷酸、含氮碱基(嘌呤与嘧啶)及戊糖(RNA 为核糖,DNA 为脱氧核糖)。此三类物质分别可按照下述原理鉴定。 1.磷酸 磷酸与钼酸铵试剂作用生成黄色磷钼酸,磷钼酸中的钼在有还原剂(硫酸亚铁)存在时可被还原成蓝色的钼蓝。根据此呈色反应即可鉴定磷酸的存在。 2.嘌呤碱 根据嘌呤碱能与硝酸银产生灰褐色的絮状嘌呤银化合物而鉴定。 3.戊糖 根据核糖经浓盐酸或浓硫酸作用则生成糠醛,后者能与3,5二羟甲苯缩合而形成绿色化合物而鉴定。 CHO C H C H C H CH 2OH OH OH OH O CHO O H CH 3 C O CH 3 O C H 3OH -H 2O 核糖 3,5-二羟甲苯 糠醛 绿色化合物 脱氧核糖在浓酸中生成ω-羟基-γ-酮基戊醛,它和二苯胺作用生成蓝色化合物。 CHO C H C H C 2OH H H O -H 2O 浓酸脱氧核糖 蓝色化合物 CHO C H C H C H CH 2OH H OH OH ω-羟基-γ-酮基戊醛 二苯胺 【器材】 剪刀、镊子、玻棒、滤纸、试管、试管架、蒸发皿、匀浆器、离心机、沸水浴箱。 【试剂 1.生理盐水。
Oct4在不同时期牛睾丸组织中的表达
Oct4在不同时期牛睾丸组织中的表达 黄伟玲,宋锐,陶勇,张运海,曹鸿国*,章孝荣* (安徽农业大学动物科技学院,安徽地方畜禽遗传资源保护与生物育种省级实验室,安徽合肥230036) 摘要:为探明不同时期牛睾丸组织中干细胞的表达特点,以2.5月龄、4月龄牛胎儿和出生后1年牛、2年牛睾丸为试验材料,通过HE染色和免疫组化法染色,探讨了不同时期牛睾丸的组织学特征及Oct4在睾丸组织中的表达。结果显示,早期胎儿阶段的牛睾丸组织细胞呈现团状,睾丸组织中细胞随着年龄增长逐步分化形成管状,在2.5月龄和4月龄胎牛睾丸组织中,Oct4阳性细胞广泛分布于睾丸组织生精小管细胞团和睾丸间质中;在出生后1年牛睾丸组织中,阳性细胞主要分布于牛睾丸组织生精小管基底膜,在睾丸间质中数量较少或没有;在出生后2年牛睾丸组织中,仅在睾丸组织生精小管基底膜的少量细胞呈现Oct4阳性。试验证实了随着牛年龄的增长,牛睾丸组织中Oct4阳性细胞逐渐减少或消失。关键词:Oct4;牛;睾丸组织 中图分类号:S814.1文献标识码:文章编号:0529-5130(2011)01-0036-03 睾丸组织是生殖系统的重要组成部分,Guan 等[1]和Valenzuela等[2]先后从睾丸组织中分离出具有胚胎干细胞(embryonic stem cells,ES细胞)特性的多能性细胞,为干细胞的分离培养和应用奠定了基础。Oct4又称Oct3或Pou5f1,是由Pou5f1基因编码产生的,是POU(Pit-Oct-Unc)结构域的转录因子家族中的一员[3],Oct4作为干细胞的主导基因广泛表达于各种类型的干细胞,本次试验采用免疫组织化学方法探讨Oct4阳性细胞在不同时期牛睾丸组织中的分布及表达,为从牛睾丸中分离培养多能性干细胞奠定基础。 1材料与方法 1.1试验材料 PV-9000二步法免疫组化检测试剂盒和显色用浓缩型DAB试剂盒购自北京中杉金桥生物技术有限公司,Oct4兔多克隆抗体购自Abcam公司。 牛睾丸分别取自2.5月龄、4月龄的黑白花奶牛胎儿以及出生后1年、2年的黑白花奶牛;12.5d昆明白小鼠胎儿生殖嵴用作阳性对照。 1.2切片制作与观察 试验材料取出后,用生理盐水冲洗,4%多聚甲醛固定48h,将固定好的各睾丸组织样本流水冲洗24h后,依次经梯度酒精脱水、二甲苯透明、常规石蜡包埋、切片等处理,然后将切片贴于预先用多聚 收稿日期:2010-02-24;修回日期:2010-10-25 基金项目:国家“863”重点项目(2008AA101003);安徽农业大学资助引进与稳定人才科研启动项目(yj2007-10)。 作者简介:黄伟玲(1984-),女,硕士研究生。 *通讯作者:曹鸿国,副教授,主要研究方向为动物干细胞与胚胎工程,E-mail:caohongguo1@https://www.360docs.net/doc/9b3326983.html,;章孝荣,教授,主要研究方向为动物胚胎工程,E-mail:zxr@https://www.360docs.net/doc/9b3326983.html,。赖氨酸处理过的干净载玻片上。选取连续相邻的四张切片分别作HE、免疫组化染色、免疫染色阴/阳性对照。 石蜡切片60?烤30min,经二甲苯脱蜡,酒精梯度复水。用含Triton X-100和双氧水的通透液孵育10min,柠檬酸缓冲液中微波抗原修复20min,0.025%Triton X-100的TBS冲洗,3%双氧水孵育10 min,含1%BSA的TBS封闭30min,1?2500稀释的Oct4一抗湿盒4?孵育过夜,二抗添加按照试剂盒操作说明书进行,DAB显色1min。显色后的切片经苏木精衬染,酒精梯度脱水,二甲苯透明,中性树胶封片,在显微镜下观察拍照。 2结果 2.1不同年龄牛睾丸组织的结构特征 在2.5月龄牛胎儿睾丸组织中,未形成曲细精管结构,不同类型的细胞开始分区,原始生殖细胞聚集明显,呈现明显的团状细胞集落,各细胞集落之间被支持细胞分隔(图1A)。4月胎牛睾丸组织中生精小管结构初步显现,生精小管的管腔还没有形成,睾丸组织间质分布于生精小管周围(图1B)。1年牛睾丸组织生精小管结构形成,但生精小管管腔仍处于闭锁状态,睾丸间质细胞呈梭形分布于生精小管周围,精原细胞沿生精小管基底膜整齐分布(图1C)。2年牛睾丸组织中生精小管的管腔已经形成,管腔壁上有多层细胞分布(图1D)。 2.2Oct4在不同年龄牛睾丸组织的表达 表达Oct4是干细胞的普遍特征,牛睾丸组织切片免疫组织化学检测显示在2.5月龄和4月龄胎牛睾丸组织中,在牛睾丸组织生精小管细胞团和睾丸间质细胞中Oct4阳性细胞较多,阳性细胞在睾丸组织的实质和间质中均有较多分布(图2A,2B);伴随着 · 63 ·Animal Husbandry&Veterinary Medicine2011Vol.43No.1
提取蛋白的常规方法
1、原料的选择 早年为了研究的方便,尽量寻找含某种蛋白质丰富的器官从中提取蛋白质。但至目前经 常遇到的多是含量低的器官或组织且量也很小,如下丘脑、松果体、细胞膜或内膜等原材料,- 105 - 蛋白质提取与制备Protein Extraction and Preparation 因而对提取要求更复杂一些。 原料的选择主要依据实验目的定。从工业生产角度考虑,注意选含量高、来源丰富及成 本低的原料。尽量要新鲜原料。但有时这几方面不同时具备。含量丰富但来源困难,或含量来源均理想,但分离纯化操作繁琐,反而不如含量略低些易于获得纯品者。一般要注意种属的关系,如鲣的心肌细胞色素C 较马的易结晶,马的血红蛋白较牛的易结晶。要事前调查制备的难易情况。若利用蛋白质的活性,对原料的种属应几乎无影响。如利用胰蛋白酶水解蛋白质的活性,用猪或牛胰脏均可。但若研究蛋白质自身的性质及结构时,原料的来源种属必须一定。研究由于病态引起的特殊蛋白质(本斯.琼斯氏蛋白、贫血血红蛋白)时,不但使用种属一定的原料,而且要取自同一个体的原料。可能时尽量用全年均可采到的原料。对动物生理状态间的差异(如饥饿时脂肪和糖类相对减少),采收期及产地等因素也要注意。 2、前处理 a、细胞的破碎 材料选定通常要进行处理。要剔除结缔组织及脂肪组织。如不能立即进行实验,则应冷 冻保存。除了提取及胞细外成分,对细胞内及多细胞生物组织中的蛋白质的分离提取均须先将细胞破碎,使其充分释放到溶液中。不同生物体或同一生物体不同的组织,其细胞破坏难易不一,使用方法也不完全相同。如动物胰、肝、脑组织一般较柔软,作普通匀浆器磨研即可,肌肉及心组织较韧,需预先绞碎再制成匀桨。 ⑴机械方法 主要通过机械切力的作用使组织细胞破坏。常用器械有:①高速组织捣碎机(转速可达10000rpm,具高速转动的锋利的刀片),宜用于动物内脏组织的破碎;②玻璃匀浆器(用两个磨砂面相互摩擦,将细胞磨碎),适用于少量材料,也可用不锈钢或硬质塑料等,两面间隔只有十分之几毫米,对细胞破碎程度较高速捣碎机高,机械切力对分子破坏较小。小量的也可用乳钵与适当的缓冲剂磨碎提取,也可加氧化铝、石英砂及玻璃粉磨细。但在磨细时局部往往生热导致变性或pH 显著变化,尤其用玻璃粉和氧化铝时。磨细剂的吸附也可导致损失。 ⑵物理方法 主要通过各种物理因素的作用,使组织细胞破碎的方法。 Ⅰ反复冻融法 于冷藏库或干冰反复于零下15~20℃使之冻固,然后缓慢地融解,如此反复操作,使大 部分细胞及细胞内颗粒破坏。由于渗透压的变化,使结合水冻结产生组织的变性,冰片将细胞膜破碎,使蛋白质可溶化,成为粘稠的浓溶液,但脂蛋白冻结变性。 Ⅱ冷热变替法 将材料投入沸水中,于90℃左右维持数分钟,立即置于冰浴中使之迅速冷却,绝大部 分细胞被破坏。 Ⅲ超声波法 暴露于9~10 千周声波或10~500 千周超声波所产生的机械振动,只要有设备该法方便 且效果也好,但一次处理量较小。应用超声波处理时应注意避免溶液中气泡的存在。处理一些超声波敏感的蛋白质酶时宜慎重。 Ⅳ加压破碎法 加一定气压或水压也可使细胞破碎。
小鼠灌注取脑
成年小鼠心脏灌流及取脑组织步骤 实验步骤: 1、小鼠麻醉后立即将其用针头固定在泡沫板上(用针头插住四肢)。用镊子扯起胸部皮肤,另一只手用剪刀剪开胸腔的皮肤和肋骨,暴露出心脏和肝脏。 2、将注射针头插入小鼠左心室,同时将小鼠肝脏减掉,以使血液流出。灌注生理盐水,时间维持在1min(10~20ml)灌注液左右,血液排除后四肢、肝脏和舌头会变白。 3、待小鼠四肢、肝脏和舌头变白之后,用4%PFA灌流固定,当PFA 流至大脑处可能会使小鼠尾巴略有反射现象(有时可能没有),此时可将灌流速度下调,以使固定更加充分。整个PFA灌流时间约为5min。(固定原理:多聚甲醛可以使蛋白质交联) 4、将导管始端从PFA中拿出,待管中液体流尽后,将心脏上的针头拔下,如果固定的较好,可发现小鼠眼球呈现白色。将托盘中的血液倒至废液桶内,并准备下一步的取脑操作。 取脑及脱水:
1、剪开头部皮肤,露出白色头盖骨。将延髓上包被的软骨剪开,除去多余的结缔组织。需要注意的时,眼睛要由剪刀剪下,不能够直接扯下来,因为眼睛后部连着视神经,如果扯的话有可能会损坏视交叉上核等其他脑部组织。 2、将头盖骨小心剥开,露出白色的脑部,在剥嗅球部位时要格外小心,必要的话可以先将嗅球前部的碎骨留着待进一步固定之后再去除。 3、将头盖骨剥开后,将脑下部连接的神经逐条剪短(可看到视神经交叉),待全部剪断后将脑整个剥离出来。 4、将剥离出来的脑浸泡在4%PFA中,过夜固定。 5、将PFA液换为30%蔗糖进行脱水(防止冷冻切片时形成冰晶和孔洞),初始脱水时脑会浮在蔗糖上面,待完全脱水后脑会沉底。此时可将脑取出进行冷冻切片。
小鼠睾丸生殖细胞标本制作及减数分裂期染色体观察
Isolation and staining of mouse meiotic metaphase chromosomes 小鼠睾丸生殖细胞标本制作及减数分裂期染色体观察 xx 2011级生科四班201100140120 同组者:xx 【实验目的】 1、learn to isolate mouse testes cells and stain with Giemsa. 学会分离小鼠睾丸细胞并用Giemsa染液染色 2、Observe the number and morphology of mouse chromosomes 观察小鼠染色体的数目及形态特征 【实验材料】 【Reagents】 秋水仙素colchicine solution 吉姆萨染液Giemsa stains solution 生理盐水physiological saline 氯化钾溶液KCl solution 固定液fixation solution 【Tools and equipments】 Dissecting tray,beaker,centrifuge tube,microscope,glass slide,pipette,scissors,forceps,copper mesh. 解剖盘,烧杯,离心管,显微镜,载玻片,吸管,剪刀,镊子,铜网 【实验原理】 meiosis is a process of reductional division in which the number of
chromosomes per cell is cut in half. In animals, meiosis always results in the formation of gametes, while in other organisms it can give rise to spores. 减数分裂是细胞分裂染色体数减半的过程,在动物中,减数分裂的结果总是在形成配子,而在其他生物可以产生孢子。 Testosterone is the place where the male germ cell develop and mature,it is the organ that produce sperm. After sexual maturation, sex cells of mammals in the testis is always mature partially. Therefore,have an appropriate treatment to testis enables us to get a variety of chromosomes of different process. 睾丸是雄性动物生殖细胞发育和成熟的部位,是产生精子的器官。哺乳动物在性成熟以后,精巢内的性细胞总是在分批分期不断的成熟,因此,对哺乳动物的精巢进行一定的技术处理,随时都可以获得减数分裂过程中各个时期染色体的标本。 Inject an amount of colchicine solution into the abdomen cavity can prevent the formation of the spindle fiber, so that a large amount of cells in the process of meiotic metaphase can be accumulated. By the normal way of making specimen,we can observe the chromosomes of mouse testosterone 用适量的秋水仙素溶液注入动物腹腔内,可以阻止分裂细胞纺锤丝的形成,从而积累大量处于分裂中期的细胞。利用上述原理,通过常规的制片方法,观察小鼠睾丸细胞的染色体。 Chromosomes are not visible in the cell’s nucleus—not even under a microscope—when the cell is not dividing. However, the DNA that makes up chromosomes becomes more tightly packed during cell division and is then visible under a microscope. Most of what researchers know about
小鼠肝脏缺血再灌注损伤模型
小鼠肝脏缺血再灌注损伤模型 缺血再灌注损伤,即缺血器官、组织重新获得血液供应,不仅不能使组织、器官功能恢复,反而加重了功能代谢障碍及结构破坏。对麻醉动物的肝中叶和肝左叶的门静脉和肝动脉进行阻断和再通,由于肝脏中叶和左叶血流的阻断和再通,引起肝脏中叶和左叶明显的再灌注损伤。肝脏缺血过程中由于肝细胞内ATP 迅速耗尽,导致乳酸酮体等的堆积,及线粒体氧化磷酸化功能低下,引发代谢性酸中毒,缺血过程中细胞缺氧使ATP含量下降,导致肝细胞内外Ca2 +重新分布,即Ca2 +内流,引起线粒体的损伤。再灌注过程中由于氧自由基的爆发性增多,中性粒细胞的聚集,kupffer细胞的激活,细胞凋亡及其他多种细胞因子的作用,使得肝细胞膜损伤,内皮细胞损伤及肝脏微循环障碍等导致肝脏功能代谢障碍及结构破坏。 1.实验动物 SPF级Balb/C小鼠,雄性,周龄为4w~6w,体重为20g~22g。 2.实验分组: 实验分六组:正常对照组、模型组、阳性药组、受试药组三个剂量组,每组15只动物。 3.实验周期 0h、3h、6h、12h、24h、72h 4.建模方法 1 小鼠术前1 2 h禁食,自由饮水。 2 3%戊巴比妥钠80mg/kg腹腔注射麻醉,麻醉成功后将小鼠平躺在手术台上胶带固定四肢,将小鼠腹部术去毛,用碘酒和75%乙醇术区消毒。 3 取腹正中切口1cm,打开腹腔,小心分离出肝脏左、中叶之肝蒂(左、中叶肝脏供血的门静脉和肝动脉)。 4 用无创血管夹夹闭中叶和左叶的门静脉和肝动脉,使约70%的肝脏缺血,以防止发生严重肠系膜静脉淤血。0.5min后,与非阻断的右叶相比,肉眼可见阻断叶明显变白,说明阻断成功,用止血钳夹闭皮肤切口临时关闭腹腔,同时将小鼠放在37℃恒温加热垫上保温。 5 完成持续缺血60min后,重新打开腹腔,迅速取出血管夹,恢复缺血肝血流,
肝组织蛋白提取
1肝组织蛋白的提取 准备物品:PBS (提前消毒,4℃过夜备用),平皿,眼科剪,小镊子,匀浆器,枪头,EP管(以上物品需高压消毒备用),冰盒(所有操作均在冰上) 1)取出肝组织块于平皿中,加入PBS漂洗,切下约黄豆大小的肝组织放入手动匀浆器中,在冰上迅速碾磨直至呈现云雾状 2)加入组织裂解液约500μL(裂解液:PMSF=100:1),冰上作用20~30min 3)吸取组织液到已高压灭菌的Ep管中,4℃离心,12000rpm×15min 4)取出EP管放在冰盒内,仔细吸取上清,取2μl的上清用于蛋白浓度的测定 5)剩余上清,按蛋白:5xbuffer=4:1的比例加入5xbuffer,煮沸10min 6)瞬时离心,放入-20℃冰箱冻存备用。 2. RNA抽提 1、取等量肝组织,液氮中磨碎; 2、加入TRIZOL Reagent lml,室温孵育5min; 3、 )b[I)k2001al氯仿剧烈振荡l 5sec,室温孵育2min; 4、 4℃,12,000rpm,离心15min; 5、吸取上层含有RNA的水相入新管,Dla入500rtl异丙醇沉淀RNA,室温孵育l 0min; 6、 4℃,12,000rpm,离心l 5min; 7、弃上清,加入lml 75%的乙醇洗涤RNA沉淀,4"C,75009,离一L,5min;
8、干燥RNA,用20tal DEPC水溶解RNA; 9、用紫外分光光度计测定RNA的含量,.20℃保存,准备做RT.PCR。 2蛋白浓度测定 1)蛋白标准液(用BSA配制)25mg/ml储存液,稀释为0.5mg/ml,稀释步骤:例:10μL 25mg/ml的蛋白标准液+90μL PBS混合成2.5mg/ml蛋白标准液20μL 2.5mg/ml的蛋白标准液+80μL PBS混合成0.5mg/ml蛋白标准液2)需设置八个标准孔以绘出标准曲线,采用BCA试剂盒测出蛋白浓度,标准孔设置及所加试剂量如下: 试剂添加量(μL) 蛋白标准液 3)配制BCA蛋白测定液,溶液A:溶液B=50:1先混合均匀,至完全互溶备用4)待测蛋白孔加:2μL蛋白液+18μL PBS,每孔的体积均为20μL 5)每孔加180μL配好的BCA蛋白测定液,使每孔总体积均为200μL; 6)室温避光放置两个小时或37℃放置30min; 7)用酶标仪测出每孔的吸光度,(570nm),测三次; 8)用excel工具根据标准孔的数据作散点图,并做出直线及公式。以标准孔的浓度为X轴(分别为0,0.0025,0.005,0.01,0.02,0.03,0.04,0.05),以所测标准孔的吸光度为Y轴,绘制线性关系图,并取相关度(R2值)最高的公式代入计算出需测的蛋白浓度,进而计算出做Western的每孔加样量=(所需上样的蛋白量)/(蛋白浓度×100)μL。 (注:文档可能无法思考全面,请浏览后下载,供参考。可复制、编制,期待 你的好评与关注)
转录因子Ets1和Ets2在小鼠睾丸组织中的表达及其意义
[文章编号] 1671-587Ⅹ(2011)01-0006- 05[收稿日期] 2010-08- 16[基金项目] 国家自然科学基金资助课题(30771555 )[作者简介] 刘 洋(1985-),男,黑龙江省大庆市人,基础兽医学硕士,主要从事Ets转录因子对小鼠睾丸组织调控 研究。 [通信作者] 张学明(Tel:0431-87836162,E-mail:zhangxuem@jlu.edu.cn)[DOI] CNKI:22-1342/R.20101130.1108.000[网络出版时间] 2010-11-30 11:08[网络出版地址] http ://www.cnki.net/kcms/detail/22.1342.r.20101130.1108.000.html转录因子Ets1和Ets2在小鼠睾丸组织中的表达及其意义 刘 洋,金 波,郭 斌,赵丽红,韩玉帅,岳占碰,张学明 (吉林大学畜牧兽医学院动物胚胎工程吉林省重点实验室,吉林长春130062 )[摘 要] 目的:检测Ets家族转录因子Ets1和Ets2在小鼠睾丸组织中的表达,探讨其对小鼠睾丸发育的调控及其对精原干细胞(SSCs)增殖、分化的可能影响。方法:取生后第1、5、10、15、20、25、30、35、40、50和 70天的小鼠睾丸组织,对成年小鼠进行白消安10mg·kg-1 腹腔注射,分别在注射后第0、3、5、8、1 0和18天取睾丸组织,用半定量RT-PCR方法对比内参β-actin在对应组织内的表达水平,分析Ets1、Ets2mRNA在睾丸组织中的相对表达量。结果:Ets1的表达量在生后第1~30天显著高于出生后第35天(P<0.05或P<0.01),之后明显降低并保持稳定;Ets2在生后第1~25天表达量显著高于第35天(P<0.05或P<0.01),之后明显下降并保持稳定。白消安处理后,Ets1的表达量于第5天降至最低,随后逐渐恢复,第9天后基本达到处理前水平并保持相对稳定,其中第5、8天表达量均显著低于处理后第0天(P<0.05或P<0.01);Ets2的表达量在白消安处理后前期变化不明显,第10天时明显降低,与第0和18天比较差异有统计学意义(P<0.05),之后缓慢回升,第18天左右恢复至处理前水平。结论:转录因子Ets1和Ets2可能对睾丸早期发育、成年精子发生的维持及精原细胞的增殖、分化具有调节作用。 [关键词] Ets转录因子家族;Ets1;Ets2;睾丸;白消安;小鼠[中图分类号] Q51;R-332 [文献标志码] A Expressions of transcrip tion factors Ets1and Ets2in mouse testis tissue and sig nificancesLIU Yang,JIN Bo,GUO Bin,ZHAO Li-hong,HAN Yu-shuai,YUE Zhan-peng ,ZHANG Xue-ming(Key Laboratory of Animal Embryo Engineering of Jilin Province,College of Animal Science andVeterinary Medicine,Jilin University,Changchun 130062,China)Abstract:Objective To detect the expressions of Ets family transcription factors Ets1and Ets2in mouse testistissue and explore the effects of Ets1and Ets2on the development of mouse testis and self-renewal anddifferentiation of spermatogonial stem cells(SSCs).Methods The mouse testis tissues were collected from specificdevelopmental stages including postnatal days 1,5,10,15,20,25,30,35,40,50and 70;Busulfanperitoneal injection was performed and mouse testis tissues were collected on the 0th,3rd,5th,8th,10th,18thdays after injection,respectively.The mRNA expression levels of Ets1and Ets2in samples were analyzed by semi-quantitative RT-PCR withβ-actin as the internal control.Results The expression of Ets1was significantly higher6 第37卷 第1期2011年1月吉 林 大 学 学 报 (医 学 版) Journal of Jilin University( Medicine Edition)Vol.37No.1 Jan.2011
取小鼠脑组织
丁香园上面总结得方法,排版有点乱、 其实过程与大鼠近似,我得经验就是:?1。材料准备;大剪刀、眼科剪、眼科镊、大镊子、滤纸、竹签等;?2。步骤:处死小鼠,取头颅; 剪开皮肤,漏出颅骨;?用大尖镊子夹住两侧眼眶,用眼科剪稍剪除颅骨中线;?再 用眼科镊夹住颅骨从内向外夹,从下向上逐步去除颅骨; 当全脑露出时,再用眼科镊去除脑膜与血管;?然后用竹签从嗅球处向下取出全脑,即可。 3。注意事项:用力轻柔,否则容易弄破脑部;?用剪刀剪颅骨时,一定要贴壁向上剪,否则容易剪破脑部;?去除脑膜时,不能硬拉,否则容易弄破大脑;?取出全脑时应把头顶朝下,用竹签轻轻取出,离桌面也不要太远、高;?若留病理,建议一定要取完整无损得大脑。 做免疫组化得话,稍微麻烦一点儿,因为脑组织含水量多,要固定得好,就需要先灌注。?先麻醉小鼠?剪开胸腔,找到心脏,从心尖入针,剪开右心耳 先用生理盐水灌注直到从心耳流出来得水清亮了?再改用固定液(一般就是4%多聚甲醛)灌注至小鼠四肢僵硬 小鼠只需要用注射器就行了,我做得25~35g得小鼠一般用50mLNS+30mL多聚甲醛。具体步骤:常规麻醉小鼠,将其固定,用剪刀剪开胸部皮肤,暴露出皮下组织,剪开时注意钝性分离,以免误伤。然后用镊子提起剑突,用剪刀剪开胸腔,剪断两侧肋骨,暴露整个胸腔,小心误伤肺及心脏、大血管。用镊子撕开心包膜,暴露心脏,用眼科剪剪开右心耳,然后提起心尖将准备好得生理盐水注射器插入左心室,注射,注射时小心针头滑脱。生理盐水灌流至肺与肝得颜色都变成灰白色即可、然后用多聚甲醛灌流,针孔最好就是同一个,多聚灌流时小鼠四肢会抽搐,待抽搐结束,小鼠僵硬即可。取下小鼠,用剪刀在颈部离断头颅,用剪刀在小鼠头颅中间皮肤剪一刀,将两边皮肤向下翻用手捏住,暴露整个颅骨,用眼科剪从脊髓端插入椎孔,沿着颅正中线剪开颅骨,注意剪刀向上翘一些,以免误伤脑组织,剪开后用弯眼科镊分离颅骨,小心分离,直至暴露整个大脑,然后用弯镊伸入颅底离断颅底神经,就可以取出整个脑子了。放多聚里固定24h后包埋切片即可。 具体操作如下:?实验操作步骤:?1) 小鼠称重,以每克小鼠0、0025ml 4%戊巴比妥钠剂量得实施腹腔麻醉、也可以用10%得水合氯醛,3-5ul/g腹腔注射麻醉。?2) 将麻醉得小鼠仰放在操作台上,去毛、 3) 解剖小鼠,暴露心脏。 4) 找到心尖部,左手用镊子提起心尖部,右手或左手将灌流针刺破心尖部进针约 0.5cm(最好就是用小点得针头,用止血钳固定针尖,剪开右心耳、? 5) 将灌流器得导管部开口放到生理盐水中里,打开灌流器灌流,直到从右心耳流出得液体为无色,同时小鼠肝脏色淡,肠管肿胀为止,停止灌流。没有灌流器得用注射器或者吊瓶都可以。?6) 将灌流器得导管小心得移至4%多聚甲醛或2、5%戊二醛中,注意不要产生气泡,开始灌流。此时如果瞧到小鼠四肢突然紧张,尾部卷曲,说明达到固定效果。 7) 灌流大约5分钟,灌流液用量约150毫升左右结束、(小鼠得用量没这么多)?8) 取材、取实验所需得标本、 9) 将取出得材料放到事先准备得多聚甲醛(戊二醛)中固定2—-4小时后移至30%蔗糖中4度冰箱保存过夜。
小鼠睾丸细胞染色体的制备与观察
小鼠睾丸细胞染色体的制备与观察 一、实验目的 1、了解快速制备动物染色体的方法,掌握小鼠睾丸细胞染色体的制备方法; 2、观察小鼠睾丸染色体的数目及其形态特征; 3、掌握小鼠睾丸染色体标本制备基本过程,了解操作步骤的原理。 二、实验原理 染色体是基因的载体。真核细胞染色体的数目和结构是重要的遗传指标之一。制备染色体标本无疑是细胞学最基本的技术之一,优良的染色体制片是进行染色体显带、组型分析、原位杂交等的先决条件。 染色体的制备在原则上可以从所有发生有丝分裂的组织和细胞悬浮液中得到。最常用的途径是从骨髓细胞、血淋巴细胞和组织培养的细胞中制备染色体(由于分裂旺盛)。本实验采用的方法是从小鼠的睾丸细胞中获取。在小鼠睾丸中,细胞有丝分裂和减数分裂比较旺盛,因此不需要体外培养就可以直接得到分裂中期细胞。通过小鼠睾丸得到染色体比较简便,一般不需要无菌操作。用秋水仙素作为有丝分裂的抑制剂。 染色体的形态结构在细胞增殖周期中是不断地运动变化的,一般在有丝分裂中期,染色体的形态最典型、最易辨认和区分。因此,制备染色体标本获取的是中期细胞。通过前处理,低渗,固定,制片,染色等步骤制得染色体标本,可观察到许多处于分裂中期的染色体,可以进行染色体组型分析。 用适量的秋水仙素溶液注入动物腹腔内,可以阻止分裂细胞纺锤丝的形成,从而积累大量处于分裂中期的细胞。利用上述原理,通过常规的制片方法,观察小鼠睾丸细胞的染色体。 三、实验用品 解剖盘解剖剪镊子 10ml刻度的离心管离心机载玻片盖玻片显微镜小鼠秋水仙素 0.3% KCl 固定液(甲醇:冰醋酸=3:1) Giemsa染液 0.9%生理盐水
四、实验步骤 (一)标本的制备 1、取雄性小鼠以每克体重4μg注射秋水仙素,经14~16小时后,断头法 杀死小鼠,取出睾丸用生理盐水(0.9%的NaCl)洗去血污。 2、放入装有1ml 0.3%KCl液的小烧杯中剪碎至呈乳白色。 3、用铜网过滤到刻度离心管中,再加0.3%KCl液至4ml。37℃静置30分钟, 进行低渗处理。以800~1000转/分离心8分钟。 4、弃上清液,加入2ml甲醇·冰醋酸固定液(3:1),并用吸管至管底吹气, 轻轻打散细胞,固定8分钟。 再以800~1000转/分离心8分钟。 5、弃上清液,加1ml固定液,再制成细胞悬液,固定5分钟。 6、取洁净的低温预冷载片,距载片10~15cm高度滴下2~3滴细胞悬液, 从载片一边向另一边轻轻吹气,并同时轻轻敲打载片,以使细胞均匀分布和促使染色体展开。 7、将玻片竖直放置于玻片盒中 一周后 (二)标本的染色与观察 1、用 Giemsa染色20 ~ 30分钟,采用倒置染色法:在玻璃板上用废旧玻 片做支架,使标本玻片的标本面朝下放置到支架上,在玻璃板和标本载玻片之间滴加Giemsa染液。 2、细水冲洗玻片背面,去多余染液,气干。 3、镜检:低倍镜下寻找分散良好、染色适中的分裂相,高倍镜或油镜下观 察染色体形态并计数。 五、实验结果 显微镜下(共有20个染色体)
