填写元素周期表1
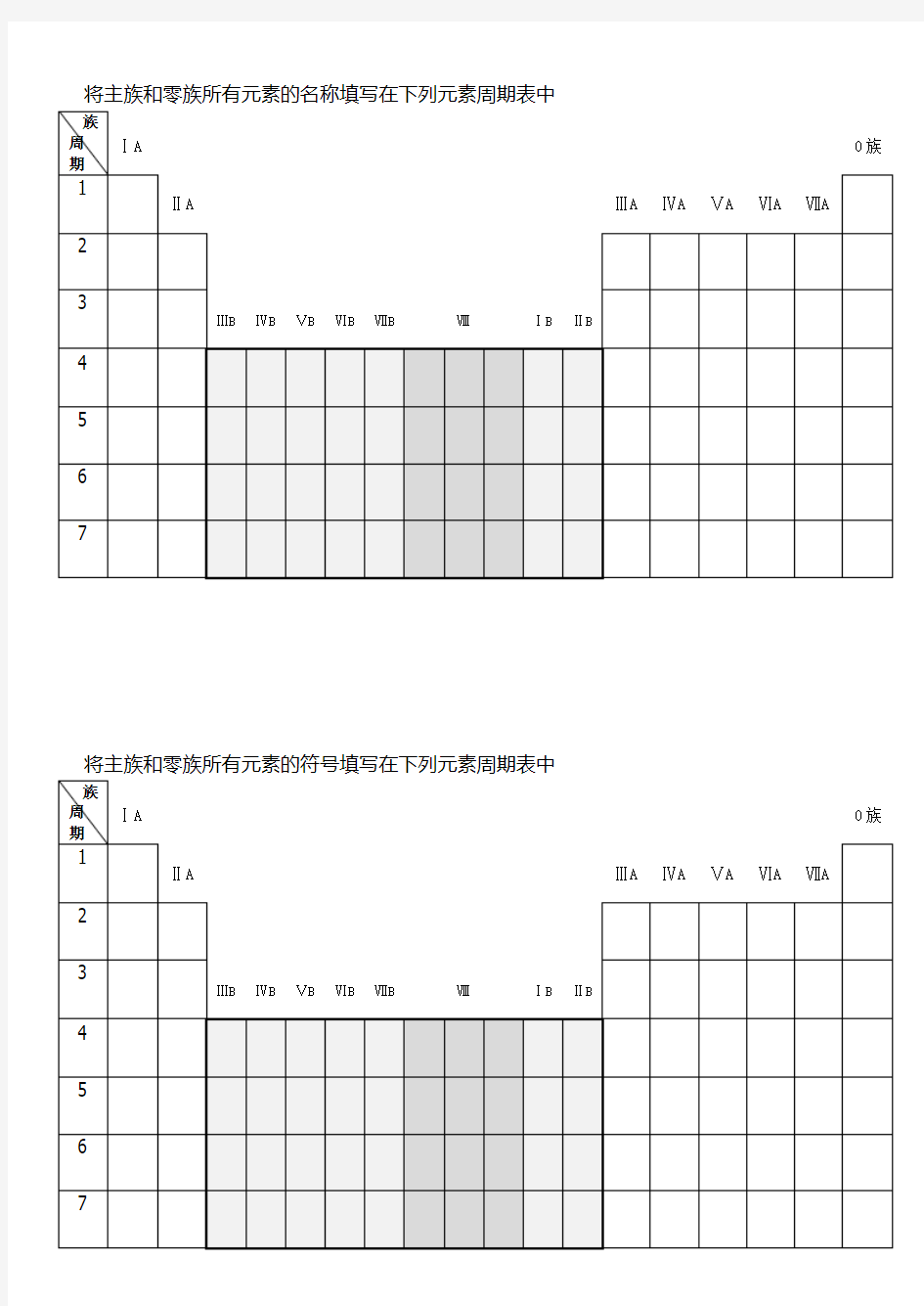
将主族和零族所有元素的名称填写在下列元素周期表中
族
周
ⅠA 0族期
1
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2
3
ⅢB ⅣB ⅤB ⅥB ⅦB ⅧⅠB ⅡB
4
5
6
7
将主族和零族所有元素的符号填写在下列元素周期表中
族
周
ⅠA 0族期
1
ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2
3
ⅢB ⅣB ⅤB ⅥB ⅦB ⅧⅠB ⅡB
4
5
6
7
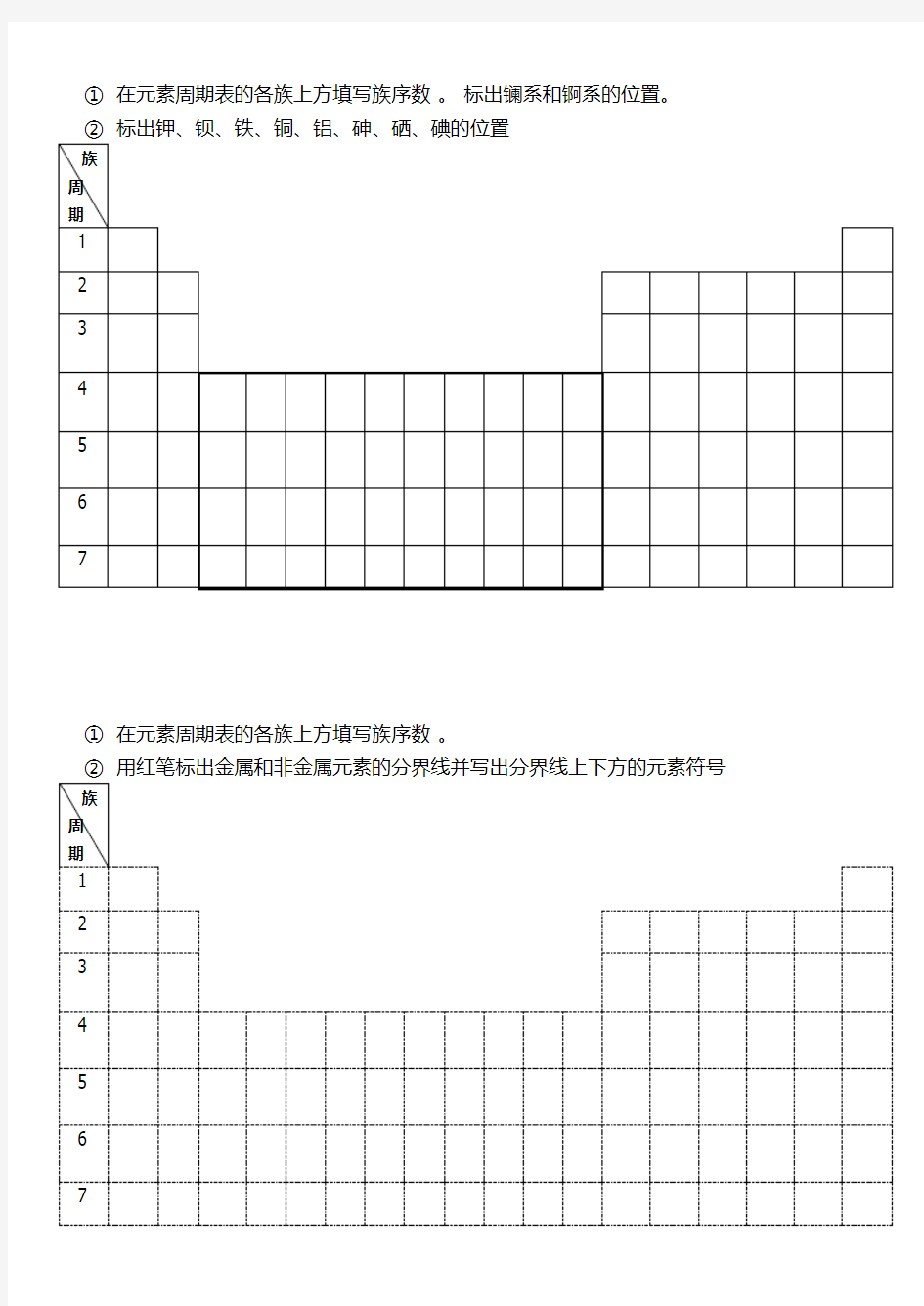
①在元素周期表的各族上方填写族序数。标出镧系和锕系的位置。
②标出钾、钡、铁、铜、铝、砷、硒、碘的位置
族
周
期
1
2
3
4
5
6
7
①在元素周期表的各族上方填写族序数。
②用红笔标出金属和非金属元素的分界线并写出分界线上下方的元素符号族
周
期
1
2
3
4
5
6
7
①在下表中画出所有主族元素所在位置的轮廓
②将ⅡA 、ⅢA、ⅦA所有元素的元素名称填入下表中
●在下表中画出所有非金属元素所在位置的轮廓
●将ⅡA 、ⅢA、ⅦA所有元素的元素符号填入下表中
氮气氯气氨气二氧化碳水氯化氢次氯酸过氧化氢分子式
结构式
电子式
空间构型
甲烷乙烯乙炔甲醛水四氯化碳氟气一氯甲烷分子式
结构式
电子式
空间构型
1.填写下表
氮气氯化钠氨气氧化镁水氯化钙次氯酸氯化铵化学式
电子式
2.用电子式表示下列物质的形成过程
水
氯化镁
过氧化氢过氧化钠氯化镁二氧化碳碳化钙四氯化碳氢氧化钠
化学式
电子式
甲醇氧化钠肼氧化镁硫化氢硫化钠氮化钠
化学式
电子式
甲基乙基氢氧根离子羟基羰基醛基
化学式
结构式
电子式
铵根离子氨基水合氢离子硝基羧基正丙基
化学式
结构式
电子式
1填下表
过氧化钠二硫化碳氟化钙氢氰酸氦气氢化钙四氯化碳化学式
电子式
2用电子式表示下列物质的形成过程
●氯气
●氯化氢
●氯化钠
1.写出下列物质的原子结构示意图
钠离子氟原子钫原子碘离子铜原子铁原子
2.写出常见的10电子微粒
●阴离子
●分子
●阳离子
1.写出常见的18电子微粒
●阴离子
●分子
●阳离子
2. 写出常见的14电子微粒
3. 写出常见的16电子微粒
1.写出常见同主族单质间发生的置换反应(同类型只写一个)
2.写出常见气体单质间发生的置换反应(同类型只写一个)
1.写出常见金属单质间发生的置换反应(同类型只写一个)
2.写出常见非金属单质间发生的置换反应(同类型只写一个)
1.写出常见非金属单质置换金属反应(同类型只写一个)
2.写出常见金属单质置换非金属反应(同类型只写一个)
写出A B C D可能的转化关系
O2 O2 H2O
A B C D
1.
2.
3.
4.
●若X是金属单质,则ABC可能转化关系是:
●若X是非金属单质(氧气除外),则ABC可能转化关系是:
X X
A B C
●若X是酸,则ABC可能转化关系是:
●若X是碱,则ABC可能转化关系是:
●若X是酸性气体,则ABC可能转化关系是:●若X是碱性气体,则ABC可能转化关系是:
人教版必修二《1.1.1元素周期表》同步练习及答案
第一章第一节第1课时 一、选择题 1 ?下列叙述不能作为元素周期表中元素排列顺序依据的是() A. 原子的核电荷数 B. 原子的中子数 C. 原子的质子数 D. 原子的核外电子数 答案:B 点拨:元素周期表中元素是按照原子序数由小到大的顺序排列的,而在原子中,原子序数=核电荷数=质子数=核外电子数,但是不一定等于中子数,所以不能用原子的中子数作为元素周期表中元素排列顺序的依据。 2. 在周期表中,第3、4、5、6周期元素的数目分别是() A. 8,18,32,32 B. 8,18,18,32 C. 8,18,18,18 D. 8,8,18,18 答案:B 点拨:元素周期表中1?6周期的元素种类数分别是2,8,8,18,18,32 ,故选B。 3. (2018 ?经典习题选萃)下列对于元素周期表结构的叙述中正确的是() A. 7个横行代表7个周期,18个纵行代表18个族 B. 副族元素中没有非金属元素 C. 除第1周期外,其他周期均有18种元素 D. 碱金属元素是指IA 族的所有元素 答案:B 点拨:在周期表中18个纵行代表16个族,即7个主族、7个副族、1个0族、1个第忸族,A项错误;副族元素全部是金属元素,B项正确;第2、3周期均为8种元素,第6周期有32种元素,C项错误;碱金属元素是指IA族除H以外的所有元素,D项错误。 4. (2018 ?试题调研)原子序数为Z的元素R,在周期表中位于A B、C、D四种元素的中间,A、B、C D 四种元素的原子序数之和为下列数据,其中不可能的是() n_C t A_ o A.4Z B. 4Z+ 10 C. 4Z+ 5 D. 4Z+ 14 答案:C 点拨:周期表中同一周期左右相邻原子序数差1;由题图中结构可知,C不可能在第1周期,故C与R或R
第1章第3节元素周期表的应用 (1)
第1章第3节元素周期表的应用 学校:___________姓名:___________班级:___________考号:___________ 一、单选题 1.下列实验不能达到实验目的的是() A.A B.B C.C D.D 2.X、Y两元素是同周期的非金属元素,如果X 原子半径比Y的大,下面说法正确的是( ) A.最高价氧化物对应的水化物的酸性,X的比Y的强 B.X的非金属性比Y的强 C.X的阴离子比Y的阴离子还原性强 D.X的气态氢化物比Y的稳定 3.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是() A.气态氢化物的稳定性:X﹥W B.金属性:Y﹥Z C.最高价含氧酸的酸性:X﹥W D.原子半径:Y﹥Z﹥X 4.X、Y、Z、W、E五种同周期元素从左向右按原子序数递增(原子序数为5个连续的自然数)的顺序排列如图所示。下列说法正确的是()
A.W元素的负化合价为-2时,E元素的最高化合价一定为+7 B.Y(OH)n为强碱时,X(OH)n也一定为强碱 C.H n WO m为强酸时,E的非金属性一定很强 D.H n ZO m为强酸时,E的单质具有强还原性 5.a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与b原子次外层的电子数相同;c所在周期数与族序数相同;d与a同主族,下列叙述正确的是() A.四种元素中b的金属性最强 B.c的最高价氧化物对应的水化物是强碱 C.原子半径:d>c>b>a D.d的单质的氧化性比a的单质的氧化性强 二、有机推断题 6.短周期主族元素W、X、Y、Z的原子序数依次增大,元素W的一种单质是熔点高、硬度大的宝石,Y的原子半径在所有短周期主族元素中最大。X和Z同主族,由X、Y 和Z三张元素形成的一种盐溶于水后,加入稀盐酸,有刺激性气体产生。回答下列问题:(1)Y元素在元素周期表中的位置是___。 (2)Z元素是___(填元素符号),由X和Z两种元素形成的化合物有___。 (3)四种元素中(填元素符号)是形成化合物最多的元素___。 三、填空题 7.(1)某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象,如表所示:
【研究院】[人教版][高一化学必修2][第1讲 元素周期表]讲义(学生版)
1.了解元素周期表的编排原则及结构。 2. 了解周期、族等概念。 3.理解原子结构与其元素在周期表中位置的关系。(重点) 4.了解碱金属、卤素原子的结构特点,了解原子结构与元素性质的关系。(重点) 5.了解碱金属、卤素性质的相似性与递变性,并能初步运用原子结构理论解释。(重点) 6.了解核素、同位素的概念,并了解同位素的重要作用。 7.了解原子的结构以及各种微粒数的关系。 本节的重点内容是元素周期表和元素周期表的应用,也是无机化学的核心知识,是高考和会考中每年必考的重点内容。题型多以选择题、填空题为主,多属中档题,主要考察内容有元素周期表的结构及其应用,在填空题中会综合考查元素性质、原子结构及元素在周期表中的位置三者之间的关系。 第 1 讲元素周期表
知识点一.元素周期表的结构 1. 世界上第一张元素周期表是在 1869 年由俄国化学家门捷列夫绘制完成的,随着科学的不断发展,已逐渐演变为现在的常用形式。 2. 原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。 3. 编排原则 (1) 周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。 从上到 下行数 名称 元素种数 原子的电 子层数 同周期内元素原子 序数的变化规律 1 第一周期 短周期 2 1 从左到右,依次变大 2 第二周期 8 2 3 第三周期 8 3 4 第四周期 长周期 18 4 5 第五周期 18 5 6 第六周期 32 6 7 第七周期 32 7 (2) 族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。 项目 定义 族序数 主族 由短周期和长周期元素共同构成的族,用 A 表示。 ⅠA 、ⅡA 、ⅢA……ⅦA 副族 完全由长周期元素构成的族,用 B 表示。 ⅠB 、ⅡB 、ⅢB……ⅦB 第Ⅷ族 第 8、9、10 列元素 ⅧB 0 族 稀有气体元素 主族 1 2 13 14 15 16 17 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 副族 11 12 3 4 5 6 7 ⅠB ⅡB ⅢB ⅣB ⅤB ⅥB ⅦB 第Ⅷ族 第 8、9、10 列元素
高中化学必修一第一节元素周期表
第一节元素周期表 第1课时元素周期表 多选 9.X、Y、Z均为短周期元素,在元素周期表中它们的相对位置如下表所示,已知3种元素的原子序数之和为31,下列有关叙述中正确的是()。 A. B.X的氧化物XO有毒 C.Y能与氢氧化钠溶液反应生成氢气 D.Z的氧化物只能与酸反应 10.下列叙述不正确 ...的是()。 A.除0族元素外,短周期元素的最高正化合价在数值上都等于该元素所属族的族序数B.除短周期外,其他周期均为18种元素 C.副族元素没有非金属元素 D.第ⅢB族中所含元素种类最多 12.下列各表为周期表的一部分(表中数字为原子序数),其中正确的是()。 A
B C D 13.A、B、C、D、E五种元素在元素周期表中的位置如图1-1-1所示,已知E的原子序数为x,则五种元素的原子序数之和不可能 ...为()。 图1-1-1 A.5x B.5x+10 C.5x+14 D.5x+25 14.已知115号元素原子有七个电子层,且最外层有5个电子,试判断115号元素在元素周期表中的位置是()。 A.第七周期第ⅢA族B.第七周期第ⅤA族 C.第五周期第ⅦA族D.第五周期第ⅢA族 15.目前人类已发现的非金属元素除稀有气体元素外,共有16种。下列对这16种非金属元素的相关判断()。 ①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④氧化物常温下都可以与水反应生成酸。 A.只有①②正确B.只有①③正确 C.只有③④正确D.①②③④均不正确 16.已知X、Y、Z、W是短周期中的四种非金属元素,它们的原子序数依次增大。X
第一节元素周期表主要知识点
第一节元素周期表 一、元素周期表概述 1、门捷列夫周期表 按相对原子质量由小到大依次排列,将化学性质相似的元素放在一个纵行,通过分类、归纳制出的第一张元素周期表。 2、现行常用元素周期表 ⑴周期表的编排原则 ①按原子序数递增的顺序从左到右排列 ②将电子层数相同的元素排成一个横行 ③把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行 ⑵周期表的结构 七个横行;7个周期[三短(2、8、8)、三长(18、18、32)、一不完全] 18个纵行(列),16个族: 7个主族(ⅠA~ⅦA);(1、2、13~17列)7个副族(ⅠB~ⅦB);(3~12列) Ⅷ族:3个纵行;(8、9、10列)零族:稀有气体(18列) 周期表中有些族有特殊的名称: 第ⅠA族:碱金属元素(不包括氢元素)第ⅦA族:卤族元素0族:稀有气体元素3、元素周期表的结构与原子结构的关系 原子序数==核电荷数==质子数==核外电子数周期序数==原子的电子层数 主族序数==最外层电子数==最高正价数(O、F除外)==价电子数 非金属的负价的绝对值==8-主族序数(限ⅣA~ⅦA) 4、由原子序数确定元素位置的规律 ⑴主族元素:周期数==核外电子层数;主族的族序数==最外层电子数 ⑵确定族序数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,最后的差 值即可确定。 基本公式:原子序数-零族元素的序数(或各周期元素总数)== 差值 ①对于短周期元素: 若差值为0,则为相应周期的零族元素;若0<差值≤7,则元素在下一周期,差值即为主族序数。 ②对于长周期元素:
差值为1~7时,差值即为族序数,位于Ⅷ族左侧; 差值为8、9、10时,为Ⅷ族元素。 差值为11~17时,再减去10所得最后差值,即为Ⅷ族右侧的族序数。 若差值>17,再减14,按同上方法处理。 例:37号和114号元素的推导。 5、同主族元素上、下相邻元素原子序数推导规律: ⑴ⅠA、ⅡA族元素: 元素的原子序数==上一周期的元素的原子序数+上一周期的元素总数 ⑵ⅢA~ⅦA、0族元素: 元素的原子序数==上一周期的元素的原子序数+本周期的元素总数 例1:甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是 A. x+2 B. x+4 C. x+8 D. x+18 例2:X、Y、Z是周期表中相邻的三种短周期元素,X和Y同周期,Y和X同主族,三种元素原子的最外层电子数之和为17,核内质子数之和为31,则X、Y、Z分别是( ) A. Mg、Al、Si B. Li、Be、Mg C. N、O、S D. P、S、O 二、原子结构 1 A Z X 电量:Z==e- ⑴、构成原子的微粒数目的定量关系 符号X表示质子数为Z,质量数为A的一类原子。 ⑵、构成原子的各种微粒存在下列定量关系: ①核电荷数==质子数==核外电子数 ②质量数(A)==质子数(Z)+中子数(N) ③质量数(A)≈原子的相对原子质量 核外电子(e-) 带负电
第三节 元素周期表的应用(第1课时)
第三节元素周期表的应用(第1课时) 白水县仓颉中学丁江龙 二.教学目标 (一)知识与技能目标 1、以第3周期元素为例,使学生掌握同周期元素性质递变规律,并能用原子结构理论初步解释这些变化规律; 2、了解原子结构、元素性质及该元素三者间的关系,初步学会运用元素周期表; 3、通过“实验探究”、“观察思考”,培养学生实验能力以及对实验结果的分析、处理和总结能力; 4、了解元素周期表在指导生产实践等方面的作用。 (二)过程与方法目标 1、通过“钠、镁、铝原子失电子能力的递变”的活动探究,培养学生的实验能力以及对实验结果的分析、处理、总结的能力,并认识对比试验中条件控制的重要性; 2、通过“硅、磷、硫、氯原子得电子能力的递变”的探究,培养学生获取信息的能力。 3、通过利用原子结构的理论解释这些规律,培养学生的分析推理能力。(三)情感态度与价值观目的 1、通过对门捷列夫的预言和一些化学元素的发现等化学史的学习,让学生体验科学研究的艰辛与喜悦; 2、通过对元素“位、构、性”间关系的学习,帮助学生初步树立“事物的普遍联系”和“量变引起质变”等辨证唯物主义观点; 3、通过对元素周期表在指导生产实践中的作用等知识的学习,让学生体会化学对人类生活、科学研究和社会发展的贡献,培养学生将化学知识应用于生产生活实践的意识。 三、教学重点、难点 (一)知识上重点、难点 1、同周期、同主族元素性质递变规律;
2、元素“位、构、性”三者间的关系。 (二)方法上重点、难点 学会在元素周期律和元素周期表指导下探究和学习元素化合物知识的学习方法。 四、教学准备 1、第1课时前,布置学生预习并准备实验探究方案; 2、第2 课时前,布置学生完成导学案“ⅦA族元素原子结构和性质比较”表格。 3、第3 课时前,布置学生上网查阅“元素周期表的意义” 五、教学方法 实验探究法、讨论归纳法 六、课时安排 3课时 七、教学过程 第1课时 【导入】前面我们学习了元素周期律和元素周期表,它对我们化学有什么作用呢?大家知道,门捷列夫在编制元素周期表时,人类只发现了六十多种元素,因此他做过很多大胆的预测,如他就预测在硅和锡之间存在一种元素—-“类硅”,15年后该元素被德国化学家文克勒发现,为了纪念他的祖国,将其命名为“锗”。 【投影】 【设问】你知道门捷列夫是如何做出如此准确的预测的吗? 【点评】通过展示门捷列夫预言的准确性和锗元素名称来历的介绍,激发学生的学习兴趣和爱国热情,引导他们关注元素周期表的重要作用。 【板书】第三节元素周期表的应用 一、同周期元素性质的递变
2020高考化学元素周期表测试
第一章物质结构元素周期律 第一讲元素周期表 复习重点:元素周期表的结构;元素在元素周期表中的位置及其性质的递变规律。复习难点:元素在元素周期表中的位置及其性质的递变规律。 一、元素周期表的结构 把电子层数目相同各种元素, 按排成横行;再排成纵行得到一个表,这个表就叫元素周期表。元素周期表是的具体表现形式,它反映了相互联系的规律,是我们学习化学的重要工具。 1.周期:(1)周期序数= 电子层数,共个周期(、、短周期;、、 长周期;不完全周期)。填表: 类别周期序数起止元素包括元素种数核外电子层数 短周期 长周期 不完全周期 (2) 总称镧系元素。,总称锕系元素。在锕系元素中以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫做超铀元素。 2.族:(1)由构成的族,叫做主族;构成的族,叫做副族。(2)元素周期表的中部从族到族10个纵行,包括了族和全部副族元素,共六十多种元素,通称为过渡元素。因为这些元素都是,所以又把它们叫做过渡金属。(3)主族元素的族序数=元素原子的最外层电子数。周期表共18个纵行(个主族;个副族;一个族;一个族(、、三个纵行))。 二、元素性质与原子结构 (一)碱金属元素 元素名称核电荷数原子结构示意图最外层电子数电子层数 碱 金 属 元 素 个。单质密度逐渐,熔沸点逐渐。
2、碱金属的化学性质:钾的保存及取用方法: 。 (1)与氧气反应差异性: Li+O 2_(_色、氧化锂);_Na+O 2__(_色、过氧化钠);_K+O 2_(_色,_氧化钾);_Rb+_O 2 _(棕色、_氧化铷);_C S +_O 2 _(_色、_氧化铯)。 (2)与水反应差异性:(填反应现象) 2Li+2H 2O=2LiOH+H 2↑(__);2Na+2H 2O=2NaOH+H 2↑(剧烈);2K+2H 2O=2KOH+H 2↑(____、__);2Rb+2H 2O=2RbOH+H 2↑(更猛烈、燃烧、爆炸)。 (3)写出下列反应的化学方程式: 过氧化钾与CO 2: ;超氧化钾与水、CO 2: 、 ; 氧化锂与水、CO 2 : 、 。 (二)卤族元素 1、卤素原子结构(1)示意图:F Cl Br I 。 最外层电子数相同,但电子层数逐渐增大,得电子能力 ,非金属性 。 2、卤族元素单质的物理性质的变化规律 (随原子序数的递增) (1)颜色:__色~__色~___色~__色 (颜色逐渐加深 ) (2)状态: _态~_态~_态(3)熔沸点:逐渐__ (4)密度: 逐渐__ (5)水溶解性:逐渐__。 3、卤素单质与氢气反应 名称 反应条件 方程式 生成氢化物的稳定性 F 2 _____ H 2+F 2====2HF HF 很稳定 Cl 2 _____ H 2+Cl 2=====2HCl HCl 稳定 Br 2 _____ H 2+Br 2======2HBr HBr 较不稳定 I 2 _____ H 2+I 2======2HI HI ___稳定 2氯化钠水溶液反应:____________。 疑难点拨 一、元素周期表终点之迷 1869年2月,俄国化学家门捷列夫将当时已发现的63种元素列成元素周期表,并留下一些空格,预示着这些元素的性质。在元素周期表的指导下,人们“按因索骥”找出了这些元素。 元素种类到底是否有限? 周期表有否终点? 这是科学家们,也是诸位读者所关心的问题。 本世纪30~40年代,人们发现了92号元素,就有人提出92号是否是周期表的最后一种元素。然后从1937年起,人们用人工合成法在近50年时间又合成近20种元素,元素周期尾巴越长了。这时又有人预言,105号元素该是周期表的尽头了,其理由是核电荷越来越大,核内质子数世越来越大,质子间的排斥力 将远远超过核子间作用力,导致它发生蜕变,然而不久,又陆续合成了106~109号元素。这些元素存在的时间很短,如107号元素半衰期只有2微秒,照此计算是否周期表到尽头了? 1969年起,理论物理学家从理论上探索“超重元素”存在的可能性,他们认为具有2,光 500℃
第一节 元素周期表教案
第一章物质结构元素周期律 第一节元素周期表 (第一课时) 【教学目标】 1.知识与技能 (1)使学生了解元素周期表得结构以及周期、族等概念。 (2)使学生了解原子结构、元素性质及该元素在周期表中得位置三者间得关系,初步学会运用周期表。 2.过程与方法 通过对原子结构得初步认识,树立对立统一得观点,知道有关元素、核素、同位素得涵义及其简单得计算。 3.情感态度与价值观 (1)通过对元素周期表得编制过程得了解,使学生正确认识科学发展得历程,并以此来引导自己得实践,同时促使她们逐渐形成为科学献身得高贵品质。 (2)使学生了解元素周期表得意义,认识事物变化由量变引起质变得规律,对她们进行辩证唯物主义教育。 (3)使学生对核素、同位素及元素相对原子质量得测定有常识性得认识。 【教学重点】元素周期表得结构、元素在周期表中得位置与原子结构得关系。 【教学难点】元素在周期表中得位置与原子结构得关系、核素、同位素。 【教学准备】投影仪、胶片、元素周期表挂图 【教学方法】启发、诱导、阅读、讨论、练习、探究 【教学过程】 【引言】通过我们学习知道元素有一百多种。那么,有没有一种工具可以把我们已知得一百多种元素之间得这种周期性很好地表现出来呢?答案就是肯定得。那就就是元素周期表,也就是我们本节课所要讲得主要内容。 【板书】第一节元素周期表 元素周期表就是元素周期律得具体表现形式,它反映了元素之间相互联系得规律,就是我们学习化学得重要工具。下面我们就来学习元素周期表得有关知识。 首先,我们来认识元素周期表得结构。 【板书】一、元素周期表得结构
原子序数=核电荷数=质子数=核外电子数 【问】数一数元素周期表有多少个横行?多少个纵行?(7个横行,18个纵行) 【讲述】我们把元素周期表中得每一个横行称作一个周期,每一个纵行称作一族。下面,我们先来认识元素周期表中得横行——周期。 【板书】1、周期 【学生活动】元素周期表中共有7个周期,请大家阅读课本P4得有关内容。回答以下问题 1、把不同得元素排在同一个横行即同一个周期得依据就是什么? 2、周期序数与什么有关? 【讲述】元素周期表中,我们把1、2、3周期称为短周期,其余周期称为长周期, 【投影】 周期表得有关知识 类别周期序数起止元素包括元素种数核外电子层数 短周期1 H—H e 2 1 2 Li—Ne 8 2 3 Na—Ar 8 3 长周期4 K—K r 18 4 5 Rb—X e 18 5 6 Cs—Rn 32 6 7 F r—112号26 7 【板书】(1)周期序数=电子层数 说明:1、除第1周期只包括氢与氦,第7周期尚未填满外,每一周期得元素都就是从最外层电子数为1得碱金属开始,逐步过渡到最外层电子数为7得卤素,最后以最外层电子数为8得稀有气体结束。 2、第6周期中,57号元素镧(La)到71号元素镥(Lu),共15种元素,它们原子得电子层结构与性质十分相似,总称镧系元素。第7周期中,89号元素锕(Ac)到103号元素铹(Lr),共15种元素,它们原子得电子层结构与性质也十分相似,总称锕系元素。为了使表得结构紧凑,将全体镧系元素与锕系元素分别按周期各放在同一个格内,并按原子序数递增得顺序,把它们分两行另列在表得下方。在锕系元素中92号元素铀(U)以后得各种元素,多数就是人工进行核反应制得得元素,这些元素又叫做超铀元素。 元素周期表上列出来得元素共有112种,而事实上现在发现得元素还有:114号、116号、118
高中化学 《元素周期表的应用》教案
元素周期表的应用 教材分析 (一)知识脉络 在学过原子结构、元素周期律和元素周期表之后,结合《化学1(必修)》中学习的大量元素化合物知识,通过对第3周期元素原子得失电子能力强弱的探究,整合ⅧA 族元素及其化合物的性质,以及对金属钾性质的预测等一系列活动,归纳得出同周期、同主族元素的性质递变规律,体会元素在周期表中的位置、元素的原子结构、元素性质(以下简称“位、构、性”)三者间的关系,学会运用元素周期律和元素周期表指导化学学习、科学研究和生产实践。 (二)知识框架 (三)新教材的主要特点: 旧教材是根据第3周期元素性质的递变通过归纳得出元素周期律和元素周期表,而新教材则是在学过元素周期律和元素周期表之后,让学生根据原子结构理论预测第3周期元素原子得失电子能力的递变规律和金属钾性质,再通过自己设计实验去验证。教材这样处理旨在培养学生的探究能力,引导学生学会运用元素周期律和元素周期表来指导化学学习和科学研究。 二.教学目标 (一)知识与技能目标 1、以第3周期元素和ⅦA 、ⅠA 族元素为例,使学生掌握同周期、同主族元素性质递变规律,并能用原子结构理论初步加以解释; 2、了解元素“位、构、性”三者间的关系,初步学会运用元素周期表; 3、通过“实验探究”、“观察思考”,培养学生实验能力以及对实验结果的分析、处理和总结能力; 4、了解元素周期表在指导生产实践等方面的作用。 通过探究第三周期元素原子得失电子能力强弱 通过寻找新材料、探矿等实例 通过整合ⅦA 族元素及其化合物性质、预测钾的性质 元素周期 表的应用 认识同周期元素性质的递变 认识同主族元素性质的相似性和递变 了解元素周期表在哲学、指导生产实际和科学研究等方面的意义
人教版高中化学必修二第1讲:元素周期表(教师版)
元素周期表 __________________________________________________________________________________ __________________________________________________________________________________ 1.掌握元素周期表的结构。认识元素在周期表中的位置与其原子的电子层结构的关系。 2.知道金属、非金属在元素周期表中的位置及其性质的递变规律。 3.认识元素、核素、质量数和同位素的含义。 知识点一.元素周期表的结构 1.世界上第一张元素周期表是在1869年由俄国化学家门捷列夫绘制完成的,随着科学的不断发展,已逐渐演变为现在的常用形式。 2.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。 3.编排原则 (1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。 (2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。 4.元素周期表的结构
5.元素周期表中的特殊位置 (1).分区 ①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条斜线,即为金属元素区和非金属元素区分界线(氢元素除外)。 ②各区位置:分界线左面为金属元素区,分界线右面为非金属元素区。 ③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质。 (2).过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。 (3).镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。 (4).锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。 (5).超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。 结构巧记口诀: 横行叫周期,现有一至七,四长三个短,第七尚不满。 纵列称为族,共有十六族,一八依次现①,一零再一遍②。 一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。 镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。 说明:①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ; ②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。 知识点二.元素的性质与原子结构 1 .碱金属元素:周期表中第IA族的元素(除H元素外)。 (1).碱金属的原子结构 ①.相同点:碱金属元素原子结构的最外层电子数相同,都为1。
(第1.1.1 元素周期表)
绝密★启用前 人教版·必修2 第1章第1节课时1 元素周期表 一、选择题 1、下列关于元素周期表的说法中正确的是( )。 A.现行元素周期表是按照元素的相对原子质量大小排列而成的 B.元素周期表共有7个周期、16个族 C.第ⅠA族和过渡元素都是金属元素 D.最外层电子数相同的元素都在同一主族 2、在周期表中,第 3、 4、 5、6周期元素的数目分别是( ) A.8,18,32,32 B.8,18,18,32 C.8,18,18,18 D.8,8,18,18 3、在周期表中,所含元素种类最多的是( )。 A.第Ⅷ族 B.第ⅠA族 C.0族 D.第ⅢB族 3.下列关于元素周期表的说法中正确的是( )。 A.每个横行是一个周期,每个纵行是一个族 B.副族是完全由长周期元素构成的族 C.原子最外层电子数为2的元素全部在第ⅡA族和第ⅡB族 D.第ⅠA族又称碱金属元素,第ⅦA族又称卤族元素 4.下列关于元素周期表的叙述中不正确 ...的是( )。 A.第ⅡA族中无非金属元素 B.0族中无金属元素 C.第ⅠA族元素单质均能与水反应生成 H 2 D.金属元素的种类比非金属元素多 5.M+的结构示意图可表示为,则M元素在周期表中的位置是( )。 A.第三周期0族 B.第四周期ⅠA族 C.第三周期ⅠA族 D.第三周期ⅦA族 6.据国外有关资料报道,在独居石(一种共生矿,化学成分为Ce、La、Nb等的磷酸盐)中查明有尚未命名的116、124、126号元素。则可推测出116号元素应位于周期表中的( )。 A.第六周期ⅣA族 B.第七周期ⅥA族 C.第七周期ⅦA族 D.第八周期ⅥA族 8.若把长式元素周期表原先的主副族及族号取消,由左至右改为18列,如碱金属元素在第1列,稀有气体元素在第18列。按此规定,下列说法错误 ..的是( )。 A.第9列元素中没有非金属元素 B.只有第2列元素原子最外层有2个电子 C.只有第15列元素原子最外层有5个电子 D.在整个18列元素中,第3列的元素种类最多 9. 已知X、Y、Z三种元素在周期表中的相对位置如图所示,且X的原子序数为a,下列 说法中不正确 ...的是( )。 A.Y、Z的原子序数之和可能为2a B.Y的原子序数可能是a-17 C.Z的原子序数可能是a+31 D.X、Y、Z一定都是短周期元素 10.下列叙述不能作为元素周期表中元素排列顺序依据的是( ) A.原子的核电荷数 B.原子的中子数 C.原子的质子数 D.原子的核外电子数 11.下列对于元素周期表结构的叙述中正确的是( )
第一节元素周期表第1课时作业
必修2第一章物质结构元素周期律 第一节元素周期表 第1课时 2、据报道, Jl 二可有效地治疗肝癌,该原子核内的中子数与核外电子数之差为( ) 3、在"二;中,m n 、p 、q 表示X 的四个角码,若 X i 和X ?的q 均为1, m p 的值相等,则 X i 和X 2表示的可能是 A 、不同种元素的原子 B 、同种元素的不同种原子 C 同种元素不同种原子形成的离子 D 、不同元素的离子 4、某元素原子核内质子数为 m ,中子数为n ,则下列论断正确的是 A 、 不能由此确定该元素的相对原子质量 B 、 这种元素的相对原子质量为 m+n C 、 若12 C 原子质量为 Wg ,则此元素原子的质量为 (m+n )Wg D 、该元素原子核内中子的总质量小于质子的总质量 5、道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不 能再分的粒子;②同种元素的原子的各种性质和质量都相同; ③原子是微小的实心球体。从 现代原子一一分子学说的观点看,你认为不正确..的是 ( ) A .只有① B .只有② C .只有③ D .①②③ 6、 据报道,月球上有大量 3 He 存在,以下关于3 He 的说法正确的是 ( ) A 、是4He 的同素异形体 B 、比4He 多一个中子 C 、是4 He 的同位素 D 、比4 He 少一个质子 7、 1 mol D 2O 和1 mol H 2O 不相同的是 ( ) A .含氧原子的数目 B .质量 C. 含有质子的数目 D ?含有中子的数目 & n mol H 2与n mol T 2气体不同之处是 ( ) A ?物质的量 B ?原子数 C .质量 D .体积(相同状况) 78 80 9、Se 是人体必需微量元素,下列关于 34 Se 和34 Se 说法正确的是 ( ) 1、钛(Ti )金属常被称为未来钢铁。钛元素的同位素 中子数不可.能.为 A 、 28 B 、 30 C 、 26 姓名 ________ 46 47 Ti 48 Ti 22 li 、 22 Ti 、 22 Ti D 、24 成绩 _________ 49> Ti 、52Ti 中, ( ) A. 32 B.67 C.99 D.166 78 80 A . 34 Se 和34 Se 互为同素异形体 78 80 B . 34 Se 和34 Se 互为同位素
必修二元素周期表知识点
第一讲 元素周期表 【展示目标 聚焦学习】 1、原子结构 2、元素周期表 3、碱金属元素及其性质 4、卤族元素及其性质 【知识精讲 深化思维】 要点一:原子结构 1、元素周期表的诞生及其发展 诞生:1869年,俄国化学家门捷列夫编制出第一张元素周期表; 依据:将元素按照相对原子质量由小到大依次排列,并将化学性质相似的元素放在一个纵行; 意义:揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑; 发展:随着化学科学的不断发展,元素周期表中为未知元素留下空位先后被排满; 成熟:当原子结构的奥秘被发现后,元素周期表中的元素的排列依据由相对原子质量改 为原子的原子序数,形成现行的元素周期表。 2、元素周期表的编排原则 (1)原子与元素的关系 ①原子的结构 原子的结构 ???? ?? ?? ??? ?一个单位的负电荷)核外电子(一个电子带中子(不带电)电荷)个质子带一个单位的正质子(原子核(带正电)1
在一个原子中:核电荷数 = 质子数 = 核外电子数 =原子序数 ②元素的定义:质子数相同的一类原子的总称; 关系:元素将原子分类,按照质子数是否相同分类,对应的一类原子就是一种元素。 原子序数与元素的原子结构之间的关系: 原子序数=核外电子数=质子数=核电荷数。 (2)原子核外电子排布的规律 核外电子遵循“2n2”的规律:其中“2n2”指的是每一层最多容纳的电子数;“n”指的是电子层数。 每一层排满是最稳定的结构,每当排下那一层电子的时候,首先要看看能不能排满,如果不能排满,则以上一层为标准来排,然后依次类推。 (3)编排原则 1.元素周期表的结构 (1)周期(七横七周期,三短四长)
第一章第一节元素周期表知识点归纳
第一章第一节元素周期表知识点归纳
高中化学必修2知识点归纳总结 第一章物质结构元素周期律 第一节元素周期表 知识点一元素周期表 一、元素周期表的发现 1869年,俄国化学家门捷列夫指出第一张元素周期表。 编制原则:将元素按照相对原子质量由小到大的顺序排列,将化学性质的元素放在一个纵行。 二、原子序数: (1)按照元素在周期表中的顺序给元素编号。 (2)原子序数与原子结构的关系:原子序数=核内质子数=核电荷数=核外电子数 三、元素周期表的结构 1.元素周期表的编排原则: ①按原子序数递增的顺序从左到右排列 ②将电子层数相同 ..。(周期序数......的各元素从左到右排成一横行 =原子电子层数) ③把最外层电子数相同 ........的元素按电子层数递增的顺序从上到 下排成一纵行 ..。主族序数=原子最外层电子数 2.元素周期表的结构——周期和族 ①周期: (1)定义:具有相同电子层数的元素按照原子序数递增的顺序排列的一行,叫周期。(周期序数=原子电子层数) (2)元素周期表有7行,共有7个周期,从上到下依次为第一周期到第七周期。除第一周期外,每一周期的元素都是从
活泼金属元素开始,逐渐过渡到活泼非金属元素,最后以稀有气体元素结束。 (3)数目、分类及各周期特点 类别 周期序数 起止元素 包括元素种数 核外电 子层数 短周期 一 H —He 2 1 二 Li —Ne 8 2 三 Na —Ar 8 3 长周期 四 K —Kr 18 4 五 Rb —Xe 18 5 六 Cs —Rn 32 6 七 (不完全周期) Fr —112号 26(排满应为32种) 7 ②族: (1) 定义:最外层电子数相同的元素按电子层数递增的顺 序排成的纵行叫族。 (主族元素的族序数=元素原子的最外层电子数) (2)分类18个纵行,分为16个族。(7个主族;7个副族;族的分类、数目 分类依据 表示方法 列序号 族序号 主族(7个) 由短周期元素和长周期元素共同构成的族 用族序数(用大写罗马数字表示)后加字母A 表示 1、2、13、14、 15、16、17 ⅠA 、ⅡA 、ⅢA 、ⅣA 、ⅤA 、ⅥA 、ⅦA
第一节元素周期表课时1元素周期表
第一节元素周期表课时1元素周期表 学校:___________姓名:___________班级:___________考号:___________ 一、单选题 1.在元素周期表中横行的编排依据是() A.按元素的相对原子质量递增顺序从左到右排列 B.按元素的原子核外电子层数依次递增顺序从左到右排列 C.电子层相同的元素,按原子序数依次递增顺序从左到右排列 D.按元素的原子最外层电子数依次递增顺序从左到右排列 2.下列有关元素周期表中“族”的说法正确的是() A.元素周期表中共有七个主族、八个副族、一个0族 B.同一主族元素原子最外层的电子数目不一定相同 C.同一主族元素的化学性质相同 D.族序数后标注A的元素是主族元素 3.下列各组元素中,属于同一周期的是 A.Na、P B.N、Cl C.F、Mg D.O、S 4.下列叙述正确的是() A.ⅡA族某元素的原子序数为a,则原子序数为a+1的元素一定位于ⅢA族 B.除短周期外,其他周期均有32种元素 C.原子最外层只有2个电子的元素可能是金属元素,也可能是非金属元素 D.Ca是碱金属元素 5.下列选项能确定主族元素在元素周期表中所处位置的是() A.电子层数和最外层电子数 B.核内中子数 C.次外层电子数 D.相对原子质量 6.原子序数为83的元素位于:①第五周期;②第六周期;③ⅣA族;④ⅤA族;⑤ⅡB族,其中正确的组合是( ) A.①④B.②③C.②④D.①⑤ 7.关于元素周期表的说法中正确的是() A.元素周期表共7个周期、18个族B.38号元素位于第五周期第IIA族C.非金属元素均位于周期表右侧D.第六周期共计18种元素
高中化学《元素周期表的应用》教案(1)
元素周期表的应用 教材分析 (一)知识脉络 在学过原子结构、元素周期律和元素周期表之后,结合《化学1(必修)》中学习的大量元素化合物知识,通过对第3周期元素原子得失电子能力强弱的探究,整合ⅧA族元素及其化合物的性质,以及对金属钾性质的预测等一系列活动,归纳得出同周期、同主族元素的性质递变规律,体会元素在周期表中的位置、元素的原子结构、元素性质(以下简称“位、构、性”)三者间的关系,学会运用元素周期律和元素周期表指导化学学习、科学研究和生产实践。 (二)知识框架 通过探究第三周 通过整合ⅦA族元素元素周期认识同周期元认识同主族元了解元素周期表
(三)新教材的主要特点: 旧教材是根据第3周期元素性质的递变通过归纳得出元素周期律和元素周期表,而新教材则是在学过元素周期律和元素周期表之后,让学生根据原子结构理论预测第3周期元素原子得失电子能力的递变规律和金属钾性质,再通过自己设计实验去验证。教材这样处理旨在培养学生的探究能力,引导学生学会运用元素周期律和元素周期表来指导化学学习和科学研究。 二.教学目标 (一)知识与技能目标 1、以第3周期元素和ⅦA、ⅠA族元素为例,使学生掌握同周期、同主族元素性质递变规律,并能用原子结构理论初步加以解释; 2、了解元素“位、构、性”三者间的关系,初步学会运用元素周期表; 3、通过“实验探究”、“观察思考”,培养学生实验能力以及对实验结果的分析、处理和总结能力; 4、了解元素周期表在指导生产实践等方面的作用。 (二)过程与方法目标 1、通过“活动·探究”,学会运用具体事物来研究抽象概念的思想
方法; 2、通过“阅读探究”、“交流·研讨”、“观察思考”等活动,培养学生获取并整合信息的能力; 3、通过对本节内容的整体学习,学会运用元素周期律和元素周期表指导探究化学知识的学习方法。 (三)情感态度与价值观目的 1、通过对门捷列夫的预言和一些化学元素的发现等化学史的学习,让学生体验科学研究的艰辛与喜悦; 2、通过对元素“位、构、性”间关系的学习,帮助学生初步树立“事物的普遍联系”和“量变引起质变”等辨证唯物主义观点; 3、通过对元素周期表在指导生产实践中的作用等知识的学习,让学生体会化学对人类生活、科学研究和社会发展的贡献,培养学生将化学知识应用于生产生活实践的意识。 三、教学重点、难点 (一)知识上重点、难点 1、同周期、同主族元素性质递变规律; 2、元素“位、构、性”三者间的关系。
1.1.1 元素周期表
第一节 元素周期表(第1课时) 学习目标: 1、知道原子序数的含义,明确原子序数与构成原子的粒子间的关系 2、明确掌握周期表的结构 知识梳理: 一、元素周期表 1. 原子序数: (1)含义:____________________________________________________________________ (2). 原子序数与构成原子的粒子之间的关系: 原子序数= ______________ = ___________________ = __________________ 2. 元素周期表的编排原则 (1)将___________________的元素按______________________的顺序从左到右排成横行 (2)把___________________的元素按______________________的顺序从上到下排成纵行 3. 周期表的结构 ⑴周期:元素周期表共有 个横行,每一横行称为一个 ,故元素周期表共有 个周期 ①周期序数与电子层数的关系: ②周期的分类 [思考]: 如果第七周期排满后,应有几种元素?__________________ ⑵族:元素周期表共有 个纵行,除了 三个纵行称为Ⅷ外,其余的每一个纵行称为一 个 ,故元素周期表共有 个族。族的序号一般用罗马数字表示。 ①族的分类 元素周期表中,我们把18个纵行共分为16个族,其中7个主族,7个副族,一个零族,一个第Ⅷ族。 a 、主族:由短周期元素和长周期元素共同构成的族,用A 表示:如:ⅠA、ⅡA、ⅢA、 ⅣA、ⅤA、ⅥA、ⅦA b 、副族:完全由长周期元素构成的族,用B 表示:ⅠB、ⅡB、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB c 、第Ⅷ族: 三个纵行 (注意: 第Ⅷ族既不是主族也不是副族) d 、零族:第 __ _ 纵行,即稀有气体元素 ②主族序数与最外层电子数的关系: ③族的别称 如 ⅠA 称为 元素 ⅦA 称为 元素 零族称为 元素 [练习]画出具有下列原子序数的元素原子结构示意图,并指出其在周期表中的位置。 9、16、14、5、18 __________________________________________________________________________ 例1:已知元素周期表中前七周期排满后的元素如下所示: 分析元素周期数和元素种数的关系,然后预测第八周期最多可能含有的元素种数为( ) A. 18 B. 32 C. 50 D. 64 例2. 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为X ,则乙的原子序数不可能是( ) A. x+2 B. x+14 C. x+8 D. x+18 二、元素的性质和原子结构 1、碱金属元素 (1)结构 请同学们阅读课本第5页,科学探究,并完成该表。由此可以得出的结论:从锂→铯 相同点: 最外层电子数均为_____________ 不同点: 随着核电荷数的增多,电子层数_____________, 原子半径_______________ (2)化学性质 注意:比较元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化 物的水化物-氢氧化物的碱性强弱来比较 (3)物理性质
元素周期表的应用--同主族 (1)
第三节元素周期表的应用(第2课时) 学习目标: 1、掌握同主族元素性质的递变规律 2、了解原子结构、元素性质及元素在表中的位置三者间的关系,初步学会用元素周期表 3、领会元素周期表在指导生产实践中的作用 【预习导学】 1、元素周期表中,同主族元素原子的核外电子排布的特点是。所以同主族元素具有的性质,又有其性。元素周期表与和 有着密切的关系,因此可以根据元素在周期表中的位置可推知该元素的和。 2、ⅦA族元素包括。 元素名称氟氯溴碘 最外层电子数 得电子能力 最高化合价 最低化合价 无 最高价氧化物对 应水化物(酸) 气态氢化物 相似性:其原子的最外层都有个电子,在化学反应中都易电子,他们原子得电子能力都,都是的非金属元素。它们都能形成气态氢化物,最高价氧 化物的水化物都是,能与大多数金属,其单质常做剂。 递变性:从氟到碘,原子电子层数,原子半径,失电子能力,得电子能力。 ① F2、cl2、Br2、I2与H2化合的条件依次。 ② HF、HCl、HBr、HI 稳定性逐渐,还原性逐渐。 注意:氧族、氮族等非金属主族元素性质的递变规律类似ⅦA族元素,但非金属性比同周期的ⅦA族元素。 3、ⅠA族中的金属元素等称为碱金属元素。 第ⅠA族元素结构、性质探究【阅读课本P24观察·思考】预测金属钾的性质实验步骤:实验现象:实验结论: K与水反应
Na与水反应 (2)预测ⅠA族元素(又称碱金属元素)性质的递变 元素符号原子结构示意 图 原子 半径 失电子能 力 最高价氧化物 水化物及碱性 强弱 单质反应的剧烈程度 与水与O2 相似性:碱金属元素最外层都有个电子,元素的最高化合价为。原子的失电子能力,都是的金属元素,其单质都能与、等物质 发生反应,其最高价氧化物对应的水化物一般具有很强的。 递变性:但从锂到铯,元素的原子失电子能力逐渐,与氧气反应越来越。 ① Li、Na、K、Rb 与水反应的剧烈程度。 ② LiOH、NaOH、KOH、RbOH 碱性逐渐。 4、元素周期表对生产实践的指导作用【阅读教材P24,填写】 根据在元素周期表中位置靠近的元素具有这一规律,可以利用元素周期表寻找。人们不但在处寻找半导体材料,还在中寻找优良的。目前,人们已经用做催化剂使石墨在高温和高压下转化成金刚石;广泛采用过渡元素做进行石油化工生产,而且通过少量的加入来改善催化剂的性能。位于元素周期表的过渡元素如等的单质,大多具有、等特点,人们利用以它们为原料制成的来制造火箭、导弹、宇宙飞船等。人们还利用元素周期表寻找合适的、等。 科学研究发现,地球上化学元素的分布与它们在有着密切的关系。如相对原子质量较小的元素在地壳中含量,相对原子质量较大的元素在地壳中含量,原子序数是的元素在地壳中的含量较多,原子序数是的元素在地壳中的含量较少,处于地球表面的元素多数呈现,处于岩层深处的元素多数呈现;碱金属一般是强烈的,主要富集于,科
