头孢曲松钠 BP2014(EP8.0)

Ceftriaxone Sodium
General Notices
(Ph. Eur. monograph 0991)
C 18H 16N 8
Na 2O 7S 3,3?H 2O 662 10437Action and use
Cephalosporin antibacterial.
Preparation
Ceftriaxone Injection
PhEur
DEFINITION
Disodium
(6R ,7R )-7-[[(2Z )-(2-aminothiazol-4-yl)(me ro-1,2,4-triazin-3-yl)sulfanyl]methyl]-8-oxo Semi-synthetic product derived from a fe Content
96.0 per cent to 102.0 per cent (anhydrou CHARACTERS
Appearance
Almost white or yellowish, slightly hygros Solubility
Freely soluble in water, sparingly soluble
04376-79-6
yl)(methoxyimino)acetyl]amino]-3-[[(2-methyl-6-oxido-5-oxo-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylate 3.5 h a fermentation product.
ydrous substance).
ygroscopic, crystalline powder.
luble in methanol, very slightly soluble in anhydrous ethanol.-2,5-dihyd 3.5 hydrate. nol.
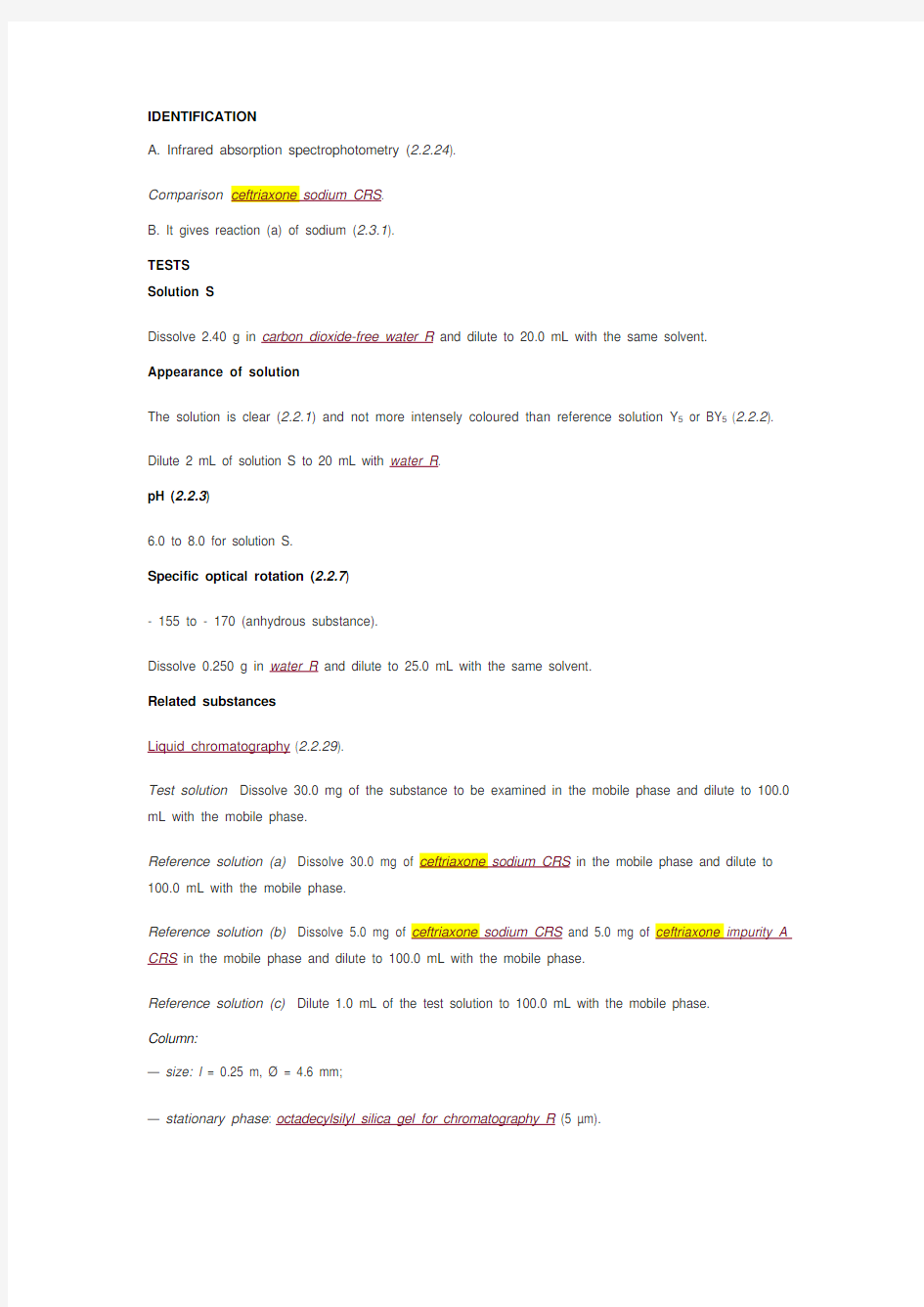
IDENTIFICATION
A. Infrared absorption spectrophotometry (2.2.24).
Comparison ceftriaxone sodium CRS.
B. It gives reaction (a) of sodium (2.3.1).
TESTS
Solution S
Dissolve 2.40 g in carbon dioxide-free water R and dilute to 20.0 mL with the same solvent. Appearance of solution
The solution is clear (2.2.1) and not more intensely coloured than reference solution Y5 or BY5 (2.2.2).
Dilute 2 mL of solution S to 20 mL with water R.
pH (2.2.3)
6.0 to 8.0 for solution S.
Specific optical rotation (2.2.7)
- 155 to - 170 (anhydrous substance).
Dissolve 0.250 g in water R and dilute to 25.0 mL with the same solvent.
Related substances
Liquid chromatography (2.2.29).
Test solution Dissolve 30.0 mg of the substance to be examined in the mobile phase and dilute to 100.0 mL with the mobile phase.
Reference solution (a) Dissolve 30.0 mg of ceftriaxone sodium CRS in the mobile phase and dilute to 100.0 mL with the mobile phase.
Reference solution (b) Dissolve 5.0 mg of ceftriaxone sodium CRS and 5.0 mg of ceftriaxone impurity A CRS in the mobile phase and dilute to 100.0 mL with the mobile phase.
Reference solution (c) Dilute 1.0 mL of the test solution to 100.0 mL with the mobile phase.
Column:
— size: l = 0.25 m, ? = 4.6 mm;
— stationary phase: octadecylsilyl silica gel for chromatography R (5 μm).
Mobile phase Dissolve 2.0 g of tetradecylammonium bromide R and 2.0 g of tetraheptylammonium bromide R in a mixture of 440 mL of water R, 55 mL of 0.067 M phosphate buffer solution pH 7.0 R, 5.0 mL of citrate buffer solution pH 5.0 prepared by dissolving 20.17 g of citric acid R in 800 mL of water R, adjusting to pH 5.0 with strong sodium hydroxide solution R and diluting to 1000.0 mL with water R, and 500 mL of acetonitrile R.
Flow rate 1.5 mL/min.
Detection Spectrophotometer at 254 nm.
Injection 20 μL of the test solution and reference solutions (b) and (c).
Run time Twice the retention time of ceftriaxone.
System suitability Reference solution (b):
— resolution: minimum 3.0 between the peaks due to ceftriaxone and impurity A.
Limits:
— any impurity: not more than the area of the principal peak in the chromatogram obtained with reference solution (c) (1.0 per cent);
— total: not more than 4 times the area of the principal peak in the chromatogram obtained with reference solution (c) (4.0 per cent);
— disregard limit: 0.1 times the area of the principal peak in the chromatogram obtained with reference solution (c) (0.1 per cent).
N,N-Dimethylaniline (2.4.26, Method B)
Maximum 20 ppm.
2-Ethylhexanoic acid (2.4.28)
Maximum 0.8 per cent m/m.
Water (2.5.12)
8.0 per cent to 11.0 per cent, determined on 0.100 g.
Bacterial endotoxins (2.6.14)
Less than 0.08 IU/mg, if intended for use in the manufacture of parenteral preparations without a further appropriate procedure for the removal of bacterial endotoxins.
ASSAY
Liquid chromatography (2.2.29) as descr
modification.
Injection Test solution and reference sol
Calculate the percentage content of C18
CRS.
STORAGE
In an airtight container protected from ligh
tamper-proof container.
IMPURITIES
A.(6R,7R)-7-[[(2E)-(2-aminothiazol-4-yl)(m
ahydro-1,2,4-triazin-3-yl)sulfanyl]methyl]
((E)-isomer),
B.(5a R,6R)-6-[[(2Z)-(2-aminothiazol-4-
uro[3,4-d][1,3]thiazine-1,7(4H)-dione,
C. 2-methyl-3-sulfanyl-1,2-dihydro-1,2,4
described in the test for related substances with the following
e solution (a).
H16N8Na2O7S3 from the declared content of ceftriaxone
m light. If the substance is sterile, store in a sterile, airtight,
yl)(methoxyimino)acetyl]amino]-3-[[(2-methyl-5,6-dioxo-1,2,5
ethyl]-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic ac
-yl)(methoxyimino)acetyl]amino]-5a,6-dihydro-3H,7H-azeto[
1,2,4-triazine-5,6-dione,
wing
sodium
ht,
1,2,5,6-tetr
ylic acid
zeto[2,1-b]f
D. S -benzothiazol-2-yl (2Z )-(2-aminothiaz
E.(6R ,7R )-7-amino-3-[[(2-methyl-5,6-diox hia-1-azabicyclo[4.2.0]oct-2-ene-2-carbo PhEur
othiazol-4-yl)(methoxyimino)thioacetate,
dioxo-1,2,5,6-tetrahydro-1,2,4-triazin-3-yl)sulfanyl]methyl]-carboxylic acid.
-8-oxo-5-t
各类头孢皮试液的配制
各种头孢类皮试液配制方法 1.头孢唑啉钠皮试液的配制 05g/瓶头孢唑啉钠加等渗盐水至5ml →ml 取瓶加等渗盐水至5ml →2mg/ml 取瓶加等渗盐水至5ml →60μg/ml 取头孢唑啉钠皮试液含6μg作皮内注射观察20分钟后判断试验结果。 2.头孢曲松钠1g皮试方法 1于内含头孢曲松钠的瓶内注入4毫升生理盐水 2取上液加NS至1ml则1毫升内含头孢曲松钠50mg 3取上液加NS至1ml则1毫升内含头孢曲松钠5mg 4取上液加NS至1ml则1毫升内含头孢曲松钠即配成试敏液 3.头孢哌酮钠舒巴坦钠1g皮试方法 1于内含头孢哌酮钠舒巴坦钠1g内加4ml生理盐水 2取上液加NS至1ml则1毫升内含头孢哌酮钠舒巴坦钠 50mg 3取上液加NS至1ml则1毫升内含头孢哌酮钠舒巴坦钠5mg 4取上液加NS至1ml则1毫升内含头孢哌酮钠舒巴坦钠即配成试敏液 4.头孢他啶1g每支的皮试方法: 1于内含头孢他啶1g内加4ml生理盐水 2取上液加NS至1ml则1毫升内含头孢他啶 50mg 3取上液加NS至1ml则1毫升内含头孢他啶5mg 4取上液加NS至1ml则1毫升内含头孢他啶即配成试敏液 5.头孢呋辛钠支皮试方法 皮试注射剂量为毫升含头孢呋辛钠ml 皮试液配制方法如下 1于内含头孢呋辛钠的瓶内加入3ml生理盐水则每毫升含头孢呋辛钠250mg
2取上液加NS至1ml则1ml内含头孢呋辛钠50mg 3取上液加NS至1ml则1ml内含头孢呋辛钠5mg 4取上液加NS至1ml则1ml内含头孢呋辛钠即成皮试液 6.头孢呋辛钠支皮试法 1于内含头孢呋辛钠的瓶内注入3ml生理盐水则每毫升含头孢呋辛钠500mg 2取上液加NS至1ml则1ml内含头孢呋辛钠50mg 3取上液加NS至1ml则1ml内含头孢呋辛钠5mg 4取上液加NS至1ml则1ml内含头孢呋辛钠 7.头孢哌酮钠1g皮试法 取1g注射用头孢哌酮钠一支加入10ml生理盐水用1ml注射器取出再加入 NS使之变为1ml后推出混合液后再用NS加到1ml在从混合液中取出毫升混 合液再用盐水使之成为1毫升后即为皮试。 8.头孢匹胺克皮试法 (1)克头孢匹胺2毫升用%盐水配制成250毫克/毫升的A溶液 (2)用1毫升的注射器吸取A溶液毫升加毫升盐水配制成浓度50毫克/毫升的B 溶液。 (3)用的B溶液+毫升配制成浓度5毫克/毫升的C溶液。 (4)用毫升C溶液+毫升盐水配制成浓度为毫克/毫升D溶液即皮试
注射用头孢曲松钠不良反应范文注射用头孢曲松钠的不良反应
注射用头孢曲松钠不良反应范文注射用头孢曲松钠的不良 反应 不良反应与治疗的剂量、疗程有关。局部反应有静脉炎(1.86%),此外可有皮疹、皮炎、瘙痒、荨麻疹、水肿、发热、支气管痉挛和血清病等过敏反应(2.77%),头痛或头晕(0.27%),软便、腹泻、恶心、呕吐、口炎、腹痛、结肠炎、黄疸、胀气、味觉障碍和消化不良等消化道反应(3.45%)。实验室检查异常约19%,其中血液学检查异常占14%,包括嗜酸性粒细胞增多,出血,血小板增多或减少和白细胞减少。肝、肾功能异常者为5%和1.4%。其它罕见副作用有肝酶增加、尿少等。 不良反应与治疗的剂量、疗程有关。静脉用药后,局部反应有静脉炎(1.86%),可通过减慢静脉注射速度(2-4分钟)以减少此现象发生。肌肉注射时,如不加用利多卡因会导致疼痛。 此外可有皮疹、瘙痒、发热、支气管痉挛和血清病等过敏反应(2.77%),头痛或头晕(0.27%),腹泻、恶心、呕吐、腹痛、结肠炎、黄疸、胀气、味觉障碍和消化不良等消化道反应(3.45%)。实验室检查异常约19%,其中血液学检查异常占14%,包括嗜酸性粒细胞增多,血小板增多或减少和白细胞减少。肝肾功能异常者为5%和1.4%。
其他罕见副作用,头痛或眩晕,症状性头孢曲松钙盐之胆囊沉淀,肝脏转氨酶增高,少尿,血肌酐增加,生殖道霉菌病,发热,寒战,以及过敏性或过敏样反应。 因滥用抗生素药物头孢曲松钠可导致儿童泌尿系统结石,近期又有专家研究发现更为严重的问题,头孢曲松钠可导致急性肾后性肾功能衰竭。由于药典、教科书及药品说明均未提及这一严重并发症,医生普遍对其缺乏认识,会导致误诊和误治。 1.首先,这个人对头孢类抗生素肯定过敏! 为了安全考虑,在这样的情况下绝对地禁止再次使用头孢类抗生素,同时,青霉素类也不可以使用。 2.更换别的种类的抗生素,可以选用合成类抗生素,如,左氧氟沙星注射液等。 3.第二天医院仍然使用头孢曲松钠,那么它就是有责任的,如果造成无法挽回的后果,那就是医疗事故了。医院是要对第二天的治疗付责任的。
山东大学2000年获奖情况一览表-山东大学科学技术研究院
山东大学2000年度获奖情况一览表国家技术发明二等奖(1项) 1.反应生成粒子复合强化耐热钢 完成单位:材料科学与工程学院 主要完成者:王执福、于化顺、张景德、公志光、刘明、惠希东 国家科技进步二等奖(2项) 1.ES500电力调度自动化主站应用环境 完成单位:威海分校 主要完成者:云昌钦、杨志强、严中华、王浩、张志伟、魏新华、孙玉军 2."风包粉"系列低Nox浓淡煤粉燃烧技术研究及应用 完成单位:哈尔滨工业大学能源与动力工程学院 主要完成者:秦裕琨*、吴少华*、孙绍增*、李争起*、马春元、孙锐* 荣获高校科学技术奖(10项) 自然科学一等奖(6项)
1.离子注入光波导和缺陷研究 完成单位:物理与微电子学院 主要完成者:王克明、时伯荣、王忠烈、卢霏、孟鸣岐 2.哺乳动物呼吸节律形成及调节机制的研究 完成单位:医学院 主要完成者:宋刚、刘磊、王玉田、张衡、李勤、于萍 3.焊接熔池形态及其热过程的数值模拟研究 完成单位:材料科学与工程学院 主要完成者:武传松、孙俊生、郑炜、曹振宁 4.新型全固化短脉冲激光系统和高效腔内倍频激光系统实验理论研究完成单位:物理与微电子学院 主要完成者:王青圃、赵圣之、张行愚、何京良、刘华 5.钕铁硼永磁合金矫顽力机制的研究 完成单位:物理与微电子学院 主要完成者:高汝伟、张德恒 6.无创伤性测定心腔和大血管内压力的方法学研究 完成单位:齐鲁医院 主要完成者:葛志明、张运、张梅、季晓平、范觉新、赵玉霞 自然科学二等奖(4项)
1.华林--哥德巴赫问题的新研究 完成单位:数学与系统科学学院 主要完成者:刘建亚、展涛 2.微扰非微扰过渡区强相互作用性质 完成单位:物理与微电子学院 主要完成者:梁作堂、王群、谢去病 3.人乳头瘤病毒16型致癌基因E6/E70RF的基因克隆及新型疫苗研究完成单位:医学院 主要完成者:于修平、卡继峰、栾怡、赵蔚明、齐眉 4.D-(一)-对羟基苯甘氨酸及其邓氏盐(甲酯、钾盐)的研究 完成单位:化学与化工学院 主要完成者:张苗、王明刚、谢新记、李吉海、鲁成学、王春省 荣获山东省科学技术进步奖(59项) 一等奖(3项) 1.高效遗传性AITiB中间合金的研究 完成单位:材料科学与工程学院 主要完成者:边秀房、刘相法、亦效刚、马家骥
注射用头孢西丁钠.
注射用头孢西丁钠 【药品名称】 通用名称:注射用头孢西丁钠 英文名称:Cefoxitin Sodium for Injection 【成份】 本品主要成份为头孢西丁钠,其他学名称为:(6R,7S-3-氨基甲酰基氧甲基-7-甲氧基-8-氧代-7-[2(2-噻吩基乙酰氨基]-5-硫杂-1-氮杂双环-[4.2.0]辛-2-烯-2-甲酸钠盐。 【适应症】 适用于对本品敏感的细菌引起的下列感染:1.上下呼吸道感染。2.泌尿道感染包括无并发症的淋病。3.腹膜炎以及其它腹腔内、盆腔内感染。4.败血症(包括伤寒。 5.妇科感染。 6.骨、关节软组织感染。 7.心内膜炎。由于本品对厌氧菌有效及对β-内酰胺酶稳定,故特别适用于需氧及厌氧混合感染,以及对于由产β-内酰胺酶而对本品敏感细菌引起的感染。【用法用量】 肌内注射、静注或静脉滴注。成人常用量为1~2g/次,每6~8小时一次。或根据致病菌的敏感程度及病情调整剂量。 肾功能不全者则按肌酐清除率调整剂量。 本品用于肌肉注射,每克溶于0.5%盐酸利多卡因2ml;静注时每克溶于10ml无菌注射用水;静滴时,1-2g头孢西丁钠溶于50ml或100ml生理盐水或5%或10%葡萄糖溶液中。【不良反应】 本品不良反应轻微。最常见的局部反应:静脉注射后可出现血栓性静脉炎,肌注后可有局部硬结压痛。另外偶见变态反应(皮疹、瘙痒、嗜酸性细胞增多、发热、
呼吸困难等、低血压、腹泻、恶心、呕吐、白细胞减少、血小板减少、贫血以及ALT、AST、ALP、LDH、BUN 或血清Cr值一过性升高。 【禁忌】 对本品及头孢菌素类抗生素过敏者禁用。 【注意事项】 1 青霉素过敏者慎用。 2 肾功能损害者及有胃肠疾病史(特别是结肠炎者慎用。 3 本品与氨基糖苷类抗生素配伍时,会增加肾毒性。 【药物相互作用】 尚不明确。 【药理作用】 注射用头孢西丁钠通过抑制细菌细胞壁合成而杀灭细菌,且由于本品结构上的特点使其对细菌产生的β-内酰胺酶具有很高的抵抗性,某些临床常见革兰氏阳性、阴性需氧及厌氧致病菌对本品高度敏感。 注射用头孢西丁钠对绿脓杆菌、肠球菌大多数菌株,阴沟杆菌等耐药。 【贮藏】 遮光、密闭,在阴凉干燥处保存。有效期:24个月 【有效期】 24个月。
7―ACT生产工艺的优化与头孢曲松钠质量的提高共4页文档
7―ACT生产工艺的优化与头孢曲松钠质量的提高 1 主要内容 该文在对7-ACT生产成本的降低方式上出发,简单叙述降低成本的实验方案,该方案的设计中,把7-ACT的质量符合中间体质量标准作为基础,主要研究目标就是怎样提高7-ACA的利用率。7-ACA合成7-ACT路线(见图1)。 对图1分析研究,7-ACT中含有氨基和羧基,在不同的酸碱环境下呈现性质有所不同,并且很容易和酸、碱混合后产生不同的盐并溶于水溶液。所以,在实验过程中,应该适当的控制酸、碱程度,尽量让其以中性的形态析出。该文结合正交法[4,5]来提高7-ACA的利用,而7-ACT的收率的提高则应该在控制结晶方面来实现,最终来达到降低7-ACT制造成本的目的。 2 实验部分 2.1 实验仪器及试剂 (1)高效液相色谱仪(安捷伦,仪器编号Lk-20AT),分光光度计(写型号)、pH计(仪器编号Lk350)、水分滴定仪(仪器编号Lk008)、电热恒温鼓风干燥箱(仪器编号Lk6903)。 (2)试剂:7-ACA(含量99.2%,批号1307011,鲁抗医药),7-ACT 标准品(纯度99.5%,批号1305024,鲁抗医药)、三嗪环(纯度99.0%批号1306015,石家庄合佳化工有限公司),乙腈(含量99.3%,批号1306056,鲁抗医药回收车间),BF3.乙腈(固体,含量60%~62%,批号1306022,东营合益化工有限公司)。
2.2 7-ACT的检测 (1)检测条件。 色谱柱:C18流速1.0 mL/min 波长:263 nm进样量:20 μL 流动相:4-庚基-氨基溴化物:pH7.0的磷酸盐缓冲液:柠檬酸钠=(440∶55∶5) (2)检测方法。 取配制的试液,精密量取该溶液20 μL,注入高效液相色谱仪,记录色谱图,按峰面积归一化法计算。 2.3 试验方法7-ACT合成条件优化:反应过程中的反应温度、反应 加工过程的长短和主要原材料的投放比例直接影响着7-ACT的收率,所以,反应过程中温度的控制、反应时间的控制以及原材料投放比例的控制是非常重要的,并且应该规定出一定的标准水平,作为优化因素的水平分布。 向300 mL的乙腈溶剂中加入28.4 g 7-ACA和一定比例的三嗪环,再加入一定比例的固体BF3.乙腈,在一定温度下反应一段时间。反应结束后,用pH=3.3的氨水溶液进行结晶,养晶1 h后抽滤、干燥,得到 7-ACT干粉,检测7-ACT干粉的纯度、干燥失重和重量,计算7-ACT的收率和主要原材料成本,在7-ACT的纯度符合要求的同时以主要原材料成本为指标确定最优反应条件。 2.4 7-ACT结晶条件优化 按照1.2优化后的合成条件进行反应,反应结束后,用8%的氢氧化钠
注射用头孢曲松钠(罗氏芬
注射用头孢曲松钠(罗氏芬?)给药前需进行过敏试验 根据注射用头孢曲松钠(罗氏芬?)新版说明书的要求,罗氏芬?在给药前需进行过敏试验,请各位临床医生按照说明书的要求执行。 注射用头孢曲松钠说明书 注:以下有下划线的部分为新版说明书改动的内容 警示:本品不能加入哈特曼氏以及林格氏等含有钙的溶液中使用。本品与含钙剂或含钙产品合并用药有可能导致致死性结局的不良事件。 【药品名称】 通用名称:注射用头孢曲松钠 商品名称:罗氏芬? 英文名称: Ceftriaxone Sodium for Injection 汉语拼音:Zhusheyong Toubaoqusongna 【成份】(省略) 【性状】(省略) 【适应症】 对罗氏芬?敏感的致病菌引起的感染,如:脓毒血症,脑膜炎,播散性莱姆病(早、晚期),腹部感染(腹膜炎、胆道及胃肠道感染),骨、关节、软组织、皮肤及伤口感染,免疫机制低下病人之感染,肾脏及泌尿道感染,呼吸道感染,尤其是肺炎、耳鼻喉感染,生殖系统感染,包括淋病,术前预防感染。 【规格】(省略) 【用法用量】 标准剂量 成人及 12 岁以上儿童:罗氏芬?的通常剂量是1~2 克,每日一次(每24 小时)。危重病例或由中度敏感菌引起之感染,剂量可增至 4 克,每日一次。新生儿、婴儿及12 岁以下儿童建议按以下剂量每日使用一次。新生儿(14 天以下)每日剂量为按体重20~50 毫克/千克,不超过50 毫克/千克,无需区分早产儿及足月婴儿。新生儿(出生体重小于2kg 者)的用药安全尚未确定。有黄疸的新生儿或有黄疸严重倾向的新生儿应慎用或避免使用本品。婴儿及儿童(15 天至12 岁)每日剂量按体重20~80 毫克/千克。体重 50 千克或以上的儿童,应使用通常成人剂量。静脉用量按体重 50 毫克/千克以上时,输注时间至少要30分钟以上。老年病人除非老年患者虚弱、营养不良或有重度肾功能损害时,老年人应用头孢曲松一般不需调整剂量。疗程疗程取决于病程。与一般抗菌素治疗方案一样,在发热消退或得到细菌被清除的证据以后,应继续使用罗氏芬?至少48 至72 小时。联合用药在试验条件下,罗氏芬?与氨基糖甙类抗菌素对许多革兰氏阴性杆菌的协同作用已被证实。虽然不总能预测出这种联合用药的增强作用,但对于象绿脓杆菌等所致的严重的危及生命的感染,应当考虑联合用药。由于这两种药物具有物理不相容性,故在使用推荐剂量时应分开用药。 特殊用药指导 脑膜炎:婴儿及儿童细菌性脑膜炎,开始治疗剂量每千克体重100 毫克(不超过4 克),每日一次,一旦确认了致病菌及药敏试验结果,则可酌情减量,以下疗程已被证实是有效的:脑膜炎奈瑟氏菌 4 天,流感嗜血杆菌 6天,肺炎链球菌 7 天。莱姆病:儿童及成人按体重50 毫克/千克,最大剂量2 克,每日一次,共14 天。淋病:治疗淋病(产青霉素酶及不产青霉素酶菌株)罗氏芬?的推荐剂量为肌肉注射250 毫克单剂。术前预防性用药:预防污染
头孢曲松钠结晶过程研究
天津大学 硕士学位论文 头孢曲松钠结晶过程研究 姓名:潘杰 申请学位级别:硕士 专业:化学工程 指导教师:王静康 20040101
中文摘要 头孢曲松钠(CeftriaxoneSodiujl】)足第三代头孢菌素中具有长效作用的抗q二囊。随着头孢1{{1松铺在国内抗感染药物市场上地位的提高,对于其质量提出了更高的要求。采用溶析结晶工艺,对头孢曲松钠进行精制分离,可以明显的提高其质量。因此,本文对头孢益松铺在水一丙酶体系中的溶析结晶过程进行了较为系统的研究,其中包括结晶热力学、结晶动力学、结晶工艺过程三个方面。 利用失重法测定了不同温度下,头孢曲松钠在水一丙酮体系中的溶解度,用^卉方程回归了上述溶解度数据,回归出的计算值车Ⅱ实验值枢比较,吻合较好。利用激光法,测定了不同温度下头孢曲松钠在水一丙酮体系中的超溶解度,从而获撂了头孢曲松钠在水一丙酮钵系中的介稳区数据。著采用DSC测量了头孢曲松钠的脱水温度、熔化分解温度和熔化热。以上基础数据为结晶器的设计提供了操作依据。 结晶动力学数据是结晶器设计的重要参数。本文通过对头孢曲松钠的结晶工艺分析,对粒数衡算模型进行简化,对于具有聚结和破碎的头孢曲松钠的溶析结晶过程,采用生死函数法建立的聚结一破碎粒数衡算模型,采用间歇动态泫中的矩量变换法,对动力学进行研究。在此基础上对实验数据按最小二乘法进行多元线性回归得到了头孢曲松钠结晶的动力学方程参数,为过程模拟和工艺放大提供了可靠的实验依据和理论基础。 在热力学、动力学研究的基础上,依据收率、粒度分布和电镜照片等指标,结合一定的对比实验,对结晶工艺过程中的溶析剂、晶种的加入、溶析剂的加入速率、搅拌速率以及结晶温度、养晶时间等进行了优化,得到了较佳的工艺条件。 关键词:头孢曲松钠:溶析结晶:结晶热力学:介稳区:结晶动力学:DSC
各种皮试液配制方法
各种皮试液配制方法 Final revision by standardization team on December 10, 2020.
各种皮试液的配制方法 一、青霉素皮试药液配制方法: 青霉素1瓶80万u,注入4ml生理盐水,则1ml含20万u 取,加生理盐水至1ml,则1ml含2万u 取,加生理盐水至1ml,则1ml含2000u 取,加生理盐水至1ml,则1ml含500u,即成青霉素皮试液 皮内注射含50 u 二、头孢唑啉钠皮试液的配制方法: 头孢唑啉钠1瓶0.5g,加5ml生理盐水溶解 (每ml含100000ug ) 取上液加生理盐水配成1ml。(每ml含10000ug) 取上液加生理盐水配成1ml。(每ml含1000ug) 取上液加生理盐水配成1ml即为皮试液。(每ml含500ug) 取头孢唑啉钠皮试液(含50ug)作皮内注射,观察20分钟,判断试验结果三、头孢曲松钠皮试液的配制方法: 头孢曲松钠1瓶1g,加入生理盐水5ml,充分溶化,(每ml含200mg)
取上液,加生理盐水配成1ml(每ml含20mg) 取上液,加生理盐水配成1ml,(每ml含2mg) 取上液,加生理盐水配成1ml即为皮试液(每ml含500μg) 取头孢曲松钠皮试液(含50μg)作皮内注射,观察20分钟,判断试验结果 四、头孢硫咪皮试液的配制方法: 头孢硫咪1瓶0.5g,加5ml生理盐水溶解 (每ml含100000ug ) 取上液加生理盐水配成1ml。(每ml含10000ug) 取上液加生理盐水配成1ml。(每ml含1000ug) 取上液加生理盐水配成1ml即为皮试液。(每ml含500ug) 取头孢硫咪皮试液(含50ug)作皮内注射,观察20分钟,判断试验结五、头孢噻肟钠皮试液的配制方法: 头孢噻肟钠1瓶1克,加入生理盐水5ml,充分溶化,(每ml含200mg)取上液,加生理盐水配成1ml(每ml含20mg) 取上液,加生理盐水配成1ml,(每ml含2mg) 取上液,加生理盐水配成1ml即为皮试液(每ml含500μg)
头孢的研究综述
有关头孢的综述 内容摘要:头孢菌素类抗菌药物因具有抗菌作用强、临床疗效高、耐青霉素酶、毒性低、过敏反应较青霉素少等优点,经过半个多世纪的发展,头孢菌素类抗生素在临床上得到广泛运用,随着头孢的广泛运用,越来越引起其在医学界乃至全社会的关注。本文主要介绍了头孢的简介、发展历史及其分类、作用机理、临床用途、使用原则等。头孢简介:头孢是头孢类抗菌药的总称,头孢菌素类(Cephalosporins)是以冠头孢菌培养得到的天然头孢菌素C作为原料,经半合成改造其侧链而得到的一类抗生素。常用的约30种。在抗生素市场中,头孢类抗生素占据着较大的份额,而其相关中间体也连带着表现出可观的市场潜力。头孢类抗生素中销量最大的品种有头孢曲松钠、头孢唑啉钠、头孢噻肟、头孢三嗪、头孢哌酮和头孢呋辛(酯)等,相应的中间体包括7-ACA、7-ADCA、GCLE、氨噻肟酸、AE-活性酯、三嗪环、四氮唑乙酸、甲巯四氮唑、HO-EPCP、甲氧胺盐酸盐、呋喃胺盐(SIMA)以及氯磺酸异氰酸酯等。 发展历史及其分类:1948年,意大利的Brotzu从撒丁岛海岸阴沟出口处分离到一株顶孢子霉(Cephalosporium acremonium);1956年,Newton和Abraham从顶孢子霉的培养液中分离出头孢菌素C。头孢菌素C虽然抗菌作用不强,但毒性远低于青霉素,对酸及青霉素酶稳定。1961年确定了头孢菌素C的结构,其母核为7-ACA。随着生产工艺的优化,1962年礼来公司已经能够生产工业用量的7-ACA,而7-ACA 作为合成头孢菌素类药物的起始原料,它的量产被看作是头孢菌素类
药物时代到来的标志。根据开发年代、对β-内酰胺酶的稳定性及对G-菌抗菌作用的不同,通常将头孢菌素类药物分为四代。 笫一代头孢菌素 第一代头孢菌素是60年代初开始上市的,本代抗生素中常用品种有头孢唑林、头孢氨苄、头孢拉定、头孢羟氨苄、头孢克罗等,其中除头孢唑林只能供注射外,其他的均可用于口服,也称口服头孢。头孢噻吩、头孢噻啶、头孢来星、头孢乙腈、头孢匹林等均已少用或不用。。从抗菌性能来说,对第一代头孢菌素敏感的菌主要有β-溶血性链球菌和其他链球菌、包括肺炎链球菌(但肠球菌耐药),葡萄球菌(包括产酶菌株)、流感嗜血杆菌、大肠杆菌、克雷伯杆菌、奇异变形杆菌、沙门菌、志贺菌等。不同品种的头孢菌素可以有各自的抗菌特点,如头孢噻吩对革兰阳性菌的抗菌作用较优,而头孢唑林则对某些革兰阴性菌有一定作用。但是,第一代头孢菌素对革兰阴性菌的β-内酰胺酶的抵抗力较弱,因此,革兰阴性菌对本代抗生素较易耐药。 第一代头孢菌素对吲哚阳性变形杆菌、枸橼酸杆菌、产气杆菌、假单胞菌、沙雷杆菌、拟杆菌、粪链球菌(头孢硫脒除外)等微生物无效。笫二代头孢菌素 第二代头孢菌素类药物多为20世纪70年代开发的产品,主要包括头孢孟多、头孢呋辛、头孢尼西和头霉素类药物头孢西丁等。第二代头孢菌素对革兰阳性菌的抗菌效能与第一代相近或较低,而对革兰阴性菌的作用较为优异,表现在: (l)抗酶性能强一些革兰阴性菌(如大肠杆菌、奇异变形杆菌等)
头孢曲松钠皮试液配制方法
头孢曲松钠皮试液配制方法针对目前第三代头孢菌素临床应用广泛,皮试液浓度及配制方法不统一,高过敏体质者在使用头孢菌素类药物之前要求用拟用品做皮试,为保障患者用药安全,在临床护理工作中总结出两种不同剂量的头孢曲松皮试液的配制方法。此方法简单易记,准确性较高,供同行们参考。 目前第三代头孢菌素广泛应用于临床,用青霉素G所作的皮试并不能测出所有对非青霉素G的其他青霉素类和头孢菌素类抗生素有特异免疫反应性的个体[1],若仅根据青霉素G过敏史或皮试阳性即武断地禁用其他青霉素类和头孢菌素类抗生素将使许多患者失去用药机会。高过敏体质者在使用头孢菌素类药物之前必须做皮试[2]。目前国内有关头孢菌素类药物皮试液浓度说法不一,而且头孢曲松皮试液配制方法教科书和药典均无记载。有的产品在说明书中要求用药前做皮试[3,4],并规定皮试液参考浓度为300~600 μg/ml。另有关文献报道,β-内酰胺类抗生素临床应用存在的一个大问题就是过敏反应,而过敏反应与用药剂量无关[5]。目前大多数医院临床所用皮试液浓度为 300~500 μg/ml,配制使用注射器有5 ml和1 ml,有的用5 ml注射器抽取药液 ml,其准确性难以肯定。为保障患者用药安全、避免医患纠纷,我科近几年在临床应用头孢菌素之前,应用拟用品皮试,选用的皮试液浓度为500 μg/ml。现将头孢曲松皮试液配置方法介绍如下。 1 材料与方法 材料方法
1.2.1 大剂量头孢曲松皮试液的配置第一步,在原粉针剂为1 g的头孢曲松钠中加入用5 ml注射器抽取的生理盐水4 ml,充分溶化,使浓度达到250 mg/ml。第二步,用1 ml注射器从上液中抽取 ml,加入100 ml生理盐水中,即成浓度为500 μg/ml的皮试液。 小剂量头孢曲松皮试液的配置第一步:在原粉针剂为1 g的头孢曲松钠中加入用5 ml注射器抽取的生理盐水4 ml,充分溶化,使每毫升浓度为250 mg/ml。第二步:用1 ml注射器从上液中抽取 ml,加生理盐水至1 ml,使其浓度为50 mg/ml。第三步:取 ml,加生理盐水至1 ml,使其浓度为5 mg/ml。第四步:取 ml,加生理盐水至1 ml,即成浓度为500 μg/ml的皮试液。 注意事项 (1)每次需抽动皮试针管活塞使针管腔内有一小气泡,然后弹动皮试针管,使气泡在针管腔内倒转4~5周将药液混匀,确保皮试液的剂量准确[6]。 (2)为减少误差,配制皮试液时必须用1 ml注射器。 (3)做皮试前要询问有无青霉素、头孢菌素类药物过敏史,并备好盐酸肾上腺素等急救药物。
注射用抗菌药物用法用量
注射用抗菌药物用法用量 1.注射用阿莫西林钠克拉维酸钾(5:1)成人与12岁以上得儿童常 用剂量:每8小时一次,每次1、2克;严重感染者:科增加至每6小时一次,每次1、2克。12岁以下得儿童按体重一次30mg/kg,一日3-4次(新生儿一日2-3次)。一日最大剂量用至4、8g。 2.美洛西林钠粉针肌内注射临用前加灭菌注射用水溶解,静脉注 射通常加入5%葡萄糖氯化钠注射液或5%~10%葡萄糖注射液溶解后使用。成人一日2~6g,严重感染者可增至8~12g,最大可增至15g。儿童,按体重一日0、1~0、2g/kg,严重感染者可增至0、3g/kg; 肌内注射一日2~4次,静脉滴注按需要每6(8小时一次,其剂量根据病情而定,严重者可每4~6小时静脉注射一次)。 3.美洛西林钠舒巴坦钠针(4:1)成人剂量:每次2、5~3、75g(美洛 西林2、0~3、0g、舒巴坦0、5~0、75g)(每次2~3瓶),每8小时或12小时一次,疗程7~14天。1~14岁儿童及体重超过3Kg得婴儿,每次给药75mg/Kg体重,每日2~3次。体重不足3Kg者,每次75mg/Kg体重,每日2次。每天最高剂量不宜超过15g。 4.注射用哌拉西林钠舒巴坦钠(4:1)成人每次2、5g或5g(即哌拉西 林2g或4g舒巴坦0、5g或1g),每8小时一次。肾功能不全者酌情调整剂量。疗程:7~14天。最大用量不得超过12克/日(舒巴坦最大推荐剂量4克/日)。 5.注射用萘夫西林钠成人:一般感染,一次2-4g/日;重度感染,4-6 g/日。儿童:每日按体重50-100mg/kg,分3-4次。新生儿一般不主
张用。一日最大剂量用至6g。 6.注射用磺苄西林钠中度感染成人一日剂量8g,重症感染或铜 绿假单胞菌感染时剂量需增至一日20g,分4次静脉给药;儿童根据病情每日剂量按体重80~300mg/kg,分4次给药。一日最大剂量用至20g。 7.苯唑青霉素针成人每次1-2g,溶于100ml输液中滴注0、5-1h, 每日3-4次。小儿按体重每日50-100mg/kg,分次给予。肌注:每次1g,每日3-4次。一日最大剂量用至8g。 8.苄星青霉素针长效青霉素,主要用以预防风湿热,治疗各期梅毒, 也可用以控制链球菌感染得流行。不能代替青霉素G用于治疗重症急性感染。临用前用适量灭菌注射用水制成混悬液,肌内注射,一次60万U~120万U,2~4周一次。小儿肌注每次30万U~60万U,2~4周一次。 9.五水头孢唑啉钠不宜用于中枢神经系统感染、淋病与梅毒。成 人常用剂量:一次0、5~1g,一日2~4次,严重感染可增加至一日6g,分2~4次静脉给予。儿童常用剂量:一日50~100mg/kg,分2~3次静脉缓慢推注,静脉滴注或肌内注射。一日最大剂量用至6g。 10.注射用头孢硫脒成人一次2g,一日2-4次;小儿按体重一日 50mg-100mg/kg,分2-4次给药。一日最大剂量用至8g。 11.头孢呋辛钠针成人:大多数感染可肌肉注射或静脉注射本品 治疗,每次750mg,每日3次;对于较严重得感染,剂量应增至每次 1、5g,每日3次,静脉注射给药;如果需要,肌肉注射或静脉注射得
头孢曲松钠皮试液配制方法
头孢曲松钠皮试液配制方法 针对目前第三代头孢菌素临床应用广泛,皮试液浓度及配制方法不统一,高过敏体质者在使用头孢菌素类药物之前要求用拟用品做皮试,为保障患者用药安全,在临床护理工作中总结出两种不同剂量的头孢曲松皮试液的配制方法。此方法简单易记,准确性较高,供同行们参考。 目前第三代头孢菌素广泛应用于临床,用青霉素G所作的皮试并不能测出所有对非青霉素G的其他青霉素类和头孢菌素类抗生素有特异免疫反应性的个体[1],若仅根据青霉素G过敏史或皮试阳性即武断地禁用其他青霉素类和头孢菌素类抗生素将使许多患者失去用药机会。高过敏体质者在使用头孢菌素类药物之前必须做皮试[2]。目前国内有关头孢菌素类药物皮试液浓度说法不一,而且头孢曲松皮试液配制方法教科书和药典均无记载。有的产品在说明书中要求用药前做皮试[3,4],并规定皮试液参考浓度为300~600 μg/ml。另有关文献报道,β-内酰胺类抗生素临床应用存在的一个大问题就是过敏反应,而过敏反应与用药剂量无关[5]。目前大多数医院临床所用皮试液浓度为 300~500 μg/ml,配制使用注射器有5 ml和1 ml,有的用5 ml注射器抽取药液0.04 ml,其准确性难以肯定。为保障患者用药安全、避免医患纠纷,我科近几年在临床应用头孢菌素之前,应用拟用品皮试,选用的皮试液浓度为500 μg/ml。现将头孢曲松皮试液配置方法介绍
如下。
1 材料与方法 1.1 材料75%酒精、棉签、头孢曲松1支(上海罗氏制药有限公司生产,批号SH0693)、生理盐水1瓶(石家庄四药有限公司生产,批号050628442)、5 ml 和1 ml注射器(生产许可证:鲁食药监械生产许20050048号,标准号:GB15810-2001,通过ISO9001质量认证)。 1.2 方法 1.2.1 大剂量头孢曲松皮试液的配置第一步,在原粉针剂为1 g的头孢曲松钠中加入用5 ml注射器抽取的生理盐水4 ml,充分溶化,使浓度达到250 mg/ml。第二步,用1 ml注射器从上液中抽取0.2 ml,加入100 ml生理盐水中,即成浓度为500 μg/ml的皮试液。 1.2.2 小剂量头孢曲松皮试液的配置第一步:在原粉针剂为1 g的头孢曲松钠中加入用5 ml注射器抽取的生理盐水4 ml,充分溶化,使每毫升浓度为250 mg/ml。第二步:用1 ml注射器从上液中抽取0.2 ml,加生理盐水至1 ml,使其浓度为50 mg/ml。第三步:取0.1 ml,加生理盐水至1 ml,使其浓度为5 mg/ml。第四步:取0.1 ml,加生理盐水至1 ml,即成浓度为500 μg/ml的皮试液。
注射用头孢曲松钠说明书--泛生舒复
注射用头孢曲松钠说明书 【药品名称】 通用名称:注射用头孢曲松钠 商品名称:泛生舒复 英文名称:Ceftriaxone Sodium for Injection 汉语拼音:Zhusheyong Toubaoqusongna 【成份】本品主要成份为头孢曲松钠。 化学名称为:(6R ,7R )-7-[[(2-氨基-4-噻唑基)(甲氧亚胺基)乙酰]氨基]-8-氧代-3[[(1,2,5,6-四氢-2甲基-5,6-二氧代-1,2,4-三嗪-3-基)硫代]甲基]-5-硫代-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸二钠盐三倍半水合物 化学结构式: 分子式:C 18H 16N 8Na 2O 7S 3?3 1/2 H 2O 分子量:661.59 Cas No :74578-69-1 本品辅料:无任何辅料。 【性状】本品为白色或类白色结晶性粉末,无臭。在水中易溶,在甲醇中微溶,在三氯甲烷或乙醚中几乎不溶。 【适应症】本品适用于敏感菌所致的下列感染,如:脓毒血症,脑膜炎,播散性莱姆病(早、晚期),腹部感染(腹膜炎、胆道及胃肠道感染),骨、关节、软组织、皮肤及伤口感染,免疫机制低下病人之感染,肾脏及泌尿道感染,呼吸道感染,尤其是肺炎、耳鼻喉感染,生殖系统感染,包括淋病,术前预防感染。 【规格】按C18H 18N 8O 7S 3计算 1.0g 肌肉注射:配有1安瓿装2ml 的1%盐酸利多卡因注射液 静脉注射:配有1安瓿装5ml 或10ml 的灭菌注射用水 【用法用量】 用药方法:配制后的溶液应立刻使用。 肌肉注射:本品0.25克或0.5克溶于1%利多卡因注射液2毫升中,1克溶于3.5毫升中用于肌肉注射,以注射于相对大些的肌肉为好,不主张在一处的肌肉注射1克以上剂量。 利多卡因溶液绝对不能用于静脉注射。 静脉注射:本品0.25克或0.5克溶于5毫升灭菌注射用水中,1克溶于10毫升中用于静脉注射,注射时间不能少于2~4分钟。 静脉滴注:静脉滴注时间至少要30分钟,本品2克溶于40毫升以下其中一种无钙的静脉注射液中:如氯化钠溶液,0.45%氯化钠+2.5%葡萄糖注射液,5%葡萄糖,10%葡萄糖,5%葡萄糖加6%葡聚糖,6~10%羟乙基淀粉静脉注射液,灭菌注射用水等,由于可能会产生药物 C H 3 N O N N N N C H 3 N a N S H 2 N O O H 2 O 3 1 2 ,
头孢曲松钠结晶过程研究与实践
史上最快最全的网络文档批量下载批量上传,尽在: https://www.360docs.net/doc/aa4369336.html,/item.htm?id=9176907081 头孢曲松钠结晶过程研究与实践 王道社,李丽,王青 (山东鲁抗医药股份有限公司,山东济宁272021) WANG Dao-She,LI Li,WANG Qing (Shandong Lu Kang Pharmaceutical CO.LTD, Shandong Jining,272021) 摘要:通过对头孢曲松钠结晶过程中的机理,分析影响结晶的主要因素并有目的的予以改进,在保证理化指标合格的同时,有效改进产品的流动性,满足分装需要。 关键词:头孢曲松钠;溶媒结晶;流动性; 头孢曲松钠作为第三代头孢的代表产品,在国际国内市场有极为广阔的市场。该产品自1984年获准上市以来,以其确切的疗效,迅速在抗感染药物市场掀起风潮。尤其是2000年后,国内制药厂家的加入使竞争白热化,曲松的产量、销量逐步上升,但销售价格逐渐下降,逐渐由高价位药品成为大家接受的普药产品,2007年头孢曲松仅国内销量达到2000吨以上,位居头孢类产品的第一位,在残酷的竞争形势下,保证和提高产品质量是确保企业持续发展的前提。 鲁抗于2003年开始进行头孢曲松的生产,贯通了头孢曲松钠无菌原料药的大生产,改变了靠进口或外购其他厂家原料药的历史。但是自投产之初,质量问题就一直伴随着生产,突出表现为部分产品的流动性不能满足制剂分装的要求,通过研究发现,流动性与结晶工艺密切相关,结晶过程中的控制成为车间解决产品流动性,必须研究和解决的问题。本文的主要内容在于总结曲松流动性质量攻关中摸索出的一些做法,希望对类似产品生产有所帮助。一、结晶工艺改进前头孢曲松钠质量状况: 鲁抗在开始进行头孢曲松钠的生产后,头孢曲松无菌粉各项理化指标与进口样品及外购样品比较,没有明显差异,部分关键指标如聚合物,含量等较其他厂家略有优势。现以2007年4-5月份自产的头孢曲松钠与其它样品几项主要指标情况进行对比,结果如表一。 表一:2007年自产头孢曲松钠与外购头孢曲松钠主要指标对比 项目2005药典标准自产曲松钠外购曲松钠 含量90.0-95.0 93.0±0.5 92.6±0.9 聚合物0.1-0.7 0.2±0.11 0.3±0.11
皮试液配制方法大全
《皮试液配制方法大全》 1、青霉素80万U/瓶(160万U/瓶):80万青霉素加生理盐水溶解至4ml(8ml);(20万U/ml) 取上液0.1ml+生理盐水至1ml;(2万U/ml) 取上液0.1ml+生理盐水至1ml;(2千U/ml) 取上液0.25ml+生理盐水至1ml;(500U/ml) 取上液0.1ml作皮试(即50U) 2、美洛西林舒巴坦钠1.25g/瓶以上所需药物加生理盐水溶解至5ml;(250mg/ml) 取上液0.1ml+生理盐水至1ml;(25mg/ml) 取上液0.1ml+生理盐水至1ml;(2.5mg/ml) 取上液0.2ml+生理盐水至1ml;(0.5mg/ml) 取上液0.1ml作皮试(即0.05mg) 皮试结果判断同青霉素。 3、氨苄西林钠氯唑西林钠2g/瓶以上所需药物加生理盐水溶解至 8ml;(250mg/ml) 取上液0.1ml+生理盐水至1ml;(25mg/ml) 取上液0.1ml+生理盐水至1ml;(2.5mg/ml) 取上液0.2ml+生理盐水至1ml;(0.5mg/ml) 取上液0.1ml作皮试(即0.05mg) 皮试结果判断同青霉素。 4、氨苄西林1g/瓶、氯唑西林1g/瓶、氨苄西林钠氯唑西林钠1g/瓶、阿洛西林舒巴坦钠1g/瓶: 以上所需药物加生理盐水溶解至4ml;(250mg/ml) 取上液0.1ml+生理盐水至1ml;(25mg/ml) 取上液0.1ml+生理盐水至1ml;(2.5mg/ml) 取上液0.2ml+生理盐水至1ml;(0.5mg/ml) 取上液0.1ml作皮试(即0.05mg) 皮试结果判断同青霉素。
5、阿莫西林舒巴坦钠1.5g/瓶、派拉西林舒巴坦钠1.5g/瓶以上所需药物加生理盐水溶解至6ml;(250mg/ml) 取上液0.1ml+生理盐水至1ml;(25mg/ml) 取上液0.1ml+生理盐水至1ml;(2.5mg/ml) 取上液0.2ml+生理盐水至1ml;(0.5mg/ml) 取上液0.1ml作皮试(即0.05mg) 皮试结果判断同青霉素。 6、美洛西林0.5g/瓶、派拉西林0.5g/瓶、氨苄西林0.5g/瓶以上所需药物加生理盐水溶解至2ml;(250mg/ml) 取上液0.1ml+生理盐水至1ml;(25mg/ml) 取上液0.1ml+生理盐水至1ml;(2.5mg/ml) 取上液0.2ml+生理盐水至1ml;(0.5mg/ml) 取上液0.1ml作皮试(即0.05mg) 皮试结果判断同青霉素。 7、长效西林(苄星青霉素)120万U/瓶: 长效西林+生理盐水5.8ml溶解;(20万U/ml) 取上液0.1ml+生理盐水至1ml;(2万U/ml) 取上液0.1ml+生理盐水至1ml;(2千U/ml) 取上液0.25ml+生理盐水至1ml;(500U/ml) 取上液0.1ml作皮试(即50U/0.1ml) 皮试结果判断同青霉素。 8、普鲁卡因: 普鲁卡因40mg/支,浓度为0.25%; 取0.125ml+生理盐水至1ml; 取上液0.1ml作皮试(即0.25mg) 皮试结果判断同青霉素。 9、先锋铋1g/瓶、头孢替唑1g/瓶: 以上所需药物加生理盐水溶解至4ml;(250mg/ml) 取上液0.1ml+生理盐水至1ml;(25mg/ml) 取上液0.1ml+生理盐水至1ml;(2.5mg/ml) 取上液0.2ml+生理盐水至1ml;(0.5mg/ml 500ug/ml) 皮试时取0.1ml(即50ug/0.1ml) 皮试结果判断同青霉素。
注射用头孢曲松钠他唑巴坦钠神经科专辑(内容)
一、头孢曲松简介 罗氏于1982首次在瑞士上市头孢曲松(商品名为Rocephin?,中文商品名为罗氏芬?),1994年进口产品进入中国市场,1997在上海罗氏制药有限公司进口分装的国产品罗氏芬?面世,迄今为止仍是唯一可以一天给药一次的长半衰期三 代头孢菌素。 罗氏芬?的产品定位:一天一次给药,最具药物经济学价值的抗生素(显著降低感染治疗和外科预防费用)。 头孢曲松具备以下诸多优点: ★抗菌谱广保证了卓越的疗效 对临床常见病菌,头孢曲松均有优良抗菌活性。 以下细菌对头孢曲松敏感: ▲革兰氏阳性需氧菌 金黄色葡萄球菌;凝固酶阴性葡萄球菌;无乳链球菌(β-溶血性,B族) ;(甲氧西林敏感)β-溶血性链球菌(非A、非B族);草绿色链球菌;化脓性链球菌(β-溶血性,A族) ;肺炎链球菌。 注:耐甲氧西林葡萄球菌,对包括头孢曲松在内的头孢菌素耐药。一般来说,粪链球菌、屎肠球菌、单核细胞增多性李斯德杆菌也对头孢曲松耐药。 ▲革兰氏阴性需氧菌 鲁氏不动杆菌;莫拉氏菌属(其他)*;硝酸盐阴性不动杆菌 (多为鲍曼氏菌)* 摩根杆菌;嗜水气单胞菌;淋球菌;粪产碱杆菌;脑膜炎奈瑟氏菌;粪产碱黄杆菌;多杀巴氏杆菌;类产碱杆菌;志贺氏邻单胞菌;伯氏包柔体;奇异变形杆菌;二氧化碳嗜纤维菌属;彭氏变形杆菌*;迪沃斯枸橼酸杆菌;普通变形杆菌;弗 劳地枸椽酸杆菌*;洋葱假单胞菌*;大肠杆菌;萤光假单胞菌*;产气肠杆菌*;假单胞菌属(其他)*;阴沟肠杆菌*;雷极氏普鲁菲登斯氏菌;杆菌属(其他)*; 普鲁菲登斯氏菌属(其他);杜克嗜血杆菌;伤寒沙门杆菌;流感嗜血杆菌;沙门杆菌属(非伤寒);副流感嗜血杆菌;粘质沙雷氏菌;海马槽哈夫尼亚菌;沙雷氏菌属(其他);催产克雷白氏菌;志贺氏菌属;肺炎克雷白氏菌**;孤菌属;卡他摩拉克氏菌(卡他布兰汉氏菌);结肠炎耶尔森杆菌;奥斯陆摩克拉氏菌;耶尔森杆菌属(其他); * 这些种类中的一些分离菌对头孢曲松耐药,主要是由于产生染色体编码的β- 内酰胺酶 所致。 ** 这些种类中的一些分离菌的耐药,是由于产生广谱的、质粒传递的β-内酰胺酶所致。注:以上细菌的许多菌株对其他多种抗生素耐药,如氨基-和酰脲-青霉素,老一代的头孢菌 素和氨基糖甙抗菌素等,但对头孢曲松敏感。梅毒螺旋体在体外和动物试验中对头孢曲松敏感,临床调查显示,一期和二期梅毒对头孢曲松反应良好,绿脓假单胞菌除一小部分外,对 头孢曲松耐药。 ▲厌氧菌 类杆菌属(胆汁敏感)*;梭状芽胞杆菌属(不包括产气荚膜梭状芽胞杆菌群) 核梭杆菌;梭杆菌属(其他);厌氧加夫基氏球菌(消化球菌);消化链球菌属 * 这些种类中的一些分离菌由于产生β-内酰胺酶而对头孢曲松耐药。 注:产β-内酰胺酶的类杆菌属的某些菌种(值得注意的是:脆弱类杆菌)对头孢曲松耐药,难辨梭状芽胞杆菌对头孢曲松耐药。
头孢曲松钠皮试液配制方法
头孢曲松钠皮试液配制 方法 Document serial number【UU89WT-UU98YT-UU8CB-UUUT-UUT108】
头孢曲松钠皮试液配制方法针对目前第三代头孢菌素临床应用广泛,皮试液浓度及配制方法不统一,高过敏体质者在使用头孢菌素类药物之前要求用拟用品做皮试,为保障患者用药安全,在临床护理工作中总结出两种不同剂量的头孢曲松皮试液的配制方法。此方法简单易记,准确性较高,供同行们参考。 目前第三代头孢菌素广泛应用于临床,用青霉素G所作的皮试并不能测出所有对非青霉素G的其他青霉素类和头孢菌素类抗生素有特异免疫反应性的个体[1],若仅根据青霉素G过敏史或皮试阳性即武断地禁用其他青霉素类和头孢菌素类抗生素将使许多患者失去用药机会。高过敏体质者在使用头孢菌素类药物之前必须做皮试[2]。目前国内有关头孢菌素类药物皮试液浓度说法不一,而且头孢曲松皮试液配制方法教科书和药典均无记载。有的产品在说明书中要求用药前做皮试[3,4],并规定皮试液参考浓度为300~600 μg/ml。另有关文献报道,β-内酰胺类抗生素临床应用存在的一个大问题就是过敏反应,而过敏反应与用药剂量无关[5]。目前大多数医院临床所用皮试液浓度为 300~500 μ g/ml,配制使用注射器有5 ml和1 ml,有的用5 ml注射器抽取药液 ml,其准确性难以肯定。为保障患者用药安全、避免医患纠纷,我科近几年在临床应用头孢菌素之前,应用拟用品皮试,选用的皮试液浓度为500 μg/ml。现将头孢曲松皮试液配置方法介绍如下。 1 材料与方法 材料方法
1.2.1 大剂量头孢曲松皮试液的配置第一步,在原粉针剂为1 g的头孢曲松钠中加入用5 ml注射器抽取的生理盐水4 ml,充分溶化,使浓度达到250 mg/ml。第二步,用1 ml注射器从上液中抽取 ml,加入100 ml生理盐水中,即成浓度为500 μg/ml的皮试液。 小剂量头孢曲松皮试液的配置第一步:在原粉针剂为1 g的头孢曲松钠中加入用5 ml注射器抽取的生理盐水4 ml,充分溶化,使每毫升浓度为250 mg/ml。第二步:用1 ml注射器从上液中抽取 ml,加生理盐水至1 ml,使其浓度为50 mg/ml。第三步:取 ml,加生理盐水至1 ml,使其浓度为5 mg/ml。第四步:取ml,加生理盐水至1 ml,即成浓度为500 μg/ml的皮试液。 注意事项 (1)每次需抽动皮试针管活塞使针管腔内有一小气泡,然后弹动皮试针管,使气泡在针管腔内倒转4~5周将药液混匀,确保皮试液的剂量准确[6]。 (2)为减少误差,配制皮试液时必须用1 ml注射器。 (3)做皮试前要询问有无青霉素、头孢菌素类药物过敏史,并备好盐酸肾上腺素等急救药物。
