谷胱甘肽耗竭与微囊藻毒素-LR细胞毒性的关系初探

细胞毒性实验方案
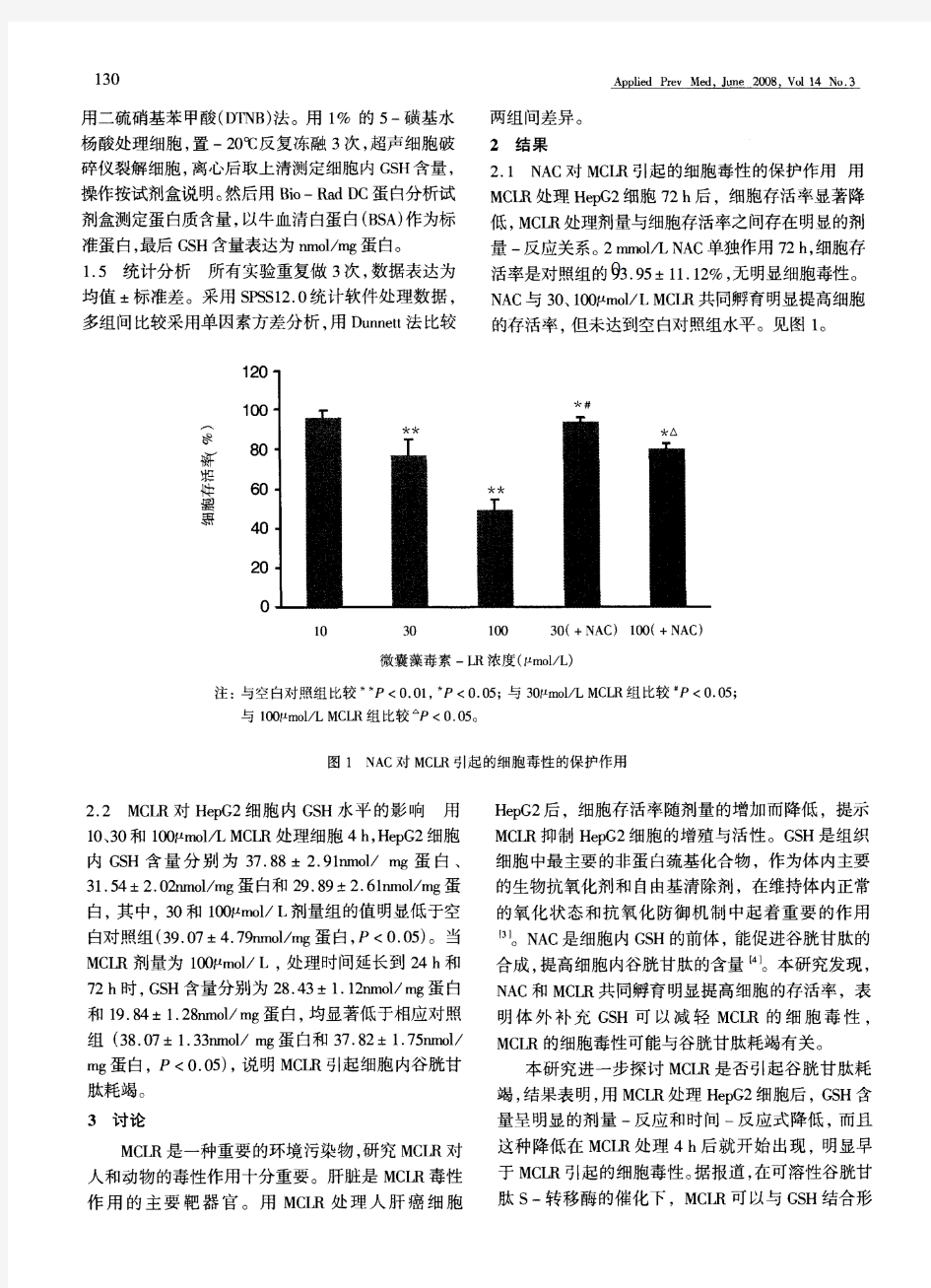
细胞毒性实验设计方案 1.准备材料:DMEM(高糖) 胰酶双抗(青霉素/链霉素)DAPI MTT(5mg/mL) DMSO PBS 4%多聚甲醛指甲油 6孔培养板 96孔培养板超薄载玻片培养瓶(25mL) 一包0.45μm滤膜 灭菌: 50mL,10mL,5mL离心管两种枪头 2.实验方案 本实验所用的材料为载药的通过二硫键桥连透明质酸的夹心二氧化硅 (SiO 2 -SS-HA/DOX),在高谷胱甘肽条件下,二硫键断裂,透明质酸脱离,同时 夹心二氧化硅中药物得以释放。本实验的目的为测定透明质酸修饰的夹心二氧化 硅(SiO 2-SS-HA/DOX)的细胞毒性。实验组为SiO 2 -SS-HA/DOX、SiO 2 -SS-HA、DOX, 空白对照组为纯细胞,分别采用HepG2人肝癌细胞为肿瘤细胞模型和L929成纤维 细胞为正常细胞模型。 采用HepG2人肝癌细胞为肿瘤细胞模型,实验组为SiO 2 -SS-HA/DOX、 SiO 2 -SS-HA、DOX,空白对照组为纯细胞。培养基中含有10% (v/v) FBS和1% (w/v) 双抗(青霉素/链霉素)。配制不同浓度的SiO 2-SS-HA/DOX、SiO 2 、HA、DOX药物载 体培养基溶液。 (1).以HepG2人肝癌细胞为肿瘤细胞模型: 培养基的配置:双抗 1% 血清12% DMEM 87% 具体操作步骤: 细胞的复活: ①将冻存于液氮中的细胞取出,迅速放入37℃温水中,使细胞快速溶解。 ②将悬浮的细胞移至离心管中,加5mL无血清培养基,1000rmp,5min离心去上清,再加5mL有血清培养基,转移至培养瓶中。(每次转移时,将之前的离心管洗涤,并用移液枪来回吸,使液体混合均匀。) ③将培养瓶放入培养箱中培养。 细胞的传代: 将0.25%的胰酶分装至小离心管中,每个管中2mL,冻存于-20℃,每次使用一管,避免反复冻融。 ①将培养瓶从培养箱中取出,盖子旋紧,喷75%的酒精放入超净台。 ②将培养液倒入废液缸,残留培养基用吸管吸干净,操作完成后,培养瓶口
细胞培养与病毒培养实验步骤
实验二传代细胞培养与病毒在传代细胞中的培养 一、实验目的 了解倒置显微镜的构造与使用,了解不同传代细胞的形态及接毒后的病变特征,掌握细胞的传代培养法、病毒接种法及收毒法。 二、常用细胞的种类 BHK-21:仓鼠肾传代细胞 PK-15:猪肾传代细胞 IBRS-2:猪肾传代细胞 Hela:人的子宫瘤细胞 Vero:非洲绿猴肾细胞 Marc-145:来源于Vero细胞 TK-143:人的胸苷激酶阴性细胞 Sf9:昆虫细胞 三、材料 1、100ml细胞瓶、吸管、吸球、96细胞培养板、加样器、枪头 2、BHK-21(baby hamster kidney)细胞
3、0.25%胰酶 4、生长液:含10%犊牛血清、200U/ml青、链霉素的DMEM 维持液:含2-5%犊牛血清、200U/ml青、链霉素的DMEM 5、伪狂犬病病毒液(PRV) 四、传代细胞培养的条件要求 1)细胞密度:2-3×105个/ml 2)pH围最适pH7.0-7.4,耐受pH6.6-7.8 3)培养温度 哺乳动物细胞一般为37℃ 昆虫细胞28-30℃ 五、常用细胞分散剂与作用原理 1、胰酶使精氨酸或赖氨酸的羧基和其他氨基酸的氨基之间的多肽链发生水解, 导致细胞间质水解而使细胞或组织块消化为分散的单个细胞。 2、乙二胺四乙酸二钠(EDTA):与二价钙、镁离子结合,从而使细胞分散。 3、灰色链丝菌酶:由灰色链丝菌提取的一种酶制剂,是蛋白酶、氨肽酶和羧肽 酶的混合物。
六、营养液 1、人工综合营养液 氨基酸、糖类、无机盐类、维生素、辅酶、嘌呤、嘧啶、辅助生长因子。2、血清 1)血清的种类 胎牛血清、新生犊牛血清、成年牛血清、马血清、鸡血清、兔血清、羊血清、人血清,其中以新生犊牛血清使用最为广泛。 2)血清的处理 无菌采集,过滤除菌。用前56℃灭活30min。 3)血清的作用 A、能提供细胞生存、生长和增生所必须的生长调节因子。 B、能补充基础培养液中没有或量不足的营养成分。 C、含有一些可供贴壁依赖型细胞在培养器皿表面贴附和铺展的生长基质成分。 D、有中和毒性物质保护细胞不受伤害的作用。 E、给培养液提供良好的缓冲系统。 F、提供蛋白酶抑制剂,保护细胞免受细胞释放的蛋白酶的损害。
细胞毒性检测方法总结!
细胞毒性检测方法总结! 细胞毒性(cytotoxic)是由细胞或者化学物质引起的单纯的细胞杀伤事件,不依赖于凋亡或坏死的细胞死亡机理。有时需要进行特定物质细胞毒性的检测,比如药物筛选。 细胞毒性检测主要是根据细胞膜通透性发生改变来进行的检测,常用以下几种方法: MTT、XTT法:利用线粒体内部酶的活性,可以将特定的四唑盐类进行转化,然后通过酶标仪进行检测 一.LDH的方法:通过检测细胞培养上清中LDH的酶活性,来检测细胞毒性 其它酶方法:如检测上清中碱性磷酸酶、酸性磷酸酶的活性等 细胞增殖能力分析试剂 原理:正常细胞代谢旺盛,其线粒体内的琥珀酸脱氢酶,可将四唑盐类物质(如MTT、XTT、WST-1等)还原为紫色的结晶状的物质,沉积在细胞周围,然后通过酶标仪读取OD值,从而检测到细胞增值状态 优点:1)快速:96孔培养板形式,可进行高通量检测。2)灵活:可直接通过显微镜观察,也可通过酶标仪进行定量检测。 二.荧光素发光法细胞生存能力检测 原理:腺苷酸激酶(AK)存在于所有真核和原核细胞的胞浆中,AK具有激活ADP 生成ATP。当细胞受损后,细胞膜发生破损,AK会释放到培养上清中。该试剂盒利用荧光素酶和荧光素在ATP作用下可以发光,通过化学发光仪可以定量进行检测。 特点: 1)简单、快速。2)板式检测,可进行高通量 。 三.LDH法细胞毒性检测 原理:LDH(乳酸脱氢酶)是一种稳定的蛋白质,存在于正常细胞的胞质中,一旦细胞膜受损,LDH即被释放到细胞外; LDH催化乳酸形成丙酮酸盐,和INT(四唑盐类)反应形成紫色的结晶物质,可通过500nm酶标仪进行检测。通过检测细胞培养上清中LDH的活性,可判断细胞受损的程度 特点:1)方法简单,安全,不使用放射性物质2)可进行高通量检测
CDC ADCC细胞毒性
1 Antibody-dependent cellular cytotoxicity (ADCC)抗体依赖的细胞介导的细胞毒性作用 In antibody-dependent cellular cytotoxicity (ADCC), Fc gamma receptors (FcγR or FCGR) on the surface of immune effector cells bind the Fc region of an antibody, itself specifically bound to a target cell. The cells that can mediate ADCC are nonspecific cytotoxic cells such as natural killer cells, macrophages, monocytes and eosinophils. Upon FCGR binding to the antibody, the FCGR ITAM is phosphorylated, which triggers the activation of the effector cell and the secretion of various substances (lytic enzymes, perforin, granzymes, TNF) that mediate the destruction of the target cell. The level of ADCC effector function is high for human IgG1 and IgG3, low for IgG2 and IgG4, and for these last two subclasses, the level of binding depends on the FCGR isotype and on the cell type. 2 Complement-dependent cytotoxicity (CDC) 补体依赖的细胞毒性作用 In complement-dependent cytotoxicity (CDC), the C1q binds the antibody and this binding triggers the complement cascade which leads to the formation of the membrane attack complex (MAC) (C5b to C9) at the surface of the target cell, as a result of the classical pathway complement activation.
细胞毒性药物配制方法及使用时注意事项
抗肿瘤药物的用药顺序及溶媒选择 原则 (1)药物相互作用原则 有的化疗药物之间会发生相互作用,从而改变药物的体内过程,可能影响疗效或毒性。 如顺铂影响紫杉醇的清除率,先用紫杉醇再用顺铂。 (2)刺激性原则 使用非顺序依赖性化疗药物时,应先用对组织刺激性较强的药物,后用刺激性小的药物。由于治疗开始时静脉尚未损伤,结构稳定性好,药业渗出机会少,药物对静脉引起的不良 反应较小如长春瑞滨和顺铂合用时,长春瑞滨刺激性强,宜先给药。 (3)细胞动力学原则 生长较慢的实体瘤处于增殖期的细胞较少,G0期细胞较多,先用周期非特异性药物杀 灭一部分肿瘤细胞,使肿瘤细胞进入增殖期再用周期特异性药物。顺铂和依托泊苷合用时,先用顺铂后用VP-16。 生长快的肿瘤先用周期特异性药物大量杀灭处于增殖周期的细胞,减少肿瘤负荷,随后用周期非特异性药物杀灭残存的肿瘤细胞。 用药顺序 1、联用顺铂化疗 化疗方案联用药物用药顺序原因 GP 吉西他滨先用GEM 顺铂会影响吉西他滨的体内过程,加重骨髓抑制。TP 紫杉醇先用PTX 顺铂对细胞色素P450酶有调节作用,可使PTX清除 率大约降低33%,产生更为严重的骨髓抑制 FP 5-FU 先用DDP 小剂量DDP能够增加细胞内蛋氨酸, 使细胞内活性叶酸生成增加, 从而增加5-FU的抗肿瘤作用。 PP 培美曲塞先用Alimta,30min后用顺铂说明书 2、联合长春新碱化疗 化疗方案联用药物用药顺序原因 CHOP 环磷酰胺先用VCR,6-8小时后在给CTX VCR具有同步化作用,使细胞停滞在M期,约6~8h后细胞同步进入G1期,再用CTX可增效 VCM 甲氨蝶呤先用VCR VCR阻止甲氨蝶呤从细 胞内渗出而提高细胞内浓度 VDLP 门冬酰胺酶先用VCR 合用加重神经系统血液系统毒性,先于门冬12~24小时给药 3、甲氨蝶呤 化疗方案联用药物用药顺序原因 CMF 5-FU 用MTX4~6h后用5-FU 序贯抑制 MTX----二氢叶酸还原酶抑制 剂 5-FU-----胸腺嘧啶合成酶抑制剂
USP87细胞毒性体外试验
87 BIOLOGICAL REACTIVITY TESTS, IN VITRO The following tests are designed to determine the biological reactivity of mammalia n cell cultures followi ng con tact with the elastomeric plastics and other polymeric materials with direct or in direct patie nt con tact or of specific extracts prepared from the materials under test. It is essential that the tests be performed on the specified surface area. When the surface area of the specime n cannot be determ in ed, use 0.1 g of elastomer or 0.2 g of plastic or other material for every mL of extraction fluid. Exercise care in the preparation of the materials to preve nt con tam in ati on with microorga nisms and other foreign matter. Three tests are described (i.e., the Agar Diffusi on Test , the Direct Con tact Test and the Elution Test ).1 The decision as to which type of test or the number of tests to be performed to assess the potential biological response of a specific sample or extract depends upon the material, the final product, and its inten ded use. Other factors that may also affect the suitability of sample for a specific use are the polymeric composition; processing and cleaning procedures; con tact ing media; in ks; adhesives; absorptio n, adsorptio n, and permeability of preservatives; and con diti ons of storage. Evaluatio n of such factors should be made by appropriate additi onal specific tests before determining that a product made from a specific material is suitable for its in ten ded use. Materials that fail the in vitro tests are can didates for the in vivo tests described in Biological Reactivity Tests, In Vivo 88 . USP R EFERENCE S TANDARDS 11 —USP High-Density Polyethylene RS. USP Positive Bioreaction RS. Cell Culture Preparation —Prepare multiple cultures of L-929 (ATCC cell line CCL 1, NCTC clone 929; alternative cell lines obtained from a standard repository may be used with suitable validation) mammalian fibroblast cells in serum-suppleme nted minimum esse ntial medium hav ing a seedi ng den sity of about 10 5 cells per mL. Incubate the cultures at 37 1 一in a h±midified
第十九章补体参与的反应及补体测定ComplementMediated
第十九章补体参与的反应及补体测定 Complement Mediated Reactions and Assays of Complement 第一部分目的要求和教学内容 一、目的要求 掌握:免疫溶血试验及CH,。测定的原理及意义;熟悉:补体参与的反应试验类型、补体依赖的细胞毒试验的原理、旁路途径溶血活性测定;了解:补体结合试验和免疫黏附试验的原理、C4和B因子活性测定的原理。 二、教学内容 1.补体参与的反应:免疫溶血试验,补体结合试验,补体依赖的细胞毒试验,免疫黏附试验。 2.补体的测定:补体活性的测定,补体含量的测定,补体测定的临床意义。 第二部分测试题 一、选择题 (一)单项选择题(A型题) 1.溶血素效价滴定判定的温度和时间是 A.37℃、30min B.4℃、30min C.37℃、15min D.40℃、30min E.56℃、30min 2.在补体连锁反应中最终形成的攻膜复合体是 A.C5b6789 B.C4b2a3b C.C4b2b D.C3bBb E.C3b4b 3. 下列哪项试验没有补体参加 A.CH试验 B.CDC试验 C.溶血空斑试验 D.ADCC试验 E.Raji细胞试验 4.补体结合试验中所用补体是哪种动物血清 A.马血清 B.绵羊新鲜血清 C.豚鼠新鲜血清 D.大白鼠新鲜血清 E.山羊新鲜血清
5.下列哪项试验不能用于补体缺陷的过筛诊断 A.CDC式验 B.CH50试验 C.血清C3含量测定 D.血清Cl含量测定 E.C4溶血活性试验 6.B因子溶血活性测定中,在缓冲液中加.),.EGTA是为了螯合反应体系中的A.Mg2+离子 B.Ca2+离子 C.zn2+离子 D.Fe3+离子 E.P3+离子 7.在单个补体成分溶血活性测定中,用氨水处理是为了去除哪个补体成分A.C1 B.C2 C.C4 D.C5 E.C3 8.检测免疫小鼠脾细胞分泌到细胞外的抗SRBC抗体的试验是 A.CH50试验 B. CFT C,APH50测定 D.B因子活性测定 E.溶血空斑试验 9.利用溶血反应作为指示系统,判断抗原抗体是否相对应的试验是 A.CHs50试验 B.CFT C.APH50测定 D.B因子活性测定 E.抗补体试验 10.补体经典途径的最重要激活物是 A.特异性抗原 B.特异性抗体 C.抗原抗体复合物 D.细菌脂多糖 E、酵母多糖 11.正常血清中,补体含量最低的是 A.C1q B. C5aR C. C1rR D.Df E.C1INH 12.正常血清中,补体含量最高的是 A.C1 B.C2 C.C3
细胞毒性实验方案上课讲义
细胞毒性实验设计方案 1. 准备材料:DMEM高糖)胰酶双抗(青霉素/链霉素)DAPI MTT(5mg/mL) DMSO PBS 4% 多聚甲醛指甲油6 孔培养板 96孔培养板超薄载玻片培养瓶(25mL) 一包0.45 pm滤膜 灭菌:50mL , 10mL 5mL离心管两种枪头 2. 实验方案 本实验所用的材料为载药的通过二硫键桥连透明质酸的夹心二氧化硅 (SiO^SS-HA/DOX ,在高谷胱甘肽条件下,二硫键断裂,透明质酸脱离,同时夹心二氧化硅中药物得以释放。本实验的目的为测定透明质酸修饰的夹心二氧化硅(SiO2-SS-HA/DOX 的细胞毒性。实验组为SiO2-SS-HA/DOX SQ2-SS-HA、DOX 空白对照组为纯细胞,分别采用HepG2人肝癌细胞为肿瘤细胞模型和L929成纤维细胞为正常细胞模型。 采用HepG2人肝癌细胞为肿瘤细胞模型,实验组为SiO2-SS-HA/DOX SQ2-SS-HA、DOX空白对照组为纯细胞。培养基中含有10%(v/v) FBS和1%(w/v) 双抗(青霉素/链霉素)。配制不同浓度的SQ2-SS-HA/DOX SiO2、HA DOX药物载体培养基溶液。 (1).以HepG2人肝癌细胞为肿瘤细胞模型: 培养基的配置:双抗1% 血清12% DMEM 87% 具体操作步骤: 细胞的复活: ①将冻存于液氮中的细胞取出,迅速放入37°C温水中,使细胞快速溶解。 ②将悬浮的细胞移至离心管中,力卩5mL无血清培养基,1000rmp,5min离心去上清,再加5mL有血清培养基,转移至培养瓶中。(每次转移时,将之前的离心管洗涤,并用移液枪来回吸,使液体混合均匀。) ③将培养瓶放入培养箱中培养。 细胞的传代: 将0.25%的胰酶分装至小离心管中,每个管中2mL冻存于-20 C,每次使用一管,避免反复冻融。 ①将培养瓶从培养箱中取出,盖子旋紧,喷75%勺酒精放入超净台。
细胞增殖毒性实验步骤cck8知识讲解
如有侵权请联系网站删除 细胞增殖-毒性实验步骤 1、细胞传代、细胞计数、细胞增殖-毒性实验步骤: 实验准备:用75%酒精擦生物安全柜台面2遍,紫外线消毒30分钟(枪、枪头、 15ml及50ml离心管、剪刀、封口膜、记号笔、打火机、酒精灯、培养瓶),复温实验所需试剂[细胞培养液(DMEM、1640)、磷酸缓冲盐溶液(PBS、胰酶(0.25% Trypsin-EDT)胎牛血清(FBS、双抗],所有的试剂、仪器放入生物安全柜前要用酒精喷洒消毒。显微镜下看细胞生长状态,有无污染。 1、倒去培养瓶内的培养液; 2)加入PBS 2ml洗涤培养瓶内细胞2次; 3)加入胰酶500ul/0.5ml 2?10min (具体时间因细胞而异,可在显微镜下看是否贴壁,必要时轻拍培养瓶促使细胞脱落); 4)加入含10%FBS勺培养液1?1.5ml[培养液:胰酶=(2?3):1]中和胰酶;5)轻轻吹打成单细胞悬液,吹打力度以不起气泡为宜; 6)将单细胞悬液吸入10?15ml离心管中,低速离心800rpm 3分钟,倒去上清 液; 7)加入含10%FBS ffl胞培养液1?2ml吹打悬浮细胞至单细胞悬液; 8)吸取20ul细胞悬液(10ul细胞悬液+10ul台盼兰液:给坏死细胞染色,判断细胞活力)至细胞计数板,进行细胞计数; CCK-8实验: 9)在96孔板中,给每孔加100卩L (约7000个)的细胞悬液,将培养板放在培养箱预培养 24-72 小时(37 C,5%CO2,使细胞贴壁; 10)向培养板中加入10卩L不同浓度(5、10、20、40、80、160ug/ml)的待测药物; 11)将培养板在培养箱孵育一段适当的时间24小时(例如:6、12、24或48小时)(药物起作用); 注意:如果待测物质有氧化性或还原性的话,可在加CCK之前更换新鲜培养基(除去培养基,并用培养基洗涤细胞两次,然后加入新的培养基),去掉药物影响。 当然药物影响比较小的情况下,可以不更换培养基,直接扣除培养基中加入药物后的空白吸收即可。 12)向每孔加入10让(约10%)CCK-8溶液(注意不要再孔中生成气泡,它们会影响OD值的读数); 13)将培养板在培养箱内孵育1?4小时(半小时测一次OD值); 14)用酶标仪测定在450nm处的吸光度。 精品资料
实验方案
实验方案 繁殖障碍类病毒病(PR、PP、PRRS)弱毒疫苗的研制 1. 病毒的克隆 1.1 细胞制备原种细胞系(MARC-145,IBRS-2)复苏、传代 1.1.1复苏 (a)取液氮冻存的Marc-145(34代)细胞1支,立即置37℃水浴中不断摇晃,待融化后,将细胞倒入25mL的克氏瓶中,加入含10%BCS的MEM生长液,37℃培养,5-6h后换液以倾去死亡细胞, 37℃培养。待长成单层后,进行传代培养。 (b)取液氮冻存的Marc-145(34代)细胞1支,立即投入37-38℃水浴中,待融化后(约1min),室温下在5min内用25℃左右的血清营养液稀释至原体积的4倍,500r/min离心10min,弃上清,加新鲜营养液悬浮细胞,并将细胞转入25mL的克氏瓶中补足营养液,37℃培养。 1.1.2传代 取长满单层后的细胞(约72h),倾去原来的营养液,用Hank’s液冲洗一次,加入0.25%的胰酶(或是0.5%的胰酶和0.04%EDTA的等量混合液),其加入量以能在细胞上形成1mm 厚的液层为宜。置室温或37℃温度中消化,当细胞层开始由瓶壁脱离时(眼观可见细胞面呈毛玻璃样,镜下观察可见细胞圆缩,间隙增大,即将脱落),将消化液倾出,加入少量营养液,轻晃冲洗细胞层后倾弃,再加入相同于原营养液量的新营养液,以大口径吸管充分吹打,直到细胞完全分散,再加同量营养液,吹打数次后即可分瓶。(为便于吹打和分散细胞,开始时可以少加一些营养液,吹打分散后再逐步追加营养液至需量。)其分种率为1:2或1:3,37℃培养。 1.2 病毒培养种毒(PRRSV[欧美株]、PRV、PPV)复壮、病毒增殖 1.2.1种毒复壮(PRRSV[欧美株]、PRV) (1) 取刚长成单层的Marc-145细胞,倾弃营养液后,加入不含血清的维持液[1%Gln,2%NaHCO3(7.5%),1%双抗的MEM],洗2-3遍,倾弃清洗营养液; (2) 接毒冻干毒种(原装量为2mL,湿毒1mL,保护剂1mL),以无血清MEM恢复为原装量,每瓶(100mL瓶)接毒1mL; (3) 吸附37℃吸附1h,其中每20min轻轻晃一次,以使接种毒液能与细胞层更好地接触以利病毒吸附。吸附1h后,倒出接种病毒液,再加入含3%BCS的维持液,置37℃培养。 (4) 收获每日观察细胞的CPE。接毒后24h、36h、48h各观察一次CPE,或根据CPE 的形成情况,适当缩短观察间隔时间,待细胞形成80%的CPE时,冻融三次后-20℃冻存。 1.2.2 病毒增殖 (1) 取刚长成单层的Marc-145细胞,倾弃营养液后,加入不含血清的维持液,洗2-3
细胞毒性实验方案
细胞毒性实验方案 Prepared on 22 November 2020
细胞毒性实验设计方案 1.准备材料:DMEM(高糖)胰酶双抗(青霉素/链霉素) DAPIMTT(5mg/mL)DMSOPBS4%多聚甲醛指甲油6孔培养板96孔培养板超薄载玻片培养瓶(25mL)一包μm滤膜 灭菌:50mL,10mL,5mL离心管两种枪头 2.实验方案 本实验所用的材料为载药的通过二硫键桥连透明质酸的夹心二氧化硅(SiO2-SS-HA/DOX),在高谷胱甘肽条件下,二硫键断裂,透明质酸脱离,同时夹心二氧化硅中药物得以释放。本实验的目的为测定透明质酸修饰的夹心二氧化硅(SiO2-SS-HA/DOX)的细胞毒性。实验组为SiO2-SS-HA/DOX、SiO2-SS-HA、DOX,空白对照组为纯细胞,分别采用HepG2人肝癌细胞为肿瘤细胞模型和L929成纤维细胞为正常细胞模型。 采用HepG2人肝癌细胞为肿瘤细胞模型,实验组为SiO2-SS-HA/DOX、SiO2-SS-HA、DOX,空白对照组为纯细胞。培养基中含有10%(v/v)FBS和1%(w/v)双抗(青霉素/链霉素)。配制不同浓度的SiO2-SS-HA/DOX、SiO2、HA、DOX药物载体培养基溶液。 (1).以HepG2人肝癌细胞为肿瘤细胞模型: 培养基的配置:双抗1%血清12%DMEM87% 具体操作步骤: 细胞的复活: ①将冻存于液氮中的细胞取出,迅速放入37℃温水中,使细胞快速溶解。 ②将悬浮的细胞移至离心管中,加5mL无血清培养基,1000rmp,5min离心去上清,再加5mL有血清培养基,转移至培养瓶中。(每次转移时,将之前的离心管洗涤,并用移液枪来回吸,使液体混合均匀。) ③将培养瓶放入培养箱中培养。 细胞的传代:
第四章 补体系统
第四章补体系统(Complement system) 19世纪人们在新鲜免疫血清中加入相应的细菌,无论进行体内或体外实验,均可以发现细菌的溶解,称之为免疫溶菌现象,如将免疫血清加热60℃,30min则可丧失溶菌能力。证明免疫血清中含有二种物质与溶菌现象有关。一种对热稳定的抗体,另一种对热不稳定的称为补体,单独的抗体或补体均不能引起细菌的溶解现象。 第一节补体系统的组成和理化性质 一、补体分子的组分和理化性质 补体分子是分别由肝细胞、巨噬细胞以及肠粘膜上皮细胞等多种细胞产生的,均为多糖蛋白,大多数电泳迁移率属α、γ球蛋白。 补体系统是由将近20多种血清蛋白组成的多分子体系,具有酶的活性和自我调节作用,它至少有两种不同的活化途径,其生物学意义不仅是抗体分子的辅助和增强因子,也具有独立的生物学作用,对机体的防御功能,免疫系统功能的调节以及免疫病理过程都发挥重要意义。 1968年世界卫生组织对其进行了统一命名, 分别以C1-C9命名。1981年对新发现的成分和因子也进行了统一命名。 如C1, C2, C3┅┅C9,其中C1又分为3个亚单位,分别为C1q, C1r, C1s。 1.每一分子的酶解片段用小写的英文字母表示,如C3a; C3b。 2.具有酶活性的可在其上面划一横线,如C1。 3.对灭活的补体成分加i表示,如C2ai。 4.对具有酶活性的复合物则应用其片段表 5.补体系统的其他因子以英文大写字母表示,如B因子, P因 子等。示,如C3转化酶,可以用C4b,2a表示。
补体系统各成分的理化性质 补体成分分子量 (KD) 电泳区 带 血清含量 (μg/ml) 裂解 片段 产生部位 第一组 C1q C1r C1s 390 95 85 γ2 β α 70 35 35 小肠上皮细胞, 脾, 巨噬细胞 C2117 β130 C1aC 2b 巨噬细胞C3190 β11300 C3aC 3b C3cC 3d 巨噬细胞,肝 C4(A因 子) 180 β2430 C4aC 4b C4cC 4d 巨噬细胞,肝 C5190 β175 C5a, C5b 巨噬细胞C6128 β260 肝 C7120 β255 ? C8163 γ155 肝 C979 α200 肝 第二组B因子 D因子 P因子 95 25 220 β α γ2 240 2 25 Ba, Bb 巨噬细胞,肝 巨噬细胞,血小板 巨噬细胞 第三组C1INH C4bp I因子 H因子 S蛋白 105 1100 93 150 80 α β β α 180 250 50 400 500 噬细胞 噬细胞 噬细胞,细小板 血清中:C3含量最高1300μg/ml,其次为C4,S蛋白,H因子各约C3,含量的1/3,其他成分仅为C3的1/10以下。
细胞培养与病毒培养实验步骤
实验二传代细胞培养与病毒在传代细胞中得培养 一. 实验目得 了解倒置显微镜得构造与使用,了解不同传代细胞得形态及接毒后得病变特 征,掌握细胞得传代培养方法、病毒接利方法及收毒方法。 二、常用细胞得种类 BHK-21:仓鼠肾传代细胞 PK-15:猪肾传代细胞 IBRS-2:猪肾传代细胞 Hela :人得子宫瘤细胞 Ver 。:非洲绿猴肾细胞 Marc-145:来源于Vero 细胞 TK-143:人得胸昔激酶阴性细胞 Sf9:昆虫细胞 三、材料 1、lOOml 细胞瓶、吸管、吸球、96孔细胞培养板、加样器、枪头 BHK-21 (baby hamster kidney)细胞 生长液:含10%犊牛血清、200U/inl 青、链霉素得DMEM 2、 3、 0、25%胰酶 4、
维持液:含2-5%犊牛血清、200U/inl青、链霉素得DMEM 5、伪狂犬病病毒液(PRV) 四.传代细胞培养得条件要求 1)细胞密度:2-3X105个/ml 2)pH 范围最适 pH7、0-7、4,耐受 pH6、6-7、8 3)培养温度 哺乳动物细胞一般为37°C 昆虫细胞28-3(rC 五、常用细胞分散剂与作用原理 1、胰酶使精氨酸或赖氨酸得竣基与其她氨基酸得氨基之间得多肽链发生水解, 导 致细胞间质水解而使细胞或组织块消化为分散得单个细胞。 2、乙二胺四乙酸二钠(EDTA):与二价钙、镁离子结合■从而使细胞分散。 3、灰色链丝菌酶川I灰色链丝菌提取得一种酶制剂,就是蛋口酶、氨肽酶与竣肽 酶得混合物。 六、营养液 1、人工综合营养液 氨基酸、糖类、无机盐类、维生素、辅酶、嚓吟、陀唏、辅助生长因子。 2、血清 1)血清得种类 胎牛血清、新生犊牛血清、成年牛血清、马血清、鸡血清、兔血清、羊血清、人血清,其中以新生犊牛血清使用最为广泛。
病毒感染细胞实验整体流程及原理
病毒感染细胞实验整体流程及原理 目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。 1、病毒的种类 病毒有很多种,常见的有慢病毒和腺病毒 1.1慢病毒 1.1.1原理 慢病毒(Lentivirus)是逆转录病毒的一种。构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方 面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。 1.1.2特点 1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。 3)可用于基因敲除、基因治疗和转基因动物研究。 4)无需任何转染试剂,操作简便。 5)可以根据客户需要制备多种标记。 1.1.3慢病毒包装简要流程: 1)含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。 2)慢病毒载体,包装系统共转染病毒包装细胞293T等。 3)培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。 4)病毒的纯化和浓缩。 5)分装、- 80 ℃保存。
6)滴度测定目的基因检定,并出具检测报告。 1.2、腺病毒 1.2.1 原理 腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。 1.2.2特点 1)几乎可以感染所有类型的细胞 2)可以获得复制缺陷型(E1 和E3 缺失) 的腺病毒 3)病毒滴度高,产生病毒经过浓缩后可以达到1012 PFU/mL,能有效的进行增殖。 4)腺病毒载体感染宿主的范围比较广,制备容易,操作简单. 5)感染细胞时,不整合到染色体中,不存在激活致癌基因或插入突变等危险,生物安全性高。 1.2.3腺病毒包装简要流程 1)构建表达siRNA/miRNA 的腺病毒载体 2)采用PacI消化纯化的质粒。 3)消化好的腺病毒表达载体转染293A 细胞,收获细胞以制备病毒粗提液。 4)将病毒粗提液感染293A 细胞以扩增病毒。 5)分装,-80℃保存。 1.3、慢病毒和腺病毒的比较
病毒感染细胞的实验整体流程和原理
病毒感染细胞的实验整体流程和原理 目的基因不能直接整合到大多数真核细胞,常用的手段是将目的基因包装成病毒来感染细胞,从而得到表达满足实验需求。 1、病毒的种类 病毒有很多种,常见的有慢病毒和腺病毒 1.1慢病毒 1.1.1原理 慢病毒(Lentivirus)是逆转录病毒的一种。构建的siRNA / miRNA慢病毒载体,与化学合成的siRNA 和基于瞬时表达载体构建的普通siRNA 载体相比,一方 面可以扩增替代瞬时表达载体使用,另一方面,Lentivirus-siRNA 克隆经过慢病毒包装系统包装后,可用于感染依靠传统转染试剂难于转染的细胞系如原代细胞、悬浮细胞和处于非分裂状态的细胞,并且在感染后可以整合到受感染细胞的基因组,进行长时间的稳定表达。 1.1.2特点 1)直接包装成为假病毒颗粒,对分裂和非分裂细胞均有感染作用,适合RNAi 研究和体内实验中难于转染的细胞(比如神经元细胞、干细胞或其它原代细胞)。2)可以通过简单方式,在短时间内获得稳定表达特定基因的多种细胞株。 3)可用于基因敲除、基因治疗和转基因动物研究。 4)无需任何转染试剂,操作简便。 5)可以根据客户需要制备多种标记。 1.1.3慢病毒包装简要流程: 1)含有目的基因的慢病毒RNAi 干扰载体的构建和质粒纯化提取。
2)慢病毒载体,包装系统共转染病毒包装细胞293T等。 3)培养48hrs - 72hrs 左右,收集含有病毒的上清培养液。 4)病毒的纯化和浓缩。 5)分装、- 80 ℃保存。 6)滴度测定目的基因检定,并出具检测报告。 1.2、腺病毒 1.2.1 原理 腺病毒(Adenovirus,Ad)是一种无包膜的线状双链DNA病毒,其复制不依赖于宿主细胞的分裂。有近50个血清型,大多数Ad载体都是基于血清型2和5,通过转基因的方式取代E1和E3基因,降低病毒的复制能力。这些重组病毒仅在高水平表达E1和E3基因的细胞中复制,因此是一种适用于治疗的高效控制系统。 1.2.2特点 1)几乎可以感染所有类型的细胞 2)可以获得复制缺陷型(E1 和E3 缺失) 的腺病毒 3)病毒滴度高,产生病毒经过浓缩后可以达到1012 PFU/mL,能有效的进行增殖。 4)腺病毒载体感染宿主的范围比较广,制备容易,操作简单. 5)感染细胞时,不整合到染色体中,不存在激活致癌基因或插入突变等危险,生物安全性高。 1.2.3腺病毒包装简要流程 1)构建表达siRNA/miRNA 的腺病毒载体 2)采用PacI 消化纯化的质粒。 3)消化好的腺病毒表达载体转染293A 细胞,收获细胞以制备病毒粗提液。 4)将病毒粗提液感染293A 细胞以扩增病毒。 5)分装,-80℃保存。
医疗器械生物学评价 第五部分 体外细胞毒性试验
医疗器械生物学评价 第5部分:体外细胞毒性试验 1 范围 GB/T 16886 的本部分阐述了评价医疗器械体外细胞毒性的试验方法。 这些方法规定了下列供试品以直接或通过扩散的方式与培养细胞接触和进行孵育; a)用器械的浸提液,和/或 b)与器械接触。 这些方法是用相应的生物参数测定哺乳动物细胞的体外生物学反应。 2 规范性引用文件 下列文件中的条款通过GB/T 16886 的本部分的引用而成为本部分的条款。凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本部分,然而,鼓励根据本部分达成协议的各方研究是否可使用这些文件的最新版本。凡是不注日期的引用文件,其最新版本适用于本部分。 GB/T 16886. 1 医疗器械生物学评价第1部分:评价与试验(GB/T 16886.1-2001,idt ISO 10993- 1:1997)CB/ T 16886. 12-2000 医疗器械生物学评价第12部分:样品制备和参照材料(idt ISO 10993- 12 :1996) 3 术语与定义 GB/ T 16886. 1/ ISO 1993-1中确立的以及下列术语和定义适用于本部分。 3.1 阴性对照材料negative control material 按照本部分试验时不产生细胞毒性反应的材料。 注:阴性对照的目的是验证背景反应,例如高密度聚乙烯1)已作为合成聚合物的阴性对照材料,氧化陶瓷棒则用作牙科材料的阴性对照物。 3.2 阳性对照材料 pos itive control material 按照本部分试验时可重现细胞毒性反应的材料。 注:阳性对照的白目的是验证相应试验系统的反应,例如用有机锡作稳定剂的聚氯乙烯2)已用作固体材料和浸提液的阳性对照,酚的稀释液用于浸提液的阳性对照。 _____________________________________ 1)高密度聚乙烯可从美国药典委员会(Rockvillie, Maryland, USA)和Hatano研究所食品和药品安全中心(Ochiai 729-5 ,Hanagawa.257-Japan)获得。提供这一信息是为本部分的使用者提供方便,但ISO对使用该产品不提供担保。 2)有机锡聚氯乙烯阳性对照材料可从SIMS Portex Ltd,Hythe, Kent,CT21 6JL,UK(产品号码499-300-000)获得。ZDEC和ZDBC 聚氨甲酸乙酯可从Hatano 研究所食品和药品安全中心(Ochiai 729-5 , Hanagawa257-Japan) 获得。提供这一信息是为本部分的使用者提供方便,但ISO 对使用该产品不提供担保。
免疫学练习题12
肿瘤免疫及检验 一、选择题 (一)单项选择题(A型题) 1.肿瘤特异性抗原 A.是细胞癌变过程中过度表达的抗原物质 B.非肿瘤细胞所特有,在正常细胞上也有微量表达 C.是细胞癌变过程中出现的新抗原及过度表达的抗原物质的总称 D.是仅存在于肿瘤细胞表面而不存在于正常细胞的抗原 E.有明显的病毒特异性 2.目前认为,下列属于肿瘤特异抗原的是 A.MAGE-1 B.AFP C.CEA D.EB病毒蛋白 E.HPV(人乳头瘤状病毒)蛋白 3.以下关于自发性肿瘤抗原的叙述正确的是 A.它是由病毒感染诱发的肿瘤 B.它是除病毒感染诱发的肿瘤之外的所有肿瘤 C.它是由理化因素诱发的肿瘤 D.它是无明确的诱发因素的肿瘤 E.人类肿瘤极少数属于此类 4.关于肿瘤免疫的描述,错误的是: A.实验证实在某些肿瘤细胞表面存在肿瘤特异性抗原 B.血清CEA升高有助于结肠癌的诊断 C.人乳头瘤病毒感染与人宫颈癌发生有关 D.血清抗AFP抗体水平升高可辅助诊断原发性肝癌 E.抗EB病毒抗体阳性可辅助诊断鼻咽癌 5.以下关于癌胚抗原的叙述错误的是 A.正常人血清中CEA水平极低 B.结肠癌、直肠癌患者血清中的含量急剧增加 C.观察CEA动态水平,有助于临床疗效的判断及复发、转移的观察 D.由于早期结肠癌CEA的检测率低,一般不用于早期诊断 E.它是一种分泌性胚胎抗原 6.肿瘤细胞的“漏逸”是指 A.在机体免疫系统的作用下,某些肿瘤抗原表位减少或丢失,从而逃逸免疫系统识别 B.肿瘤细胞分泌高水平唾液多糖,可“覆盖”抗原 C.由于机体抗肿瘤免疫效应的产生不能赶上肿瘤细胞迅速生长的速度,致使大量生长的肿瘤细胞不能 被有效清除 D.血清中存在的封闭性抗体与肿瘤抗原结合 E.血清中存在的分泌性抗原与肿瘤抗原竞争同TCR结合 7.高水平血清甲胎蛋白(AFP)见于 A.孕妇 B.重度嗜烟者 C.酒精性肝硬化病人 D.结肠癌切除术后病人 E.生殖细胞畸胎瘤病人 8.关于对肿瘤的排斥作用,下列哪项是正确的? A.T细胞介导的细胞毒 B.ADCC C.补体依赖的细胞毒 D.吞噬细胞对肿瘤细胞的破坏 E.以上全部 9.下述有关系的组合是哪项 A.AFP—肿瘤相关抗原 B.备解素-淋巴因子 C.过敏毒素—免疫球蛋自 D.干扰素-佐剂 E.EPO—补体系统 10.应用IL-2抗肿瘤治疗是扩增 A.抗体产小细胞 B.单核细胞 C.TIL细胞 D.嗜中性粒细胞 E.肥大细胞 11.近年表明,应用抗独特型血清可清除B细胞淋巴瘤,但用同法治疗浆细胞瘤则无效,其原因是由于 A.浆细胞瘤无肿瘤特异抗原 B.浆细胞瘤对ADCC效应不敏感 C.浆细胞无表面Ig D.浆细胞表面的独特型与B细胞表面的独特型不同 E.浆细胞瘤只能被带有相同MHC—I类抗原的细胞毒性T细胞杀伤 12.病毒诱发的肿瘤抗原的特点是 A.无明显的个体、组织特异性,但有明显的病毒特异性 B.无明显的个体、组织特异性,也无明显的病毒特异性 C.抗原性较弱 D.有明显的个体、组织特异性,也有明显的病毒特异性 E.有明显的个体、组织特异性,但无明显的病毒特异性 13.活化的单核巨噬细胞
