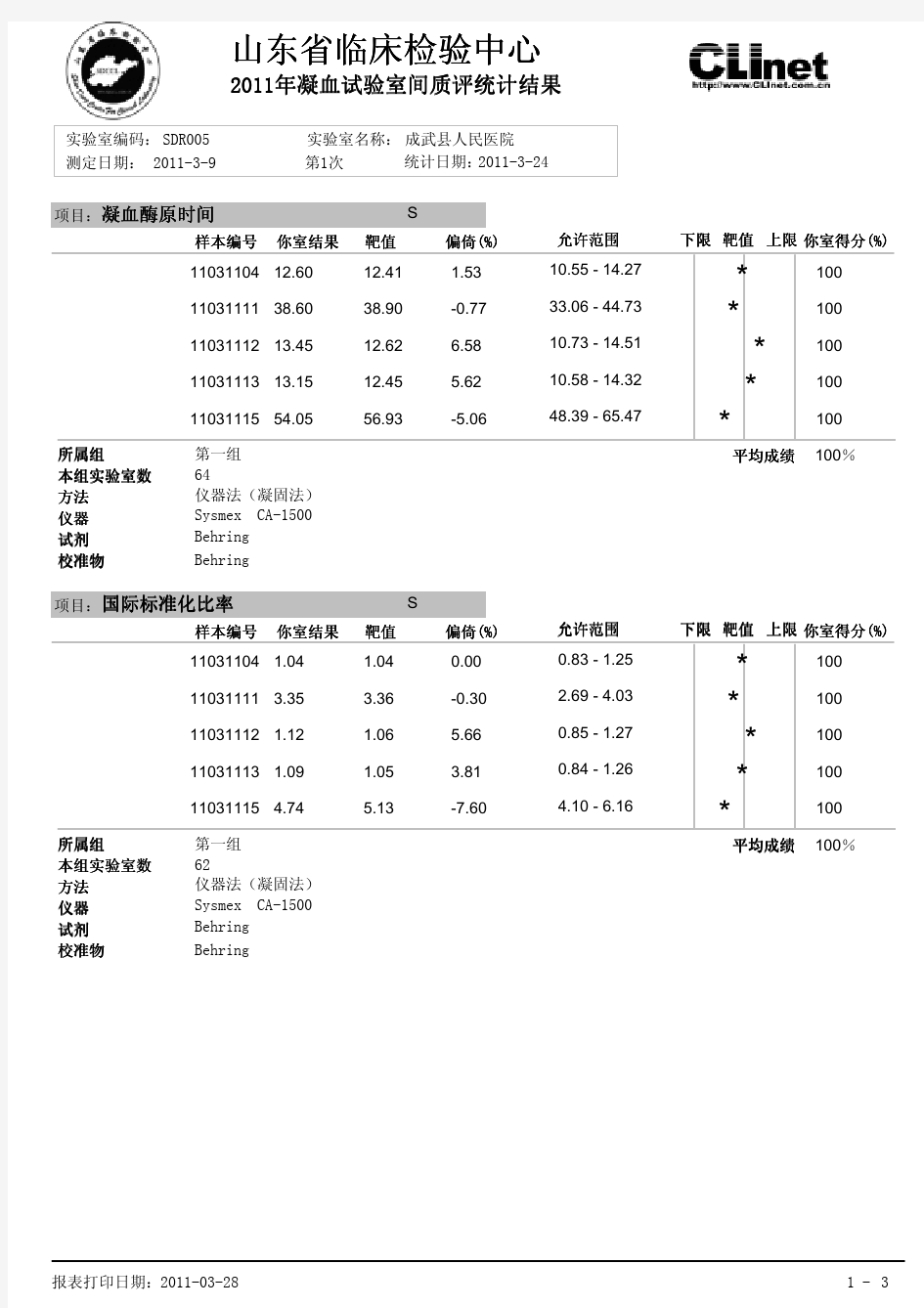
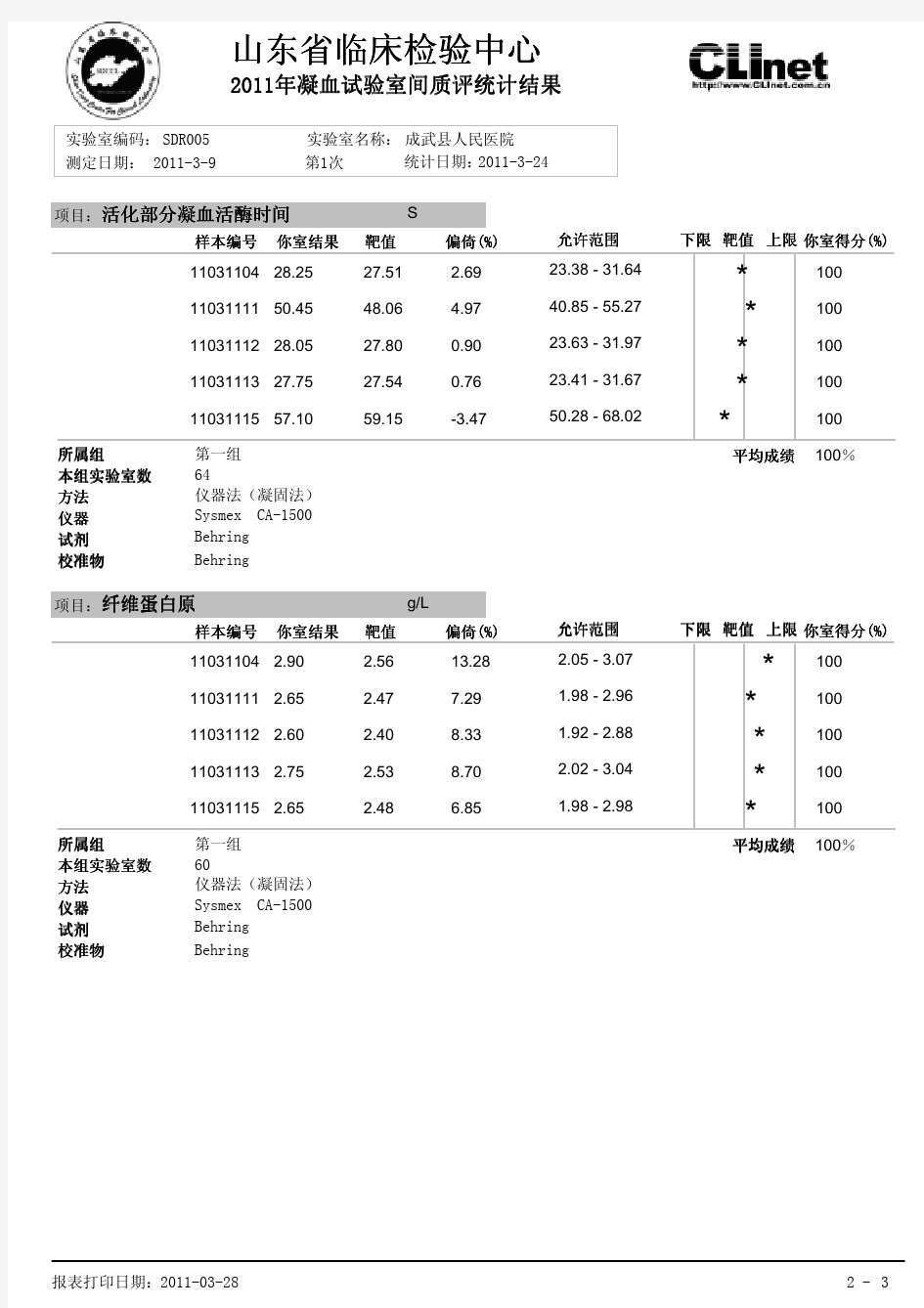
血凝质控结果2011
输血科质量与安全管理
输血科 2018年6月医疗质量与安全管理 一、2018年6月临床用血情况通报与述评 统计时间段 2018-06-01 00:00:00至2018-06-30 23:59:59 报表说明:红细胞、冷沉淀、血浆血量单位为U,血小板血量单位为治疗量,血液制品按照对应血站的转换规则进行计算 1、2018年6月与2017年6月用血数据比较
报表说明:红细胞、冷沉淀、血浆血量单位为U,血小板血量单位为治疗量,血液制品按照对应血站的转换规则进行计算 分析与述评: 统计我院临床科室2018年6月临床用血总量为668.25U,与2017年6月511.5相比增长30.6%;用血人次环比增长20.5%。具体情况为:悬浮红细胞407.5U,与2017年6月343.5U比较增长18.6%;血浆67U,与2017年6月37.5U比较增长78.7%;机采血小板18治疗量,与2017年6月7治疗量比较增长157.1%;冷沉淀175.75U,与2017年6月123.5U比较增长42.3%;全血用量0U。用血临床科室涉及20个。上述数据显示,成分输血比率为100%。本月用血人次及临床用血总量环比均出现了较大幅度的增长,与我院广泛开展的“调结构控成本提质量”活动增加了住院病人有关。血浆用量环比增长78.7%,机采血小板环比增长157.1%,这与2017年同期的基数较少有关, 2017年6月血浆用量仅37.5U,2017年6月机采血小板用量仅7治疗量。总体来看我院2018年6月合理用血情况较好,成分输血已形成良好格局。
二、2018年6月临床科室质量指标及分析 1、《输血治疗知情同意书》签署率92.7%
定标与质控流程图
定标与质控流程图
解释说明: 一、定标前准备: ?车内实验室环境准备 1、环境温度:实验室的标准温度为20℃,浮动范 围为15℃—25℃。 2、实验室内的相对湿度一般应保持50~70%。 3、实验室的噪音、防震、防尘、防腐蚀、防磁与 屏蔽等方面的环境条件应符合在室内开展的检 定项目之检定规程和计量标准器具及计量检测 仪器设备对环境条件的要求,室内采光应利于 检定工作和计量检测工作的进行。 ?仪器准备 保证仪器工作状态良好,确保检验结果的重复性在可控制范围内。例如检查生化仪光路良好;反应杯 无破损,无染色;各工作臂工作正常等。 试剂准备 确认试剂的批号及有效期,确保试剂的有效性。 ?定标品准备 严格按照说明书配置标准的的定标品,确保定标品的有效性。 二、定标操作: ?定标液设置: 根据所使用的定标液的批号,输入定标液的目标值,最好是设置空白杯的对比;设置正确的定标规则。 ?定标样本申请: 根据所需要定标的项目,申请定标样本。注意定标样本的杯号、反应盘号及虚拟盘号。 ?定标测试:
仪器进行初始化完成后,无任何异常现象时,在“样本检测”的界面点击开始检测。仪器工作过程中, 注意仪器的工作过程中有无异常现象,以确保定标结果 的准确性。 三、定标结果的应用: ?定标结果分析: 待定标测试完成后,在“定标结果”一栏中,查看反应曲线及定标曲线,观察反应曲线是否正常,定标 线是否正常。确定该项目的定标结果是否可用,若不可 用,则需要排除异常后重新进行定标;若可用,则需要 进行质控验证。 ?质控验证: 质控验证是作为定标的补充,是对定标结果的验证,为确保样本检测结果的正确最为重要的一环。只有 通过质控验证的定标结果才可进行样本测试,否则只能 重新进行定标测试。 ?样本测试: 在样本测试中,一定要严格按照检验工作的规范制度进行操作,确保样本检测结果的正确可信。
血液细胞形态学检查标准操作程序
血液细胞形态学检查标准操作程序 一.目的:指导血液细胞形态学的检查。 二.该SOP变动程序:本操作程序的改变,可由任一使用本SOP的工作人员提出,并报下述人员批准:专业负责人、科主任。 三.具体内容 (一)原理:将血液制成细胞分布均匀的薄膜涂片,用瑞氏—吉姆萨复合染料染色后,在光学显微镜下油镜观察各类细胞的形态特征及数量变化,对血液系统及某些感染疾病有辅助诊断及疗效观察等意义。 (二)标本要求: 1.采血后推制厚薄适宜的血膜片,血膜应呈舌状,头、体、尾清晰可分。 2.推好的血膜应在空气中晃动,以促使其快干,以免细胞变形缩小。 (三)试剂准备:瑞氏—吉姆萨复合染液。 (四)仪器、器材要求:显微镜、洁净载玻片。 (五)操作具体步骤: 1.染色:平置玻片于染色架上,滴加染色液3~5滴,使其迅速盖满血膜约1min后,滴加 缓冲液5~10滴,轻轻摇动玻片或对准血片吹气,与染液充分混合,10~20min后用水冲去染液待干。 2.选择涂片细胞分布厚薄适宜、染色良好的区域在油镜下观察各类细胞的形态及数量变 化。 (六)结果判断 1.红细胞:正常形态呈双凹圆盘状、无核、平均直径7.2μm,染粉红色,外周血中无有核红细胞、异常形态红细胞量小于1%。 2.白细胞:正常外周血中白细胞分为中性杆状核粒细胞占1%~5%,中性分叶核粒细胞占50%~70%,嗜酸性粒细胞占0.5%~5%,嗜碱性粒细胞占0~1%,淋巴细胞占20%~40%,单核细胞占3%~8%,无幼稚细胞。 3.血小板:正常形态呈椭圆形及不规则形,无核、胞质中有嗜苯胺蓝颗粒,直径约2~4μm,多为2μm左右,呈单个或成堆分布。 (七)干扰因素 1.涂片要新鲜,涂片自然晾干后立即进行染色,如特殊情况下,一般不超过一周,否则,细胞蛋白质变性,使染色偏碱。 2.染色时间长短除与气温有关外,也与细胞增生情况、各批染液的性能有关,故要求将染色中的涂片在显微镜下观察,待颗粒清楚、核浆分明,着色满意后才终止染色,冲洗晾干待检。 3.染色过深得涂片可用瑞氏染液滴加于涂片上,马上冲洗;染色过浅可重染,先加缓冲液再加染色液,混合后复染到需要的深度。 (八)临床意义 (一)红细胞分布异常 1.红细胞分布异常:红细胞呈缗钱状分布,见于多发性骨髓瘤、巨球蛋白血症、高纤维蛋白原血症等,红细胞聚集成堆见于冷凝集素血症。 2.红细胞大小及染色异常 a.低色素性小红细胞增多:见于缺铁性贫血、海洋性贫血、骨髓增生异常综合症等。 b.正色素性或高色素性大红细胞增多,见于巨幼细胞性贫血、抗核酸代谢药物等影响。 3.异性红细胞 a.球形红细胞增多:见于遗传性球形红细胞增多症(常大于25%)、自身免疫性溶血性贫血等。
输血科室内质控项目及方案
输血科室内质控项目及方案 一、目的:考察检测结果是否准确和稳定。 二、原理:选择已知血浆和红细胞,标定其在不同检测介质(盐水介质、凝聚胺、抗人球蛋白以及微柱凝胶等)中的阳性及阴性检测的结果。通过每天或每批与检测标本同等的检测以证明其检测过程中影响检测结果的主要因素(试剂、设备、检测程序、人员操作等)是否符合标准操作规程限定的范围,证明检测结果是否有效的衡量标准。 三、试剂组成: 1、AB型Rh阴性红细胞。 2、O型Rh阳性红细胞。 3、AB型血浆。 4、O型血浆。 检测项目:ABO正反定型、RhD血型、抗体筛检、交叉配血 四、适用范围: 试管法、凝聚胺法、抗人球蛋白法、微柱凝集法 五、检验方法: 1、确认:首次应用室内质控品时,应进行确认凝集强度试验。方法:重复检测两次或以上进行结果对照,确定本实验室对样品管检测的凝集强度,并以此为标准。 2、用微柱凝胶卡法做ABO正定型、RhD时,将红细胞直接稀释至相应的红细胞悬液浓度,进行分装后冷藏保存。 3、样本3含有弱D抗体,要稀释后才能用于反定型和抗体筛检。方法:首先对样本做倍比稀释,再与抗筛细胞进行检测,测出与其反应强度在1+的稀释比例,按比例稀释后应用。稀释后的血浆可分装后
冷冻保存。样本4直接分装后冷冻保存。 六、结果判定: 严格按照《医院输血科IQC检测反应记录单》各项内容进行填写,与“室内质控品的组成”绘出的反应格局表格进行对照,一致则表明此次室内质控通过,反之则为不通过。请查明原因后,方可开展常规工作。 七、注意事项: 1、本质控品只能用于输血相容性室内质控研究,不能作为试剂。 2、本质控品虽经检测并已对其进行病毒灭活,操作中仍应按照一般血液标准使用,注意防护措施。 3、本质控品最佳保存条件为2℃-8℃,使用完毕后立即放回冷藏室内。 4、使用本质控品,先在室温平衡10-15min,才可进行相关检测工作,如需混匀,应避免剧烈摇动。 5、红细胞质控品出现轻微溶血后,可使用生理盐水对其进行洗涤,重新悬浮后使用。 6、质控血清如出现浑浊或有沉淀物出现时,应进行适当离心,去除杂质,将上清液移至新的容器中。 7、如发生以下情况,请严禁使用 1)超过有效期限的质控品。 2)样品管已发生泄漏。 3)样品管标记无法识别。
生化质控操作方法
生化质控操作方法公司标准化编码 [QQX96QT-XQQB89Q8-NQQJ6Q8-MQM9N]
iChem---330生化分析仪 做质控,样本测试之前,注意一下几点: 一、试剂针,样本针,搅拌杆以及清洗臂的各个位置是否正确,特别是反应杯的位置,如 把试剂或者标本加至反应杯壁上,对测试有影响; 二、所有反应杯是否干净,杯子里有无残留水,反应杯外壁上是否有水,反应槽里是否有 水,如有水,请擦干净; 三、执行清洗程序,观察7阶清洗臂清洗反应杯时,杯子里的水是否会溢出来,7根清洗针 的针尖是否会滴水下来。 质控测试: 一、点击质控液设置,点击增加,输入名称:质控液,批号:852UN,浓度水平:中,样本 盘号:1号样本盘,虚拟号:0,样本杯号:58,然后选中所有项目,分别点击右下角的平均浓度的白色框,输入项目的靶值和标准差,然后选中某个项目,输入其靶值和 标准差(所有项目的靶值和标准差根据说明书的靶值表设定)见附表: 二、依次输入所有要做质控的项目的靶值和标准差,完成之后,点保存即可,保存之后, 检查下所有靶值和浓度有无输错,如有输错,点击修改,然后再保存; 三、然后点击质控申请,选中你刚刚所加的那个质控液的编号,然后点击编号对应的小正 方形,会出现一个小勾勾,右边所有的项目默认都会选中(有绿点代表选中),确认 所做项目无缺漏之后,点击开始测试,它会自动跳到样本检测的那个界面,点开始测 试,就进行质控的测试了(点开始测试之前,注意全部试剂盖子去掉,质控液用样品 杯装着,放在设定的位置); 四、测试完成之后,点击质控结果,点击查询,观察测试值是否在靶值的正负两个标准差 之内,如不在范围之内,请检查质控液,定标,试剂是否正常,机器测试过程中有无 异常现象; 五、如均无异常,调整K因子,公式:新K因子=(均值÷测试值)×定标出来的K因子; 六、定标出来的K因子在定标结果里查看,首先找到定标结果里的因子,例如UREA的 “K”值是,然后乘以10000等于86, 86才是真正要换算的K因子; 七、得出新的K因子之后,在定标设置里找到项目UREA,将定标规则修改为K因子法,输 入新的K因子,然后点击保存即可; 八、重新做质控测试,观察质控结果。 质控液复溶步骤
交叉配血操作规程
1.目的:检查受血者与献血者的抗原及抗体成分是否相容,以保证安全输血。 2.要求: 要求全科人员能够熟练掌握原理及操作。 3.原理: 交叉配血试验分“主侧”交叉配血试验即病人血清与献血者红细胞相容性试验;“次侧”交叉配血试验即献血者血清与病人红细胞的相容性试验。只用盐水介质进行交叉配血是有危险性,因为不完全抗体(多是IgG类不规则的血型抗体),所导致的受血者和献血员血型不相容,只是用盐水交叉配血试验检测不出来,而临床中遇到的这类血型不完全抗体所导致的血型不相容输血反应,可能是严重的甚至是致死性的,在临床交叉配血试验中,必须常规地应用能够检测出这类抗体的方法,如聚凝胺;抗人球蛋白等方法。 4.仪器试剂和材料 4.1 抗A、抗B、抗D血清 4.2 病人血样,供血者血样 4.3 聚凝胺试剂 4.4 抗人球蛋白试剂 5.操作方法 5.1 首先查看输血申请单,核对姓名、科室、床号等内容,无误后方可进行配血。★ 5.2盐水介质配血法 (1)首先对患者血样充分离心后,吸出血清于另一试管中并标记。 (2)取试管12支,分别标记患者细胞、患者抗A、抗B、抗D、A C、BC、O C、主侧、次侧、献血者抗A、抗B、献血者细胞管。对患者血样进行ABO血型(正反定性)和Rh血型检定,主侧管加受血者血清2滴,献血者2%~5%红细胞悬液1滴;次侧管加献血者血清2滴,受血者2%~5%红细胞悬液1滴,对献血者血辫进行ABO血型
复查,以1000g离心15秒,观察结果
6.结果判断 ABO同型配血,主侧和次侧均无凝集及溶血现象。为盐水介质配血结果阴性,可将原标本接着做聚凝胺法或抗人球蛋白法配血。 6.1聚凝胺法:具体方法见聚凝胺法。 6.2 抗人球蛋白法:具体方法见抗人球法。 7.附注 7.1冬季室温较低,应将试管保温以防止冷凝集引起的凝集反应。 7.2献血者血型因初复检已确定,可只做正定型,但务必要做。 7.3患者血清中纤维蛋白没完全析出时,要放置到37℃水浴箱中15分钟,然后再离心。以防未完全析出的纤维蛋白影响判断结果。 7.4 交叉配血试验中发现不配合时,首先应考虑受血者和献血者的ABO定型是否错误,必要时进行抗体筛选,注意有无特异性同种抗体。或者病人的血清在室温,37℃或抗人球蛋白血清中凝集所有的其它红细胞,造成交叉配血的困难,应进一步作有关试验进行鉴定。 7.5 在每次输血之后,受血者和献血者样本应在2℃~6℃保存10天。如果病人在输血中发生不良反应或在输血后数天内发生迟发性溶血性反应时,保存的病人和献血员的血样就有可能要重新或追加试验,必要时从发生溶血性输血反应的病人重新采取血样与输血前病人血样同时检查以资比较。 7.6 各医院前来配血时,要有输血申请单方可配血。 8.相关文件 8.1《中国输血技术操作规程》 9.相关表单 9.1 CB—004血型参比室实验记录单 9.2 CB—005青海省血液中心交叉配血报告单
生化质控操作方法
iChem---330生化分析仪 做质控,样本测试之前,注意一下几点: 一、试剂针,样本针,搅拌杆以及清洗臂的各个位置是否正确,特别是反应杯的位置,如 把试剂或者标本加至反应杯壁上,对测试有影响; 二、所有反应杯是否干净,杯子里有无残留水,反应杯外壁上是否有水,反应槽里是否有 水,如有水,请擦干净; 三、执行清洗程序,观察7阶清洗臂清洗反应杯时,杯子里的水是否会溢出来,7根清洗针 的针尖是否会滴水下来。 质控测试: 击质控液设置,点击增加,输入名称:质控液,批号:852UN,浓度水平:中,样本盘号:1号样本盘,虚拟号:0,样本杯号:58,然后选中所有项目,分别点击右下角 的平均浓度的白色框,输入项目的靶值和标准差,然后选中某个项目,输入其靶值和 标准差(所有项目的靶值和标准差根据说明书的靶值表设定)见附表: 二、依次输入所有要做质控的项目的靶值和标准差,完成之后,点保存即可,保存之后, 检查下所有靶值和浓度有无输错,如有输错,点击修改,然后再保存; 三、然后点击质控申请,选中你刚刚所加的那个质控液的编号,然后点击编号对应的小正 方形,会出现一个小勾勾,右边所有的项目默认都会选中(有绿点代表选中),确认 所做项目无缺漏之后,点击开始测试,它会自动跳到样本检测的那个界面,点开始测 试,就进行质控的测试了(点开始测试之前,注意全部试剂盖子去掉,质控液用样品 杯装着,放在设定的位置); 四、测试完成之后,点击质控结果,点击查询,观察测试值是否在靶值的正负两个标准差 之内,如不在范围之内,请检查质控液,定标,试剂是否正常,机器测试过程中有无 异常现象; 五、如均无异常,调整K因子,公式:新K因子=(均值÷测试值)×定标出来的K因子; 六、定标出来的K因子在定标结果里查看,首先找到定标结果里的因子,例如UREA的“K” 值是0.0086,然后0.0086乘以10000等于86, 86才是真正要换算的K因子; 七、得出新的K因子之后,在定标设置里找到项目UREA,将定标规则修改为K因子法,输 入新的K因子,然后点击保存即可; 八、重新做质控测试,观察质控结果。
S交叉配血试验标准化操作规程盐水法
落石出
交叉配血试验标准化操作规程(盐水法) 一、目的 为保证临床输血的相容性,确保临床输血安全,对全血、红细胞悬液、洗涤红细胞、浓缩红细胞、少白细胞红细胞、冰冻红细胞、机采浓缩白细胞悬液等血液成分进行交叉配血试验。 二、方法 采用盐水介质试管法; 三、原理 交叉配血试验也称配合性试验,只是检查不配合性,使受、供者血液间没有可测的不相配合的抗原、抗体成分。盐水介质交叉配血试验常称立即离心配血试验,将人红细胞血型抗原与相应的抗体发生的凝集反应在盐水介质中进行,只有在任何步骤中不产生溶液血或凝集时方可将供血者的血液或血液成分给受血者输注。试验通常包括:主侧交叉配血试验:受血者血清对供血者红细胞,是检测受血者血清中是否存在与供血者红细胞发生反应的抗体; 次侧交叉配血试验:受血者红细胞对供血者血清,是检测供血者血清中是否存在与受血者红细胞发生反应的抗体; 自身对照试验:受血者红细胞对受血者血清,是检测受血者血清中是否存在抗自身红细胞抗体、直接抗球蛋白试验阳性及红细胞缗钱状假阳性的存在。 四、适用范围 适用于输血前需进行交叉配血试验的血液及血液成分。
五、仪器设备 普通离心机;血型专用离心机; 六、试剂 1、试剂名称:0.9%氯化钠注射液 2、试剂生产厂家:湖南科伦制药有限公司; 3、批准文号:国药准字H2005006143020455; 4、包装规格:500ml/瓶; 5、贮藏条件;18-25℃避光保存。 6、有效期:自检定合格之日起二年; 七、检测样本要求 1、标本类型:静脉血(EDTA抗凝剂:血液=1:10)。 2、标本采集:见输血科标本管理标准化操作规程。 3、标本储存和运输:新鲜血2~8℃贮存时间不超过72小时。 4、标本拒收状态:标识不准确、标本稀释、细菌污染,严重溶血等不能测定。 八、操作步骤 1、将受血者与献血者的红细胞血清分离; 2、分别配制受血者与献血者红细胞配成2%盐水悬液; 3、取洁净小试管(10mmx60mm)2支,1支标明主侧:受血者血清(PS)+供血者细胞(DC);另1支标明次侧:供血者血清(DS)+受血者细胞(PC)。 4、按标记主侧管加受血者血清1滴和供血者红细胞悬液1滴。次侧
血细胞形态学检验存在问题与临床实践
【检验】血细胞形态学检验存在问题与临床实践 2014-10-06 血细胞形态学检查是血常规检验的主要内容,也是医学检验人员必须掌握的基本功。近年来,随着血液分析仪的普及,忽视血常规检验中的形态学观察,以致造成漏检、漏诊及误诊的现象常常发生,已引起临床医生、检验人员及患者家属的高度重视。造成上述现象的原因较多,应积极研究对策,确保血细胞形态学检验质量不断提高。 一、专业知识面窄造成漏检与对策 血细胞形态学检验涉及到红细胞、白细胞、血小板及其它异常细胞形态学的知识和丰富经验。临床工作中常由于形态学知识面窄而造成漏检,甚至引发医疗纠纷。 例1,男、8岁,主因经常鼻衄、皮肤紫癜而求诊,甲院查血常规RBC 3.8×10^12/L,HBG 105g/L,WBC 4×10^9/L,PLT 84×10^9/L,按血细胞减少症治疗不见好转而转乙院。血常规结果与甲院近似,血象中粒细胞胞质中多见Dhle小体,并伴有巨大血小板。其母血象与患者近似。结合临床诊为May-Hegglin畸形。家属认为甲院检验人员工作不认真,要追查其责任,后经耐心解释,家属不再追究。 例2,患者,男,80岁,因发热查血常规,甲院化验报告,RBC 3.5×10^12/L,WBC 20.3×10^9/L,W-SCR 0.26 ,W-LCR 0.74(两分群),未提示形态学异常,
PLT 160×10^9/L。转乙院W-SCR 0.74 , W-MCR 0.07 ,W-LCR 0.19(三分群)。查血象多为带空泡的绒毛淋巴细胞,骨髓及血涂片证实为伴绒毛淋巴细胞的脾淋巴瘤,家属拟起诉甲院延误诊断,由于本病非常少见,经解释,家属理解。 对策:①普及血细胞形态学知识,不断提高检验人员业务水平。②从事血细胞形态学的检验人员上岗前应接受正规培训。③建立形态学检验人员评价认可制度。 ④加强血细胞形态学室间质评工作,对多次不达标实验室应提出警告。 二、染色技术不正规发生漏诊与对策 有些基层实验室使用快速染色法,这种染色法操作迅速,但不适合鉴别细胞结构。 例3,女,4岁,主因皮肤出现小脓泡、肝、脾肿大而求诊。甲院查血常规RBC 3.1×10^12/L,HBG 93g/L,WBC 3.8×10^9/L,血涂片快速染色后白细胞分类为N 0.63,L 0.36,M 0.01,未报形态学异常。转到乙院后查血象,中性粒细胞胞质中有粗大紫灰色颗粒,淋巴细胞胞质中可见到1~2个粗大紫红色颗粒。结合临床特点诊断为Chediak-Higashi综合征。患者家属对早日确诊非常满意。 对策:①提倡使用国际血液学标准化委员会推荐的Romanowsky染色法,也可使用Wright、Giemsa或Wright-Giemsa混合染色法。②严格按标准化程序进行染色。③采用快速染色法的单位应定期更换分染试剂,以免影响染色质量。 三、仪器法引发的医疗纠纷与对策 随着血液分析仪的普及,忽视血常规检验中的形态学观察,从而造成漏检、漏诊及误诊等现象,以至引发医患之间的矛盾,已引起临床医生、检验人员、患者及其家属的普遍关注。 1、异常结果提示未引起重视 例4,患者,女,40岁,因干咳而住甲院,血常规检查提示WBC 11×10^9/L,三分群血细胞分析仪MCR 0.19,异常提示F2,未查血片。后患者转外院住院,多次查血常规,嗜酸粒细胞高,确诊为支气管哮喘。先后支付医疗费用较多,认为甲院延误了诊断,要求赔偿。 例5,患者,女,38岁,脑外科术前查血常规,血液分析仪RBC 4.25×1012/L,PLT 58×109/L 。异常提示为PLT直方图DW,医生不给做手术,转内科进一步
交叉配血试验
交叉配血试验 交叉配血试验交叉配血是确定能否输血的重要依据,两侧均不凝集可输血。将献血人的红细胞和血清分别与受血人的血清和红细胞混合,观察有无凝集反应,这一试验称为交叉配血试验。 用交叉配血是确定能否输血的重要依据,两侧均不凝集可输血。若献血人红细胞与受血人血清(主侧)发生凝集应禁止输血;主侧不凝集,次侧(献血人血清与受血者红细胞)凝集,必要时可少量、慢速输血。 交叉配血不能只进行盐水介质交叉配血,在条件差的实验室也应该进行胶体介质配血,以尽量消除不完全抗体存在的危害,减少输血引起的不良反应。 在血型鉴定的基础上,通过交叉配血试验进一步证实受血者和供血者之间不存在血型不合的抗原一抗体反应,以保证受血者的输血安全。 因输血直接涉及病人的生命安全,故病人与献血员虽属同一血型也应进行交叉配血。 分类 交叉配血试验有多种方式,如盐水法、胶体介质配血法、抗球蛋白法、聚凝胺法等。 1、首先准备好受血者和献血者的血样。 2、配好用受血者血清配成的2%的红细胞悬液;用献血者血清配成的2%红细胞悬液。 3、主侧加受血者血清0.5ml,献血者血清配成的2%红细胞悬液0.25ml。 4、次侧加献血者血清0.5ml,受血者血清配成的2%的红细胞悬液0.25ml。 5、37度水浴箱孵育1小时,后观察有无凝集或溶血。 不同血型的人的血清中各含有不同的凝集素,即不含有对抗内他自身红细胞凝集原的凝集素。在A型人的血清中,只含有抗B凝集素;B型人的血清中,只含有抗A凝集素;AB型人的血清中没有抗A和抗B凝集素;而O型人的血清中则含有抗A和抗B凝集素。 在ABO系统血型相同的人之间进行输血,在输血前必须进行交叉配血试验(cross-match test),即不仅把供血者的红细胞与受血者的血清进行血清配合试验(这称为试验主侧);而且要把受血者的红细胞与供血者的血清作配合试验(这称为试验的次侧)。 这样,既可检验血型测定是否有误,又能发现他们的红细胞或血清中,是否还存在一些其它的凝集原或凝集素,足以引起红细胞凝集反应。在进行交叉式配血试验时,应在37℃下进行,以保证可能有的凝集反应得以充分显示。 试验方式 交叉配血试验有多种方式,如盐水法、胶体介质配血法、抗球蛋白法、聚凝胺法等。 胶体介质配血法 1、首先准备好受血者和献血者的血样。 2、配好用受血者血清配成的2%的红细胞悬液;用献血者血清配成的2%红细胞悬液。 3、主侧加受血者血清0.5ml,献血者血清配成的2%红细胞悬液0.25ml。 4、次侧加献血者血清0.5ml,受血者血清配成的2%的红细胞悬液0.25ml。 5、37度水浴箱孵育1小时,后观察有无凝集或溶血。 微柱凝胶试验 微柱凝胶试验(Microtubes Gel Test,MGT)是20世纪90年代先后进入国内实验室并用于交叉配血的新方法。在一些先进国家已成为常规的红细胞血型血清学检测技术。而凝聚胺用于不完全抗体的测定与鉴定以及交叉配血等血清学试验也已在国内迅速推广使用。该方法简便、时间短、结果明显。 诊断用人血型抗A血清、诊断用人血型抗B血清(常在血清中加入不同颜色的染料以示区别,如A型红色,B型蓝色)、生理盐水、供血者血清、受血者血清、供血者的2%红细胞悬液、受血者的2%红细胞悬液。
正常血细胞形态学检验
一、正常粒细胞系统形态? 1、原始粒细胞:胞体直径10~18μm,圆形或类椭圆形。胞核较大,约占细胞的2/3以上,圆或类椭圆形,居中或略偏位,核染色质呈细砂粒状,均匀、平坦如一层薄砂,无浓集。核膜薄较模糊,染成淡红色。核仁2~5个,较小,清楚。胞质量少,染成淡蓝或深蓝似天蓝色,透明绕于核周,无颗粒。过氧化物酶染色阴性,但后期有时也可呈阳性反应。 2、早幼粒细胞:胞体直径12~20μm,较原粒细胞大,圆或椭圆形。胞核大,圆或类椭圆形,位于中央或偏位。核染色质呈粗粒状,较原粒粗,开始聚集。核仁可见或消失。胞质量较多,呈淡蓝、蓝或深蓝色,浆内含大小、形态和多少不一的紫红色非特异的天青胺蓝颗粒,分布不均。过氧化物酶染色阳性。 3、中幼粒细胞: (1、)中性中幼粒细胞:胞体直径10~18μm,圆形。胞核椭圆形或一侧开始扁平,,染色质聚集呈索块状,核仁消失。胞质量多,淡红色,内含中等量、大小较一致的特异的中性颗粒,常伴有少数非特异性颗粒。 (2)嗜酸性中幼粒细胞:胞体直径15~20μm,胞核与中性中幼粒细胞相似。胞质内充满粗大、均匀、排列紧密、橘红色的特异性的嗜酸性颗粒。 (3)嗜碱性中幼粒细胞:胞体直径10~15μm,胞核椭圆形,轮廓不清楚,核染色质较模糊。胞质内及核上含有数量不多、排列零乱、大小不等的紫黑色特异的嗜碱性颗粒。 4、晚幼粒细胞 (1、)中性晚幼粒细胞:胞体直径10~16μm,呈圆形。胞核明显凹陷呈肾形、马蹄形、半月形,但其核凹陷程度一般不超过核假设直径的一半。核染色质粗糙,排列更紧密,核仁消失。胞浆量多,染浅红色,充满中性颗粒。 (2、)嗜酸性晚幼粒细胞:胞体直径10~16μm,胞核在中央或偏一侧,呈肾形或椭圆形。核质充满着嗜酸性颗粒,其颗粒粗大呈橘红色,大小一致,但有时见到深褐色或紫棕色颗粒。 (3、)嗜碱性晚幼粒细胞:胞体直径10~14μm。胞核固缩呈肾形,轮廓模糊。胞质内及核上含有少量、分布不匀的嗜碱性颗粒。 5、杆状核粒细胞: (1、)中性杆状核粒细胞:胞体直径10~15μm,圆形。胞核凹陷程度超过核假设直径的一半,核径最窄处大于最宽处1/3以上,形态弯曲成带状,粗细均匀,核染色质粗糙呈块状,也可见核呈“S”形、“U”形或“E”形,核两端钝圆染深紫红色。胞质充满中性颗粒。 (2、)嗜酸性杆状核粒细胞:胞体直径11~16μm,圆形。胞核与中性杆状粒细胞相似。胞质充满着粗大的橘红色嗜酸性颗粒。 (3、)嗜碱性杆状核粒细胞:胞体直径10~12μm。胞核呈模糊杆状。胞质内及胞核上含有紫黑色、大小不匀、数量较少的嗜碱性颗粒。 6、分叶核粒细胞: (1、)中性分叶核粒细胞:胞体直径10~14μm,圆形。胞核分叶状,叶与叶之间有细丝相连或完全断开,或者虽未断开,但有粗而明显的切痕。核常分2~5叶,核染色质浓集或呈较多小块,染深紫红色。胞质丰富,染淡红色,浆内分布着细小紫红色中性颗粒。 (2、)嗜酸性分叶核粒细胞:胞体直径11~16μm。胞核多分为两叶。胞质充满着粗大呈橘红色嗜酸性颗粒。 (3、)嗜碱性分叶核粒细胞:胞体直径10~12μm。胞核可分3~4叶或分叶不明显,常融合呈堆集状。胞质嗜碱性颗粒呈紫黑色,大小不一,分布不均,常掩盖在核上,以致核的形态看不清,有时很难确定为哪一个阶段细胞。
定标液和质控的概念作用
定标液和质控的概念作用 The Standardization Office was revised on the afternoon of December 13, 2020
定标液和质控的概念以及作用 一、质控品Quality Control: 用于体外诊断的质量控制物质(定值和非定值),是一种旨在用于医学用途的检测系统中使用的物质、材料、物品或设备,其目的是评价或验证测量精密度、测量准确度、由于试剂或分析仪器的变化检测系统可能产生的分析偏差等性能特征。质量控制物质(定值和非定值),可用于能力验证、实验室内质量控制。质控品分定值质控品和非定值质控品两种: 1、定值质控品 定值质控品有制造商使用合适的分析方法或过程分析的参考值,并指定参考范围; 2、非定值质控品 非定值质控品可以在标贴上标示目标浓度(如:低、高、中),但是没有指定的参考范围,可以不用指定非定值质控品应用的分析测试系统,但需满足质量控制的系统规则。 二、定标液calibrate: 在规定条件下,建立测量装置与一可追溯且已知参考值不确定度的标准之间关系的一整套操作活动。校准可能包括以下步骤:检验、矫正、报告、或透过调整来消除被比较的测量装置在准确度方面的任何偏差。定标就是要找出一个参考点,就是一个K值(或F值)。它是由仪器与试剂状态确定下来的当我们测定一个标本时,无论是用手工的方法或全自动生化分析仪,测出来的值叫吸光度,我们要把这个吸光度转化成一个浓度或是酶的活性那就要乘上一个K值,计算并打印出来。K值就是我们通过定标找出来的。一般上最低要求是由试剂
空白与标准品。经过仪器测定出两个吸光度。计算公式:K=标准浓度/(A-标准-A试剂空白) 在生化仪上就是用标准品(其值可溯源至国际标准)来测试其吸光度,得出标准曲线。用于标本检测。 综上,定标是前提,质控是保证。
血细胞形态学检验存在问题与临床实践.
血细胞形态学检验存在问题与临床实践 血细胞形态学检查是血常规检验的主要内容,也是医学检验人员必须掌握的基本功。近年来,随着血液分析仪的普及,忽视血常规检验中的形态学观察,以致造成漏检、漏诊及误诊的现象常常发生,已引起临床医生、检验人员及患者家属的高度重视。造成上述现象的原因 血细胞形态学检查是血常规检验的主要内容,也是医学检验人员必须掌握的基本功。近年来,随着血液分析仪的普及,忽视血常规检验中的形态学观察,以致造成漏检、漏诊及误诊的现象常常发生,已引起临床医生、检验人员及患者家属的高度重视。造成上述现象的原因较多,应积极研究对策,确保血细胞形态学检验质量不断提高。一、专业知识面窄造成漏检与对策血细胞形态学检验涉及到红细胞、白细胞、血小板及其它异常细胞形态学的知识和丰富经验。临床工作中常由于形态学知识面窄而造成漏检,甚至引发医疗纠纷。例1,男、8岁,主因经常鼻衄、皮肤紫癜而求诊,甲院查血常规RBC 3.8×1012/L,HBG 105g/L,WBC 4×109/L,PLT 84×109/L,按血细胞减少症治疗不见好转而转乙院。血常规结果与甲院近似,血象中粒细胞胞质中多见Dhle小体,并伴有巨大血小板。其母血象与患者近似。结合临床诊为May-Hegglin畸形。家属认为甲院检验人员工作不认真,要追查其责任,后经耐心解释,家属不再追究。例2,患者,男,80岁,因发热查血常规,甲院化验报告,RBC 3.5×1012/L,WBC 20.3×109/L,W-SCR 0.26 ,W-LCR 0.74(两分群),未提示形态学异常,PLT 160×109/L。转乙院W-SCR 0.74 , W-MCR 0.07 ,W-LCR 0.19(三分群)。查血象多为带空泡的绒毛淋巴细胞,骨髓及血涂片证实为伴绒毛淋巴细胞的脾淋巴瘤,家属拟起诉甲院延误诊断,由于本病非常少见,经解释,家属理解。对策:①普及血细胞形态学知识,不断提高检验人员业务水平。②从事血细胞形态学的检验人员上岗前应接受正规培训。③建立形态学检验人员评价认可制度。④加强血细胞形态学室间质评工作,对多次不达标实验室应提出警告。二、染色技术不正规发生漏诊与对策有些基层实验室使用快速染色法,这种染色法操作迅速,但不适合鉴别细胞结构。例3,女,4岁,主因皮肤出现小脓泡、肝、脾肿大而求诊。甲院查血常规RBC 3.1×1012/L,HBG 93g/L,WBC 3.8×109/L,血涂片快速染色后白细胞分类为N 0.63,L 0.36,M 0.01,未报形态学异常。转到乙院后查血象,中性粒细胞胞质中有粗大紫灰色颗粒,淋巴细胞胞质中可见到1~2个粗大紫红色颗粒。结合临床特点诊断为Chediak-Higashi综合征。患者家属对早日确诊非常满意。对策:①提倡使用国际血液学标准化委员会推荐的Romanowsky染色法,也可使用Wright、Giemsa或Wright-Giemsa混合染色法。②严格按标准化程序进行染色。③采用快速染色法的单位应定期更换分染试剂,以免影响染色质量。三、仪器法引发的医疗纠纷与对策随着血液分析仪的普及,忽视血常规检验中的形态学观察,从而造成漏检、漏诊及误诊等现象,以至引发医患之间的矛盾,已引起临床医生、检验人员、患者及其家属的普遍关注。 1、异常结果提示未引起重视例4,患者,女,40岁,因干咳而住甲院,血常规检查提示WBC 11×109/L,三分群血细胞分析仪MCR 0.19,异常提示F2,未查血片。后患者转外院住院,多次查血常规,嗜酸粒细胞高,确诊为支气管哮喘。先后支付医疗费用较多,认为甲院延误了诊断,要求赔偿。例5,患者,女,38
外周血细胞形态学检验及技巧
外周血细胞形态学检验及技巧 卫生部医院血液科天林 卫生部临床检验中心明婷谷小林陆红 一.血液学及血细胞形态学临床应用: ●是临床血液病诊断与治疗及临床医学检验学的基础工作。 ●血细胞形态学适用于临床血液病诊断快速简捷的要求。 ●近年来由于血细胞学及超微结构、免疫学、细胞遗传学、融合基因、造血干细胞及其细胞因子、骨髓造血微环境、基质细胞、树突状细胞、淋巴系细胞发生及其疾病表现,细胞增殖动力学与细胞凋亡以及骨髓组织病理学应用,推动了血液的临床与实验室的新知识迅猛发展。 ●当前血液病不能单凭临床与形态学作出诊断,必须以临床和血细胞形态学为基础,将免疫学、细胞遗传学及分子生物学新知识、新技术应用到血液学中,构成现代临床血液学与分子生物学诊断技术,弥补形态学的经验性与主观性带来负面缺陷,才能提高血液病的诊断与治疗水平。 ●进入90 年代以来,国外采用多学科联合技术综合诊断技术与方案: ○FAB-AL (1976 )、NCL (美国国家癌症研究所)对FAB-AL 分型的补充(1995 )、AL-MIC 分(类)型,MIC 及MICM 分型(1985-1990 ); ○FAB-CL 分型(1989 )、中国CL 分型(1997 ); ○FAB-MDS 分型(1982 )、MIC 协作组对FAB-MDS 分型提出补充建议(1987 ); ○WHO 对造血系统及髓系恶性疾病和淋巴系恶性肿瘤WHO 分类(2000 ); ●血细胞形态学诊断技术正在进入显微图象软件时期: ○创造出许多多功能软件,如血细胞形态学、细胞化学染色、血液病诊断与鉴别诊断、CL 诊断与治疗及教学系统多媒体软件等。 ○将显微镜与微机相连,应用储存、分类、检索软件,编辑、打印诊断报告,并可附多幅细胞图象。 二.血细胞形态学基本概念 血细胞形态学作为临床血液病基础诊断:
ABO血型鉴定和交叉配血实验
ABO血型鉴定和交叉配血实验 [实验目的] 观察红细胞凝集现象。 学习ABO血型鉴定方法,掌握血型鉴定原理。 [实验原理] ABO血型是根据红细胞表面存在的凝集原决定的。存在A凝集原的称为A血型,存在B凝集原的称为B血型。而血清中还存在凝集素。当A凝集原与抗A凝集素相遇或B凝集原与抗B 凝集素相遇时,会发生红细胞凝集反应。一般A型标准血清中含有抗B凝集素,B型标准血清中含有抗A凝集素,因此可以用标准血清中的凝集素与被测者红细胞反应,以确定其血型。 同种动物不同个体的红细胞凝集称为同族血细胞凝集作用。不同动物的血液互相混合有时也可产生红细胞凝集,称为异族血细胞凝集作用。对于动物的天然血型抗体了解不多,而且免疫效价也很低,所以同种动物第一次输血,一般不会引起严重后果。但第二次输血就必须进行交配试验,才能决定是否能相互输血。 [实验对象] 正常人。 [实验药品] A型B型标准血清。 [仪器器械] 双凹玻片,采血针,竹签,75%酒精棉球,干棉球,玻璃蜡笔(记号笔),尖头滴管,显微镜。 [实验方法与步骤] 1.ABO血型的鉴定: (1)取双凹玻片一块,在两端分别标上A和B,中央标记受试者的号码。 (2)在A端和B端的凹面中分别滴上相应标准血清少许。 图6.9-1 ABO血型鉴定示意图 (3)75%酒精棉球消毒无名指端,用采血针刺破指端,用消毒后的尖头滴管吸取少量血(也可用红细胞悬浮液,见下述),分别与A端和B端凹面中的标准血清混合,放置1~2 min后,能肉眼观察有无凝血现象,肉眼不易分辨的用显微镜观察。 (4)根据凝集现象的有无判断血型(图6.9-1)。
2.交叉配血实验: (1)分别对供血动物和受血动物消毒、静脉取血,制备成血清和红细胞悬浮液。红细胞悬浮液是将受检者的血液一滴,加入装有生理盐水约1 ml的小试管中,即为2%的红细胞悬浮液。加盖备用。 (2)取双凹玻片一块,在两端分别标上供血动物和受血动物的名称或代号,分别滴上它们的血清少许。 (3)将供血者的红细胞悬浮液吸取少量,滴到受血者的血清中(称为主侧配血,图6.9-2);将受血者的红细胞悬浮液吸取少量,滴入供血者的血清中(称为次侧配血),混合。放置10~30 min后,肉眼观察有无凝集现象,肉眼不易分辨的用显微镜观察。如果两次交叉配血均无凝集反应,说明配血相合,能够输血。如果主侧发生凝集反应,说明配血不合,不论次侧配血如何都不能输血。如果仅次侧配血发生凝集反应,只有在紧急情况下才有可能考虑是否输血。 [注意事项]
生化定标及质控操作说明
生化定标及质控操作说明 ⊙定标液及质控液在溶解之后避光、-20℃保存一个月 一.定标程序 1.设置定标液: 点击定标→定标液设置一般选用的都是线性定标;设置2个定标点一个是蒸馏水,另一个是定标液。(蒸馏水要求是干净新鲜的,要是没有蒸馏水就使用0.9%的生理盐水代替,不要用注射器抽取生理盐水那样瓶塞会污染生理盐水,直接倒出适量生理盐水即可) 再点击添加设置①名称:例如:水②批号、浓度水平一般无意义可以不设置③有效期:尽量设的时间长一些,在每次定标的时候要注意是否超过有效期,保证定标过程顺利④位置:因为样本检测是从1盘开始的,所以设置的时候设置虚拟盘例如:10盘作为定标的专用位置,此位置不能进行其他测试,只能用于定标⑤在项目列表一栏选中项目,并将定标项目的靶值浓度输入浓度一栏。设置完成后点击确认。 2.设置定标规则 点击参数→项目设置→选中项目→点击定标规则→在定标列表中选中所使用的定标液→重复测量次数为 3.每个项目都要设置 3.定标申请 ①点击定标→点击定标申请,在定标类型上选择定标,在项目选择选择要定标的项目(注明:使用双试剂终点法检测的项目如:TB、DB、GLu、UA四个项目要做试剂空白,需要在定标类型上选择试剂空白,然后在项目选择中选择以上四个项目)然后点击确认。 ②将蒸馏水放在样本盘1号位置,把定标液放在2号位置。点击换杯换上干净杯子。因为一个项目的定标需要6个杯子,所以要保证杯子够用。 4.质控 定标做的好不好主要是看质控做的怎么样。做完定标后接着做质控。 (1)设置质控液 点击质控→点击质控液设置→设置①批号、有效期一定是质控液上标示的数字②位置:1号盘40号位,此位置是质控专用位置,不可用于样本检测,如果样本量多,可将样本编在2号盘上。在项目列表一栏上选择项目并填上质控液的浓度和标准差,全部设置好后,点击确认。 (2)操作 做质控有两种方法,一种是:把质控当样本做。第二种是点击质控申请,选中项目进行测试,此过程查询结果比较麻烦。需要点击日内质控,在项目选择中选中项目,点击刷新,将所有项目都刷新一遍,再点击质控汇总,此次质控结果就会显示 5.结果 如果多次定标后质控仍然是做不好,在数值不是很离谱的情况下,可以对项目因子进行调整,根据项目所用测试方法不同,分为两种类型: (1)采用酶法测定的项目(ALT、AST、GGT、ALP)可以通过调整其计算因子来达到目的。点击定标→点击结果查看→选中要调整的项目,点击下方的测试数据修改计算因子。新的计算因子=(质控液靶值/质控实 际测量值)*计算因子(现在的)。改完之后,再重新做质控,看看质控是否在控。 (2)除了上述项目之外的项目,需要修改“R”值。点击定标→点击结果查看→选中要调整的项目,点击测试数据,修改“R”值。R=ac+b(a为吸光度值A ,c为浓度,b为B值。主要是修改a值)。新的a=(质控 液实际测量值/质控靶值)*a(现在的),改完之后在重新做质控,看看质控是否在控。 6.维修和保养 (1)灯泡的寿命是1000小时,要求光源本底值>45000、发光强度>70%,如果光源本底值过低的话,应先关机,呆5-10分钟后再重新开机。 (2)每天工作完成后应用75%或95%的酒精纱布从上往下擦拭样本针。 (3)若样本量大的话,点击维护→点击常规清洗,用碱性清洗液。
交叉配血实验笔记
实验八交叉配血试验 交叉配血是将受血者的红细胞与血清分别同供血者的血清与红细胞混合,观察有无凝集现象(见图4-3-1-1)。输血时,一般主要考虑供血者的红细胞不要被受血者的血清所凝集;其次才考虑受血者的红细胞不被供血者的血清所凝集。前者叫交叉配血试验的主侧(也叫直接配血),后者叫交叉配血的次侧(也叫间接配血)。只有主侧和次侧均无凝集,称为“配血相合”,才能进行输血;如果主侧凝集,称为“配血不合”或“配血禁忌”,绝对不能输血;如果主侧不凝集,而次侧凝集,可以认为“基本相合”,但输血要特别谨慎,不宜过快过多,密切注视有无输血反应。 【实验目的】学习交叉配血的三种常用方法。 【实验对象】人体(学生自愿者)。 【实验器材和药品】 1.仪器显微镜,离心机。2.器械采血针,消毒注射器,双凹玻片,小试管,竹签,棉球,腊笔。3.药品标准A血清,标准B血清,生理盐水,75%酒精,碘酒。 【实验步骤和观察指标】
图4-3-1-1 交叉配血示意图 (一)红细胞悬浮液的配制 按需要型别,取全血1ml,加等渗盐水2 ~3ml,充分摇匀离心沉淀,弃去上清液,然后再加生理盐水2 ~3ml 按上述方法洗涤,共三次,取压积红细胞5 滴,加新鲜等渗盐水4 ml ,即成5 %红细胞悬液。(二)交叉配血基本原理见图4-3-1-1示。 盐水介质交叉配血试验 实验原理 天然IGM类血型抗体与对应的红细胞抗原在室温下盐水介质中发生凝集现象。可以检查供、受者血清中是否存在破坏对方RBC的IgM抗体(ABO血型中抗A抗B抗体以IgM抗体为主)。 实验步骤
取二试管,分别注明“主”、“次”字样,主侧滴入供血者红细胞悬液一滴和受血者血清一滴;次则滴入受血者红细胞悬液一滴和供血者血清一滴。混匀后1000rpm离心1min,取出观察结果。如两侧均无凝集现象,可多量输血;如主侧无凝集而次侧有凝集只可考虑少量输血;如主侧凝集则不能输血。 低离子聚凝胺介质交叉配血试验 实验原理 红细胞表面带有大量的负电荷,以避免其产生自发性聚集,当红细胞悬浮在电解质时,阳离子会被红细胞的负电荷所吸引,形成Zeta 电位,Zeta电位决定红细胞之间的排斥作用。凝聚胺技术首先利用低离子溶液(LIM),降低介质的离子强度,减少红细胞周围的阳离子云,以促进红细胞和血清(血浆)中的抗体结合。其后,加入凝聚胺溶液,它是一种高价阳离子多聚物、肝素中和剂,溶解后能产生很多正电荷,可以中和红细胞表面带有的负电荷,使红细胞Zeta电位降低,缩短红细胞之间的距离,使红细胞产生非特异性的凝聚。最后,加入悬浮液,悬浮液具有中和凝聚胺阳离子的作用,使正常的红细胞非特异性凝聚散开,试验结果为阴性;但如果红细胞被相应的抗体致敏,则会被凝聚胺凝结,凝集就不会散开,试验结果为阳性。 实验步骤 1 取试管二支,标主次侧,主侧管加病人血清(血浆)2滴,加供血
