Lipofectamine_2000转染说明

Lipofectamine TM 2000
CAT. NO. 11668-027 Size: 0.75ml
CAT. NO. 11668-019 Size: 1.5 ml
4℃储存(不要冻存)
说明:
Lipofectamin TM 2000是核酸(DNA或RNA)转染真核细胞的一个专用的试剂盒,其有如下优点:
●对各种细胞及细胞板(如96孔板)都有高的转染效率,在https://www.360docs.net/doc/df7863292.html, 的细胞
系数据库中有各种细胞转染成功的实例。
●在含有或是不含有血清的培养基中,DNA- Lipofectamin TM 2000复合物能够直接加给细
胞。
●在转染之后不需要除去复合物以及添加或是更换培养液,但在培养4-6小时后需要除去
复合物。
关于转染的一些重要建议:
1.不要用即将要介绍的转染程序进行RNAi的转染实验。在https://www.360docs.net/doc/df7863292.html,/rnai
上有转染步骤,登陆后点击说明。
2.对于大多数细胞系,转染复合物中DNA(μg)与Lipofectamine TM2000(μl)的比例
在1:2到1:3之间,最好达到最优化的比例。注意:在混合之前,我们建议用
Opti-MEM I 低血清培养基(Cat: NO.31985-062)(reduced serum medium)稀释
Lipofectamine TM 2000和DNA.
3.为了实现高的转染效率、高的目的基因表达水平以及低水平细胞毒效应,受体细胞
最好达到高的浓度:在转染时,细胞的培养液的混浊度建议为90%-95%并最优化
混浊度。此外,在实验过程中保证相同的接种条件。
4.为避免细胞死亡,在培养基中不要加抗生素。、
5.由于一些无血清复合物(如CD239、SFM II、VP-SFM)会抑制阳离子脂质体介导
的转染,因此有必要检测一下无血清培养基和Lipofectamine TM 2000的相容性。
转染步骤(用于DNA):
按照如下步骤在24孔板中转染哺乳动物细胞。对于其它种类细胞板请参照转染量度标准。步骤中均按照一个细胞孔的量给出质量和体积。
1.贴壁细胞:转染的前一天,在500μl无抗生素培养基中接种0.5-2×105个细胞,以保
证在转染时候细胞的混浊度达到90%-95%。
悬浮细胞:在准备转染混合物时,每500μl无抗生素培养基中含有细胞数量为4-8×105。
2.对于每个转染样品,按下面的方法准备:
a、在50μl无血清Opti-MEM I 低血清培养基中(或是其它无血清培养基)稀释DNA,
并轻轻混匀。
b、使用前轻轻混匀Lipofectamine TM 2000,然后取相应的量稀释在Opti-MEM 培养基中。
室温下静置5分钟。注意:要在30分钟内混合Lipofectamine TM 2000和DNA的稀
释液。
c、室温下静置5分钟后,混合Lipofectamine TM2000和DNA的稀释液(总体积为
100μl)。轻轻混匀并在室温下静置20分钟(溶液混合后可能会看上去浑浊)。注
意:混合物在室温下的6个小时内不会失效。
3.细胞板的每个孔中加混合液100μl,并前后轻轻摇动细胞板使混合液与孔中的培养液
混匀。
4.检测目的基因的表达情况前,细胞于37℃ CO2培养箱中培养18-48小时。此时不需要
改变培养基,但4-6小时后也许需要更换.
5.对于固定的细胞系:转染24小时后将细胞以1:10(或更高的稀释度)稀释度转移到
新鲜的生长培养基中。如果需要的话,在以后的培养中可以在培养基中加入选择培养基。
对于悬浮的细胞系:转染4小时后,如果需要,加入PMA和/或PHA以提高CVM启动子的活性并促进基因表达。
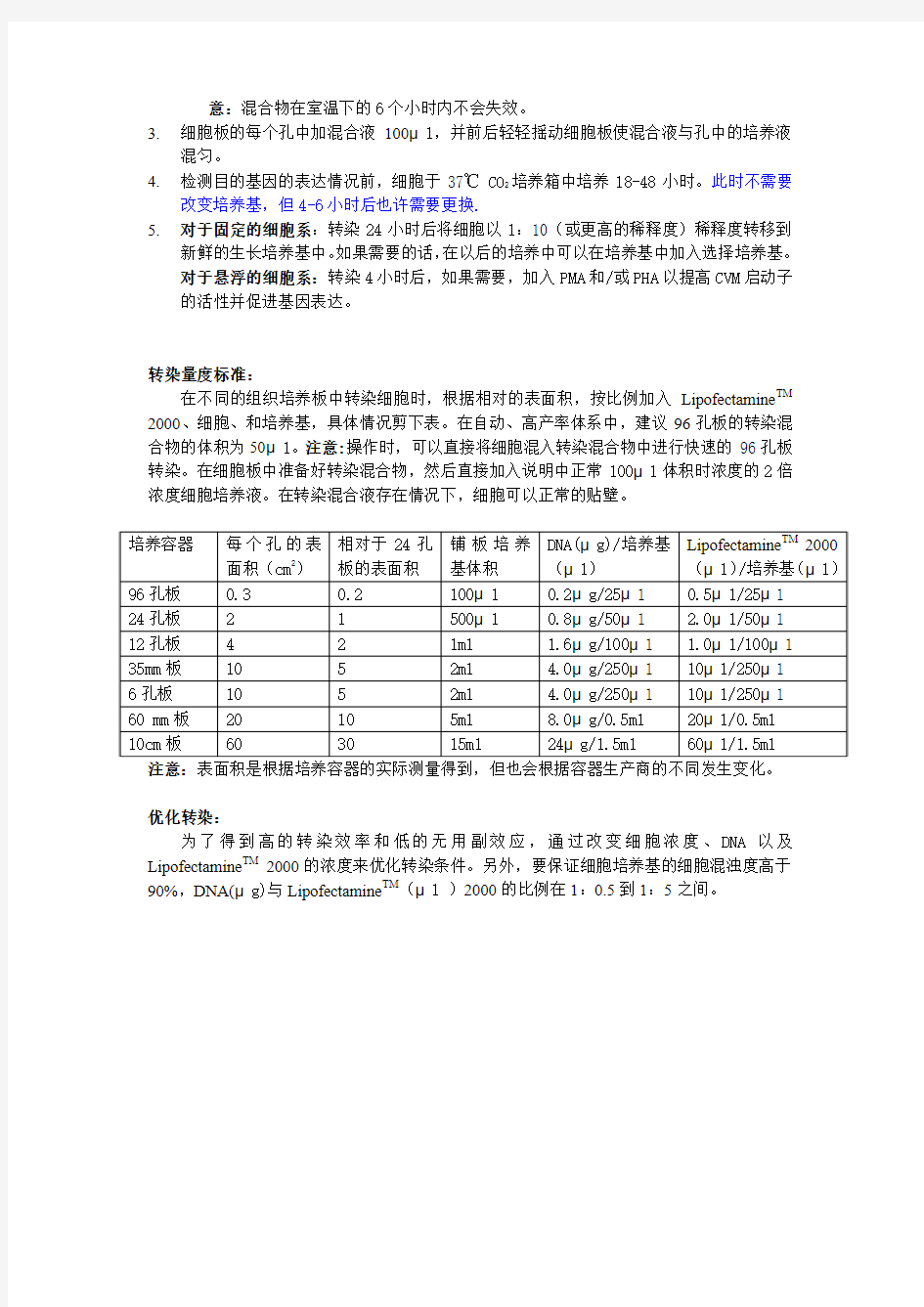
转染量度标准:
在不同的组织培养板中转染细胞时,根据相对的表面积,按比例加入Lipofectamine TM 2000、细胞、和培养基,具体情况剪下表。在自动、高产率体系中,建议96孔板的转染混合物的体积为50μl。注意:操作时,可以直接将细胞混入转染混合物中进行快速的96孔板转染。在细胞板中准备好转染混合物,然后直接加入说明中正常100μl体积时浓度的2倍浓度细胞培养液。在转染混合液存在情况下,细胞可以正常的贴壁。
注意:表面积是根据培养容器的实际测量得到,但也会根据容器生产商的不同发生变化。
优化转染:
为了得到高的转染效率和低的无用副效应,通过改变细胞浓度、DNA以及Lipofectamine TM2000的浓度来优化转染条件。另外,要保证细胞培养基的细胞混浊度高于90%,DNA(μg)与Lipofectamine TM(μl)2000的比例在1:0.5到1:5之间。
siRNA细胞转染实验操作指南
siRNA细胞转染实验操作指南 siRNA产品的最佳工作浓度、转染后检测时间因不同的细胞类型和研究目的而异。一般推荐的siRNA工作浓度为50nM,检测时间为转染后24~72h。可以通过设置时间梯度和浓度梯度进行组合实验来选择最优的siRNA工作浓度和检测时间。由于siRNA过量会对细胞产生毒性,实验建议的siRNA 工作浓度优化的范围为5~100nM。 下面以Lipofectamine 2000转染24孔板的293T细胞为例,选取50nM的siRNA工作浓度,介绍siRNA转染细胞的操作步骤。若使用其他的转染试剂,请参照对应的产品说明书进行操作。 1.在转染前一天,按1×105~5×105个/孔的量将细胞接种于不含抗生素的完全培养基中,使次日转染时细胞融合度30-50%为宜。接种时尽量 保证每孔细胞的接种数量一致,使细胞均匀地平铺在生长表面。 注意:降低转染时的细胞密度可延长转染和收样的时间间隔,避免细胞过度生长对实验结果造成影响。可根据细胞特性和实验目的等,调整接种时的细胞密度。 2.每个待转染的细胞样品(每个培养孔),按以下体系配置转染所需的siRNA-Lipofectamine 2000复合物: (1)配制稀释液A:取25pmol siRNA于50ul Opti-MEM无血清培养基中稀释,轻轻混匀。(*siRNA的用量计算参照表1) (2)配制稀释液B:使用前先将Lipofectamine 2000轻轻混匀,取出1ul于50ul Opti-MEM无血清培养基中稀释,轻轻混匀,室温下孵育5分钟。注意孵育时间不能超过25min。 (3)孵育完成后,将稀释液A与B轻轻混匀得到siRNA-Lipofectamine 2000复合物,在室温下孵育20分钟。此时溶液可能会浑浊,属于正常现象。 表1 不同细胞培养板siRNA 转染用量参考表 3.将孵育好的siRNA-Lipofectamine 2000复合物分别加到对应的细胞孔中,轻轻混匀。 注意:转染前无需更换新鲜培养基,直接将复合物加到原细胞培养基中即可。如有需要,也可根据情况更换培养基优化该步骤。 4.如果需要进行其他特殊处理,如加药等,可在此时进行。 5.将细胞培养板置于37℃的CO2培养箱中培养24-72h。具体培养时间根据细胞生长特性、实验目的进行调整。 注意:加入siRNA-Lipofectamine 2000复合物后一般无需更换培养基,但若脂质体类转染试剂对细胞毒性较大,可根据细胞的状态,在转染4-6小时后更换培养基。 6.进行后续总RNA提取、蛋白提取、细胞活性分析等实验。
LIPOFECTAMINE 2000转染试剂转染步骤
LIPOFECTAMINE 2000转染试剂转染步骤 24孔板贴壁细胞的瞬时或稳定转染实验步骤: (在生长培养基中直接加入复合物) 1.转染前一天,胰酶消化细胞并计数,将细胞转至24孔板,控制密度使其在转染日密度接近90%。细胞铺板在0.5ml含血清,不含抗生素的正常生长的培养基中。 2.对于每孔细胞,使用50μl OPTI-MEMⅠ培养基稀释1μl-3μl LIPOFECTAMINE 2000试剂。温柔混匀LIPOFECTAMINE 2000,室温温浴5分钟 (在5-25分钟内同稀释的DNA混合。保温时间过长会降低活性。可以批量制备。) 注意:即使LIPOFECTAMINE 2000使用OPTI-MEMⅠ稀释,细胞也可以使用D-MEM培养。 3.对于每孔细胞,使用50μl无血清培养基(如OPTI-MEMⅠ培养基)稀释0.8μg-1.0μg DNA。多孔操作可以批量制备。 4.混合稀释的DNA(由第3步)和稀释的LIPOFECTAMINE 2000(由第2步)。在室温保温20分钟。注意:溶液可能会混浊,但不会影响转染。复合物可以在室温保持6小时稳定。
5.直接将复合物(100μl)加入到每孔中,前后(或左右)摇动培养板,轻轻混匀。 注意:如果在无血清条件下转染,使用含血清的正常生长培养基进行细胞铺板。在加入复合物前移去生长培养基,替换为0.2ml无血清培养基。 6.在37℃,5%的CO2中保温18-48小时,无须去掉复合物或更换培养基或者在4-5小时后更换生长培养基也不会降低转染活性。 7.在细胞中加入复合物18-72小时后,分析细胞抽提物或进行原位细胞染色,检测报告基因活性。这依赖于细胞类型和启动子活性。对稳定表达,在开始转染一天后将细胞传代至新鲜培养基中(1:10),两天后加入筛选抗生素。进行稳定表达需要数天或数周。
siRNA说明书
产品以冻干粉的形式,常温运输。收到产品后,请于-20 C?-80 'C保存,冻干粉可以稳定保存一年。 使用前请瞬时离心,用RNase-freeH 2O或者灭菌ddH20,配制成20gM储存液,分装保存,避免反复冻 融(尽量不超过5次)。 表120 gM储存液的配置参考 使用前须知 为避免外界因素(包括酶,极端pH或者温度条件等)导致产品降解,所有操作请严格遵循RNA操作规则。 实验过程中,产品最好于冰上放置,使用完毕后请于-20 C~-80 C小心保存。 细胞实验方法 为了降低细胞密度、试剂用量,转染效率等因素导致的孔间差异,保证实验可靠性和可重复性,一般建议: a. 转染实验中每个转染样品至少设置3个以上复孔; b. 接种细胞时,每孔接种的细胞数量尽量保持一致,并且细胞在各孔的表面平均分布。 1. 转染浓度: siRNA产品最佳工作浓度因不同的细胞类型及研究目的而异。推荐初始转染浓度为50nM,转染后检测时 间为24?72h。最佳转染效率一般通过设置时间曲线和浓度梯度进行优化,优化的范围建议为5~100nM。 2. 转染步骤: 以Iipofectamine2000(简称Iipo2000)转染siRNA于24孔板,转染浓度为50nM为例,其他规格容器转染 请参考表2。 1)转染前一天,接种适当数量的细胞至细胞培养板中,每孔中加入不含抗生素的培养基,使转染时的细胞 密度能够达到30~50%(不同细胞生长速度不一样,因此,接种细胞的数量需要根据细胞培养的经验)。注意: 转染时,细胞密度是影响转染效率的关键因素之一,细胞生长过度会削弱细胞活力,降低细胞的转染效率。 2)对于每个转染样品,请按以下步骤准备siRNA-Iipo2000混合液: a. 稀释siRNA :用50 g 不含血清培养基Opti-MEM I (v1)稀释g I20 gM siRNA储存液,轻轻混匀,室温孵育5min ; b. 稀释Iipo2000 :用50 g不含血清培养基Opti-MEM I (v1)稀释1 g Ilipo2000,轻轻混匀并室温孵育5min ; c. 将a与b轻轻混匀,室温孵育20min(溶液可能会有浑浊,但不会影响转染)。 注意:稀释好的Iipo2000长时间放置可能导致转染试剂活性的降低,应尽量在25min之内与稀释好的siRNA 混合。另在混合试剂时,请勿剧烈吹打或振荡,手指轻弹管壁即可,过度用力可能会破坏脂质体的结构, 甚至影响siRNA-lipo2000 混合物的形成。 3)将siRNA-Iipo2000混合液加入含有细胞的400 gl培养基(v2)的培养孔中,轻轻混匀; 4)(可选)培养4?6h后,将孔中含siRNA-Iipo2000混合液的培养基移去,更换新鲜培养基; 5)(可选)进行其他必要的特殊处理(如加药处理);
Lipofectamine 2000 Transfection Reagent
Lipofectamine? 2000 Transfection Reagent TABLE OF CONTENTS PRODUCT DESCRIPTION SHIPPING CONDITIONS STORAGE CONDITIONS STABILITY QC SPECIFICATIONS PROTOCOL & APPLICATION NOTES Relative Surface Areas Of Tissue Culture Vessels Surface Areas Of Tissue Culture Vessels Tubes Recommended For Use With Lipofectamine? 2000 Optimizing Plasmid DNA Transfections With Lipofectamine? 2000 Transfection Protocols Co-Transfection Of Sirna And Plasmid DNA Transfection Of Fluorescently Labeled Oligos With Lipofectamine? 2000 Transfection Of Cells In 96-Well Plates Transient Transfection Of Suspension Cells ALTERNATE PRODUCTS & COMPATIBILITY PRODUCT DOCUMENTATION REFERENCES PRODUCT NAME & CATALOG NUMBERS ASSOCIATED PRODUCTS RELATED TECHNICAL SUPPORT NOTES
lipo2000转染操作步骤
L i p o2000瞬时转染细胞步骤 Stealth?RNAiorsiRNATransfection 以24孔板为例,其余规格的转染见表1 1中板,细胞密度为30-50%适宜。 注意:根据转染后细胞检测时间长短决定细胞中板密度,如果转染后需要长时间后检测,则细胞中板密度适当降低,已避免细胞过度生长导致存活降低。 2第二天(24-36小时后)每个孔转染方式如下: A将20pmolsiRNA溶于50ulOpti-mem无血清培养基中。 B将1ullipo2000溶于50ulOpti-mem无血清培养基中,混匀室温放置5min。 C将AB两管混合,放置20min。 3转染期间,将24孔板培养基换成无血清培养基,每孔400ul。将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。PlasmidDNATransfection DNA(ug):lipo2000(ul)=1:2-3 转染时细胞密度越高,转染效率,表达效率也越高,并且可以降低细胞毒性。1中板。 贴壁细胞:0.5-2X105cells/well,第二天待细胞密度达到70-80%时转染 悬浮细胞:4-8X105cells/well,中板后随即转染。 2转染。 A将0.8ugDNA溶于50ulOpti-mem无血清培养基中。 B将2ullipo2000溶于50ulOpti-mem无血清培养基中,混匀室温放置5min。 C将AB两管混合,放置20min。 转染期间,将24孔板培养基换成无血清培养基,每孔400ul。将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。 Table1.CultureSharedreagentsDNAtransfectionRNAitransfection
各种转染试剂的中文转染方法
各种转染试剂的中文转染方法 FuGENE6(Roche)转染步骤: 转染前一天将细胞分至培养板,转染当天细胞应50-80%融合。将细胞以1-3×105/2 ml接种于6孔板后孵育过夜将达到如此密度。 将FuGENE6 Reagent在室温孵育10-15分钟。使用之前将FuGENE6颠倒混匀一下。 1. 在PCR管中加入不含血清和双抗的营养液以稀释FuGENE6,直至总体积到100 ul。 2. 将3-6 ul FuGENE6 Reagent直接加入营养液,轻弹管壁混合。 3. 加入1-2 ug的DNA溶液(0.02-2.0 ug/ul),轻弹管壁混合。 4. 室温孵育20分钟。 5. 将6孔板中的旧营养液吸出,加入约1 ml不含血清和双抗的营养液洗涤一次,再加入2 ml不含血清和双抗的营养液。 6. 将转染复合物加入细胞,混匀使之均匀分布。 7. 3-8小时后,加入血清或换成含血清的营养液。 Lipofectamine 2000(Invitrogen)转染试剂转染步骤(6孔板): 1. 转染前一天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90-95%。细胞铺板在2 ml含血清,不含抗生素的正常生长的培养基中。 2. 对于每孔细胞,使用250 ul无血清培养基(如OPTI-MEM I培养基)稀释4.0 ugDNA,轻轻混匀。 3. 使用前将Lipofectamine 2000转染试剂轻轻混匀,用250 ul无血清培养基(如OPTI-MEM I培养基)稀释10 ul Lipofectamine 2000转染试剂,轻轻混匀。Lipofectamine 2000稀释后,在5分钟内同稀释的DNA混合(<30分钟)。NOTE:若使用DMEM培养基,则需在5分钟内同稀释的DNA混合。 4. 混合稀释的DNA(第二步)和稀释的Lipofectamine 2000(第三步)。室温放置20分钟。 5. (optional)将6孔板中的旧营养液吸出,用无血清培养基清洗两次。加入2 ml无血清配养基。 6. 直接将复合物加入到每孔中,摇动培养板,轻轻混匀。 中保温24-48小时。无需去掉复合物或更换培养基。 7. 在37℃,5%CO 2 或者在4-5小时后更换培养生长基也不会降低转染活性。 8. 在细胞中加入复合物24-72小时后,分析细胞抽提物或进行原位细胞染色,检测报告基因活性。这依赖于细胞类型和启动子活性。对稳定表达,在开始转染一天后将细胞传代至新鲜培养基中,两天后加入筛选抗生素。进行稳定表达需要数天或数周。 贴壁细胞的稳定转染: 转染后24小时,将细胞以≥1:10的比例传代至新鲜培养基中,次日加入选择性培养基。 Lipofectamine 2000转染试剂转染步骤(24孔板):
锐博siRNA产品说明书
siRNA使用说明(2009-08) 名称: 常规化学合成siRNA。 产品简介: 常规化学合成siRNA为21-25nt,带有2nt的3'端悬垂的双链小RNA(3'端悬垂通常为dTdT或者UU,也可以选择其他的碱基作为3'端悬垂)。 产品剂量经过严格测算,以摩尔数标明。产品剂型为冻干粉,即用型的siRNA已经经过去保护、退火、纯化等处理,只要用灭菌的ddH2O或者RNase-free water溶解并配制成20μM液体即可直接用于细胞转染及其他实验。 保存和使用: 保存: 液体剂型,siRNA的贮存浓度一般为20μM,-20℃或-70℃保存半年以上; 冻干粉剂型,-20℃或-70℃保存一年以上。开盖前,请先稍稍离心,将粉末收集管底,再用灭菌的ddH2O或者RNase-free water,配制成20μM的液体剂型。 例如:20nmolsiRNA冻干粉,需要加入1ml水溶解(其他剂量可以按照比例计算加水量)。 注意:(1)液体剂型产品,应避免反复冻融(尽量不要超过5次),建议溶解后的产品分装保存。(2)如果近期不做实验,产品需要长期放置,最好以冻干粉形式保存。 使用: 产品使用时(转染过程),siRNA最好冰上放置,使用完毕,请于-20℃或-70℃小心保存; 整个实验过程,要求无RNA酶环境,枪头、EP管都要经DEPC处理; 特别提示:荧光标记siRNA要求避光。 使用方法: 1. siRNA的转染浓度:推荐的siRNA转染浓度是50nM,客户可根据实验具体情况优化转染浓度,优化的范围可以是10~150nM。 (siRNA及转染试剂的建议用量,请参照“实验指导”)。 2. 使用lipofectamine2000(Invitrogen)转染siRNA的步骤(仅供参考): (1) 转染前一天,接种适当数量的细胞至细胞培养板中,使转染时的细胞密度能够达到30~50%(不同细胞生长速度不一样, 因此,接种细胞的数量需要根据细胞培养的经验),请使用无抗生素的培养基。 注意:转染时,细胞密度是影响转染效率的关键因素之一,细胞生长过度会削弱细胞活力,从而降低细胞的转染效率。而细胞密度过低则可能达不到生长的要求,也会因此影响转染效率。 (2)对于每个转染样品,按如下步骤准备siRNA- lipo2000混和液(试剂的用量和体积,请参照“实验指导”): a. 稀释转染试剂lipofectamine2000(以下称lipo2000):使用前,将lipo2000转染试剂轻轻摇匀,然后取适量,用不含血清 的优化培养基(Opti- MEMⅠ)稀释,轻轻混和,室温孵育5min; b. 稀释siRNA:用不含血清的Opti -MEMⅠ稀释siRNA,轻轻混和; c. 稀释好的lipo2000经过5min的孵育后,将之与上述(b)稀释好的siRNA轻轻混和,室温培养20min以形成siRNA-lipo2000 混和物,溶液可能会有浑浊,不过不会影响转染。 注意:稀释好的lipo2000,如果长时间放置可能导致转染试剂活性的降低,应尽量在30min之内与稀释好的siRNA混和。 (3) 将siRNA-lipo2000混和液加入含有细胞以及培养液的细胞培养板中,轻轻摇晃,使之混和; (4)将培养板置于37 ℃的CO2培养箱中培养至检测时间(24~96h)。沉默效率的检测一般建议的时间为24~72h。 可选操作(并非必要的操作):转染操作完成,经过37℃培养4~6h后,可以将孔里含有siRNA-lipo2000混合液的培养基移去,更换新鲜的生长培养基,这样也不会影响转染的效率。 注意:如果转染时使用的是不含血清的培养基(即血清饥饿的条件下进行转染),4~6h后必须换成完全培养基(含血清、含抗生素),以确保细胞生长。 3. mRNA 水平的检测:siRNA的作用机理在于其引起靶mRNA的降解,因此mRNA的降解水平是siRNA沉默效率的最直接指标。 一般在siRNA转染后24h即可以检测到靶mRNA水平的降低。检测方法一般采用RT-PCR(半定量)或Real-time PCR(定量)。 4. 蛋白水平的检测:蛋白水平的检测一般需要借助抗体(针对靶基因蛋白质的抗体或针对融合蛋白的抗体)或报告基因系统检 测,检测手段一般有Western-blot、免疫组化等。一般说来,检测时间受细胞内蛋白质表达量、蛋白质本身的半衰期等因素的影响,一般从48h开始检测,在36、48、72、96h,甚至更长时间之后多点采样。
siRNA 中文操作手册(lipo2000)
THE RNAi COMPANY RNAi 产品使用手册 上海吉玛制药技术有限公司 Shanghai GenePharma Co.,Ltd.
Ⅰ. RNAi 简介 1 A. RNAi 实验原理 B. RNAi 实验流程 C. RNAi 实验所需试剂 D. 上海吉玛 RNAi 相关产品 Ⅱ. siRNA设计7 A. 哺乳动物siRNA设计 B. 上海吉玛 siRNA 产品特性 C. siRNA oligo 技术数据 Ⅲ. siRNA 对照9 A. 普通阴性对照 B. 荧光标记的阴性对照 C. siRNA阳性对照 D. 转染试剂对照 E. 避免off-target对照 Ⅳ. siRNA 转染10 A.siRNA 转染的方法 B.Lipofectamin2000 转染试剂 C.Lipofectamin2000适用的细胞类型 D.转染前细胞培养 E.Lipofectamin:siRNA/DNA比例 F.贴壁细胞转染程序 G.悬浮细胞siRNA转染程序 H.DNA和siRNA共转染细胞程序 I. 体内siRNA导入方法 J. siRNA转染常见问题与建议 Ⅴ. mRNA水平RNAi效果监测15 A. siRNA细胞转染条件优化 B. Real-Time PCR RNAi 效果检测 C. Real-Time PCR 结果分析 Ⅵ. 蛋白质水平RNAi效果监测20 A. western-blot原理 B.western-blot操作步骤 w C.estern-blot上样液的制备 D.western-blot常用试剂的配制 Ⅶ. RNAi实验常见问题解答22
Ⅰ. RNAi 简介 A. RNAi实验原理 RNA干扰(RNA interfering,RNAi)现象是由与靶基因序列同源的双链RNA(double-stranded RNA,dsRNA)引发的广泛存在于生物体内的序列特异性基因转录后的沉默过程。细胞中的核糖核酸酶III家族成员之一的,dsRNA特异性的核酸酶Dicer将dsRNA裂解成由21-25个核苷酸组成的小干扰RNA (small interfering RNA,siRNA),随后siRNA作为介导子引起特异性地降解相同序列的mRNA,从而阻断相应基因表达的转录后基因沉默机制。
RFect小核酸转染试剂说明(单核细胞 转染)
RFect 小核酸转染试剂 货 号:11011: 0.5ml 11012: 1.0ml 储存条件:-20℃ 11013: 1.5ml 产品特点 应 用 产品介绍 RFect 小核酸转染试剂是国际知名科学家崔坤元博士领导我公司研发团队在美国西雅图实验室研发成功的一种新型的小核酸转染试剂。RFect 可用来转染siRNA 、antisense RNA 、microRNA 等200bp 以内的小分子RNA 和DNA ,转染细胞包括绝大多数贴壁生长的细胞,如一般细胞株、肿瘤细胞株等。目前,无论国外还是国内,转染试剂的主要成分均为脂质体或聚乙烯亚胺(Polyethylenimine, PEI),这两种成分都具有很大的细胞毒性,并且转染效果不好。RFect 采用新型的动物源性的纳米材料,毒性很低并且拥有非常卓越的转染性能。与其它品牌的小核酸转染试剂相比,RFect 的细胞转染阳性率一般在90%以上,Lamin A/C 基因抑制效率在95%以上,而其它品牌转染试剂的细胞转染阳性率一般不超过70%,Lamin A/C 基因抑制效率不超过75%。RFect 细胞毒性很低,转染细胞死亡率不到10%,而其它品牌试剂的转染细胞死亡率一般在30%以上。血清对转染效果没有影响,不必刻意添加或更换培养液。有关RFect 小核酸转染试剂的材料合成和试剂配制我们已申请了国际专利,并通过PCT 覆盖国际上多个国家和地区。 操作步骤:本说明书适用于24孔培养板的转染实验,其他规格的培养板的用量参照下面表格,表格给出的是每孔的用量与体积。 A. 细胞接种:转染前一天接种细胞,每孔 500 μl 培养基(不可加抗生素),使细胞在转染时密度在30-50% 。 B. siRNA-RFect 混合物准备: 1. 6pmol siRNA 用50μl 无血清培养基稀释。 2. 2μl RFect 用50μl 无血清培养基稀释。轻轻混匀,室温孵育5min 。注意:确保在25 min 内执行第三步操作,不要过于延迟。 3. 孵育5min 后,将siRNA 稀释液与RFect 稀释液混合(总体积100μl )。轻轻混匀,室温孵育20 min 。 C. 将混合物加到培养的细胞内(完全培养基培养): 1. 将100μl 混合物加入培养孔内,培养孔内含有0.5ml 培养的细胞。轻轻晃动培养板,混匀。 2. 37°C 培养18-72h ,检测基因抑制效果。如果需要,细胞培养4-6h 时可以更换培养基,但不是必须。孵育时间的长短,取决于细胞类型、 所干扰基因本身及分析方法。可设置不同的孵育时间进行实验以确定最佳孵育时间。 转染实验要点: ● 转染过程不可添加抗生素,否则会导致细胞死亡; ● 首次实验siRNA 的用量可稍大(一般10 nM ) ,后续实验根据实验结果修改。 RFect Transfection Reagent Formats for Various Cell Culture Vessels Culture vessel Surface area/well (cm 2) Vol. of growth medium (μl) Vol. of dilution medium (μl) siRNA Amount (pmol) RFect (μl) 96-well 0.3 100 2 x 10 1.2 0.4 48-well 0.8 250 2 x 25 3 1 24-well 2 500 2 x 50 6 2 12-well 4 1000 2 x 100 12 4 ◎卓越的细胞转染性能:细胞转染阳性率高达90%以上,基因敲除效果明显,A549细胞Lamin A/C 基因敲除效率在95%以上 ◎极低的细胞毒性:转染细胞死亡率不到10%,大大降低了因细胞毒性对实验结果的影响 ◎转染细胞范围广,绝大多数贴壁细胞株都能获得比较理想的转染结果 ◎siRNA 转染 ◎antisense RNA 转染 ◎200bp 内的小分子DNA 转染
lipo2000转染操作步骤(精)
Stealth? RNAi or siRNA Transfection 以24孔板为例,其余规格的转染见表1 1 中板,细胞密度为30-50%适宜。 注意:根据转染后细胞检测时间长短决定细胞中板密度,如果转染后需要长时间后检测,则细胞中板密度适当降低,已避免细胞过度生长导致存活降低。 2 第二天(24-36小时后)每个孔转染方式如下: A 将20pmol siRNA溶于50ul Opti-mem无血清培养基中。 B 将1ul lipo2000溶于50ul Opti-mem无血清培养基中,混匀室温放置5min。 C 将A B两管混合,放置20min。 3 转染期间,将24孔板培养基换成无血清培养基,每孔400ul。将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。 Plasmid DNA Transfection DNA(ug):lipo 2000(ul)=1:2-3 转染时细胞密度越高,转染效率,表达效率也越高,并且可以降低细胞毒性。 1 中板。 贴壁细胞:0.5-2X105 cells/well,第二天待细胞密度达到90%以上时转染 悬浮细胞:4-8X105 cells/well,中板后随即转染。 2 转染。 A 将0.8ug DNA溶于50ul Opti-mem无血清培养基中。 B 将2ul lipo2000溶于50ul Opti-mem无血清培养基中,混匀室温放置5min。 C 将A B两管混合,放置20min。 转染期间,将24孔板培养基换成无血清培养基,每孔400ul。将C管mix加入24孔板对应孔中,4-6小时候换成有血清培养基。
Table 1. Culture Shared reagents DNA transfection RNAi transfection *:中板密度根据不同细胞不同实验有所不同,这里仅提的数据仅供参考 **:6孔板细胞质粒转染量1-2ug足以。 ***:6cm dish细胞质粒转染量4-6ug足以。
各种转染试剂中文说明
FuGENE6(Roche)转染步骤: 转染前一天将细胞分至培养板,转染当天细胞应50-80%融合。将细胞以1-3×105/2ml接种于6孔板后孵育过夜将达到如此密度。 将FuGENE6 Reagent在室温孵育10-15分钟。使用之前将FuGENE6颠倒混匀一下。 1.在PCR管中加入不含血清和双抗的营养液以稀释FuGENE6,直至总 体积到100ul。 2.将3-6ul FuGENE6 Reagent直接加入营养液,轻弹管壁混合。 3.加入1-2ug的DNA溶液(0.02-2.0ug/ul),轻弹管壁混合。 4.室温孵育20分钟。 5.将6孔板中的旧营养液吸出,加入约1ml不含血清和双抗的营养液 洗涤一次,再加入2ml不含血清和双抗的营养液。 6.将转染复合物加入细胞,混匀使之均匀分布。 7.3-8小时后,加入血清或换成含血清的营养液。 Lipofectamine 2000(Invitrogen)转染试剂转染步骤(6孔板): 1.转染前一天,胰酶消化细胞并计数,细胞铺板,使其在转染日密度为90-95%。 细胞铺板在2ml含血清,不含抗生素的正常生长的培养基中。 2.对于每孔细胞,使用250ul无血清培养基(如OPTI-MEM I培养基)稀释 4.0ugDNA,轻轻混匀。 3.使用前将Lipofectamine 2000转染试剂轻轻混匀,用250ul无血清培养基(如 OPTI-MEM I培养基)稀释10ul Lipofectamine 2000转染试剂,轻轻混匀。 Lipofectamine 2000稀释后,在5分钟内同稀释的DNA混合(<30分钟)。 NOTE:若使用DMEM培养基,则需在5分钟内同稀释的DNA混合。 4.混合稀释的DNA(第二步)和稀释的Lipofectamine 2000(第三步)。室温放 置20分钟。 5.(optional)将6孔板中的旧营养液吸出,用无血清培养基清洗两次。加入 2ml无血清配养基。 6.直接将复合物加入到每孔中,摇动培养板,轻轻混匀。
jetPRIME转染试剂说明
Polyplus-transfection S.A. - Bioparc - 850 Bd S. Brant - 67400 Illkirch - France - Phone: +33 3 90 40 61 80 - Fax: +33 3 90 40 61 81 Polyplus-transfection Inc. - 1251 Ave of the Americas - 34th fl. - New-York - NY 10020 - USA https://www.360docs.net/doc/df7863292.html, jetPRIME? in vitro DNA & siRNA transfection reagent PROTOCOL DESCRIPTION jetPRIME? is a novel powerful molecule based on a polymer formulation manufactured at Polyplus-transfection?. jetPRIME? ensures effective and reproducible DNA and siRNA transfection into mammalian cells. jetPRIME? is extremely efficient on a wide variety of cell lines. This powerful reagent only requires low amounts of nucleic acid per transfection, hence resulting in very low cytotoxicity . 1 Transient DNA transfection protocol (2) 1.1 Cell seeding .......................................................................................................................................... 2 1.2 DNA transfection protocol ................................................................................................................... 2 1.3 Virus production in adherent cells ....................................................................................................... 5 1.4 Optimization guidelines (5) 2 siRNA transfection protocol (6) 2.1 Cell seeding .......................................................................................................................................... 6 2.2 siRNA transfection protocol .. (7) 3 DNA & siRNA cotransfection protocol (7) 3.1 Cell seeding .......................................................................................................................................... 7 3.2 DNA & siRNA cotransfection protocol . (8) 4 Transfection of CRISPR/Cas9 ..................................................................................... 9 5 Stable DNA transfection ............................................................................................. 9 6 Troubleshooting ....................................................................................................... 10 7 Product information (11)
转染试剂使用注意事项.doc
转染试剂使用注意事项 1.细胞密度:转染DNA(质粒)时,细胞密度为80-100%,转染RNA(siRNA 或miRNA)时,细胞密度为60-80%,具体细胞密度必须结合考虑核酸种类、转染试剂种类和细胞生长密度极限; 2.DNA用量:0.5-1ug/孔(以24孔板为例),具体用量根据转染效率检测实验 确定; 3.RNA用量:10-30 pmol/孔(以24孔板为例),具体用量根据转染效率检测实 验确定; 4.转染试剂的用量:转染试剂说明书推荐了一个使用范围,具体用量根据转染 效率检测实验确定; 5.根据转染效率检测实验确定核酸的用量及转染试剂的用量(核酸与转染试剂 的比例关系),转染效率检测实验一般在24孔板中进行,其他格式的培养器皿请根据底面积的比例(表1)进行计算; 6.转染试剂使用前才从4℃中取出,取用前,先短暂离心(转速达到3000RPM 时即可停止),然后放在涡旋振荡器上点动混匀三次,每次持续1秒,混匀后短暂离心(转速达到3000RPM时即可停止),上述措施是为了混匀转染试剂,保证使用效果,使用后立即放回4℃保存; 7.核酸和转染试剂分别用Opti-MEM(这是专用的转染稀释培养基,如果没有 Opti-MEM,可以用细胞对应的基础培养基代替)稀释,稀释的核酸可以通过弹匀,吹打均匀,颠倒混匀或涡旋点动混匀(三次,每次持续1秒),稀释的转染试剂可以通过弹匀,颠倒混匀或涡旋点动混匀(三次,每次持续1秒),不可使用吹打均匀;混匀后均需短暂离心; 8.把稀释的核酸和稀释的转染试剂复合混匀时,应该把稀释的核酸加入稀释的 转染试剂中(顺序不可调转);加入后立即进行(不要耽搁)弹匀或颠倒混匀(稀释的核酸和稀释的转染试剂一旦复合,转染复合物的形成立即启动,如果不及时混匀,所形成的转染复合物的效率就会很低),先不进行短暂离心,待所有的管子复合完毕后,在一起进行涡旋点动混匀三次,每次持续1秒,然后短暂离心; 9.转染复合物孵育形成时尽量避光室温或37℃放置;
siRNA转染常见问题解答
siRNA转染常见问题解答 SiRNA导入细胞有以下几种方法:化学转染技术、电穿孔法、磷酸钙共沉淀技术、显微注射和载体导入技术。选择时应该依据实验条件考虑以下因素:细胞对转入方式的承受能力、细胞对病毒侵染的易感性、细胞的生长特性等。其中,化学转染技术是目前最为常用的方法,由于电转的方法对细胞损伤比较大,一般不建议选择电转。 针对最常见的化学转染技术,有几种常见的问题以及解决方法。 一、哪种转染试剂效果好? 在选择转染试剂时,一般要考虑的是结合特定的细胞株,而不是被导入细胞中的物质。选择细胞毒性小,转染效率高的转染试剂。脂质体试剂的毒性较大,建议选择非脂质体的转染试剂,如BIODAI的RFect系列纳米材料转染试剂。 二、转染后出现细胞死亡是什么原因?如何优化转染条件? 转染后细胞死亡,原因也是多样的,如脂质体毒性,转染浓度过高,转染前的细胞状态不佳等都可能导致转染后细胞死亡的情况发生,这种情况下就需要适当优化转染条件;在优化转染条件时需要考虑以下因素:转染试剂和细胞特有的自身条件。例如:siRNA 与转染试剂的比例、转染时间、细胞传代数和细胞密度等。一般说,转染试剂毒性小,转染时所需的细胞密度就小,如RFect系列siRNA转染试剂一般要求30-50%细胞密度,而lipo2000转染时所需的细胞密度一般在70%左右。如果经优化后细胞死亡仍很多,应及时考虑更换转染试剂。 三、如何优化siRNA与转染试剂的比例? SiRNA的量与转染试剂的比例需要进行优化,一般选择24孔板进行优化,比 较节省各种试剂。可以在10-100nM之间设定几个siRNA的浓度水平,如30nM, 50nM,80nM,100nM。转染试剂根据说明书推荐的剂量上下浮动各3个浓度。之后siRNA的量与转染试剂的量进行两两组合,从中选择转染效率最高的组合用于接下 来的实验。如果通过荧光显微镜观察荧光判断转染效率的话,siRNA的最低终浓度 不要低于10nM,一般推荐的siRNA终浓度多在50-100nM。这里需要说明的是,以
Invitrogen Lipofectamine2000
Lipofectamine? 2000 前言 Lipofectamine? 2000试剂是一项专利配方,用于高效转染Stealth? RNA或者短的干扰RNA(siRNA)到哺乳动物细胞,以进行RNAi分析(1,2)。该说明书提供了一般的指导以及使用Lipofectamine? 2000转染Stealth? RNA或者siRNAj 进入哺乳动物细胞的步骤。提供推荐的起始使用试剂剂量。为了获得最佳的RNAi实验结果,需要针对哺乳动物细胞系和目的基因优化转染的条件。 影响基因阻断水平(Gene Knockdown Level)的因素 在RNAi实验中,有许多因素影响目的基因表达程度的降低(例如:基因阻断),包括: ·转染效率 ·目的基因转录效率 ·蛋白质稳定性 ·所选择特异StealthTMRNA或者siRNA序列的效率 ·所选择哺乳动物细胞系的生长特征 当设计转染和RNAi实验时,需要考虑这些因素。如果需要更多的信息帮助您成功的进行RNAi实验,查阅标题为"RNAi成功的七个步骤"的文献。随同StealthTMRNA订货可以得到说明书,也可以从我们的网站(https://www.360docs.net/doc/df7863292.html,)下载或者通过与技术服务联系获得说明书。 转染的一般性指导 使用Lipofectamine? 2000转染Stealth? RNA或者siRNA进入哺乳动物细胞时,遵从以下一般性指导: 1 为了获得最佳基因阻断结果,每一种细胞系转染Stealth? RNA或者siRNA的量都需要经过实验确定。如果您是首次转染您的细胞系,推荐尝试使用几个Lipofectamine? 2000的浓度,并在20-100nM范围内改变Stealth? RNA或者siRNA的浓度,以确定达到最佳基因阻断水平所需要的条件。高浓度的Stealth? RNA或者siRNA可能具有细胞系依赖性。注:我们推荐开始时使用40nM Stealth? RNA或者siRNA。 2 在30-50%细胞汇合度时进行转染。通常基因阻断的分析至少要在转染后24-72小时进行。低密度转染细胞可以使转染和分析之间更长的间隙更长,从而使由于细胞过度生长造成的细胞活性损害减少到最低。根据靶基因的特性,高密度转染的细胞可能更加适合条件的优化。 3 不要在转染时的培养基中加入抗生素,因为这将会降低细胞转染的效率和导致细胞死亡。 4 为了获得更好的结果,可以使用Opti-MEM? I 低血清培养基(目录号31958-062)在形成复合物前稀释Lipofectamine? 2000和Stea lth? RNA或者siRNA寡聚物。 5 可以使用invitrogen BLOCK-iT?荧光寡聚物(BLOCK-iT?Fluorescent Oligo)(目录号2013)帮助优化细胞系的转染条件。一旦确定了用来转染的最佳条件,在每一次实验都包括BLOCK-iT?荧光寡聚物,作为转染效率的指示剂。如果需要的更多的信息,请参阅BLOCK-iT?荧光寡聚物说明书,说明书可以通过我们的网站下载或者通过拨打技术服务热线。
蛋白质专用转染试剂
蛋白质专用转染试剂 ● 多肽及小蛋白(如组蛋白,~11 kDa ), ● 大蛋白(如抗体,~150 kDa ) ● 多分子蛋白复合物(半乳糖苷酶四聚体,~465 kDa ) 将蛋白导入细胞可以用于蛋白-蛋白相互作用,蛋白运转,细胞周期,信号传导通路,细胞凋亡通路,转录因子介导的基因调节等研究。将蛋白直接转染到细胞里也是研究特定蛋白对哺乳动物细胞的影响的最为迅速的方法。Novagen 的ProteoJuice TM 和Stratagene 的 BioTrek TM 是目前市售产品中适用细胞品种较多,对于哺乳动物细胞毒性极小的两种经过广泛测试的高效蛋白转染试剂。 BioTrek TM 蛋白转染试剂 已成功转染的细胞:293 B16-F0,BHK-21,CHO-K1,COS-1,COS-7, CV-1, HeLa ,HeLa-S3,HepG2,Jurkat , K562Ki-Ras 267 β1, MDCK ,NIH 3T3,P19 转染试剂冻干粉 β-半乳糖苷酶对照10 μg FITC 标记山羊IgG 对照10 ug 包装 货号 24rxn #204140 ProteoJuice 蛋白转染试剂 已成功转染的细胞:A549,COS-7,HepG2,MCF-7,PC12,BHK-21,CV-1,HEK-293,Neuro2A ,Raw 264.7,CHO-K1,HeLa L6,NIH-3T3 包装 货号 0.125 ml 71281-3 4 × 0.125 ml 71281-4 质谱法(MS )是蛋白质组学中鉴定蛋白品种的核心技术。蛋白MS 分析需要将蛋白按特定要求消化成多肽,再利用软件得到其序列及特性信息。胰蛋白酶能特异性地从赖氨酸和精氨酸残基的羧基端进行切割,产生符MS 分析所需要大小的肽段,因此胰蛋白酶是MS 实验中的重要工具之一。 Stratagene 的MS 级胰蛋白酶 纯度极高,克服了天然胰蛋白酶和非MS 级的胰蛋白酶的主要缺限,成为MS 的必然之选: ● 决无自我消化之虞:不会干扰目的蛋白的分析 经过甲基化修饰,消化活性只会针对目的蛋白;更不会产生糜蛋白酶这种活性更广的副产物 ● 杜绝任何可能的糜蛋白酶活性干扰 特别经过TCPK 处理,解决了其它胰蛋白酶产品的主要质量问题 ● 专为MS 应用而设计 Stratagene 著名的QuikChange 定点突变试剂盒家族的新成员 QuikChange TM Multi 多点突变试剂盒 用QuikChange TM Multi 多点突变试剂盒可以在短短1天时间内完成克 隆在如何质粒上多达5个点的突变,而不是通常方法的几天甚至数周! ● 简单、高效、1天完成多点突变的全新方法 ● 可以从任何质粒开始,完全没有任何前处理步骤(如:亚克隆) ● 每个突变点设计一条引物,可以使用简并引物,省钱省时 ● 决无意外突变 ● 提供高效XL-10 Gold 超级感受态细胞 第1步 生成突变链 进行温度循环: 1) 模板DNA 变性 2) 突变引物退火 (所有的引物结合于同一条链) 3) 引物延伸,并用QuikChange Multi enzyme TM 封闭缺刻 第2步 Dpn I 消化模板DNA 用Dpn I 消化甲基化和半甲基化DNA 第3步 转化 将突变产物ssDNA 转入XL10-Gold 超级感受态细胞 QuikChange TM Multi 多点突变试剂盒
