鲑鱼鱼精蛋白酶解产物中抗氧化活性肽的分离纯化研究

2009年6月第30卷第6期食品研究与开发
王勇刚1,2
,朱锋荣1,韩福森1,*,王贺瑶2
(1.天津天狮集团全球研发中心,天津301700;2.中国科学院上海药物研究所,上海201203)
鲑鱼鱼精蛋白酶解产物中抗氧化活性肽
的分离纯化研究
基金项目:“十一五”国家科技支撑计划重点项目(2006BAD27B06)作者简介:王勇刚(1974—),男,副研究员,工学博士,研究方向:药理学、生化与分子生物学、生物化工。
*通讯作者
摘
要:研究发现鲑鱼鱼精多肽具有较强的羟自由基、DPPH (1,1-二苯基-2-苦基肼)和超氧阴离子清除活性。通过凝
胶色谱、离子交换色谱和反相高效液相色谱分离方法,最终分离到一系列具有抗氧化性的肽段。关键词:鱼精蛋白;分离纯化;抗氧化活性;多肽
PURIFICATION AND CHARACTERIZATION OF ANTIOXIDATIVE PEPTIDES FROM
SALMON PROTAMINE HYDROLYSATE
WANG Yong-gang 1,2,ZHU Feng-rong 1,HAN fu-sen 1,*,WANG He-yao 2(1.Global R&D Department,Tiens Group.Tianjin,Tianjin 301700,China;
2.Shanghai Institute of Materia Medica,Chinese Academy of Science,Shanghai 201203,China )
Abstract:Salmon protamine hydrolysate was found to possess antioxidative activity against hydroxyl,2,2-diphenyl -1-picrylhydrazyl and superoxide anion radicals.Through consecutive chromatographic methods including size exclusion,ion exchange chromatography and reverse -phase high performance liquid chromatography (HPLC),a series of peptide fractions with high antioxidative activities were obtained.Key words:protamine;purification;antioxidative activity;peptide 紫外线,离子辐射,化学反应等过程产生的活性氧自由基能引起一系列的病理反应,如DNA 损伤,癌变和细胞降解等[1-3]。在需氧生物体内,自由基的产生不可避免。超氧阴离子自由基和羟自由基是两种最具代表性的自由基。它们很不稳定,能与体内的各种物质发生反应,从而导致细胞或组织损伤和死亡。抗氧化剂具有清除自由基和延缓脂质过氧化反应的发生。另外,抗氧化剂也能通过保护脂质成分的氧化降解来保持食物质量。因此,寻找抗氧化剂,特别是食物来源的天然氧化剂具有非常重要的意义。
近些年来,来源于食物蛋白酶解产物的生物活性肽受到越来越多的关注。目前许多来自食物蛋白酶解产物的自然活性肽具有抗氧化作用[4-6]。Chen 等发现大豆多肽能有效延缓脂质过氧化反应,且这些多肽的一级结构与它们的活性有重要联系[5]。Li 等从猪胶原酶
解产物中分离获得具有抗氧化和自由基清除活性的多肽序列[7]。另外,人们从渔业加工副产品中提取获得多种抗氧化活性成分,如黄鳍金枪鱼鱼皮明胶酶解产物[8],黄鳍金枪鱼骨架蛋白酶解产物[9],阿拉斯加雪鱼鱼皮明胶酶解产物[10]以及cod frame 蛋白酶解产物[11]。鱼白是一种主要由鱼精蛋白和DNA 组成的混合物,在渔业加工过程中一般作为副产物而丢弃。鱼精蛋白是一种阳离子多肽,在医学中可用作注射用胰岛素的载体,肝素拮抗剂等。近来,鱼精蛋白在食品工业中被用作抗菌成分[12]。随着经济的发展和资源的不断匮乏,鱼精蛋白和鱼精多肽受到越来越多的重视。
通过D-半乳糖(D-gal )诱导的亚急性衰老的大鼠模型,我们发现鱼精蛋白水解产物除具有基本营养功能外,在体内具有明显的抗氧化活性。它能明显提高大鼠血清,脑和肝组织中的超氧化物歧化酶(SOD )活力,并明显降低丙二醛(MDA )的含量[4]。目前对于酶解鱼精多肽的相关研究很少,包括其特定的生物学功能、水解后各种多肽片断的分子量和氨基酸残基数等。本试验中,我们研究了鱼精多肽在对于羟自由基,DPPH 自
科学研究
70
2009年6月
第30卷第6期食品研究与开发
图1鱼精多肽的G35凝胶层析图谱
Fig.1Gel filtration chromatographic profile of protamine
hydrolysates by G35column
图2G3的Macro-Prep High Q离子交换层析图谱
Fig.2The ion exchange chromatographic profile of G3by Macro-
Prep High Q column
由基和超氧阴离子自由基的清除活性,通过层析方法分离获得具有抗氧化活性的多肽,并通过LC-MS(液质联用)、NCBI数据库搜索和蛋白序列分析,对其结构进行了分析和鉴定。
1材料和方法
鲑鱼鱼精多肽粉:武汉天天好多肽研究所提供。鱼精蛋白用来源于猪胰脏的胰酶(pancreatin)在pH8.5,50℃下,水解5h,反应在100℃条件下10min 终止。水解度(DH)约为(57.18±5.04)%,总氮含量(凯氏定氮法)大于14%,含水量少于10%,其中鱼精蛋白水解产物分子量在100u~1000u之间约为43.1%(高效液相色谱法HPLC测定)。牛血清白蛋白(BSA)和1,1-二苯基-2-苦基肼(DPPH):购自Sigma公司;HPLC级的乙腈和三氟乙酸(TFA):购自Tadia公司;还原型烟酰胺腺嘌呤二核苷酸(NADH)、吩嗪硫酸甲酯(PMS)和硝基四氮唑蓝(NBT)均购Amresco;硫代巴比妥酸(TBA)、脱氧核糖(DR):购自Fluka;Sephadex G-35 (分离范围1000u~17000u):购自上海医药工业研究院;离子交换柱Macro-Prep High Q Support:Bio-Rad Lab;HiTrap脱盐柱:Amersham;HPLC的YMC-Pack PROTEIN-RP柱和Symmetry shield TM RP18:分别购自YMC公司和Waters公司;其他化学试剂购自中国医药集团化学试剂部。
2结果和讨论
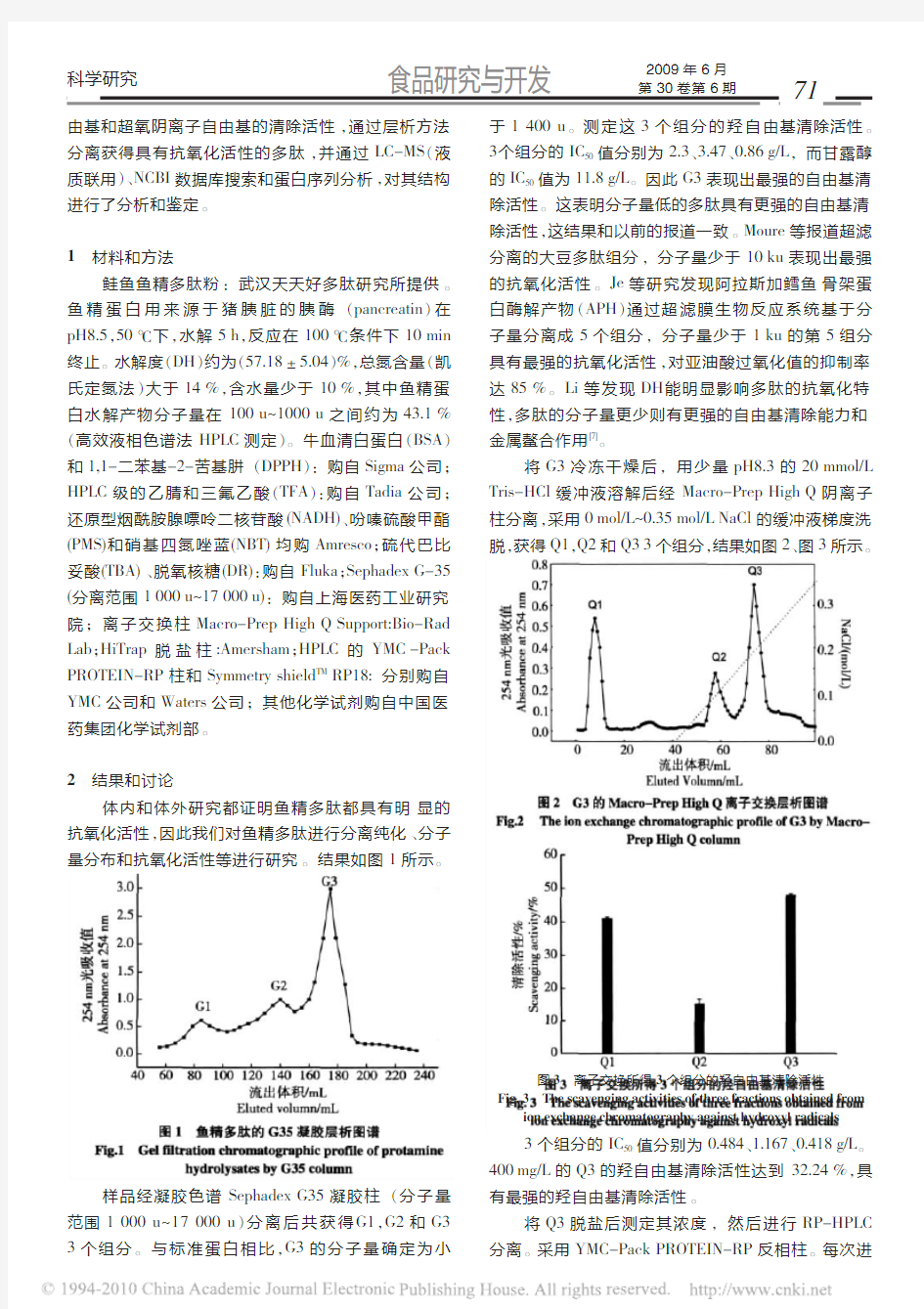
体内和体外研究都证明鱼精多肽都具有明显的抗氧化活性,因此我们对鱼精多肽进行分离纯化、分子量分布和抗氧化活性等进行研究。结果如图1所示。
样品经凝胶色谱Sephadex G35凝胶柱(分子量范围1000u~17000u)分离后共获得G1,G2和G3 3个组分。与标准蛋白相比,G3的分子量确定为小于1400u。测定这3个组分的羟自由基清除活性。3个组分的IC50值分别为2.3、3.47、0.86g/L,而甘露醇的IC50值为11.8g/L。因此G3表现出最强的自由基清除活性。这表明分子量低的多肽具有更强的自由基清除活性,这结果和以前的报道一致。Moure等报道超滤分离的大豆多肽组分,分子量少于10ku表现出最强的抗氧化活性。Je等研究发现阿拉斯加鳕鱼骨架蛋白酶解产物(APH)通过超滤膜生物反应系统基于分子量分离成5个组分,分子量少于1ku的第5组分具有最强的抗氧化活性,对亚油酸过氧化值的抑制率达85%。Li等发现DH能明显影响多肽的抗氧化特性,多肽的分子量更少则有更强的自由基清除能力和金属鳌合作用[7]。
将G3冷冻干燥后,用少量pH8.3的20mmol/L Tris-HCl缓冲液溶解后经Macro-Prep High Q阴离子柱分离,采用0mol/L~0.35mol/L NaCl的缓冲液梯度洗脱,获得Q1,Q2和Q33个组分,结果如图2、图3所示。
3个组分的IC50值分别为0.484、1.167、0.418g/L。400mg/L的Q3的羟自由基清除活性达到32.24%,具有最强的羟自由基清除活性。
将Q3脱盐后测定其浓度,然后进行RP-HPLC 分离。采用YMC-Pack PROTEIN-RP反相柱。每次进图3离子交换所得3个组分的羟自由基清除活性
Fig.3The scavenging activities of three fractions obtained from ion exchange chromatography against hydroxyl radicals
科学研究71
2009年6月第30卷第6期食品研究与开发
图6
P5的反相柱分离图谱
Fig.6RP-HPLC profile of P5by C 18Symmetry Shield TM RP18
column
保留时间/min
Retention time/min
图4Q3的RP-HPLC 分离图谱
Fig.4RP-HPLC profile of Q3by C 4YMC-Pack PROTEIN-RP
column
样50μL ,含量约为3mg 。流动相为含0.1%TFA 的3%乙腈,采用等度洗脱,流速为0.8mL/min ,检测波长为
280nm 。如图4、图5所示。
共检测到6个组分,分别命名为P1,P2,P3,P4,
P5和P6。测定各个组分的羟自由基清除活性,结果表明在40mg/L 低浓度下,组分P5的羟自由基清除活性是P1的2.1倍,在6个组分中羟自由基清除活性最高。
收集P5后再次对其进行分离,采用Symmetry
Shield TM RP18反相柱,流动相为含0.1%TFA 的3%乙腈,等度洗脱。结果如图6所示。
由图6可见,只检测到一个洗脱峰,将其命名为
PHP 。羟自由基清除实验显示PHP 在40mg/L 浓度时,对
羟自由基的清除活性为21.04%。
3小结
从大豆、鸡蛋清蛋白和鱼蛋白酶解产物中得到的天然抗氧化剂不仅具有丰富的营养功能,而且能有效抑制和清除体内的自由基。这些天然抗氧化剂目前正成为食品和医学领域的研究热点。研究表明,来源于渔业副产品的鱼精蛋白酶解产物(Protamine
hydrolysate ),在体内和体外都具有良好的抗氧化活性,
主要活性成分为一系列的小分子多肽,其中二肽Pro-
Arg 为最主要抗氧化肽。这项研究为鱼精多肽在食品和保健食品中应用提供了科学而详细的证据,也为鱼精的广泛利用提供了支持。参考文献:
[1]Ames B N.Dietary carcinogens and anticarcinogens:Oxygen radicals and degenerative diseases[J].Science,1983,221:1256-1264[2]Smith M A,Perry G,Richey P L,et al.Oxidative damage in Alzheimer ’s[J].Nature,1996,382:120-121
[3]Beckman K B,Ames B N.The free radical theory of aging matures [J].Physiological reviews,1998,78:547-581
[4]
王勇刚,朱锋荣,韩福森,等.鱼精多肽在抗氧化和抗疲劳方面的作用研究[J].食品科技,2007:245-248
[5]Chen H M,Muramoto K,Yamauchi F.Structural analysis of antiox -idative peptides from soybean[J].J Agric Food Chem,1995,43:574
[6]Chen H M,Muramoto K,Yamauchi F,et al.Antioxidative properties
of histidine -containing peptides designed from peptide fragments found in the digests of a soybean protein [J].Journal of Agricultural and Food Chemistr,1998,46:49-53[7]
Li B,Chen F,Wang X,et al.Isolation and identification of antioxida -tive peptides from porcine collagen hydrolysate by consecutive chro -matography and electrospray ionization-mass spectrometry [J].Food Chemistry,2007,102:1135-1143[8]
Kim S K,Lee H C,Byun H G,et al.Isolation and characterization of antioxidative peptides from enzymatic hydrolysates of yellowfin sole skin gelation[J].Journal of Korean Fisheries Society,1996,29:246-255[9]
Jun S Y,Park P J,Jung W K,et al.Purification and characterization of an antioxidative peptide from enzymatic hydrolysate of yellowfin sole (Limanda aspera)frame protein [J].European Food Research and Technology,2004,219:20-26
[10]Kim S K,Kim Y T,Byun H G,et al.Isolation and characterization of
antioxidative peptides from gelatin hydrolysate of Alaska pollack skin [J].Journal of Agricultural and Food Chemistry,2001,49:1984-1989[11]Jeon Y J,Byun H G,Kim S K.Improvement of functional properties
of cod frame protein hydrolysates using ultrafiltration membranes[J].Process Biochemistry,1999,35:471-478
[12]Gill T A,Singer D S,Thompson J W.Purification and analysis of
protamine[J].Process Biochemistry,2006,41:1875-1882
收稿日期:2008-11-26
图5RP-HPLC 纯化得到的6个组分的羟自由基清除活性
Fig.5The scavenging activities of six fractions obtained from RP-HPLC against hydroxyl radicals
保留时间/min Retention time/min
科学研究
72
药物分离与纯化技术提纲(自制).
第一章绪论 1.药物分离与纯化过程分为机械分离与传质分离,机械分离针对非均相混合物,传质分离(物质传递)针对均相混合物,分为平衡分离过程与速度控制分离。 2.分离剂可以是能量或物质(质量)。 第二章药物分离纯化前的预处理技术 1.预处理的目的:将目的产物转移到易于分离的相态中(液相),同时除去大部分杂质,改变流体特性,利于后续分离。 2.药物成分的形成阶段只能获得含有目的药物成分的混合物,难以进行药物分离。 3.预处理主要完成任务: (1)去除大部分可溶性杂质(阳离子、生物大分子) (2)采用凝聚或絮凝技术,将胶体状态的杂质转化为易于分离的较大颗粒。(3)改善料液的流动性,便于固液分离 (4)固液分离 (5)将胞内产物从细胞内释放出来 4.沉淀技术: (1)高价离子:Ca2+、Mg2+、Fe3+ a影响离子交换 b对药物降解加速催化作用 (2)生物大分子(可溶性黏胶状物):蛋白、核酸、多糖 a粘度增大,影响固-液分离。 b乳化作用,吸附离子基团。 5.沉淀法去除杂质常用的方法:等电点沉淀法,变性沉淀法,盐析法,有机溶剂沉淀法,反应沉淀法。 6.等电点沉淀法原理:蛋白质是两性电解质,当溶液PH值处于等电点时,分子表面净电荷为0,双电层和水化膜结构被破坏,由于分子间引力,形成蛋白质聚集体,进而产生沉淀。
7.变性沉淀法原理:利用蛋白质、酶、核酸等生物大分子对某种物理或化学因素的敏感性差异,实现分离。 8.盐析法概念:在高浓度的中性盐存在下,蛋白质(酶)等生物大分子物质在水溶液中的溶解度降低,产生沉淀的过程。 9.盐析法影响因素: (1)盐析剂的性质和加入量 (2)溶液的pH值 (3)蛋白类化合物的性质 (4)蛋白浓度 (5)温度 10.常用的凝聚剂:AlCl3·6H2O、Al2(SO43·18H2O(明矾)、 K2SO4·Al2(SO43·24H2O、FeSO4·7H2O、FeCl3·6H2O、ZnSO4和MgCO3等。 11.凝聚作用与絮凝作用的区别:凝聚作用是指某些电解质(凝聚剂)作用下,破坏胶体系统分散状态,而使胶体粒子聚集过程,而絮凝作用是通过架桥作用将许多微粒聚集在一起,形成粗大的松散絮团的过程。 12.助滤剂:具有一定刚性的颗粒或纤维状的固体。 13.常用助滤剂:硅藻土,珍珠岩,活性碳等。 14.细胞破碎方法 (1)机械法:高压均浆法(可大规模操作),珠磨法(可较大规模操作)、超声破碎法、X-press法 (2)非机械法:酶解法、化学渗透法、渗透压法、冻结融化法、干燥法。 15.高压匀浆法原理:细胞悬浮液在高压的作用下从阀座与阀之间的环隙高速喷出,每秒速度高达几百米,高速喷出的浆液又射到静止的撞击环上,被迫改变方向从出口管流出。细胞在这一系列高速运动过程中经历了剪切、碰撞及由高压到常压的变化,从而造成细胞破碎。 第三章萃取技术
碱性蛋白酶的分离纯化与性质初探
碱性蛋白酶的分离纯化与性质初探 一、综述本课题国内外研究动态,说明选题的依据和意义: 1.国内外研究现状 碱性蛋白酶(Alkaline protease)广泛存在于微生物中,最早发现在猪的胰脏中,1913年Rhom首先将胰蛋白酶作为洗涤浸泡剂使用。1945年瑞士的Dr.Jagg 等发现了微生物碱性蛋白酶,使其成为洗涤剂的主要添加剂之一。碱性蛋白酶在丝绸、制革工业、饲料工业、动物食品加工中也有广泛用途。由于市场的需求,高产、高效、耐高温、耐高碱的四高型碱性蛋白酶成为国内外当前研究的热点之一[1]。 研究结果发现,海洋酶具有作用pH 范围宽,最适pH 和反应温度适中,随反应温度的降低酶活性下降缓慢等特点。海洋酶所具有的独特性质,引起学术界高度重视,日、美等国就此展开了深入的研究。迄今为止,由海洋微生物生产海洋酶的专利已达20 余项。海洋微生物酶的研究正逐渐成为发达国家开发新型酶制剂的重要途径[2,3]。 相比之下,国内在海洋碱性蛋白酶研究方面差距较大。综合多篇文献分析,目前针对海洋细菌产生的碱性蛋白酶,分离提纯的方法大致多采用饱和硫酸铵分级盐析和层级技术。首先是从发酵液取上清制备粗酶液(此酶为一种外分泌蛋白,无需通过溶菌酶溶解或超声波破碎细胞来制备粗酶液),通过超速离心沉淀,饱和硫酸铵分级盐析,透析,凝胶层析或离子交换层析来分离提纯该菌所产生的碱性蛋白酶。其中一些已经对酶的性质、序列等进行了研究[4-7]。 2.选题依据及意义 此毕业设计的课题为《碱性蛋白酶的分离纯化及性质初探》,主要是对海洋细菌进行培养及分离提纯方案的改进,并对其性质进行初步探究。大致是将各种相关参数和实验数据建立正交关系得到最佳培养条件,并对其产生的碱性蛋白酶进行分离提纯,同时得出最佳分离提纯方案。最后对碱性蛋白酶的性质进行初步研究。本设计针对目前研究较少的产碱性蛋白酶的海洋微生物新菌株,研发新型高效的碱性蛋白酶,这对满足人类生活、生产与技术开发的需求至关重要。这种积极采用微生物代替化学法的探究,有利于开发现代生物新产品的工业化生产技术研究,有利于加快现代生物领域产业的发展。 二、研究的基本内容,拟解决的主要问题 1.海水中碱性蛋白酶高产菌株的筛选;
蛋白质和多肽提取分离
蛋白质与多肽提取分离 1 分离方法 采取何种分离纯化方法要由所提取的组织材料、所要提取物质的性质决定。对蛋白质、多肽提取分离常用的方法包括:盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法等。这些方法常常组合到一起对特定的物质进行分离纯化,同时上述这些方法也是蛋白、多肽类物质分析中常用的手段,如层析、叫泳等。 1.1 高效液相色谱(HPLC) HPLC的出现为肽类物质的分离提供了有利的方法手段,因为蛋白质、多肽的HPLC应用与其它化合物相比,在适宜的色谱条件下不仅可以在短时间内完成分离目的,更重要的是HPLC 能在制备规模上生产具有生物活性的多肽。因此在寻找多肽类物质分离制备的最佳条件上,不少学者做了大量的工作。如何保持多肽活性、如何选择固定相材料、洗脱液种类、如何分析测定都是目前研究的内容。 1.1.1 反相高效液相色谱(RP-HPLC) 结果与保留值之间的关系:利用RP-HPLC分离多肽首先得确定不同结构的多肽在柱上的保留情况。为了获得一系列的保留系数,Wilce等利用多线性回归方法对2106种肽的保留性质与结构进行分析,得出了不同氨基酸组成对保留系数影响的关系,其中极性氨基酸残基在2~20氨基酸组成的肽中,可减少在柱上的保留时间;在10~60氨基酸组成的肽中,非极性氨基酸较多也可减少在柱上的保留时间,而含5~25个氨基酸的小肽中,非极性氨基酸增加可延长在柱上的保留时间。同时有不少文献报道了肽链长度、氨基酸组成、温度等条件对保留情况的影响,并利用计算机处理分析得到每种多肽的分离提取的最佳条件。 肽图分析(Peptide Mapping):肽图分析是根据蛋白质、多肽的分子量大小以及氨基酸组成特点,使用专一性较强的蛋白水解酶[一般未肽链内切酶(endopeptidase)]作用于特殊的肽链位点将多肽裂解成小片断,通过一定的分离检测手段形成特征性指纹图谱,肽图分析对多肽结构研究合特性鉴别具有重要意义。利用胰蛋白酶能特意性作用于Arg和Lys羧基端的肽链的性质,通过RP-HPLC法采用C18柱检测了重组人生长激素特征性胰肽图谱。同时胰岛素的肽图经V8酶专一裂解也制得,并可鉴别仅相差一个氨基酸残疾的不同种属来源的胰岛素。人类肿瘤坏死因子的单克隆抗体结构也应用酶解法及在线分析技术确定了肽图,便于鉴定分析。此项技术已经在新药开发中得到广泛应用。 1.1.2疏水作用色谱(Hydrophobic interaction chromatogrphy,HIC) HIC是利用多肽中含有疏水基因,可与固定相之间产生疏水作用而达到分离分析的目的,其比RP-GPLC具有较少使多肽变性的特点。利用GIC分离生产激素(GH)产品的结构与活性比EP-GPLC分离的要稳定,活性较稳定。Geng等利用HIC柱的低变性特点,将大肠杆菌表达出的经盐酸胍乙啶变性得到人重组干扰素-γ。通过HIC柱纯化、折叠出高生物活性的产品。不同人尿表皮生长因子(EGF)也利用HIC纯化到了,均具有良好的生物活性。HIC可将未经离子交换柱的样品纯化。而RP-HPLC则不能达到这一要求。 1.1.3 分子排阻色谱(Sizs-Exclusion chromatogrphy,SEC) SEC是利用多肽分子大小、形状差异来分离纯化多肽物质,特别对一些较大的聚集态的分子更为方便,如人重组生长激素(hgH)的分离,不同结构、构型的GH在SEC柱上分离行为完全不同,从而可分离不同构型或在氨基酸序列上有微小差异的变异体,利用SEC研究修饰化的PEG的分离方法,此PEC具有半衰期长、作用强的特点。一些分子量较大的肽或蛋白均可利用此法分离分析。 1.1.4离子交换色谱(Iron-Exchange chromatography,IEXC) IEXC可在中性条件下,利用多肽的带电性不同分离纯化具有生物活性的多肽。其可分为阳离
大豆活性肽的分离纯化和生理活性
大豆活性肽的分离纯化和生理活性 大豆蛋白肽是利用酶法或微生物发酵法将大豆蛋白降解成多肽、短肽和氨基酸的混合物。大豆蛋白肽是一种重要的肽来源。大豆蛋白肽与蛋白质相比较,多肽具有如下特点:在较宽的pH 范围内溶解度高,容易在体内消化和吸收;渗透压低,能够避免高渗透压导致的腹泻;不容易导致过敏。Rerat 等研究表明,短肽的特点是吸收速度快、消耗能量低、载体不易饱和,不同肽之间运转没有竞争和抑制。 随着生物技术与生命科学的不断进步与发展,大豆多肽的功能越来越多的被人们所发掘,而某些活性肽的结构与生理功能也逐渐被人们所认识和了解,这对活性肽的研究起到了推动作用,更有利于人类对大豆活性肽进行研究与开发。 迄今为止,从大豆蛋白中已分离出降血压肽、免疫调节肽、抗氧化肽、降胆固醇肽、抗血栓形成、促进钙磷及微量元素的吸收等多种纯化的大豆蛋白生物活性肽,对这些大豆活性肽的研究情况进行了综述,以期为大豆活性肽的应用提供参考。 1 大豆蛋白活性肽的分离和纯化目前,生产大豆活性肽的方法主要三种有:酶解法、微生物发酵法和化学法,最为先进的是微生物发酵法,它不仅能修饰肽的苦味。还能将原料中的KTI 和BBI 等影响消化和口味的抗营养因子降解。 大豆蛋白肽的活性易受到外界条件的影响,在过强的酸碱、较
高的温度与剧烈震荡等条件下都有可能失活。初始的肽液成分相对较复杂,目标产物的浓度也比较低,一般低于5%,含有大 量杂质,某些杂质的理化性质和目标产物有相似之处,这就提高了大豆肽的分离纯化的难度。传统多肽分离工艺,如吸附沉淀、溶媒、萃取和离子交换法等步骤繁多,耗时,原料消耗量大,耗能高,得到的产品较少。生物技术的发展与人们对大豆肽结构和功能研究的不断深入,大豆肽分离检测技术也获得了突飞猛进的发展,出现了反相高效液相色谱法、凝胶过滤色谱法、毛细管电泳法、膜分离法、各种技术手段的联用等许多高效的分离纯化技术和手段。 1.1反相高效液相色谱(RP—HPLC法 反相高效液相色谱是一种色谱洗脱法,它以非极性的反相介质为固定相,流动相是水溶液或甲醇、乙腈等极性有机溶剂。根据流动相中被分离溶质疏水性的不同,与固定相发生的作用大小的差异,使被分离物质在固定相和流动相中具有不同的分配系数,从而进行分离纯化。 如果大豆多肽是疏水性较弱的分子,它和固定相之间的作用比较小,能够较快流出;反之,如果大豆多肽分子疏水性比较大,流出会比较靠后。反相高效液相色谱法分离纯化大豆活性肽时采用三氟乙酸- 乙氰这种挥发性冲剂作为流动相,其纯化产品不需脱盐,这样就简化了操作步骤,对于分子量在lOOODa以下的小分子大豆肽类物质的分离和纯化尤为重要。 反相高效液相色谱分离和纯化大豆活性肽时多采用增加流动相
酶的分离纯化方法介绍
酶的分离纯化方法介绍 酶的分离纯化一般包括三个基本步骤:即抽提、纯化、结晶或制剂。首先将所需的酶从原料中引入溶液,此时不可避免地夹带着一些杂质,然后再将此酶从溶液中选择性地分离出来,或者从此溶液中选择性地除去杂质,然后制成纯化的酶。 关键词:酶抽提纯化结晶制剂细胞破碎cell disruption 盐析亲和沉淀有机溶剂沉淀 生物细胞产生的酶有两类: 一类由细胞内产生后分泌到细胞外进行作用的酶,称为细胞外酶。这类酶大都是水解酶,如酶法生产葡萄糖所用的两种淀粉酶,就是由枯草杆菌和根酶发酵过程中分泌的。这类酶一般含量较高,容易得到; 另一类酶在细胞内产生后并不分泌到细胞外,而在细胞内起催化作用,称为细胞内酶,如柠檬酸、肌苷酸、味精的发酵生产所进行的一系列化学反应,就是在多种酶催化下在细胞内进行的,在类酶在细胞内往往与细胞结构结合,有一定的分布区域,催化的反应具有一定的顺序性,使许多反应能有条不紊地进行。酶的来源多为生物细胞。生物细胞内产生的总的酶量虽然是很高的,但每一种酶的含量却很低,如胰脏中期消化作用的水解酶种类很多,但各种酶的含量却差别很大。 因此,在提取某一种酶时,首先应当根据需要,选择含此酶最丰富的材料,如胰脏是提取胰蛋白酶、胰凝乳蛋白酶、淀粉酶和脂酶的好材料。由于从动物内脏或植物果实中提取酶制剂受到原料的限制,如不能综合利用,成本又很大。目前工业上大多采用培养微生物的方法来获得大量的酶制剂。从微生物中来生产酶制剂的优点有很多,既不受气候地理条件限制,而且动植物体内酶大都可以在微生物中找到,微生物繁殖快,产酶量又丰富,还可以通过选育菌种来提高产量,用廉价原料可以大量生产。 由于在生物组织中,除了我们所需要的某一种酶之外,往往还有许多其它酶和一般蛋白质以及其他杂质,因此为制取某酶制剂时,必须经过分纯化的手续。 酶是具有催化活性的蛋白质,蛋白质很容易变性,所以在酶的提纯过程中应避免用强酸强碱,保持在较低的温度下操作。在提纯的过程中通过测定酶的催化活性可以比较容易跟踪酶在分离提纯过程中的去向。酶的催化活性又可以作为选择分离纯化方法和操作条件的指标,在整个酶的分离纯化过程中的每一步骤,始终要测定酶的总活力和比活力,这样才能知道经过某一步骤回收到多少酶,纯度提高了多少,从而决定着一步骤的取舍。 酶的分离纯化一般包括三个基本步骤:即抽提、纯化、结晶或制剂。首先将所需的酶从原料中引入溶液,此时不可避免地夹带着一些杂质,然后再将此酶从溶液中选择性地分离出来,或者从此溶液中选择性地除去杂质,然后制成纯化的酶制剂。下面就酶的分离纯化的常用方法作一综合介绍: 一、预处理及固液分离技术 1.细胞破碎(cell disruption) 高压均质器法:此法可用于破碎酵母菌、大肠菌、假单胞菌、杆菌甚至黑曲霉菌。将细胞悬浮液在高压下通入一个孔径可调的排放孔中,菌体从高压环境转到低压环境,细胞就容易破碎。菌悬液一次通过均质器的细胞破碎率在12%-67%。细胞破碎率与细胞的种类有关。
木瓜蛋白酶的提取
木瓜蛋白酶的提取、分离纯化及其生物学研究综述及实验方法 13生物技术第二大组第二小组 组员:王玓玥(组长)、王子贺、王思瑶、王宇涛、王守鑫、谭国栋一、研究背景: 在经济飞速发展的今天,人们的生活水平已远远不只在于吃饱穿暖,食品的安全和营养问题受到人们越来越多的关注,绿色健康的生活也成为大家共同的追求,木瓜蛋白酶以它自身耐热及特殊结构等特点被广泛的用于食品行业,如何分离纯化得到高纯度低成本的木瓜蛋白酶则是人们现在研究的重点,本小组便也以此为研究主题展开实验。 二、木瓜蛋白酶基本介绍:木瓜蛋白酶,又称木瓜酶,是一 种蛋白水解酶。木瓜蛋白酶是番木瓜中含有的一种低特异性蛋白水解酶,广泛地存在于番木瓜的根、茎、叶和果实内,其中在未成熟的乳汁中含量最丰富。木瓜蛋白酶的活性中心含半胱氨酸,属于巯基蛋白酶,它具有酶活高、热稳定性好、天然卫生安全等特点,这种蛋白水解酶,分子量为23406,由一种单肽链组成,含有212个氨基酸残基。至少有三个氨基酸残基存在于酶的活性中心部位,他们分别是Cys25、His159和Asp158,当Cys25被氧化剂氧化或与金属离子结合时,酶的活力被抑制,而还原剂半胱氨酸(或亚硫酸盐)或EDTA能恢复酶的活力木瓜蛋白酶是一种在酸性、中性、碱性环境下均能分解蛋白质的蛋白酶。它的外观
为白色至浅黄色的粉末,微有吸湿性;木瓜蛋白酶溶于水和甘油,水溶液为无色或淡黄色,有时呈乳白色;几乎不溶于乙醇、氯仿和乙醚等有机溶剂。木瓜蛋白酶是一种含巯基(-SH)肽链内切酶,具有蛋白酶和酯酶 的活性,有较广泛的特异性,对动植物蛋白、多肽、酯、酰胺等有较强的水解能力,但几乎不能分解蛋白胨。木瓜蛋白酶的最适合PH值6~7(一般3~9.5皆可),在中性或偏酸性时亦有作用,等电点(pI)为8.75;木瓜蛋白酶的最适合温度55~65℃(一般10~85℃皆可),耐热性强,在90℃时也不会完全失活;受氧化剂抑制,还原性物质激活。。另外六个半胱氨酸残基形成了三对二硫键,且都不在活性部位。纯木瓜蛋白酶制品可含有:(1)木瓜蛋白酶,分子量21000,约占可溶性蛋白质的10%;(2)木瓜凝乳蛋白酶,分子量26000,约占可溶性蛋白质的45%;(3)
多肽类分析分离方法
多肽类化合物广泛存在于自然界中,其中对具有一定生物活性的多肽的研究,一直是药物开发的一个主要方向。生物体内已知的活性多肽主要是从内分泌腺组织器官、分泌细胞和体液中产生或获得的,生命活动中的细胞分化、神经激素递质调节、肿瘤病变、免疫调节等均与活性多肽密切相关。随着现代科技的飞速发展,从天然产物中获得肽类物质的手段也不断得到提高。一些新方法、新思路的应用。不断有新的肽类物质被发现应用于防病治病之中。本文介绍了近几年肽类物质分离、分析的主要方法研究进展。 1 分离方法 采取何种分离纯化方法要由所提取的组织材料、所要提取物质的性质决定。对蛋白质、多肽提取分离常用的方法包括:盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法等。这些方法常常组合到一起对特定的物质进行分离纯化,同时上述这些方法也是蛋白、多肽类物质分析中常用的手段,如层析、电泳等。 1.1 高效液相色谱(HPLC) HPLC的出现为肽类物质的分离提供了有利的方法手段,因为蛋白质、多肽的HPLC 应用与其它化合物相比,在适宜的色谱条件下不仅可以在短时间内完成分离目的,更重要的是HPLC能在制备规模上生产具有生物活性的多肽。因此在寻找多肽类物质分离制备的最佳条件上,不少学者做了大量的工作。如何保持多肽活性、如何选择固定相材料、洗脱液种类、如何分析测定都是目前研究的内容。 1.1.1 反相高效液相色谱(RP-HPLC) 结果与保留值之间的关系:利用RP-HPLC分离多肽首先得确定不同结构的多肽在柱上的保留情况。为了获得一系列的保留系数,Wilce等利用多线性回归方法对2106种肽的保留性质与结构进行分析,得出了不同氨基酸组成对保留系数影响 的关系,其中极性氨基酸残基在2~20氨基酸组成的肽中,可减少在柱上的保留时间;在10~60氨基酸组成的肽中,非极性氨基酸较多也可减少在柱上的保留时间,而含5~25个氨基酸的小肽中,非极性氨基酸增加可延长在柱上的保留时间。同时有不少文献报道了肽链长度、氨基酸组成、温度等条件对保留情况的影响,并利用计算机处理分析得到每种多肽的分离提取的最佳条件。 肽图分析(Peptide Mapping):肽图分析是根据蛋白质、多肽的分子量大小以及氨基酸组成特点,使用专一性较强的蛋白水解酶[一般未肽链内切酶(endopeptidase)]作用于特殊的肽链位点将多肽裂解成小片断,通过一定的分离检测手段形成特征性指纹图谱,肽图分析对多肽结构研究合特性鉴别具有重要意义。利用胰蛋白酶能特意性作用于Arg和Lys羧基端的肽链的性质,通过 RP-HPLC法采用C18柱检测了重组人生长激素特征性胰肽图谱。同时胰岛素的肽图经V8酶专一裂解也制得,并可鉴别仅相差一个氨基酸残疾的不同种属来源的胰岛素。人类肿瘤坏死因子的单克隆抗体结构也应用酶解法及在线分析技术确定了肽图,便于鉴定分析。此项技术已经在新药开发中得到广泛应用。 1.1.2 疏水作用色谱(Hydrophobic interaction chromatogrphy,HIC) HIC是利用多肽中含有疏水基因,可与固定相之间产生疏水作用而达到分离分析的目的,其比RP-GPLC具有较少使多肽变性的特点。利用GIC分离生产激素(GH)产品的结构与活性比EP-GPLC分离的要稳定,活性较稳定。Geng等利用HIC柱 的低变性特点,将大肠杆菌表达出的经盐酸胍乙啶变性得到人重组干扰素-γ。通过HIC柱纯化、折叠出高生物活性的产品。不同人尿表皮生长因子(EGF)也利用HIC纯化到了,均具有良好的生物活性。HIC可将未经离子交换柱的样品纯
胃蛋白酶提取的分离纯化
胃蛋白酶提取法中分离纯化技术的研究进展 摘要:本文就胃蛋白酶的生物提取法,对其在生产过程中的分离、纯化技术展开综述。其中,分离技术主要介绍了:盐析法、有机溶剂沉淀法、底物亲和法、透析法。纯化技术主要介绍了:凝胶过滤法、透析离子交换法。综合比较各分离纯化方法的特点,得到最优的分离纯化方法有机溶剂与盐析共沉淀法、膜分离技术、等电点沉淀法与底物亲和法。 关键词:胃蛋白酶分离纯化应用 .生物提取法生产胃蛋白酶 1.1 工艺路线 (自溶、过滤)(脱脂、去杂质) 猪胃黏膜→自溶液→上清液 (浓缩、干燥) →胃蛋白酶成品 工艺过程 (1)原材料的选择和预处理:胃蛋白酶原主要存在于胃粘膜基底部,采集原料时剥取的粘膜直径大小与收率有关。一般取直径10cm、深2-3mm的胃基底部粘膜最适宜,每头猪胃平均剥取粘膜100g左右。(2)自溶、过滤:在夹套锅内预先加水100升及盐酸升,加热至50度时,在搅拌下加入200千克猪胃黏膜,快速搅拌使酸度均匀,保持45—48度,消化3-4小时,得自溶液。用纱布过滤除去未消化的组织尿蛋白,收集滤液。(3)脱脂、去杂质:将滤液降温至30℃以下,加入15-20%氯仿或乙醚,搅匀后转入沉淀脱脂器内,静置24-48小时,使杂质沉淀,分出弃去,得脱脂酶液。(4)浓缩、干燥:取清酶液,在40℃以下减压浓缩至原体积的1/4左右,再将浓缩液真空干燥。球磨过80-100目筛,即得胃蛋白酶粉。 2胃蛋白酶的分离技术 有机溶剂法
可用于胃蛋白酶的初步提取浓缩。通常使用的有机溶剂有甲醇、乙醇、丙酮、异丙酮,其沉淀蛋白质的能力为:丙酮>异丙酮>乙醇>甲醇。当然此顺序也不是一成不变的,因为还要受温度、pH、离子强度等因素的影响。丙酮沉淀能力最好,但挥发损失多,价格较昂贵,所以工业上常采用乙醇作为沉淀剂。 2.2盐析法 盐析法是酶制剂工业中常用方法之一,硫酸镁、硫酸铵、硫酸钠是常用的盐析剂,其中用的最多的是硫酸铵。美国专利(2,701,228)改进后,用锌盐沉淀胃酶。当母液含醇(或酮)在50%--55%、pH在—时几乎全部胃酶可以用醋酸锌沉淀,沉淀物为胃酶的锌盐,然后用金属螯合剂除去锌盐,得15000—16000倍活力的酶,收集率为%%。此法较上述有机溶剂沉淀所得的胃酶活力和得率都高。 底物亲和法 底物亲和法是利用酶(胃蛋白酶)与其底物(酪蛋白)的亲和性,从胃粘膜中提取得到胃蛋白酶。使底物和酶在的乳酸缓冲液中充分结合,然后调pH至4(底物的等电点)沉淀底物和酶的结合物,随后让沉淀物再溶解于乳酸缓冲液中,添加低浓度的SDS将底物和酶分离,得到酶—SDS复合物,再进一步分离纯化。陈躬瑞(2001)成功的应用此法对蛇胃蛋白酶进行了实验室分离,得率大约为30%。与传统的分离方法比较,此法具有简单高效的优点,为后续的纯化工艺避免了昂贵的活化试剂和配基的使用,同时具有较高的特异性。【2】 透析法 胃蛋白酶的分离过程中还经常用到透析法。该法是利用蛋白质大分子对半透膜的不可透过性而与小分子物质及盐分开的。由于透析主要是扩散过程,如果袋内外的盐浓度相等,扩散就会停止,因此要经常换溶剂,一般一天换2—3次。如在冷处透析,则溶剂也要预先冷却,避免样品变性。透析时的盐是否除净,可用化学试剂或电导仪来检测。【1】 3胃蛋白酶的纯化技术 凝胶过滤法
蛋白质、多肽提取分离
蛋白质、多肽提取分离 1、分离方法 采取何种分离纯化方法要由所提取的组织材料、所要提取物质的性质决定。对蛋白质、多肽提取分离常用的方法包括:盐析法、超滤法、凝胶过滤法、等电点沉淀法、离子交换层析、亲和层析、吸附层析、逆流分溶、酶解法等。这些方法常常组合到一起对特定的物质进行分离纯化,同时上述这些方法也是蛋白、多肽类物质分析中常用的手段,如层析、叫泳等。 1.1 高效液相色谱(HPLC) HPLC的出现为肽类物质的分离提供了有利的方法手段,因为蛋白质、多肽的HPLC应用与其它化合物相比,在适宜的色谱条件下不仅可以在短时间内完成分离目的,更重要的是HPLC能在制备规模上生产具有生物活性的多肽。因此在寻找多肽类物质分离制备的最佳条件上,不少学者做了大量的工作。如何保持多肽活性、如何选择固定相材料、洗脱液种类、如何分析测定都是目前研究的内容。 1.1.1 反相高效液相色谱(RP-HPLC) 结果与保留值之间的关系:利用RP-HPLC分离多肽首先得确定不同结构的多肽在柱上的保留情况。为了获得一系列的保留系数,Wilce等利用多线性回归方法对2106种肽的保留性质与结构进行分析,得出了不同氨基酸组成对保留系数影响的关系,其中极性氨基酸残基在2~20氨基酸组成的肽中,可减少在柱上的保留时间;在10~60氨基酸组成的肽中,非极性氨基酸较多也可减少在柱上的保留时间,而含5~25个氨基酸的小肽中,非极性氨基酸增加可延长在柱上的保留时间。同时有不少文献报道了肽链长度、氨基酸组成、温度等条件对保留情况的影响,并利用计算机处理分析得到每种多肽的分离提取的最佳条件。 肽图分析(Peptide Mapping):肽图分析是根据蛋白质、多肽的分子量大小以及氨基酸组成特点,使用专一性较强的蛋白水解酶[一般未肽链内切酶(endopeptidase)]作用于特殊的肽链位点将多肽裂解成小片断,通过一定的分离检测手段形成特征性指纹图谱,肽图分析对多肽结构研究合特性鉴别具有重要意义。利用胰蛋白酶能特意性作用于Arg和Lys羧基端的肽链的性质,通过RP-HPLC法采用C18柱检测了重组人生长激素特征性胰肽图谱。同时胰岛素的肽图经V8酶专一裂解也制得,并可鉴别仅相差一个氨基酸残疾的不同种属来源的胰岛素。人类肿瘤坏死因子的单克隆抗体结构也应用酶解法及在线分析技术确定了肽图,便
药物分离纯化
1.什么是化学萃取?影响化学萃取的因素?溶质与萃取剂之间的化学作用? 2.什么事截留分子量?各种分离膜(如微滤、超滤、纳滤)的截留组分范围怎样? 3.什么是乳化现象?消除乳化的方法有哪些? 4.什么是反萃取、萃取相、萃余相? 5.什么是有效成分和有效部位? 6.什么是双水相萃取技术?有哪些特点? 7.什么是半仿生提取法?其优点有哪些? 8.什么是分子印迹技术,其特点如何? 9.什么是分子蒸馏,其操作过程如何,有哪些特点? 10.依据分离记理,色谱法分为哪几类? 11.根据料液和溶剂的接触和流动情况,萃取操作过程如何划分? 12.什么是凝胶色谱,其分离机理如何,有哪些用途?其操作过程如何? 13.什么是住色谱,如何操作? 14.活性氧化铝有哪些类型?特点是什么?其含水量关系如何? 15.何为浸漉法,去操作过程如何? 16.离子交换树脂有哪些类型,影响其选择性的因素?其操作过程如何? 17.容积提前中药有效成分时,选择溶剂的原则,常见容积大机型大小如何? 1分离纯化过程:通过物理、化学或生物等手段,或将这些方法结合,将某混合物系分离纯化成两个或多个组成彼此不同的产物的过程。 分离纯化技术:在工业中通过适当的技术手段与装备,耗费一定的能量来实现混合物的分离过程,研究实现这一分离纯化过程的科学技术。 1、药物分离的特点:(1)药物的品种繁多,结构复杂,不同来源的药物性质差别很大,采用的分离技术原理和方法也多种多样。(2)以天然形式存在的药物,或生物来源的药物通常含量较低,杂质的量远远大于有效成分的量。分离过程需要多种方法联合应用,使有效成分的含量不断提高。(3)药物中很多品种特别是天然成分和生物活性物质具有稳定性差、易分解、易变性等特点,在选择分离方法时需要考虑被分离物质的性质,采用适当的分离方法和条件,以保证产品的稳定性(4)从药物研究到药品生产,分离在量上的差别很大,小到 以鉴定、含量测定的6- 10g级,大到生产的吨级的纯化。(5)药品的质量要求高,必须达到国家标准,生产环境需要达到一定的洁净度,防止环境对产品的污染。 2、分离纯化方法按原理分为机械分离和传质分离。 3、萃取:将样品中的目标化合物选择性地转移到另一相中或选择性地保留在原来的相中(转移非目标化合物),从而使目标化合物与原来的复杂机体相互分离的方法。反萃取:调节水相条件,将目标产物从有机相转入水相的萃取操作。萃取相:当溶剂与混合液混合后成为两相,其中一个以萃取剂为主(溶有溶质)的称为萃取相。萃余相:另一个以原溶液为主的(即溶剂含量较低)称为萃余相。萃取液:利用蒸馏、蒸发和结晶等方法除去萃取相中的溶剂后得到的液体称为萃取液。萃余液:利用蒸馏、蒸发和结晶等方法除去萃余相中的溶剂后的液体称为萃余液。化学萃取:也称反应萃取,是利用脂溶性萃取剂与溶质之间的化学反应生成脂溶性复合分子实现溶质向有机相的分配。影响化学萃取的因素:(1)被萃取药物的结构(2)pH的影响(3)温度的影响(4)无机盐的存在(5)溶质的结构(6)萃取剂(7)稀释剂。 4、化学萃取中,溶质与萃取剂之间的化学作用主要有:(1)配位反应(2)阳离子交换反应(3)离子缔合反应萃取(4)协同反应萃取。 5、根据料液和溶剂的接触和流动情况,可以把萃取操作过程分成单级萃取操作和多级萃取
胃蛋白酶提取的分离纯化
胃蛋白酶提取的分离纯 化 IMB standardization office【IMB 5AB- IMBK 08- IMB 2C】
胃蛋白酶提取法中分离纯化技术的研究进展 摘要:本文就胃蛋白酶的生物提取法,对其在生产过程中的分离、纯化技术展开综述。其中,分离技术主要介绍了:盐析法、有机溶剂沉淀法、底物亲和法、透析法。纯化技术主要介绍了:凝胶过滤法、透析离子交换法。综合比较各分离纯化方法的特点,得到最优的分离纯化方法有机溶剂与盐析共沉淀法、膜分离技术、等电点沉淀法与底物亲和法。 关键词:胃蛋白酶分离纯化应用 .生物提取法生产胃蛋白酶 1.1 工艺路线 (自溶、过滤)(脱脂、去杂质) 猪胃黏膜→自溶液→上清液 (浓缩、干燥) →胃蛋白酶成品 工艺过程 (1)原材料的选择和预处理:胃蛋白酶原主要存在于胃粘膜基底部,采集原料时剥取的粘膜直径大小与收率有关。一般取直径10cm、深2-3mm的胃基底部粘膜最适宜,每头猪胃平均剥取粘膜100g左右。(2)自溶、过滤:在夹套锅内预先加水100升及盐酸升,加热至50度时,在搅拌下加入200千克猪胃黏膜,快速搅拌使酸度均匀,保持45—48度,消化3-4小时,得自溶液。用纱布过滤除去未消化的组织尿蛋白,收集滤液。(3)脱脂、去杂质:将滤液降温至30℃以下,加入15-20%氯仿或乙醚,搅匀后转入沉淀脱脂器内,静置24-48小时,使杂质沉淀,分出弃去,得脱脂酶液。(4)浓缩、
干燥:取清酶液,在40℃以下减压浓缩至原体积的1/4左右,再将浓缩液真空干燥。球磨过80-100目筛,即得胃蛋白酶粉。 2胃蛋白酶的分离技术 有机溶剂法 可用于胃蛋白酶的初步提取浓缩。通常使用的有机溶剂有甲醇、乙醇、丙酮、异丙酮,其沉淀蛋白质的能力为:丙酮>异丙酮>乙醇>甲醇。当然此顺序也不是一成不变的,因为还要受温度、pH、离子强度等因素的影响。丙酮沉淀能力最好,但挥发损失多,价格较昂贵,所以工业上常采用乙醇作为沉淀剂。 2.2盐析法 盐析法是酶制剂工业中常用方法之一,硫酸镁、硫酸铵、硫酸钠是常用的盐析剂,其中用的最多的是硫酸铵。美国专利(2,701,228)改进后,用锌盐沉淀胃酶。当母液含醇(或酮)在50%--55%、pH在—时几乎全部胃酶可以用醋酸锌沉淀,沉淀物为胃酶的锌盐,然后用金属螯合剂除去锌盐,得15000—16000倍活力的酶,收集率为%%。此法较上述有机溶剂沉淀所得的胃酶活力和得率都高。 底物亲和法 底物亲和法是利用酶(胃蛋白酶)与其底物(酪蛋白)的亲和性,从胃粘膜中提取得到胃蛋白酶。使底物和酶在的乳酸缓冲液中充分结合,然后调pH至4(底物的等电点)沉淀底物和酶的结合物,随后让沉淀物再溶解于乳酸缓冲液中,添加低浓度的SDS将底物和酶分离,得到酶—SDS复合物,再进一步分离纯化。陈躬瑞(2001)成功的应用此法对蛇胃蛋白酶进行了实验室分离,得率大约为30%。与传统的分离方法比较,此法具有简单高效的优点,为后续的纯化工艺避免了昂贵的活化试剂和配基的使用,同时具有较高的特异性。【2】
大孔吸附树脂在生物活性肽分离纯化中的应用
大孔吸附树脂在生物活性肽分离纯化中的应用 吕红1,卢建中2,张璐1,颜梅1 (1 江西中医学院,南昌,330006,2江中药业股份有限公司,南昌,330096)摘要:随着生物活性肽的的开发和利用,对生物活性肽的分离纯化也越来越引起人们的重视,大孔吸附树脂在生物活性肽分离纯化中的应用报道较少,但其条件温和,设备简单、操作方便的特性,值得在生物活性肽的分离纯化中得到推广和应用,本文就近年来的一些大孔吸附树脂在生物活性肽中的应用进行概述。 关键词:大孔吸附树脂,生物活性肽,抗氧化肽,抗菌肽,抗高血压肽 大孔吸附树脂是20世纪60年代发展起来的一类有机高分子聚合物吸附剂,具有很好的大孔网状结构和较大的比表面积,可通过物理吸附从水溶液中有选择的吸附有机物[1]。 1 大孔吸附树脂的性能 大孔吸附树脂是一类新型非离子型高分子吸附剂,是以苯乙烯和丙酸酯为单体,在0.5%的明胶溶液中,加入乙烯苯为交联剂,甲苯、二甲苯为致孔剂,它们相互交联聚合形成的高分子网状孔穴结构,在整个颗粒内部及外部都具有表面活性。其性质介于天然吸附剂(活性炭、硅胶和硅藻土)和离子交换剂之间,吸附特性与天然吸附剂类似,比离子交换剂更容易再生[2]。 大孔吸附树脂具有以下优点:(1)选择性良好,无机盐的存在有利于吸附; (2)分离和浓缩有机物,得到的化合物灰份低;(3)物理化学稳定性高,不溶于酸、碱及有机溶剂,机械强度好;(4)吸附和解吸较快,吸附容量大;(5)品种规格多,可根据化合物的性质来选择适当结构或极性的吸附剂;(6)吸附树脂呈小球状,直径为0.2-0.8mm,因此流体阻力比活性炭小,流速较快[3]。 2 大孔吸附树脂的原理 大孔吸附树脂的吸附实质为一种物体高度分散或表面分子受作用力不均等而产生的表面吸附现象,这种吸附性能是由于范德华引力或生成氢键的结果。同时由于大孔吸附树脂的多孔结构使其对分子大小不同的物质具有筛选作用。通过上述这种吸附和筛选原理,有机化合物根据吸附力的不同及分子量的大小,在大孔吸附树脂上经一定溶剂洗脱而达到分离、纯化、除杂、浓缩等不同目的。 大孔吸附树脂按其极性大小和所选用的单体分子架构不同,可以分为非极性、中等级性和极性三类,它们的结构和吸附性各不相同。非极性吸附树脂是由偶极距很小的单体聚合制得,不带任何功能基,孔表的疏水性较强,可通过与小分子内的疏水部分的作用吸附溶液中的有机物,最适于极性溶剂中吸附非极性物质,也称为芳香族吸附剂。中等极性的吸附树脂是含酯基的吸附树脂,且用多功能团的甲基丙烯酸酯作为交联剂,其表面兼有疏水和亲水两部分,即可极性溶剂中吸附非极性物质,又可由非极性溶剂中吸附极性物质,也称为脂肪族吸附剂。极性大孔吸附树脂是指含酰胺基、氰基、酚羟基等含氮、氧、硫极性功能基的吸附树脂,通过静电相互作用吸附极性物质,适用于非极性溶剂中吸附极性物质。 3 大孔吸附树脂在生物活性肽分离纯化中的应用 肽是指分子结构介于氨基酸和蛋白质之间的一类化合物,是由20种天然氨基
我国制药分离纯化技术现状和发展方向
我国制药分离纯化技术现状和发展方向 引言:制药工业关系国计民生。一种好的药品,不仅能治疗疾病,而且能够提高国民的身体素质。大千世界,形形色色的动植物,不计其数的化合物,想要从里面找到能够制成药物的有效成分是一件困难的工作。由于药物的纯度和杂质含量与其药效、毒副作用、价格等息息相关,使得分离过程在制药行业中的地位和作用非常重要。因此,制药分离纯化技术在制药工业中具有举足轻重的地位。 一、现状 制药分离过程主要利用待分离的物质中的有效活性成分与共存杂志之间在物理、化学及生物学性质上的差异进行分离,是一个复杂的过程。 近年来,我国的医药产业虽然得了比较大的发展,但是在制药过程上并没有取得重大突破,与发达国家仍有很大的差距。其原因是多方面的,但最主要的原因来自于生产过程中的工艺技术和装备问题,药品提取分离纯化过程作为医药生产过程中最关键的环节,自然而然的成为了首要原因。 目前,在我国制药领域,很多先进的提取分离纯化技术已经得到了发展和应用,但是仍然没有成为制药过程中的主导工艺,依然是以传统落后的提取技术为主导,在制药过程中存在着提取分离技术装备简单,工艺流程单一等缺陷。我国目前的分离提取技术还存在很多不足。设计和开发出一个新的生产系统和设备,显得尤为迫切。 制药提取分离技术及其装备关系到三个问题:(1)能否最大限度
地从药材中提取有效成分,但是保证无用的物质不能被同时转移。(2)能否尽量使所提取物质的量相对平均;(3)能否在尽量满足最大产能的情况下,把成本降到最低。简单来说是产率、工艺条件稳定和效率三个问题。这些问题如果能得到有效的解决,就能为后续生产环节制提供良好的生产环境,实现提高生产质量的最终目的,目前,我国大部分所使用的传统提取工艺和装备都难以解决以上的几个问题,生产中仍然以传统落后的工艺技术和装备为主导,提取生产过程中的装备陈旧、工艺流程单一,集成优化和高效节能的成套装备虽然已经开发出来,但是并没有得到广泛应用,因此,充分利用各种先进的提取分离纯化技术,先进的装备的优势以及自动化控制与在线检测系统的优势,开发出先进、适用的中药提取分离技术流程,并使其得到推广和广泛的应用。 传统的分离纯化方法主要有水提醇沉法(水醇法)、醇提水沉法(醇水法)、酸碱法、盐析法、离子交换法和结晶法等。新的分离纯化方法主要有絮凝沉淀法、大孔树脂吸附法、超滤法、高速离心法等。这些新技术的推广应用,降低了生产成本、提高了产品质量,推动了医药的现代化进程,为我国的医药行业走向国际市场奠定了基础。 二、发展方向 我国的医药生产水平与世界先进的药物提取水平差距甚大,影响了我国医药产品在世界药品市场的地位。中国已经加入WTO,国内医药生产企业要想在竞争中赢得主动,必须采用先进的提取分离技术,才可能使我国医药产品生产和销售在国际市场占有更多的份额,
药物分离与纯化
硕士学位课程考试试卷 考试科目:天然药物的分离与纯化 考生姓名:邱诗春 考生学号:20111902042 学院:生物工程学院 专业:生物学 考生成绩: 任课老师(签名) 考试日期:20 11 年11 月 5 日午时至时
姜黄中天然药物的分离与纯化 摘要:姜黄素是姜黄属植物中的主要活性成分,具有抗癌、抗氧化、抗炎、清除自由基、抗微生物以及对心血管系统、消化系统等多方面药理作用,有较好的临床应用价值和研发潜力。随着提取分离纯化技术的发展,目前有多种方法从植物中提取并分离姜黄素。本文对近年来研究姜黄素的酶法、渗漉法、水杨酸钠法、超临界CO2 萃取法、超声提取法及微波提取法等提取方法;大孔树脂吸附法、聚酰胺吸附法、活性炭色谱法、硅胶柱色谱法、乙酸沉淀法等分离纯化方法进行综述,为进一步开发利用姜黄素提供依据。 关键字:姜黄素;提取;分离 Abstract: Curcumin is one of the major active ingredients in plants of Curcuma L. and has many pharmacological effects, such as: anti-cancer, anti-oxidant, anti-inflammatory, free radical scavenging, and anti-microbial effect in the cardiovascular system and digestive system, and so on. It has better clinical application and developping potential of new drug. With the development of extraction and isolation technology, there are many ways to extract and isolate curcumin from plants. The recent studies of curcumin extraction methods, i.e. enzyme method, percolation method, sodium salicylate method, supercritical CO2, ultrasonic extraction and microwave extraction. Separation methods, i.e. polyamide adsorption, macroporous resin adsorption, polyamide adsorption, activated carbon chromatography, silica gel column chromatography and acid-precipitation method are reviewed to provide the basis evidence for further utilization of curcumin. Key words:curcumin; extraction; separation 姜黄(Curcuma longa)为多年生草本植物,其性味辛、苦、温,入心、肝、脾经,可行气破瘀,通经止痛,并且还有助消化特性,可以作为调味品、天然色素、天然染料,近年来因其具抗肿瘤、抗炎、抗氧化[1,2]等活性而倍受关注.姜
菠萝蛋白酶的提取、分离纯化及活性测定
菠萝蛋白酶的提取、初步分离纯化及活性测定 15食安(1)班张凯 摘要:本研究运用硫酸铵沉淀法和透析法并结合考马斯亮蓝G520染色法测定菠萝皮中蛋白酶活性及蛋白质含量,得到同一品种及成熟度的菠萝皮经两种不同的纯化方法处理,菠萝皮中的蛋白酶都能被有效纯化,但是蛋白酶活性会损失一部分。 关键词:菠萝蛋白酶;透析法;分离纯化;酶活性; 前言 菠萝蛋白酶(bromelain)是从菠萝植株中提取的一类蛋白水解酶的总称,主要存在于菠萝茎和果实中,根据提取部位的不同,分为茎菠萝蛋白酶和果菠萝蛋白酶。Marcano于1891年研究发现菠萝汁中含有蛋白酶。随后,人们对菠萝蛋白酶展开了一系列研究,发现其在医药和化工领域有很好的利用价值。1957年,Heineche等从菠萝茎中提取得到蛋白质水解酶,从而使菠萝蛋白酶实现商品化生产。目前,菠萝蛋白酶的一些功能成分已得到成功分离,并应用于医药领域。随着提取纯化技术的不断进步,高活性的菠萝蛋白酶将广泛应用于医药、化工和食品领域。[1]利用菠萝皮分离纯化菠萝蛋白酶,不仅可充分利用资源,拓展菠萝蛋白酶的获取途径和应用空间,还可降低菠萝加工废料对环境的污染;随着市场对菠萝加工产品需求量的增大,对于菠萝皮的研究与利用就显得尤为重要,尤其对最主要的功能成分蛋白酶的分离、纯化与性质的研究更有意义。[2] 本文通过对菠萝皮蛋白酶的提取,初步分离纯化及活性测定进行了初步研究,探讨影响菠萝蛋白酶活性的影响因素,并解决实验存在的一些问题。 1实验材料与仪器 1.1实验材料与试剂 新鲜菠萝,透析袋(截留相对分子质量8 000~14 000),0.1mo1/L pH 7.8磷酸缓冲液配制(PBS),0.01mo1/L pH 7.8磷酸缓冲液配制(PBS),1%酪蛋白,激活剂[含20mmo1/L半胱氨酸-盐酸盐、1mmo1/L EDTA-Na2 (乙二胺四乙酸二
