2016届高三化学二轮复习作业卷原电池电解池1(含解析)
高三化学二轮复习 电解池精选练习高三全册化学试题

证对市爱幕阳光实验学校专题79 电解池1、化学用语是学习化学的重要工具,以下用来表示物质变化的化学用语中,正确的选项是〔〕A.电解饱和食盐水时,阳极的电极反式:2Cl--2e-=Cl2↑B.发生电化学腐蚀的正极反式:Fe-2e-=Fe2+C.硫化钠的水解反:S2-+H3O+= HS-+H2OD.碳酸氢钠的电离方程式:NaHCO3=Na++H++CO32-【答案】A2、关于右图装置说法正确的选项是〔〕A.装置中电子移动的途径是:负极?Fe ?M溶液?石墨?正极B.假设 M为NaCl溶液,通电一段时间后,溶液中可能有NaClOC.假设M为FeCl2溶液,可以实现石墨上镀铁D.假设M是海水,该装置是通过“牺牲阳极的阴极保护法〞使铁不被腐蚀【答案】B3、如图a、b都是惰性电极,通电一段时间后,b极附近溶液呈蓝色。
以下说法中不正确的选项是( )A.U形管中溶液碱性增强 B.c上析出物质C.a极和Pt都有气泡产生 D.x是正极,y是负极【答案】D4、以下装置的线路接通后,经过一段时间,溶液的pH值明显下降的是【答案】D【解析】解析:A、该装置是原电池装置,H+放电生成氢气,溶液的pH增大,错误;B、该装置是电解池,Cu+2H2O Cu(OH)2+H2↑,氢氧根离子浓度增大,溶液的pH增大,错误;C、电解食盐水,生成氢氧化钠使溶液的pH增大,错误;D、电解硫酸铜实质是电解水和硫酸铜,水中的氢氧根离子放电使溶液中的氢离子浓度增大,溶液的pH减小,正确,答案选D。
5、关于以下各装置图的表达不正确的选项是〔〕① ② ③ ④A.用装置①精炼铜,a极为粗铜,电解质溶液为CuSO4溶液B.装置②盐桥中KCl的Cl-移向乙烧杯C.装置③中钢闸门与外接电源的负极相连获得保护D.装置④可以验证温度对化学平衡的影响【答案】B6、四个电解装置都以Pt作电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测其pH变化,所记录的结果正确的选项是〔〕【答案】C7、用Pt电极电解含有各0.1mol的Cu2-和X3+的溶液,阴极析出固体物质的质量m〔g〕与溶液中通过电子的物质的量n 〔mol〕的关系见图示。
2015-2021高考电化学真题(原电池、电解池、燃料电池)
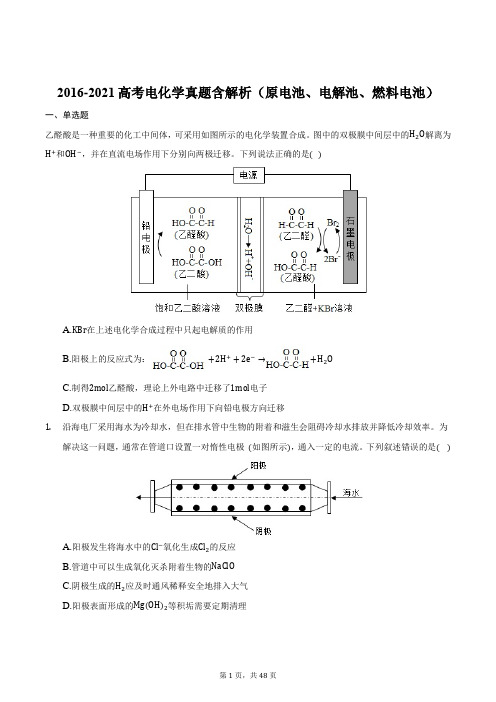
2016-2021高考电化学真题含解析(原电池、电解池、燃料电池)一、单选题乙醛酸是一种重要的化工中间体,可采用如图所示的电化学装置合成。
图中的双极膜中间层中的H2O解离为H+和OH−,并在直流电场作用下分别向两极迁移。
下列说法正确的是( )A.KBr在上述电化学合成过程中只起电解质的作用B.阳极上的反应式为:+2H++2e−→+H2OC.制得2mol乙醛酸,理论上外电路中迁移了1mol电子D.双极膜中间层中的H+在外电场作用下向铅电极方向迁移1.沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。
为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。
下列叙述错误的是( )A.阳极发生将海水中的Cl−氧化生成Cl2的反应B.管道中可以生成氧化灭杀附着生物的NaClOC.阴极生成的H2应及时通风稀释安全地排入大气D.阳极表面形成的Mg(OH)2等积垢需要定期清理2.如图所示电解装置中,通电后石墨电极Ⅱ上有O2生成,Fe2O3逐渐溶解,下列判断错误的是( )A.a是电源的负极B.通电一段时间后,向石墨电极Ⅱ附近滴加石蕊溶液,出现红色C.随着电解的进行,CuCl2溶液浓度变大D.当0.01molFe2O3完全溶解时,至少产生气体336mL(折合成标准状况下)3.某全固态薄膜理离子电池截面结构如图所示,电极A为非晶硅薄膜,充电时Li+得电子成为Li嵌入该薄膜材料中;电极B为LiCoO2薄膜;集流体起导电作用。
下列说法不正确的是()A.充电时,集流体A与外接电源的负极相连B.放电时,外电路通过amol电子时,LiPON薄膜电解质损失C.放电时,电极B为正极,反应可表示为Li1−x CoO2+xLi++xe−=LiCoO2D.电池总反应可表示为Li x Si+Li1−x CoO2Si+LiCoO24.镍镉电池是二次电池,其工作原理示意图如图(L为小灯泡,K1、K2为开关,a、b为直流电源的两极)。
高考化学复习(衡水万卷)高考化学二轮作业卷:原电池、电解池(1)(含解析).docx

高中化学学习材料(灿若寒星**整理制作)2016万卷作业卷(原电池 电解池1)可能用到的相对原子质量:H~1 O~16 S~32 N~14 Cl~35.5 C~12 Na~23 Al~27 K~39 He~4 P~31 Cu~64 Ba~137 Ca~40 Cu~64 Mg~24一 、选择题(本大题共15小题。
在每小题给出的四个选项中,只有一个选项是符合题目要求的) 1.一种熔融碳酸盐燃料电池原理示意如图。
下列有关该电池的说法正确的是( )A .反应CH 4+H 2O =点燃 =======通电 =======电解 ========催化剂△3H 2+CO,每消耗1molCH4转移12mol 电子 B .电极A 上H 2参与的电极反应为:H 2+2OH --2e -=2H 2OC .电池工作时,CO 32-向电极B 移动D .电极B 上发生的电极反应为:O 2+2CO 2+4e -=2CO 32-2.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )A 、 铜电极上发生氧化反应B 、 电池工作一段时间后,甲池的c(SO 42-)减小C 、 电池工作一段时间后,乙池溶液的总质量增加D 、 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡3.用右图所示装置除去含CN -、Cl -废水中的CN -时,控制溶液PH 为9~10,阳极产生的ClO -将CN -氧化为两种无污染的气体,下列说法不正确...的是( )A .用石墨作阳极,铁作阴极B .阳极的电极反应式为:Cl - + 2OH --2e -= ClO -+ H 2OC .阴极的电极反应式为:2H 2O + 2e - = H 2↑ + 2OH -D .除去CN -的反应:2CN -+ 5ClO - + 2H + = N 2↑ + 2CO 2↑ + 5Cl -+ H 2O4.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
高考化学二轮复习高考周测卷原电池电解池2(含解析)

原电池 电解池2可能用到的相对原子质量:H~1 O~16 S~32 N~14 Cl~35.5 C~12 Na~23 Al~27 K~39 He~4 P~31 Cu~64 Ba~137 Ca~40 Cu~64 Mg~24 、选择题1.(双选)为了防止钢铁锈蚀,下列防护方法中正确的是 A. 在精密机床的铁床上安装铜螺钉B. 在排放海水的钢铁阀门上用导线连接一块石墨,一同浸入海水中C. 在海轮舷上用铁丝系住锌板浸在海水里D. 在地下输油的铸铁管上接直流电源的负极2.氢氧燃料电池已用于航天飞机。
以30%KOH 溶液为电解质溶液的这种电池在使用时的电极反应如下:22222H 4OH 4e 4H O,O 2H O 4e ---+-=++据此作出判断,下列说法中错误的是( )A.2H 在负极发生氧化反应B.供电时的总反应为:2222H O 2H O +=C.产物为无污染的水,属于环境友好电池D.燃料电池的能量转化率可达100%3.两个惰性电极插入500 mL AgNO 3溶液中,通电电解。
当电解液的pH 从6.0变为3.0时,(设电解过程中阴极没有H 2放出,且电解液在电解前后体积变化可以忽略不计)电极上析出银的质量最大为A .27 mgB .54 mgC .106 mgD .216 mg4.以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。
关于该电池的叙述正确的是( )A.该电池能够在高温下工作B.电池的负极反应为:+612622C H O +6H O 24e 6CO +24H ↑C.放电过程中, H +从正极区向负极区迁移D.在电池反应中,每消耗1 mol 氧气,理论上能生成标准状况下CO 2气体22.46L 。
用电器 微生物质子交换膜5.如右下图所示,X.Y 分别是直流电源的两极,通电后发现a 极板质量增加,b 极板处有无色无味的气体放出,符合这一 a 极板 b 极板 x 电极 z 溶液 A 锌 石墨 负极 CuSO 4 B 石墨 石墨 负极 NaOH C 银 铁 正极 AgNO 3 D铜石墨负极CuCl 26.有关右图所示装置的叙述中正确的是( ) A.这是电解NaOH 溶液的装置 B.这是一个原电池装置,利用该装置 可长时间观察Fe(OH)2沉淀的颜色 C. Pt 为正极,其电极反应为: 22O +2H O+4e 4OHD.Fe 为阳极,其电极反应为:()3Fe+2OH 2e Fe OH7.野外作业时,可用原电池反应放出的热量来加热食品。
河南省罗山高中2016届高三化学二轮复习 考点突破79 电解池(含解析)

电解池1、用石墨作电极,电解1 mol/L 下列物质的溶液,溶液的pH 保持不变的是( )A .HClB .NaOHC .Na 2SO 4D .NaCl【答案】C【解析】电解HCl 溶液生成氢气和氯气,溶质减少,pH 增大;电解NaOH 溶液实质是电解水,NaOH 溶液浓度增大,pH 也增大;电解NaCl 溶液生成NaOH ,pH 增大。
2、pH =a 的某电解质溶液中,插入两只惰性电极,通直流电一段时间后,溶液的pH >a ,则该电解质可能是 ( )A .H 2SO 4B .AgNO 3 C.Na 2SO 4 D .NaOH【答案】D3、下图装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。
装置Ⅰ的离子交换膜只允许Na +通过,已知电池充放电的化学方程式为:当闭合开关K 时,X 电极附近溶液变红。
下列说法正确的是( )A .闭合开关K 时,钠离子从右到左通过离子交换膜B .闭合开关K 时,负极反应式为:3NaBr-2e -=NaBr 3+2Na +C .闭合开关K 时,X 电极反应式为: 2Cl --2e-=Cl 2↑D .闭合开关K 时,当有0.1molNa +通过离子交换膜,X 电极上析出标准状况下气体1.12L【答案】D4、下列叙述中,正确的是( )A. 在AgBr 饱和溶液中加入3AgNO 溶液,达到平衡时,溶液中-Br 浓度降低B. 常温下,某溶液中由水电离出的()L mol OH c /10110--⨯=,该溶液一定呈酸性C. 3FeCl 溶液和()342SO Fe 溶液加热蒸干、灼烧都得到32O FeD. 用惰性电极分别电解2CuCl 溶液和2MgCl 溶液分别得到单质Cu 和Mg【答案】A5、在25℃时,将两个铂电极插入一定量的硫酸钠饱和溶液中进行电解,通电一段时间后,在阳极逸出a mol 气体,同时有W g Na 2SO 4·10H 2O 析出,若温度不变,此时剩余溶液中溶质的质量分数为( )A.W W +18a×100% B.W W +36a ×100%C.71W 161?W +18a ?×100% D.71W 161?W +36a ?×100% 【答案】D【解析】此题要注意题目条件。
高考化学二轮复习 专题08 电化学(练)(含解析)

专题08 电化学(练)1.【2016年高考新课标Ⅲ卷】锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为-。
下列说法正确的是KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)24()A.充电时,电解质溶液中K+向阳极移动c-逐渐减小B.充电时,电解质溶液中(OH)-C.放电时,负极反应为:Zn+4OH–-2e–===Zn(OH)24D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)【答案】C【解析】【考点定位】考查原电池和电解池的工作原理【名师点睛】本题考查原电池的工作原理和电解池工作原理,这是两个装置的重点,也是新电池的考查点,需要熟记,同时考查对知识的灵活运用;电极反应式的书写是电化学中必考的一项内容,一般先写出还原剂(氧化剂)和氧化产物(还原产物),然后标出电子转移的数目,最后根据原子守恒和电荷守恒完成缺项部分和配平反应方程式,作为原电池,正极反应式为:O2+2H2O+4e-=4OH-,负极电极反应式为:Zn+4OH--2e-=Zn(OH)42-;充电是电解池,阳离子在阴极上放电,阴离子在阳极上放电,即阳离子向阴极移动,阴离子向阳极移动,对可充电池来说,充电时原电池的正极接电源正极,原电池的负极接电源的负极,不能接反,否则发生危险或电极互换,电极反应式是原电池电极反应式的逆过程;涉及到气体体积,首先看一下有没有标准状况,如果有,进行计算,如果没有必然是错误选项。
掌握原电池和电解池反应原理是本题解答的关键。
本题难度适中。
2.【2016年高考浙江卷】金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。
该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。
已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。
下列说法不正确...的是()A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面B.比较Mg、Al、Zn三种金属–空气电池,Al–空气电池的理论比能量最高C.M–空气电池放电过程的正极反应式:4M n++nO2+2nH2O+4ne–=4M(OH)nD.在M–空气电池中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜【答案】C【解析】【考点定位】考查原电池的工作原理。
高考化学第二轮复习 专题 原电池和电解池习题 鲁科版

原电池和电解池【模拟试题】(答题时间:90分钟)1. 微型钮扣电池在现代生活中有着广泛的应用。
有一种银锌电池,其电极分别是O Ag 2和Zn ,电解质溶液为KOH ,电极反应为:O H ZnO e 2OH 2Zn 2+=-+--,O H O Ag 22+ --+=+OH 2Ag 2e 2,总反应为:ZnO Ag 2Zn O Ag 2+=+。
根据上述反应式,下列叙述中正确的是A. 在使用过程中,电池负极区溶液pH 增大B. 在使用过程中,电流由O Ag 2极经外电路流向Zn 极C. 在使用过程中,Zn 电极发生还原反应,O Ag 2电极发生氧化反应D. 外电路中每通过m ol 2.0电子,正极的质量理论上减小1.6g2. 一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(32O Y )的氧化锆(2ZrO )晶体,在熔融状态下能传导-2O 。
下列对该燃料电池说法正确的是A. 在熔融电解质中,-2O 由负极移向正极B. 电池的总反应是:O H 10CO 8O 13H C 2222104+→+C. 通入空气的一极是负极,电极反应为:--=+22O 2e 4OD. 通入丁烷的一极是正极,电极反应为:O H 5CO 4O 13e 26H C 222104+=++--3. 电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:-++++242SO 2H 4PbO Pb O H 2PbSO 224+则下列说法正确的是A. 放电时:电子流动方向由B 到AB. 放电时:正极反应是424PbSO SO e 2Pb =+---C. 充电时:铅蓄电池的负极应与充电器电源的正极相连D. 充电时:阳极反应是+--++=+-H 4SO PbO O H 2e 2PbSO 242244. 一种大型蓄电系统的电池总反应为:322NaBr S Na 2+NaBr 3S Na 42+,电池中的左右两侧为电极,中间为离子选择性膜(在电池放电和充电时该膜允许钠离子通过);放电前,被膜隔开的电解质为22S Na 和3NaBr ,放电后,分别变为42S Na 和NaBr 。
高中化学原电池与电解池练习题及解析
化学专题6 原电池与电解池[例1] 下列关于铜电极的叙述正确的是A .铜锌原电池中铜是正极B .用电解法精炼铜时粗铜作阴极C .在镀件上电镀铜时可用金属铜作阳极D .电解稀硫酸制H 2、O 2时铜作阳极[解析]本题通过对铜电极的判定,将原电池和电解池综合在一起进行考查,意在从中了解考生对电能与化学能转变原理的理解。
题目有一定的知识跨度,在考查知识的同时,也考查了考生思维的严密性和整体性。
在铜锌原电池中,与铜相比,锌易失去电子,因而锌极是负极,则铜极是正极,选项A 正确;精炼铜时,需将其中的铜变成铜离子,再在阴极还原成铜。
因而在电解池中粗铜应作为阳极,选项B 错误;在工件上镀铜时,需要将溶液中的铜离子还原成铜而沉积在工件上。
用作向溶液中供给铜离子的通则必须作为阳极,选项C 正确;电解硫酸时,金属铜如果作为阳极,它将以铜离子的形式被溶解而进入电解液,当电解液内有H +、Cu 2+两种离子共存时,后者将在阴极放电。
这样阴极的生成物将是铜而不是氢气,达不到制氢气和氧气的目的。
选项D 不对。
[答案]A 、C[例2]将质量分数为0.052的NaOH 溶液1L (密度为1.06g ·cm -3)用铂电极电解,当溶[解析]本题考查考生对电解原理的理解。
在设计试题时有意提供了某些可应用于速解的信息,借以考查考生思维的敏捷性。
常规解:由题设条件可知,1LNaOH 溶液中含有的溶质质量为:1000mL ×1.06g ·cm -3×0.052=55.12g ,电解稀硫酸事实上消耗了水,使溶液浓度增大,停止电解时溶质的质量分数为0.062,停止电解时溶液的质量为:g g 889062.012.55=。
则被电解的水为:1060g-889g=171g 。
根据电解水的化学方程式不难算出:在阳极析出的氧气为:g g 1521816171=⨯,在阴极析出的氢气为:g g 19182171=⨯,选项B 正确;非常规解:根据电解NaOH 溶液事实上是电解水这一结论,可看出随着电解的进行,溶液中溶质的质量分数增加,这样,C 、D 两项应予否定。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
原电池 电解池1可能用到的相对原子质量:H~1 O~16 S~32 N~14 Cl~35.5 C~12 Na~23 Al~27 K~39 He~4 P~31 Cu~64 Ba ~137 Ca~40 Cu~64 Mg~24一、选择题(本大题共15小题。
在每小题给出的四个选项中,只有一个选项是符合题目要求的) 1.一种熔融碳酸盐燃料电池原理示意如图。
下列有关该电池的说法正确的是( )A .反应CH 4+H 2O =点燃=======通电 =======电解 ========催化剂△3H 2+CO,每消耗1molCH4转移12mol 电子 B .电极A 上H 2参与的电极反应为:H 2+2OH --2e -=2H 2OC .电池工作时,CO 32-向电极B 移动D .电极B 上发生的电极反应为:O 2+2CO 2+4e -=2CO 32-2.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )A 、铜电极上发生氧化反应B 、电池工作一段时间后,甲池的c(SO 42-)减小 C 、电池工作一段时间后,乙池溶液的总质量增加D 、阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡3.用右图所示装置除去含CN -、Cl -废水中的CN -时,控制溶液PH 为9~10,阳极产生的ClO -将CN -氧化为两种无污染的气体,下列说法不正确...的是( )A .用石墨作阳极,铁作阴极B .阳极的电极反应式为:Cl - + 2OH --2e -= ClO -+ H 2OC .阴极的电极反应式为:2H 2O + 2e - = H 2↑ + 2OH -D .除去CN -的反应:2CN -+ 5ClO - + 2H + = N 2↑ + 2CO 2↑ + 5Cl -+ H 2O4.微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是( )A .正极反应中有CO 2生成B .微生物促进了反应中电子的转移C .质子通过交换膜从负极区移向正极区D .电池总反应为C 6H 12O 6+6O 2=6CO 2+6H 2O 5.在固态金属氧化物电解池中,高温共电解H 2O-CO 2混合气体制备H 2和CO 是一种新的能源利用方式,基本原理如图所示。
下列说法不正确...的是( )A .X 是电源的负极B .阴极的反应式是:H 2O +2eˉ=H 2+O 2ˉCO 2+2eˉ=CO +O 2ˉ C .总反应可表示为:H 2O +CO 2====通电H 2+CO +O 2D .阴、阳两极生成的气体的物质的量之比是1︰16.(2014•西城区校级模拟)下列有关电池的说法正确的是( )A . 手机和电脑用的锂离子电池都属于二次电池B . 铜锌原电池工作时,电子经电解质溶液从锌电极流向铜电极C . 燃料电池能够把燃料储存的化学能通过燃烧转化为电能D . 锌锰干电池中锌电极是负极,工作时锌被还原 7.下列叙述中正确的是( )A .图①中正极附近溶液pH 降低B .图①中电子由Zn 流向Cu ,盐桥中的Cl —移向CuSO 4溶液 C .图②正极反应是O 2+2H 2O +4e¯ 4OH¯D .图②中加入少量K 3[Fe(CN)6]溶液,有蓝色沉淀生成 8.某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO 4+10FeSO 4+8H 2SO 4==2MnSO 4+5Fe 2(SO 4)3+K 2SO 4+8H 2O 盐桥中装有饱和K 2SO 4溶液,下列叙述中正确的是( )A .乙烧杯中发生还原反应B .甲烧杯中溶液的pH 逐渐减小C .电池工作时,盐桥中的SO 2-4 移向甲烧杯D .外电路的电流方向是从a 到b9.如右图所示,将铁棒和石墨棒插入盛有饱和NaCl 溶液的U 型管中,下列分析正确的是( )A .K 1闭合,铁棒上发生的反应为2H ++2e -→H 2↑B .K 1闭合,石墨棒周围溶液pH 逐渐升高C .K 2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法D .K 2闭合,电路中通过0.4N A 个电子时,两极共产生标况下4.48L 气体10.RFC 是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。
右图为RFC 工作原理示意图,下列有关说法正确的是( )图1 图2A .图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用B .当有0.1 mol 电子转移时,a 极产生0.56 L O 2(标准状况下)C .c 极上发生的电极反应是:O 2 + 4H + + 4e - = 2H 2OD .图2中电子从c 极流向d 极,提供电能11.某兴趣小组设计如图所示微型实验装置。
实验时,先断开K 2,闭合K 1,两极均有气泡产生;一段时间后,断开K 1,闭合K 2,发现电流表A 指针偏转。
下列有关描述正确的是A .断开K 2,闭合K 1时,总反应的离子方程式为:2H ++2Cl -=====通电Cl 2↑+H 2↑B .断开K 2,闭合K 1时,石墨电极附近溶液变红C .断开K 1,闭合K 2时,铜电极上的电极反应式为:Cl 2+2e -===2Cl -D .断开K 1,闭合K 2时,石墨电极作正极 12.下列说法正确的是A. 化合反应一定是放热反应B. 乙二醇和丙三醇都易溶于水和乙醇C. 牺牲阳极的阴极保护法是利用了电解原理D. 相同条件下,CuSO 4溶液比FeCl 3溶液使H 2O 2分解速率更快 13.如图为锌铜显示原电池装置图,下列说法不正确( )A .电子由Zn 极流向Cu 极B .该装置的总反应C .一段时间后,A 池带正电荷,B 池带负电荷D .取出盐桥,电流计指针不再偏转14.铅酸蓄电池是目前应用普遍的化学电池,新型液流式铅酸蓄电池以可溶性的甲基磺酸铅为电解质,电池总反应为:Pb +PbO 2 + 4H + −−−→←−−−放电充电2Pb 2+ + 2H 2O. 下列有关新型液流式铅酸蓄电池的说法正确的是( ) A.放电时负极反应式为Pb – 2e - + SO 42-= PbSO 4 B.充放电时,溶液的导电能力变化不大C.以该电池电解NaCl 溶液时,当消耗207gPb 时,在阳极生成Cl 222.4LD.充电时的阳极反应式为Pb 2++ 2e - + 4OH -= PbO 2 +2H 2O15.(2015•中山市校级模拟)如图是实验室研究海水对铁闸不同部位腐蚀情况的剖面图.下列说法正确的是( )A . 该电化腐蚀为析氢腐蚀B . 图中生成铁锈最多的是C 区域 C . A 区域比B 区域更易腐蚀D . 铁闸中的负极的电极反应:Fe ﹣2e ﹣=Fe 2+二、填空(本大题共3小题)16.C 、N 、O 、Al 、Si 、Cu 是常见的六种元素。
(1)Si 位于元素周期表第____周期第_____族。
(2)N 的基态原子核外电子排布式为_____;Cu 的基态原子最外层有___个电子。
(3(4)常温下,将除去表面氧化膜的Al 、Cu 片插入浓HNO 3中组成原电池(图1),测得原电池的电流强度(I )随时间(t )的变化如图2所示,反应过程中有红棕色气体产生。
0-t1时,原电池的负极是Al 片,此时,正极的电极反应式是_____,溶液中的H +向___极移动,t1时,原电池中电子流动方向发生改变,其原因是______。
17.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH ,回收处理该废电池可以得到多种化工原料,有关数据下图所示: 溶解度回答下列问题:(1)该电池的正极反应式为 ,电池反应的离子方程式为: (2)维持电流强度为0.5A ,电池工作五分钟,理论消耗Zn g 。
(已经F=96500C/mol )(3)废电池糊状填充物加水处理后,过滤,滤液中主要有氯化锌和氯化铵,两者可以通过____分离回收,滤渣的主要成分是二氧化锰、______和,欲从中得到较纯的二氧化锰,最简便的方法是,其原理是。
(4)用废电池的锌皮制作七水合硫酸锌,需去除少量杂质铁,其方法是:加入新硫酸和双氧水,溶解,铁变为加碱调节PH为,铁刚好完全沉淀(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全)。
继续加碱调节PH为,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
若上述过程不加双氧水的后果是,原因是。
18.(14分)工业废水中常含有一定量的Cr2O2-7,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一。
该法用Fe和石墨作电极电解含Cr2O2-7的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。
某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
(1)Fe电极为(填“M”或“N”);电解时 (填“能”或“不能”)否用Cu电极来代替Fe电极,理由是。
(2)阳极附近溶液中,发生反应的离子方程式是;阴极附近的沉淀有。
(3)图中熔融盐燃料电池是以熔融碳酸盐为电解质、CH4为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。
已知,该熔融盐电池的负极的电极反应是CH4–8e–+4CO32–==5CO2+2H2O,则正极的电极反应式为。
(4)实验过程中,若电解池阴极材料质量不变,产生4.48L(标准状况)气体时,熔融盐燃料电池消耗CH4的体积为 L(标准状况)。
(5) 已知某含Cr2O2-7的酸性工业废水中铬元素的含量为104.5 mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1。
处理该废水1 000 m3并达到排放标准至少消耗铁的质量为 kg。
2016万卷作业卷(原电池 电解池1)答案解析一、选择题 1.【答案】D【解析】试题分析:A 、1molCH4→CO ,化合价由-4价→+2上升6价,1molCH 4参加反应共转移6mol 电子,故错误;B 、环境不是碱性,否则不会产生CO 2,其电极反应式:CO +H 2+2COe -=3CO 2+H 2O ,故B 错误;C 、根据原电池工作原理,电极A 是负极,电极B 是正极,阴离子向负极移动,故C 错误;D 、根据电池原理,O 2、CO 2共同参加反应,其电极反应式:O 2+2CO 2+4e -=2CO 32-,故D 正确。
考点:考查原电池的工作原理和电极反应式书写。
2.【答案】C【解析】锌铜原电池,锌为负极,铜为正极,锌失去电子发生氧化反应,铜极上Cu 2+得到电子发生还原反应,A 项错误;由于两池间是阳离子交换膜,阴离子不能通过,故甲池中c(SO 42-)不变,B 项错误;由于Zn 2+通过阳离子交换膜进人乙池,Cu 2+得到电子析出铜,由于Zn 的相对原子质量大于铜,故乙池溶液的总质量增大,C 项正确;由于阳离子交换膜阴离子不能透过,故该装置中,阴离子不移动,只有阳离子向正极移动,D 项错误。
