课题1生活中常见的盐上课用
课题1 生活中常见的盐

课题 1 生活中常见的盐
【提问】1、你能说出几种生活中常见的盐吗? 2、 除上述几种盐外,目前我们所接触的盐 还有哪些,能否举例? 3、盐的定义是什么?
由金属离子和酸根离子构成的化合物。
一、氯化钠
• 氯化钠物理性质 • 白色固体,易溶于水特性溶解度受温度的影响不大 • 主要用途 • 日常生活用中于调味,医疗上配制生理盐水 (0.9%),也是重要的化工原料。 • 保存方法 • 不需密封保存
复分解反应 (1)定义:( AB + CD (2)发生反应的条件 AD + CB ) 两种化合物互相交换成分,生成另外两种化合物的反应。
两种化合物交换成分时,必需有沉淀 或气体或水生成。
盐
练 一 练 活动与探究
判断下列物质能否发生化学反应,能反应的 写出化学方程式,不能反应的说明理由: •铁和稀硫酸
盐田
• 我国食盐主要产地是西北部的青海、 内蒙古、新疆、山西等省区,约占我国 盐业总产量的17%多一点。除湖盐之 外,尚有海盐、井盐、矿盐(岩盐)等不 同种类,其中最大的是柴达木盆地的察 尔汗盐池,据统计,仅这一盐池开采 出来的池盐,足够我国十三亿人口食 用四千多年。但是我们平时使用的碘 盐都为井矿盐,而非海盐 。
生成新盐和新碱 (2)能与碱反应,
Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2 NaOH
(3)能与某些盐反应
Na2CO3+ CaCl2==CaCO3 ↓+ 2NaCl
(4)能与某些金属反应
1、生成盐和水反应类型 (共3种): 、 、 。 2、过量Fe投入AgNO3、Cu(NO3)2 溶液中,得到固体 ;Fe、Cu 投入大量AgNO3溶液中,得到固体 为 , 若Fe有剩余,滤液 中溶质为________。
课题1 生活中常见的盐

第十一单元盐化肥课题1 生活中常见的盐教学设计学习目标:1、了解生活中几种常见盐(食盐、碳酸钠、碳酸氢钠、碳酸钙)的性质及用途。
2、知道粗盐提纯的步骤及各步骤操作时的注意事项。
3、初步总结酸、碱、盐之间发生反应的条件,得出复分解反应的条件。
学习重点:1、碳酸盐的检验方法2、复分解反应的条件学习难点:复分解反应的条件【课前预习】1、盐是一类组成里含有和的化合物。
2、写出常见的碳酸钠、碳酸氢钠的化学式及俗称。
3、从海水中获得的盐属于,通过、、等方法可变成我们食用的精盐。
4、写出下列物质中主要成分的化学式:食用碱,发酵粉,石灰石及大理石。
5、举例说出你学过的基本反应类型:;;。
【课内探究】【课后延伸】1、鉴别化合物中含有碳酸根的最简单方法是:A、加入盐酸后产生的气体通入澄清的石灰水出现浑浊B、加盐酸后产生的气体使燃着的木条熄灭C、加热时产生的气体使燃着的木条熄灭D、加热时产生的气体通入石灰水出现浑浊2、列各组物质能在同一溶液中大量共存的是:A、NaCl,HCl,MgSO4,Cu(NO3)2B、AgNO3,NaCl,Mg(NO3)2,NaOHC、Ca(OH)2,NaNO3,Na2CO3,NH4ClD、HCl,K2SO4,NaOH,NaNO33、别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是A、NaNO3,Ba(OH)2,HNO3B、H2SO4,NaNO3,Na2SO4C、H2SO4,NaNO3,FeSO4D、CaCl2,Na2SO4,BaCl24、判断复分解反应能否发生,不必考虑的是A、是否有气体生成B、是否有沉淀生成C、是否有水生成D、金属的活动性5、甲已丙丁四瓶溶液分别是K2CO3, Ba(NO3)2,H2SO4, K2SO4中的一种,其中甲分别能与已丙丁发生反应,则甲是A、K2CO3B、H2SO4C、Ba(NO3)2D、K2SO46、怎样验证水垢、珍珠、蛋壳的主要成分是碳酸钙?7、种物质两两相混是否能发生反应?若能反应,写出方程式。
课题1__生活中常见的盐(确定稿)

③检验方法:取少量待测样品,加入少 量稀盐酸,看能否生成使澄清的石灰水变浑 浊的气体。
实验二:碳酸钠与氢氧化 钙的反应
与碱反应:
碳酸钠溶液+澄清石灰水 现象 分析 出现白色沉淀
二者发生反应,生成一种难溶物
Na2CO3+Ca(OH)2====CaCO3 ↓+2NaOH
(2)能与碱反应,生成新盐和新碱 Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH (3)能与某些盐反应 Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
达标检测
1、有四种澄清透明的溶液:①MgCl2溶液 ②Cu(NO3)2 溶液 ③K2SO4溶液 ④KOH溶液。不用其他试剂就可进 行鉴别,鉴别出来的先后顺序是(
B
)
A、④①②③
C、③②①④
B、②④①③
D、②①③④
2、化学反应要符合一定的原理和条件,下列认识正确的 是(
C
)
A、化合反应和分解反应一定有单质参加或生成
盐是什么?
练习
俗称 化学式 分类 食盐 纯碱\苏打 烧碱\火碱 生石灰 Na2CO3 盐 硫酸
熟石灰
NaCl
盐
NaOH
碱
CaO
氧化物
H2SO4 Ca(OH)2
酸 碱
新课导入
婚宴无知误用工业盐 中毒放倒八十一人
2002年3月31日上午9时许,重庆市长寿 区罗围乡寿山村发生一起严重的亚硝酸盐食 物中毒事件,当场造成吃婚宴的81人中毒, 其中8人生命垂危。这起罕见的群体中毒事 件其主要原因是,帮忙做饭打杂的一妇女误 将一瓶写有亚硝酸钠的化学品当食盐用了。
二、碳酸钠、碳酸氢钠和碳酸钙
第十一单元课题1 生活中常见的盐(第一课时)

CO32-、HCO3-的检验方法 CaCO3+2HCl=CaCl2+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑ NaHCO3+HCl=NaCl+H2O+CO2↑
①检验依据:组成里含有CO32-或 HCO3-的盐都能与盐酸反应,生成二 氧化碳气体 ②检验试剂:稀盐酸、澄清石灰水 ③检验方法:取少量待测样品,加入 少量稀盐酸,看能否生成使澄清石灰 水变浑浊的气体
快乐记忆
你学过哪些盐?你能写出它们的化学式吗? 钠盐
盐酸盐 碳酸盐 硝酸盐 硫酸盐
NaCl Na2CO3 NaNO3 Na2SO4
钙盐
CaCl2 CaCO3 Ca(NO3)2 CaSO4
铵盐
NH4Cl (NH4)2CO3 NH4NO3 (NH4)2SO4
我国的制碱工业的先驱——侯德榜
钠盐: NaCl、Na2SO4 、 Na2CO3 钾盐: KCl、K2SO4 、 K2CO3 铵盐: (NH4)2SO 4 、 NH4Cl、 NH4NO3 碳酸盐: K2CO3 、CaCO3 、 Na2CO3 硫酸盐: (NH4)2SO 4 、 K2SO4 、 Na2SO4
思考:
1.食盐知识你了解多少? 2.食盐、工业盐和盐三者是一回事吗? 3.除调味外,你还能说出食盐的其他 用途吗? 4.在自然界中,氯化钠是如何分布的?
3、食盐的制法
(1)直接开采法 (2)海水晒盐法 (3)盐井水煮盐法 (4)盐湖水煮盐法
海南省东方盐场晒盐一景
4、粗盐初步提纯 粗盐中含有较多的可溶性杂质(氯化镁 、氯化钙)和不溶性杂质(泥沙等) 粗盐提纯的步骤: 溶解→沉淀→过滤→蒸发→结晶
二、碳酸钠、碳酸氢钠和碳酸钙
课题1 生活中常见的盐

【总结】八种生成盐的化学反应类型
1、酸 + 金属 → 盐 + 氢气 2、盐 + 金属 → 新金属 + 新盐 3、金属氧化物 +酸 → 盐 + 水 + 水 4、非金属氧化物 + 碱 → 盐 5、酸 + 碱 → 盐 + 水 6、盐 + 酸 → 新盐 + 新酸
7、盐 + 碱
8、盐 + 盐
→
→
新盐
新盐
+
+
P109附录Ⅰ:部分酸、碱和盐的溶解性表(20℃)
盐类:
钾钠铵盐都可溶; 硝酸盐遇水影无踪; 硫酸盐不溶硫酸钡;氯化物中银不溶; 碳酸盐只溶钾钠铵。
碱类:
钾、钠、铵、钡、都可溶
微溶物质有四种:
钙组氢氧硫酸根,碳酸镁拉着硫酸银。
第十一单元 课题1
盐 化肥
生活中常见的盐
第二课时:盐的化学性质
P109附录Ⅰ:部分酸、碱和盐的溶解性表(20℃)
课堂练习
1、氯化钠由(钠离子)和 ( 氯离子)构成 的,俗名叫做( 食盐 )。 2、氯化钠的溶解度受温度变化( 不大 ), 所以一般采用(蒸发溶剂 )方法得到晶体,粗盐 氯化镁 )、( 氯化钙 )等杂质易发生潮 因含有( 物理 解,潮解一般属于( )变化。
2、碳酸钠(Na2CO3) (1)俗称: 纯碱、苏打 (2)性质: 白色固体,易溶于水, 其水溶液呈碱性
盐类:
钾钠铵盐都可溶; 硝酸盐遇水影无踪; 硫酸盐不溶硫酸钡;氯化物中银不溶; 碳酸盐只溶钾钠铵。
碱类:钾、钠、铵、钡、都可溶 微溶物质有四种:
钙组氢氧硫酸根,碳酸镁拉着硫酸银。
二、盐的化学性质: 1、盐 + 金属 → 新盐 + 新金属 方程式:
课题1_生活中常见的盐
H2SO4 Ba(NO3)
2
NaOH
H2SO4
Ba(NO3 √)2
NaOH √
K2CO3 √
白色沉淀 无现象 生成气体
无现象 √ 白色沉淀
无现象
K2CO3
我来归纳 盐的化学性质
(1) 盐 + 金属 = 新盐 + 新金属 置换反应
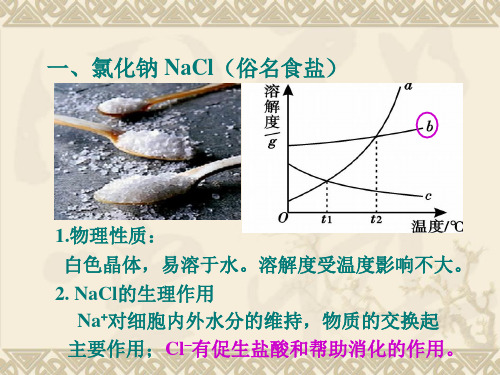
一、氯化钠 NaCl(俗名食盐)
1.物理性质: 白色晶体,易溶于水。溶解度受温度影响不大。 2. NaCl的生理作用
Na+对细胞内外水分的维持,物质的交换起 主要作用;Cl–有促生盐酸和帮助消化的作用。
氯化钠的用途
3. NaCl的用途
调味、腌制食品
配制生理盐水
选种
化工原料
消除积雪
4. 氯化钠的分布
(1)蒸发滤液析出的食盐未完全干燥即进行称量 (2)过滤后液体尚浑浊时,就进行蒸发水份 (3)称量或计算错误。
2、导致粗盐提纯后产率偏低的原因有哪些?
(1)粗盐没有完全溶解就进行过滤操作 (2)在过滤、蒸发过程中没有用玻璃棒引流或 搅拌不当造成液体溅失 (3)在蒸发皿、玻璃棒等处留有食盐等。
二、碳酸钠、碳酸氢钠和碳酸钙
Na2CO3能否与盐酸反应生成CO2?
Na2CO3++22HHCCl l==22NNaaCCl+l H+ 2HC2OO3 +CO2 ↑
⑶ 与澄清石灰水反应
CO2↑+H2O
现
产生白色沉淀
象 碳酸钠与氢氧化钙反应生成碳酸钙
Na分析2CO3+Ca(OH)2= CaCO3 +2NaOH
初中化学第十一单元课题1 课题1生活中常见的盐

是复分解反应,都有气体产生
复分解反应发生的条件
酸、碱、盐之间并不是 都能发生复分解反应。只有 当两种化合物互相交换成分, 生成物中有沉淀或有气体或 有水生成时,复分解反应才 可能发生。
酸、碱、盐之间的反应是复分解反应, 酸跟一些金属氧化物的反应也是复分解反应。
CuO + H2SO4 = CuSO4 + H2O CuO + 2HCl = CuCl2 + H2O Na2O + H2SO4 = Na2SO4 + H2O Na2O + 2HCl = 2NaCl + H2O Fe2O3 + 6 HCl =2 FeCl3 + 3 H2O Fe2O3 + 3 H2SO4 = Fe2(SO4)3 + 3 H2O
除食盐外,生活中你们还见过哪些盐?
碳酸钠(Na2CO3,俗称纯碱、苏打)
高锰酸钾(KMnO4)
虽然叫纯碱,溶液显
碱性,但不是碱是盐
碳酸氢钠(NaHCO3,又叫小苏打)
石灰石和大理石的主 要成分(CaCO3)
一、氯化钠( NaCl) 食盐的用途
调味品
医疗上的生理盐水是用 氯化钠配制的(100mL 生理盐水中含有0.9g医用 氯化钠)。
说明:“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水, “挥”表示挥发性,“—”表示那种物质不存在或者遇到水就分解了。
一些不溶性碱的制取
2NaOH+MgCl2 =Mg(OH)2↓+2NaCl 3NaOH+AlCl3=Al(OH)3↓+3NaCl 2NaOH+FeSO4=Fe(OH)2↓+Na2SO4
碳酸氢钠是焙制糕点所用 的发酵粉的主要成分之一
课题1 生活中常见的盐(第1课时)(课件)九年级化学下册(人教版)

NaHCO3 + HCl = NaCl + H2O + CO2 ↑
新课讲解
侯氏制“碱”法 1、侯氏制碱法制得的碱是 纯碱 Na2CO3 ; 2、侯氏制碱法的原理:
【现象】碳酸钠溶液滴加无色 酚酞试液变 红 色; 【结论】碳酸钠溶液显 碱 性。
+酚酞 碳酸钠溶液
变红色
新课讲解
【实验探究2】用锥形瓶取少量碳酸钠溶 液,滴加稀盐酸,观察现象。
【现象】滴加稀盐酸后有 白色浑浊 产 生,澄清的石灰水变 气泡 ;
【结论】碳酸钠能够与 酸 反应。
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
【现象】滴加CaCl2后有 白色沉淀
产生;
【结论】碳酸钠能够与 盐 反应。 Na2CO3 + CaCl2 = CaCO3 ↓+ 2NaCl
新课讲解
【归纳】碳酸根离子(CO32-)的检验方法:
+HCl
+石灰水
某溶液
有大量气泡产生
变白色浑浊
CO32-
CO2
CaCO3
【讨论】草木灰的主要成分是一种钾盐。向草木灰溶液中
④食盐腌渍蔬菜、鱼、肉、蛋等。
⑤公路上的积雪也可以用氯化钠来消 除,等等。 ⑤
新课讲解
(4)氯化钠的存在 盐 矿
湖 盐
食盐在自然中分布广:海 水、盐湖、盐井和岩矿中都蕴 藏着食盐,但主要存在于海水 中。
海 盐
新课讲解
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
盐酸腐蚀含CaCO3的建材
碳酸钠+ 盐酸
碳酸氢钠+盐酸
现象
白色固体溶解,有气泡产生 澄清石灰水变浑浊 碳酸钠(或碳酸氢钠)与盐 酸反应生成了CO2气体
分析
【演示实验11-1】
【练习】请同学们写出上述有关化学方程式。
碳酸钠+ 盐酸
物质溶解性口诀: 酸都溶,碱中有钾,钠,铵,钙, 钡可溶。钾,钠,铵,硝酸盐都可溶。 盐酸盐只有氯化银不可溶。 硫酸盐只有硫酸钡不可溶。 碳酸盐只溶钾,钠,铵,剩下都不 溶
注:AgCl、BaSO4不仅不溶于水,而且 还不溶于稀硝酸
判断下列物质是否溶于水:
Na2CO3 BaCO3 BaSO 4 (NH4)2S Mg(OH)2 Na 3PO4
常见的盐
五水硫酸铜晶体 食盐 用钡餐观察 肠内情况
明矾晶体
石盐标本
一.常见的盐 1、氯化钠(NaCl)俗称:食盐
氯化钠晶体
晶体结构
食盐
1)分布:
海水、盐湖、盐井和盐矿中都 蕴藏着食盐 海盐
盐 场
氯化钠在生活中的用途
一、氯化钠(NaCl)
1、俗名:食盐 2、用途:
(1)重要的调味品; (2)人体正常生理活动不可缺少的物质; (3)日常生活中用来腌制食品; (4)农业上可以用氯化钠溶液来选种;
(5)工业的原料,可用于制取碳酸钠、氢氧 化钠、氯气和盐酸等。 (6)公路上的积雪也可以用氯化钠来消除。
新闻事件一则
原因是食用 NaNO2工业用盐
某10岁少年因食用非法私制的 食盐而中毒殒命。
我们购买食盐一定要注意,不能 买工业用的盐。
亚硝酸钠
亚硝酸钠是工业用盐,它是 一种白色不透明晶体,形状 很像食盐。亚硝酸盐不仅是 致癌物质,而且摄入0.2~ 0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食 品添加剂的一种,起着色、 防腐作用,广泛用于熟肉类、 灌肠类和罐头等动物性食品。 现在世界各国仍允许用它来 腌制肉类,但用量严加限制。
①与酸反应:
CaCO3+2HCl==CaCl2+H2O+CO2 ↑
②高温分解:
CaCO3=高温=CaO+CO2 ↑ (工业制二氧化碳)
4.
(俗名:纯碱、苏 打)
实验:用试管取适量的Na2CO3溶液, 向试管中滴加酚酞试液。 溶液变红色 现象:______ 可见, Na2CO3水溶液呈__性。 碱 2)因为其水溶液呈碱性,故称纯碱;
四、复分解反应
1、定义:两种化合物互相交换成分,生成另外两 (属于基本反应类型) 种化合物的反应。 2、通式:(AB+CD AD+CB) 3、特征:双交换,价不变 4、复分解反应发生的条件 两种化合物互相交换成分时,必需有沉 淀或气体或水生成。(反应物若没有酸, 两种物质都必须能溶于水)
盐的水溶液的颜色 铜盐 溶液一般 呈 蓝色 铁盐溶液一般 呈 黄色 亚铁盐溶液一般呈浅绿色 高锰酸钾溶液呈紫红色 其它盐溶液一般为无色
②盐+酸→ 新盐+新酸 条件:生成物中有沉淀或气体或水
③盐+碱→ 新盐+新碱 条件:反应物两者均可溶; 生成物有沉淀或气体或水 ④盐+盐→ 新盐+新盐 条件:反应物两者均可溶; 生成物有沉淀
复分解反应 1.概念 由两种化合物互相交换成分,生成 另外两种化合物的反应。 酸+金属氧化物→盐+水 酸+碱→盐+水 酸+盐→新酸+新盐 碱+盐→新碱+新盐 盐+盐→新盐+新盐
4、盐+盐= 新盐1 + 新盐2 AgNO3+NaCl= AgCl↓+NaNO3 Na2SO4+BaCl2 = BaSO4↓+2NaCl Na2CO3+Ba(NO3)2 = BaCO3↓+2NaNO3
2.盐的化学性质 ①金属+盐→ 新盐+新金属
在金属活动性顺序表中,只有 位于前面 的金 属才能把 位于后面的金属从它的 盐溶液中置 换出来,与氢的位置 无关;盐必须是 可溶性 盐。 不要用K、Ca、Na置换盐溶液中的金属 铁参加的置换反应生成的都是亚铁盐
碳酸氢钠+盐酸
现象
白色固体溶解,放出使澄清 石灰水变浑浊的无色气体 碳酸钠(或碳酸氢钠)与盐 酸反应生成了CO2气体
分析
【演示实验11-1】
【练习】请同学们写出上述有关化学方程式。 Na2CO3 + 2 HCl === 2NaCl + H2CO3 CO2↑+H2O NaHCO3 + HCl === NaCl + H2CO3
澄清的石 灰水变浑 浊
碳酸钠能否与碱反应?
现象:试管里出现白色沉淀。 分析:碳酸钠与氢氧化钙反应, 【演示实验11-2】 生成一种难溶物。 Na2CO3 + Ca(OH)2 = CaCO3↓+ 2NaOH
三、盐的化学性质
1、盐+金属= 新盐 + 新金属 CuSO4+Fe = FeSO4+Cu 3CuSO4+2Al=Al2(SO4)3+3Cu 2AgNO3+Cu =Cu(NO3)2+2Ag 2、盐+碱= 新盐 + 新碱 3、盐+酸= 新盐 + 新酸
CO2↑+H2O
碳酸根离子的检验
取样品于试管中,加入适量的稀盐 酸,若有气体生成,把生成的气体通 入澄清的石灰水,若石灰水变浑浊, 则证明此为碳酸盐。
含有碳酸根离子(CO32-)或碳酸氢根离子 (HCO3-)的化合物都可以和盐酸反应放出 CO2 实验步骤 实验现象 实验结论 该物质中 有碳酸根
取少量样品 放在试管中, 加入稀盐酸
2.氢氧化铝中和胃酸 Al(OH)3+6HCl==AlCl3+3H2O
3纯碱制烧碱。 Ca(OH)2+Na2CO3==2NaOH+CaCO3↓ 4硫酸铜溶液与氢氧化钠溶液反应。
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
5.硫酸溶液与碳酸钠反应
H2SO4+Na2CO3==Na2SO4+H2O+CO2↑
盐→金属离子+酸根离子
快速判别酸碱盐的方法: 酸:第一个字母为H,不是水和双氧水就是酸 碱:最后两个字母是OH
盐:其他的为盐
指出下列物质中那些是酸?那些是碱?那些是盐?
NaHCO3 KOH HNO3 K2CO3 H2CO3 Mg(OH)2
NaNO3
生活中常见的盐
盐是什么?
古罗马货币
在古罗马表示富有与贫穷,不看拥有黄 金的多少,而是比藏有盐粒的数量,被 历史上称为食盐货币时代。 我国的西藏过去也使用过盐巴货币。为了 换取生活必需的一小块盐巴,需要付出 昂贵的代价。贵州解放前只有少数人家 吃得起吊盐(吃完饭以后,用舌头在吊 挂着的盐块上舔一下)可见食盐的贵重。
B、可用纯碱代替洗涤灵洗涤餐具表 面的油污 C、用纯碱可除去表面团发酵产生的 酸 D、用加水溶解的方法检验纯碱中是
【设问】碳酸钠能否与碱反应?
现象:试管里出现白色沉淀。 分析:碳酸钠与氢氧 【演示实验11-2】 化钙反应,生成一种难溶物。 Na2CO3 + Ca(OH)2 === CaCO3 ↓+ 2 NaOH (工业制备烧碱的方法)
碳酸钙
2.碳酸钙 1)洁白纯净的碳酸钙岩石叫汉白玉。 2)含杂质而有花纹的碳酸钙叫大理石。 3)质地致密的碳酸钙岩石叫石灰石。
鸡蛋壳. 贝壳主要 成分
CaCO3
碳酸钙的用途
石灰石
石灰石——建筑、保健品、日用品的原材料。 大理石——建筑材料。
1.用途:重要的建筑材料,也是一种 补钙剂。
2.化学性质:
例: Na CO +
2 3
HCl
Na Cl+ H CO3
+1 -1 +1 -2
1、交换位置:
HCl+Na2CO3
2、定化学式:
HCl+Na2CO3
3、配 平:
NaCl+H 2CO3
2NaCl+H2O+CO2
2HCl+Na2CO3
二.复分解反应
1.定义:两种化合物互相交换成分,生成 另外两种化合物的反应 AB+CD====AD+CB
滤纸紧贴漏斗 内壁
漏斗末端靠 烧杯内壁
粗盐提纯中玻璃棒作用:
溶解:搅拌,加速固体的溶解 过滤:引流 蒸发:防止液体受热不均匀, 液滴飞溅 转移:起转移固体的作用。
图为某学生进行粗盐提纯实 验中过滤操作的示意图,试 回答: (1)写出标号的仪器名称: ① ,② 。 (2)漏斗中液体的液面应 该(填“高”或 “低”) 于滤纸的边 缘。 (3)蒸发滤液时,用玻璃 棒不断搅拌滤液的目的 是 ;等到蒸发皿中 出现 时,停止加 热,利用蒸发皿的余热使滤 液蒸干,移去蒸发皿时应使 用的仪器是 。
AgCl MgSO4 Cu(OH)2 Ba(OH)2 AgNO3
请你通过实验证明 它们是碳酸盐?
思考 : 为什么用苏打粉做馒头 时可除去酸味 , 且使馒头多孔 松软? 苏打粉能和酸反应,产生 CO2 气 体,气体在面团中形成许多小 气室,使馒头多孔松软.
(2008· 揭阳)以下是四位同学对生 活中的现象进行探究后的结果的表 述,其中不正确的是( D) A、“纯碱”其实不是碱,属于盐类
纯碱不是碱,而是盐
碳酸钠的用途
纺织
玻璃
洗涤剂
造纸
5.碳酸氢钠(俗名:小苏打)
NaCl+NH3+H2O+CO2===NaHCO3+NH4Cl
