2018人教版高中化学40总复习:《弱电解质的电离》的解题指导(基础)巩固练习
高考总复习弱电解质电离的解题指导

高考总复习《弱电解质的电离》的解题指导【考纲要求】1.理解强电解质和弱电解质的概念,并能正确书写电离方程式;掌握判断强弱电解质的方法规律。
2.加深理解弱电解质在水溶液中的电离平衡及其影响。
3.本部分知识的综合应用。
【考点梳理】考点一、强酸与弱酸(或强碱与弱碱)的比较1、相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较见下表:2、相同pH、相同体积的一元强酸与一元弱酸的比较见下表:考点二、判断强弱电解质的方法规律实验设计思路:以证明某酸(HA)是弱酸为例【典型例题】类型一、判断电解质强弱的实验方法例1、为证明某可溶性一元酸(HX)是弱酸,某同学设计了如下实验方案,其中不合理的是()A.室温下,测0.1 mol / L的HX溶液的pH,若pH>1,证明HX是弱酸B.室温下,将等浓度等体积的盐酸和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸C.室温下,测1 mol / L NaX溶液的pH,若pH>7,证明HX是弱酸D.在相同条件下,对0.1 mol / L的盐酸和0.1 mol / L的HX溶液进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸【思路点拨】弱电解质本质上是未完全电离,存在电离平衡。
【答案】B【解析】由0.1 mol / L HX溶液pH>1知,c (H+)<0.1 mol / L,说明HX只部分电离,HX是弱酸,A项正确;等物质的量浓度的HCl和NaX组成的混合溶液,无论HX是强酸还是弱酸,溶液都显酸性,B项错误;若NaX 溶液的pH>7,说明盐在水中发生水解,X―+H2O HX+OH―,为强碱弱酸盐,C项正确;用同浓度的一元酸做导电实验,灯泡较暗者,溶液离子浓度较小,说明HX没有完全电离,则为弱酸,D项正确。
【总结升华】判断HA是强酸还是弱酸最典型的两种方法:(1)取其钠盐(NaA)溶于水,测其pH,若pH>7,则说明HA为弱酸。
(2)配制一定物质的量浓度的HA溶液(如:0.01 mol / L),测其pH。
高三化学复习弱电解质

《弱电解质的电离》学案班级姓名一、【考纲要求】1.了解强、弱电解质的概念,并能正确判断强、弱电解质;2.了解弱电解质在水溶液中的电离平衡,并掌握其应用;二、【典型例题】【例题1】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是()【巩固练习1】下列事实可以证明氨水是弱碱的有A.氨水能跟氯化亚铁溶液反应生成氢氧化亚铁B.铵盐受热易分解C.0.1 mol/L氨水可以使酚酞试液变红D.0.1 mol/L氯化铵溶液的pH约为5【例2】在0.1 mol/L CH 3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是() A.加入水时,平衡逆向移动B.加入少量NaOH固体,平衡正向移动C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)减小D.加入少量CH3COONa固体,平衡正向移动【反思小结2】【巩固练习2】在0.1 mol/L NH3·H2O溶液中存在如下平衡:NH3 + H2O NH3·H2O N H4+ + OH-。
下列叙述正确的是()A.加入少量浓盐酸,盐酸与NH3反应生成NH4Cl,使NH3浓度减小,N H4+浓度增大,平衡逆向移动B.加入少量NaOH固体,OH-与N结合生成NH3·H2O,使N H4+浓度减小,平衡正向移动C.加入少量0.1 mol/L NH4Cl溶液,电离平衡常数不变,溶液中c(OH-)减小D.加入少量MgSO4固体,溶液pH增大【检测性练习】1.下列物质在水溶液中的电离方程式书写正确的是()A.CH3COOH H++CH3COO-B.NaHSO4Na++HSO4-C.H3PO43H++PO43-D.NaHCO3Na++H++CO32-2、下列有关溶液的叙述错误的()A.常温下0.01 mol/L HA溶液的pH=4,能证明HA是弱酸B.在pH=2的醋酸中加入等体积2 mol/L的某酸溶液后,混合溶液的pH一定会减小C.pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液的m倍和n倍,若稀释后两溶液的pH仍相同,则m>nD.相同温度下,0.2 mol/L氨水中的c(OH-)和0.1 mol/L的氨水中的c(OH-)之比小于23. 向下列溶液中通入少量HCl气体,导电能力显著增强的是()A.NaOH溶液B.AgNO3溶液C.氨水 D.NaBr溶液4、已知0.1 mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+。
人教版高中化学选修4导学案:3.1弱电解质的电离 -含答案

第一节 弱电解质的电离1.理解强电解质、弱电解质的概念。
2.能描述弱电解质在水溶液中的电离平衡,正确书写电离方程式。
3.理解一定条件下弱电解质的电离平衡移动。
4.了解电离常数的概念、表达式和意义。
强、弱电解质1.盐酸和醋酸的比较按图所示,将体积相同、浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH 。
完成下面的表格:强电解质—⎪⎪⎪⎪――――→概念在水溶液中完全电离的电解质――――→物质类别强酸、强碱、大多数盐等弱电解质—⎪⎪⎪⎪――――→概念在水溶液中部分电离的电解质――――→物质类别弱酸、弱碱、水等 3.电离方程式的书写(1)强电解质完全电离,书写电离方程式时用“===”。
(2)弱电解质部分电离,书写电离方程式时用“ ”。
①一元弱酸、弱碱一步电离。
如CH3COOH:CH3COOH CH3COO-+H+,NH3·H2O:NH3·H2O NH+4+OH-。
②多元弱酸分步电离,必须分步写出,不可合并(其中以第一步电离为主)。
如H2CO3:H2CO3 H++HCO-3(主),HCO-3 H++CO2-3(次)。
③多元弱碱分步电离(较复杂),在中学阶段要求一步写出。
如Fe(OH)3:Fe(OH)3 Fe3++3OH-。
(1)酸式盐电离方程式的书写①强酸的酸式盐在水溶液中完全电离,如NaHSO4===Na++H++SO2-4,但其在熔融态时为NaHSO4(熔融)===Na++HSO-4。
②弱酸的酸式盐“强中有弱”,如NaHCO3===Na++HCO-3,HCO-3 H++CO2-3。
(2)Al(OH)3电离方程式的书写酸式电离:Al(OH)3 H++AlO-2+H2O,碱式电离:Al(OH)3 Al3++3OH-。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)稀硫酸能导电,所以稀硫酸是电解质。
( )(2)SO2的水溶液能导电,故SO2是电解质。
( )(3)固态的NaCl不导电,因此NaCl不属于电解质。
2018人教版高中化学40总复习:《弱电解质的电离》的解题指导(基础)知识讲解

高考总复习《弱电解质的电离》的解题指导【考纲要求】1.理解强电解质和弱电解质的概念,并能正确书写电离方程式;掌握判断强弱电解质的方法规律。
2.加深理解弱电解质在水溶液中的电离平衡及其影响。
3.本部分知识的综合应用。
【考点梳理】考点一、强酸与弱酸(或强碱与弱碱)的比较1、相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较见下表:2考点二、判断强弱电解质的方法规律【典型例题】类型一、判断电解质强弱的实验方法【高清课堂:363381 例3】例1、为证明某可溶性一元酸(HX)是弱酸,某同学设计了如下实验方案,其中不合理的是()A.室温下,测0.1 mol / L的HX溶液的pH,若pH>1,证明HX是弱酸B.室温下,将等浓度等体积的盐酸和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸C.室温下,测1 mol / L NaX溶液的pH,若pH>7,证明HX是弱酸D.在相同条件下,对0.1 mol / L的盐酸和0.1 mol / L的HX溶液进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸【思路点拨】弱电解质本质上是未完全电离,存在电离平衡。
【答案】B【解析】由0.1 mol / L HX溶液pH>1知,c (H+)<0.1 mol / L,说明HX只部分电离,HX是弱酸,A项正确;等物质的量浓度的HCl和NaX组成的混合溶液,无论HX是强酸还是弱酸,溶液都显酸性,B项错误;若NaX 溶液的pH>7,说明盐在水中发生水解,X―+H2O HX+OH―,为强碱弱酸盐,C项正确;用同浓度的一元酸做导电实验,灯泡较暗者,溶液离子浓度较小,说明HX没有完全电离,则为弱酸,D项正确。
【总结升华】判断HA是强酸还是弱酸最典型的两种方法:(1)取其钠盐(NaA)溶于水,测其pH,若pH>7,则说明HA为弱酸。
(2)配制一定物质的量浓度的HA溶液(如:0.01 mol / L),测其pH。
若pH>2,则说明HA为弱酸。
弱电解质的电离(含解析)

第一节弱电解质的电离弱电解质的电离平衡1.电离平衡的建立在一定条件(如温度、浓度)下,当弱电解质分子离解成离子的速率和离子结合成弱电解质分子的速率相等时,电离过程就达到了平衡。
2.电离平衡的特征3.外界条件对电离平衡的影响电离是一个吸热过程,主要受温度、浓度的影响。
以弱电解质CH 3COOH 的电离为例:CH 3COOHCH 3COO -+H +⎩⎪⎪⎨⎪⎪⎧平衡右移⎨加水稀释平衡左移 电离平衡常数 1.表达式(1)对于一元弱酸HA : HAH ++A -,平衡常数K=c (H +)·c (A -)c (HA );(2)对于一元弱碱BOH : BOH B ++OH -,平衡常数K =c (B +)·c (OH -)c (BOH )。
2.意义相同条件下,K 值越大,表示该弱电解质越易电离,所对应的酸性或碱性相对越强。
3.特点(1)多元弱酸是分步电离的,各级电离常数的大小关系是K1≫K2……,所以其酸性主要决定于第一步电离。
1.易误诊断(正确的打“√”,错误的打“×”)。
(1)溶液导电能力弱的电解质一定是弱电解质()(2)弱电解质浓度越大,电离程度越大()(3)温度升高,弱电解质的电离平衡右移()(4)0.1 mol/L某一元酸HA溶液的pH=3,HA溶液中存在:HA===H++A-()(5)温度不变,向CH3COOH溶液中加入CH3COONa,平衡左移()(6)电离平衡常数(K)越小,表示弱电解质电离能力越弱()(7)不同浓度的同一弱电解质,其电离平衡常数(K)不同()(8)电离平衡右移,电离平衡常数一定增大()【答案】(1)×(2)×(3)√(4)×(5)√(6)√(7)×(8)×2.NH3·H2O在水溶液中的电离方程式为:__________________________,其电离常数表达式为:_____________________________________________。
高三化学一轮复习学案:弱电解质的电离
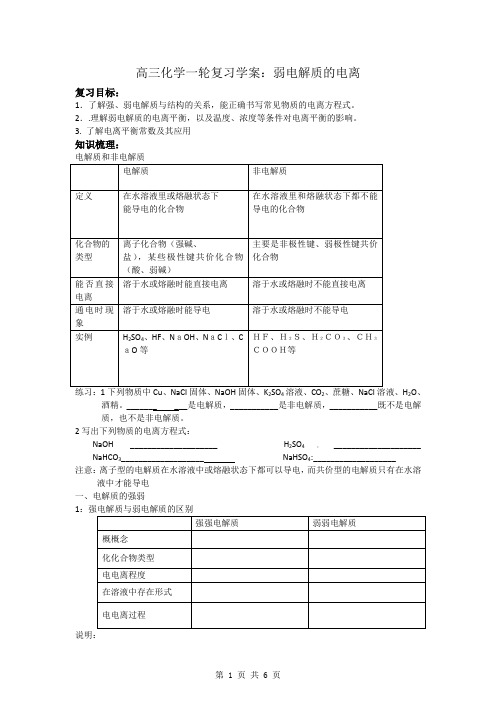
高三化学一轮复习学案:弱电解质的电离复习目标:1.了解强、弱电解质与结构的关系,能正确书写常见物质的电离方程式。
2..理解弱电解质的电离平衡,以及温度、浓度等条件对电离平衡的影响。
3. 了解电离平衡常数及其应用知识梳理:电解质和非电解质练习:1下列物质中Cu 、NaCl 固体、NaOH 固体、K 2SO 4溶液、CO 2、蔗糖、NaCl 溶液、H 2O 、酒精。
_______ ___是电解质,___________是非电解质,___________既不是电解质,也不是非电解质。
2写出下列物质的电离方程式: NaOH____________________H 2SO 4:____________________NaHCO 3___________________ NaHSO 4:___________________ 注意:离子型的电解质在水溶液中或熔融状态下都可以导电,而共价型的电解质只有在水溶液中才能导电 一、电解质的强弱1说明:1:电解质的强弱与溶解性无关。
2:电解质的强弱与日夜的导电性无关。
3: 电解质的强弱与化学键没有必然的联系。
练习:下列电解质中:NaCl、NaOH,NH3·H2O、CH3COOH,BaSO4,AgCl,Na2O,K2O,Na2O2 _________________________是强电解质____________________________是弱电解质⒉电离方程式的书写⑴强电解质用号:弱电解质用⑵多元弱酸分步电离,且第一步电离远远大于第二步电离,如碳酸:、⑶多元弱碱分步电离一步写完,如氢氧化铁:。
二、弱电解质的电离⒈电离平衡:。
⒉电离平衡的特征:①弱:只有才会存在电离平衡;②动:电离平衡是平衡;③等:V电离V结合(填﹥,=或﹤)④定:条件一定与的浓度一定;⑤变:条件改变,破坏,发生移动。
3弱电解质电离平衡的移动(1)弱电解质的电离平衡符合原理(2)影响弱电解质电离平衡的因素有:①温度:;②浓度:;③同离子反应:加入与弱电解质具有相同离子的强电解质,将电离;④加入能反应的物质,将电离。
高中化学《弱电解质的电离》练习题(附答案解析)

高中化学《弱电解质的电离》练习题(附答案解析)学校:___________姓名:___________班级:_____________一、单选题1.下列属于弱电解质的物质是 ( ) A .COOH CH 3B .NaOHC .24H SOD .Cl NH 42.常温下,将醋酸与NaOH 溶液充分反应后所得溶液的pH <7,则此溶液中( ) A .c(Na +)<c(CH 3COO -) B .c(Na +)>c(CH 3COO -)C .c(Na +)=c(CH 3COO -)D .无法确定c(Na +)与c(CH 3COO -) 的关系3.在相同温度下,关于相同物质的量浓度的盐酸和醋酸的说法正确的是( ) A .等体积的盐酸和醋酸中的氢氧化钠时,盐酸消耗的氧氢化钠多 B .盐酸的pH 小于醋酸的pH C .稀释相同倍数后,盐酸的pH 大 D .溶液中离子总数一定不相等 4.在醋酸溶液中存在电离平衡:CH 3COOH CH 3COO -+H +,要使电离平衡左移且c(H +)减小,应采取的措施是( ) A .加入NaOH(s)B .加入盐酸C .加蒸馏水D .降低温度5.下列化学用语正确的是( ) A .HClO 的电离方程式:HClO=H ++ClO - B .CO 2的电子式:C .氯原子价电子的轨道表示式:D .Al 3+的结构示意图:6.下列溶液中导电性最强的是( ) A .1 L 0.2 mol ·L -1醋酸 B .0.1 L 0.1 mol ·L -1H 2SO 4溶液 C .0.5 L 0.1 mol ·L -1盐酸D .2 L 0.1 mol ·L -1H 2SO 3溶液7.某生物燃料电池以N 2和H 2为原料可在室温下制取NH 3,电池中含有固氮酶和氢化酶两种蛋白酶。
下列说法正确的是( )A .酸性条件下的负极反应为H 2-2e -+2OH -=2H 2OB .燃料电池放电时能将化学能完全转化为电能C .该电池适宜在高温下使用D .室温下,向氨水中通入少量HCl ,-32c(OH )c(NH H O)⋅减小8.对于0.1 mol ·L -1的醋酸溶液,下列说法中错误的是( ) A .醋酸根的浓度是0.1 mol ·L -1B .若加入少量的冰醋酸,则氢离子浓度增大C .若加入少量的固体NaOH ,则醋酸根离子浓度增大D .若加入少量的浓盐酸,则醋酸根离子浓度减小 9.强电解质和弱电解质的本质区别是( ) A .溶解度的大小 B .导电性的强弱 C .电离是否完全D .化合物类别10.室温下,关于110.0mL0.1mol L -⋅氨水的下列说法正确的是( ) A .该氨水的pH=13B .加入少量水后,溶液中所有离子浓度均减小C .加少量4NH Cl 固体恢复到室温,w K 不变D .与110.0mL0.1mol L -⋅盐酸混合后,溶液呈中性 11.常温下,CH 3COOH 溶液中存在电离平衡:CH 3COOHCH 3COO -+H +,下列说法正确的是( )A .向10mLpH=5的CH 3COOH 溶液中加水至10L ,最后溶液pH 在7和8之间B .加入少量CH 3COONa 固体,平衡向左移动,c(CH 3COO -)下降C .加入少量NaOH 固体(忽略溶解热效应),平衡向右移动,水的电离程度也随之增大D .向10mLpH=5的CH 3COOH 溶液中加入等体积,等浓度的盐酸,混合溶液的c(H +)不变 12.室温下,下列关于电解质溶液的说法中不正确的是( )A .将pH 12=的氨水与pH 2=的硝酸等体积混合:()()()()43NH NO OHH +--+>>>c c c cB .室温下,调节3H A 溶液的pH 5=时,20.63(HA )10(H A)c c -=(已知:K a1=10-2.2、K a2=10-7.2、K a3=10-12.4) C .25℃时,22RS M MS R ++++的平衡常数4000K =[该温度下,K sp (MS)=1.0×10-21、K sp (RS)=4.0×10-18] D .加水稀释氯化铝溶液,铝离子水解程度增大,H +物质的量增加,溶液酸性增强 13.下列说法正确的是( )A .0.1mol/LpH 为9 的NaHB 溶液中:c(HB -) >c(B 2-)>c(H 2B)B .将标准状况下的2.24 LCO 2通入150 mL1mol/L NaOH 溶液中,所得溶液中c(CO 32-)>c(HCO 3-) C .室温下,c(NH 4+)相同的①(NH 4)2CO 3②(NH 4)2SO 4 ③(NH 4)2Fe(SO 4)2溶液浓度大小顺序为:①>②>③ D .常温时①pH=12 的氨水②pH=12的NaOH 溶液,将两溶液稀释相同倍数后溶液的pH:②>①二、填空题14.已知某温度下有如下三个反应: 22NaCN HNO HCN NaNO +=+NaCN HF HCN NaF +=+22NaNO HF HNO NaF +=+则该温度下HF 、HCN 和2HNO 三种弱酸的电离常数由大到小的顺序是___________。
知识讲解—弱电解质电离的解题指导(基础)

高考总复习《弱电解质的电离》的解题指导编稿:房鑫审稿: 曹玉婷【考纲要求】1.理解强电解质和弱电解质的概念,并能正确书写电离方程式;掌握判断强弱电解质的方法规律。
2.加深理解弱电解质在水溶液中的电离平衡及其影响。
3.本部分知识的综合应用。
【考点梳理】考点一、强酸与弱酸(或强碱与弱碱)的比较1、相同物质的量浓度、相同体积的一元强酸(如盐酸)与一元弱酸(如醋酸)的比较见下表:2、相同pH、相同体积的一元强酸与一元弱酸的比较见下表:考点二、判断强弱电解质的方法规律实验设计思路:以证明某酸(HA)是弱酸为例【典型例题】类型一、判断电解质强弱的实验方法【高清课堂:363381例3】例1、为证明某可溶性一元酸(HX)是弱酸,某同学设计了如下实验方案,其中不合理的是()A.室温下,测0.1 mol / L的HX溶液的pH,若pH>1,证明HX是弱酸B.室温下,将等浓度等体积的盐酸和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸C.室温下,测1 mol / L NaX溶液的pH,若pH>7,证明HX是弱酸D.在相同条件下,对0.1 mol / L的盐酸和0.1 mol / L的HX溶液进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸【思路点拨】弱电解质本质上是未完全电离,存在电离平衡。
【答案】B【解析】由0.1 mol / L HX溶液pH>1知,c (H+)<0.1 mol / L,说明HX只部分电离,HX是弱酸,A项正确;等物质的量浓度的HCl和NaX组成的混合溶液,无论HX是强酸还是弱酸,溶液都显酸性,B项错误;若NaX 溶液的pH>7,说明盐在水中发生水解,X―+H2O HX+OH―,为强碱弱酸盐,C项正确;用同浓度的一元酸做导电实验,灯泡较暗者,溶液离子浓度较小,说明HX没有完全电离,则为弱酸,D项正确。
【总结升华】判断HA是强酸还是弱酸最典型的两种方法:(1)取其钠盐(NaA)溶于水,测其pH,若pH>7,则说明HA为弱酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【巩固练习】一、选择题:(每题有1-2个选项符合题意)1.下列事实一定能说明醋酸是弱酸的是①0.1mol/L 的醋酸pH >1②与同浓度的盐酸对比导电性③同浓度的盐酸对比溶液的pH④与同浓度的盐酸对比与锌粉反应的速率⑤将溶液冲稀1000倍后pH 的变化⑥与同pH 的盐酸等倍冲稀后比较pH 变化⑦同体积同pH 的盐酸和醋酸与足量的锌粒反应产生氢气的体积或平均速率⑧ 0.1mol/L 的醋酸钠pH >7A .①②④⑤⑦⑧B .①⑤⑥⑧C .①③⑤⑥⑧D .全部2.用食用白醋(醋酸浓度约为1 mol / L )进行下列实验,能证明醋酸为弱电解质的是( )A .白醋中滴入石蕊试注解呈红色B .白醋加入豆浆中有气体放出C .蛋壳浸泡在白醋中有气体放出D .pH 试纸显示白醋的pH 为2~33、将浓度为0.1 mo1·L -1 HF 溶液加水不断稀释,下列各量始终保持增大的是( )A .c (H +)B .K a (HF)C .(F )(H )c c -+D .(H )(HF)c c + 4.保持温度不变,用水稀释0.1 mol ·L ―1氨水时,溶液中随着水量的增加而减小的是( )A .c (OH ―) / c (NH 3·H 2O)B .c (NH 3·H 2O) / c (OH ―)C .NH 4+的物质的量D .OH ―的物质的量5.将体积都为10mL 、pH 都等于3的醋酸和盐酸,加水稀释至a mL 和b mL ,测得稀释后溶液的pH 均为5,则稀释后溶液的体积:A .a = b =100mLB .a = b =1000mLC .a<bD .a>b6.下列说法正确的是( )A 、强电解质溶液的导电能力不一定比弱电解质溶液强B 、中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸C 、将氢氧化钠和氨水各稀释一倍,两者的OH -浓度均减少到原来的1/2D 、如果盐酸的浓度是醋酸浓度的两倍,则盐酸的H +浓度也是醋酸的两倍7.室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )A .溶液中导电粒子的数目减少B .溶液中33(CH COO )(CH COOH)(OH )c c c --⋅不变 C .醋酸的电离程度增大,c (H +)亦增大D .再加入10 mL pH=11的NaOH 溶液,混合液pH=78.一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示。
则下列说法错误的是A .醋酸的电离程度:c <b <aB .溶液的pH :b <a <cC .蘸取a 点溶液滴在湿润的pH 试纸上,测得pH 一定偏大D .若分别取a 、b 、c 三点的溶液各10mL ,各用同浓度的氢氧化钠 、溶液中和,消耗NaOH 溶液的体积a >b >c9.现有 ①0.1mol/L 醋酸溶液;②0.1mol/L 盐酸;③pH = 1 的醋酸溶液,分别加水稀释,使体积变为原来的10倍,对于稀释前后溶液的有关说法错误的是A、稀释前,溶液pH:①>②= ③B、稀释后,溶液pH:①>②= ③C、稀释前,溶液中溶质的物质的量浓度:③>①= ②D、稀释后,溶液中溶质的物质的量浓度:③>①= ②10.某温度下,相同pH的值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如下图所示。
据图判断正确的是()A.Ⅱ为盐酸稀释时的pH值变化曲线B.b点溶液的导电性比c点溶液的导电性强C.a点K W的数值比c点K W的数值大D.b点酸的总浓度大于a点酸的总浓度11.25℃,将V a mLpH=2的CH3COOH溶液与V b mLpH=12的NaOH溶液混合。
下列说法正确的是A.若V a=V b,则混合后的溶液pH=7B.若V a<V b,则混合后的溶液pH一定大于7C.若V a=V b,则CH3COOH与NaOH恰好完全中和D.若V a=V b,则混合后溶液中微粒浓度的关系可能为:c(CH3COO—)>c(Na+)>c(H+)>c(OH—)12.下列叙述正确的是A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)B.两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色D.向0.1mol/L 的氨水中加入少量硫酸铵固体,则溶液中增大13.一定温度下,一定量水中石灰乳悬浊液存在如下平衡:Ca(OH)2(s) Ca2++2OH-,当向浑浊液中加少量生石灰时,下列说法正确的是:A.溶液的pH值不变B.溶液中OH-离子浓度不变C.c(Ca2+)增大D.溶液中所剩固体量减少二、填空题:1.今有0.1 mol / L的4种酸溶液:A.HCl B.H2SO4C.CH3COOH用A、B、C、D回答下列问题:(1)它们的pH大小关系为________。
(2)取等体积上述溶液,分别与颗粒大小相同的锌反应,开始时反应速率的大小关系为________。
(3)等体积的各酸分别与足量的锌粒反应,在同温同压下放出氢气的体积大小关系为________。
(4)等体积的3种酸溶液,分别与足量NaOH溶液完全反应,生成正盐的物质的量的关系为________。
(5)取3种溶液各10mL,分别与10 mL0.1 mol / L的NaOH溶液混合,反应后溶液的pH大小关系为________。
1.(1)B<A<C (2)B>A>C (3)B>A=C (4)A=B=C (5)C>A>B【解析】(1)等物质的量浓度的3种酸,H+浓度大小顺序是:B>A>C,pH的大小与之相反。
(2)H+浓度越大,反应速率越快。
(3)酸的物质的量相同,与足量的锌反应时,生成氢气的量取决于酸最终能够电离出H+的物质的量。
(4)正盐的物质的量等于酸的物质的量。
(5)本小题中酸和碱的物质的量相同,HCl和CH3COOH 都恰好反应完,但NaCl溶液呈中性;CH3COONa溶液呈碱性;H2SO4过量,反应后溶液呈强酸性。
2.已知:CH 3COOH CH 3COO ―+H +;ΔH >0。
下列方法中,可以使0.10 mol ·L ―1 CH 3COOH 溶液中CH 3COOH 的电离程度增大的是________。
a .加入少量0.10 mol ·L ―1的稀盐酸b .加热CH 3COOH 溶液c .加水稀释至0.010 mol ·L ―1d .加入少量冰醋酸e .加入少量氯化钠固体f .加入少量0.10 mol ·L ―1的NaOH 溶液【答案与解析】一、选择题1.D【解析】上述事实的本质都表明醋酸存在电离平衡,故为弱酸,因为强酸不存在电离平衡。
2.D【解析】A 项说明醋酸显酸性,B 项是醋酸使蛋白质发生聚沉,C 项为强酸制弱酸,D 项证明醋酸为弱酸(不能完全电离)。
3.D【解析】HF 属于弱电解质,加水促进HF 的电离平衡向右移动,即电离程度增大,但电离平衡常数只与温度有关,所以选项B 错误;但同时溶液的体积也增大,所以溶液的酸性会降低,即c (H +)、c (F ―)和c (HF)的浓度均降低,考虑到溶液中水还会电离出氢离子,所以稀释到一定程度(即无限稀释时),c (H +)就不再发生变化,但c (HF)却会一直降低,所以选项D 符合题意。
4.B【解析】稀释时,NH 3·H 2O 的电离度增大,NH 4+、OH ―的物质的量增大,C 、D 项错误;稀释时,NH 3·H 2O 的物质的量减小,OH ―的物质的量增大,由于3232(OH )(OH )(NH H O)(NH H O)c n c n --=⋅⋅,故该比值增大,A 项错误,B 项正确。
5.D【解析】若a = b=100mL ,由于醋酸加水后平衡右移,导致醋酸中pH 小于5,要是pH 均为5,需满足a>b 。
6.A【解析】稀的强电解质溶液的导电能力不一定比浓的弱电解质溶液强。
中和等体积、等物质的量浓度的盐酸和醋酸溶液,需氢氧化钠一样多。
氨水为弱酸,加水电离平衡右移,将氨水各释一倍后OH -浓度减少,但比到原来的1/2要大。
如果盐酸的浓度是醋酸浓度的两倍,则盐酸的H +浓度比醋酸H +浓度的二倍要大。
7.B【解析】醋酸溶液存在电离平衡,加水稀释,电离程度增大,溶液导电粒子数目增加,c (H +)降低,故A 、C 错;因醋酸是弱酸,10 mL pH=3的醋酸加入10 mL pH=11的NaOH 溶液,醋酸过量,溶液显酸性,pH <7,D 错;因温度不变,电离平衡常数为定值,B 正确。
8. AC【解析】加水越多,醋酸的电离程度越大,氢离子浓度越小,溶液的pH 越大。
A .醋酸的电离程度应为:a <b <c ;B .正确;C .蘸取a 点溶液滴在湿润的pH 试纸上,氢离子数目增多,若忽略溶液体积变化,测得pH 应偏小;D .若分别取a 、b 、c 三点,溶液浓度大小:a >b >c ,故消耗NaOH 溶液的体积a >b >c 。
9. B【解析】10.B【解析】pH相同的盐酸与醋酸相比,醋酸的浓度要大的多。
当加水稀释时,醋酸溶液中存在电离平衡的移动,故c (H+)变化比盐酸中小,故Ⅰ为盐酸,Ⅱ为醋酸,A项错误;c点溶液c (H+)小于b点,故c点导电性差,B正确;K W只受温度影响,因题中温度不变,故各点K W均相等,C错误;起始时c (CH3COOH)>c (HCl),故稀释相同倍数仍有c (CH3COOH)>c (HCl),D错误。
11.D【解析】A.若V a=V b,则混合后的溶液pH<7;B.若V a<V b,则混合后的溶液pH可能大于7、等于7或小于7;C.若V a=V b,则反应后CH3COOH过量;D.若V a=V b,则混合后溶液中溶质为CH3COONa和过量的CH3COOH。
12.C【解析】A.从电荷守恒入手分析;B.因pH分别为a和a+1,故c1>c2,浓度越小,电离程度越大,故c1>10c2。
C.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合后,pH<7,故滴入石蕊溶液呈红色。
D.从氨水电离平衡入手分析。
13AB【解析】加少量生石灰,发生反应:CaO+H2O= Ca(OH)2,平衡:Ca(OH)2(s) Ca2++2OH-左移,由于温度不变,故溶液的pH值、OH-离子浓度、c(Ca2+)均不变,溶液中所剩固体量增加。
二、填空题2.b、c、f【解析】加入少量0.10 mol·L―1的稀盐酸,c (H+)增大,平衡向逆反应方向移动,醋酸电离程度减小;由于电离反应吸热,加热CH3COOH溶液,平衡向正方向移动,醋酸电离程度增大;加水稀释有利于醋酸的电离,醋酸电离程度增大;加入少量冰醋酸,醋酸电离程度减小;加入少量氯化钠固体,平衡不移动,醋酸电离程度不变;加入少量0.10 mol·L―1的NaOH溶液,c (H+)减小,平衡向正方向移动,醋酸电离程度增大。
