高一化学必修一 第二章 《化学物质及其变化》全章复习PPT课件
合集下载
人教版高中化学必修1:第二章 化学物质及其变化 复习课件

3.概念辨析:
(1)电解质、非电解质都是化合物,单质和混合物既 不是电解质也不是非电解质,如金属铜能够导电,稀硫
酸能够导电,但它们既不是电解质也不是非电解质。
(2)电解质不一定导电,如NaCl固体,导电的物质不 一定是电解质,如Cu。非电解质不导电,但不导电的 物质不一定是非电解质,如Cl2。 (3)电解质不是指水溶液,而是指化合物本身。如食 盐水能导电,电解质是NaCl而不是食盐水。
4.氧化性还原性强弱比较:
1)根据化学反应方程式判断:
氧化剂和氧化产物具有 氧化 性,
还原剂和还原产物具有 还原 性。
反应方向是由强到弱,即:
氧化剂+还原剂
还原产物+氧化产物
氧化性:氧化剂 > 氧化产物,
氧化剂 > 还原剂。
还原性:还原剂 > 还原产物,
还原剂 > 氧化剂。
2)从元素的价态考虑: 最高价态——只有 氧化 性, 最低价态——只有 还原 性, 中间价态——有 氧化 性,也有 还原 性。
电解质在水溶液中发生的复分解反应都属于离子反应,所
以离子反应发生的条件是:
(1)生成沉淀的物质,如BaSO4、AgCl、CaCO3、Cu(OH)2等
沉淀。
(2)生成 气 体或易挥发性物质,如CO2、H2S等气体。 (3)生成难电离的物质,如H2O、弱酸、弱碱等。
(4)离子参加的氧化还原反应,如Cu+2Ag+=Cu2++2Ag
①氢氧化钾和硫酸反应
_____H_+_+_O_H_-_=_H_2_O_________________;
②硫酸钠和氯化钡反应
___S_O__42_-_+_B_a_2_+_=_B_a_S_O_4_↓____________;
高中化学人教版必修1第二章化学物质及其变化ppt课件

化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
(2)属于电解质的是 _________________________________________________________________; (3)属于非电解质的是 _________________________________________________________________; (4)属于电解质,但在上述状态下不能导电的是 _________________________________________________________________。
属电解质,处于熔融状态,可导电
答案: (1)②④⑥⑨ (2)①⑦⑨⑩ (3)③⑤⑧ (4)①⑦⑩
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
[思考感悟] 电解质与非电解质
1.电解质与非电解质的比较
电解质
非电解质
相同点
均为化合物
不同点
水溶液或熔融状态能导电
水溶液和熔融状态都不能导电
合作探究·课堂讲练
课时作业
2.下列电离方程式书写不正确的是( ) A.硝酸:HNO3===H++NO- 3 B.纯碱:Na2CO3===2Na++CO23- C.硫酸:H2SO4===H++SO24- D.氢氧化钙:Ca(OH)2===Ca2++2OH- 答案: C
化学 必修1
第二章 化学物质及其变化
化学 必修1
第二章 化学物质及其变化
自主学习·新知全解
合作探究·课堂讲练
课时作业
[自我诊断] 判断下列说法正误(正确的打“√”,错误的打“×”)。 (1)固体氯化钠不导电,所以 NaCl 是非电解质。(×) (2)不是电解质的物质一定是非电解质。(×) (3)BaSO4 难溶于水,故 BaSO4 为非电解质。(×) (4)CO2 溶于水能导电,CO2 是电解质。(×) (5)盐酸能导电,所以氯化氢是电解质。(√)
必修一第二章化学物质及其变化复习ppt课件
知识点五:氧化还原反应
3.氧化还原反应与四种基本类型反应关系
氧化还原反应
置换反应 复分解反应
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
4.基本概念
还原剂 失电子 还原性
价升
被氧化
氧化 产物
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
5.基本规律
3、电子得失守恒规律: 例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+ 7H2O,则M2O7 x-中的M的化合价为 (D)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
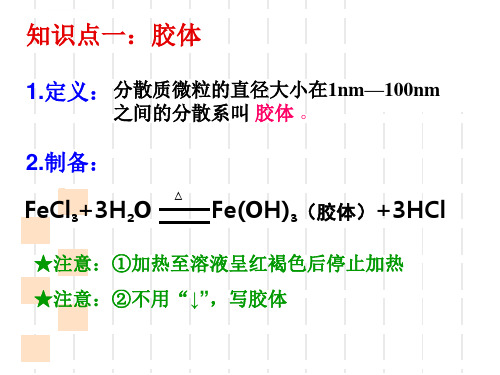
知识点一:胶体
1.定义: 分散质微粒的直径大小在1nm—100nm
之间的分散系叫 胶体 。
2.制备: FeCl3+3H2O △
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不用“↓”,写胶体
3.性质:
⑤胶体的凝聚 Ⅰ加电解质溶液 Ⅱ加带相反电荷的胶粒 Ⅲ加热凝聚(加热较长时间)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
均匀透明 稳定 d<1nm 小分子或离子
氯化钠溶液
均匀透明 介稳定
钾盐、钠盐、铵盐、硝酸盐全溶 SO42-除Ba2+(Ca2+、Ag+ 微溶) Cl-除Ag+ CO32-只溶K+、Na+、NH4+(Mg2+微溶) OH-只溶K+、Na+、Ba2+(Ca2+微溶)
3.氧化还原反应与四种基本类型反应关系
氧化还原反应
置换反应 复分解反应
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
4.基本概念
还原剂 失电子 还原性
价升
被氧化
氧化 产物
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点五:氧化还原反应
5.基本规律
3、电子得失守恒规律: 例.已知M2O7 x-+ 3S 2-+ 14H+ = 2 M3+3S↓+ 7H2O,则M2O7 x-中的M的化合价为 (D)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
1.定义: 分散质微粒的直径大小在1nm—100nm
之间的分散系叫 胶体 。
2.制备: FeCl3+3H2O △
Fe(OH)3(胶体)+3HCl
★注意:①加热至溶液呈红褐色后停止加热 ★注意:②不用“↓”,写胶体
3.性质:
⑤胶体的凝聚 Ⅰ加电解质溶液 Ⅱ加带相反电荷的胶粒 Ⅲ加热凝聚(加热较长时间)
火灾袭来时要迅速疏散逃生,不可蜂 拥而出 或留恋 财物, 要当机 立断, 披上浸 湿的衣 服或裹 上湿毛 毯、湿 被褥勇 敢地冲 出去
知识点一:胶体
均匀透明 稳定 d<1nm 小分子或离子
氯化钠溶液
均匀透明 介稳定
钾盐、钠盐、铵盐、硝酸盐全溶 SO42-除Ba2+(Ca2+、Ag+ 微溶) Cl-除Ag+ CO32-只溶K+、Na+、NH4+(Mg2+微溶) OH-只溶K+、Na+、Ba2+(Ca2+微溶)
高中化学第二章化学物质及其变化本章整合课件必修1高一必修1化学课件

正确?
。
12/11/2021
第三页,共十六页。
强化
强化
(qiánghu (qiánghu
à)点一
à)点二
解析:(1)A项,根据氧化性:Cl2>Br2>Fe3+>I2可知,Fe3+能够把I-氧化为I2,所以Fe3+
和体,I反不-在应能同大生一量成溶共B液a存C中O;D3不沉项能淀,四大,种不量离能共子大(存l量ízǐ;)之共B项间存,B不;Ca2发项+能生,H够反+能与应够,可与以大量H反共CO应存3- 生。成COC2O气32-
本章(běn zhānɡ)整合
12/11/2021
第一页,共十六页。
复习回顾本章(běn zhānɡ)所学内容,完善下列知识网,熟练掌握本章的知识结构。
12/11/2021
第二页,共十六页。
强化 (qiánghu
à)点一
强化 (qiánghu
à)点二
离子反应
【典例1】 已知氧化(yǎnghuà)性:Cl2>Br2>Fe3+>I2,请回答下列问题。
No
Image
12/11/2021
第十六页,共十六页。
12/11/2021
第八页,共十六页。
强化 (qiánghu
à)点一
强化
(qiánghu à)点二
(5)物质的氧化性或还原性的强弱取决于得到电子或失去电子的难易,而不是得 失电子的数目,如化学反应中Al失电子数多于Na,但还原性:Na>Al。
2.氧化还原反应的计算(jìsuàn) (1)计算类型:求氧化剂与还原剂的物质的量之比或质量比,计算参加反应的氧 化剂或还原剂的量,确定反应前后某一元素的价态变化等。 (2)计算公式:氧化剂物质的量×变价元素原子的个数×化合价的变化值= 还原剂物质的量×变价元素原子的个数×化合价的变化值。
高中-化学-人教版-高中化学必修一第二章《化学物质及其变化》单元复习 课件

③
石蕊溶液无明显现 象(显中性)
物质 稀硫酸、稀盐酸 NaOH溶液、Ca(OH)2溶液 BaCl2溶液、KNO3溶液
【对应训练】
1.物质分类是化学研究的重要方法之一。化学工作
者经常要根据物质的组成对物质进行分类研究。近年
来发现,在金星大气层中存在三氧化二碳。下列物质
与它属于同类的是( )
A.H2、O3 C.SO2、NO
【问题探究】(1)怎样判断离子方程式的正误?
离子方程式正误判断应抓住以下三点:两易、两 等、两查。“两易”即易溶且易电离的物质是否以离子符号表示。 “两等”即方程式两边各元素原子个数和各电荷数是否相等。 “两查”即检查是否漏掉反应条件、化学计量数是否最简单。
【拓展探究】在书写离子方程式时,微溶物该如何处
2、离子方程式正误判断:
【对应训练】
1.下列反应的离子方程式正确的是( ) A.氢氧化铝中和胃酸:Al(OH)3+3H+=Al3++3H2O B.石灰乳与Na2CO3溶液混合:Ca2++CO32-
=CaCO3↓ C.硫酸铜与烧碱溶液反应:CuSO4+2OH-
=Cu(OH)2↓+SO42- D.碳酸钡与硫酸反应:Ba2++SO42-=BaSO4↓ E.氢氧化钙溶液与等物质的量的稀H2SO4混合:
如溶液稳定,但比浊液稳定,放置较长时间不会聚沉而析出沉淀。
二、离子反应方程式的书写及判断 【讨论交流】(1)酸、碱、盐等都是电解质,在书 写离子方程式时都要拆写成离子吗?
不是。强酸、强碱和易溶性的盐改写成离子形式, 难溶物、难电离的物质(如弱酸、弱碱和水等)、易挥发性的物 质、单质、氧化物、非电解质等均不能写成离子形式,要写化 学式。
B.H2SO4、H2CO3 D.Na2CO3、KClO3
人教版高中化学必修一第二章 化学物质及其变化 复习课件

。
问题探究 1:由同种元素形成的物质一定是纯净物吗?
提示:不一定,如 O2 和 O3 组成的物质,虽然是同种元素 形成的,但属于混合物。
问题探究 2:下列变化一定属于化学变化的是________。 (1)导电 (2)爆炸 (3)缓慢氧化 (4)品红褪色 (5)无水硫
酸铜由白色变为蓝色 黄
(6)白磷转化为红磷
(6)⑦⑨ (7)⑩ (8)①~⑩ ⑦⑨⑩ (4)⑤ (5)⑦⑨⑩
在解答物质的分类问题时,首先要审清题意,明确分类的 依据,然后分析物质的组成和性质,作出正确判断。
表中关于物质分类的正确组合是
类别 酸性氧 碱性氧 酸 组合 化物 化物 A CO2 SiO2 H2SO4 B CO Na2O HCl C SO2 Na2O2 CH3COOH 碱
(1)属于混合物的是________; (2)属于氧化物的是________________;
(3)属于碱的是 ________________; (4)属于酸的是 ________________; (5)属于盐的是 ________________; (6)属于铜盐的是________________; (7)属于钠盐的是________________; (8)从单质、混合物、酸、碱、盐等角度看采用树状分类法 的物质有 ________________ ;同时采用交叉分类法的物质有 __________________。 (以上空格填物质的序号)
(7)久置浓硝酸变
提示:(1)金属导电是物理变化,电解质溶液导电是化学变 化;(2)爆炸的原因很多,有的是化学变化如 H2 与 Cl2 光照条件 下爆炸,有的是物理变化如自行车打气时轮胎爆炸等;(4)活性 炭使品红褪色属物理变化;(5)无水硫酸铜由白色变为蓝色是结 合水生成了胆矾;(6)白磷和红磷是两种不同的单质;(7)浓硝酸 久置分解出 NO2, NO2 又溶解在 HNO3 溶液中, 使得硝酸变黄。 故上述变化一定属于化学变化的是(3)(5)(6)(7)。
高一化学第二章化学物质及其变化复习必修-PPT课件

强弱:
1.定义:电离时生成的阳离子全部是氢离子(H+)的化合物叫做 酸 氧化性酸: 浓H2SO4、HNO3 、HClO、HClO3、HClO4 含氧酸: H2SO4、 HNO3 、H3PO4 、 H2CO3
酸的分类
强酸: HCl、HBr、HNO3、H2SO4 中强酸: H2SO3、H3PO4、H2C2O4 弱酸: H2CO3、CH3COOH、HF
5.2
例:用树状分类法对HCl,CO2 ,CaO ,NaOH, Na2SO4 , CaCO3 , Ca(OH)2 ,H2SO4进行分类.
化合物
Evaluation only. ted with 酸 Aspose.Slides for .NET Profile 5.2 碱 盐 3.5 Client 氧化物 Copyright 2019-2019 Aspose Pty Ltd.
SO3、P2O5、Mn2O7、CrO3
两性氧化物: 同时能跟碱和酸起反应只生成盐和水
Al2O3 、ZnO: Al2O3+2NaOH=2NaAlO2+H2O 不成盐氧化物: 既不跟酸反应也不跟碱反应的氧化物 H2O、NO、CO、N2O、NO2、MnO2
按是否 含氧: 无氧酸: HCl、HBr、HI、HF、H2S 一元酸 : HCl、HBronly. 、HNO3、CH3COOH Evaluation 按提供氢 二元酸: H SO 、H CO 、H C O 2 3 2 2 4 Profile 5.2 酸 with Aspose.Slides 2 ted for 3.5 Client 离子数目: 多元酸 : H3PO4 Aspose Pty Ltd. Copyright 2019-2019 挥发性酸: HNO3、HCl、HF、HBr、HI、H2S 按挥发性: 难挥发性酸: H2SO4、H3PO4 按酸性
1.定义:电离时生成的阳离子全部是氢离子(H+)的化合物叫做 酸 氧化性酸: 浓H2SO4、HNO3 、HClO、HClO3、HClO4 含氧酸: H2SO4、 HNO3 、H3PO4 、 H2CO3
酸的分类
强酸: HCl、HBr、HNO3、H2SO4 中强酸: H2SO3、H3PO4、H2C2O4 弱酸: H2CO3、CH3COOH、HF
5.2
例:用树状分类法对HCl,CO2 ,CaO ,NaOH, Na2SO4 , CaCO3 , Ca(OH)2 ,H2SO4进行分类.
化合物
Evaluation only. ted with 酸 Aspose.Slides for .NET Profile 5.2 碱 盐 3.5 Client 氧化物 Copyright 2019-2019 Aspose Pty Ltd.
SO3、P2O5、Mn2O7、CrO3
两性氧化物: 同时能跟碱和酸起反应只生成盐和水
Al2O3 、ZnO: Al2O3+2NaOH=2NaAlO2+H2O 不成盐氧化物: 既不跟酸反应也不跟碱反应的氧化物 H2O、NO、CO、N2O、NO2、MnO2
按是否 含氧: 无氧酸: HCl、HBr、HI、HF、H2S 一元酸 : HCl、HBronly. 、HNO3、CH3COOH Evaluation 按提供氢 二元酸: H SO 、H CO 、H C O 2 3 2 2 4 Profile 5.2 酸 with Aspose.Slides 2 ted for 3.5 Client 离子数目: 多元酸 : H3PO4 Aspose Pty Ltd. Copyright 2019-2019 挥发性酸: HNO3、HCl、HF、HBr、HI、H2S 按挥发性: 难挥发性酸: H2SO4、H3PO4 按酸性
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
显的光带,前者则没有
第二章
化学物质及其变化
【解析】
本题考查了溶液与胶体的性质。胶体本身
是不带电,只是胶体中的胶体粒子具有较大的表面积,吸
附了溶液中的离子而使胶体粒子带了电荷,故A项错误;
溶液中的溶质,要看能否电离,若是非电解质,则不导电,人 教 也即不会移动,B项错误;溶液中溶质粒子的运动也是没 有规律的,C项错误;丁达尔效应可以用来区分溶液和胶 体,D项正确。
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
2.以分散质粒子大小为标准对分散系进行分类
人 教 版 化 学
第二章
化学物质及其变化
【例1】
今有下列三组物质,每组中都有一种物质
跟其他三种属于不同的种类。将此种物质(写化学式)和分
类依据(选出的物质与其他物质不同之处)写在相应的表格
人 教 版 化 学
子反应: Ba(OH)2+NaHSO4===BaSO4+H2O+NaOH Ba(OH)2+MgSO4===BaSO4+Mg(OH)2。
【答案】 见解析
第二章
化学物质及其变化
【例5】
下列反应的离子方程式正确的是(
)
A.碳酸氢钙溶液与稀盐酸的反应
Ca(HCO3)2+2H+===Ca2++2H2O+2CO2↑
2 应物中必须包含 SO4-和 Ba2+)。
人 教 版 化 学
第二章
化学物质及其变化
- +
2 【解析】 能用离子方程式 SO4 +Ba2 ===BaSO4表
示的离子反应: BaCl2+H2SO4===BaSO4+2HCl Ba(NO3)2+Na2SO4===BaSO4+2NaNO3
2 不能用离子方程式 SO4- +Ba2 + ===BaSO4表示的离
质进行分类时,通常可从物理性质中的状态、颜色或从物
质的组成进行分析,如纯净物、混合物、金属单质、非金 属单质、氧化物、酸、碱、盐等。 N2 属于气态单质,而S则属于固态单质;第(2)组,所给四
人 教 版 化 学
第(1)组,所给四种物质均为非金属单质,而O2 、Cl2 、
种物质均为单质,而Fe、Na、Al属于金属单质,Si属于非
人 教 版 化 学
又有还原性,但主要呈现一种性质;物质若含有多种元素,
应用:判断元素或物质氧化性或还原性的有无。
注意:元素处于最高价,具有氧化性,但不一定氧化 性最强,如氧化性HClO>HClO4。
第二章
化学物质及其变化
4.转化律:氧化还原反应中,以元素相邻价态间的 转化最容易;同种元素不同价态之间若发生反应,元素的
B.碳酸钙溶于醋酸中 CaCO3+2H+===Ca2++CO2↑+H2O C.澄清石灰水跟硝酸反应 Ca(OH)2+2H+===Ca2++2H2O
人 教 版 化 学
D.硫酸铜溶液跟氢氧化钡溶液反应
Ba2++SO2-===BaSO4↓ 4
第二章
化学物质及其变化
E.氯化铁溶液中加入过量铁粉 Fe3++Fe===2Fe2+↑
人 教 版 化 学
被Cl2氧化等。
第二章
化学物质及其变化
2.混合顺序不同,离子反应不同 如AlCl3 与NaOH、Na2CO3 与HCl、Na2S与FeCl3 、氯
水与FeBr2 、氨水与AgNO3 等。这些情况归根到底还是与
量的多少有关。 3.书写“十不忽视” 反应条件(如加热、不加热):溶液浓度(浓、稀);物质 聚集状态(气、液、固);电荷守恒;方程式中化学计量数
人 教 版 化 学
【解析】
胶体与溶液均比较稳定,故C项正确;而
胶体由于其微粒粒度的大小,其不能通过半透膜,具有聚 沉的特性等,而溶液不可。 【答案】 C
第二章
化学物质及其变化
1.量不同,离子反应不同
(1)生成的产物可与过量的物质继续反应的离子反应。 这类离子反应,只需注意题给条件,判断产物是否与过量 物质继续反应,准确确定产物形式即可。如NaOH与AlCl3 溶液 (少量 或过量 ), NaAlO2 溶液通 CO2(少量或过 量 ) ,
金属单质;第(3)组,所给四种物质为四种氧化物,通过对 氧化物分析可得出,其中,CO2 、SO2 、P2O5 为常见的酸 性氧化物,而NO则属于不成盐氧化物。
第二章
化学物质及其变化
【答案】
组别 第(1)组 第(2)组 第(3)组
被选出的物质 S Si NO
分类依据 物质的状态 金属单质、非金属单质 氧化物的性质
内。三组物质分别为: (1)O2 、Cl2 、S、N2 CO2、SO2、P2O5 组别 第(1)组 被选出的物质 分类依据 (2)Fe、Na、Al、Si (3)NO、
人 教 版 化 学
第(2组)
第(3)组
第二章
化学物质及其变化
【解析】
不同的分类标准其分类方法不同,其分类
的基本原则是分在同一类的物质应具有相似之处,在对物
版 化 学
【答案】
D
第二章
化学物质及其变化
【 例 3】
( 河 南 平 顶 山 2009 - 2010 学 年 度 调 研 )
题)FeCl3溶液、Fe(OH)3胶体共同具备的性质是(
A.加入饱和的MgSO4溶液都发生聚沉
B.分散质的粒子都不能通过半透膜 C.都比较稳定,密封保存一段时间也都不会产生沉 淀 D.加入硫酸先产生沉淀,后沉淀溶解
人 教 版 化 学
习,我将对本章的知识进一步深化巩固。
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
ห้องสมุดไป่ตู้
分类是学习和研究化学物质及其变化的一种常用方法。
分类要有一定的标准,根据不同的标准可以对化学物质及 其变化进行不同的分类。常用的分类方法有交叉分类法和 树状分类法。 1.以组成为标准对物质进行分类
人 教 版 化 学
第二章
化学物质及其变化
【例6】
(山东五莲2009-2010学年度上学期期中考
试)有Na、Cl2、NaOH溶液、FeCl2溶液四种物质,按下列
要求,选用其中的两种物质,并写出相应的离子方程式。
(1)氧化还原反应,一种单质氧化一种阳离子 _______________________________________________ _________________________; (2)非氧化还原反应,
第二章
化学物质及其变化
章末专题复习
人 教 版 化 学
第二章
化学物质及其变化
物质的分类、离子反应、氧化还原反应是中学化学的
重要理论部分,是联系元素及其化合物知识的桥梁,也是
高考的热点之一。本章首先介绍了物质的组成与分类的重 要方法,胶体部分是对有关溶液知识的补充。然后重点学 习了电解质、离子反应及其应用。最后是对氧化还原反应 相关概念的分析以及氧化剂还原剂的判断。通过本节的复
化合价只靠近而不交叉;同种元素,相邻价态间不发生氧
化还原反应。 应用:分析判断氧化还原反应能否发生。如浓H2SO4 与 SO2 不 会 发 生 反 应 ; KClO3 + 6HCl===KCl + 3Cl2 + 3H2O反应中,中+5价氯不会转化为KCl中-1价氯;反应
人 教 版 化 学
H2SO4(浓)+H2S===S+SO2+2H2O中,浓H2SO4对应
人 教 版 化 学
Ca(OH)2 溶液通CO2(少量或过量),NaAlO2 溶液加盐酸(少
量或过量),有关离子方程式都有所区别。
第二章
化学物质及其变化
(2)酸式盐与量有关的离子反应。一般书写时,量不足 的物质中参加反应的离子的物质的量之比一定要与它的化 学式相符合;而足量的物质中参加反应的离子的物质的量 之比不一定与化学式相符。如果没有明确的用量,用任一 反应物作为足量写出的离子方程式均属正确。如NaHSO4 溶液与Ba(HCO3)2(少量或过量),Ca(HCO3)2溶液与 NaOH(少量或过量),Ca(OH)2溶液与NaHCO3(少量或过
方程式两端电荷不守恒;F 项错误,反应后应该生成 Fe2+ 而不是 Fe3 。G、H、I 三项既符合反应规律,又遵守离子 方程式的书写规则。
+
第二章
化学物质及其变化
【答案】 【点拨】
G、H、I 判断离子方程式的正误应注意:(1)看原理,
是否符合客观实际;(2)看改写,看用化学式还是用离子符
号表示;(3)看守恒,即左右两端原子个数、电荷数是否相 等;(4)看配比,不足量物质参加反应的离子的配比与其化 学式中离子个数比应相同;(5)看符号,“===” “ ”“↓”“↑”使用是否适当。
- - - - -
人 教 版 化 学
第二章
化学物质及其变化
【解析】
A 项错误,Ca(HCO3)2 易溶于水,应写成
人 教 版 化 学
Ca2+、HCO-形式;B 项错误,醋酸是弱电解质,保留化学 3 式;C 项错误,澄清石灰水是强碱溶液,应写成 Ca 、OH
- + -
2+
形式; 项错误, Cu2 和 OH 的反应漏掉了; 项错误, D 把 E
F.单质铁与稀盐酸反应
2Fe+6H+===2Fe3++3H2 G.向稀氨水中加入稀盐酸
NH3· 2O+H+===NH++H2O H 4 H.向 NaOH 溶液中通少量 CO2 气体 2OH +CO2===CO2 +H2O 3 I.小苏打溶液跟烧碱溶液反应
2 HCO3 +OH ===CO3 +H2O
人 教 版 化 学
第二章
化学物质及其变化
【解析】
本题考查了溶液与胶体的性质。胶体本身
是不带电,只是胶体中的胶体粒子具有较大的表面积,吸
附了溶液中的离子而使胶体粒子带了电荷,故A项错误;
溶液中的溶质,要看能否电离,若是非电解质,则不导电,人 教 也即不会移动,B项错误;溶液中溶质粒子的运动也是没 有规律的,C项错误;丁达尔效应可以用来区分溶液和胶 体,D项正确。
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
2.以分散质粒子大小为标准对分散系进行分类
人 教 版 化 学
第二章
化学物质及其变化
【例1】
今有下列三组物质,每组中都有一种物质
跟其他三种属于不同的种类。将此种物质(写化学式)和分
类依据(选出的物质与其他物质不同之处)写在相应的表格
人 教 版 化 学
子反应: Ba(OH)2+NaHSO4===BaSO4+H2O+NaOH Ba(OH)2+MgSO4===BaSO4+Mg(OH)2。
【答案】 见解析
第二章
化学物质及其变化
【例5】
下列反应的离子方程式正确的是(
)
A.碳酸氢钙溶液与稀盐酸的反应
Ca(HCO3)2+2H+===Ca2++2H2O+2CO2↑
2 应物中必须包含 SO4-和 Ba2+)。
人 教 版 化 学
第二章
化学物质及其变化
- +
2 【解析】 能用离子方程式 SO4 +Ba2 ===BaSO4表
示的离子反应: BaCl2+H2SO4===BaSO4+2HCl Ba(NO3)2+Na2SO4===BaSO4+2NaNO3
2 不能用离子方程式 SO4- +Ba2 + ===BaSO4表示的离
质进行分类时,通常可从物理性质中的状态、颜色或从物
质的组成进行分析,如纯净物、混合物、金属单质、非金 属单质、氧化物、酸、碱、盐等。 N2 属于气态单质,而S则属于固态单质;第(2)组,所给四
人 教 版 化 学
第(1)组,所给四种物质均为非金属单质,而O2 、Cl2 、
种物质均为单质,而Fe、Na、Al属于金属单质,Si属于非
人 教 版 化 学
又有还原性,但主要呈现一种性质;物质若含有多种元素,
应用:判断元素或物质氧化性或还原性的有无。
注意:元素处于最高价,具有氧化性,但不一定氧化 性最强,如氧化性HClO>HClO4。
第二章
化学物质及其变化
4.转化律:氧化还原反应中,以元素相邻价态间的 转化最容易;同种元素不同价态之间若发生反应,元素的
B.碳酸钙溶于醋酸中 CaCO3+2H+===Ca2++CO2↑+H2O C.澄清石灰水跟硝酸反应 Ca(OH)2+2H+===Ca2++2H2O
人 教 版 化 学
D.硫酸铜溶液跟氢氧化钡溶液反应
Ba2++SO2-===BaSO4↓ 4
第二章
化学物质及其变化
E.氯化铁溶液中加入过量铁粉 Fe3++Fe===2Fe2+↑
人 教 版 化 学
被Cl2氧化等。
第二章
化学物质及其变化
2.混合顺序不同,离子反应不同 如AlCl3 与NaOH、Na2CO3 与HCl、Na2S与FeCl3 、氯
水与FeBr2 、氨水与AgNO3 等。这些情况归根到底还是与
量的多少有关。 3.书写“十不忽视” 反应条件(如加热、不加热):溶液浓度(浓、稀);物质 聚集状态(气、液、固);电荷守恒;方程式中化学计量数
人 教 版 化 学
【解析】
胶体与溶液均比较稳定,故C项正确;而
胶体由于其微粒粒度的大小,其不能通过半透膜,具有聚 沉的特性等,而溶液不可。 【答案】 C
第二章
化学物质及其变化
1.量不同,离子反应不同
(1)生成的产物可与过量的物质继续反应的离子反应。 这类离子反应,只需注意题给条件,判断产物是否与过量 物质继续反应,准确确定产物形式即可。如NaOH与AlCl3 溶液 (少量 或过量 ), NaAlO2 溶液通 CO2(少量或过 量 ) ,
金属单质;第(3)组,所给四种物质为四种氧化物,通过对 氧化物分析可得出,其中,CO2 、SO2 、P2O5 为常见的酸 性氧化物,而NO则属于不成盐氧化物。
第二章
化学物质及其变化
【答案】
组别 第(1)组 第(2)组 第(3)组
被选出的物质 S Si NO
分类依据 物质的状态 金属单质、非金属单质 氧化物的性质
内。三组物质分别为: (1)O2 、Cl2 、S、N2 CO2、SO2、P2O5 组别 第(1)组 被选出的物质 分类依据 (2)Fe、Na、Al、Si (3)NO、
人 教 版 化 学
第(2组)
第(3)组
第二章
化学物质及其变化
【解析】
不同的分类标准其分类方法不同,其分类
的基本原则是分在同一类的物质应具有相似之处,在对物
版 化 学
【答案】
D
第二章
化学物质及其变化
【 例 3】
( 河 南 平 顶 山 2009 - 2010 学 年 度 调 研 )
题)FeCl3溶液、Fe(OH)3胶体共同具备的性质是(
A.加入饱和的MgSO4溶液都发生聚沉
B.分散质的粒子都不能通过半透膜 C.都比较稳定,密封保存一段时间也都不会产生沉 淀 D.加入硫酸先产生沉淀,后沉淀溶解
人 教 版 化 学
习,我将对本章的知识进一步深化巩固。
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
人 教 版 化 学
第二章
化学物质及其变化
ห้องสมุดไป่ตู้
分类是学习和研究化学物质及其变化的一种常用方法。
分类要有一定的标准,根据不同的标准可以对化学物质及 其变化进行不同的分类。常用的分类方法有交叉分类法和 树状分类法。 1.以组成为标准对物质进行分类
人 教 版 化 学
第二章
化学物质及其变化
【例6】
(山东五莲2009-2010学年度上学期期中考
试)有Na、Cl2、NaOH溶液、FeCl2溶液四种物质,按下列
要求,选用其中的两种物质,并写出相应的离子方程式。
(1)氧化还原反应,一种单质氧化一种阳离子 _______________________________________________ _________________________; (2)非氧化还原反应,
第二章
化学物质及其变化
章末专题复习
人 教 版 化 学
第二章
化学物质及其变化
物质的分类、离子反应、氧化还原反应是中学化学的
重要理论部分,是联系元素及其化合物知识的桥梁,也是
高考的热点之一。本章首先介绍了物质的组成与分类的重 要方法,胶体部分是对有关溶液知识的补充。然后重点学 习了电解质、离子反应及其应用。最后是对氧化还原反应 相关概念的分析以及氧化剂还原剂的判断。通过本节的复
化合价只靠近而不交叉;同种元素,相邻价态间不发生氧
化还原反应。 应用:分析判断氧化还原反应能否发生。如浓H2SO4 与 SO2 不 会 发 生 反 应 ; KClO3 + 6HCl===KCl + 3Cl2 + 3H2O反应中,中+5价氯不会转化为KCl中-1价氯;反应
人 教 版 化 学
H2SO4(浓)+H2S===S+SO2+2H2O中,浓H2SO4对应
人 教 版 化 学
Ca(OH)2 溶液通CO2(少量或过量),NaAlO2 溶液加盐酸(少
量或过量),有关离子方程式都有所区别。
第二章
化学物质及其变化
(2)酸式盐与量有关的离子反应。一般书写时,量不足 的物质中参加反应的离子的物质的量之比一定要与它的化 学式相符合;而足量的物质中参加反应的离子的物质的量 之比不一定与化学式相符。如果没有明确的用量,用任一 反应物作为足量写出的离子方程式均属正确。如NaHSO4 溶液与Ba(HCO3)2(少量或过量),Ca(HCO3)2溶液与 NaOH(少量或过量),Ca(OH)2溶液与NaHCO3(少量或过
方程式两端电荷不守恒;F 项错误,反应后应该生成 Fe2+ 而不是 Fe3 。G、H、I 三项既符合反应规律,又遵守离子 方程式的书写规则。
+
第二章
化学物质及其变化
【答案】 【点拨】
G、H、I 判断离子方程式的正误应注意:(1)看原理,
是否符合客观实际;(2)看改写,看用化学式还是用离子符
号表示;(3)看守恒,即左右两端原子个数、电荷数是否相 等;(4)看配比,不足量物质参加反应的离子的配比与其化 学式中离子个数比应相同;(5)看符号,“===” “ ”“↓”“↑”使用是否适当。
- - - - -
人 教 版 化 学
第二章
化学物质及其变化
【解析】
A 项错误,Ca(HCO3)2 易溶于水,应写成
人 教 版 化 学
Ca2+、HCO-形式;B 项错误,醋酸是弱电解质,保留化学 3 式;C 项错误,澄清石灰水是强碱溶液,应写成 Ca 、OH
- + -
2+
形式; 项错误, Cu2 和 OH 的反应漏掉了; 项错误, D 把 E
F.单质铁与稀盐酸反应
2Fe+6H+===2Fe3++3H2 G.向稀氨水中加入稀盐酸
NH3· 2O+H+===NH++H2O H 4 H.向 NaOH 溶液中通少量 CO2 气体 2OH +CO2===CO2 +H2O 3 I.小苏打溶液跟烧碱溶液反应
2 HCO3 +OH ===CO3 +H2O
人 教 版 化 学
