基本化学反应PPT课件1 人教版优质课件
化学反应基本反应类型PPT课件(上课用)

练习10:将一定质量的铁粉放入足量相同
质量分数的Cu(NO3)2和AgNO3混合溶液中,
充分反应后过滤,测得滤渣中只含一种金
Байду номын сангаас
属,该金属是 A. Fe B. Cu
C. Ag
() C
练习11:向含有CuCl2,ZnCl2,HCl的溶液中撒入 过量的铁粉,反应后溶液中一定有
(D)
A. ZnCl2 , HCl B. FeCl2 , CuCl2
113.人生的目的有二:先是获得你 想要的 ;然后 是享受 你所获 得的。 只有最 明智的 人类做 到第二 点总与 幽默的 人相伴 ,健康 总与阔 达的人 相伴。 20、对所学知识内容的兴趣可能成 为学习 动机。 ——赞 科夫 21、游手好闲地学习,并不比学习游手 好闲好 。—— 约翰·贝 勒斯
22、读史使人明智,读诗使人灵秀,数 学使人 周密, 自然哲 学使人 精邃, 伦理学 使人庄 重,逻 辑学使 人善辩 。—— 培根 23、我们在我们的劳动过程中学习思考 ,劳动 的结果 ,我们 认识了 世界的 奥妙, 于是我 们就真 正来改 变生活 了。— —高尔 基 24、我们要振作精神,下苦功学习。下 苦功, 三个字 ,一个 叫下, 一个叫 苦,一 个叫功 ,一定 要振作 精神, 下苦功 。—— 毛泽东
(3)碱 + 盐 新盐 + 新碱(至少一种难溶)
(可溶) (可溶)
(用来制 NaOH)
Ca(OH)2 + Na2CO3 = CaCO3 + 2NaOH
2NaOH + CuSO4 = Cu(OH)2 + Na2SO4 (蓝色沉淀)
3NaOH + FeCl3 = Fe(OH)3 + 3NaCl (红褐色沉淀)
(新教材)氧化还原反应PPT优秀课件人教版1

氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
二、氧化还原关系
失电子,化合价升高,发生氧化反应
还原剂+氧化剂=氧化产物+还原产物
得电子,化合价降低,发生还原反应
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
小组合作任务一: 氧化还原反应与四种基本反应类型的关系
氧化还原
分解
置换
化合
复分解
小组合作任务一: 氧化还原反应与离子反应的关系
离子反应
氧化还原反应
反应实例
一、氧化剂、还原剂、氧化产物、还原产物
失2e-电子,化合价升高,发生氧化反应
Fe+H2SO4=FeSO4+H2
得2e-电子,化合价降低,发生还原反应
▪
2.“现代的散文之最大特征,是每一个 作家的 每一篇 散文里 所表现 的个性 ,比从 前的任 何散文 都来得 强”。他 这里所 说的“ 个性”, 还有林 语堂此 前所说 的“性 灵”,指 的也都 是这种“ 自我” 。
▪
3.调查人群中,九成以上的学生为自 己是一 名中国 人而自 豪,九 成以上 的学生 对国家 的未来 充满信 心,这 表明学 生普遍 具有积 极的人 生观。
• 【总结】含有最高价态的元素的物质具有氧化 (填“氧化”或“还原”,下同)性;含有最低 价态的元素的物质具有__还_原___性;含有中间 价态的元素的物质既有__氧_化___性又有__还_原___ 性。
• 【巧记】高价氧化,低价还;中间价态两俱 全。
氧化还原反应 -【新教材】人教版高中化学必修一P PT优质 课件( 共16张)
人教教材《化学反应的方向》优质课件1

课堂小结:
化学反应的方向
ΔH - TΔS < 0 反应正向能自发进行。
C. 小黑点多的区域电子多
共同 影响
ΔH - TΔS = 0 反应达到平衡状态。
反应能焓量变判据 反应熵熵变判据ΔH - TΔS > 0 反应正向不能自发进行。 四D【A2(9B1D故【原D-(①【A0.7、... . .种解4答详子13用答..4镁3)下)根种原若标X晶 析 案 解 的 p案6【、和结列可6H据子反准体】B为】最】解.Y试铝8合性能2.半应状、都BN低A8答kF纸分Je以质存种。径生况W原·C是能】m测别上递在的l大成下子2o离C量解得+与l分变的最.小-A,最C子状1:氯B等l析不物6高2:11外为晶态由种=,1水浓可正质价W.层液2体轨①2则的度>知确是氧FL有态Y,道e溶由p、C>C,的N化7H,CZ形表于lCa个3等为l是L物4C2吸可的成示D水中H电l体2,对.收知4化离式得氯3子积(故②应2g的氧学子是无)原种,的和答不水热化式晶:色子根过H案宜化量性H2体溶数据,量为O用物N小是的液目(构O答稀:l瓷之)于C3反离,为造案硫l,N坩间2(应子可a>a2原选酸G埚互-CN生键的知Fl理AB反;e灼相b。成3越化一),应k烧+都JC强,学定基,氢2能,符式H不态产氧发5熔合为含ON生化生原H点题CC气(钠反aul子)越干(S体的O固应O的H高已4的△体)、核H2。知体;为C外而条a积C电构件O(子3成,V;排)离所布与子以式时键化为间的学1(离方s2t子程)2s半式2关2径成p系3越立如,小,右根,故图据离B。洪不子反特选所应规;带中则电镁可荷和知数铝基越的态多原,子离中子的键电越子强优,先所单以独答占案据是1个B。轨道,且自旋方向相同,因此氮
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
新人教版化学选修1(全书)ppt课件pptx

新人教版化学选修1(全书)ppt课件pptxcontents •绪论•物质结构与性质•化学反应原理•有机化学基础•化学与生活•化学实验基础目录绪论01加深对化学学科的理解通过学习选修1,学生可以更深入地了解化学学科的本质、研究对象和研究方法,从而增强对化学学科的兴趣和热爱。
拓展化学知识视野选修1涵盖了有机化学、无机化学、分析化学等多个领域,有助于学生拓展化学知识视野,提高化学素养。
为后续学习打下基础选修1中的许多知识点是后续化学学习的基础,如有机化学中的官能团、反应机理等,对于后续学习具有重要的铺垫作用。
内容概述选修1主要包括有机化学基础、无机化学基础和分析化学基础三个部分,每个部分都包含了相应的知识点和实验内容。
结构特点选修1采用模块化的结构,每个模块内部又分为若干个小节,小节之间既有联系又有相对独立性,方便学生进行学习和复习。
学习化学选修1的方法和要求学习方法学生应该采用多种学习方法,如阅读教材、听讲、记笔记、做实验等,以加深对知识点的理解和记忆。
学习要求学生需要掌握选修1中的基本概念、原理和实验技能,能够运用所学知识解决实际问题,同时还需要培养自己的创新思维和实践能力。
物质结构与性质0203元素性质与原子结构的关系原子结构对元素性质的影响,如元素的金属性、非金属性、氧化还原性等。
01原子结构原子的组成、原子核外电子排布、原子半径、电离能等基本概念和原理。
02元素周期律元素周期表的结构、周期和族的划分、元素性质的周期性变化等。
原子结构与元素周期律分子结构与化学键分子结构分子的组成、分子间作用力、分子的极性和非极性等基本概念和原理。
化学键离子键、共价键、金属键等不同类型的化学键的形成和性质。
分子结构与化学键的关系化学键对分子结构的影响,如分子的形状、键长、键角等。
1 2 3晶体的组成、晶胞、晶格等基本概念和原理。
晶体结构离子晶体、分子晶体、原子晶体和金属晶体等不同类型的晶体的结构和性质。
晶体的类型与性质晶体结构对物质性质的影响,如熔点、硬度、导电性等。
《化学反应基本原理》PPT课件

6. 化学反应热效应的计算
(1)由盖斯定律计算
例2 N2H4(l)+ O2(g)=N2(g)+2H2O(l) △rHmΘ1=-622.3 kJ •mol-1
H2O(l)+1/2O2(g)=H2O2(g) △rHmΘ2=149.5 kJ •mol-1
H2O2(g)=H2O2(l) △rHmΘ3= -51.5 kJ •mol-1
H2 + ½ O2 = H2O (l) △rHmΘ = △f HmΘ (H2O ,l) C(石墨)= C(金刚石)
△rHmΘ (T)=△f HmΘ (金刚石,T)=1.897kJ •mol-1
C(s)+ O2(g)= CO2(g) △rHmΘ = △f HmΘ (CO2 ) 2NH3(g)= N2(g)+3H2(g)
3.1 化学反应中的能量关系 3.2 化学反应的方向 3.3 化学反应速率 3.4 化学反应的限度
伴随化学反应的发生,能量也发生变化,对于 大多数化学反应,能量转化主要表现为化学能和热 能间的转化。
当今世界大部分能量来源于石油、煤和天然气 的燃烧反应,但这些资源越来越少,人们不得不寻 找新的能源,除了核能和太阳能,能量的获得离不 开化学反应。可见,研究化学反应中能量转化及其 规律有重要意义。
aA + mM = gG + dD
-aA –mM + gG + dD = 0
BB 0
nB()BnB(0) nBBBmol
nAA nM M nG G nD D
ξ=1mol时,表示参与反应的物质按所给的 计量数关系进行了一个单位的化学反应。
2. 焓和焓变 恒压只做体积功
W = -P△V
ΔU = Q+W = Qp+W = Qp -P△V 恒压反应热 QP=△U-W =△U+P△V
人教版化学必修1课件:第2章-第2节-离子反应

25
(2)如果病人同时患有胃溃疡,此时最好服用胃舒平[ 主要成分是Al(OH)3],反应的离子方程式为 ___________________________________。
非电解质 SO2 金属Al H2O
C2H5OH
23
【解析】 B项中CaCO3为强电解质,Al不是非电解 质;C项中H2O为弱电解质;D项中CH3COONH4是强电解 质。
【答案】 A
24
2.人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀 菌、帮助消化等作用,但胃酸的量不能过多或过少,它必 须控制在一定范围内,当胃酸过多时,医生通常用“小苏 打片”或“胃舒平”给病人治疗。
强电解质:在水溶液中全部电离成离子的电解质
包 括
强酸 如 盐酸 硫酸 硝酸 强碱 如 NaOH KOH Ba(OH)2 Ca(OH)2 大多数盐 如 NaCl AgNO3 BaSO4 CaCO3
弱电解质:在水溶液中部分电离成离子的电解质
包 弱酸 如 醋酸 H3PO4 H2S HClO
括
弱碱 如氨水 水
重点 离子方程式的书写
1
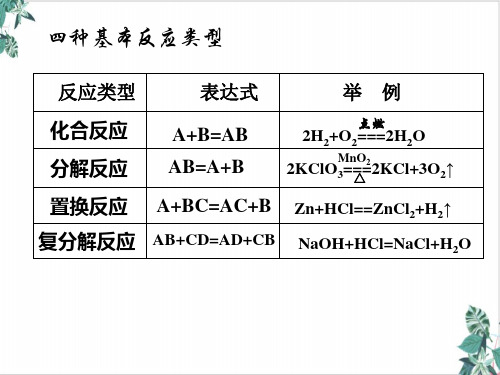
化学反应的分类方法 一、根据反应物和生成物的类别以及反应前后物 质种类的多少
置换反应、分解反应、化合反应、复分解反应 二、根据反应中是否有电子的转移
氧化还原反应、非氧化还原反应
三、根据反应中是否有离子参加 离子反应、分子间的反应
2
一、电解质和非电解质 1、电解质和非电解质
❖问题与讨论
5
❖溶液的导电性
溶液导电示意图:
化学选修4《化学反应原理》(人教版)全部课件

一、反应热 (焓变)
化学反应过程中所释放或吸收的能量,都 可以用热量(或换算成相应的热量)来表述,叫 做反应热,在恒压条件下又称为焓变。
PS:
ΔH=生成物能量-反应物能量 放热反应:ΔH<0或 ΔH为“-” 吸热反应:ΔH>0 或ΔH为“+”
从化学键的角度理解反应与能量变化的关系
以H2+Cl2=2HCl为例
E1不能通过实验测得,∴没有实际的计算意义 Ⅱ:反应物分子断键时吸收的总能量Σ反与生成物分 子形成新化学键时释放的能量Σ生的相对大小 △H= Σ反- Σ生 若: △H > 0 则为吸热反应 △H为“+” , Q<0 △H <0 则为放热反应 △H为“-” , Q>0 Ⅲ:通过实验直接测得→掌握中和热的测定
一、反应热 (焓变)
化学反应过程中所释放或吸收的能量,都 可以用热量(或换算成相应的热量)来表述,叫 做反应热,在恒压条件下又称为焓变。
PS:
1、符号:△H
单位: kJ/mol 或 kJ· mol-1
2、反应热描述的是化学反应前后的热量变化 3、反应热描述的是一定温度下的热量变化 4、任何化学反应都有反应热,表现为吸热反应或 者放热反应
★书写热化学方程式的注意事项
1、化学方程的右边必须写上△H,并 用“空格”隔开, △H:吸热用“+”,放热用:“-”, 单位是kJ/mol或J/mol
3、下列变化过程中会放出热量的是 ( D ) ①硝酸铵溶于水②物质的燃烧③苛性钠溶于水 ④生石灰放入水中 ⑤醋酸的电离 A.仅①⑤ B.仅②③ C.仅②④ D.②③④ 4、下列变化中,属于放热反应的是 ( B ) A.Ba(OH)2· 8H2O与NH4Cl的反应 B.点燃的镁条在二氧化碳中继续燃烧 C.灼热的碳与二氧化碳的反应 D.氯化钠溶于水
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a
1)知道化学方程式表示的意义
a
4、化学方 2)正确表述常见反应的化学方程式 程式
b
3)根据化学方程式进行生成物和反应物之间的计算
c
5、氧化性、1)举例说出氧化还原反应
a
还原性和 2)说明氧气具有氧化性、氢气和CO具有还原性
b
可燃性
3)说明氢气和CO具有可燃性,根据产物区别 b
描述物理和化学变化,区别物理和化学变化
件。 ②量:表示各反应物、生成物之间的质量比及分子(或
原子)个数比。
例:配平下列化学方程式: 1)_1_Fe3O4 +_4_CO==_3_Fe +_4_CO2 2)_2_C4H10 +_1_3O2==8CO2+1_0_H2O
已知铁在化合物中有+2、+3价,而铜也有 +1、+2两种价态。一般氯气(Cl2)与 金属化合时则一般生成低价金属硫化物。 试着写出下列反应的化学方程式:
化合反应:由两种或两种以上物质生成
一种物质的反应(多变一)
3、
A + B == AB
四 分解反应:由一种物质生成两种或两种
大
以上物质的反应(一变多)
基
AB == A + B
本 反
置换反应:由一种单质和一种化合物生成另 一种单质和另一种化合物的反应
A + BC == AC + B
应 复分解反应:两种化合物相互交换成分生
5)有酸生成的复分解反应
6)有三种不同类别的物质生成的分解反应
10.某商场开业庆典时,店外挂的氢气球因人群拥挤而 被挤破,遇上点燃的香烟,引起爆炸,并引起邻近 一串氢气球爆炸;迅速掠过的火苗烧了一些顾客的 头发,并浅度灼烧20多人的皮肤。请简答:
1)应以方上程事式实)说__明_氢_2_气_H_2具_+_有_O_什_2么__=点化_=燃_=学_=_性2_H_质2_O?(用化学反
式为2C2H5SH+9O2==4CO2 +2X+6H2O,则X的化学 式为( C )
A.H2SO4
B.SO3
C.SO2
D.CO
在一密闭容器内有X、Y、Z、Q四种物质,在一 定条件下充分反应,反应前后各物质的质量 如下表:
物质
X
Y
Z
Q
反应前质 量(克)
2
2 84 5
反应后质 量(克)
待测
24
0
14
试判断该密闭容器中发生的反应属于( C )
A.反应前后Cr元素的化合价分别为+6,+3
B.CrO3是还原剂 C.反应前后Cr元素的化合价分别为+3,+6
D.CO2是氧化剂
9.用化学反应方程式解释事实或写出有关的化学 反应方程式。
1)用硫酸铜配制农药波尔多液时不能用铁制容器
2)工业上常用稀盐酸除铁锈(铁锈的主要成分是 Fe2O3)
3)胃舒平[主要成分Al(OH)3]治疗胃酸过多症 4)有单质和化合物参加的化合反应
例2.100克稀硫酸恰好与适量的锌粒完全反应, 所得溶液的质量变为106.3克,问:有多少克 锌参加了反应?
6.5克
基础习:
1.鉴别氢气和一氧化碳,应选用的最佳方法是( )
DA.通入水中
B.与灼热的氧化铜反应
C. 分别点燃,观察火焰的颜色
D.分别点燃,检验燃烧后的产物
2.下列四个化学反应中,符合此漫画情景的是( )
4.近日,专家否认了“味精致癌”的说法。实验表明,味精在
100℃时加热半小时,只有0.3%的味精(谷氨酸钠)生成 焦谷氨酸钠,对人体的影响甚微。对此下列认识正确的是 ( D)
A.谷氨酸钠受热不分解
B.谷氨酸钠在加热下生成焦谷氨酸钠是物理变化
C.大量食用味精有利于身体健康
D.实验是研究问题的一种有效方法
①铁在氯气中燃烧_2_F_e__+_3_C_l_点2_=燃_=_=_2_F_e_C_l_3 ②铜在硫蒸气中燃烧_2_C_u__+_S_点_=燃_==_C__u_2_S____
1)知道化学方程式表示的意义(物质、分子、质量) 2)正确表述常见反应的化学方程式
3)根据化学方程式进行生成物和反应物之间的计算
2)某兴趣小组在进行探究实验时,用相对原子质量为 4的稀有气体氦气作为大型空气球的气体,其原因是 氦气:_密__度__比__空_气__小_______,化__学__性__质__稳_定_________
19 、做任何事都要经受得挫折,要有恒心和毅力,满怀信心坚持到底。 15 、机遇是难求的,失去了就不会再来,把握好现有的机会,努力进取,那么你将会得到不菲的收获。 20 、新人新工作,要有新气象:工作要认真,遇事莫要慌,见人懂礼貌,微笑挂脸上,心态要摆正,前辈是榜样,听从领导话,虚心又自强,注意讲卫生,衣着要端庄。祝你早日适应工作,成 为国家栋梁。
8.2004年5月1号期实施的新交通法规加大了对酒 后驾车的处罚力度。测试酒精既可用电子仪器, 又可用化学方法。某兴趣小组利用物质颜色变化 验证酒精的存在,其做法是:向盛有硫酸溶液的 试管中加入少量的红棕色三氧化铬晶体 (CrO3),然后向其中滴加酒精,生成了绿色 的硫酸铬溶液[Cr2(SO4)3]和CO2气体.下列叙 述正确的是(A )
成二种新化合物的反应
AB + CD == AD + CB
4、氧化还原反应:
在反应物之间直接发生电子转移的反应
失去电子→化合价升高→被氧化→是还原剂(具有还原性)
失升氧化还原剂
得到电子→化合价降低→被还原→是氧化剂(具有氧性)
得降还原氧化剂
1)举例说出氧化还原反应
2)说明氧气具有氧化性、氢气和CO具有还原性
5.伽利略说:“生命如铁?,愈被敲打,愈能发出火花”,其 中蕴含的化学原理,用化学方程式表示真确的是(B )
A. 3Fe + O2 =高=温 Fe3O4 B. 3Fe + 2O2 == Fe3O4 C. 3Fe + 2O2 == Fe3O4 D. Fe + 2O2 == Fe3O4
6.如图是小明同学为探究“植物光合作用所需条件” 而进行的实验操作过程,通过这个实验说明光合 作用需要( C )
d.复分解反应一__定__不__是_氧化还原反应.
例:1)工业上制硅的反应方程式为:
SiO2 + C == Si + CO2 ,下列叙述错误的是( )
A.该C反应为置换反应
B.碳表现出还原性
C. SiO2发生了氧化反应
D.碳是还原剂
2)氢气是一种绿色能源,科学家们最新研制出利用
太阳能产生激光,在利用激光使海水分解得到氢气
6 、骨宜刚,气宜柔,志宜大,胆宜小,心宜虚,言宜实,慧宜增,福宜惜,虑不远,忧亦近。 5 、当你感到悲哀痛苦时,最好是去学些什么东西。学习会使你永远立于不败之地。 5 、每个人在成功之初都会遇到各种困难。但失败是成功之母,只有经历失败的洗礼,才能有丰富的成功。要珍惜每个人的态度,再平凡的人也有自己的主见,也会决定你的质量。 20 、新人新工作,要有新气象:工作要认真,遇事莫要慌,见人懂礼貌,微笑挂脸上,心态要摆正,前辈是榜样,听从领导话,虚心又自强,注意讲卫生,衣着要端庄。祝你早日适应工作,成 为国家栋梁。
2、(1)识别物理性质和化学性质:
物理性质(不需要发生化学变化就能表现出来的性质)
颜色,气味,味道,状态,密度,溶解 性,挥发性,熔点,沸点,硬度,比热,
导电性,导热性,延展性等 化学性质(需要发生化学变化就能表现出来的性质)
可燃性,酸碱度,氧化性,还原性, 毒性,稳定性等
2)应用性质解释现象
2.通常状况下,下列不适宜用物理性质区别的一
E. H2 + CuO =△= Cu + H2O
F. Fe + CuSO4 == FeSO4 + Cu
G. HCl + NaOH == NaCl + H2O
H. NaCI+AgNO3== AgCI↓+ NaNO3
2)根据1)的分析结论和推论,可推测四大基本 反应类型与氧化还原反应的关系为:
(填“一定是”,“一定不是”,“有的是”) a.化合反应_有__的__是__氧化还原反应, b.分解反应_有__的__是__氧化还原反应, c.置换反应_一__定__是__氧化还原反应,
1.物理变化与化学变化:
(1)物理变化:没有新的物质生成的变化。 (2)化学变化:有新的物质生成的变化。
例1.古诗词是古人为我们留下的宝贵精神财富。下列
诗句中只涉及物理变化的是( C )
A.野火烧不尽,春风吹又生 B.春蚕到死丝方尽,蜡炬成灰泪始干 C.只要功夫深,铁杵磨成针 D.爆竹声中一岁除,春风送暖入屠苏
A
A. Fe + CuSO4 == FeSO4 + Cu B. Fe + H2SO4 == FeSO4 + H2↑
△
C. H2 + CuO == Cu + H2O △
D. CuO + CO == Cu + CO2↑
3.下列用连线方法对部分化学只是进行归纳的内容中,有
错误的一组是(B )
A.物质的性质与用途:
有增减。 3)注意: ①参加化学反应的各物质的质量不包括虽然是反应物,
但却未参加反应的那部分。 ②生成的各物质的质量包括生成的沉淀和逸出的气体。
1)描述质量守恒定律 2)从分子、原子的角度解释质量守恒定律 3)应用质量守恒定律解释常见的现象
例:为了防止煤气逸散使人中毒,常在煤气中加
入少量的有特殊气味的乙硫醇(C2H5SH)乙硫醇 在煤气燃烧过程中也可充分燃烧,其化学方程
7.根据化学方程式进行计算: 1)一般步骤:设未知数→写出配平的化学方程式
→写出有关物质的质量比和已知量→列出量方程、 求解→写出简明的答案 2)注意: ①方程式必须配平 ②计算有关物质的质量比时式量要乘以前面的系 数 ③单位必须统一 ④如是不纯物必须换算成纯物质的质量代入计算
