高一化学氧化反应和还原反应PPT优秀课件
合集下载
2.3 课时2 氧化剂和还原剂 课件(共17张PPT) 年高一化学鲁科版(2019)必修第一册

点燃
2Fe+3Cl2==2FeCl3 , Fe+S=FeS, 变价金属Fe被Cl2氧化为+3价,而S只能将Fe氧化+2价, 氧化性: Cl2 >S
1.下列物质属于常见还原剂的是
A.O2
B.KMnO4
D
C.HNO3
D.活泼金属
2.下列变化中,需要加入还原剂的是
B
A.2Cl-→Cl2
B.Fe3+→Fe2+
阳离子的氧化性逐渐增强
(3)根据反应的难易(反应条件)程度比较
如:①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓)
△ =====
MnCl2+Cl2↑+2H2O
由反应条件可判断氧化性:KMnO4>MnO2。
(4) 根据变价元素被氧化或被还原的程度判断
三、氧化性和还原性强弱比较
(1) 根据反应方程式判断
氧化性:氧化剂>氧化产物; 还原性:还原剂>还原产物。
根据下列反应判断有关物质还原性由强到弱的顺序是 B ①Fe+ Cu2+ == Fe2+ + Cu ②2Fe3+ + Cu == 2Fe2+ + Cu2+
A. Cu2+ > Fe3+ > Fe2+ B. Fe > Cu > Fe2+ C. Fe2+ > Cu2+ > Fe3+
(2)根据元素活动性顺序判断,如根据金属活动性顺序表
单质的还原性逐渐减弱
金 K Ca Na Mg Al Zn Fe Sn Pb (H) Cu
Hg Ag Pt Au
人教版高一化学必修一2.3氧化还原反应课件共28张PPT

【例】下列说法中正确的是( D )
A、还原性强弱:Fe > Cu> H2 B、氧化性强弱:Cu2+ > H+> Fe3+
C、得电子越多的物质,氧化性越强
D、夺电子越强的物质,氧化性越强
物质氧化性、还原性相对强弱的比较
【方法三】根据氧化还原反应的程度 不同氧化剂和相同还原剂作用时,还原剂化合价升高数值 越大,氧化剂的氧化性越强。 例如:2Fe +3Cl2=== 2FeCl3 Fe + S FeS
+1 -1
化合价降低,被还原,发生还原反应
(1)化合价升降的原因是什么? (2 Nhomakorabea阅读课本P36第3段、第4段,讨论钠和氯气的氧化 还原反应的发生过程是怎样的?
氯化钠形成过程
化合价升降的原因:电子的得失
-
+ Na Na
-
-
-
Cl-
-
-
-
-
-
-
-
0
-
失去2×e-,化合价升高,被氧化
还原剂
2Na + Cl2
5、2Fe+3Cl2===2FeCl3
点燃
6、Fe+S==FeS
△
7、MnO2+4HCl(浓)==MnCl △ 2+Cl2↑+2H2O 8、2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2 ↑ +8H2O 9、H2S+H2SO4(浓)=S↓+SO2↑+2H2O
【思考】结合常见氧化剂和还原剂及氧化还原反应知识分 析,元素处于最高价态、最低价态、中间价态时分别具有什 么性质?
高一化学氧化还原反应优秀课件 PPT

还原剂 KClO3 氧化产物 O2
氧化剂 KClO3 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物质是还 原剂以及氧化产物、还原产物。
(9) 4NH3 + 5O2 == 4NO + 6H2O
还原剂 NH3 氧化产物 NO
氧化剂 O2 还原产物 H2O NO
(10) 5H2S+2KMnO4+3H2SO4=K2SO4+2MnSO4+5S↓+8H2O
+1 -1
△ 2HCl
还原剂 氧化剂 既是氧化产物又是还原产物
化合价降低,被还原
H H +1
+17
Cl
电是 子还 偏原 离剂
电是 子氧 偏化 向剂
+1
+17
HCl
氯化氢形成示意图
氯化氢分子的形成过程:
氧化还原反应中,电子转移(得失或偏移)和化 合价升降关系,可以表示如下:
被氧化、失去e-,化合价升高 -4 –3 –2 –1 0 +1 +2 +3 +4 +5 +6 +7
小结
电子得失角度:
有电子转移的反应是氧化还原反应; 物质失去电子的反应就是氧化反应; 物质得到电子的反应就是还原反应。
化合价升降角度:
有元素化合价升降的反应是氧化还原反应; 物质所含元素化合价升高的反应就是氧化反应; 物质所含元素化合价降低的反应就是还原反应。
氧化剂、还原剂;氧化产物、还原产物概念:
失去氧,被还原
CuO + H2 △ Cu + H2O
氧化剂 还原剂
还原产物 氧化产物
得到氧,被氧化
CuO + H2 △ Cu + H2O
高中化学氧化还原反应课件.ppt

失电子总数=得电子总数 化合价升高总数=化合价降低总数
练习:
1、在下列反应中,属于氧化还原反应的是( C )
A、CaCO3+2HCl = CaCl2+CO2 +H2O
B、CaO + H2O = Ca(OH)2 C、2H2O2 催==化=剂= 2H2O + O2
高温
D、CaCO3 === CaO + CO2
三、双线桥法表示电子转移情况的步骤 及特点1 、标化合价,找变价
➢2、画线桥: ➢3、写数目: ➢4、检查:
谢谢
钠原子失电子价升 高
氯原子得电子价降 低
我想要
一个电 子。
●●
● ●
●+
●●
Cl
老兄,干嘛愁 眉苦脸的?
●
Na
你给我一个 电子,好吗?
●●
● ●
●+
●●
Cl
让我想想 那好吧
●
Na
谢谢你!
●●
●
●
●
●
●●
﹣ Cl
没关系,互相帮 助嘛。
●
Na﹢
●●
Cl
● ●
●
还 ●●原Βιβλιοθήκη 反应 ●●●
●
Cl-● ●
还原产物
被氧化 被还原
板书设计 (即小结)如下: 一、氧化还原反应 1、定义: 2、特征: 二、氧化剂和还原剂 1. 定义: 氧化剂:得到电子(元素化合价降低)的物质——被还原。 还原剂:失去电子(元素化合价升高)的物质——被氧化
2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。 还原剂:Al、Zn、Fe、C、H2、CO 、KI 等
练习:
1、在下列反应中,属于氧化还原反应的是( C )
A、CaCO3+2HCl = CaCl2+CO2 +H2O
B、CaO + H2O = Ca(OH)2 C、2H2O2 催==化=剂= 2H2O + O2
高温
D、CaCO3 === CaO + CO2
三、双线桥法表示电子转移情况的步骤 及特点1 、标化合价,找变价
➢2、画线桥: ➢3、写数目: ➢4、检查:
谢谢
钠原子失电子价升 高
氯原子得电子价降 低
我想要
一个电 子。
●●
● ●
●+
●●
Cl
老兄,干嘛愁 眉苦脸的?
●
Na
你给我一个 电子,好吗?
●●
● ●
●+
●●
Cl
让我想想 那好吧
●
Na
谢谢你!
●●
●
●
●
●
●●
﹣ Cl
没关系,互相帮 助嘛。
●
Na﹢
●●
Cl
● ●
●
还 ●●原Βιβλιοθήκη 反应 ●●●
●
Cl-● ●
还原产物
被氧化 被还原
板书设计 (即小结)如下: 一、氧化还原反应 1、定义: 2、特征: 二、氧化剂和还原剂 1. 定义: 氧化剂:得到电子(元素化合价降低)的物质——被还原。 还原剂:失去电子(元素化合价升高)的物质——被氧化
2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。 还原剂:Al、Zn、Fe、C、H2、CO 、KI 等
人教版化学必修一氧化还原反应ppt33张课件
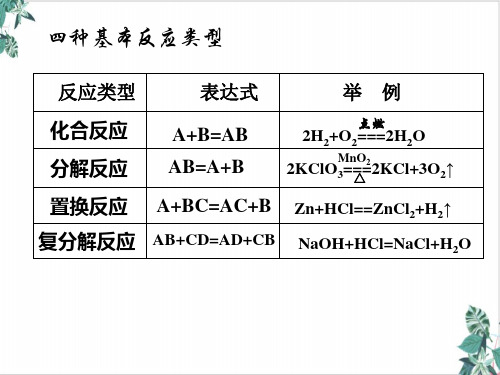
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应 课件(共38张PPT)

高温
H2 O + C == H2 + CO
得到氧,被氧化〔发生氧化反响〕
氧化反响和复原反响是分别独立进行的吗?
思考与交流
仔细从整个反响分析下面反响的反响类型:
失去氧, 被复原
CuO + H2 = Cu + H2O 得到氧,被氧化
CuO失去氧变成单质铜的同时, 还原反应
H2得到氧变成H2O。
氧化反应
〔一〕从得氧失氧角度来分析:
△
CuO + H2 == Cu + H2O
H
Cu
O
H
Cu
O
H
H
氧化反响:物质得到氧的反响,如H2得到氧的反响。 复原反响:物质失去氧的反响,如CuO失去氧的反响。
失去氧,被复原〔发生复原反响〕
△
CuO + H2 == Cu + H2O
得到氧,被氧化〔发生氧化反响〕 失去氧,被复原〔发生复原反响〕
分解反响 化合反响 置换反响 复分解反响
一、氧化复原反响
〖练习〗判断以下哪些是氧化复原反
响?属于哪种根本反响类型?
√ Cu+Cl2 =△== CuCl2
化合 反响
× CaO + H2O === Ca(OH) 2
× CaCO3=高=温=CaO+CO2 ↑
分解反应
√ 2KClO3==△=2KCl+3O2 ↑
A.一定被氧化
B.一定被复原
C.可能被氧化,也可能被复原
D.以上都不是
2、以下变化属于氧化反响的是〔 〕BD
A. Fe2O3
Fe B. Zn ZnCl2
C. Na2CO3 CO2 D. Al Al2O3
一、氧化复原反响
化学人教版高中必修1高一化学《氧化还原反应》课件-PPT

还原剂:反应中失电子的物质,表现还原性,具 有还原能力,起还原作用。
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
2、氧化产物:还原剂失电子被氧化对应生成物 还原产物:氧化剂得电子被还原对应生成物 氧化剂(有氧化性)--→还原产物 还原剂(有还原性)--→氧化产物
一、常见的氧化剂和还原剂
1.常见氧化剂
(1)部分非金属单质:如 、Cl2 等O。2
CaCO3 高温 CaO+CO2
(否)
2KClMO△n3O2 2KCl+3O2
(是)
CaO+H2O Ca(OH) 2
(否)
C+O2 点燃 CO2
(是)
CuO+H△2
Cu+H2O
(是)
3C+Fe2O3 高温 2Fe+3CO2
(是)
HCl+NaOH NaCl+H2O
(否)
2HCl+CaCO3 CaCl2+H2O+CO2(否)
(2)含有高价态元素的化合物:如
HNO3、 KMnO、4 FeC等l3。
H2、SO4
2.常见还原剂 (1)活泼的金属单质,如 (2)某些非金属单质,如
Al Zn Fe
、H2 、C 等。 、 C等O。 SO2
(3)某些非金属氧化物,如 、 等。
要点一 氧化性、还原性强弱的判断
1.根据氧化还原反应方程式进行判断 在同一反应中 氧化性:氧化剂>氧化产物;还原性:还原剂>还 原产物; 如:Fe+H2SO4===FeSO4+H2↑ 氧化性:H2SO4>FeSO4,还原性:Fe>H2
四 “双线桥”法
Mg + Cl2 = MgCl2
步骤:
1.标出变价元素的化合价
高一化学氧化还原反应优秀课件-PPT

第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应的基本概念及相互关系
回忆初中学过的氧化反应和还原反应
还原反应
CuO + H2 △ Cu + H2O
氧化反应
CuO + H2 △ Cu + H2O
一、从氧的得失角度分析
CuO + H2 △ Cu + H2O
CuO 失去氧 Cu
H2 得到氧 H2O
氧化剂 Cl2 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物 质是还原剂以及氧化产物、还原产物。
(3) 2H2O =电=解= 2H2↑ + O2↑
还原剂 H2O
氧化剂 H2O
氧化产物 O2
还原产物 H2
(4) MnO2 + 4HCl =△= MnCl2 + Cl2↑+2H2O
还原剂 HCl 氧化产物 Cl2
+5 -2
2KClO3
=△=
-1
2KCl
+
0
3O2↑
练习6:下列说法下说法正确的是( BD )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏 向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同 一物质。
练习7:下列反应中,HCl为还原剂的是( C ) HCl为 氧化剂的是( A ) HCl不是氧化剂也不是还原剂的是 ( BD )
被还原,得到e-,化合价降低
氧化还原反应的特征:化合价升降 氧化还原反应的实质:电子转移(得失或偏移)
通过以上分析,我们认识到:
1.有电子转移的反应是氧化还原反应。
第三节 氧化还原反应
氧化还原反应的基本概念及相互关系
回忆初中学过的氧化反应和还原反应
还原反应
CuO + H2 △ Cu + H2O
氧化反应
CuO + H2 △ Cu + H2O
一、从氧的得失角度分析
CuO + H2 △ Cu + H2O
CuO 失去氧 Cu
H2 得到氧 H2O
氧化剂 Cl2 还原产物 KCl
练习2:指出下列反应中哪种物质是氧化剂 、哪种物 质是还原剂以及氧化产物、还原产物。
(3) 2H2O =电=解= 2H2↑ + O2↑
还原剂 H2O
氧化剂 H2O
氧化产物 O2
还原产物 H2
(4) MnO2 + 4HCl =△= MnCl2 + Cl2↑+2H2O
还原剂 HCl 氧化产物 Cl2
+5 -2
2KClO3
=△=
-1
2KCl
+
0
3O2↑
练习6:下列说法下说法正确的是( BD )
A、氧化剂本身被还原,生成氧化产物。
B、氧化剂是在反应中得到电子(或电子对偏 向)的物质。
C、还原剂在反应时所含元素的化合价降低。
D、在一个反应中,氧化剂和还原剂可能是同 一物质。
练习7:下列反应中,HCl为还原剂的是( C ) HCl为 氧化剂的是( A ) HCl不是氧化剂也不是还原剂的是 ( BD )
被还原,得到e-,化合价降低
氧化还原反应的特征:化合价升降 氧化还原反应的实质:电子转移(得失或偏移)
通过以上分析,我们认识到:
1.有电子转移的反应是氧化还原反应。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学物质及其变化
第三节 氧化还原反应 第1课时 氧化反应和还原反应
在1904年2月6日到1905年9月5日的日俄海战,日本海 军大将东乡平八部曾经参观过俄国的舰队,带着雪白的手套 摸了一下俄国人的炮膛,结果发现炮膛里有锈,所以回去向 明治天皇汇报说可以和俄国人开战,于是发生了有名的对马 海峡战争,俄国的波罗的海舰 队被日本舰队歼灭。 无独有偶, 2003年8月30日,俄罗斯海军的 K-159核动力潜艇也因某处生 锈而艇毁人亡。
答案:(1)化合价 (2)电子 转移 (3)电子 升高 降低 (4)化合价
综合拓展 一、氧化还原反应的概念 1.概念:特征本质的剖析
狭义含义
氧化反 应
还原 反应
氧化还 原 反应
得到氧的反应
失去氧的反应
发生了氧得失的 反应
特征
本质
元素化合价升高的反 应
元素化合价降低的反 应
失去电子(或电子对偏离) 的反应
答案:1.(2)+1 氧化 -1 还原 偏移
2.电子 氧化 电子 还原 电子 电子
3.特征和实质 (1)氧化还原反应的特征:元素______有升降。 (2)氧化还原反应的实质:___有___(得失或偏移)。 (3)氧化还原反应中,得失____的总数相等,化合价 ____的总数等于____的转移总数。 (4)判断氧化还原的方法:判断化学反应中有无元素 ____变化。
得到电子(或电子对偏向) 的反应
元素化合价升降的化 有电子转移(得失或偏移)
学反应
的反应
2.关系、性质
二、氧化还原反应与四种基 本反应类型的关系
尝试应用 1.氧化还原反应的判断依据是( A ) A.化合价的升降 B.分子中各原子重新组合 C.电子的得失应的是( CD )
解析:P0
+1
0
―→KH2 P O2;P
-3
―→ P H3
,P在反应中化
合价从0降到-3,被还原,同时从0升高到+1,被氧化,
故P单质既被氧化又被还原。
答案:C
名师点睛:元素化合价的变化是氧化还原反应的 特征,故分析反应中什么元素被氧化,什么元素被还原 的题目,就由其在反应前后化合价的变化而定。反应后, 化合价升高的元素被氧化,化合价降低的元素被还原, 也可能同一种元素在反应中,一部分被氧化,一部分被 还原。
②H2和氯气的反应:
在H2+Cl2
点燃 =====
2HCl的反应中,氢元素的化合价从0
升高到____,氢元素被____;氯元素的化合价从0降低到
____,氯元素被____。
在此反应中发生了共用电子对的____。
2.概念:
元素的原子失去了____的反应称为____反应,元素 的原子得到____的反应称为____反应;有____转移(得失 或偏移)的一类化学反应,是氧化还原反应;不发生____ 转移(得失或偏移)的一类化学反应,是非氧化还原反应。
(2)电子的变化
①钠和氯气的反应:2Na+Cl2
点燃 =====
2NaCl,钠元素
从0价升高到____价,一个钠原子____一个电子,钠元素
被____了,氯元素从0价降到____ 价,一个氯原子____一
个电子,氯元素被____了。
答案:1.(1)升高 氧化 降低 还原 变化 氧化 还原反应 (2)+1 失去 氧化 -1 得 还原
1.理解氧化还原反应的概念、特征及本质。 2.掌握氧化还原反应与四种基本反应类型的区 别与联系。 3.应用双线桥法表示氧化还原反应的电子转移。
氧化还原反应
1.判断依据
(1)化合价的变化:元素化合价____的反应称为____ 反应,元素化合价____的反应称为______原应,元素化合 价在反应前后发生了____的反应称为________。
氧化还原反应的表示方法(一般用双线桥法)
综合拓展 三、氧化还原反应中电子转移的表示方法 1.双线桥法:
2.单线桥法:
3.单线桥法与双线桥法的区别如下: (1)单线桥表示氧化剂和还原剂中变价元素原子得失 电子的情况; (2)不需标明“得”或“失”,只标明电子转移数目; (3)箭头标明电子转移的方向; (4)箭头从还原剂中失电子的元素原子指向氧化剂中 得电子的元素原子。
尝试应用
3.分析反应Fe2O3+3CO
△ =====
2Fe+3CO2中元素的
化合价变化,用双线桥标出电子转移的方向和数目,指
出发生氧化和还原反应的元素。
一、氧化和还原的概念
+PH3中(
P单质在反应4P+3KOH+3H2O===3KH2PO2 )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既不被氧化又未被还原
变式应用
低条饮件用下1.水用饮中铝用粉N O水将3- 中的N 的O浓3- 度N还O,原3- 对某为人饮N类2用,健水其康研化会究学产人方生员程危提式害出为,,:为在了碱降性
10Al+6NaNO3+4NaOH+18H2O
10Na[Al(OH)4]+3N2↑。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元 素的原子________(填“得到”或“失去”)电子;而 ________元素的化合价降低,则该元素的原子被 ________(填“氧化”或“还原”)。
(2)上述反应中,若有10个铝原子参与反应,则转移的 电子总数为________。
解析:Al元素化合价由0价升高到Na[Al(OH)4] 中的+3价,1 mol Al失3 mol 电子,10个Al原子反 应转移电子数为30。N元素化合价由NaNO3中+5价 降低到N2中的0价,该元素被还原。
答案:(1)Al 失去 N 还原 (2)30
二、氧化还原反应电子转移计算
(2011年临沂高一检测)溶液中氧化剂XO的含量 有1.5×10-2 mol,与300 mL 0.1 mol/L亚硫酸钠(Na2SO3)溶液 恰好反应完全,已知Na2SO3被氧化为Na2SO4,则还原产物 中元素X的价态是( )
A.+2 B.-2 C.+1 D.0
解析:n(Na2SO3)=0.3 L×0.1 mol ·L-1=0.03 mol, Na2SO3被氧化为Na2SO4,化合价升高总数为[+6-(+4)] ×0.03 mol;设X被还原后的价态为y,则化合价降低总数为 (+5-y)×1.5×10-2 mol,则化合价升高总数等于降低总数: (6-4)×0.03=(5-y)×1.5×10-2,y=+1。
第三节 氧化还原反应 第1课时 氧化反应和还原反应
在1904年2月6日到1905年9月5日的日俄海战,日本海 军大将东乡平八部曾经参观过俄国的舰队,带着雪白的手套 摸了一下俄国人的炮膛,结果发现炮膛里有锈,所以回去向 明治天皇汇报说可以和俄国人开战,于是发生了有名的对马 海峡战争,俄国的波罗的海舰 队被日本舰队歼灭。 无独有偶, 2003年8月30日,俄罗斯海军的 K-159核动力潜艇也因某处生 锈而艇毁人亡。
答案:(1)化合价 (2)电子 转移 (3)电子 升高 降低 (4)化合价
综合拓展 一、氧化还原反应的概念 1.概念:特征本质的剖析
狭义含义
氧化反 应
还原 反应
氧化还 原 反应
得到氧的反应
失去氧的反应
发生了氧得失的 反应
特征
本质
元素化合价升高的反 应
元素化合价降低的反 应
失去电子(或电子对偏离) 的反应
答案:1.(2)+1 氧化 -1 还原 偏移
2.电子 氧化 电子 还原 电子 电子
3.特征和实质 (1)氧化还原反应的特征:元素______有升降。 (2)氧化还原反应的实质:___有___(得失或偏移)。 (3)氧化还原反应中,得失____的总数相等,化合价 ____的总数等于____的转移总数。 (4)判断氧化还原的方法:判断化学反应中有无元素 ____变化。
得到电子(或电子对偏向) 的反应
元素化合价升降的化 有电子转移(得失或偏移)
学反应
的反应
2.关系、性质
二、氧化还原反应与四种基 本反应类型的关系
尝试应用 1.氧化还原反应的判断依据是( A ) A.化合价的升降 B.分子中各原子重新组合 C.电子的得失应的是( CD )
解析:P0
+1
0
―→KH2 P O2;P
-3
―→ P H3
,P在反应中化
合价从0降到-3,被还原,同时从0升高到+1,被氧化,
故P单质既被氧化又被还原。
答案:C
名师点睛:元素化合价的变化是氧化还原反应的 特征,故分析反应中什么元素被氧化,什么元素被还原 的题目,就由其在反应前后化合价的变化而定。反应后, 化合价升高的元素被氧化,化合价降低的元素被还原, 也可能同一种元素在反应中,一部分被氧化,一部分被 还原。
②H2和氯气的反应:
在H2+Cl2
点燃 =====
2HCl的反应中,氢元素的化合价从0
升高到____,氢元素被____;氯元素的化合价从0降低到
____,氯元素被____。
在此反应中发生了共用电子对的____。
2.概念:
元素的原子失去了____的反应称为____反应,元素 的原子得到____的反应称为____反应;有____转移(得失 或偏移)的一类化学反应,是氧化还原反应;不发生____ 转移(得失或偏移)的一类化学反应,是非氧化还原反应。
(2)电子的变化
①钠和氯气的反应:2Na+Cl2
点燃 =====
2NaCl,钠元素
从0价升高到____价,一个钠原子____一个电子,钠元素
被____了,氯元素从0价降到____ 价,一个氯原子____一
个电子,氯元素被____了。
答案:1.(1)升高 氧化 降低 还原 变化 氧化 还原反应 (2)+1 失去 氧化 -1 得 还原
1.理解氧化还原反应的概念、特征及本质。 2.掌握氧化还原反应与四种基本反应类型的区 别与联系。 3.应用双线桥法表示氧化还原反应的电子转移。
氧化还原反应
1.判断依据
(1)化合价的变化:元素化合价____的反应称为____ 反应,元素化合价____的反应称为______原应,元素化合 价在反应前后发生了____的反应称为________。
氧化还原反应的表示方法(一般用双线桥法)
综合拓展 三、氧化还原反应中电子转移的表示方法 1.双线桥法:
2.单线桥法:
3.单线桥法与双线桥法的区别如下: (1)单线桥表示氧化剂和还原剂中变价元素原子得失 电子的情况; (2)不需标明“得”或“失”,只标明电子转移数目; (3)箭头标明电子转移的方向; (4)箭头从还原剂中失电子的元素原子指向氧化剂中 得电子的元素原子。
尝试应用
3.分析反应Fe2O3+3CO
△ =====
2Fe+3CO2中元素的
化合价变化,用双线桥标出电子转移的方向和数目,指
出发生氧化和还原反应的元素。
一、氧化和还原的概念
+PH3中(
P单质在反应4P+3KOH+3H2O===3KH2PO2 )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既不被氧化又未被还原
变式应用
低条饮件用下1.水用饮中铝用粉N O水将3- 中的N 的O浓3- 度N还O,原3- 对某为人饮N类2用,健水其康研化会究学产人方生员程危提式害出为,,:为在了碱降性
10Al+6NaNO3+4NaOH+18H2O
10Na[Al(OH)4]+3N2↑。
请回答下列问题:
(1)上述反应中,________元素的化合价升高,则该元 素的原子________(填“得到”或“失去”)电子;而 ________元素的化合价降低,则该元素的原子被 ________(填“氧化”或“还原”)。
(2)上述反应中,若有10个铝原子参与反应,则转移的 电子总数为________。
解析:Al元素化合价由0价升高到Na[Al(OH)4] 中的+3价,1 mol Al失3 mol 电子,10个Al原子反 应转移电子数为30。N元素化合价由NaNO3中+5价 降低到N2中的0价,该元素被还原。
答案:(1)Al 失去 N 还原 (2)30
二、氧化还原反应电子转移计算
(2011年临沂高一检测)溶液中氧化剂XO的含量 有1.5×10-2 mol,与300 mL 0.1 mol/L亚硫酸钠(Na2SO3)溶液 恰好反应完全,已知Na2SO3被氧化为Na2SO4,则还原产物 中元素X的价态是( )
A.+2 B.-2 C.+1 D.0
解析:n(Na2SO3)=0.3 L×0.1 mol ·L-1=0.03 mol, Na2SO3被氧化为Na2SO4,化合价升高总数为[+6-(+4)] ×0.03 mol;设X被还原后的价态为y,则化合价降低总数为 (+5-y)×1.5×10-2 mol,则化合价升高总数等于降低总数: (6-4)×0.03=(5-y)×1.5×10-2,y=+1。
