保健品工艺制备图
07-chapter-08生育酚

(三)羟甲基化
HO
H CH3 H CH3
CH3
O
CH3
CH3
CH3
HCHO/acid
HO HOH2C
CH2OH
H CH3 H CH3
O
CH3
CH3
CH3 CH3
H2/Pd-C
HO H3C
CH3 H CH3 H CH3
O
CH3
CH3
CH3 CH3
在酸存在下,非α-生育酚与甲醛或多聚甲醛反应生成 非α-生育酚的羟甲基化物(8-7),然后催化氢化转化 成RRR-α-生育酚(8-1)。
项目
表8-1 美国FCC天然生育酚规格
RRR-α-生 育 酚 浓缩物
RRR-混 合 生 育 酚 浓 缩 物
高α-型
低α-型
总生育酚含量 ≥40.0%
≥50.0%
≥50.0%
RRR-α-生育酚占 ≥95.0% 总生育酚比例
≥50.0%
/
非RRR-α-生育酚 / 占总生育酚比例
≥20.0%
≥80.0%
RRR-α-生育酚(8-1)为淡黄色粘稠状液体,无 臭无味。熔点2.5~3.5 ℃,13.3 Pa下的沸点为 200~220 ℃,相对密度 0.950。比旋光度 +31.5 ( 辛烷)。最大吸收波长为292 nm。不溶于水,易 溶于乙醇,溶于丙酮、氯仿、乙醚和植物油中 。对热稳定,很容易被氧化,露置空气中被缓 慢氧化,有铁盐、银盐存在时氧化加快,遇光 则逐渐变深色。其它几种生育酚的物理性质与 α-生育酚相近。
第七章(教材第八章) RRR-α-生育酚的生产工艺原理
第一节 概述 第二节 混合生育酚的提取工艺 第三节 非α-生育酚的转型反应工艺原理及其过程 第四节 精制工艺 第五节 副产物的综合利用与溶剂的回收
药品生产技术《维生素C的生产》

生产案例二维生素C发酵维生素C在国外,1938年开始工业化生产,主要用作保健品及食品添加剂。
一般采用采用莱氏化学法。
生产流程图如下:在国内,开始工业化生产有30多年历史,主要作为药用。
采用自行开发的发酵法,分为发酵,提取,转化三个步骤。
1、发酵过程:2、提取过程:3、转化过程:莱氏法的优点是生产工艺成熟,总收率能到达60%〔对D-山梨醇计〕,优级品率为100%,但生产中为使其它羟基不受影响,需用丙酮保护,使反响步骤增多,连续操作有困难,且原料丙酮用量大,苯毒性大,劳动保护强度大,并污染环境。
由于存在上述问题,莱氏法工艺已逐步被两步发酵法所取代。
两步发酵法也是以葡萄糖为原料,经高压催化氢化、两步微生物〔黑醋菌、假单孢杆菌和氧化葡萄糖酸杆菌的混合菌株〕氧化,酸〔或碱〕转化等工序制得维生素C。
这种方法系将莱氏法中的丙酮保护和化学氧化及脱保护等三步改成一步混合菌株生物氧化。
因为生物氧化具有特异的选择性,利用适宜的菌将碳上羟基氧化,可以省去保护和脱保护两步反响。
此法的最大特点是革除了大量的有机溶剂,改善了劳动条件和环境保护问题,近年来又去掉了动力搅拌,大大地节约了能源。
我国已全部采用两步发酵法工艺,淘汰了莱氏法工艺。
第一节L-山梨糖的制备一、菌种制备黑醋菌是一种小短杆菌,属革兰氏阴性菌〔G-〕,生长温度为30~36℃,最适温度为30~33℃。
培养方法:将黑醋菌保存于斜面培养基中,每月传代一次,保存于0~5℃冰箱内。
菌种从斜面培养基移入三角瓶种液培养基中,在30~33℃振荡培养48h,合并入血清瓶内,糖量在100mg/ml以上,镜检菌体正常,无杂菌,可接入生产。
二、发酵液制备种子培养分为一、二级种子罐培养,都以质量浓度为16%~2021D-山梨醇投料,并以玉米浆、酵母膏、泡敌、碳酸钙、复合维生素B、磷酸盐、硫酸盐等为培养基,在pH5.4~5.6下于12021温30min灭菌,待罐温冷却至30~34℃,用微孔法接种。
保健食品生产工艺研究保健品专家张保献 ppt课件

2020/12/27
23
生产工艺简图要求
1. 生 产 工 艺 简 图 应 符 合 工 艺 简 图 的 格 式 要 求 。 2.与生产工艺说明及相关研究资料一致。 3.与配方一致。 4.涉及的工艺路线、主要技术参数完整。 5.标明生产各工序的卫生洁净级别(或划分
洁净区范围)。
2020/12/27
24
保健食品原料大致可分为三类: 1.营养补充剂 2.天然动植物及其提取物 3.中草药
2020/12/27
26
保健食品常用原料
51号文中表1和表2名单 食品添加剂和新资源食品 提取物
2020/12/27
27
提取物投料的审评要件
提取物的生产工艺:附在成品生产工艺说 明后边 提取物的质量标准:放在企标附录B中 提取物的供货证明及供货商(生产商)的资质 证明:放在14号资料中
2020/12/27
17
胶囊
全粉末直接装胶囊的问题 吸湿性问题 流动性与临界相对湿度的测定 辅料的加与不加的问题
2020/12/27
18
酒剂
酒基的选用 提取方法:渗漉与浸渍 微生物检验与否 甲醇问题
2020/12/27
19
三批中试数据
批量的确定 内容: 1.投料量 2.半成品量 3. 理论成品量 4.成品量 5.成品率
2020/12/27
30
提取物的管理与安全问题
提取物功效成分富集可能提高功效 提取物可能富集有毒成分导致毒副作用增 强 理念的误区:普通食品的提取物一定可以食 用 管理的缺失:未实行批准文号管理
2020/12/27
31
提取物投料有关问题
配方中的剂量换算 生产工艺的合理性问题 标准问题 购货证明、生产商资质和检验报告
保健品GSP流程图PPT课件

品
通知业务部门
进行处理
检
验 合 格 药 品
“填写”产品 质量处理
通知单“解 除暂停发 货牌
做好养 护记录
建立 产品 养护 档案
库
产 品
近效期产品每 月进行检查
到期产品
质量管理人员确认
填写“产品质量 处理通知单
通知业务部门 进行处理
检查库房的温度、湿度 等储存条件并记录
发现超出规定范围,应立 即采取调控措施并记录
国 产 产 品
经营 企业
首营 企业
企业证照 审查、质 量信誉审 查、填写“ 首营企业 审批表”
非首营 企业
销售人员资 格审查: 1、企业法人 签署的销售 人员委托书 原件 2、身份证复 印件 3、岗位证书
非首营 品种
进货
签定合 同或质 量保证 协议书
产品验收时 执行合同规 定的质量条 款或质量保 证协议书
拣货 到货位确定发货批号
并记录批号和登记保 管帐后将产品搬运到
发货区交发货员
复核
发货员对出库产品进行包
括产品质量、包装、标识、记录
有效期、批号、通用名称 剂型、规格、数量的核对 和质量检查
发货员复核无误后在 库凭证上记录质量状 况和签名,填写“产 品出库复核记录”
出库
产品交顾客 或本企业的 运输部门
保管员将产品 移入不合格库
记不合格产品 保管帐
4
产品销后退回的处理程序
销售部门开 具“销后退 回通知单“
保管员凭“销后 退回通知单“对
照实物收货
存放在退货区 并做好退货记录
按“产品质量检查 验收程序“验收并
办理交接手续
按“产品入库储 存程序“办理入 库手续
藿香正气口服液生产工艺-课程设计
制药工程专业课程设计说明书目录第一章绪言 (3)1.1 项目概况 (3)1.2 设计依据 (3)1.3 设计指导思想和设计原则 (4)1.4 生产任务 (4)1.5 生产方法 (4)1.6 生产制度 (4)1.7 其它 (4)第二章生产工艺说明 (5)2.1 原料及产品介绍 (5)2.2工艺过程概述 (6)2.3 工艺流程 (6)2.4 原料定额表 (7)2.5 包装材料消耗定额 (7)第三章原料消耗综合表 (8)3.1 设计任务 (8)3.2 设计基准 (8)3.3 物料衡算 (9)第四章能量衡算 (10)第五章主要设备选型说明 (11)5.1 主要设备参数及特点 (11)5.2 设备选择 (12)5.3 工艺设备一览表 (13)5.4 超声波清洗机设备详述 (14)5.4.1 超声波清洗机发展史 (14)5.4.2 超声波清洗机结构组成 (14)5.4.3 超声波清洗机工作原理 (14)第六章生产分析控制 (15)6.1 概述 (15)6.2 分析项目 (15)6.3质量监控 (16)6.3.1鉴别 (16)6.3.2 检查 (17)6.3.3含量测定 (17)第七章第七章车间工艺平面布置说明 (18)7.1布置说明 (18)7.2布置原则 (18)7.3车间布置 (18)7.3.1 周围环境 (19)7.3.2 厂房 (19)7.3.3 人员要求 (19)7.3.4 洁净区域划分说明 (20)第八章车间人员表 (20)第九章车间技术要求 (20)9.1限额领料 (20)9.2根据处方正确计量称量 (21)9.3置与过滤 (21)9.4洗瓶和干燥灭菌 (21)9.5灌装于封口 (21)9.6灭菌消毒 (22)9.7灯检和印包 (22)第十章安全卫生与环境保护 (22)10.1 设计依据 (22)10.2 主要污染及主要污染物 (23)10.3 设计中采用的环保措施 (23)10.4 水的循环利用 (23)第十一章公用系统消耗及消防 (24)11.1 公用系统主要参数 (24)11.2公用系统消耗表 (24)11.3 消防依据 (25)11.4 专业设计对消防要求的考虑和采取措施 (25)第十二章节能 (25)12.1 工艺设备节能措施 (25)12.2 电气专业节能措施 (26)12.3 暖通专业节能措施 (26)12.4 给排水专业节能措施 (26)第一章绪言1.1 项目概况口服液系指合剂以单剂量包装者,是在汤剂、注射剂基础上发展起来的新剂型。
保健品工艺制备图
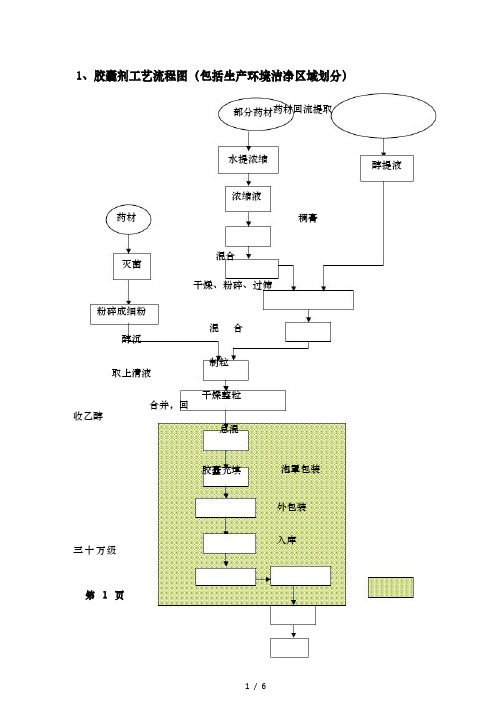
1、胶囊剂工艺流程图(包括生产环境洁净区域划分)部分药材药材回流提取水提浓缩浓缩液醇提液药材灭菌粉碎成细粉醇沉取上清液合并,回收乙醇稠膏混合干燥、粉碎、过筛混合制粒干燥整粒总混胶囊充填泡罩包装外包装入库三十万级第1页2、颗料剂生产工艺流程图(包括生产环境洁净区域划分)药材净制水提浓缩醇沉沉淀物干燥蔗糖粉碎粗提物混合粉碎蔗糖粉75%乙醇外包装材料制粒干燥整粒总混分装外包装入库三十万级第2页3、软胶囊生产工艺流程图(包括生产环境洁净区域划分)其它部分原辅料配料辅料化胶乙醇铝箔、PVC 制丸洗丸干燥检丸泡罩包装外包装入库三十万级第3页4、口服液生产工艺流程图(包括生产环境洁净区域划分)原药材辅料炼制初滤辅料研磨配制精滤检验灌装检漏灯检烘干灭菌清洗口服液瓶瓶盖十万级非最终灭菌制剂的口服液的配制、灌装环境是十万级第4页5、酒剂生产工艺流程图(包括生产环境洁净区域划分)原料药材碎断50 度白酒浸渍粗滤辅料滤液瓶盖外包装材料消毒混合密闭、静置过滤精滤灌装检漏灯检包装待验库搅拌溶解清洗玻璃瓶、干燥十万级第5页6、片剂生产工艺流程图(包括生产环境洁净区域划分)部分药材净制药材渗漉药材水提药渣渗漉液水提液醇沉取上清液部分药粉合并,回收乙醇浓缩收膏过筛,灭菌干浸膏混合黏合剂制粒干燥整粒总混压片包衣泡罩包装外包装入库三十万级第6页。
保健品专利申请范文

保健品专利申请范文一、发明名称。
[具体保健品名称]及其制备方法。
二、技术领域。
本发明涉及保健品领域,具体涉及一种具有[特定保健功效,如增强免疫力、改善睡眠等]的保健品及其制备方法。
三、背景技术。
随着现代生活节奏的加快,人们面临着各种健康问题。
在保健品市场上,虽然有多种产品可供选择,但仍然存在一些不足。
例如,部分保健品的有效成分含量低,导致保健效果不明显;有些产品在制备过程中使用了大量的化学添加剂,可能对人体存在潜在危害;还有些保健品的配方缺乏科学依据,不能针对特定的健康需求进行有效的调理。
目前市场上针对[本保健品所针对的健康需求,如抗氧化方面]的产品大多采用[列举常见的原料或方法],这些产品在[阐述其存在的问题,如吸收效率低等]方面存在缺陷。
因此,有必要研发一种新的保健品来满足人们日益增长的健康需求。
四、发明内容。
1. 保健品的原料组成。
- 本保健品的原料按重量份包括:[主要原料1] [X]份、[主要原料2] [Y]份、[主要原料3] [Z]份等。
- [主要原料1]:详细介绍该原料的来源、特性及其在保健品中的作用。
例如,[主要原料1]为[具体名称],它富含[有效成分名称],这种成分具有[阐述该成分的保健功能]的功能,能够[与保健品功效相联系]。
- 同理,对其他主要原料进行详细说明。
2. 保健品的制备方法。
- 原料预处理:将[主要原料1]进行清洗、干燥、粉碎处理,粉碎后的粒度达到[具体粒度要求]。
对其他原料也进行相应的预处理操作。
- 混合:将预处理后的[主要原料1]、[主要原料2]、[主要原料3]等按照设定的重量份放入[混合设备名称,如三维混合机]中,在[混合温度]下,以[混合转速]混合[混合时间],得到混合原料。
- 成型:将混合原料通过[成型工艺,如压片、制丸等]制成[保健品的最终剂型,如片剂、丸剂等]。
如果有包衣等后续工序,也需详细说明,如采用[包衣材料名称]进行包衣,包衣的厚度为[具体厚度],包衣的目的是[如提高稳定性、改善口感等]。
