溴酸盐的生成及控制
溴酸盐化学式

溴酸盐化学式溴酸盐是一类含有溴酸根离子的化合物,其化学式通常为BrO3-。
溴酸盐可由溴酸与金属离子或铵离子反应而成,也可由溴酸与溴化物反应生成。
溴酸盐广泛存在于自然界中,如海水、土壤和一些矿石中。
溴酸盐的性质与用途溴酸盐具有一些独特的性质和用途。
首先,溴酸盐是一种强氧化剂,可以与许多物质发生剧烈反应。
其次,溴酸盐溶液呈酸性,可以与碱反应生成溴酸。
此外,溴酸盐还具有杀菌、消毒和漂白的作用,广泛应用于水处理、纸浆和纺织工业。
溴酸盐的制备方法溴酸盐的制备方法有多种。
一种常见的方法是通过将溴酸溶液与金属离子或铵离子反应生成溴酸盐。
例如,将溴酸与钠离子反应可以得到溴酸钠。
另一种方法是通过将溴酸与溴化物反应生成溴酸盐。
例如,将溴酸与溴化钠反应可以得到溴酸钠。
溴酸盐的应用领域溴酸盐在许多领域中都有重要的应用。
首先,在水处理方面,溴酸盐可以用作消毒剂和杀菌剂,用于净化水源和防止水中细菌和病毒的传播。
其次,在纸浆和纺织工业中,溴酸盐可以用作漂白剂,去除杂质和提高产品的质量。
此外,溴酸盐还可以用于制备其他化学品,如溴酸钾、溴酸铵等。
溴酸盐的环境影响溴酸盐在环境中的存在对生态系统和人类健康可能产生一定的影响。
溴酸盐的过量排放会导致水体中溴酸盐浓度升高,从而对水生生物产生毒性影响。
此外,溴酸盐在一些工业过程中的使用可能产生有害物质和气体的排放,对大气环境造成污染。
总结溴酸盐是一类含有溴酸根离子的化合物,具有强氧化性和酸性。
它在水处理、纸浆和纺织工业中有广泛应用,并且在制备其他化学品时也起到重要作用。
然而,溴酸盐的排放和使用也可能对环境和人类健康产生一定的负面影响,需要引起重视和控制。
我们应该在使用溴酸盐的同时,注重环保和健康安全,合理使用和处理溴酸盐,以保护我们的环境和健康。
农夫山泉溴酸盐的含量

农夫山泉溴酸盐的含量农夫山泉溴酸盐的含量问题曾在一段时间内引起公众关注。
根据相关报道,江苏省市场监督管理局在2020年12月4日抽检中发现,广西巴马丽琅饮料有限公司生产的饮用天然矿泉水(规格为500ml/瓶,生产日期为2020年12月4日)溴酸盐含量不符合食品安全国家标准规定。
那么,溴酸盐究竟是什么物质?为什么它在矿泉水中出现?农夫山泉等矿泉水产品中溴酸盐的含量如何?以下是对这一问题的详细解答。
一、溴酸盐的概念与特性1. 溴酸盐的概念:溴酸盐是一种化学物质,通常存在于自然水体中。
它是由溴化物与臭氧等氧化剂反应生成的。
2. 溴酸盐的毒性:溴酸盐对实验动物具有一定的致癌作用。
国际癌症研究中心(IARC)将溴酸钾列为对人体可能致癌的物质。
3. 溴酸盐的来源:在自然环境中,溴酸盐主要来源于水体的臭氧消毒过程。
此外,某些植物和微生物也可以产生溴酸盐。
二、矿泉水中溴酸盐的来源与危害1. 矿泉水中溴酸盐的来源:矿泉水在生产过程中,通常采用臭氧消毒技术对水源进行净化。
在这个过程中,溴化物与臭氧反应生成溴酸盐。
2. 矿泉水中溴酸盐的危害:长期饮用含有较高溴酸盐的矿泉水可能对人体健康造成一定影响。
虽然目前关于溴酸盐对人体的致癌作用尚无明确证据,但出于谨慎考虑,我国食品安全国家标准对矿泉水中溴酸盐的含量进行了规定。
三、农夫山泉溴酸盐含量事件回顾1. 检测结果:江苏省市场监督管理局在2020年12月4日抽检中发现,广西巴马丽琅饮料有限公司生产的饮用天然矿泉水(规格为500ml/瓶,生产日期为2020年12月4日)溴酸盐含量不符合食品安全国家标准规定。
2. 企业回应:对于检测结果,巴马丽琅饮料有限公司表示,同批次矿泉水已经全部召回进行重新检测,确保产品质量符合国家标准。
3. 监管部门行动:江苏省市场监督管理局对不合格产品进行了公告,并要求相关企业加强产品质量管理,确保产品符合食品安全国家标准。
四、农夫山泉等矿泉水产品中溴酸盐的含量1. 标准规定:我国食品安全国家标准《饮用天然矿泉水》(GB 8537-2008)规定,天然矿泉水中溴酸盐的含量不得超过0.01mg/L。
矿泉水中溴酸盐的形成与控制

矿泉水中溴酸盐的形成与控制摘要:本文主要概述了关于含溴矿泉水臭氧化过程中的主要副产物溴酸根离子的生成途径、生成量的影响因素、以及控制其生成的主要方法以及相关控制措施,望为从事相关工作的人士提供参考。
关键词:包装水;矿泉水;溴酸盐;臭氧消毒前言:正常情况下,自然界的矿泉水中溴酸盐的含量几乎为零,但是因其富含矿物离子的原因,溴离子(Br-)却是普遍都含有。
在使用臭氧对含有溴化物的矿泉水进行杀菌消毒时,溴化物容易与臭氧发生反应,被氧化成为溴酸盐,并以Br03-的形式存在于水中。
在国家制定的饮用水标准对微生物的严格要求下,许多饮用水行业厂家不得不批量使用臭氧对其生产的水产品开展杀菌消毒的工作,由此也就顺理成章地产生出了溴酸盐这类毒副产物。
国际癌症研究中心做了与溴酸盐之一的溴酸钾(KBrO3)的相关实验,并且证实其对于实验动物产生了致癌作用,但就目前而言,世界上还未曾发现任何一例人因为溴酸盐而患上癌症的医学事实,因此,国际上一般把溴酸盐列为2B级潜在致癌物。
为了广大人民群众在饮用矿泉水上的安全保障,现亟待发现控制矿泉水中溴酸盐的更好方法。
一、矿泉水中溴酸盐的测定由于溴酸盐在水溶液中多以Br03-的形式存在,目前离子色谱测定法对于矿泉水中溴酸盐的测定仍然适用。
其原理如下:水样中的溴酸盐和其他阴离子随碳酸盐系统洗脱液进入阴离子交换系统,根据分析柱对各离子的亲和力不同进行分离,已分离的阴离子流经阴离子抑制系统,转化成高电导率的强酸,而洗脱液则转化成低电导率的弱酸或水,电导检测器测量各种阴离子组分的电导率,以保留时间定性、峰面积或峰高定量。
二、矿泉水中溴酸盐的形成臭氧对含溴的水体进行氧化时,溴离子被氧化生成溴酸盐的机理相当复杂,甚至还受多种条件的影响。
氧化过程中,溴酸盐的生成量受水中Br-浓度、臭氧投量、pH、碱度及水体中天然有机物(NOM)含量等多种因素影响。
1.形成机理大量实验和推导的结论表明,臭氧在对含溴水体进行氧化的过程中所产生的Br03-副产物是通过臭氧和羟基自由基(·OH)联合反应完成。
溴酸盐的形成机制与控制方法研究进展

鲁金凤等,溴酸盐的形成机制与控制方法研究进展
7
形式存在于水中,有利于 O3 对次溴酸的氧化,BrO3的生成量也不断增加。 2.4 NOM 的影响
天然有机物(NOM)普遍存在于天然水体中, 其浓度和组成因水源和季节的不同而变化。NOM 是 许多氯化消毒副产物的前质。NOM 对 BrO3- 的生成 也有很大影响。NOM 与 O3 反应很快,NOM 的存在, 会显著减少 BrO3- 的生成。NOM 主要通过以下两种 途径抑制 BrO3- 生成:(1)NOM 竞争反应,减少了 O3 及·OH 与 Br- 和 HOBr/OBr- 的作用机率;(2)与生成 BrO3- 的重要中间产物 HOBr/OBr- 反应生成 TOBr 或 Br-,从而减少了 HOBr/OBr-[15]。NOM 因组成不同,对 O3 分解、BrO3- 生成的影响也不同。当 UV 吸光值较高 时,直接消耗的 O3 量增加,BrO3- 生成量明显减少[14]。 O3 与 Br- 及 O3 与 HOBr/OBr- 的反应,均比 O3 与 NOM 及 HOBr/OBr- 与 NOM 的反应慢,因此,DOC 越高的水体经 O3 氧化时生成的 BrO3- 越少。 2.5 水 温
原生动物(如隐孢子虫)的灭活效果很好[2]。在处理 盐生成的方法[10-11];此外,针对已形成的溴酸盐,研究
天然水体中,臭氧氧化工艺也可以进一步降低 DOC 者也尝试了一系列相应的去除溴酸盐的方法。这两
饮用矿泉水中溴酸盐的控制

54饮用矿泉水中溴酸盐的控制一、目前矿泉水行业存在的食品安全性各国的饮用水标准都将微生物指标作为最重要的强制性指标。
但是在WHO、美国EPA 等最新标准中,细菌总数不再出现在标准之中,而对致病菌的控制则越来越严格。
目前我国天然矿泉水主要执行的《GB8537-2018饮用天然矿泉水》国家标准,相比旧国标《GB8537-2008饮用天然矿泉水》,对感官要求、理化指标、微生物等多个指标的要求更加严格,对饮用天然矿泉水生产企业提出了更大的挑战。
臭氧用于水消毒有一个临界浓度,在临界浓度以上时可把水中微生物全部杀死。
一般水中临界浓度为0.3-0.4mg/L。
《美国瓶装水的标准与法规》和《美国食品法令21CFR》中要求水中臭氧浓度为0.1mg/L,并且在密封系统中停留时间不应少于5min。
在矿泉水生产中采用臭氧杀菌,剩余臭氧量的测定是关键工艺控制点,在我国大部分企业在生产时矿泉水中臭氧的添加量一般为0.2~1.0mg/L,作用时间为5~10min,作用后残留的臭氧控制在0.1~0.5mg/L。
若臭氧杀菌方法不当,易导致溴酸盐的产生。
而由于控制菌落总数与控制溴酸盐之间在工艺上产生了明显的矛盾,且会增大企业的成本压力。
目前,溴酸盐问题让行业颇为头痛。
溴酸盐(通常是溴酸钾)被毒理学国际癌症研究所(IARC)归为2B 组致癌(可能使人致癌)物质,许多发达国家已规定其限量。
正常情况下,水中不含溴酸盐,但普遍含有溴化物。
当用臭氧对水消毒时,溴化物与臭氧反应,氧化后会生成溴酸盐。
国际癌症研究中心(IARC)认为溴酸钾对实验动物有致癌作用,但溴酸盐对人的致癌作用还不能肯定,为此将溴酸盐列为对人可能致癌的物质。
由于早期中国很少使用臭氧对水进行消毒,因此中国《饮用天然矿泉水》国家标准未制定溴酸盐限量要求。
但近年来,矿泉水企业普遍采用臭氧杀菌工艺,致使溴酸盐现象凸显。
郑礼深 王立军 宋俊杰Control of Bromate inDrinking Mineral WaterTECHNOLOGY 55最近,国家质检总局开展了瓶装水中溴酸盐国家监督专项抽查工作。
溴酸盐的性质

为确保 B .二的准确测定,必须采用梯度洗脱,为此 本文通过优化梯度条件选择了最佳的梯度淋洗程序,在该 梯度程序下可有效的将组分分离完全。在不同流速条件下 测定,比较样品中各离子的保留时间( RT ) ,分离度 ( RS )和峰面积 ( A )。最终得到结果以流速 0 . 8 一 1 . 1 ml / mi 最佳,本次实验选用流速为 1.0mL/min。
● 溴酸盐在瓶装水中的含量取决于水 源水中的溴化物含量、与臭氧接触并起化 学应的时间和各种各样的水质状态,包括 酸碱度、有机物含量、水的硬度和碱性大 小。
§2.溴酸盐对人体的危害
溴酸盐被定为2B级的潜在致癌物,长期食用超 标的矿泉水,会大大增加患癌症的概率。如育龄 妇女,幼儿、怀孕妇女,免疫功能低下者和年迈 的个人应尽量避免。
二.离子色谱法测Βιβλιοθήκη 矿泉水中溴酸盐的含量1.准备阶段 1). 仪器与试剂 DIONEXDX ISC 一 90 型离子色谱仪(带有 EG40 淋洗液自动 发生器) ,UPW一 20NE 型超纯水仪, A s2060B 型超声波清 洗器, ESJ120 一 4 型分析天平,容量瓶, 0 . 22鲡微孔滤 膜,注射器。所有水样取自矿泉水,所用溶液均用电导率 < 1 . ops
用移液管分别准确移取配制好的标准溶液 0.0、 0.25、0.50、0.75 、1.0 、1.25 mL 定容至 10.00ml, 经0.22 肠 l 微孔滤膜过滤。分别取各个浓度点的标 准溶液20.00 mL注入 ISC-90 型离子色谱仪,得到各 个浓度点的色谱峰和保留时间,利用离子色谱工作站 进行数据处理,以峰面积为纵坐标,以溴 酸盐浓度为横坐标,绘制标准曲线
饮用天然矿泉水中溴酸盐的生成与控制
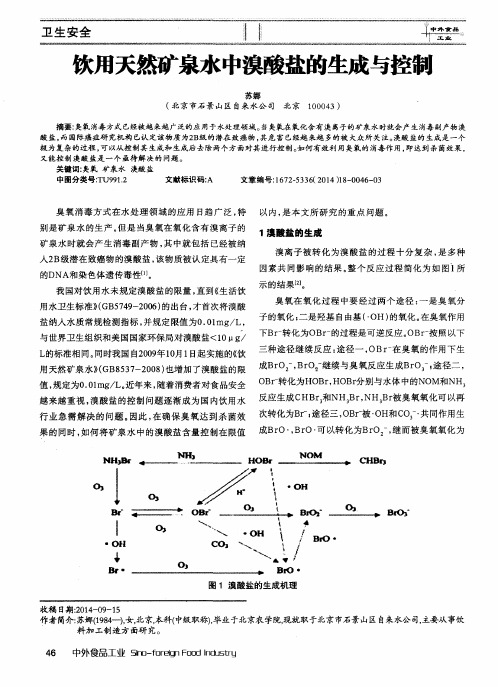
1澳 酸盐 的生 成
溴离 子被 转化 为溴酸 盐 的过程 十分 复杂 , 是 多种 因素共 同影响 的结果 。 整 个 反应过 程 简化 为如 图1 所
示 的结果[ 2 1 。
臭氧在 氧 化过程 中要 经过 两个 途径 : 一 是臭 氧分 子的氧化 ; 二是羟基 自由基 ( ・ OH) 的氧化 。 在臭氧作用
卫 生 安 全
Br O3 一 。
面, 原水 中微生 物 的含量 越 少 , 所 需通 入 的臭 氧量 也
也就 不会有 过 多的臭 氧余量将 溴化 物转变 为 有研 究表 明 , 在 反应初 期 , 溴酸 盐会较为 迅速 的增 就越少 ,
加, 主要 由于羟基 自由基 的作用 ; 在 反应第二 阶段 , 溴 溴酸 盐 , 从而 可 以控 制 溴酸 盐的含 量 。
●● — —— ——- 一 r— — — — — — 一
0
\、
、\
弋啼 l : ■ : ・ 0 H \ 啪 . \ \ /
▲ '
Bf 0 ・
图 1 溴 酸盐 的生 成 机理
收稿 日期 : 2 0 1 4 - 0 9 -1 5
下Br 一 转化为OB r 一 的过程是可逆反 应 i OB r 一 按照 以下
盐纳入水质 常规检 测指标 , 并规定 限值为0 . 0 1 mg / L, 与世界卫生组 织和美 国国家环保局对溴酸 盐<l 0“ g / L 的标准相 同。 同时我 国 自2 0 0 9 年l 0 月1 日起实施 的( ( 饮
又能 控 制 溴酸 盐是 一 个 亟待 解 决 的 问题 。 关键词: 臭 氧 矿 泉 水 溴 酸 盐 中图分类号: T U9 9 1 . 2 文献标识码: A
臭氧消毒中溴酸盐的形成.检测与控制

臭氧消毒中溴酸盐的形成.检测与控制第22卷第16期2006年8月中国给水排水CHINAV01_22No.16Aug.2006WATER&WASTEWATER臭氧消毒中溴酸盐的形成、检测与控制吴清平1,孟凡亚1”,张菊梅1,郭伟鹏1(1.广东省微生物研究所广东省菌种保藏与应用重点实验室,广东广州510070;2.中国科学院南海海洋研究所,广东广州510301)摘要:用臭氧对含溴化物的饮用水进行消毒时会生成溴酸盐副产物,溴酸盐被国际癌症研究机构定为2B级(具有较高的致癌可能性)潜在致癌物。
臭氧氧化溴化物生成溴酸盐要经过多步反应,控制溴酸盐生成的方法有加氨、降低pH值、投加活性炭、投加高锰酸盐和增加臭氧投加点的数量等。
用臭氧消毒的最终目的是杀灭致病菌,因此如何找到臭氧、致病菌、溴酸盐消毒副产物之间的最佳平衡点还有待进一步研究。
关键词:饮用水;中图分类号:TU991溴酸盐;臭氧;离子色谱文章编号:1000—4602(2006)16—0012—04文献标识码:BFormation,DetectionandControlofBromateintheOzoneDisinfectionofDrinkingWaterWei:pen91ofOceano—CollectionandApplication,GuangdongWUQing.pin91,MENG(1.GuangdongInstituteFan.yal”,ZHANGJu—meil,GUOProvincialKeyLaboratoryofMicrobialofMicrobiology,Guangzhou510070,China;2.SouthChinaSeaInstitutelogy,ChineseAcademyAbstract:ofSciences,Guangzhou510301,China)Ozonationofdrinkingwatercontainingbromidemayleadtotheformationofbromate,awhichisconsideredtobepotential2B—levelcarcinogenbyInternationalAgencyforResearchonCancer(IARC).Bromateisformedthroughmultiplereactionsduringozonationofdrinkingwatercontainingbro-mide.Methodsofcontrolthevatedcarbonozoneorformationofbromateincludeammoniaaddition,pHdecreasing,dosingacti—permanganate,andincreasingthenumberofdosingposition,etc.Thecriticaltoobjectiveofdisinfectionisinactivationofpathogenicbacteria.Therefore,furtherinvestigationfindtheopti—malbalanceamongozone,pathogenicbacteriaandbromateshouldbeconducted.Keywords:drinkingwater;bromate;ozone;ionchromatography随着给水处理技术的发展和人们对饮用水水质的重视,臭氧消毒技术在饮用水中的应用日益广泛。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
@ @ @ 6 E8 6 78
@@@@@@@@@+MN4,Q+N47!QN4%,+7M@ @ @ @ @ @ @ @ @ @ @ 6 %8 @ @ @ @ 溴胺生成反应非常复杂 % 溴胺的组成决定于水 体 G+ 值 ’溴的含量以及氨的含量等因素 & @ @ @ @ 降低 G+ 值是控制溴酸盐生成量有效方法 & +MN4(MN4O 的氧化受( M+ 控制 %降低 G+ 值使( M+
77] & 新使用活性炭表面具有的官能团 O .+! 硫化
物 " ’O .O .! 双 硫 基 团 " 和 O CM7M+! 碳酸盐基 团 " 等都会与溴酸盐发生反应 % 因而新使用活性炭对溴 酸盐具有很好的去除作用& 初始溴酸盐浓度为
E%!!R( ’ 时 % 溴酸盐在选定的 [NC\ 范围内全部被 去 除 & 溴 酸 盐 初 始 浓 度 为 7"%!R(’%[NC\ 大 于 E9&)* 时 % 溴酸盐也可以被全部去除 % 仅在 [NC\ 减
e86:M4B@:2H89:M*456:M4W<6:M2G@:M*4e86:M4;@6:2g@<*4f6:M4B@2OF< $%&’()%*+%,-. $%/’%++(’%/ 0+1,2 3)4,5 $-6, 7%’&+(6’,82 9-%:’%/ ;"<<=>2 ?5’%- # ;@ A)B+( $%/’%++(’%/ 3C5)).2 9-%:’%/ 9)(*-. 7%’&+(6’,82 9-%:’%/ ;"<<D;2 ?5’%-E 4‘8949II9NK4FI4FG9D6K@:M4GD9HH<D94F:4F<KIJFL4D6K9*4FDM6:@NH4D9?FU6J4D6K946:P4H6JK4D9h9NK@F:4@:4K894NF<DH94FI4KD96K@:M4]28OPDFiO2 C9:76JP98OP94L6HK9L6K9D4CO4b6:FI@JKD6K@F:4jb_R4L6H4HK<P@9Pk46:P4K894@:P<NK@F:46:P4@:IJ<9:N94FI4NF:N9:KD6K@F:4GFJ6D@76K@F:46D946:6J2 OH9P4@:4K894G6G9D3 4:6:FI@JKD6K@F:l4]28OPDFiOC9:76JP98OP9l4FG9D6K@F:4GD9HH<D9l4NF:N9:KD6K@F:4GFJ6D@76K@F: !"#
54
第 31 卷 第 6 期 2005 年 6 月
Vol.31 No.6 Jun.,2005
安
东 1, 2, 李伟光 1, 崔福义 1, 宋佳秀 1, 赫
2. 上海市自来水市北有限公司 , 上海 200086%
鑫1
!1. 哈尔滨工业大学市政环境工程学院 ! 黑龙江 哈尔滨
150090
通过试验考察了活性炭对溴酸盐的去除效果 # 在溴酸盐初始浓度为 137!g/L 时 ! 新投入使用的活性炭可以 去除 100! 的溴酸盐 ! 初始浓度为 283!g/L 时 ! 活性炭空床接触时间$ EBCT % 大于 15min 时去除率为 100! ) 使用一 年的活性炭对溴酸盐的去除效果降低 # 新炭和旧炭出水中均含有一定数量的溴离子 ! 旧炭对溴离子的去除效果明显 降低 # 活性炭 ) 臭氧 ) 空床接触时间$ EBCT% ) 溴酸盐
国外学着对溴酸盐的控制途径已经有了一定的 研究 & 水处理中对溴酸盐生成量的控制可行的方法 主要有加氨 ’ 降低 G+ 值等几种 & H=*@AI*3J*K %L 认为 加入水中的氨会与 +MN4 结合生成溴胺 % 消耗了可 生成 N4M%O 的 +MN4 %从而减少了 N4M%O 的生成 & 水 体中溴胺的存在有三种形式 % 分别为一溴胺 ’ 二溴胺 和三溴胺 %它们的反应途径见反应式! E" P ! %" &
E%!!R_’ 时 % 出水溴酸盐浓度为 %"!R_’#初始浓度为 7"%!R_’ 时 %出水溴酸盐浓度增加到 99!R_ ’ & 可见 %
溴酸盐经活性炭处理后% 转变为数量较大的溴离 子 % 活性炭经长期使用 % 表面化学性质发生改变 % 离 子交换作用减弱 % 另一方面活性炭长期使用造成孔 隙堵塞 % 表面被生物膜覆盖影响了溴离子与活性炭 表面发生作用 & 因而长期使用的活性炭 % 特别是在 沿海溴离子含量较高地区 % 采用活性炭进行深度处 理 % 一方面应关注有机污染物质的去除效果变化 % 另一方面对溴离子的增加应更加关注 % 因为活性炭 出水如果含有较高浓度的溴离子将造成后续消毒工艺产 ! 下转第 !" 页 "
"CZN4M%O !N4MO ,"CM7@ @ @ @ @ @ @ @ @ @ @ @ @ "C,7N4MO !7N4O ,"CM7@@
氧化物 &
6 U8 6 98
其中 %"C 代表活性炭表面 %"CM7 代表活性炭表面 试验中同样发现新使用的活性炭对溴酸盐具有 很好的去除作用 & 表 E 和表 7 对比了不同初始溴酸盐浓度和不同
的量减少 %因此 +MN4( MN4O 被 M+ 氧化生成 N4M%O ( 的量也将减少 & .=*R@/S -&T@AKUL@ 等人认为对于高碱 度的含溴自来水%降低 G+ 值来控制 N4M%O 在经济上不 可行%因为碳酸盐会消耗大量的酸& -&T@@V4)JWRJ4 认 为 G+ 值从 "F# 降低到 XF#% 可以减少溴酸盐的生成 量 9#Y & 水深度处理工艺中 % 活性炭吸附对于溴酸盐的 去除具有良好的作用 %大部分溴酸盐通过与 C 的反 应还原为 N4O % 从而降低溴酸盐含量 % 反应方程式见 式! U " 和 ! 9 " K 9L &
$ 美国 规定 !饮用水 BrO3- 浓度低于 25!g/L# USEPA 环保署 % 和 EU $ 欧盟 % 对 BrO3- 浓度的规定更加严 格 !MCL $ 最大污染水平 % 不得高于 10!g/ L # 一旦
[2]
臭氧工艺被应用到饮用水处理中 !BrO 问题就会凸
- 3
现出来 !必须加以关注 #
溴离子生成溴酸盐机理相当复杂 ! 受多种条件 的影响 # von Gunten[ 3] 将整个反应简化为如图 1 所示 的结果 # 臭氧在水体中与物质的相互作用有两个途径 ! 一是臭氧分子氧化 ’ 二是( $ 氢氧自由基 % 氧化 # OH
Br- ) 其 三 OBr- 在( OH 和 CO3-(的 作 用 下 转 化 为 ( !BrO (可以生成 BrO2- ! 并继续转化为 BrO3- # BrO 在反应的初始阶段 ! 臭氧产生的 ( OH 与 Br- 迅速反
收稿日期 ’2004- 04- 15 # 基金项目 : 国家高技术研究发展计划$ 863 % 项目$ 2002AA601120 % )E- m ai l : andonghi t @ 163. com
第 %E 卷 第 X 期 碳酸钠 # 淋洗液流速 $#$%&’( &)* #抑制方式 $ 电抑 制 % 由电解水产生 +,%抑制器为 -./.01234567&&8 型阴离子抑制器 # 柱温 $%9: # 检 测 器 % 电 导 检 测 器 # 检 测 器 温 度 为 %9; # 色 谱 柱 $ <=*>5? @ -AB+C @ 阴 离 子 保 护 柱! 9#&& ! 7&& " D <=*>5C@-.B+C 阴 离子分离柱 ! 79#&&!7&&" #进样量 $E##!’ &
[NC\6&)*8 9 E# E9 7# 79
@@@@ 新炭 6!R_’8
N4O N4M%O N4O
旧炭 6!R_’8
N4M %O
U" U% U" 99 X#
E7 U ‘7$## ‘7$## ‘7$##
7B" %B7 U%E U7! U7#
99 U" %! E% !
O 注 $a7$ ## 代表 N4 M % 低于检测限
!"#$ $ $ 王 晓 琳 " 中 尾 真 一 % 低 分 子 量 中 性 溶 质 体 系 的 纳 滤 膜 的 透 过
特性 !&#’ 南京化工大学学报 ""(()*+,-./ !012.,3
!+# 4$$$56789:4;<* 4=>?@4A44B9CD<:’EF?G6D@HF:$FI$$$$$:6::FI@JKD6K@F:$ GDFG9DK@9H$ FI$ KLF$ ?9?CD6:9H$ <H@:M$ 9J9NKDFJOK94 6:P4 :F:29J9N2 KDFJOK94HFJ<K9H4!"Q9H6J@:6K@F:*4"++-"(((R$(S2",13$$
小到 E#&)* 以下时 % 才有一部分溴酸盐穿透炭层流 出 & 大部分的溴酸盐被活性炭表面基团还原为溴离 子 % 试 验 中 出 水 溴 离 子 浓 度 为 %"^X#!R_’% 活 性 炭 表面的离子交换作用可以减少一部分溴离子的流 出 & 经使用一年的活性炭 %溴酸盐的去除率明显有所 降 低 % 以 活 性 炭 [NC\@ 9&)* 为 例 % 初 始 浓 度 为
