高考化学一轮复习课件水的电离和溶液的酸碱性
高三化学一轮复习【水溶液 酸碱中和滴定】

(4)25℃时,pH=12的溶液不一定是碱溶液,pH=2的溶液 不一定是酸溶液;也可能是能水解的盐溶液。
【高考命题探究】 【模拟母题示例1】(溶液酸碱性的判断) 室温时下列混合溶液的pH一定小于7的是 ( )
A.pH=3的盐酸和pH=11的氨水等体积混合 B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合 C.pH=3的醋酸溶液和pH=11的氢氧化钡溶液等体积混合 D.pH=3的硫酸溶液和pH=11的氨水等体积混合 【解析】选C。A项氨水过量,pH>7;B项pH=7;C项 CH3COOH过量,pH<7;D项氨水过量,pH>7。
【解析】选D。该温度下蒸馏水中[H+]=1×10-6mol·L-1,
大于25℃时纯水中[H+],故该温度高于25℃,A正确;此温
度下KW=1×10-12,故该NaHSO4溶液中[OH-]=
11012=1×
1102
10-10(mol·L-1),由水电离出的[H+]与溶液中的[OH-]相
等,B正确;加入NaHSO4后,NaHSO4电离出的H+抑制了水的 电离,C正确;加水稀释时,[H+]减小,而KW不变,故[OH-] 增大,D错误。
(4)升高温度,水电离平衡右移,H+浓度增大,呈酸 性。 ( ) 提示:×。升高温度,水电离平衡右移,H+浓度和OH-浓度 同等程度地增大,溶液仍呈中性。
(5)纯水中[H+]>10-7mol·L-1,该溶液呈酸性。( ) 提示:×。升高温度,水电离平衡右移,H+浓度和OH-浓度 都增大,都大于10-7mol·L-1,溶液仍呈中性。
【方法点拨】溶液酸、碱性判断需注意的4个问题 (1)溶液呈现酸、碱性的实质是c(H+)与c(OH-)的相对 大小不相等,不能只看pH,一定温度下pH=6的溶液可能 显中性,也可能显酸性,应注意温度。 (2)使用pH试纸时不能用蒸馏水润湿。 (3)广范pH试纸只能测出pH的整数值。pH计的精确度为 0.01。
高考化学复习:水的电离,溶液的酸碱性

酸碱中和滴定
• (3)“考”指示剂的选择 • ①强酸强碱相互滴定,可选用甲基橙或酚酞; • ②若反应生成强酸弱碱盐溶液呈酸性,则选用酸性变色范围的指示剂(甲基橙),若反应生成
强碱弱酸盐,溶液呈碱性,则选用碱性变色范围的指示剂(酚酞); • ③石蕊溶液因颜色变化不明显,且变色范围过宽,一般不作指示剂。 • (4)“考”误差分析
9
水的电离、溶液的酸碱性
• 试判断下列溶液在常温下的酸、碱性(在括号中填“酸性”“碱性”或“中性”)。
• ①相同浓度的HCl和NaOH溶液等体积混合(
)
• ②相同浓度的CH3COOH和NaOH溶液等体积混合(
)
• ③相同浓度的NH3·H2O和HCl溶液等体积混合(
)
• ④pH=2的HCl和pH=12的NaOH溶液等体积混合(
正
Kw
不变 不变 不变 不变
水的电离程度 c(OH-) c(H+)
减小 减小 增大 增大
减小 增大 增大 减小
增大 减小 减小 增大
6
水的电离、溶液的酸碱性
• (4)外界条件对水的电离平衡的影响
体系变化
条件
平衡移动方向
Kw
水的电离程度 c(OH-) c(H+)
温度
升温 降温
其他:如加入Na
7
水的电离、溶液的酸碱性
出的pH值只能是整数;不能用pH试纸测定氯水的pH,因为氯水呈酸性的同时呈现强氧化 性(漂白性)。 • ②pH计测量法。
12
酸碱中和滴定
• 1.“中和滴定”考点归纳 • (1)“考”实验仪器 • 酸式滴定管、碱式滴定管、滴定管夹(带铁架台)、锥形瓶。其中常考的是滴定管,如正确选
择滴定管(包括量程),滴定管的检漏、洗涤和润洗,滴定管的正确读数方法等。 • (2)“考”操作步骤 • ①滴定前的准备:查漏、洗涤、润洗、充液(赶气泡)、调液面、读数; • ②滴定:移液、滴加指示剂、滴定至终点、读数; • ③计算。
高考化学大一轮复习 第二单元 溶液的酸碱性 酸碱中和滴定习题详解课件

3.解析:(1)c(H+)=0.01 mol/L pH=2。
(2)c(OH
-
)
=
1×10-4+1×10-6 2
mol/L
=
1×10-4 2
c(H
+
)
=
15××1100--154=2×10-10(mol·L-1)故 pH=9.7。
(3)酸过量 c(H+)=1×101-15×+911-9 mol/L
=1×10-6 mol/L,pH=6。
[高考载体·巧妙利用] (1)强酸 (2)> (3)> (4)①相同 ②中 ③酸 (5)4 (6)<
(浙江专)中考语文总复习 第五讲 表达方式与记叙的顺序课件(经典回放点拔+考点解 读回放+考点跟踪突破+13中考真题)
聚焦中考——语文 第五讲
表达方式与记叙的顺序
• (2013·荆门)阅读下文,完成习题。 • ①那天下午6点多,该上公交车的人早已上了车,唯独有个小女孩,在车
2.不一定,在室温时 pH=7 的溶液呈中性,不在室温时 pH=7 的溶液不呈中性,如在 100℃时 pH=7 的溶液呈碱性。常温下 pH=14 的溶液碱性不是最强的,因为 pH 的范围仅为 0~14, pH=14 的碱溶液中 c(OH-)=1.0 mol/L,2.0 mol/L 的 NaOH 溶 液碱性比其碱性强。
[教材实验·全面发掘]
多悟一些 1.B 2.相等
多思一些
1.(1)提示:反应后溶液的
c(OH-)=0.1
mol/L×0.04×10-3 20+20×10-3 L
L
=10-4 mol/L
c(H+)=c1O0-H1-4 =1100--144=10-10 mol/L,pH=10。
2022年高考化学一轮复习 第8章 第38讲 水的电离和溶液的pH

温度高低点顺序是A=B=C<D<E,水的离子积常数只与温度有关,温 度越高,离子积常数越大,Kw间的关系:E>D>A=B=C,故C正确;
C点时,Kw=1×10-14,c(OH-)=1×10-6 mol·L-1,溶液的pH=8,显碱 性,故D错误。
题组二 计算电解质溶液中水电离出的c(H+)或c(OH-) 3.(2020·长沙市雅礼中学检测)25 ℃时,在等体积的①pH=0的H2SO4溶 液、②0.05 mol·L-1的Ba(OH)2溶液、③pH=10的Na2S溶液、④pH=5的 NH4NO3溶液中,发生电离的水的物质的量之比是
2.水的离子积 (1)表达式:Kw=_c_(_H_+__)·_c_(O__H_-__) _。 (2)影响因素:一定温度时,Kw是个常数,Kw只与_温__度__有关,_温__度__越 高,Kw越_大__。25 ℃时,Kw=_1_×_1_0_-__14__,100 ℃时,Kw=1×10-12。 (3)适用范围:Kw不仅适用于纯水,也适用于_酸__、_碱__、_盐__的稀溶液。
2.如图三条曲线表示不同温度下水的离子 积常数,下列说法不正确的是 A.图中温度:T3>T2>T1 B.图中pH关系:pH(B)=pH(D)=pH(E) C.图中五点Kw间的关系:E>D>A=B=C
√D.C点可能是显酸性的盐溶液
解析 水的电离吸热,升高温度促进电离,则水中c(H+)、c(OH-)及离 子积常数均增大,根据图知,离子积 常数:T3>T2>T1,所以温度:T3>T2>T1, 故A正确; 水的离子积常数只与温度有关,温度越 高,离子积常数越大,同一曲线是相同 温度,根据图知,温度高低点顺序是B<D<E,但三点溶液的氢离子浓度 相等,则pH相等,故B正确;
高考理综高三一轮高考化学复习 第8章 第2讲 水的电离和溶液的pH
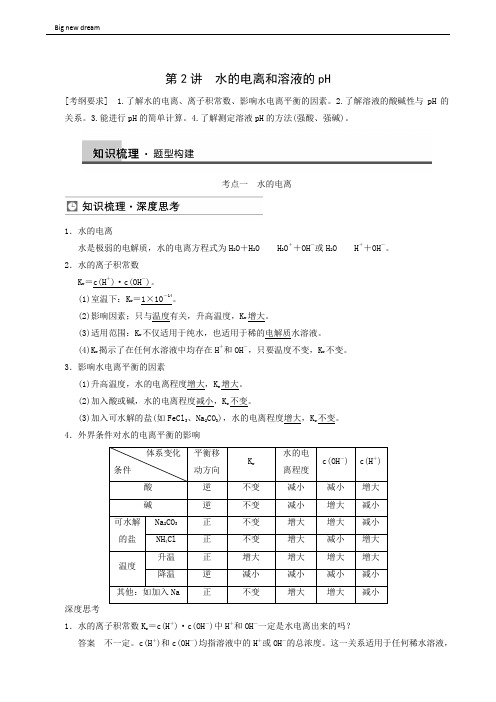
第2讲水的电离和溶液的pH[考纲要求] 1.了解水的电离、离子积常数、影响水电离平衡的因素。
2.了解溶液的酸碱性与pH的关系。
3.能进行pH的简单计算。
4.了解测定溶液pH的方法(强酸、强碱)。
考点一水的电离1.水的电离水是极弱的电解质,水的电离方程式为H2O+H2O H3O++OH-或H2O H++OH-。
2.水的离子积常数K w=c(H+)·c(OH-)。
(1)室温下:K w=1×10-14。
(2)影响因素;只与温度有关,升高温度,K w增大。
(3)适用范围:K w不仅适用于纯水,也适用于稀的电解质水溶液。
(4)K w揭示了在任何水溶液中均存在H+和OH-,只要温度不变,K w不变。
3.影响水电离平衡的因素(1)升高温度,水的电离程度增大,K w增大。
(2)加入酸或碱,水的电离程度减小,K w不变。
(3)加入可水解的盐(如FeCl3、Na2CO3),水的电离程度增大,K w不变。
4.外界条件对水的电离平衡的影响深度思考1.水的离子积常数K w=c(H+)·c(OH-)中H+和OH-一定是水电离出来的吗?答案不一定。
c(H+)和c(OH-)均指溶液中的H+或OH-的总浓度。
这一关系适用于任何稀水溶液,即任何稀水溶液中都存在这一关系。
因此,在酸溶液中酸本身电离出来的H+会抑制水的电离,而在碱溶液中,碱本身电离出来的OH-也会抑制水的电离。
2.在pH=2的盐酸溶液中由水电离出来的c(H+)与c(OH-)之间的关系是什么?答案外界条件改变,水的电离平衡发生移动,但任何时候水电离出c(H+)和c(OH-)总是相等的。
3.甲同学认为,在水中加入H2SO4,水的电离平衡向左移动,解释是加入H2SO4后c(H+)增大,平衡左移。
乙同学认为,加入H2SO4后,水的电离平衡向右移动,解释为加入H2SO4后,c(H+)浓度增大,H+与OH-中和,平衡右移。
你认为哪种说法正确?说明原因。
2024届高三化学一轮复习+水的电离平衡

H2O
H+ + OH-
对常温下纯水进行下列操作,填写下表
条件
酸碱性 平衡移 C(H+) C(OH-) C(H+) Kw
动方向
C(OH-)
大小
加热 中性 正向 增大 增大 = 增大
加HCl 酸性 逆向 增大 减小 > 不变
加 碱性 逆向 减小 增大 < 不变
NaOH
(3)加酸或加碱:抑制水的电离,但 水的离子积保持不变。
解:稀释前:c(OH-)=
=1 ×10-2 mol/L 稀释后: c(OH-) =
=1 ×10-4mol/L
c(H+)=
=
=1 ×10-10mol/L
pH=-lgc(H+) =10 关键:稀释碱溶液相当于稀释OH-
巩固练习
溶液的稀释
①pH=3的稀盐酸加水稀释100倍 ②pH=2的稀硫酸加水稀释100倍
④C (H+) 和 C (OH-) 指水溶液H+ 和OH- 的总浓度
练习1:常温下,0.01mol/L盐酸溶液中 C(H+)、 C(OH-)分别为多少?由水电 离出的C水(H+)、 C水(OH-)分别为多少?
练习2:常温下,0.01mol/L氢氧化钠溶液中 C(H+)、C(OH-)分别为多少?由水电 离出的C水(H+)、 C水(OH-)分别为多少?
课后作业:
完成P169 考点一练习题,预习考 点二中混合溶液pH的计算。
感谢聆听. 欢迎各位领导老师批评指正!
稀释后所得 溶液的pH
5
4
③pH=11的NaOH溶液加水稀释100倍 9
④pH=12的Ba(OH)2溶液加水稀释100倍 10
水的电离和溶液的酸碱性

水的电离平衡
水的电离是吸热过程
水的电离平衡常数表达式
影响因素:温度、酸碱度、浓 度等
水的离子积常数
水的离子积的计算方法
水的离子积常数Kw
温度对离子积的影响
酸碱溶液中水电离出的离 子浓度计算
水的电离平衡常数与离子 积的关系
水的电离的影响因素
温度:温度升高, 电离程度增大, 酸性增强;温度 降低,电离程度 减小,酸性减弱
03
溶液的pH值
pH值的定义
pH表示溶液中氢 离子浓度的负对数
计算公式:pH=lg[H+]
范围:0-14之间, 其中pH=7为中性 溶液,pH<7为酸 性溶液,pH>7为 碱性溶液
pH值对生物体和 化学反应具有重要 影响
pH值的计算方法
定义:氢离子浓度的负对数 计算公式:pH = -lg[H+] 酸碱性判断:pH<7,溶液呈酸性;pH=7,溶液呈中性;pH>7,溶液呈碱性 实例:硫酸溶液的pH值计算
碱性溶液:OH-浓度大于H+浓 度
中性溶液:H+浓度等于OH-浓 度
酸碱性的分类
酸性溶液:pH<7,显酸性 碱性溶液:pH>7,显碱性 中性溶液:pH=7,显中性 酸碱性对生物和工业领域的影响
酸碱性的表示方法
酸碱指示剂
pH值
酸度计
滴定法
酸碱性的影响因素
酸碱物质的浓度 温度 溶剂的性质 光、压力等物理因素
浓度:浓度增大, 电离程度减小, 酸性减弱;浓度 减小,电离程度 增大,酸性增强
酸碱环境:酸碱 的存在会抑制水 的电离,改变水 的离子积
盐类物质:某些 盐类物质会促进 水的电离,例如 硫酸铝钾等
2015届高考化学总复习课件:8-2水的电离和溶液的pH

A.1∶10∶1010∶109
B.1∶5∶5×109∶5×108
训 练 · 高 效 提 能
C.1∶20∶1010∶109 D.1∶10∶104∶109
菜
单
高考总复习· 化学
第八章
考 点 · 核 心 突 破
水溶液中的离子平衡
解析
本题考查酸、碱、盐对水电离的影响及KW
与溶液中c(H+)、c(OH-)之间的换算。①pH=0的 H2SO4溶液中c(H+)=1 mol· L-1,c(OH-)=10-14 mol· L
训 练 · 高 效 提 能
菜
单
高考总复习· 化学
第八章
考 点 · 核 心 突 破
水溶液中的离子平衡
考点· 核心突破
考点一
1.电离方程式
H2O+H2O
+ H O H H3O +OH , 可简写为___________ 2
+ -
水的电离
训 练 · 高 效 提 能
- + OH ________。
菜
单
高考总复习· 化学
增大 减小 减小 增大 增大 减小
不变
不变 不变 不变 增大 减小
碱
可水解 Na2CO3 的盐 NH4Cl
训 练 · 高 效 提 能
温度
升温 降温
菜
单
高考总复习· 化学
第八章
考 点 · 核 心 突 破
水溶液中的离子平衡
◎思维拓展 1.水的离子积常数KW=c(H+)· c(OH-)中H+和OH
-一定是水电离出来的吗?
少量稀氨水或NaHSO4后溶液的KW均不变。 答案
训 练 · 高 效 提 能
D菜单ຫໍສະໝຸດ 高考总复习· 化学第八章
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
方法技巧
(4)水解呈酸性或碱性的盐溶液 ①pH=5 的 NH4Cl 溶液中 H+全部来自水的电离,由水电离的 c(H+)= 10-5 mol·L-1,因为部分 OH-与部分 NH+4 结合 c(OH-)=10-9 mol·L-1。 ②pH=12 的 Na2CO3 溶液中 OH-全部来自水的电离,由水电离出的 c(OH-)=10-2 mol·L-1。
(3)pH=2 的 NH4Cl 溶液 、c(H+)=_1_0_-__2_m__o_l·_L。-1 (4)pH=10 的 Na2CO3 溶液、c(OH-)=_1_0_-_4_m__o_l_·_L。-1
4.下列四种溶液中,室温下由水电离生成的 H+浓度之比(①∶②∶③∶④)
是 ( A)
①pH=0 的盐酸 ②0.1 mol·L-1 的盐酸 ③0.01 mol·L-1 的 NaOH 溶液 ④pH=11 的 NaOH 溶液
A.1∶10∶100∶1 000 B.0∶1∶12∶11
C.14∶13∶12∶11 D.14∶13∶2∶3
递方进题法组技 巧
理清溶液中 H+或 OH-的来源 (1)常温下,中性溶液:c(OH-)=c(H+)=10-7 mol·L-1
(2)溶质为酸的溶液 ①来源:OH-全部来自水的电离,水电离产生的 c(H+)=c(OH-)。
后,水的电离平衡向右移动,解释为加入 H2SO4 后,c(H+)浓度增
大,H+与 OH-中和,平衡右移。你认为哪种说法正确?说明原因。
水的电离平衡移动后,溶液中 c(H+)·c(OH-)增大还是减小? 答案 甲正确,温度不变,Kw 是常数,加入 H2SO4,c(H+)增大, c(H+)·c(OH-)>Kw,平衡左移。 不变,因为 Kw 仅与温度有关,温度不变,则 Kw 不变,与外加酸、 碱、盐无关。
3O++OH-
或 H2
++OH- 。
2.水的离子积常数
Kw=c(H+)·c(OH-)。 (1)室温下:Kw= 1×10-14 。 (2)影响因素;只与 温度 有关,升高温度,Kw 增大 。 (3)适用范围:Kw 不仅适用于纯水,也适用于稀的 电解质 水溶液。 (4)Kw 揭示了在任何水溶液中均存在 H+和 OH-,只要温度不变,
题组一 影响水电离平衡的因素及结果判断
1.25 ℃时,相同物质的量浓度的下列溶液:①NaCl ②NaOH
③H2SO4 ④(NH4)2SO4,其中水的电离程度按由大到小顺序排
列的一组是
(C )
A.④>③>②>① B.②>③>①>④
C.④>①>②>③ D.③>②>①>④
2.一定温度下,水存在 H2
H++OH- ΔH=Q(Q>0)的平衡,下
列叙述一定正确的是
(B )
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw 减小
B.将水加热,Kw 增大,pH 减小
C.向水中加入少量固体 CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,
c(H+)=10-7 mol·L-1,Kw 不变
题组二 水电离的c(H+)或c(OH-)的计算
化学基本理论
水的电离和溶液的酸碱性
2020/10/13
[考纲要求]
1.了解水的电离、离子积常数以及影响水电离平衡的 因素。
2.了解溶液的酸碱性与 pH 的关系。 3.能进行 pH 的简单计算。 4.了解测定溶液 pH 的方法(强酸、强碱)。
知识梳理
I 考点一 水的电离
1.水的电离 水是极弱的电解质,水的电离方程式为 H2O+H2
知深识梳度理思 考
1.在 pH=2 的盐酸溶液中由水电离出来的 c(H+)与 c(OH-)之间的关
系是什么? 答案 外界条件改变,水的电离平衡发生移动,但任何时候由水 电离出的 c(H+)和 c(OH-)总是相等的。 2.甲同学认为,在水中加入 H2SO4,水的电离平衡向左移动,解释是
加入 H2SO4 后 c(H+)增大,平衡左移。乙同学认为,加入 H2SO4
Kw 不变。
知识梳理
3.影响水电离平衡的因素 (1)升高温度,水的电离程度 增大 ,Kw增大 。 (2)加入酸或碱,水的电离程度 减小 ,Kw不变 。 (3) 加 入 可 水 解 的 盐 ( 如 FeCl3 、 Na2CO3) , 水 的 电 离 程 度 增大 ,Kw 不变 。
知识梳理
4.外界条件对水的电离平衡影响
体系变化 平衡移
水的电
条件
动方向
Kw
c(OH-) c(H+) 离程度
酸
逆 不变 减小 减小 增大
碱
逆 不变 减小 增大 减小
可水解 Na2CO3 正 不变 增大 增大 减小
的盐 NH4Cl 正 不变 增大 减小 增大
温度
升温 降温
正 增大 增大 增大 增大 逆 减小 减小 减小 减小
其他:如加入 Na 正 不变 增大 增大 减小
3.求算下列溶液中由 H2O 电离的 c(H+)和 c(OH-)。 (1)pH=2 的 H2SO4 溶液
c(H+)=1_0_-__12__m_o__l·_L,-c1 (OH-)=1_0__-_1_2 _m__o_l·_L。-1
(2)pH=10 的 NaOH 溶液 c(H+)=_1_0_-_1_0_m__o_l_·L,-c1(OH-)=1_0__-_1_0 _m__o_l·_L。-1
反思归纳
(1)水的离子积常数 Kw=c(H+)·c(OH-),其实质是水溶液中的 H+和 OH- 浓度的乘积,不一定是水电离出的 H+和 OH-浓度的乘积,所以与其说 Kw 是水的离子积常数,不如说是水溶液中的 H+和 OH-的离子积常数。即 Kw 不仅适用于水,还适用于酸性或碱性的稀溶液。不管哪种溶液均有 c(H+)H2O=c(OH-)H2 O。 (2)水的离子积常数显示了在任何水溶液中均存在水的电离平衡,都有 H+和 OH-共存,只是相对含量不同而已。
②实例:如计算 pH=2 的盐酸溶液中水电离出的 c(H+),方法是先求出 溶液中的 c(OH-)=(Kw/10-2) mol·L-1=10-12 mol·L-1, 即水电离出的 c(H+)=c(OH-)=10-12 mol·L-1。
(3)溶质为碱的溶液 ①来源:H+全部来自水的电离,水电离产生的 c(OH-)=c(H+)。
