原电池和电解池物理化学
高中化学原电池和电解池全面总结超全版

高中化学原电池和电解池全面总结超全版公司内部编号:(GOOD-TMMT-MMUT-UUPTY-UUYY-DTTI-原电池和电解池1.原电池和电解池的比较:2.化学腐蚀和电化腐蚀的区别3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较6.电解方程式的实例(用惰性电极电解):↑+2NaOH强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2+ H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极3。
常见实用电池的种类和特点⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e-=2NH3+H2NH3和H2被Zn2+、MnO2吸收: MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
高中化学原电池和电解池全面总结超全版

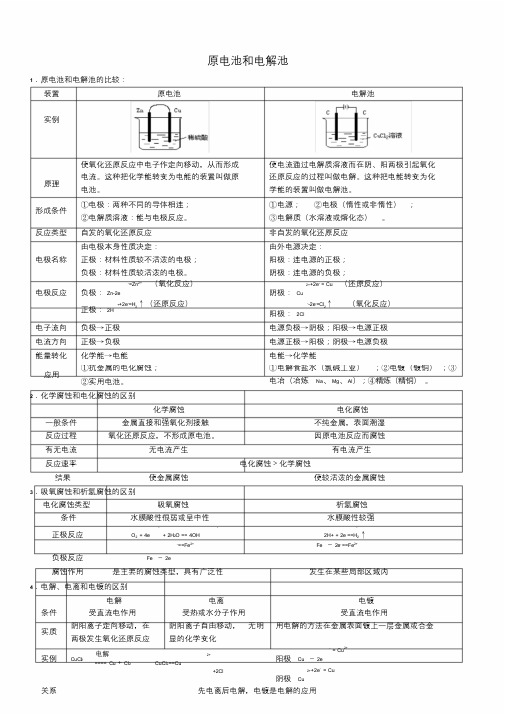
原电池和电解池1.原电池和电解池的比较:②实用电池。
电冶(冶炼Na 、Mg 、Al );④精炼(精铜)。
结果使金属腐蚀 使较活泼的金属腐蚀负极反应Fe - 2e+2CI 2++2e・Cu阴极Cu关系先电离后电解,电镀是电解的应用5 •电镀铜、精炼铜比较考点解说= =1•电化腐蚀:发生原电池反应L 有电流云星 (1|吸氧腐蚀负极:Fe~ 2e==Fe •+2H 2O==4OH'正极:O 尹4e总式:2Fe+O 2+2H 2O==2Fe(OH )24Fe(OH )2+O2 +2H2 O==4Fe(OH)s 2Fe(OH )3==Fe2O3+3H2O++HCO3(2)析圣》腐蚀• CO 2+H 2O H 2CO 3 H==Fe 2+ 负极:Fe - 2e+ + 2e'==H 2 f正极:2H总式:Fe + 2CO 2 + 2H 2O = Fe(HCO 3)2 + 舄人Fe(HC°3)2水解、空气氧化、风吹曰晒得 Fe 203o电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀 粗铜金属作阳极,精铜作阴极, CUSO4溶液作电极反应液必须含有镀层金属的离子・ 2+阳极Cu - 2e电解液・2+・2+小阳极:Zn - 2eCu -2e= Cu寺二 Cu2++2e = Cu=Zn2+ + 2e~ = Cu阴极:Cu阴极Cu溶液变化6•电解方程式的实例电镀液的浓度不变 (用惰性电极电解)溶液中溶质浓度减小申•解质溶液阳机反应式阴机反应式总反应方程式 (条件:电解)溶液酸碱件誉化CuCI?2 31•-2e=CI 2 f2++2e= CuCuCl2= C 1+CI2THCI:Cl2F ++2e=H 2^|2HCI=HN82SO4 4( )H -4e =2H2O+O2 2H +2eH2SO4 DHNaOH40H■-4e=2H 2O+O 2 f2H ++2e=H 2 fNaCI2CI -2e++2e =H 2=ci 2 t2H2H 2O=2H 2 f +02 f消耗水,碱性增强2NaCI+2H2O=H 2 f +CI 2 f+2NaOHH加电,碱性增强■^e '=2H 2O+O 2 f-4e=2H 2O+O 2 fCu 2++2e'= CuCu 2++2e = Cu 2CUS °4+2H2°=2CU+。
原电池和电解池比较

原电池和电解池比较1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀: CO2+H2OH2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2+ H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢。
高中化学原电池和电解池全面总结超全版
原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例使氧化还原反应中电子作定向移动,从而形成使电流通过电解质溶液而在阴、阳两极引起氧化原理电流。
这种把化学能转变为电能的装置叫做原电池。
还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应由电极本身性质决定:由外电源决定:电极名称正极:材料性质较不活泼的电极;阳极:连电源的正极;负极:材料性质较活泼的电极。
阴极:连电源的负极;电极反应-=Zn2+ (氧化反应)负极:Zn-2e++2e-=H2↑(还原反应)正极:2H2++2e- = Cu (还原反应)阴极:Cu--2e-=Cl2↑(氧化反应)阳极:2Cl电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
2.化学腐蚀和电化腐蚀的区别化学腐蚀电化腐蚀一般条件金属直接和强氧化剂接触不纯金属,表面潮湿反应过程氧化还原反应,不形成原电池。
因原电池反应而腐蚀有无电流无电流产生有电流产生反应速率电化腐蚀>化学腐蚀结果使金属腐蚀使较活泼的金属腐蚀3.吸氧腐蚀和析氢腐蚀的区别电化腐蚀类型吸氧腐蚀析氢腐蚀条件水膜酸性很弱或呈中性水膜酸性较强- 正极反应O2 + 4e-+ 2H2O == 4OH-2H+ + 2e ==H2↑-==Fe2+ Fe -2e- ==Fe2+负极反应Fe -2e腐蚀作用是主要的腐蚀类型,具有广泛性发生在某些局部区域内4.电解、电离和电镀的区别电解电离电镀条件受直流电作用受热或水分子作用受直流电作用实质阴阳离子定向移动,在两极发生氧化还原反应阴阳离子自由移动,无明显的化学变化用电解的方法在金属表面镀上一层金属或合金实例CuC2l 电解2+==== Cu+Cl2 CuCl2==Cu+2Clˉ- = Cu2+阳极Cu -2e2++2e- = Cu阴极Cu关系先电离后电解,电镀是电解的应用5.电镀铜、精炼铜比较电镀铜精炼铜形成条件镀层金属作阳极,镀件作阴极,电镀粗铜金属作阳极,精铜作阴极,CuSO4溶液作液必须含有镀层金属的离子电解液电极反应- 2+阳极 Cu -2e= Cu 2++2e -= Cu阴极 Cu-2+阳极: Zn - 2e = Zn 2+ + 2e -= Cu阴极: Cu- Cu - 2e2+= Cu等溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例 (用惰性电极电解) :电解质溶液阳极反应式 阴极反应式总反应方程式 (条件:电解)溶液酸碱性变化CuCl 2 2Cl--2e -=Cl 2↑ Cu 2++2e -= Cu CuCl 2= Cu +Cl 2↑ —— HCl 2Cl--2e -=Cl 2↑2H ++2e -=H 2↑2HCl=H 2↑+Cl 2↑酸性减弱--+-Na 2SO 4 4OH -4e =2H 2O+O 2↑ 2H +2e=H 2↑2H 2O=2H 2↑+O 2↑不变H 2SO 4 4OH--4e -=2H 2O+O 2↑ 2H ++2e -=H 2↑ 2H 2O=2H 2↑+O 2↑ 消耗水,酸性增强 NaOH4OH--4e -=2H 2O+O 2↑2H ++2e -=H 2↑2H 2O=2H 2↑+O 2↑消耗水,碱性增强--+-NaCl2Cl -2e+2e =H 2↑ =Cl 2↑2H2NaCl+2H 2O=H 2↑+Cl 2↑+2NaOH+H 放电,碱性增强CuSO 44OH --4e -=2H 2O+O 2↑Cu 2++2e -= Cu--4e -=2H 2O+O 2↑ Cu 2++2e -= Cu 2CuSO 4+2H 2O=2Cu+ O 2↑+2H 2SO 4OH ˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生 (1)吸氧腐蚀-2+负极: Fe -2e==Fe-+2H 2O==4OH - 正极: O 2+4e总式: 2Fe+O 2+2H 2O==2Fe(OH)24Fe(OH)2+O 2+2H 2O==4Fe(OH)3 2Fe(OH)3==Fe 2O 3+3H 2O++HCO 3-(2)析氢腐蚀: CO 2+H 2O H 2CO 3H-==Fe 2+ 负极: Fe -2e+ + 2e -==H 2↑正极: 2H总式: Fe + 2CO 2 + 2H 2O = Fe(HCO 3)2 + H 2↑ Fe(HCO 3)2 水解、空气氧化、风吹日晒得 Fe 2O 3。
第六章 物理化学 原电池和电解池

e上一内容 f下一内容 回主目录
2返回
极化作用
极化(polarization)
当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极平衡电势 ϕ(阳,平) 和阴 极平衡电势ϕ(阴,平) 。
在有电流通过时,随着电极上电流密度的增 加,电极实际分解电势值对平衡值的偏离也愈来愈 大,这种对平衡电势的偏离称为电极的极化。
例如,只有控制溶液的pH,利用氢气的析出有超 电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。
e上一内容 f下一内容 回主目录
2返回
电极反应的竞争
在电解质的水溶液中,正、负离子都不止一种,若为混合电 解质溶液,则正、负离子就更多了,原则上正离子都可以到阴 极去放电,负离子都可以到阳极去放电。但各离子的电极电势 不同,它们到电极上去放电有先有后,这种先后顺序要根据实 际电解中电极电势(即极化后的电极电势)来判断。实际电极 电势最大的先到阴极去放电,实际电极电势最小的先到阳极去 放电。在水溶液中有H+和OH-,需考虑H+和OH-的放电。在 中性水溶液中,
aH+ = 10−7 ,取p(H2) = 100kPa,25℃时有
ϕH+ /H2
= − RT F
ln
1 10−7
= −0.414V
e上一内容 f下一内容 回主目录
2返回
电极反应的竞争
若不考虑氢的超电势,则凡是电极电势大于-0.414V的离子都 可以先于H+到阴极放电并沉积出来。若考虑到氢的超电势, 许多电极电势比H+小得多的离子,如Zn2+、Cd2+,甚至Na+ 都可能先于H+到阴极放电沉积出来。
2返回
极化曲线(polarization curve)
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池。
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解。
这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn-2e-=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜)。
2.化学腐蚀和电化腐蚀的区别化学腐蚀电化腐蚀3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较溶液变化电镀液的浓度不变溶液中溶质浓度减小6.电解方程式的实例(用惰性电极电解):电解质溶液阳极反应式阴极反应式总反应方程式(条件:电解)溶液酸碱性变化CuCl22Cl--2e-=Cl2↑Cu2+ +2e-= Cu CuCl2= Cu +Cl2↑——HCl2Cl--2e-=Cl2↑2H++2e-=H2↑2HCl=H2↑+Cl2↑酸性减弱Na2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑不变H2SO44OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,酸性增强NaOH4OH--4e-=2H2O+O2↑2H++2e-=H2↑2H2O=2H2↑+O2↑消耗水,碱性增强NaCl2Cl--2e-=Cl2↑2H++2e-=H2↑2NaCl+2H2O=H2↑+Cl2↑+2NaOHH+放电,碱性增强CuSO44OH--4e-=2H2O+O2↑Cu2+ +2e-= Cu2CuSO4+2H2O=2Cu+ O2↑+2H2SO4OHˉ放电,酸性增强考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)3 2Fe(OH)3==Fe2O3+3H2O (2)析氢腐蚀: CO2+H2O H2CO3H++HCO3-负极:Fe -2e-==Fe2+正极:2H+ + 2e-==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:2.化学腐蚀和电化腐蚀的区别3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较6.电解方程式的实例(用惰性电极电解):考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e-==Fe2+正极:O2+4e-+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O(2)析氢腐蚀:CO2+H2OH2CO3H++HCO3—负极:Fe -2e-==Fe2+正极:2H+ + 2e—==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
2.金属的防护⑴改变金属的内部组织结构。
合金钢中含有合金元素,使组织结构发生变化,耐腐蚀。
如:不锈钢.⑵在金属表面覆盖保护层。
常见方式有:涂油脂、油漆或覆盖搪瓷、塑料等;使表面生成致密氧化膜;在表面镀一层有自我保护作用的另一种金属。
⑶电化学保护法①外加电源的阴极保护法:接上外加直流电源构成电解池,被保护的金属作阴极。
②牺牲阳极的阴极保护法:外加负极材料,构成原电池,被保护的金属作正极3。
常见实用电池的种类和特点⑴干电池(属于一次电池)①结构:锌筒、填满MnO2的石墨、溶有NH4Cl的糊状物。
②电极反应负极:Zn-2e-=Zn2+正极:2NH4++2e—=2NH3+H2NH3和H2被Zn2+、MnO2吸收:MnO2+H2=MnO+H2O,Zn2++4NH3=Zn(NH3)42+⑵铅蓄电池(属于二次电池、可充电电池)①结构:铅板、填满PbO2的铅板、稀H2SO4。
②A。
放电反应负极:Pb—2e-+ SO42- = PbSO4正极:PbO2 +2e—+4H+ + SO42-= PbSO4 + 2H2OB.充电反应阴极:PbSO4 +2e-= Pb+ SO42—阳极:PbSO4—2e- + 2H2O = PbO2 +4H+ + SO42-总式:Pb + PbO2 + 2H2SO4错误!2PbSO4 + 2H2O注意:放电和充电是完全相反的过程,放电作原电池,充电作电解池.电极名称看电子得失,电极反应式的书写要求与离子方程式一样,且加起来应与总反应式相同。
高中化学原电池和电解池全面总结超全版

原电池和电解池1.原电池和电解池的比较:装置原电池电解池实例原理使氧化还原反应中电子作定向移动,从而形成电流。
这种把化学能转变为电能的装置叫做原电池.使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程叫做电解.这种把电能转变为化学能的装置叫做电解池。
形成条件①电极:两种不同的导体相连;②电解质溶液:能与电极反应。
①电源;②电极(惰性或非惰性);③电解质(水溶液或熔化态)。
反应类型自发的氧化还原反应非自发的氧化还原反应电极名称由电极本身性质决定:正极:材料性质较不活泼的电极;负极:材料性质较活泼的电极。
由外电源决定:阳极:连电源的正极;阴极:连电源的负极;电极反应负极:Zn—2e—=Zn2+ (氧化反应)正极:2H++2e-=H2↑(还原反应)阴极:Cu2+ +2e- = Cu (还原反应)阳极:2Cl--2e-=Cl2↑(氧化反应)电子流向负极→正极电源负极→阴极;阳极→电源正极电流方向正极→负极电源正极→阳极;阴极→电源负极能量转化化学能→电能电能→化学能应用①抗金属的电化腐蚀;②实用电池。
①电解食盐水(氯碱工业);②电镀(镀铜);③电冶(冶炼Na、Mg、Al);④精炼(精铜).2.化学腐蚀和电化腐蚀的区别化学腐蚀电化腐蚀3.吸氧腐蚀和析氢腐蚀的区别4.电解、电离和电镀的区别5.电镀铜、精炼铜比较6.电解方程式的实例(用惰性电极电解):考点解说1.电化腐蚀:发生原电池反应,有电流产生(1)吸氧腐蚀负极:Fe-2e—==Fe2+正极:O2+4e—+2H2O==4OH-总式:2Fe+O2+2H2O==2Fe(OH)24Fe(OH)2+O2+2H2O==4Fe(OH)32Fe(OH)3==Fe2O3+3H2O (2)析氢腐蚀:CO2+H2OH2CO3H++HCO3—负极:Fe -2e-==Fe2+正极:2H+ + 2e—==H2↑总式:Fe + 2CO2 + 2H2O = Fe(HCO3)2 + H2↑Fe(HCO3)2水解、空气氧化、风吹日晒得Fe2O3。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
8 3
H2O(
s)
CdSO4饱和
溶
液Hg2
SO4
(
s
)
Hg
电极反应: (+)Hg2SO4(s)+2e-→2Hg(l)+ SO42-
(-) Cd(Hg) + SO42- +8/3H2O(l)→CdSO4. 8/3H2O +2e-
电池反应:Hg2SO4(s)+Cd(Hg)(a)+8/3H2O→CdSO4·8/3H2O(s)+2Hg(l)
2Fe2++ Cl2 → 2Fe3++ 2Cl-
§6.3 可逆电池热力学
桥梁公式:
Wf,max QE nEF ( r Gm )T ,P,R zEF
二、可逆电池的热力学函数
Δr Sm
zF
E T
p
(E/T)p称为电池电动势的温度系数,可由实验测定后, 求出电池反应的熵变。
物理化学
第六章 原电池和电解池
学习要求:
重点掌握电池反应和电极反应的能斯特方程,会 利用能斯特方程计算电池电动势和电极电势。
第六章 电化学
§6.1 §6.2 §6.3 §6.4 §6.5 §6.7
原电池和电解池基本概念 可逆电池 可逆电池热力学 电极电势和液体接界电势 电极分类及电极电势的计算 电动势的测定及其应用
负极:Fe2+(aq) - e- → Fe3+(aq).
(-)Pt |Fe2+, Fe3+(0.10mol·L-1)||Cl-(2.0mol·L-1),Cl2(100 kPa) | Pt(+)
1)、根据化学反应设计电池 Zn(s)+H2SO4(aq)→H2(p)+ZnSO4(aq)
(-) Zn(s) -2e-→Zn2+ (+) 2H++2e-→H2(p) 净反应: Zn(s)+2H+→Zn2++H2(p)
§6.2 可逆电池
利用氧化还原反应将化学能转变为电能的装置.
Cu2+
+
Zn
==
Cu
+
Zn2+,
rG m=
-212.55 kJ·mol-1
电池反应: Zn(s) + Cu2+(aq) = Zn2+(aq) + Cu(s)
理论上讲,任何一个氧化还原反应都能组成原电池. 每个原电池都是由两个半电池构成, 对应两个电对。
ξ接触 ξ -
ξ扩散
ξ+
E = ξ接触 + ξ - + ξ扩散 + ξ +
1. 电极电势差 2.接触电势Ec 3.液体接界电势:扩散电势Ej
液接电势的消除——盐桥(Salt bridge)
1)盐桥中离子的t+≈t-,使Ej≈0。 2)常用饱和KCl盐桥,因为K+与Cl-的迁移数相 近,当有Ag+时用KNO3或NH4NO3。 3)盐桥中盐的浓度要很高,常用饱和溶液。 4)盐桥只能降低液接电势,但不能完全消除,
构成条件: 1、能设计成电池的反应,如氧化还原反应。 2、有适当的装置——电池:单液电池或双液电池( 盐桥连接) 3、电极
原电池电极反应
Ox + neRed- ne-
Red Ox
半电池反应(或电极反应):
表示氧化型和还原型相互转化的关系式(或分别在 两个半电池中发生的反应).
式中n为电极反应转移的电子数.
二、可逆电池
组成可逆 电池的必 要条件
1、化学反应可逆 2、 能量变化可逆
电极反应可逆、速度无限缓慢。
3.其他过程可逆
原电池
电解池
三、电池的书写方式:
1. 左边为负极,起氧化作用; 右边为正极,起还原作用。
2.“|”表示相界面,有电势差存在。 3.“||”表示盐桥,使液接电势降到可以忽略不计。
4. 要注明温度,不注明就是298.15 K;要注明物态, 气体要注明压力;溶液要注明浓度。
5. 气体电极和氧化还原电极要写出导电的惰性电极, 通常是铂电极。
纯液体、固体和气体写在靠惰性电极一边, 用“,”分开.
Zn(s)┃ZnSO4(a) ┇ ┇CuSO4(a)┃Cu(s)
1)、根据化学反应设计电池
例题: 将反应 2Fe2+(1.0mol·L-1) + Cl2 (100kPa) → 2Fe3+(0.10mol·L-1) + 2Cl-(2.0mol·L-1)设计成原电池,并 写出电池符号. 解: 正极:Cl2 (g) + 2e- → 2Cl- (aq);
H2(p) +1/2O2(p)
H2O(l)
2)根据电池书写化学方式和电极反应 Pt Fe2+,Fe3+(0.10mol·L-1)||Cl-(2.0mol·L-1),Cl2(100 kPa) |Pt(+)
解:
正极:Cl2 (g) + 2e- → 2Cl- (aq);
负极:Fe2+(aq) - e- → Fe3+(aq).
电化学中
Δr Hm Qr ???
6.7 电池电动势的测定——对消法
Ew:工作电池 Ex:待测电池 Es:标准电池
Ex EAC1 Es EAC2
Ex AC1 Es AC2
1.对消法测电动势的实验装置
标准电池 待测电池
工作电源
检流计
电位计
2.韦斯顿标准电池
镉汞齐w(Cd
)
0.125CdSO4
1.电极电势( )的产生:
M活泼
M不活泼
双电层
Mn+稀
Mn+浓
溶解 >沉积 沉积 >溶解
M Mn+(aq) +ne-
双电层间的电势差,实 际上就是氧化还原电对 ቤተ መጻሕፍቲ ባይዱ平衡电势, 称之为电 极反应的电势,简称为
电极电势(E,本书用“”
表示.)
电动势的值
() Cu' | Zn | ZnSO4 (a1) | CuSO4 | Cu()
二、可逆电池的热力学函数
在等温条件下 ΔrGm Δr Hm TΔr Sm
Δr Hm
zEF
zFT (E T
)p
温度一定时,电池反应的可逆热效应为
E
Qr
zFT ( T
)p
E
( T
)
p
0
电池工作时不与环境交换热量
E
( T
)p
0
E
( T
)
p
0
电池工作时从环境吸热 电池工作时向环境放热
优点: 电动势稳定,随温度改变小。
ET/V = 1.01845 – 4.05 10-5(T/K –293.15) – 9.5 10-7(T/K –293.15)2 + 1 10-8 (T/K –293.15)3
通常要把标准电池恒温、恒湿存放,使电动 势稳定。
第四节 电极电势和电池电动势
电极电势
Zn(s)|ZnSO4(aq)||H2SO4(aq),H2(p) | Pt
2)、根据电池表示式写出化学反应 写出下列电池表示式所对应的化学反应
解: Pt, H2(g)|H+(a)|O2(g), Pt
(-) H2(p) H+(a)+2e(+) 1/2O2(p) + H+(a+2e-
H2O(l)
电池反应:
