人类EGFR基因突变荧光PCR检测试剂盒说明书讲课讲稿
透景EGFR检测试剂盒说明书

透景EGFR检测试剂盒说明书【药品名称】通用名称:EGFR基因突变检测试剂盒(荧光PCR法)汉语拼音:EGFRJiYinTuBianJianCeShiJiHe(YingGuangPCRFa)【成份】外显子19检测试剂:探针1(delE746-A750)、探针2(delL747-P753insS)、正向引物1、反向引物1、阳性对照品1(delE746-A750)、阳性对照品2(delL747-P753insS)、阴性对照品1(exon19 wildtype);外显子21检测试剂:探针3(L858R)、探针4(L861Q)、正向引物2、反向引物2、阳性对照品3(L858R)、阳性对照品4(L861Q)、阴性对照品2(exon21wild type);通用试剂:去离子水、2X PCR Pre-Mix。
产品储存条件及有效期:检测试剂于-20℃±3℃避光、密封储存,通用试剂于2℃~8℃密封储存,有效期为自生产之日起一年。
附件:注册产品标准、说明书【适应症】该产品用于定性检测经临床确诊为非小细胞癌患者的肺组织新鲜样本或石蜡包埋样本中的EGFR基因外显子19(delE746-A750,delL747-P753insS)和外显子21(L858R,L861Q)的突变。
【规格】10人份/盒、20人份/盒。
人EGFR基因突变检测试剂盒(PCR荧光法)技术参数规格:24人份/盒组分及储存有效期24人份:序号名称包装体积描述样本类型(1)推荐样品类型顺序:新鲜病变组织>冰冻病理切片>石蜡包埋病理组织或切片>其它类型标本。
从新鲜病变组织中取样应确定含有肿瘤病变组织,石蜡包埋病理组织或切片应确定含有肿瘤病变组织,所用石蜡包埋病理组织或切片保存时间不超过3年。
(2)推荐使用商业化的DNA提取试剂盒(推荐使用QIAGEN石蜡组织DNA抽提试剂盒,Cat NO,56404),所提取的DNA OD260/OD280在1.6~2.0。
非小细胞肺癌患者EGFR基因检测PPT培训课件

03
非小细胞肺癌患者EGFR基因 突变检测
突变类型与发生率
突变类型
EGFR基因突变主要涉及18-21外显子,包括L858R、G719X、T790M等常见 突变。
发生率
EGFR基因突变在非小细胞肺癌中发生率较高,约15-20%的肺腺癌患者存在 EGFR基因突变。
突变检测方法与流程
检测方法
目前常用的EGFR基因突变检测方法包括直接测序法、实时荧光定量PCR、液相 芯片法和组织芯片法等。
政策支持与资金投入
政府和社会各界应加大对EGFR基因检测的投入,提高检测的可及 性和可负担性。
感谢您的观看
THANKS
05
非小细胞肺癌患者EGFR基因 检测的临床实践
检测前的准备与注意事项
01
02
03
患者教育
向患者解释EGFR基因检 测的目的、方法及意义, 消除患者的疑虑和恐惧。
样本采集
确保采集的样本质量,如 肺部组织或血液,避免污 染和降解。
注意事项
告知患者检测前需避免使 用某些药物或停止使用某 些药物,以免影响检测结 果。
数字PCR技术
数字PCR技术具有高灵敏度、高特 异性的特点,未来可能会成为 EGFR基因突变检测的重要手段。
液态活检技术
基于循环肿瘤细胞的检测和基于循 环肿瘤DNA的检测等液态活检技术, 为肺癌患者的早期诊断和实时监测 提供了新的可能性。
个性化治疗与精准医学的结合
个性化治疗
根据患者的基因突变类型和个体特征,制定 个性化的治疗方案,以提高治疗效果和患者 的生存率。
检测过程中的沟通与护理
沟通
与患者保持良好沟通,了 解患者的病情和需求,解 答患者的问题。
护理
EGFR实验说明书电子版414

10.预处理溶液Ⅲ:甲醛固定液
市售甲醛
1ml
PBS(pH7.2-7.4)
39ml
MgCl 2·6H2O
0.18g
充分混匀,每次实验前应使用新鲜配制的溶液。
备注:正确的操作程序保证试剂的质量
20×SSC(pH5.3)
100ml
去离子水
800ml
充分混匀,室温下10M NaOH调节pH值至7.0±0.2,用去离子水定容至1L。使用 期间2-8℃储存。试剂配制6个月后应丢弃,若试剂出现混浊或污染丢弃时间应更早。
3.变性液:70%(v/v)甲酰胺/2×SSC
甲酰胺
35ml
20×SSC(pH5.3)
(8) 组织切片经蛋白酶K消化后,于2×SSC溶液中漂洗2次,每次5分钟。 (9) 室温下于甲醛固定液中固定5分钟。
(为保持组织结构,蛋白酶K消化后室温下用甲醛固定液固定)
(10) 室温下将组织切片玻片依次置于70%乙醇、85%乙醇和100%乙醇中各2分钟脱水。 (11) 自然干燥玻片。 (12) 加热玻片至56℃。 (13) 按照FISH操作步骤进行FISH实验。
6
EGFR基因扩增检测试剂盒
【变性杂交操作步骤】
注意:荧光原位杂交有杂交仪变性杂交和甲酰胺变性杂交两种方法。前者是 样本和探针分别变性,后者是用杂交仪对样本和探针进行共变性,减少了人为因 素的影响。
1. 甲酰胺变性杂交(手工操作) (1) 探针混合物准备及变性
探针配制。室温下将如下液体加入到微量离心管中。
交产生明亮的信号。EGFR DNA 探针杂交到人类7号染色体短臂7p11.2-p21, 荧光 信号为橘红色(Rhodamine)。对照探针为CSP7,探针杂交信号位于人类7号染色体 7p11.1-q11.1,覆盖整个着丝粒区域,荧光信号为绿色(FITC)。
人类EGFR基因突变荧光PCR检测试剂盒说明书

人类EGFR基因突变荧光PCR检测试剂盒说明书【产品名称】通用名称:人类EGFR基因突变荧光PCR检测试剂盒英文名称:Shuwen® Human EGFR Gene Mutation Detection Kit for Real-Time PCR【包装规格】7测试/盒【预期用途】EGFR是一种细胞膜表面的糖蛋白受体,具有酪氨酸激酶(Tyrosine Kinase,TK)活性,是原癌基因c-erbB-1(HER-1)的表达产物。
EGFR 的主要信号转导途径有:PI3K-PDK 通路,RAS-RAF-MEK-ERK-MAPK 通路,PLC-γ 通路,JAK-STAT 通路。
通过这些途径,将胞外信号转化为胞内信号,从而有效应对外界的信号刺激,调节细胞的生长、增殖、分化,抑制细胞的凋亡。
EGFR异常调节通过多种机制促进细胞恶性转化,包括受体的过度表达、突变、生长因子-受体自分泌环的活化以及特定的磷酸酶失活,其中涉及肿瘤发生和进展的机制中最常见的是EGFR的基因突变和过度表达。
EGFR基因位于7号染色体短臂7pl2-14区,由28个外显子组成。
其突变主要发生在EGFR酪氨酸激酶的ATP结合位点的编码区(第18-20外显子),研究表明,EGFR酪氨酸激酶抑制剂(例如吉非替尼、厄洛替尼和埃可替尼等)疗效与EGFR基因的突变有密切的相关性。
目前已经报道大约有30种突变与吉非替尼的药物反应相关,主要是19外显子上的缺失突变和21外显子上的L858R的点突变。
外显子19上747-750位氨基酸的大约20种缺失约占所有突变的45%,其中以两种delE746-A750(2235_2249del15和2236_2250del15)最为常见,占到外显子19缺失总数的75%;外显子21上L858R的点突变占所有突变的45%左右;外显子18的3种点突变(G719X)约占5%;外显子20的突变占1%左右。
另外研究发现外显子20上的T790M突变与酪氨酸激酶抑制剂药物的耐药性相关。
人类EGFR基因突变荧光PCR检测试剂盒说明书
人类EGFR基因突变荧光PCR检测试剂盒说明书【产品名称】通用名称:人类EGFR基因突变荧光PCR检测试剂盒英文名称:Shuwen® Human EGFR Gene Mutation Detection Kit for Real-Time PCR【包装规格】7测试/盒【预期用途】EGFR是一种细胞膜表面的糖蛋白受体,具有酪氨酸激酶(Tyrosine Kinase,TK)活性,是原癌基因c-erbB-1(HER-1)的表达产物。
EGFR 的主要信号转导途径有:PI3K-PDK 通路,RAS-RAF-MEK-ERK-MAPK 通路,PLC-γ 通路,JAK-STAT 通路。
通过这些途径,将胞外信号转化为胞内信号,从而有效应对外界的信号刺激,调节细胞的生长、增殖、分化,抑制细胞的凋亡。
EGFR异常调节通过多种机制促进细胞恶性转化,包括受体的过度表达、突变、生长因子-受体自分泌环的活化以及特定的磷酸酶失活,其中涉及肿瘤发生和进展的机制中最常见的是EGFR的基因突变和过度表达。
EGFR基因位于7号染色体短臂7pl2-14区,由28个外显子组成。
其突变主要发生在EGFR酪氨酸激酶的ATP结合位点的编码区(第18-20外显子),研究表明,EGFR酪氨酸激酶抑制剂(例如吉非替尼、厄洛替尼和埃可替尼等)疗效与EGFR基因的突变有密切的相关性。
目前已经报道大约有30种突变与吉非替尼的药物反应相关,主要是19外显子上的缺失突变和21外显子上的L858R的点突变。
外显子19上747-750位氨基酸的大约20种缺失约占所有突变的45%,其中以两种delE746-A750(2235_2249del15和2236_2250del15)最为常见,占到外显子19缺失总数的75%;外显子21上L858R的点突变占所有突变的45%左右;外显子18的3种点突变(G719X)约占5%;外显子20的突变占1%左右。
另外研究发现外显子20上的T790M突变与酪氨酸激酶抑制剂药物的耐药性相关。
病理科肺癌EGFR检测 ppt课件

ORR(%) PFS (月)
组织
血液
ctDNA检测EGFR突变阳性可用于指导EGFR-TKI治疗
Jan YD, et al. 2014 ASCO Abstract 1868.
非小细胞肺癌血液EGFR突变基因检测专家共识解析
标本采集及处理
p 建议使用如下两种方法之一采集10毫升全血并进一步分离血浆:
•进行个体化治疗决定前应有足够的组织材料进行组织学 诊断和分子检测 •在疾病进展时应考虑重新检测 •应当系统分析EGFR突变状态——在晚期非鳞非小细胞 肺癌患者组织中进行标准检测[II, A].
NCCN2014指南:
对晚期非鳞NSCLC及不吸烟/小标本鳞癌的治疗强调了治 疗前必须检测EGFR/ALK,并指出 “多重/下一代测序 项目应该包含这2个靶点的检测”
外显子19,21突变为药物敏感突变类型
Dacic S. Adv Anat Pathol 2008; 15:241-247. Riely GJ, et al. Clin Cancer Res 2006; 12(24):7232-7241. Murray S, et al. J Thorac Oncol 2008; 3:832-839.
2011年NCCN非小细胞肺癌治疗指南(中文版)
基因突变检测流程
患者
临床医生
-肿瘤科医生 -放疗科医生 -呼吸科医生 -胸外科医师
报告结果给临床医生
内镜医师
胸外科医师 收集肺癌组织标本
病理科医生 准备样本
实验室人员 实验操作及结果分析
肿瘤标本
病理评估
DNA提取
突变检测
结果分析
NSCLC---腺癌基因突变谱:亚洲研究
EGFR依然是亚裔腺癌最常见的驱动基因,约占50%
人类EGFR基因突变荧光PCR检测试剂盒说明书

人类EGFR基因突变荧光PCR检测试剂盒说明书1.打开操作软件,设置PCR扩增程序为Stage1:95℃ 5minStage2:95℃ 20s,57℃ 32s ,5个循环Stage3:95℃ 20s,60℃ 32s ,40个循环收集FAM信号注:如果使用ABI定量PCR仪,将“Passive Reference”设置为“None”, “reporter”设置为“FAM”,“quencher”设置为“TAMRA”【参考值】检测结果判定:1.当样品CT值大于或等于阴性临界值时,则该样品为阴性或低于本试剂盒的检测下限。
2.当样品CT值小于阴性临界值时,则该样品为阳性。
表3 结果判定【实验结果的解释】1.阈值设定:针对ABI7500机型,对以上9种检测分别设定阈值,其中19-del(1) ,19-del(2)和G719X阈值设定为12000,其他为300002.阴性无模板空白对照(NTC) 应无扩增曲线升起;否则表明此次实验结果无效,建议更换操作环境或反应试剂,重新试验。
(若只稍稍升起,但对结果判断无显著影响,则结果依然有效)3.阳性对照Ct值一般小于25,参照基因体系的阳性对照CT值一般小于23,但须根据仪器型号等情况进行判断。
4.CT值确定:建议对于一个突变检测体系应同时选择参照基因反应管,STD反应管,NTC和样品反应管,一并划定阈值,从而得到外控CT值和样品的突变CT值。
5.参照基因CT值应控制在23之前,以用于评估反应体系中的DNA模板量。
若外控CT值大于23,说明加入的DNA含有PCR抑制剂或DNA加入量太少,需重新提取或增大DNA加入量再做。
(仅对全阴性结果而言;若已经判断为阳性,结果仍然可靠)附表:。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
人类EGFR基因突变荧光PCR检测试剂盒说明书
【产品名称】
通用名称:人类EGFR基因突变荧光PCR检测试剂盒
英文名称:Shuwen? Human EGFR Gene Mutation Detection Kit for Real-Time PCR
【包装规格】
7测试/盒
【预期用途】
EGFR是一种细胞膜表面的糖蛋白受体,具有酪氨酸激酶(Tyrosine Kinase,TK )活性,是原癌基因
c-erbB-1 (HER-1 )的表达产物。
EGFR 的主要信号转导途径有:PI3K-PDK 通路,RAS-RAF-MEK-ERK-MAPK 通路,PLC- Y通路,JAK-STAT通路。
通过这些途径,将胞外信号转化为胞内信号,从而有效应对外界的信号刺激,调节细胞的生长、增殖、分化,抑制细胞的凋亡。
EGFR异常调
节通过多种机制促进细胞恶性转化,包括受体的过度表达、突变、生长因子-受体自分泌环的活化以及特定
的磷酸酶失活,其中涉及肿瘤发生和进展的机制中最常见的是EGFR的基因突变和过度表达。
EGFR基因位于7号染色体短臂7pl2-14区,由28个外显子组成。
其突变主要发生在EGFR酪氨酸激酶的ATP 结合位点的编码区(第18-20外显子),研究表明,EGFR酪氨酸激酶抑制剂(例如吉非替尼、厄洛替尼和埃可替尼等)疗效与EGFR基因的突变有密切的相关性。
目前已经报道大约有30种突变与吉非替尼的药物反应相关,主要是19外显子上的缺失突变和21外显子上的L858R的点突变。
外显子19上747-750位氨基酸的大约20种缺失约占所有突变的45%,其中以两种delE746-A750(2235_2249del15和2236_2250del15)最为常见,占到外显子19缺失总数的75%;外显子21上L858R的点突变占所有突变的45%左右;外显子18的3种点突变(G719X )约占5%;外显子20的突变占1%左右。
另外研究发现外显子20上的T790M突变与酪氨酸激酶抑制剂药物的耐药性相关。
本试剂盒以肿瘤DNA为检测样本,提供EGFR基因突变的定性检测。
本试剂盒仅为临床医生肿瘤靶向治疗药物的选择提供参考,具体临床应用时须结合实际情况进行判断,不能以本试剂盒检测结果作为临床诊断的唯一依据。
【检测原理】
本试剂盒结合特异性引物和TaqMan探针技术,用实时荧光PCR方法检测DNA样品中的EGFR突变基因。
利用特异性引物对突变靶序列进行扩增,同时阻滞野生型的扩增,通过TaqMan探针对扩增产物进行检测,
使得突变基因得到扩增而野生型基本不扩增,从而达到高检测特异性和高灵敏度。
【主要组成成分】
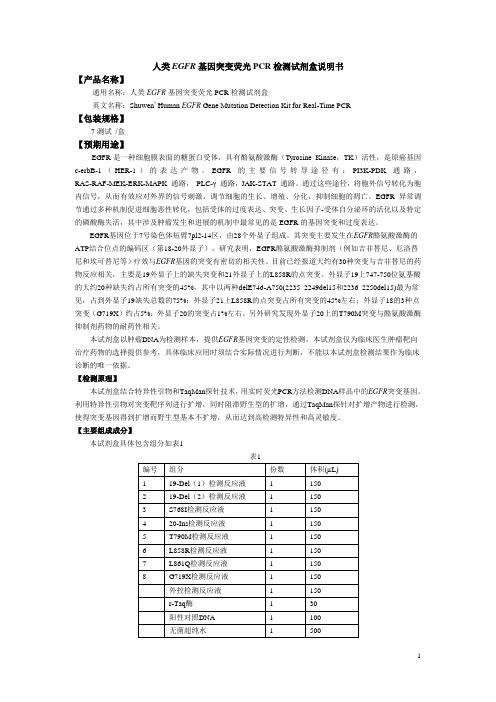
本试剂盒具体包含组分如表1
【储存条件及有效期】
避光,-20'C以下保存,避免反复冻融(不要超过5次),有效期6个月。
【适用仪器】
ABI 7300,ABI 7500,ABI 7900,ABI StepOne,ABI StepOne Plus,Rotor-Gene Q
【样本要求】
本试剂盒可以检测从新鲜组织及FFPE组织中提取的DNA,DNA质量及浓度影响检测的特异性和灵敏
度。
DNA的质量与样本保存时间、样本组成、DNA提取方法密切相关;而且所采集的临床样本中正常组织
细胞的混杂程度也不同,因此对样本做如下要求:
1、新鲜标本的制备过程中,术后标本取下后应立即放入-20C以下冰箱中保存;石蜡包埋组织制备过程中,
术后标本应在1个小时内放入10%中性缓冲福尔马林溶液中固定,用量应为组织块的4-20倍,固定时间应在6-48小时之间;
2、新鲜组织样本,要确保含有肿瘤细胞大于1%,尽量减少正常组织、间质及坏死组织,推荐使用商业化
试剂盒提取DNA(AXYGEN ,QIAGEN等公司产品)。
提取的DNA用分光光度计检测DNA纯度,A260/A280在1.6-2.0之间,如果不能立即检测请置于-20 C保存。
3、FFPE组织样本,要确保含有肿瘤细胞,尽量去除坏死组织及石蜡边缘,推荐使用商业化试剂盒提取
DNA(QIAamp DNA FFPE Tissue Kit)。
提取的DNA 用分光光度计检测DNA 纯度,A260/A280 在1.6-2.0 之间,如果不能立即检测请置于-20C保存。
FFPE组织样本保存年限尚未超过3年。
4、样本切片规格要求为:横切面面积至少6mn X 6mm,厚度10 pm,3片,如果切片面积小请适当增加切
片数。
最终提取的DNA用100让-200让水溶解,分光光度计检测浓度后,稀释或浓缩成5-10ng/ p。
【检验方法】
本试剂盒可以进行5人份的检测反应,并为每个样本额外提供一个参照基因扩增反应,用于估测样本实
际DNA的浓度。
建议每批次实验都检测一个阳性对照(positive control)和一个无模板阴性对照(NTC)。
建议根据实验条件进行分区操作,如样品处理区,反应液配制区等。
具体操作步骤如下:
1. 将试剂盒中所有组分冰上融化,涡旋混匀并短暂离心,放置于冰上。
[注意:试剂盒中的所有试管在开
盖前均应短暂离心,以免粘在管口或管盖上的试剂在开盖时被污染。
]
2. 每批实验根据待检测样本数、一个阳性对照、一个阴性对照,同时计算并分别配制1-8号反应液。
每个
反应液所需反应数=待测样本数+ 2(—个阳性对照、一个阴性对照),而每个反应所需反应液19.7 J L,需r-Taq酶0.3丄,即从1-8号反应液中分别取(19.7 >反应数)此于对应编号的1.5EP管,再分别加入(0.3 X 反应数)pL的r-Taq酶。
[注意:由于取样误差,请根据情况适当多配置0.3个反应即可。
]
3. 将配制好的混合液轻轻充分混匀,并按照每管20 pL分装到每个PCR反应管中。
4. 然后向每个反应管中加入5此待检测DNA、或阳性参照、或水(试剂盒提供)。
待检测样本最佳浓度范围为
5ng/ p L-10ng/ p L,即每个反应管中有效DNA总量为25-50ng。
5. 短暂离心消除反应管中的气泡,将PCR反应管放入PCR仪。
样本在PCR反应板中的布局可参见表2
Stagel:95°C 5min
Stage2: 95 C 20s, 57 C 32s , 5个循环
Stage3: 95C 20s, 60 C 32s , 40个循环收集FAM 信号
注:如果使用ABI定量PCR仪,将“Passive Reference设置为“None , “report设置为“FAM,“quenche设置为“ TAMRA
【参考值】
检测结果判定:
1. 当样品CT值大于或等于阴性临界值时,则该样品为阴性或低于本试剂盒的检测下限。
2. 当样品CT值小于阴性临界值时,则该样品为阳性。
表3结果判定
【实验结果的解释】
1. 阈值设定:针对ABI7500机型,对以上9种检测分别设定阈值,其中19-del⑴,19-del(2)和G719X阈值设定为
12000,其他为30000
2. 阴性无模板空白对照(NTC)应无扩增曲线升起;否则表明此次实验结果无效,建议更换操作环境或反应试剂,重新
试验。
(若只稍稍升起,但对结果判断无显著影响,则结果依然有效)
3. 阳性对照Ct值一般小于25,参照基因体系的阳性对照CT值一般小于23,但须根据仪器型号等情况进行判断。
4. CT值确定:建议对于一个突变检测体系应同时选择参照基因反应管,STD反应管,NTC和样品反应管,
一并划定阈值,从而得到外控CT值和样品的突变CT值。
5. 参照基因CT值应控制在23之前,以用于评估反应体系中的DNA模板量。
若外控CT值大于23,说明加
入的DNA含有PCR抑制剂或DNA加入量太少,需重新提取或增大DNA加入量再做。
(仅对全阴性结果而言;
若已经判断为阳性,结果仍然可靠)。
