医疗器械临床试验病例数之临床试验要素参考表
医疗器械临床试验备案表
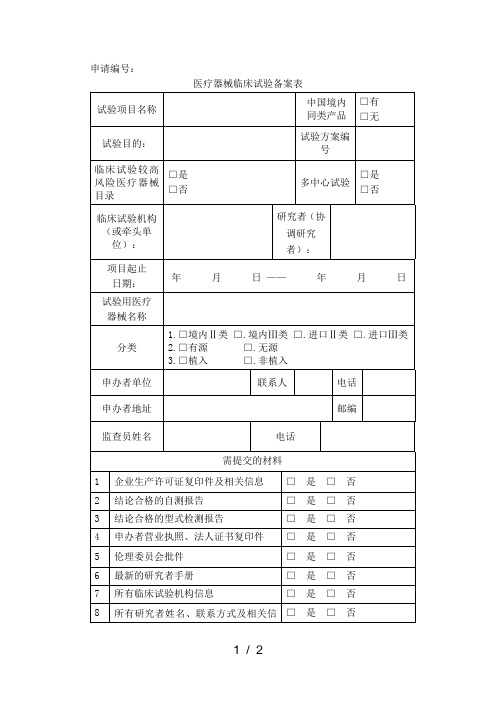
医疗器械临床试验备案表
试验项目名称
中国境内同类产品
□有
□无
试验目的:
试验方案编号
临床试验较高风险医疗器械目录
□是
□否
多中心试验
□是
□否
临床试验机构(起止
日期:
年月日——年月日
试验用医疗
器械名称
分类
1.□境内Ⅱ类 □.境内Ⅲ类 □.进口Ⅱ类 □.进口Ⅲ类 2.□有源 □.无源 3.□植入 □.非植入
□ 是 □ 否
8
所有研究者姓名、联系方式及相关信息
□ 是 □ 否
9
监查员姓名、联系方式及相关信息
□ 是 □ 否
10
项目概要说明
□ 是 □ 否
11
SFDA批件(适用时)
□ 是 □ 否
12
申办者保证所提供资料真实性的声明
□ 是 □ 否
申请人签名:
年 月 日
备案号:
经办人签名:
年 月 日
申办者单位
联系人
电话
申办者地址
邮编
监查员姓名
电话
需提交的材料
1
企业生产许可证复印件及相关信息
□ 是 □ 否
2
结论合格的自测报告
□ 是 □ 否
3
结论合格的型式检测报告
□ 是 □ 否
4
申办者营业执照、法人证书复印件
□ 是 □ 否
5
伦理委员会批件
□ 是 □ 否
6
最新的研究者手册
□ 是 □ 否
7
所有临床试验机构信息
临床试验-CRF病例报告表-模板

受试者编号:□□□□XXXXXXXXXXX(此处输入课题名称)XXXXXXXXXXX病例报告表(Case Report Form):受试者姓名缩写:□□□□研究医师:所在科室:研究单位:研究开始日期:年月日研究结束日期:年月日<填表说明在正式填表前,请认真阅读下列填表说明1.筛选合格者填写正式病例报告表。
2.病例报告表应用签字笔填写。
3病例填写务必准确、清晰,不得随意涂改,错误之处纠正时需用横线居中划出,并签署修改者姓名缩写及修改时间。
举例:LGW05-02-12。
(4.患者姓名拼音缩写四格需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每一个字的首字母。
举例:张红5.所有选择项目的□内用√标注。
如:√。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.因故未查或漏查,请填写“ND”;具体用药剂量和时间不明,请填写“NK”;不适用请选“NA”。
7.期间应如实填写不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床研究过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究者及其单位伦理委员会。
临床研究流程表`研究医师(签名):日期:20□□年□□月□□日基线情况研究医师(签名):日期:20□□年□□月□□日研究医师(签名):日期:20□□年□□月□□日;开始禁食时间:□□□□年□□月□□日□□时□□分第一阶段记录□□□□年□□月□□日供试制剂:受试品T :□ 参比品R : □生命体征Vital Signs临床观察记录Clinical Observation研究医师(签名):日期:20□□年□□月□□日开始禁食时间:□□□□年□□月□□日□□时□□分第二阶段记录□□□□年□□月□□日供试制剂:受试品T :□ 参比品R : □,生命体征Vital Signs临床观察记录Clinical Observation`;研究医师(签名):日期: 20□□年□□月□□日—合 并 用 药(CONCOMITANT MEDICATION )□无 □有 如有请填写下表注:*如研究结束后继续用药,请在□内划√研究医师(签名):日期:20□□年□□月□□日不良事件记录表*严重程度: 轻度(不处理,不停药),中度(停药,不处理),重度(停药,对症处理)。
临床试验观察表(CRF)

临床试验观察表(CRF)受试者姓名拼音缩写□□□□ 封面病例报告表(Case Report Form)受试者姓名:家庭地址:联系电话:试验中心名称:申办单位:延吉喜来健医疗器械有限公司在正式填表前请认真阅读下列填表说明病例报告表填写说明: 1.筛选合格者填写病例报告表。
2.病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。
3.填写记录一律用钢笔或碳素签字笔。
4.患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。
5.表中凡有“□”的项,请在符合的条目上划“√”。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.所有检验项目因故未查或漏查,请填写ND;具体合并用药剂量和时间不明,请先写NK。
7.试验期间应如实填写合并用药记录表、不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。
单位联系人联系电话传真延吉喜来健医疗器械公司8.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目,请对照临床流程图执行。
受试者姓名拼音缩写□□□□ 临床试验流程图项目治疗前治疗 0天治疗 10天治疗 20天治疗 30天基本情况采集确定入选/排除病例√ √ 签署知情同意书√ 填写一般资料√ 病史与治疗史√ 合并疾病√ √ √ √ 症状与体征√ √ √ √ 合并用药记录√ √ √ √ 安全性观察不良反应√ √ √疗效性观察临床症状、体征评分√ √ √ √ 理化指标检查√ √ 影像学、心电、B超等检查√ √ 不良反应评估√ 疗效评定√ 其它工作随机分组√ 分发研究产品√ 回收研究产品数量√ 受试者姓名拼音缩写□□□□ 患者知情同意书受试者知情同意书敬爱的患者:我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。
医疗设备临床试验观察表(CRF)

病例报告表(Case Report Form)受试者姓名:家庭地址:联系电话:试验中心名称:申办单位:XXXX医疗器械有限公司在正式填表前请认真阅读下列填表说明病例报告表填写说明:1.筛选合格者填写病例报告表。
2.病例报告表填写务必准确、清晰,不得任意涂改,错误之处纠正时需用横线居中化出,并签署修改者姓名缩写及修改时间。
3.填写记录一律用钢笔或碳素签字笔。
4.患者姓名拼音缩写四个需填满,两字姓名填写两字拼音前两个字母;三字姓名填写三字首字母及第三字第二字母;四字姓名填写每个字的首字母。
5.表中凡有“□”的项,请在符合的条目上划“√”。
表格中所有栏目均应填写相应的文字或数字,不得留空。
6.所有检验项目因故未查或漏查,请填写ND;具体合并用药剂量和时间不明,请先写NK。
7.试验期间应如实填写合并用药记录表、不良事件记录表。
记录不良事件的发生时间、严重程度、持续时间、采取的措施和转归。
如有严重不良事件发生(包括临床验证过程中发生需住院治疗、延长住院时间、伤残、影响工作能力危及生命或死亡、导致先天畸形等事件),必须立即通知主要研究单位伦理委员会及申办单位。
8.临床试验应严格按照临床试验方案要求进行。
试验不同时期需完成的检查和需记录的项目,请对照临床流程图执行。
受试者知情同意书敬爱的患者:我们现在正在进行一项临床研究,该项临床研究是经吉林省药品监督管理局备案的,研究的目的是评价物理治疗的高科技产品----温热电位治疗仪的疗效和安全性。
温热磁疗仪是XXX医疗器械有限公司根据韩国专利技术研制生产的医疗器械,本治疗仪是通过XXXXXXXXXXXXXXXXXXXXXXXXXXXXXX机理,主要用于XXXXXXXXXXXXX治疗。
具有平衡机体阴阳,增强脏腑机能,促进新陈代谢,调节植物神经,改善心脑血管血液供应,促进血液循环,调节血管张力,降低血液粘稠度,防治动脉粥样硬化,促进组织的再生修复功能,增强机体免疫功能及消炎止痛等作用。
医疗器械临床试验病例报告表样表说明模板

医疗器械临床试验病例报告表样表医疗器械临床试验病例报告表
试验项目名称
受试者病例号:□□□□□
试验用医疗器械编号:□□□
临床试验机构(或编号):□□
临床试验方案编号和日期(修改编号和日期若有)试验开始日期年月日
跟踪结束日期年月日
记录人签名:
填表说明
1.请用钢笔或签字笔填写,字迹应清晰,易于辨认。
2.每项填写内容务必准确,不得随便涂改,如发现填写内容有误,应在原记录上划单横线,在旁边写明正确内容及修改原因,由研究者签名并注明日期。
不得用任何方式(橡皮、涂改液等)涂抹原记录。
一、受试者病历简况
1、入组日期年月日
2、受试者姓名
3、出生日期年月
4、性别□1.男□2.女
5、临床诊断
6、接受的诊断/治疗方式(既往用药和/或手术)
7、入组前基础症状
8、入组时实验室检查
二、符合纳入/排除标准
三、诊断/治疗情况记录
四、一般情况观察记录
五、不良事件记录表
六、试验结论
七、声明
此病例报告表中的信息记录真实、准确,符合试验方案的要求,特此声明。
研究者签名:
年月日
监查与检查记录粘贴处
奥咨达小编提醒你,
快捷医疗器械注-册、zi询、各国ren-证、体系、临-床试验等一条龙高质量服务,服-务超过2600家企业,技术过硬,成功率高。
报jia?快来问问奥咨达客fu吧!。
-2017年医疗器械临床试验核查项目汇总表
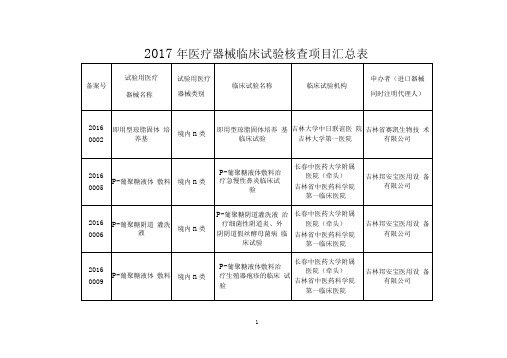
吉林市人民医院
长春恒晓生物科技 有限责任公司
2016
0011
中性粒细胞载脂 蛋白(HNL检测 试剂盒(酶联免 疫法)
境内n类
中性粒细胞载脂蛋白 (HNL检测试剂盒(酶 联免疫法)临床试验
中国人民解放军
第二零八医院
长春博德生物技术 有限公司
2016
0012
中性粒细胞载脂 蛋白(HNL检测 试剂盒(酶联免 疫法)
吉林大学第一医院
长春光机医疗仪器 有限公司
2017
0045
尿液分析试纸条
6840
尿液分析试纸条
(FUS-14Cai)临床试
验
吉林省中吉林省中医 药科学院第一临床医 院日联谊医院、吉林 省人民医院
长春迪瑞医疗科技 股份有限公司
2017
0047
贻贝粘蛋白鼻粘 膜洗液
6864
评价贻贝粘蛋白鼻粘 膜洗液治疗急慢性鼻 炎
吉林省中医药科学院 第一临床医院
四平市中心人民医院
吉林省博涵医疗器 械有限公司
2017
0048
贻贝粘蛋白水凝 胶
6864
评价贻贝粘蛋白水凝 胶治疗痔疮有效性和 安全性
吉林省中医药科学院 第一临床医院
四平市中心人民医院
吉林省博涵医疗器 械有限公司
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
2016
0022
抗环瓜氨酸肽抗 体测定试剂盒 (免疫散射比浊 法)
境内n类
抗环瓜氨酸肽抗体测 定试剂盒(免疫散射比 浊法)临床试验
中国人民解放军第
161医院
葛洲坝集团中心医院
吉林普阳医用科技 有限公司
医疗器械临床试验登记表
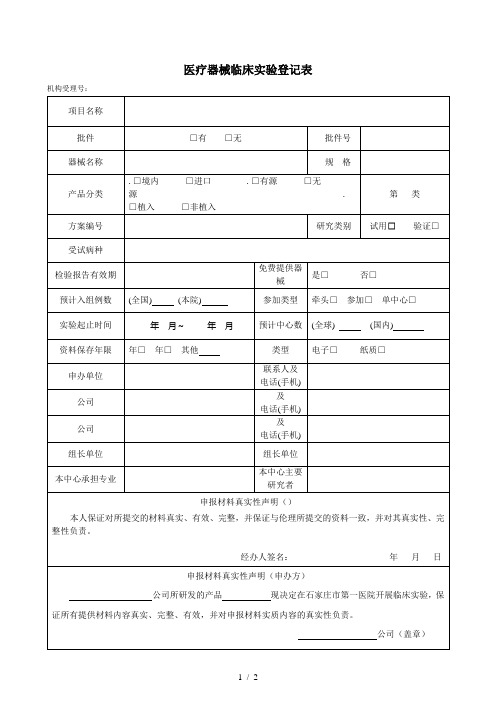
公司(盖章)
研究团队成员:
姓名
职称
项目分工
是否获得证书
签名
联系电话
主要研究者声明
本人自觉接受国家有关法律和法规的约束,对该项目的所有临床研究资料及相关内容保密,保护受试者权益及隐私,并郑重承诺与该项目无任何利益冲突。
资料保存年限
年□年□其他
类型
电子□纸质□
申办单位
联系人及
电话(手机)
公司
及
电话(手机)
公司
及
电话(手机)
组长单位
组长单位
本中心承担专业
本中心主要研究者
申报材料真实性声明()
本人保证对所提交的材料真实、有效、完整,并保证与伦理所提交的资料一致,并对其真实性、完整性负责。
经办人签名:年月日
申报材料真实性声明(申办方)
本人已审阅所有临床实验资料,认为本科室的人员配备、病源量和设备条件满足该项目实验要求,团队成员有充分的时间、并保证在约定时间内入组完成实验。本人同意并确认上述人员参加该临床实验。
主要研究者签字:年月日
(此由机构填写)
机构意见:经形式审查资料合格。
审查人签字:年月日
注:.团队成员中必须授权有项目质控训。
.机构登记表正反面打印。
.所有选择项目的“□”内用“×”标注
医疗器械临床实验登记表
机构受理号:
项目名称
批件
□有□无
批件号
器械名称
规格
产品分类
.□境内□进口.□有源□无源.□植入□非植入
第类
方案编号
医疗器械临床试验归档资料交接单

14 试验用医疗器械的标签
15 试验方案及其修正案(已签名)
16 知情同意书文本、更新件(若有)
17 病例报告表文本、更新件(若有)
18 受试者日志卡样表 临床试验协议或合同(已签名)(临床试验机构
19 和研究者、申办者)
20 食品药品监督管理部门临床试验备案文件
21 主要研究者、参加研究者履历
6 临床前实验室资料(若有)
7 研究者手册、更新件(若有) 试验用医疗器械研制符合适用的医疗器械生产
8 质量管理规范声明
9 试验用医疗器械研制的质量保证和质量控制文件
10 试验用医疗器械合格检验报告
11 试验用医疗器械的自检报告
12 医学或实验室操作的质控证明(若有) 临床试验有关的实验室检测正常值范围、更新件
医疗器械临床试验归档资料交接单
项目名称:
负责人:
申 办 者:
试验起止时间:
编号
目录
资料状态(根据情况打×) 有(份数) 无 NA/不适用
备注
1 国家食品药品监督管理总局批件(若有)
2 临床试验申请表(若有)
3 伦理委员会审查意见、伦理委员成员表
4 申办者资质(生产许可证、营业执照)
5 委托文件(CRO、CRA 等委托书)
31 试验用医疗器械温湿度记录表
32 试验用医疗器械处理记录/销毁记录
33 已签名的知情同意书
34 受试者日志卡(已填写)
35 原始医疗文件(已填写,原始病历,注明日期)
36 病例报告表(已填写,签名,注明日期)
37 研究者对严重不良事件的报告(若有)
申办者对严重不良事件和可能导致严重不良事 38 件的器械缺陷的报告(若有)
