选修4影响化学反应速率的因素(一)
(人教版)化学选修四思维导图:2-2影响化学反应速率的因素(含答案)
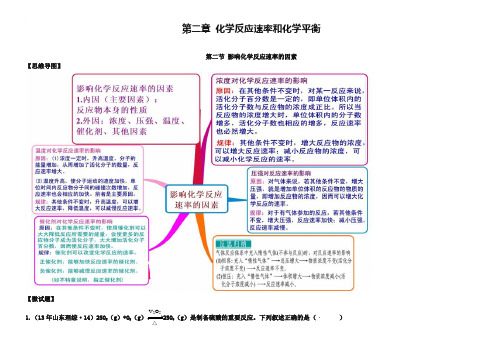
第二章化学反应速率和化学平衡第二节影响化学反应速率的因素【思维导图】【微试题】V2O51.(13年山东理综·14)2SO2(g)+O2(g)2SO3(g)是制备硫酸的重要反应。
下列叙述正确的是()△A .催化剂V 2O 5不改变该反应的逆反应速率B .增大反应体系的压强,反应速度一定增大C .该反应是放热反应,降低温度将缩短反应达到平衡的时间则时间间隔t 1~t 2内,SO 3(g )生成的平均速率为2121c c u t t -=- D .在t 1、t 2时刻,SO 3(g )的浓度分别是c 1,c 2,【答案】B2.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t 产生氢气体积v 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的试验组别可能是( )组别 c(HCl)(mol·L-1) 温度(℃) 状态1 2.0 25 块状2 2.5 30 块状3 2.5 50 粉末状 42.530粉末状A.4-3-2-1 B.1-2-3-4 C.3-4-2-1 D.1-2-4-3【答案】C3.把铝条放入盛有过量稀盐酸的试管中,不影响...氢气产生速率的因素是()A.盐酸的浓度 B.铝条的表面积 C.溶液的温度 D.加少量Na2SO4【答案】D4.(海南16分)下表是稀硫酸与某金属反应的实验数据:实验序号金属质量/g金属状态C(H2SO4)/mol·L-1V(H2SO4)/mL溶液温度/℃金属消失的时间/s反应前反应后1 0.10 丝0.5 50 20 34 5002 0.10 粉末0.5 50 20 35 503 0.10 丝0.7 50 20 36 2504 0.10 丝0.8 50 20 35[: 2005 0.10 粉末0.8 50 20 36 256 0.10 丝 1.0 50 20 35 1257 0.10 丝 1.0 50 35 50 508 0.10 丝 1.1 50 20 34 1009 0.10 丝 1.1 50 30 44 40分析上述数据,回答下列问题:(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);(3)本实验中影响反应速率的其他因素还有,其实验序号是。
第二课时《(鲁科版选修4)化学反应的速率》影响速率的因素(定稿)

外界 条件
作用规律实质
相关公式
注意
通常增大反应物浓 浓度 度可以提高化学反 应速率 温度 温度升高速率常数 增大反应速率提高
浓度对化学反应速率的影响
当其它条件不变时, 增大反应物的浓度,可以增大正逆反应的速率; 减小反应物的浓度,可以减小正逆反应的速率。
二、压强对化学反应速率的影响
对于气体参加的反应, 增大压强,可以增大反应的速率;
减小压强,可以减小反应的速率。
小结:当体系的压强改变时,是否 对反应速率产生影响,要看压强的 改变是否对体系内物质的浓度产生 影响,浓度改变了,速率才会随之改 变。即:
知识回顾及知识准备:
⑴有效碰撞: 能够发生化学反应的碰 撞叫做有效碰撞。
⑵活化分子: 能够发生有效碰撞的 分子叫作活化分子。
⑶活化能: 活化分子所多出普通分子的 那部分能量E1。 (4) 活化能越低,单位体积内活化分子 数越多,化学反应速率就会越快。
阿仑尼乌斯公式
k AeA 比例常数Ea RT实验编号
C(HI)/mol· -1 L C(H2O2)/mol· -1 L v /mol· -1· -1 L S
1
0.100 0.100 0.00760
2
0.200 0.100
3
0.300 0.100
4
0.100 0.200
5
0.100 0.300
0.0153 0.0227 0.0151 0.0228
化学人教版选修四影响化学反应速率的因素课件

可以加快化学反应速率;降低体系的压强,可以减慢化学反应速率 • 3.温度的影响:升高体系的温度可以加快化学反应速率;降低体系的温
度,可以减慢化学反应速率。
• 4.催化剂:使用催化剂同等程度的增大(减慢)正逆反应速率, 从而改变反应到达平衡所需时间。
2、由于固体、液体粒子间的空隙很 小,增大压强几乎不能改变它们的浓度,
因此对只有固体或液体参加的反应,压 强的变化对于反应速率的影响可以忽 略不计。
例题1
讨 恒容条件下,反应N2+3H2 2NH3 论 中充入He气,反应速率如何改变?
反应速率无变化!
He分子
注意!!
对于压强的改变,只有 引起反应体系中反应物浓度 的变化,才对反应速率产生 影响。改变压强,其实是改 变了反应物的浓度。
浓度增大 →单位体积内n总↑
T不变,活%不变
n活增大 →有效碰撞↑
反应物浓度增大,单位体积内活化分子数增多,
有效碰撞的频率增加,反应速率增大。
结论:其它条件不变时,增加反应物的 浓度,反应速率加快;反之,降 低反应物的浓度,反应速率减慢。
注意
对于纯固体或纯液体,其浓 度可视为常数,因而其物质的量 改变时不影响化学反应速率。
温度( )
B
A.①②④
B. ②③④
C.①③④
D. ①②③
练习2.下图为将Zn投入一定浓度一定体积的H2SO4中, 解释图象的成因。(纵坐标为H2的生成速率)
由图象可知氢气的生成速率随时间先由慢到快,然后又由快到慢 。反应体系中硫酸所提供的氢离子浓度是由大到小,若氢气的生成速 率由其决定速率的变化趋势也应由快到慢,反应前半程的原因只能是 温度所致,锌与硫酸反应时放热,体系温度逐渐升高,温度对反应速 率的影响占主导地位,一定时间后,硫酸的浓度下降占据主导地位, 因而氢气的生成速率随时间先由慢到快,然后又由快到慢。
人教版高中化学选修四导学案:2.2影响化学反应速率的因素

目标:(简洁、明确、概念、要点、规律)1.了解活化能、活化分子等概念,了解分子碰撞理论、过渡态理论等反应速率理论2.通过实验探究,掌握温度、浓度、压强和催化剂对化学反应速率的影响重点:用活化分子理论解释外界条件对化学反应速率的影响。
难点:用活化分子理论解释外界条件对化学反应速率的影响。
教学设计(知识系统化、问题化)一、化学反应速率模型1、有效碰撞:2、活化分子:3、活化能:二、影响化学反应速率的因素1、内因2、外因(一)浓度对化学反应速率的影响[实验2-2]在温度不变的情况下,L KMnO4 4mL酸性溶液与不同浓度的H2C2O4溶液反应的对比实验。
反应的化学方程式:教师寄语:海纳百川自强不息厚德笃学知行合一填写实验记录卡:【结论】:当其它条件不变时,增加反应物的浓度,可以反应的速率。
【原理】:在其他条件不变的条件下,增大反应物的浓度,单位体积内的数目增多,次数增多,化学反应速率。
反之,减小反应物的浓度,化学反应速率。
(二)、压强对化学反应速率的影响【结论】:对于有气体参加的反应来说,当温度一定时,增大体系的压力,反应速率会。
【原理】:对气体参与的反应,在一定的温度下,一定质量的气体所占的体积与压强成反比。
也就是说,在相同的温度下,压强越大,一定质量的体积就越,单位体积内气体的分子数越,活化分子的数目,有效碰撞次数,化学反应速率。
反之,压强越小,化学反应速率。
(三)、温度对化学反应速率的影响[实验2-3]10ml同浓度的Na2S2O3溶液分别在不同温度下与L的硫酸10ml反应的对比实验。
反应的化学方程式:填写课本上实验记录卡编号L的Na2S2O3L的H2SO4反应温度(℃)反应中出现浑浊的时间1 5ml 5ml 冷水2 5ml 5ml 热水实验结果: 温度的一组先出现浑浊。
【结论】:在其它条件不变的情况下,升高温度化学反应速率要,降低温度,化学反应速率要。
【原理】:.在其他条件不变的情况下,温度升高,反应物分子的增加,使一部分原来能量较低的分子变成,从而增加了反应物分子中的百分数,使的次数增多,因而化学反应速率。
高中化学选修四影响化学速率的因素

影响化学反应速率的影响因素【知识精讲深化思维】要点一:有效碰撞理论1、有效碰撞有效碰撞:能够发生化学反应(相互碰撞导致化学键断裂)的碰撞,是发生化学反应的充要条件;无效碰撞:不能发生化学反应(相互碰撞化学键不会断裂)的碰撞。
2、活化分子活化分子:具有较高能量,有可能发生有效碰撞的分子。
普通分子:具有较低能量,不能发生有效碰撞的分子。
3、活化能活化能:活化分子高出普通分子的能量;活化分子百分数:活化分子总数占分子总数的百分比。
例题1、下列说法中正确的是()①活化分子间的碰撞一定能发生化学反应②普通分子间的碰撞有时也能发生化学反应③活化分子比普通分子具有较高的能量④化学反应的实质是原子的重新组合⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程⑥化学反应的实质是活化分子有合适取向时的有效碰撞.A.①③④⑤B.②③⑥C.③④⑤⑥D.②④⑤解:①活化分子间有合适的取向,发生的碰撞一定能发生化学反应,故①错误;②普通分子间不可能发生化学反应,故②错误;③活化分子比普通分子具有较高的能量,故③正确;④化学反应的实质是旧键的断裂和新键的形成,即原子的重新组合,故④正确;⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程,故⑤正确;⑥化学反应的实质是旧化学键的断裂和新化学键的形成过程,即活化分子有合适取向时的有效碰撞,故⑥正确;故选:C。
变式训练1、下列说法正确的是()①参加反应的物质的性质是影响化学反应速率的主要因素②光是影响某些化学反应速率的外界条件之一③决定化学反应速率的主要因素是浓度④不管什么反应,增大浓度,或加热或加压,或使用催化剂,都可以加快反应速率.A.①②B.②③ C.③④ D.①④解:决定化学反应速率快慢的主要因素是反应物本身的性质,而浓度、温度、压强、催化剂是影响因素。
此外,还有固体物质的表面积,光,射线,溶剂性质等属于外因,也会影响化学反应速率,压强只对有气体参与的反应有影响。
故选:A。
高中化学 第二章 第二节影响化学反应速率的因素 新人教版选修4

表格中的各种情况,可以用下面对应选项中
的图像曲线表示的是(双选)( )
选项 A
B
C
D
反应 纵坐标 甲 乙 外形、大小相近的金 K Na 属和水反应 4 mL 0.01 mol· -1 L 0.1 mol· - 0.2 mol· -1 L L 的KMnO4溶液,分 1的H C O 别和不同浓度的 2 2 4 的H2C2O4溶 H2C2O4(草酸)溶液各 溶液 液 反应 2 mL反应 速率 5 mL 0.1 mol· - L 1Na S O 溶液和5 2 2 3 热水 冷水 mL 0.1 mol· - L 1H SO 溶液反应 2 4 5 mL 4%的过氧化氢 无MnO2粉 加MnO2粉 溶液分解放出O2 末 末
C.10 ℃ 10 mL 4 mol/L的X溶液
D.10 ℃ 10 mL 2 mol/L的X溶液
【解析】 分析本题,在其他条件不变的情 况下,比较速率大小,先比较浓度的大小。 此时,浓度必须是混合后的浓度,由于混合 后各烧杯中盐酸浓度相等,所以 X 的浓度最 大者反应最快,然后比较温度的高低。 20×3 A 项中,c(X)= =1.2 mol/L; 50
30×2 B 项中,c(X)= =1.2 mol/L; 50 10×4 C 项中,c(X)= =0.8 mol/L; 50 10×2 D 项中,c(X)= =0.4 mol/L。 50 由此可见,混合后 A、B 选项中 X 的浓度最 大,但是二者温度不同。A 项中为 10 ℃,B 项中为 20 ℃,故选项 B 中反应速率最大。
【思路点拨】
解题时注意以下三点:
(1)理解化学反应速率的影响因素。
(2)表格中各栏信息的意义。
(3)图像中x、y轴的含义及曲线的变化趋势。
选修4 第二章 第二节 影响化学反应速率的因素

左先群
本讲学习目标 1.影响可逆反应化学反应速率的因素 (内因、外因——浓度、温度、压强、 催化剂等)
一. 化学反应速率的影响因素 影响化学 反应速率 的因素 内因: 反应物本身的性质 外因: 浓度、温度、压强、 催化剂等
有效碰撞理论——活化分子的有效碰撞
反应速率的改变是单位体积内活化 分子数或百分率的改变引起的
温度升高,单位体积内的活化分子数增 加,单位体积内的活化分子百分率增大,反 应速率增大
催化剂 催化剂能降低反应所需的活化能 E
0.2 mol活 1 mol总 T V
0.8 mol活
E生 1 mol总Fra bibliotekE反T V t 使用催化剂,单位体积内的活化分子数 增加,单位体积内的活化分子百分率增大, 反应速率增大
c(Cl2)mol· L -1 1.0 1.0 4.0 υ(mol· L -1· s-1) 1.0k 2.0k 4.0k
㈢温度对化学反应速率的影响
在其他条件不变时,升高温度,化学 反应的速率加快;降低温度,化学反应 的速率变慢。 温度改变 温度每升高 对吸热反应 10℃反应速率要增 的影响较大 大到原来的2~4倍 υ υ 吸 △T
反应物浓度的关系是用实验方法测定的, 化学反应H2+Cl2=2HCl的反应速率可表 m n 示为υ=Kc(H2) · c(Cl2),式中K为常数,m、 n值可用下表中数据确定为( ) D c(H2 )mol· L -1 1.0 2.0 2.0 A.1 1 B.1/2 1/2 C.1/2 1 D.1 1/2
温度一定时,缩小体积使压强增大, 则浓度增大,反应速率增大 温度、体积一定时,通入反应物气 体,P(分压)增大,P(总压)增大,反应 物浓度增大,反应速率增大 温度、体积一定时,通入不相干气 体,P(分压)不变,P(总压)增大,反应 物浓度不变,反应速率不变
《影响化学反应速率的因素》(第1课时)说课稿

《影响化学反应速率的因素》(第1课时)说课稿(实用版)编制人:__________________审核人:__________________审批人:__________________编制单位:__________________编制时间:____年____月____日序言下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!并且,本店铺为大家提供各种类型的实用资料,如职业道德、时事政治、政治理论、专业基础、说课稿集、教资面试、综合素质、教案模板、考试题库、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor.I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, this shop provides you with various types of practical materials, such as professional ethics, current affairs and politics, political theory, professional foundation, lecture collections, teaching interviews, comprehensive qualities, lesson plan templates, exam question banks, other materials, etc. Learn about different data formats and writing methods, so stay tuned!《影响化学反应速率的因素》(第1课时)说课稿开场白:各位评委好,我是XXX号考生,今天我说课题目是《影响化学反应速率的因素(第1课时)》,下面开始我的说课,根据新课标理论我将以教什么,怎样教,为什么这样教为设计思路,从教材分析,学情分析,教学目标,教学重难点等几个方面进行说明,首先说一下我对教材的认识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Ⅱ在反应中保持体系容积不变,充入N2 ,反应的速率怎么变?
Ⅲ在反应中保持体系容积不变,充入He,反应的速率怎么变?
Ⅳ在反应中保持体系压强不变,充入He,反应的速率怎么变?
例:对于反应N +O =2NO在密闭容器中进行,下
2 2
列条件哪些不能加快该反应的化学反应速率(DE)
A、缩小体积使压强增大
B、体积不变充入 N2 使压强增大 C、体积不变充入 O2使压强增大 D、使体积增大到原来的2倍 E、体积不变充入氦气使压强增大
影响 外因 增大压强
单位体积内
分子总数 活化分子数
有效碰撞几率
化学反 应速率
增加
增加
增加
加快
结
论
其它条件不变时,有气体参加的反 应中,增大压强,反应速率加快;减小 压强,反应速率减慢。
压强对反应速率的影响 思考:在N2+3H2
2NH3中,当其他外界条件不变时:
Ⅰ减小体系压强,该反应的速率怎么变?
20141104上课
思考
某些化学反应的速率太快或太慢了 怎么办?
例:夏天时食物变质得太快了; 废弃的有机高分子材料降解速率太慢了;
控制一个反 应的快慢 如何控 制? 找到影响反应 快慢的因素
决定化学反应速率的主要因素
1、 在通常情况下,Na、Mg、Al与水的反应哪个剧 烈(反应速率快)?为什么?
实验2-2(P20)
2KMnO4+5H2C2O4+3H2SO4=2MnSO4+K2SO4+10CO2↑+8H20
现象: 加入浓度较大的H2C2O4(aq)的试管先褪色 结论: 在其他条件不变时,增大反应物浓度, 可以增大反应速率;减小反应物的浓度, 可以减小化学反应的速率。
浓度对反应速率的影响
影响 外因 增大浓度
一个反应经历的过程
普通 分子
活化 能
活化 分子
合理 取向的 碰撞
有效 碰撞
新物质
能量
n活=n总×活%
活化分子百分数: (活化分子数/反应物分子数)×100%
化学反应速率主要取决于: 有效碰撞频率
所有能够改变内能,运动速率,以及碰撞几率的方 法,都可以用来改变、控制反应的速率。
一、浓度对反应速率的影响
2、将等物质的量的碳酸钠与碳酸氢钠放入等体积等
浓度的盐酸中,产生CO2的速率哪个较快?为什么?
以上说明化学反应速率的决定因素是什么?
参加反应的物质本身的化学性质。
不同化学反应
决定于 决定于 温 度
反应物性质
同一化学反应
浓 度 压 强
反应条件 催 化 剂
其 他 因 素
【复习】外界件对某一个确定的反应的速率影响: 1、浓度 增大反应物或生成物的浓度,反应速率加快。 2、温度 升高体系温度,反应速率加快。 3、压强 增大压强(专指压缩体积方法),反应速率加快。 4、催化剂 使用(正)催化剂,反应速率加快。 5、其它条件
单位体积内
分子总数 活化分子数
有效碰撞几率
化学反 应速率
增加
增加
增加
加快
应用1:
一定条件下,在CaCO3(块状)+2HCl=CaCl2+H2O+CO2 反应中,为了加快反应的速率,下列哪些方法可行: A、增加HCl的浓度 C、增加同浓度盐酸的量 B、加水 D、改加CaCO3粉末
二、压强对反应速率的影响
【思考】
为什么对于一个确定的反应,改变条件反应速率会 发生相应的改变? 【研究方法】:控制变量法 建模法
物理学中对于多因素(多变量)的问题,常常采用 控制因素(变量)的方法,把多因素的问题变成多 个单因素的问题,而只改变其中的某一个因素,从 而研究这个因素对事物影响,分别加以研究,最后 再综合解决,这种方法叫控制变量法。它是科学探 究中的重要思想方法,广泛地运用在各种科学探索 和科学实验研究之中。也常用于化学实验探究中.
碰 撞 理 论
类比法:借鉴投篮
考点28页
没足够的能量
没合适的取向
足够的能量 +合适的取向
参考<考点>28页资料:
有效碰撞: 能够发生化学反应的碰撞。 活化分子:有可能发生有效碰撞的分子。 活化能: 活化分子所多出普通分子的那部分能量E1。 活化能和反应速率的关系: 活化能越低,单位体积内活化分子数越多, 化学反应速率就会越快。
