CTD制剂部分学习之——骨架篇
骨架型缓释制剂

醚萃取物
水分 铁
0.5~0.75
10~13 微量
各种高分子的粘度(1%水溶液)
种类 刺槐豆胶 甲基纤维素 粘度/cPa· s (25℃) 100 150
西黄蓍胶
角叉胶
200
300
羧甲纤维素(高粘度型)
皂皮胶
1200
1500
瓜耳胶
4200
第三节 骨架型制剂制备技术
片状骨架 颗粒状骨架 模铸骨架 其它
60 40 20 0 0 2 4 6 8
taxifolin silycristin silydianin isosilybin silybin erosion
10
12
14
Time (h)
水飞蓟素自GMS/PEG骨架的释放
第五节 药物释放动力学
Higuchi方程
Mt D(2c0 cs )cs t A
Mt K t M
Peppas方程,又称指数方程(power law)是综
合扩散和溶蚀作用的半经验方程。
Mt n kt M
不同几何形状骨架药物释放指数n及释放机制
薄膜 0.5 0.5<n<1.0 1.0 0.45 0.45<n<0.89 0.89 圆柱体 0.43 0.43<n<0.85 0.85 球体 释放机理 Fickian扩散 不规则转运 II相转运
t
基于果胶/钙在体交联的“S”释放
120
Percent indomethacin released (%)
100 80
89 n=
n=
40 20 0 0 2 4 6
Time (h)
n=
1.
20
60
膜控型和骨架型缓控释制剂

流化床包衣法 流化床包衣法即空气悬浮法制丸和包衣,通常以空
白小丸为基核采用底喷方式,这种方法可用于可溶解或
可分散于上衣材料的药物制丸,这比离心-流化制丸方 法方便、圆整,损耗小,利于工业生产。并适用于水溶
性或水分散体缓释材料的包衣,如Aquacoat 和
Surelease,配方中有适量增塑剂。必要时可加入适 量致孔剂。(见附图)
压 片
制 粒
பைடு நூலகம்
搅 拌 混 合
微晶纤维素 乳糖 滑石粉
3.不溶性骨架片 辅料:聚乙烯、聚丙烯、聚氯乙烯类材料 释药:消化液渗入,溶解药物,孔道扩散 制备:有机溶剂制粒压片,直接压片
2.膜控型缓释、控释制 (主要是用于水溶性药物)
(1)微孔膜包衣片 (2)膜控释小片 (3)肠溶膜控释片 (4)膜控释小丸
骨架型缓控释给药系统
亲水性凝胶骨架片
辅料:甲基纤维素(MC)、羟丙甲纤维素 (HPMC)、卡伯母(HPC)、羧甲基纤维 素(CMC) 释药机理:扩散(水溶性药物)
释药速率:取决于高分子粘度及浓度里
阿米替林缓释片 阿米替林 50mg 枸橼酸 10mg 羟丙甲纤维素HPMC( K4M) 乳糖 180mg 硬脂酸 2mg 乙醇
新康泰克小丸结构
聚合物缓释包 衣层 基丸 药物层 色衣层
新康泰克膜控小丸结构
新康泰克药物体内释放柱型图
Q (%)
16 14 12 10 8 6 4 2 0 1 2 3 4 5 6 7 8 9 10 11 12 药物释放百分比
t(h)
药物体内释放柱型图
1961年— “康泰克”在美国上市,先进的“时 控小丸,缓释技术”已经成为独特的卖点。 1966年—“康泰克600”以服一粒药12小时有效 的宣传核心正式在日本上市。 1988年—“康泰克”进入中国,成为中国第一个 感冒药合资品牌。 现在康泰克已经开始实现流化床一步制粒了。
骨架型缓释制剂解析

优级粉状羟丙甲纤维素,15000 特级(控释用)粉状羟丙甲纤维素,15000
优级粉状羟丙甲纤维素,100000 特级(控释用)粉状羟丙甲纤维素,100000
瓜耳胶(guar gum)又称愈创木胶,是由印度、巴基斯坦的干燥地 带栽培的一年生豆科植物瓜耳豆种子的胚乳部分经干燥研磨加压水 解后用20%乙醇沉淀,离心分离后经干燥、粉碎而制得的一种天然 胶
75/75 (pectin/NaCl)
20
75/0 (pectin)
0
0
2
4
6
8
10 12
Time (h)
皂皮胶
1500
瓜耳胶
4200
第三节 骨架型制剂制备技术
片状骨架 颗粒状骨架 模铸骨架 其它
第四节 骨架控释原理
扩散原理 不溶性骨架在遇水后,水向骨架渗透,溶解后药物通 过骨架中许多弯弯曲曲的孔道扩散至骨架表面而释放。 药物的释放符合Higuchi方程,即释放量与时间的平方 根呈正比。 溶蚀原理 释药是外层表面的磨蚀-分散-溶出过程。 亲水凝胶骨架的控释原理
等级外观,粘度/10-9Pa·s
优级粉状羟丙甲纤维素,3 优级粉状羟丙甲纤维素,5 优级粉状羟丙甲纤维素,6 优级粉状羟丙甲纤维素,15 优级粉状羟丙甲纤维素,50 特级(控释用)粉状羟丙甲纤维素,4000
特级(控释用)粉状羟丙甲纤维素,10000
优级粉状羟丙甲纤维素,100 特级(控释用)粉状羟丙甲纤维素,100
Mt/M Higuchi
n=0.5 n=1
Zero-order n>1.0
Sigmoidal
t
基于果胶/钙在体交联的“S”释放
药物结构中常见的化学骨架及名称

《药物结构中常见的化学骨架及名称》在药物化学领域,药物结构可以说是药物研究的基础,而药物结构中的化学骨架则是构成药物分子的基本框架,对药物的活性、代谢、药效和副作用等都有着重要的影响。
本文将对药物结构中常见的化学骨架及名称进行深入探讨,以便读者更好地理解药物结构的重要性和药理学的基础知识。
1. 芳香族环在许多药物结构中,芳香族环是一种常见的化学骨架。
芳香环具有稳定性高、反应性低的特点,因此在药物分子中起着重要的作用。
例如苯环、噻吩环、吡啶环等都是常见的药物结构中的芳香族环。
这些芳香族环的存在往往决定了药物分子的结构和性质,对药物的活性具有重要的影响。
2. 羧酸和酯另一个常见的药物结构中的化学骨架是羧酸和酯。
羧酸和酯是含氧功能团,它们在药物分子中常常起到增强药物溶解度、改变药物代谢和稳定药物分子等作用。
例如阿司匹林中的羧酸结构是其抗炎和镇痛作用的重要基础。
3. 环状结构环状结构也是药物结构中常见的化学骨架之一。
环状结构的存在可以增加药物分子的稳定性和立体构象,对药物的活性和选择性具有重要的影响。
如环状肽类药物、环烷烃类抗生素等都包含有环状结构,这些环状结构对药物的生物利用度和药效有着重要的作用。
总结回顾通过对药物结构中常见的化学骨架及名称的探讨,我们可以看到药物分子的多样性和复杂性。
不同的化学骨架决定了药物分子的性质和功能,进而影响着药物的临床应用和药理效应。
在今后的研究和开发中,我们需要更加深入地理解药物结构中的化学骨架,以便设计出更加安全有效的药物分子。
个人观点和理解作为一名药物化学研究者,我对药物结构中化学骨架的重要性深有体会。
在药物研发过程中,理解各种化学骨架的特点和相互作用,对于设计新药和改良老药具有重要的指导意义。
这也是我在研究中不断努力的方向,希望能够为药物研究和临床应用做出更大的贡献。
通过这篇文章,希望读者能够更加深入地了解药物结构中常见的化学骨架及名称,以便在药物领域进行更加有针对性和深入的研究和应用。
骨架型与储库型芬太尼透皮贴剂

药代动力学研究表明,单次给药的骨架扩散型与储库型芬太尼透皮贴剂具有相同
的疗效,芬太尼的血药浓度在下降前可以维持12~24小时。骨架扩散型芬太尼透 皮贴剂药代动力学研究表明,多次重复给药的血清峰浓度相似,曲线下面积也相似。
值得关注的是,骨架扩散型芬太尼透皮贴剂达到峰浓度的时间比储库型快4~8小 时,疗效持续时间长达72小时,且前者在不同人种的试验中具有相同的疗效。芬太尼 药代动力学研究的进一步表明,多种剂量的骨架扩散型芬太尼透皮贴剂具有生物等效 性,患者可以很轻松地根据镇痛的需要改变剂量。与储库型芬太尼透皮贴剂相比较, 这种新的剂型更小、更薄,弹性及黏附性更好,使用更方便,从而改善了患者对治疗 的依从性,提高了临床治疗疗效,特别适合长期的慢性持续性疼痛的治疗。
首页 医院介绍 新闻中心 临床医疗 科研教学 肿瘤科普 医院文化 药学园地 护理天地 释疑解惑 联系我们
用药指南
肿瘤药房 用药指南 不良反应 政策与法规
当前位置:汕头大学医学院附属肿瘤医院 >> 药学园地 >> 用药指南 >> 浏览文章
骨架型与储库型芬太尼透皮贴剂(多瑞吉)
CTD制剂部分学习之——骨架篇

CTD制剂部分学习之——⾻架篇CTD格式申报资料提交要求(药学部分:制剂——⾻架篇)⽬录内容CCTD (China) CTD (ICH)3.2.P.1 剂型及产品组成Description and Composition of the Drug Product (name, dosage form)3.2.P.2 产品开发Pharmaceutical Development3.2.P.2.1 处⽅组成Components of the Drug Product3.2.P.2.1.1 原料药Drug Substance3.2.P.2.1.2 辅料Excipients3.2.P.2.2 制剂Drug Product3.2.P.2.2.1 处⽅开发过程Formulation Development3.2.P.2.2.2 制剂相关特性Overages3.2.P.2.2.3 Physicochemical and Biological Properties3.2.P.2.3 ⽣产⼯艺开发Manufacturing Process Development3.2.P.2.4 包装材料容器Container Closure System3.2.P.2.5 相容性Microbiological attributes3.2.P.2.6 Compatibility3.2.P.3 ⽣产Manufacture3.2.P.3.1 ⽣产商Manufacturer(s)3.2.P.3.2 批处⽅Batch Formula3.2.P.3.3 ⽣产⼯艺和⼯艺控制Description of Manufacturing Process and Process Controls3.2.P.3.4 关键步骤和中间体的控制Controls of Critical Steps and Intermediates3.2.P.3.5 ⼯艺验证和评价Process Validation and/or Evaluation 3.2.P.4 辅料控制Control of Excipients3.2.P.4.1 Specifications3.2.P.4.2 Analytical procedures3.2.P.4.3 Validation of analytical procedures3.2.P.4.4 Justification of specifications3.2.P.4.5 Excipients of human or animal origin3.2.P.4.6 Novel excipients(ref to A 3)3.2.P.5 制剂控制Control of Drug Product3.2.P.5.1 质量标准Specifications3.2.P.5.2 分析⽅法Analytical procedures3.2.P.5.3 分析⽅法验证Validation of analytical procedures3.2.P.5.4 批检验报告Justification of specifications3.2.P.5.5 杂质分析Characterisation of Impurities3.2.P.5.6 质量标准依据Justification of Specification(s)3.2.P.6 对照品Reference Standards or Materials 3.2.P.7 Container closure system3.2.P.8 稳定性Stability3.2.P.8.1 稳定性总结Stability Summary and Conclusion3.2.P.8.2 上市后稳定性研究⽅案和承诺Post-approval Stability Protocol andStability3.2.P.8.3 稳定性数据Stability Data个⼈定义CTD:ICH的要求,英⽂⽔平所限,仅罗列上,没有核对。
亲水骨架片的配方与设计

亲水骨架片的配方与设计孙霞,于海春,张莉,杨继荣,刘瑞明上海卡乐康包衣技术有限公司口服给药已经成为最普遍最受欢迎的给药途径。
调查显示,它也是新药及新制剂研发过程中最优先使用的给药途径。
口服途径的流行得益于它的如下优势:病人易接受,容易给药,剂量准确,生产成本较低且通常产品的有效期较长。
对于大多数药物来说,传统的多剂量给药的速释制剂也可以提供满意的临床疗效,并能够在疗效和安全性之间进行适当的平衡。
开发缓释制剂是为了提高药物的治疗效果,在控制疾病的同时将副作用减少到最低。
除了临床上的优势,创新的缓释制剂还能为制药企业提供控制其产品生命周期的机会。
本文将重点讨论骨架系统(片剂),这一缓释制剂工业生产中常用的方法。
这里还将阐述构成骨架的不同聚合物材料的选择以及配方,及生产中的变量对缓释制剂设计和性能的影响。
定义美国药典(USP)是这样定义缓控释(MR)制剂的,“可以选择性地改变药物释放的时间和/或部位以达到治疗或使用方便等目的的制剂,且这些是传统制剂如溶液剂,软膏剂或速释制剂无法达到的”。
其中一类缓控释制剂是缓释制剂,它的定义为“和现有的传统制剂(溶液剂或速释制剂)相比,给药频率减少一半或者显著提高患者顺应性或治疗效果的制剂”。
现在市场上几乎所有口服缓释制剂都属于下列两类技术:1. 亲水、疏水或中性骨架系统:由控制释放速率的骨架材料组成,药物即通过此材料溶出或分散出来。
2. 储库(包衣)系统:在此系统中,高分子包衣材料包裹含药芯材。
根据所用高分子材料的不同,储库系统可分为两种类型:(a)简单的扩散/溶蚀系统:该系统的含药芯材包裹于亲水或水溶性的高分子包衣材料中。
药物的释放通过包衣材料的扩散或者高分子材料溶蚀后实现。
(b)渗透泵系统:该系统的药芯包含在一层半透膜中,为了药物释放,该膜上有机械或激光打的小孔。
药物的释放通过药芯产生的渗透压实现。
缓释口服给药系统:亲水骨架片在缓释剂型中,制备骨架片是最简单和最有成本效益的方法。
骨架片
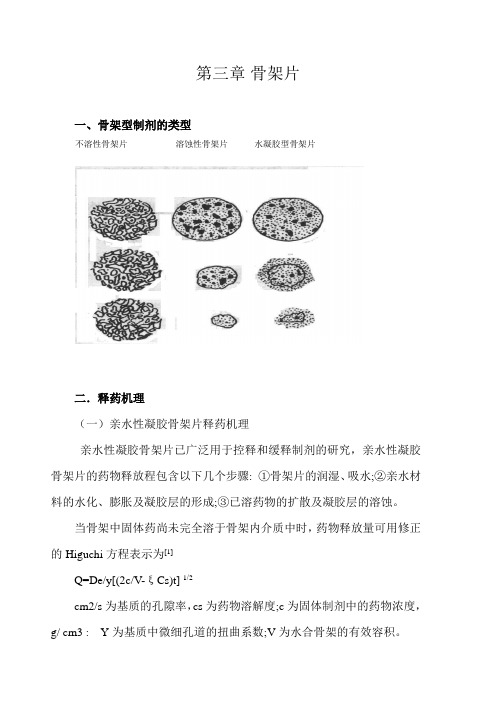
第三章骨架片一、骨架型制剂的类型不溶性骨架片溶蚀性骨架片水凝胶型骨架片二.释药机理(一)亲水性凝胶骨架片释药机理亲水性凝胶骨架片已广泛用于控释和缓释制剂的研究,亲水性凝胶骨架片的药物释放程包含以下几个步骤: ①骨架片的润湿、吸水;②亲水材料的水化、膨胀及凝胶层的形成;③已溶药物的扩散及凝胶层的溶蚀。
当骨架中固体药尚未完全溶于骨架内介质中时,药物释放量可用修正的Higuchi方程表示为[1]Q=De/y[(2c/V-ξCs)t] 1/2cm2/s为基质的孔隙率,cs为药物溶解度;c为固体制剂中的药物浓度,g/ cm3 : Y为基质中微细孔道的扭曲系数;V为水合骨架的有效容积。
若骨架中药物能完全溶解子水化凝胶层,则药物的释放量可用如下简化式表示Q=2C0/v[De/y]式中C0为骨架中药物溶液的浓度。
实际上药物从亲水性凝胶骨架中的释放一般通过两种机制(药物扩散和凝胶骨架的溶蚀)综合效应的过程.如果药物在水中溶解度较大,其释放机理主要是活性成分的扩散和凝胶层的不断溶蚀。
如果药物属水中难溶物,缓释机理主要表现在凝胶层的溶蚀过程中。
但其释药讨释均符合卜述动力学过程。
一般情况下,药物从骨架片中的释放机制可通过Peppas经验式来描述[2]:W=kt n式中,W为药物在t时间的累积释放分数,k为释放速率常数,释放指数。
是表征释放机制的特征参数。
对于圆柱形制剂(如片剂)而言,当0.45<n<0. 89时,药物释放机制为非Fick扩散(即药物扩散和骨架溶蚀协同作用);当。
n<0.45时,为Fick扩散;当n>0.89时,为骨架溶蚀机制。
上式可进一步转化为lnW=nlnt+c式中,c=nk。
用药物整个释放过程的数据对式(6-20)进行拟合得到的。
值可把药物的释放过程描述为某一种释放机制。
其实,亲水骨架材料的水化、凝胶层的形成是一个时间过程,因而亲水性凝胶骨架片在不同的时间段很可能具有不同的药物释放机制。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CTD格式申报资料提交要求(药学部分:制剂——骨架篇)目录内容CCTD (China) CTD (ICH)3.2.P.1 剂型及产品组成Description and Composition of the Drug Product (name, dosage form)3.2.P.2 产品开发Pharmaceutical Development3.2.P.2.1 处方组成Components of the Drug Product3.2.P.2.1.1 原料药Drug Substance3.2.P.2.1.2 辅料Excipients3.2.P.2.2 制剂Drug Product3.2.P.2.2.1 处方开发过程Formulation Development3.2.P.2.2.2 制剂相关特性Overages3.2.P.2.2.3 Physicochemical and Biological Properties3.2.P.2.3 生产工艺开发Manufacturing Process Development3.2.P.2.4 包装材料容器Container Closure System3.2.P.2.5 相容性Microbiological attributes3.2.P.2.6 Compatibility3.2.P.3 生产Manufacture3.2.P.3.1 生产商Manufacturer(s)3.2.P.3.2 批处方Batch Formula3.2.P.3.3 生产工艺和工艺控制Description of Manufacturing Process and Process Controls3.2.P.3.4 关键步骤和中间体的控制Controls of Critical Steps andIntermediates3.2.P.3.5 工艺验证和评价Process Validation and/or Evaluation 3.2.P.4 辅料控制Control of Excipients3.2.P.4.1 Specifications3.2.P.4.2 Analytical procedures3.2.P.4.3 Validation of analytical procedures3.2.P.4.4 Justification of specifications3.2.P.4.5 Excipients of human or animal origin3.2.P.4.6 Novel excipients(ref to A 3)3.2.P.5 制剂控制Control of Drug Product3.2.P.5.1 质量标准Specifications3.2.P.5.2 分析方法Analytical procedures3.2.P.5.3 分析方法验证Validation of analytical procedures3.2.P.5.4 批检验报告Justification of specifications3.2.P.5.5 杂质分析Characterisation of Impurities3.2.P.5.6 质量标准依据Justification of Specification(s) 3.2.P.6 对照品Reference Standards or Materials3.2.P.7 Container closure system3.2.P.8 稳定性Stability3.2.P.8.1 稳定性总结Stability Summary and Conclusion3.2.P.8.2 上市后稳定性研究方案和承诺Post-approval Stability Protocol andStability3.2.P.8.3 稳定性数据Stability Data个人定义CTD:ICH的要求,英文水平所限,仅罗列上,没有核对。
CCTD:中国式CTD,主要来自CDE发布的讨论稿模板,和重庆培训的相关内容。
申报资料正文及撰写要求3.2.P.1 剂型及产品组成CTDA description of the drug product and its composition should be provided. The information provided should include, for example:∙Description1 of the dosage form;∙Composition, i.e., list of all components of the dosage form, and their amount on a per-unit basis (including overages, if any) the function of the components, and a reference to their quality standards (e.g., compendial monographs or manufacturer’s specifications)∙Description of accompanying reconstitution diluent(s); and∙Type of container and closure used for the dosage form and accompanying reconstitution diluent, if applicable.Reference ICH Guidelines: Q6A and Q6BCCTD:(1) 说明具体的剂型,并以表格的方式列出单位剂量产品的处方组成,列明各成份在处方中的作用,执行的标准。
如有过量加入的情况需给予说明。
对于处方中用到但最终需去除的溶剂也应列出。
1For a drug product supplied with reconstitution diluent(s), the information on the diluent(s) should be provided in a separate part “P”, as appropriate(2) 如附带专用溶剂,参照以上表格方式列出专用溶剂的处方。
(3) 说明产品所使用的包装材料及容器。
举例:3.2.P.2 产品开发CTD:The Pharmaceutical Development section should contain information on the development studies conducted to establish that the dosage form, the formulation, manufacturing process, container closure system, microbiological attributes and usage instructions are appropriate for the purpose specified in the application. The studies described here are distinguished from routine control tests conducted according to specifications. Additionally, this section should identify and describe the formulation and process attributes (critical parameters) that can influence batch reproducibility, product performance and drug product quality. Supportive data and results from specific studies or published literature can be included within or attached to the Pharmaceutical Development section. Additionalsupportive data can be referenced to the relevant nonclinical or clinical sections of the application.Reference ICH Guidelines: Q6A and Q6BCCTD提供相关的研究资料或文献资料来论证剂型、处方组成、生产工艺、包装材料选择和确定的合理性,具体为:应包含为了确定剂型、处方、生产工艺、直接接触药品的包装容器而开展的研究工作;应确定并描述可影响批次可重复性、产品性能和药品质量的处方和工艺特性(关键参数);特定研究或已发表文献的支持性数据和结果可列入此章节内或附于此章节;其他支持性数据可参考申报资料相关非临床或临床章节。
3.2.P.2.1 处方组成3.2.P.2.1.1 原料药CTD:The compatibility of the drug substance with excipients listed in 3.2.P.1 should be discussed. Additionally, key physicochemical characteristics (e.g., water content, solubility, particle size distribution, polymorphic or solid state form) of the drug substance that can influence the performance of the drug product should be discussed.For combination products, the compatibility of drug substances with each other should be discussed.CCTD:参照《化学药物制剂研究的技术指导原则》,提供资料说明原料药和辅料的相容性,根据药物稳定性、拟考察的制备工艺,选择可靠的分析方法,有针对性的进行研究。
复方制剂还要说明两种成分的相容性,根据药物特性,剂型特点选择工艺制备方法,如混合制粒还是分开制粒。
分析与制剂生产及制剂性能相关的原料药的关键理化特性晶型溶解性:不同pH、不同溶剂;结合渗透性了解药物的生物药剂学分类(BCS)吸湿性粒度分布粒度与制剂工艺、溶出或释放行为、生物利用度,进行批汇总分析。
