大电流密度下铬电极析氢行为(1)
【镀铬标准】电镀工艺的规范--镀铬工艺镀铬标准

【镀铬标准】电镀工艺的规范--镀铬工艺镀铬标准【镀铬标准】电镀工艺的规范--镀铬工艺镀铬标准话题:镀铬标准休闲阅读催化剂的作用协同作用镀铬四、规范镀铬工艺铬面是凹版制版公司的一张脸面,可以直接为公司赢得客户的信赖。
光洁的铬面,超凡的耐印力,令人满意的刮刀消耗,无不对客户产生着巨大的吸引力。
镀铬层印刷时直接与承印材料接触,要能有效地保护铜层不被刮伤、刮坏,因此,要求铬层要达到一定的硬度。
铬层的高硬度和表面硬度均匀是提高凹版滚筒耐印力的关键,如果印数达到50万印,则铬层硬度在HV750,HV950、耐印力在80万,100万次为佳。
目前业内普遍采用镀硬铬工艺,有的公司还采用瑞士镀铬工艺,以保证铬层有很高的硬度、很好的耐磨性及化学稳定性,从而提高印版滚筒的耐印力,使其能够承受刮墨刀及油墨中颜料的频繁摩擦。
当前全国各地凹版制版公司都深深感受到镀铬质量是个永远的问题,是造成返工的一个主要因素。
影响镀铬质量的因素很多,也很复杂,铬层硬度与温度、电流密度、铬酐及硫酸的含量有着密切关系。
归纳一下,笔者认为主要有三大影响因素:一是导电性不良,二是镀铬液不稳定,三是清洗不干净,还有些公司虽然制定了质量标准和控制数据,但员工在执行时不认真,不严格,造成返工。
因此,必须强化管理,严格管理。
(一)镀铬工艺流程雕刻好滚筒?检查(合格)?装配?滚筒清洗?镀铬?抛光?自检(合格)?交总检(不合格退铬)。
(二)镀铬的基本原理镀铬液中铬酸一般以重铬酸形式存在(H2Cr2O7),在浓度很高的镀铬液中可以三铬酸(H2Cr3O10)和四铬酸(H2Cr4O13)的形式存在。
当镀液中只有铬酸而无硫酸等催化剂存在时,通入直流电,阴极上只有氢气析出,没有铬层沉积,相当于电解水。
加入适当的硫酸催化剂后(CrO3?H2SO4=100?1),在阴极上依次发生下列反应:Cr2O72-,8H+ +6e ? Cr2O3+4H2O ?2H,,2e ? H2? ?Cr2O72-+ H2O2CrO42-+2H+ ?CrO42-+ 8H+ +6e ? Cr?+4H2O ?由以上反应可知,镀铬的阴极反应是很复杂的。
第4章--析氢腐蚀与耗氧腐蚀
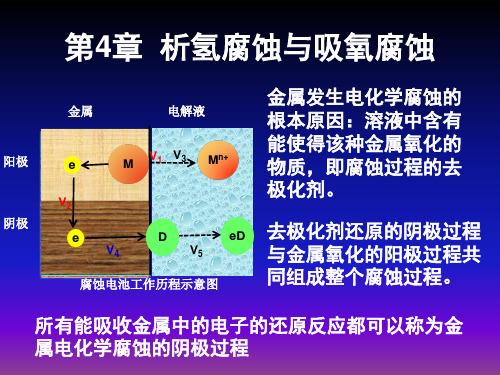
溶液组成和温度有关; b’:与电极材料无关。
(2)当阴极极化电流密度增大, 阴极电位由电化学极化与氧的扩散过程混合控 制( PF),过电位与电流密度ic间的关系为
• 有两种复合方式: – A 化学脱附:
2Had →H2 两个吸附氢原子进行化学反应 而复合成一个氢分子 – B 电化学脱附: Had + H++ e → H2 由一个H+离子与一个Had原子 进行电化学反应形成一个氢分子
(4)H2分子形成气泡离开电极表面
•决定析氢反应动力学行为的步骤: (1)电化学步骤(放电反应) (2)复合步骤 A:化学脱附, B:电化学脱附
约在0.11~0.12V之间。
影响析氢过电位的因素
• 电极材料 • 表面状态
– 粗糙表面<光滑表面 – 粗糙表面有效面积更大 • 溶液pH – 酸性溶液,pH增加, ηH增加 – 碱性溶液, pH增加, ηH 减小 • 溶液组成 – 含有表面活性物质,ηH增加 • 温度 – 温度增加1℃, ηH 减小2mV
5、析氢腐蚀的控制过程
(1)阴极控制的析氢腐蚀
指阴极析氢反应的极化率大于 阳极溶解反应的极化率。
析氢腐蚀速率受氢在阴极上放 电的析氢过电位所控制。此时, 金属电极的腐蚀电位Ecorr接 近金属阳极反应的平衡电位EMe。 例如金属锌在酸中的腐蚀,即 属于此类。
(2)阳极控制的析氢腐蚀
金属阳极溶解反应的极化率大于阴极析氢反应 的极化率,析氢腐蚀速率受阳极溶解的过电位 所控制。 – 金属离子必须穿透氧化膜
2.氧去极化过程的基本步骤
析氢反应机理[专业类别]
![析氢反应机理[专业类别]](https://img.taocdn.com/s3/m/257046755727a5e9856a6183.png)
1
e
e0
RT F
ln[ H
]
H
常数
2RT F
ln
IK
RT F
ln[ H
] 1
H
pH
I ,1
H
lg[
H
]
I
,
1
2.3RT F
59mV
精制课件
25
但对其它的金属电极,我们不能仅根据实 验测得的b值是118mV,29.5mV或39 mV就简单地推断在此金属上析氢反应的 机理。
因为上述的电化学极化方程对电极材料有 一定要求。例如:金属对氢的吸附要十分 微弱。
精制课件
32
开发直接甲醇燃料电池的主要困难:
首先是甲醇氧化反应的电化学催化.即使采用铂 催化剂,这一电池的工作电压也只有0.4~0.5V (1.21V),只有理论电动势的35%~40%,导 致电池系统的实际比能量严重降低.
其次是甲醇往往能透过电解质层达到阴极(正极) 表面,称为甲醇的“穿越”(crossover).这一 现象不仅会引起甲醇的额外损耗,还常引起空气 电极的催化剂中毒,使电池的工作电压进一步降 低.
由于中超电位和低超电位电极上H析出复杂,处 理也要小心。
精制课件
27
金属材料的防护中,常采用缓蚀剂,降 低析氢速度,借此减低金属溶解速度。
但不是任何能增大H过电位的添加剂都能 用作“缓蚀剂”。
精制课件
28
6.2 氢氧化反应的电催化
阳极氧化反应机理应与阴极还原机理相同,只是进行方向相反而已。 根据对氢气析出反应机理的认识,不难得出氢气的阳极氧化反应历程 包含如下步骤:
H
2.3RT
nF
log i0
2.3RT
析氢现象及其危害

析氢现象及其危害本篇针对我司产品加工工艺特点,简单概述了原材料在冶金、锻造、电镀和焊接过程中的析氢现象,主要分析了氢产生的原因、危害及除氢方法,为生产提供一定的参考。
一、原因1.冶炼⑴炉料带入。
由废钢、生铁、铁合金及造渣材料等炉料中固有的氢以及炉料中的水分分解产生的氢溶入钢中。
⑵由炉气带入。
炉气中的水、氢气等都经过炉渣或直接与钢液接触而溶入钢中。
⑶由钢包、钢锭模以及保温冒的耐火材料带入。
⑷由大气带入。
大气铸锭时,空气中的水蒸气、氢气与钢液接触而溶入钢中。
2.电镀在电镀过程中,由于水分子的离解,总是或多或少地存在一定数量的氢离子,在电极的作用下,一部分就会从阴极析出氢气逸出,一部分以原子氢的状态渗入基体金属及镀层中。
具体的析氢过程如下:⑴H3O+从溶液中转移到阴极表面附近;⑵H3O+在阴极上脱水还原,生成的氢离子吸附在电极表面H3O+→H++H2O⑶两个吸附的氢原子结合成氢分子H++H+→H2⑷氢分子聚合成小气泡,并逐渐长大,最后离开电极表面而逸出。
3.焊接⑴焊条⑵母材⑶不干燥的保护气体(4) 空气湿度较大(5) 焊前未除油去污二、危害1.冶金⑴白点:在钢材横向断口上,主要表现为放射性或不规则排列的锯齿形小裂缝(有时也叫发裂);在纵向断口上,有圆形或椭圆形的银白色斑点。
它是锻件在冷却过程中产生的一种内部缺陷,它的存在对钢的性能极为不利。
在交变和重复载荷作用下,白点处为应力集中点,常常成为疲劳源。
白点的产生是由于钢中氢和组织应力共同作用的结果。
目前关于氢致白点有以下几种解释:①钢中含有氢时,使钢的塑性降低。
当氢含量达到某一数值时,塑性急剧下降,造成氢脆现象。
②炼钢时钢液中吸收的氢,在钢锭凝固时因溶解度减少而析出。
有些氢来不及扩散到钢锭表面而存在钢锭内部显微空隙处、夹杂物附近或晶界上的小孔中。
氢原子在该处易结合成分子状态,并产生压力。
另外氢与钢中的碳反应易形成甲烷(CH4),也造成较大的分子压力。
③钢坯在冷却过程中因冷却速度等因素使相变产生较大的组织应力,在钢中氢脆的地方,将发生脆性破裂。
Ni_AC电催化剂在中性溶液中的析氢电催化性能[1]
![Ni_AC电催化剂在中性溶液中的析氢电催化性能[1]](https://img.taocdn.com/s3/m/7b251c7a1711cc7931b71633.png)
(a) Active carbon; (b) Ni/AC electro-catalyst 图 2 Ni/AC 电催化剂的 XRD 图 Fig.2 XRD patterns of the Ni/AC electro-catalyst
图 3 镍电极和 Ni/AC 膜电极塔菲尔曲线 Fig.3 Tafel curves of the Ni and Ni/AC electrodes
α 0.979 0.685
b/V 0.148 0.146
Region Ⅰ β
0.396 0.404
i0 / (μA·cm-2) 0.269 20.334
Region Ⅱ
α
b/V
β
1.535
0.468
0.126
镍电极的 Tafel 曲线在整个研究的高过电位区 都是一条直线,其斜率为 148 mV,根据一般的 HER 机理[9,10],如果电子转移步骤是速度控制步骤,Tafel 斜率 b 值为 120 mV 左右,若速度控制步骤为电化 学脱附步骤,Tafel 斜率 b 值为 40 mV 左右,因此,镍 电极在中性 NaCl 溶液中的 HER 的速度控制步骤 为电子转移步骤。从图 3 可以明显的看出,Ni/AC 膜 电极的 Tafel 曲线分两段,Ⅰ段:0.318 V≤η≤0.456 V,Ⅱ段:0.120 V≤η≤0.288 V;Ⅰ段的 Tafel 斜率 b 值为 0.146 V,与镍电极的 Tafel 斜率 0.148 V 相近, 所以与镍电极一样其速度控制步骤为电子转移步 骤。Ⅱ段的 Tafel 斜率 b 值为 0.468 V,与 HER 的速 度控制步骤为电子转移步骤的 b 值 0.120 V 和电化 学脱附步骤的 0.04 V 都相差较大,其具体的机理目 前还不清楚。 2.3 Ni/AC 膜电极的电化学交流阻抗(EIS )分析
[物理]第四章析氢腐蚀与吸氧腐蚀
![[物理]第四章析氢腐蚀与吸氧腐蚀](https://img.taocdn.com/s3/m/77bcf7d2ba4cf7ec4afe04a1b0717fd5360cb2f7.png)
★和析氢腐蚀一样,对吸氧腐蚀影响因素的讨论 也只局限在电极反应,而没有涉及腐蚀过程的 产物。如金属氧化物、氢氧化物或更复杂化合 物(如铁锈)。它们在金属表面形成膜,必然对 腐蚀过程造成重大影响。
4、影响吸氧腐蚀的因素
★氧极限扩散电流密度id为:
3、吸氧腐蚀的控制过程及特点
1)如果腐蚀金属在溶液中的电位较正,腐蚀过程 中氧的传递速度又很大,则金属腐蚀速度主要由 氧在电极上的放电速度(吸氧阴极反应速度)决 定,属于活化极化控制。
2)如果腐蚀金属在溶液中的电位非常负,如Zn、 Mn等,阴极过程将由氧去极化(吸氧反应)和 氢离子去极化(析氢反应)两个反应共同组成。
几种钢的氧扩散控制腐蚀速度
钢
的
腐
热处理的影响
蚀
0.39
冷拉,500oC退火
0.39
900oC正火20分
0.39
850oC淬火
各试样在300oC~800oC回火
2Had H2
3)H2分子聚集形成气泡离开电极表面。
由于反应途径和控制步骤不同,其反应动力 学机制就会不同。
如果某一步骤进行得较缓慢,就会使整个氢 去极化反应受到阻滞,由阳极来的电子就会在阴 极积累,使阴极电位向负方向移动,产生一定的 析氢过电位H。
研究表明,第一步是整个电极反应最慢的步 骤。
4、析氢腐蚀的阴极H+ 还原反应的动力学特征
5、析氢腐蚀的影响因素
★溶液方面
1)pH值 溶液pH值对析氢腐蚀速度影响很大,随pH值下降,
腐蚀速度迅速增大。 pH值下降造成两方面的影响。一 方面pH值下降使析氢反应平衡电位Eec正移,腐蚀倾向 增大;另一方面pH值下降又使阴极极化过电位减小, 同样使腐蚀速率增大。
常用电镀技术的术语

常用电镀技术术语电镀技术常用术语一、电镀层种类1、硬铬在严格控制温度与电流密度(较装饰镀铬高)的条件下,从镀铬液中获得的硬度较高、耐磨性好的硬铬层。
2、乳色铬通过改变镀铬溶液的工作条件,获得的孔隙少、具有较高抗蚀能力、而硬度较低的乳白色铬镀层。
二、氧化及钝化1、阳极氧化通常指铝或铝合金制品或零件,在一定的电解液中和特定的工作条件下作为阳极,通过直流电流的作用,使其表面生成一层抗腐蚀的氧化膜的处理过程。
2、磷化钢铁零件在含有磷酸盐的溶液中进行化学处理,使其表面生成一层难溶于水的磷酸盐保护膜的处理过程。
3、发蓝钢铁零件在一定的氧化介质中进行化学处理,使其表面生成一层蓝黑色的保护性氧化膜的处理过程。
4、化学氧化在没有外电流作用下,金属零件与电解质溶液作用,使其表面上生成一层氧化膜的处理过程。
5、电化学氧化以浸入一定的电解质溶液中的金属零件作为阳极,在直流电作用下,使其表面生成氧化膜的电化学处理过程。
6、化学钝化在没有外电流作用下,金属零件与电解质溶液作用,使其表面上生成一层钝化膜的处理过程。
7、电化学钝化以浸入一定电解质溶液中的金属零件作为阳极,在直流电作用下,使其表面生成一层钝化膜的处理过程。
三、电解1、电解在外电流通过电解液时,在阳极和阴极上分别进行氧化和还原反应,将电能变为化学能的过程。
2、阳极电解以零件作为阳极的电解过程。
3、阴极电解以零件作为阴极的电解过程。
四、镀前处理1、化学除油在含碱的溶液中,借助皂化和乳化作用,除去零件或制品表面油垢的过程。
2、有机溶剂除油利用有机溶剂对油垢的溶解作用,除去零件或制品表面油垢的过程。
3、电化学除油(即电解除油)在含有碱的溶液中,以零件作为阳极或阴极,在电流作用下,除去零件或制品表面油垢的过程。
4、化学酸洗在含酸的溶液中,除去金属零件表面的锈蚀物和氧化物的过程。
5、化学抛光金属零件在一定组成的溶液中和特定条件下,进行短时间的浸蚀,从而将零件表面整平,获得比较光亮的表面的过程。
第六章 析氢反应机理

三、氢析出反应的可能反应机理
假设:
1.
H原子具有高度的活性,可以吸附态存在于电极 表面;
2. H2价键饱和,无活性,常温下在电极表面不吸附; 3. H3O+不可能在电极表面同一点同时放极上发生氧化或还原反 应,当这种气体反应成为电极上的主反应或成为不可避免 的副反应时,就称该电极过程为气体电极过程.
在各种实际电化学体系中,最常见的气体电极过程是氢电 极过程和氧电极过程.
6.1 氢电极反应的电催化
氢电极反应包括:氢气的析出和氧化。
(2)
pH 7, H 2O e MH OH I K FK [ H 2O ]e
0 K
F
RT
( 1 )
2 RT ln I K 1 F RT 0 e e ln[ H ] F 2 RT RT H 常数 ln I K ln[ H ] 1 F F H H 2.3RT pH lg[ H ] F 59 mV I , 1 I , 1
F
阴离子影响;
有机分子影响; 阳离子影响。
(2)pH值对 H 的影响
在酸、碱溶液中, 1 对 H 影响正好相反:
当电流密度一定时, I 10 4 A / cm2 , H 与pH值有影响 : (1) pH 7, H ( H 3 O) e MH
H 常数
在氢气氧化反应的机理中,除包含有上述两步骤外,当然还包括H2、 H+(或OH-)等物种的扩散过程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Table 1 The potential and current density under violent hydrolysis at pH = 2.1
Temperature (oC) Voltage (V, SCE) Voltage (V, NHE) Current density (A/dm2)
表 2 pH=2.1 时不同温度、不同电流密度下的铬电极表面析氢电位
Table 2 The hydrogen-evolving potential at the surface of chromium electrode at different temperatures and current densities with pH=2.1 (V, NHE)
Dk (A/dm2)
Temperature (oC)
30
35
45
50
55
10
1.138
12
1.168
14
1.190
16
1.213
1.115 1.142 1.163 1.181
1.088 1.115 1.139 1.164
0.834 1.066 1.102 1.126
0.721 0.812 1.010 1.092
观察各条曲线的极限电流发现,温度较低时,极限电流恒定,但随着温度的升高,极限电流 不再为一平台,这是由于温度升高,氢从铬电极脱附活化能减小所致.
用千分尺测量铬电极尺寸,计算其面积为 2.39×10−3 dm2. 计算出不同温度下剧烈析氢的电位 和电流密度值如表 1 所示.
216
过程工程学报
2卷
表 1 pH=2.1 时不同温度下铬电极表面剧烈析氢的电位和电流密度
在 50oC 的恒温浴中,测量 pH 值为 2.1~2.5 条件下的析氢极化曲线,得图 3. 由图可知,相同 电流密度下,pH 值升高,极化曲线向负方向移动,析氢电位变负,不利于析氢. 这是由于随着 pH 值升高,式(1)中第 2 项变大,且溶液中的氢离子浓度减小,本体溶液与电极表面形成的浓差梯度 减小,氢离子的扩散速度降低,增大了浓差极化,使式中过电位一项也变大,析氢电位负移.
第2卷 第3期 2002 年 6 月
过程工程学报 The Chinese Journal of Process Engineering
Vol.2 No.3 June 2002
大电流密度下铬电极析氢行为
张晓顺, 姜效军
(鞍山钢铁学院应用化学系,辽宁 鞍山 114002)
摘 要:在电解金属铬使用的 7.5~20 A/dm2 的大阴极电流密度下,测定了温度 30~55oC 及 pH 为
Dk (A/dm2)
10 12 14 16 18
30 −1.264 −1.294 −1.316 −1.339 −1.363
35 −1.244 −1.271 −1.292 −1.310 −1.331
Temperature (oC)
45 −1.221 −1.248 −1.272 −1.297 −1.323
2.1~2.5 条件下的硫酸铵体系中铬电极表面析氢极化曲线,探讨了大电流密度下铬电极析氢的电化
学过程. 结果表明,同一电流密度下,温度升高或 pH 值降低,析氢电位的绝对值变小. 电解铬时
十六烷基三甲基溴化铵的加入使析氢极化曲线向负方向移动,可用作阻氢剂. 加入 20 mg/L 的十六
烷基三甲基溴化铵,电流效率提高了 8.1%. 由 pH=2.1 时的极化曲线得到不同温度及电流密度下铬
18
1.237
1.202
1.190
1.153
1.125
20
1.258
1.226
1.211
1.174
i (mA) i (mA)
10
T = 5 0oC
8
pH
1. 2.1
6 2. 2.3 3. 2.5
4
2
0
70
1
T = 3 0oC
1
2
60
pH=2.4
3
2 3 4
50
CTMAB conc. (mg/L)
5
1. 0
40
2. 10
3. 20
30
4. 30
5. 40
20
10
-2 -0.4 -0.6 -0.8 -1.0 -1.2 -1.4 -1.6 -1.8
表 3 pH=2.1 时不同温度、不同电流密度下铬电极的表面析氢过电位
Table 3 The hydrogen-evolving over-potential at the surface of chromium
electrode at different temperatures and current densities with pH=2.1 (V)
50 −0.969 −1.201 −1.237 −1.261 −1.288
55 −0.857 −0.948 −1.146 −1.228 −1.261
20
−1.384
−1.355
−1.344
−1.309
−1.288
氢离子在铬电极表面放电,实际铬电极相当一个氢电极. 有ϕH=ϕH0− (2.303RT/F)pH−η,通过三 电极系统有 öH=ö 测+ö 甘汞,连立上两式有η=−ϕ剩−ϕ甘汞−0.0001984T pH. 由此得到各电流密度下铬电极 表面的析氢过电位值如表 3 所示.
收稿日期:2001−12−07,修回日期:2002−03−28 作者简介:张晓顺(1977−),男,辽宁丹东市人,硕士研究生,从事金属铬电沉积研究.
3 期 张晓顺等:大电流密度下铬电极析氢行为 215
3.4 添加剂对极化曲线的影响
向硫酸铵溶液中加入不同浓度的十六烷基三甲基溴化铵(CTMAB),测量析氢极化曲线,结果 见图 4. 由图可知,电极电位为−1.0 V 之前,CTMAB 的加入对析氢极化曲线没有影响. 当电极电 位超过−1.0 V 后,随添加量的增大,析氢极化曲线开始向负方向移动. 加入量为 20~40 mg/L 的极 化曲线基本重合,表明该条件下 20 mg/L 的 CTMAB 在铬电极表面已达到饱和吸附.
2 实 验
2.1 仪器试剂 铬酐(沈阳新城化工厂)、硫酸铵(沈阳试剂一厂)、十六烷基三甲基溴化铵(北京化工厂)均为分
析纯试剂,硫酸为锦西市化工试剂厂的优级纯试剂. 水为去离子水. 所用仪器为天津兰力科化学电 子高技术有限公司和中国科学院生产的 LK−98 微机电化学分析系统. 2.2 实验操作
取电流密度为 10~20 A/dm2 间的 6 点,由图 2 可得铬电极表面相对 SCE 的析氢电位值,根据 不同温度下的 SCE 电位[7],将铬电极表面析氢电位值转换为相对 NHE 的电位值,见表 2.
3 期 张晓顺等:大电流密度下铬电极析氢行为 217
配制 250 g/L 的 CrO3 镀液 100 ml,其中 CrO3:H2SO4(质量比)=100:1. 加热至 55oC,以 Pb−Ag 合金为阳极,铜片为阴极,在 20 A/dm2 电流密度下电镀 30 min 左右. 将镀好的极板留出约 0.2 cm2, 其余部分及背面用环氧树脂绝缘,得到铬电极. 以铂电极为对电极,铬电极为工作电极,饱和甘汞 电极为参比,测量不同条件下 350 g/L 硫酸铵溶液在−0.5~−1.6 V 范围内的析氢极化曲线.
CTMAB 是一种阳离子表面活性剂,在−1.0 V 时,达到其在铬电极上的吸附电位,开始在极 板表面吸附. 由于 CTMAB 覆盖了铬电极表面的催化活性点,可以阻止氢离子在极板上放电析出, 因此使析氢电位负移. 相同条件下,分别以不含添加剂的铬铵钒电解液和含 20 mg/L CTMAB 的电 解液进行电解铬操作,前者的电流效率为 15.9%,后者为 24.0%,证明 CTMAB 在电解铬过程中确 实起到了阻氢的作用. 3.5 不同温度下铬电极表面析氢电位、析氢 -1.0 -1.2 -1.4 -1.6 -1.8
ϕ (V)
图 3 不同 pH 值时的极化曲线 Fig.3 The polarization curves at different pH values
图 4 十六烷基三甲基溴化铵对析氢极化曲线的影响 Fig.4 Effect of CTMAB on hydrolysis polarization curves
3 结果与讨论
3.1 析氢极化曲线的分析 pH=2.1、温度为 30oC 时的极化曲线如图 1. 电位向负方向扫描,阴极上的电子在累积,A 点
前,几乎没有物质发生还原析出. 直到 A 点[−0.7220 V(SCE)]达到了氢的析出电位,氢离子开始在 阴极上放电析出. 在 AB 段,由于 H+在极板表面放电需克服一定能垒,此时电化学反应为慢步骤, 极板上产生的电流小,即 AB 段发生电化学极化. 电极电位继续负移,铬电极表面的 H+浓度不断 降低,发生了浓差极化,如 BC 段所示. 此时电极反应速度由 i=m0nFA(CH+−CH+, x=0)来决定. 继续增 大电位,直至电极表面附近液层中的 H+浓度降低为零,此时的电流最大,为极限电流,如 CD 段 所示. H+被还原为 H,但 H 原子并不能立刻结合成 H2 脱附,随着电位负移,为 H 原子发生电化学 脱附提供了能量,达到 D 点,电极表面上的 H 迅速结合成 H2 脱附,同时,电场的加强进一步加 快了本体溶液中 H+向电极表面的迁移速度,因此,电流进一步变大,如图中 DE 段所示. 宏观现 象为电解池中大量快速析出气泡. D 点电位为−1.2668 V (SCE).
电极表面一系列析氢过电位值. pH=2.1 时的极化曲线的塔菲尔直线均通过 lgi 为 1.72、过电位为 1.35
V 的公共点.
