人教版九年级下册化学 第11单元 课题1 生活中常见的盐 典型例题
人教版九年级化学下册第十一单元盐化肥课题1生活中常见的盐课后练习(word版 含答案)

人教版九年级化学下册第十一单元盐化肥课题1生活中常见的盐课后练习一、选择题1.下列除杂所选试剂正确的是A.用稀盐酸除去铜粉中的铁粉B.用稀硫酸除去氯化钠中的碳酸钠C.用浓硫酸吸收氧气中的二氧化碳气体D.用稀盐酸除去氧化铁中的碳酸钙2.“见著知微”是化学学科的重要特点,它是通过对宏观现象的观察、思考、推理,建立起对微观粒子的认识。
下列说法不正确的是A.品红在水中扩散,说明分子在不断地运动B.电解水生成氢气和氧气,说明水是由氢分子和氧分子构成的C.盐酸、稀硫酸具有相似的化学性质,说明它们的溶液中都含有氢离子D.某固体与盐酸反应放出二氧化碳气体,则该固体中一定含碳酸根离子或碳酸氢根离子3.古诗《石灰吟》:“千锤万凿出深山,烈火焚烧若等闲。
粉骨碎身浑不怕,要留清白在人间。
”中蕴含了如图所示三种物质间的相互转化关系,下列说法不正确的是A.CaO俗名叫生石灰,是一种氧化物B.“烈火焚烧若等闲”描述的是反应①的变化C.反应①发生时,会放出热量D.反应①是化合反应4.有一包白色粉末,可能含有Na2CO3、Na2SO4、K2SO4、NaCl、Ba(OH)2中的一种或几种,为了探究其成分,实验过程如图所示:关于该实验的说法正确的是A.步骤①中沉淀不溶解,则原白色粉末一定有Na2SO4,一定没有Na2CO3B.步骤①中沉淀部分溶解,则原白色粉末一定有Ba(OH)2、Na2CO3、K2SO4C.步骤①中沉淀部分溶解,则原白色粉末中有Na2SO4或K2SO4,一定没有NaClD.步骤①中沉淀全部溶解,则原白色粉末一定有Ba(OH)2、Na2CO3,可能有NaCl5.一定温度下,向ag FeCl3溶液中加入NaOH固体,溶液的质量与加入NaOH固体的质量变化关系如图所示。
下列叙述错误的是A.Fe(OH)沉淀完全时消耗NaOH的质量为ng B.P点对应的溶液中NaOH达到饱和状3态C.生成Fe(OH)的质量为(n﹣b+a)g D.M点对应溶液能使酚酞显红色36.为了除去粗食盐中的钙离子、镁离子、硫酸根离子等可溶性杂质,某同学设计了如下图所示的实验方案(用于沉淀的试剂均过量)。
人教版九年级化学下册11.1生活中常见的盐

11.1生活中常见的盐【基础达标】1.下列有关物质的化学式、名称、俗名不完全对应的是( ) A.NaCl 氯化钠 食盐 B.CaO 氧化钙 熟石灰 C.Na 2CO 3 碳酸钠 纯碱 D.NaOH 氢氧化钠 烧碱2.下列说法不正确的是( )A.纯碱属于碱类,可用于玻璃、造纸、纺织、洗涤剂的生产B.小苏打是制造发酵粉的主要成分之一,还可以治疗胃酸过多症C.大理石、石灰石的主要成分相同,都是重要的建筑材料D.胃酸中含有适量的盐酸,帮助消化,增加食欲3.如图是实验室里一瓶标签破损的白色粉末状固体。
小明同学取出少量该固体放入一洁净试管中,加水振荡后固体溶解,形成无色透明溶液,继续加入少量盐酸,有无色无味的气体产生。
该固体可能是( )A.Na 2SO 4B.NaClC.NaHCO 3D.NaOH 4.下列溶液混合后,不发生复分解反应的一组是( ) A.HCl 和NaOH B.Na 2CO 3和H 2SO 4 C.KNO 3和NaCl D.NaOH 和FeCl 3 5.下列物质分别能与稀盐酸、稀硫酸、氯化铜溶液反应并能观察到不同实验现象的是( )A.氯化钾溶液B.碳酸钠溶液C.硝酸钡溶液D.氢氧化钡溶液 6.下列各组离子在溶液中一定能大量共存的是( ) A.H +、OH -、Na + B.Ca 2+、OH -、CO 32- C.Na +、K +、Cl - D.H +、NO 3-、CO 32-7.已知甲、乙、丙、丁四种溶液分别是Ba(OH)2溶液、MgSO 4溶液、Na 2CO 3溶液和稀盐酸中的一种。
甲、乙混合有白色沉淀出现;乙、丙按一定比例混合后所得液体的导电性几乎为零。
则甲、乙、丙、丁四种溶液可能是( ) A.Ba(OH)2、MgSO 4、Na 2CO 3、HCl B.Na 2CO 3、Ba(OH)2、MgSO 4、HCl C.HCl 、MgSO 4、Ba(OH)2、Na 2CO 3 D.Ba(OH)2、Na 2CO 3、HCl 、MgSO 48.在下列物质中:a.食盐b.纯碱c.碳酸氢钠d.碳酸钙(1)“侯德榜制碱法”中的“碱”指的是____________(填字母,下同)。
人教版化学九年级下册人教版九年级化学下册第十一单元课题1 生活中常见的盐(同步练习)

课题1 生活中常见的盐火眼金睛1、若不用其他试剂,而用最简便的方法鉴别下列四种溶液:①硫酸镁溶液②氢氧化钾溶液③硫酸铜溶液④氯化钠溶液。
鉴别的正确顺序是()A. ③②①④B.④③②①C.①②③④D.③①④②2、取适量某白色固体依次进行如下表所示实验,已知该固体可能是碳酸钙、碳酸钠、氯化钠、硫酸铜中的一种,则依实验结果判断白色固体是()实验现象(1)加水观察其溶解情况易溶解,得无色溶液(2)滴加无色酚酞试液溶液无变化A.CuSO4B. NaClC.Na2CO3D. CaCO33、食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是()①除去热水瓶中的水垢②鉴别食盐和纯碱③检验鸡蛋壳能否溶于酸A. ①②B. ①③C. ①D. ①②③4.如图,将下列各组物质混合,再加入足量多稀硝酸后为无色溶液的是()5、现有甲、乙、丙、丁四瓶失去标签的无色溶液,只知道它们是稀盐酸、氯化钙溶液、碳酸钠溶液、硝酸银溶液,按下表中实验顺序两两混合进行实验,现象如表所述。
第5次实验是把乙和丁混合,将出现的现象是(提示:反应中生成的碳酸银难溶于水)()实验顺序溶液编号实验现象1 甲+乙有气体产生2 甲+丙有沉淀生成3 丙+丁有沉淀生成4 乙+丙无明显现象5 乙+丁A.有气体产生B.有沉淀产生C.无明显现象D.不能确定6、下列各组物质的溶液,不能发生复分解反应的是()A、HCl和Ca(OH)2B、Na2CO3和H2SO4C、AgNO3和BaCl2D、KCl和CuSO47、下列说法错误的是()A、干冰不是冰B、金刚石不是金C、食盐不是盐D、铅笔芯中不含铅8、蒸馒头时,在发酵的面团里加入些纯碱,其作用是()A、使馒头变白B、既除去生成的酸,又使馒头轻而体积大C、加快面团的发酵速度D、产生的二氧化碳使馒头质量变大9、下列物质中,能跟CuSO4、FeCl3、Mg(NO3)2、Na2CO3四种溶液都发生反应的是()A.AgNO3溶液B. BaCl2溶液C. Ba(OH)2D.稀盐酸画龙点睛1.如右图所示,甲、乙两个相邻的工厂向河水中排放的废水中分别含有硫酸铜、氢氧化钠、氯化钡、氯化铁四种物质中有两种。
2021——2022学年度人教版九年级化学下册-第十一单元课题1生活中常见的盐同步练习题

2021——2022学年度人教版九年级化学下册第十一单元盐化肥课题1生活中常见的盐同步练习题一、选择题1.浓硫酸属于第八类腐蚀品。
下列说法正确的是A.复分解反应只能发生在酸、碱、盐之间B.浓硫酸吸水干燥气体属于物理变化C.浓硫酸不慎沾到手上,马上配制3%~5%的碳酸氢钠溶液来涂抹D.稀释浓硫酸时,要把水慢慢倒入浓硫酸中,并不断搅拌2.下列有关物质的性质与用途具有对应关系的是A.氮气不易溶于水,可用作保护气B.碳酸钙能与盐酸反应,可用作补钙剂C.一氧化碳具有可燃性,可用于工业炼铁D.氢氧化钙为白色固体,可用于改良酸性土壤3.下列描述与其化学用语对应关系完全正确的一组A.2个亚铁离子—2Fe3+B.过氧化氢中氧元素的化合价表示为-1H O22C.海水制“碱”得到的是烧碱NaOH D.不含金属元素的碱的化学式为NH4OH4.将某氢氧化钠溶液逐滴滴入盐酸和氯化铜的混合溶液中,直至过量。
根据实验事实绘制如图所示曲线。
其中说法正确的是A.a至b段有蓝色沉淀生成B.a至d段氯化钠质量不断增大C.c点比a点所含的溶质种类少D.c至d段,溶液pH不断减小5.下列叙述对应的化学方程式、所属基本反应类型都正确的是A.验证铁的活动性:2Fe+6HCl=2FeCl3+3H2↑置换反应B.用稀硫酸洗去试管壁上附着的铜:Cu+H2SO4=CuSO4+H2↑置换反应C.加熟石灰研磨,检验铵态氮肥:2NH4NO3+Ca(OH)2=Ca(NO3)2+2NH3↑+2H2O复分解反应D.溶洞的形成:Ca(HCO3)2=CaCO3+H2O+CO2分解反应6.能一次将稀盐酸、稀硫酸、氯化铜溶液鉴别开的试剂是A.Na2CO3B.Ba(OH)2C.Na2SO4D.KOH7.下列图象与对应的叙述相符合的是A.等质量的铁片、锌片分别与足量且质量分数相同的稀硫酸反应B.高温煅烧石灰石C.向pH=13 的氢氧化钠溶液中不断加水稀释D.将一瓶浓硫酸敞口放置在空气中8.元素化合价和物质类别是认识物质的两个重要维度。
课题1 生活中常见的盐
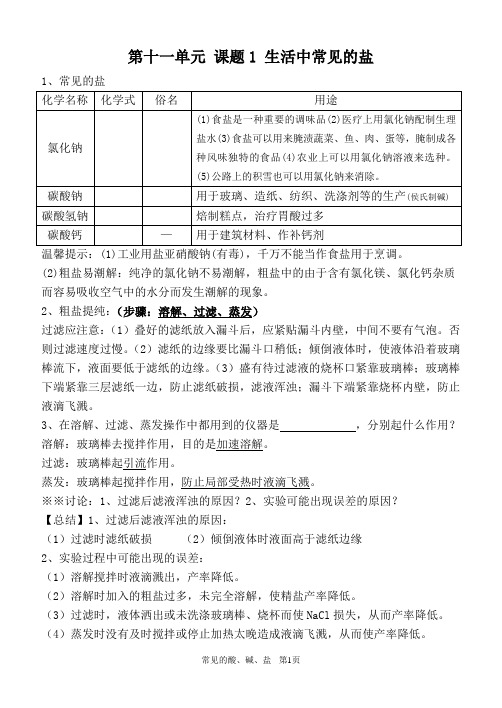
第十一单元课题1 生活中常见的盐1、常见的盐温馨提示:(1)工业用盐亚硝酸钠(有毒),千万不能当作食盐用于烹调。
(2)粗盐易潮解:纯净的氯化钠不易潮解,粗盐中的由于含有氯化镁、氯化钙杂质而容易吸收空气中的水分而发生潮解的现象。
2、粗盐提纯:(步骤:溶解、过滤、蒸发)过滤应注意:(1)叠好的滤纸放入漏斗后,应紧贴漏斗内壁,中间不要有气泡。
否则过滤速度过慢。
(2)滤纸的边缘要比漏斗口稍低;倾倒液体时,使液体沿着玻璃棒流下,液面要低于滤纸的边缘。
(3)盛有待过滤液的烧杯口紧靠玻璃棒;玻璃棒下端紧靠三层滤纸一边,防止滤纸破损,滤液浑浊;漏斗下端紧靠烧杯内壁,防止液滴飞溅。
3、在溶解、过滤、蒸发操作中都用到的仪器是,分别起什么作用?溶解:玻璃棒去搅拌作用,目的是加速溶解。
过滤:玻璃棒起引流作用。
蒸发:玻璃棒起搅拌作用,防止局部受热时液滴飞溅。
※※讨论:1、过滤后滤液浑浊的原因?2、实验可能出现误差的原因?【总结】1、过滤后滤液浑浊的原因:(1)过滤时滤纸破损(2)倾倒液体时液面高于滤纸边缘2、实验过程中可能出现的误差:(1)溶解搅拌时液滴溅出,产率降低。
(2)溶解时加入的粗盐过多,未完全溶解,使精盐产率降低。
(3)过滤时,液体洒出或未洗涤玻璃棒、烧杯而使NaCl损失,从而产率降低。
(4)蒸发时没有及时搅拌或停止加热太晚造成液滴飞溅,从而使产率降低。
4、盐的化学性质:【务必掌握】(1)盐+金属→新盐+新金属(置换反应) 如:Fe + CuSO4——Cu + AgNO3——(2)盐+酸→新盐+新酸(复分解反应)如:HCl + BaCO3——H 2SO4+ BaCl2——Na2CO3+ H2SO4——HCl + AgNO3——H 2SO4+ MgCO3——(3)盐+碱→新盐+新碱(复分解反应) (前提:反应物均可溶)如:K2CO3+ Ca(OH)2——MgSO4 + Ba(OH)2——FeCl3+ NaOH ——Cu(NO3)2+ KOH ——Al2(SO4)3+ NaOH ——(NH4)2SO4+ Ca(OH)2——(4)盐+盐→另两种盐(复分解反应) (前提:反应物均可溶)如:Na2CO3+ Ca(NO3)2——BaCl2 + AgNO3——Ba(NO3)2+ K2SO4——K 2CO3+ Fe(NO3)2——MgSO4 + Na2CO3——判断下列反应能否发生,能反应的完成化学方程式:① Zn + FeSO4——② Cu + AgCl ——③ NaCl + CuSO4——④ Na2CO3+ Ca(OH)2——⑤ BaCl2 + Na2CO3——⑥ CuCl2 + H2SO4——⑦ CaCO3 + BaCl2——⑧ BaSO4+ HCl ——⑨ Na2CO3+ Cu(OH)2——⑩Na2CO3+ BaCl2——5、复分解反应(1)定义:由________________互相交换成分,生成_________________的反应。
生活中常见的盐(练习)(解析版)——2020-2021学年人教版九年级化学下册

课题11.1 生活中常见的盐(练习)【基础篇】1.盐在日常生活中使用广泛,下列关于盐的用途说法错误的是()A.用碳酸钠治疗胃酸过多B.碳酸氢钠可用于焙制糕点C.用氯化钠配制生理盐水D.亚硝酸钠不能用于保鲜食品【答案】A【解答】解:A.碳酸氢钠能与胃酸中的盐酸反应,所以常用碳酸氢钠治疗胃酸过多,而不是使用碳酸钠,选项说法错误,符合题意;B.碳酸氢钠受热会分解产生二氧化碳,且能与酸性物质反应生成二氧化碳,所以常用于焙制糕点,选项说法正确,不合题意;C.生理盐水是0.9%的氯化钠溶液,所以可用氯化钠配制生理盐水,选项说法正确,不合题意;D.亚硝酸钠有毒,不能用于食品保鲜,选项说法正确,不合题意;故选:A。
2.分类是化学学习的重要方法,下列各组物质按照单质、盐、混合物的顺序排列的是()A.生铁、小苏打、冰水混合物B.液氮、碳酸钡、粗盐C.钙片、氯化镁、海水D.臭氧、硫化氢、沼气【答案】B【解答】解:A、生铁的主要成分是铁,含有碳等杂质,属于混合物,不符合排列顺序,可排除该选项,故选项错误。
B、液氮是液态的氮气,属于单质;碳酸钡是由钡离子和碳酸根离子构成的化合物,属于盐;粗盐的主要成分是氯化钠,含有杂质,属于混合物;是按照单质、盐、混合物的顺序排列的,故选项正确。
C、钙片的主要成分是碳酸钙,属于混合物,不符合排列顺序,可排除该选项,故选项错误。
D、臭氧属于单质,硫化氢不属于盐,不符合排列顺序,可排除该选项,故选项错误。
故选:B。
3.下列溶液显碱性的是()A.酸雨B.食醋C.碳酸钠D.盐酸【答案】C【解答】解:A、酸雨是pH小于5.6的雨水,显酸性,故选项错误。
B、食醋中含有醋酸,显酸性,故选项错误。
C、碳酸钠溶液显碱性,故选项正确。
D、盐酸显酸性,故选项错误。
故选:C。
4.把鸡蛋放在下列某物质中.可以将蛋壳溶解而制作“无壳鸡蛋”.该物质是()A.食盐B.食醋C.白酒D.酱油【答案】B【解答】解:鸡蛋壳的主要成分是碳酸钙,碳酸盐能与酸反应生成易溶于水的物质;食醋的主要成分是醋酸,醋酸可以和碳酸盐反生成易溶于水的醋酸盐,能把鸡蛋壳反应掉,可以能得到“无壳鸡蛋”。
课题1 生活中常见的盐同步练习 2022-2023学年人教版化学九年级下册

九年级化学下册第十一单元同步练习课题1生活中常见的盐一、选择题1.下列说法正确的是()A.盐都能食用,故称食盐B.盐就是食盐,易溶于水C.盐都有咸味,都是白色晶体D.盐是一类物质的总称2.下列各项不属于NaCl作用的是()A.做净水剂B.生产烧碱C.做调味品D.生产氯气3.根据你的生活经验和所学的化学知识判断,下列做法正确的是()A.用氯化钠消除公路上的积雪B.在食品袋里充入氧气延长食品的保持期C.制作香肠时添加较多量的亚硝酸钠防腐D.电器因电线短路着火,立即用水扑灭4.化学中的盐是指()A.食盐(NaCl)B.组成里含有阳离子和阴离子的化合物C.组成里含有金属离子的物质D.组成里含有金属离子和酸根离子的化合物5.下列物质(括号内为杂质),可用溶解.过滤.蒸发的方法进行提纯的是()A.二氧化锰(氯化钾)B.氯化钙(碳酸钙) C.氯化钠(氯化钾)D.酒精(水)6.下列物质的用途错误的是()A.盐酸用于制药B.氢氧化钠用于生产肥皂C.用石灰水刷墙D.氯化钠可用于配制生理盐水7.下列各组物质能按溶解.过滤.蒸发的操作顺序将它们分离是()A.氧化铜和炭粉B.食盐和糖C.水和酒精D.碳酸钙和氯化钠8.下列说法正确的是()A.粗盐提纯中蒸发时用玻璃棒搅拌是为了防止液滴飞溅B.医用生理盐水是0.5%的氯化钠溶液C.配制100g10%的氯化钠溶液要10g氯化钠和80g水D.成年人一般每天需要摄入食盐10g左右9.该实验室购进了两瓶无水氯化钙,应将它放在()A.甲橱B.乙橱C.丙橱D.丁橱10.粗盐中难溶性杂质的去除过程中,涉及到称量与溶解.过滤.蒸发等过程。
下列说法不正确的是()A.称量时粗盐放在托盘天平左盘的称量纸上B.粗盐溶解时,要用玻璃棒不断搅拌C.过滤时漏斗下端尖嘴处紧靠烧杯内壁D.蒸发时,在恰好蒸干时停止加热11.国家质检部门检测出人们端午节包粽子的“返青粽叶”多以硫酸铜为添加物,长期食用有害健康。
硫酸铜是一种()A.氧化物 B.盐 C.碱 D.酸12.分类是学习和研究化学物质及其变化的一种常用的基本方法。
最新人教版九年级化学下册第十一单元《生活中常见的盐》典型例题

拓展延伸高手支招3 典例精析【例1】在发酵面团中加入下列某种物质,既能除去面团中的酸,又能使蒸出的馒头疏松多孔,这种物质是( )A.Na 2CO 3B.Ca (OH )2C.CaOD.NaCl解析:在上述选项中,A 、B 、C 选项能与酸反应,但B 、C 不能用于食品加工,D 不能与酸反应,只有A 选项中的Na 2CO 3既能与酸反应,又能产生二氧化碳气体,使馒头疏松多孔、口感更好。
答案:A技术化提示:碳酸盐的一种重要化学性质是与酸反应生成二氧化碳,可简记为“与酸生气”,检验碳酸盐就是依据这一性质。
【例2】下列对实验过程的描述正确的是( )A.某固体中加入稀盐酸产生无色气体,证明该固体中一定含有-23COB.某溶液中滴加BaCl 2溶液,生成不溶于稀硝酸的白色沉淀,该溶液中一定含有-24SOC.某溶液中滴加无色酚酞溶液,溶液变成红色,该溶液不一定是碱D.某溶液中滴加AgNO 3溶液有白色沉淀产生,该溶液中一定含有Cl -解析:遇到酸能产生无色气体的固体除了碳酸盐之外还有活泼金属,要证明含有-23CO ,必须再将生成的气体通入澄清石灰水中,看是否变浑浊,故A 错;B 中向溶液中加入的是BaCl 2溶液,故产生的白色沉淀有可能是AgCl ,因而B 错;能使酚酞变红的除了碱外,还可能是显碱性的盐,如Na 2CO 3,故C 对;D 中,加入AgNO 3溶液后没有再加稀硝酸进一步验证,故白色沉淀有可能是Ag 2CO 3。
答案:C技术化提示:本题考查几种常见离子的检验。
-23CO 的检验一般是先加稀盐酸,产生气体后再通入澄清的石灰水,看是否变浑浊;若变浑浊,说明含-23CO 。
-24SO 的检验,一般先加Ba (NO 3)2溶液,产生了白色沉淀后再加入稀硝酸,看沉淀是否溶解。
若不溶解,说明含-24SO 。
Cl -的检验是先加AgNO 3溶液,再加稀硝酸;若沉淀不溶解,说明含Cl -。
后面CO的干扰,因为BaCO3和Ag2CO3也是两种离子的鉴别中,加稀硝酸的目的是为了排除 23白色沉淀,但这两种沉淀能溶于稀硝酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
【典例1】关于氯化钠的说法不正确的是()A 食盐的主要成分是氯化钠B 氯化钠可用来清除公路上的积雪C 氯化钠是人体正常生理活动必不可少的额,应长期大量服用D 医疗上的生理盐水是用氯化钠配制的【答案】C【典例2】氯化钠是用途广泛,是重要的调味品,又是重要的工业原料。
(1)通过晾晒海水或煮井水、盐湖水等可得到含有较多杂质的氯化钠晶体—粗盐,这属于(填物理或化学)变化。
粗盐经过、、可得到初步提纯。
(2)氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水(Cl2+2NaOH=NaCl+NaClO+H2O),工业上常用氯气和石灰水反应制漂白粉,反应原理与上述反应相同,请写出化学方程式。
【答案】物理、溶解、过滤、蒸发、2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O【典例3】下列说法不正确的是()A 公路上的积雪可用氯化钠消除B 碳酸钠广泛应用玻璃、造纸、纺织和洗涤剂的生产C 天安门前的华表是用大理石做的,碳酸钙还可用作补钙剂D 熟石灰可用作干燥剂【解析】熟石灰没有强吸水性,不能用作干燥剂【答案】D【典例2】下列物质的名称和俗名对应关系正确的是()A 碳酸钙—纯碱B 氯化钠—食盐C 碳酸钠—小苏打D 氧化钙—熟石灰B食盐主要成分是氯化钠,C【典例4】蒸馒头、炸油条时常用到一种白色物质,既能中和面粉发酵过程产生的酸,又能起到发泡作用,这种白色物质是()A NaOHB Ca(OH)2C NaHCO3D NaCl【解析】只有NaHCO3与酸反应生成气体,起到发泡作用【答案】C【典例5】碳酸氢钠是生活中常见的盐,下列说法错误的是()A 碳酸氢钠俗称小苏打,能使焙制出的糕点疏松多孔B NaCl通常从海水中提取C 碳酸氢钠、柠檬酸和水等混合可制成汽水D 碳酸氢钠能用于治疗胃酸过多【答案】A【典例6】下列试剂中不能用于检验NaOH溶液是否变质的是()A 稀盐酸B 稀硫酸C Ca(OH)2D 酚酞溶液【解析】NaOH溶液变质后生成的Na2CO3溶液也显碱性,酚酞溶液无法确定NaOH溶液是否变质【答案】D【典例7】如图所示药品是实验室里一瓶标签破损的白色粉末状固体。
小明同学取出少量该固体放入一洁净试管中,加水振荡后固体溶解,形成无色透明溶液,继续加入少量盐酸,有无色、无味的气体产生。
该固体可能是()A Na2SO4B NaClC NaHCO3D NaOH【解析】只有NaHCO3与盐酸反应生成二氧化碳气体【答案】C【典例8】俗称纯碱的碳酸钠与二氧化碳和水反应生成碳酸氢钠,且碳酸氢钠的溶解度比碳酸钠小得多。
在饱和的碳酸钠溶液中通入足量二氧化碳的现象为;反应的化学方程式为;分离出产物的方法是。
【解析】碳酸氢钠溶解度较小会析出【答案】有晶体析出(或溶液变浑浊)、Na2CO3+H2O+CO2=2NaHCO3、过滤【典例9】某化学学习小组在实验中发现:不仅碱溶液可以使酚酞溶液变红,Na2CO3溶液也能使酚酞溶液变红。
碱溶液可使酚酞溶液变红,因为碱在水中解离出OH-,那么Na2CO3溶液中哪种粒子可以使酚酞溶液变红呢?他们设计了如图所示三个实验:(1)实验I是为了。
(2)实验II加入蒸馏水的目的是探究水分子是否能使酚酞溶液变红,小组内有同学认为实验II没必要做,理由是。
(3)实验III滴入溶液,振荡,酚酞溶液变红,向变红的溶液中再逐滴滴入过量的溶液,红色逐渐消失,同时还观察到生成。
反应的化学方程式为。
实验I、II、III得出结论:CO32-可以使酚酞溶液变红。
(4)小组同学在与老师交流上述结论时,老师说:“其实溶液能使酚酞溶液变红也是由于溶液中存在OH-”。
你认为溶液中存在的原因是。
【答案】探究Na+是否能使酚酞溶液变红;酚酞溶液中就有水分子(或氢氧化钠溶液中含有水分子);白色沉淀、Na2CO3+CaCl2=CaCO3↓+2NaCl;CO32-与H2O发生反应生成【典例10】纯碱(Na2CO3)是一种重要的盐类物质,在化学工业中用途极广。
小明同学为探究纯碱的化学性质进行了猜想,并设计实验进行验证。
请你帮助他将下列实验报告填写完整。
【交流与反思】若用稀硫酸代替稀盐酸进行实验,是否与猜想二相同?填. (是或否)【解析】碳酸钠溶液显碱性,能使无色酚酞溶液变红色;稀盐酸可与碳酸钠发生复分解反应生成氯化钠、水和二氧化碳;氢氧化钙可与碳酸钠发生复分解反应生成碳酸钙沉淀和氢氧化钠;验证猜想四应向Na2CO3溶液中滴入BaCl2溶液。
碳酸钠可与酸反应生成相应的盐、水和二氧化碳,若用稀盐酸代替稀盐酸进行实验,现象与猜想二相同【答案】溶液变红色、Na2CO3+2HCl=2NaCl+H2O+CO、Na2CO3+Ca(OH)2=CaCO3↓+2NaOH、取少量Na2CO3溶液于试管中,滴入BaCl2溶液、复分解反应。
【典例11】在A+B→盐+水的反应中,A、B分别是()A 硫酸和熟石灰B 纯碱和熟石灰C 小苏打和盐酸D 熟石灰和氯化铵【答案】A【典例12】下列各组物质间发生化学反应的是()A 银和稀盐酸B 铁和硫酸锌溶液C 硝酸钾溶液和食盐水D 硫酸和氯化钡溶液【解析】B铁活泼型不如锌,不能置换出硫酸锌溶液中的锌【答案】D【典例13】下列反应中属于复分解反应的是()A B C D【解析】NaOH、HCl、NaCl、H2O四种物质都属于化合物,反应过程是NaOH溶液中的钠离子Na+与稀盐酸HCl中的氢离子H+交换后生成NaCl和H2O【答案】D【典例14】有一包白色粉末可能由CaCO3、Na2SO4、BaCl2、NaCl中的一种或几种组成。
把少量该粉末放入足量水中,搅拌、静置、过滤,得到白色固体和滤液。
向所得固体中加入稀硝酸,固体溶解并有气体放出。
向所得滤液中加入稀硫酸,有白色沉淀生成。
该粉末中肯定没有的物质是()A Na2SO4B CaCO3C BaCl2D NaCl【解析】滴加稀硫酸有沉淀,说明原固体中一定含有BaCl2;“固体溶解并有气体放出”说明原固体中含有CaCO3,一定不含Na2SO4【答案】A【典例15】如图所示,X溶液与AgNO3、Na2CO3、Na2SO4三种溶液发生反应均生成白色沉淀。
则X可能是下列物质中的()A HNO3或KNO3B HCl或H2SO4C BaCl2或CaCl2D NaOH或Ca(OH)2【解析】能与碳酸钠Na2CO3、硫酸钠Na2SO4反应产生沉淀的物质一般含有钙离子Ca 2+或钡离子Ba2+;能与硝酸AgNO3银反应产生沉淀的物质一般都含有氯离子Ag +【答案】C【典例16】在河旁有甲乙丙丁四座工厂(位置如图),每个工厂排出的废液中只含有Na2CO3、FeCl3、NaOH、HCl中的一种。
某环保小组对河水检测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑浊变澄清;丁处产生气泡,河水澄清。
(1)甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是。
(2)乙处河水呈红褐色的原因是(用化学方程式表示)。
(3)丁处产生气泡的原因是(用化学方程式表示)。
【解析】“乙处河水呈红褐色”说明甲处是NaOH、乙处是FeCl3;“丙处河水由浑浊变澄清”说明丙处是HCl、“丁处产生气泡”说明丁处是Na2CO3【答案】酚酞或石蕊溶液、3NaOH+FeCl3=Fe(OH)3↓+3NaCl、Na2CO3+2HCl=2NaCl+CO2↑+H2O【典例17】有一包固体粉末,可能是NaOH、Na2SO4、MgCl2、CuSO4中的一种或几种,为了分析固体粉末的成分,取少量该固体粉末进行实验,实验设计方案如图所示:(1)固体粉末中一定有,一定没有。
(2)若现象X为“沉淀不溶解”或“沉淀部分溶解”,结论是固体粉末中;若现象X为“沉淀全部溶解”,结论是固体粉末中。
(3)实验步骤①和③都有相同的实验操作,该操作名称为。
(4)写出实验步骤②的化学方程式:。
(5)简单修改实验方案,可取消第④步实验,修改方法是。
【答案】NaOH和MgCl2、CuSO4;一定有Na2SO4、一定没有Na2SO4;过滤;Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;把第③步使用的Ba(OH)2溶液改为BaCl2溶液(或硝酸钡溶液)【典例18】某化学学习小组的同学围绕“澄清石灰水与碳酸钠溶液的反应”展开了如下探究活动。
(1)该反应的化学方程式为。
(2)反应后溶液中的溶质是什么?同学们一致认为有以下三种情况:①氢氧化钠和氢氧化钙;②氢氧化钠和碳酸钠;③。
(3)小明取少量溶液于试管中,滴加过量稀盐酸,发现无气泡产生,说明情况(填序号)不可能。
为了进一步确定溶液的成分,同学们设计了如下实验方案:【解析】反应有2种情况:一种是恰好完全反应,一种是有一种反应物过量,据此可提出猜想③是氢氧化钠;加盐酸的目的是验证是否含有碳酸钠,无气泡,说明没有碳酸钠;氢氧化钠是生成物,一定存在,需判断氢氧化钙是否存在,应通入CO2(或加Na2CO3等)【答案】Ca(OH)2+Na2CO3=Ca2CO3↓+2NaOH、氢氧化钠、②、取少量溶液于试管中,加入少量Na2CO3溶液(或通入CO2等)、产生白色沉淀、CO2(或加Na2CO3等)【典例19】某厂生成纯碱的工艺流程示意图如下:(1)粗盐水中主要含有Ca 2+、Mg2+、SO42-等杂质离子,工业上常加入稍过量的NaOH溶液、Na2CO3溶液、BaCl2溶液及矢量的盐酸等除杂、精制。
则加入试剂的顺序合理的为(只写一种)、盐酸。
加盐酸的作用是(用化学方程式表示)。
(2)制碱原理:NaCl+CO2+NH3+H2O=NaHCO3+NH4Cl,该反应原理可看作是由①CO2+NH3+H2O=NH4HCO3和②NaCl+NH4HCO3=NaHCO3+NH4Cl两个反应加合而成,该反应类型为。
(3)X的化学式为。
(4)Y是滤液中最主要的成分,Y与反应的产物之一可用于循环使用,该产物的名称为,Y 的化学式为,写出Y的一种用途:。
【答案】NaOH、Na2CO3溶液、BaCl2;HCl+NaOH=NaCl+H2O、Na2CO3+2HCl=2NaCl+H2O+CO2↑复分解反应、CO2、氨气、NH4Cl、制取氮肥【典例20】分别将下列各组物质同时放入水中,能发生复分解反应的是()A 氯化钠和硫酸钾B 硫酸铜和氢氧化铁C 碳酸钠和氯化钡D 氯化钠和硝酸钾【解析】不同物质加入水中,得到溶液,要想发生复分解反应必须有沉淀、气体或水生成【答案】C【典例21】镧(La)是一种活动性比锌更强的元素,它的氧化物的化学式为La2O3,La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水。
由此判断下列几组物质,不能直接反应制取的是()A La2O3和HClB La(OH)3和HClC NaCl和La(OH)3D La和HCl 【解析】因La(OH)3是不溶于水的碱,与不能发生复分解反应【答案】C【典例22】有K2CO3、BaCl2、H2SO4、Na2SO4四种物质的溶液,其中一种溶液与其他三种溶液都能发生反应,这种溶液中所含的溶质是()A K2CO3B BaCl2C H2SO4D Na2SO4【解析】K2CO3与BaCl2反应生成碳酸钡BaCO3沉淀和氯化钾KCl;H2SO4与BaCl2反应生成硫酸钡BaSO4沉淀和氯化氢HCl;Na2SO4与BaCl2反应生成硫酸钡BaSO4沉淀和氯化钠NaCl【答案】B【典例23】下表是部分物质的溶解性表,利用表中提供的信息回答下列问题:(1)和两种溶液混合后能否发生反应?理由是什么?(2)写出一个有BaSO4生成的复分解反应的化学方程式.【解析】(1)复分解反应发生条件是生成物中有沉淀(难溶物)、气体或水等,否则不能发生复分解反应;NaOH和Ba(NO3)2交换成分没有沉淀(难溶物)、气体或水等,不能发生复分解反应;(2)BaSO4是一种难溶性盐,可由Ba 2+和SO42-结合生成,选用Ba(OH)2或可溶性钡盐与硫酸或可溶性硫酸盐反应得到硫酸钡沉淀【答案】(1)不能,没有沉淀、气体或水生成(2)Na2SO4+Ba(OH)2=BaSO4↓+2NaOH【典例24】某溶液由NaOH、HCl、H2SO4和MgCl2中的一种或几种组成。
