第一节:脂肪烃学案
2021人教版选修5 第二章第一节 脂肪烃(共2课时) 学案

第二章烃和卤代烃第一节《脂肪烃》导学案(第1课时:烷烃和烯烃)【学习目标】1认识烷烃、烯烃物理性质的变化规律,记住它们的化学性质。
2知道烯烃的顺反异构现象及结构要求。
【学习重、难点】烷烃和烯烃【学习过程】【旧知回顾】烷烃、烯烃的物理性质:烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈规律性变化,沸点逐渐___升高___,相对密度逐渐____增大____,常温下的存在状态,也由____气态____逐渐过渡到____液态、固态___。
1当烃分子中碳原子数≤4时,常温下呈____气态____。
2分子式相同的烃,支链越多,熔沸点越__低___。
例如沸点:CH3CH23CH3>CH32CHCH2CH3>CCH34。
3烷烃、烯烃的相对密度___小于___水的密度。
【典例】下列烷烃沸点由高到低顺序正确的是B①CH4②C3H8③C5H12④C8H18⑤C12H26A.①②③④⑤B.⑤④③②①C.⑤③④②①D.③④⑤②①【新知探究】一、烷烃、烯烃的化学性质1.烷烃的化学性质——与甲烷相似1常温下:性质__稳定,不与强酸、强碱、强氧化剂反应。
2在特定条件下可发生___取代反应____、___氧化反应___燃烧。
2.烯烃的化学性质——与乙烯相似1能使KMnO4酸性溶液___褪色___。
2能燃烧,燃烧通式为___C n H2n+错误!O2错误!ol可与4 mol氯气发生完全的取代反应,则该烃的结构简式为AA.CH2===CH2B.CH3CH===CH2C.CH3CH3D.CH2===CHCH===CH22.有机化合物C4H8是生活中的重要物质,关于C4H8的说法中,错误的是CA.C4H8可能是烯烃B.C4H8中属于烯烃类的同分异构体有4种C.核磁共振氢谱有2种吸收峰的烯烃结构一定是(还有顺-2-丁烯、反-2-丁烯共3种)D.C4H8中属于烯烃的顺反异构体有2种3.mol某烃A在氧气中充分燃烧后,生成化合物B、C各mol。
《第一节 脂肪烃》学案

§2-1 脂肪烃【学习目标】1、掌握烷烃、烯烃、炔烃的结构特点、物理性质的变化规律和典型的化学性质。
2、掌握几种典型代表物甲烷、乙烯、乙炔的结构、性质和制法。
3、掌握有关烃燃烧的计算规律。
(1.5h)【学习过程】一、烷烃(又可称饱和烃)1、结构特点:可用“”、“”、“”概括。
(单键、锯齿、四面体)分子式通式:2、物理性质:(1)熔沸点:①碳原子数越多,相对分子质量越,熔沸点越;(如:甲烷乙烷丙烷正丁烷)②碳原子数相同时,支链数越多,熔沸点越。
(如:正丁烷异丁烷;正戊烷异戊烷新戊烷)③常温常压下是气体的烷烃,其碳原子数,此外,新戊烷常温常压下也是气体。
(2)密度:碳原子数越多,密度越大;液态烷烃的密度小于水的密度。
(3)溶解性:不溶于水,易溶于有机溶剂。
有的液态烷烃本身就是有机溶剂,如己烷。
3、化学性质:一般比较稳定。
与酸、碱、氧化剂都不发生反应,也难与其它物质化合。
(1)取代反应写出CH4光照下与Cl2反应的方程式(2)氧化反应(使酸性KMnO4溶液褪色)燃烧的通式:甲烷燃烧的现象:随着碳原子数的增加,往往燃烧越来越不充分,火焰明亮,并伴有黑烟。
(3)高温分解反应:甲烷隔绝空气高温下可分解成碳和氢气;长链烷烃高温下可分解成短链烷烃和烯烃,这在石油化工上有很重要的应用,称为_________________。
二、烯烃(分子中含有的不饱和烃)1、单烯烃:多烯烃:单烯烃(简称烯烃)分子式的通式:组成特点:2、物理性质(类似于烷烃)3、化学性质:(1)加成反应(与H2、X2、HX、H2O、HCN等)例:①写出下列反应的化学方程式:乙烯通入溴水中:乙烯与水的反应:乙烯与溴化氢反应:②阅读课本P42“马氏加成规则”,丙烯与氯化氢、H2O反应后,会生成什么产物呢?试写出反应方程式。
③1,3丁二烯与溴单质可能发生的两种加成反应,试写出反应方程式。
1,2-加成:1,4-加成:(2)氧化反应用通式表示烯烃的燃烧化学方程式_____________________________乙烯燃烧的现象:烯烃可使酸性KMnO 4溶液褪色,烯烃被氧化的产物的对应关系为:例:现已知某烯烃的化学式为C 5H 10,它与酸性高锰酸钾溶液反应后得到的产物为乙酸和丙酸,推测出此和丁酮 ,则此烯烃的结构简式为 (3)加聚反应单烯烃加聚的通式为:1,3丁二烯的加聚方程式为:异戊二烯的加聚方程式为:三、炔烃(分子中含有 的不饱和烃)1、单炔烃:其分子式的通式为 ,与同碳原子数的 、 互为同分异构体。
新人教版高中化学教案-脂肪烃教案 (1)
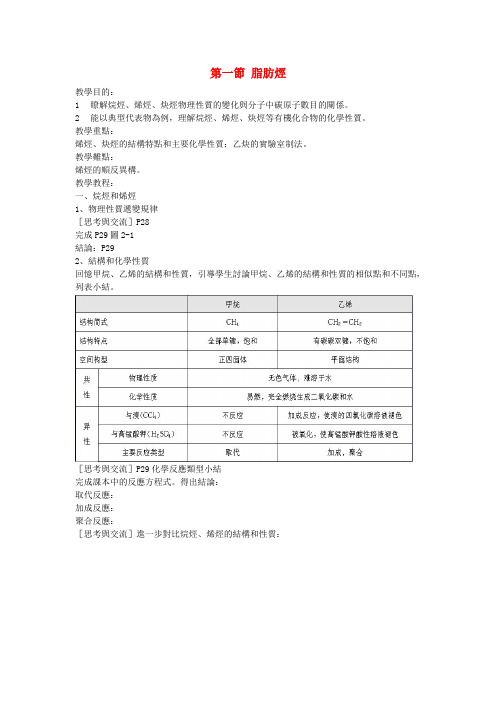
第一節脂肪烴教學目的:1瞭解烷烴、烯烴、炔烴物理性質的變化與分子中碳原子數目的關係。
2能以典型代表物為例,理解烷烴、烯烴、炔烴等有機化合物的化學性質。
教學重點:烯烴、炔烴的結構特點和主要化學性質;乙炔的實驗室制法。
教學難點:烯烴的順反異構。
教學教程:一、烷烴和烯烴1、物理性質遞變規律[思考與交流]P28完成P29圖2-1結論:P292、結構和化學性質回憶甲烷、乙烯的結構和性質,引導學生討論甲烷、乙烯的結構和性質的相似點和不同點,列表小結。
[思考與交流]P29化學反應類型小結完成課本中的反應方程式。
得出結論:取代反應:加成反應:聚合反應:[思考與交流]進一步對比烷烴、烯烴的結構和性質:[思考與交流]丙稀與氯化氫反應後,會生成什麼產物呢?試著寫出反應方程式: 導學在課堂P36[學與問]P30烷烴和烯烴結構對比完成課本中表格[資料卡片]P30二烯烴的不完全加成特點:競爭加成注意:當氯氣足量時兩個碳碳雙鍵可以完全反應二、烯烴的順反異構體觀察下列兩組有機物結構特點:它們都是互為同分異構體嗎? 歸納:什麼是順反異構?P32 思考:下列有機分子中,可形成順反異構的是 A CH 2=CHCH 3 B CH 2=CHCH 2CH 3 C CH 3CH =C(CH 3)2 D CH 3CH =CHCl答案:D三、炔烴1)結構:2)乙炔的實驗室制法:原理:CaC 2+2H 2O Ca(OH)2+C 2H 2↑實驗裝置: P.32圖2-6注意事項:a 、檢查氣密性;b 、怎樣除去雜質氣體?(將氣體通過裝有CuSO 4溶液的洗氣瓶)c 、氣體收集方法乙炔是無色無味的氣體,實驗室制的乙炔為什麼會有臭味呢?(1)因電石中含有 CaS 、Ca 3P 2等,也會與水反應,產生H 2S 、PH 3等氣體,所以所制乙炔氣體會有難聞的臭味;(2)如何去除乙炔的臭味呢?(NaOH 和CuSO 4溶液)(3)H 2S 對本實驗有影響嗎?為什麼?H 2S 具有較強還原性,能與溴反應,易被酸性高錳酸鉀溶液氧化,使其褪色,因而會對該實驗造成干擾。
脂肪烃导学案

高二化学导学案第二章第一节脂肪烃【学习目标】1、了解烷烃、烯烃的结构及物理性质递变规律2、掌握烷烃、烯烃、炔烃的结构特点和主要化学性质;烯烃的顺反异构现象;掌握乙炔的实验室制法3、了解脂肪烃的来源和石油化学工业【学习重点】烷烃、烯烃、炔烃结构特点和主要化学性质;乙炔的实验室制法【课前预习区】【课堂互动区】一、烷烃和烯烃【思考与交流】(认真观察分析P28表2-1、2—2,进行讨论并作图)(一)烷烃和烯烃的物理性质随分子中碳原子数递增的规律性变化:熔沸点变化:密度变化:状态变化:(二)烷烃、烯烃的化学性质1、烷烃(1)取代反应(特征性质)写出乙烷与溴单质生成溴乙烷的反应__________________________ 烷烃取代反应的共同特征:2、烯烃的化学性质(1)氧化反应(双键的还原性,特征性质)乙烯通入酸性高锰酸钾溶液中现象是__________________________(2)加成反应(特征性质)①写出下列反应的化学方程式:乙烯通入溴水中: 乙烯与水的反应: 乙烯与氯化氢的反应 ②丙烯与氯化氢反应后,会生成什么产物呢?试着写出反应方程式:(3)烯烃的自身加成聚合反应 — 加聚反应乙烯的加聚反应:丙烯的加聚反应 :探究:你能写出CH 2=CH —CH =CH 2与Cl 2发生加成反应的方程式吗?【针对练习一】制取一氯乙烷,采用的最佳方法是( )A .乙烷和氯气取代反应B .乙烯和氯气加成反应C .乙烯和HCl 加成反应D .乙烷和HCl 作用二、烯烃的顺反异构观察下列两组有机物结构特点:它们都是互为同分异构体吗?【归纳】什么是顺反异构?【针对练习二】下列有机化合物有顺反异构体的是( )A .CH 3CH 3B .CH 2=CH 2C .CH 3CH =CH 2D .CH 3CH =CHCH 3【小结】对比烷烃和单烯烃的结构和性质三、炔烃(一)乙炔1、书写乙炔的分子式、电子式和结构式及物理性质。
人教版化学选修五第二章第一节脂肪烃导学案 打印版

第二章第一节《脂肪烃》导学案乾县二中高二化学备课组班级组号:姓名【学习目标】1.了解烷烃、烯烃的结构及物理性质递变规律2.掌握烷烃、烯烃、炔烃的结构特点和主要化学性质;烯烃的顺反异构现象;掌握乙炔的实验室制法3.了解脂肪烃的来源和石油化学工业【学习重点】烷烃、烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法【学习难点】烯烃的顺反异构【自学导学】第一课时烷烃:单烯烃:【思考与交流】(认真观察分析P28表2-1、2—2,进行讨论并作图)1.状态当碳原子数小于或等于时,烷烃和烯烃在常温下呈气态,其他的烷烃和烯烃常温下呈态或态(新戊烷常温常压下也是气体)。
2.熔沸点:①碳原子数越多,熔沸点越;(如:甲烷乙烷丙烷正丁烷)②碳原子数相同时,支链数越多,熔沸点越。
(如:正丁烷异丁烷;正戊烷异戊烷新戊烷)3.密度:随碳原子数的增多,密度逐渐;但密度均(大于/ 小于)水的密度。
4.溶解性:不溶于,易溶于。
有的液态烷烃本身就是有机溶剂,如己烷。
四.烷烃、烯烃的化学性质(一)烷烃通常条件下性质很稳定,不能使氯水、溴水及酸性高锰酸钾溶液褪色,也不跟酸、碱起反应。
1.取代反应(特征反应)烷烃在通常条件下比较稳定,在________条件下容易与卤素发生反应。
如乙烷与氯气生成一氯乙烷的反应,其化学方程式为______________________________________________,反应类型为______反应。
取代反应不能得到纯净的取代产物2.氧化反应—可燃性:用通式表示烷烃燃烧的化学方程式:______________________________ 随着碳原子数的增加,往往燃烧越来越不充分,火焰明亮,并伴有黑烟。
3.高温分解反应:甲烷高温下可分解成碳和氢气;长链烷烃高温下可分解成短链烷烃和烯烃,这在石油化工上有很重要的应用,称为。
(二)烯烃的化学性质(1)燃烧用通式表示单烯烃的燃烧化学方程式:(2)氧化反应(双键的还原性,特征性质)乙烯通入酸性高锰酸钾溶液中现象是__________________________(3)加成反应(特征性质)一定条件下,烯烃能够使氯水、溴水褪色,与H 2、Cl2、Br2、HCl、HBr、H2O 等发生加成反应。
人教版高中化学学案-脂肪烃

第二章第1節脂肪烴課前預習學案一、預習目標1、瞭解烷烴、烯烴代表物的結構和性質等知識2、瞭解乙炔和炔烴的結構、性質和製備等知識3、瞭解烯烴的順反異構概念、存在條件和脂肪烴的來源二、預習內容(一)、烷烴和烯烴1、分子裡碳原子跟碳原子都以結合成,碳原子剩餘的跟氫原子結合的烴叫烷烴。
烷烴的通式為,烷烴的主要化學性質為(1)(2)2、烷烴和烯烴(1)烯烴是分子中含有的鏈烴的總稱,分子組成的通式為CnH2n,最簡式為。
烯烴的主要化學性質為(1)(2)(3)(3)順反異構的概念(二)乙炔1、乙炔的分子式,最簡式,結構簡式2、電石遇水產生乙炔的化學方程式為3、乙炔燃燒時,火焰明亮並伴有濃烈的黑煙,這是因為乙炔4、乙炔與溴水發生加成反應的化學方程式是5、炔烴典型的化學性質有(1)(2)(3)(三)脂肪烴的來源根據課本P36頁【學與問】,閱讀課本P35~36,完成下表:三、提出疑惑同學們,通過你的自主學習,你還有哪些疑惑,請把它填在下面的表格中課內探究學案一、學習目標1.瞭解烷烴、烯烴、炔烴物理性質的變化與分子中碳原子數目的關係2、能以典型代表物為例,理解烷烴、烯烴、炔烴的化學性質3、瞭解烷烴、烯烴、炔烴的特徵結構、烯烴的順反異構和乙炔的實驗室制法4、讓學生在複習、質疑、探究的學習過程中增長技能,學習重難點:1、物理性質的規律性變化、烷烴的取代反應2、烯烴的加成反應、加聚反應、烯烴的順反異構現象3、實驗室制乙炔的反應原理及反應特點二、學習過程探究一:烷烴、烯烴的熔、沸點閱讀p28思考和交流思考; 烷烴的沸點與其分子中所含有的碳原子數之間的關係(a)隨著分子裡含碳原子數的增加,熔點、沸點逐漸,相對密度逐漸;(b)分子裡碳原子數等於或小於的烴,在常溫常壓下是氣體,其他烴在常溫常壓下都是液體或固體;(c)烷烴的相對密度水的密度。
(d)分子式相同的烴,支鏈越多,熔沸點越練習:比較正戊烷、異戊烷、新戊烷沸點高低探究二:烷烴和烯烴化學性質1、烷烴的化學性質特徵反應(1)甲烷與純鹵素單質(Cl2)發生取代反應,條件:(2)反應式2.烯烴的化學性質(1)燃燒用通式表示烯烴的燃燒化學方程式_________________________________________________ (2)氧化反應(雙鍵的還原性,特徵性質)一個特徵反應現象就是___________________________________________________________ (3)加成反應(特徵性質)①寫出下列反應的化學方程式:乙烯通入溴水中_______________________________________________________________乙烯與水的反應_______________________________________________________________乙烯與溴化氫反應_____________________________________________________________②丙烯與氯化氫反應後,會生成什麼產物呢?試著寫出反應方程式:【引申】共軛二烯烴的不完全加成特點:競爭加成(參考P30 資料卡片)【例題】2-甲基-1,3-丁二烯與等物質的量Br 2的加成產物有幾種,各是什麼?(4)烯烴的自身加成聚合反應 — 加聚反應請觀察乙烯的加聚反應後,書寫丙烯的加聚反應方程式探究三:烯烴的順反異構 觀察下列兩組有機物結構特點:它們都是互為同分異構體嗎? 【歸納】存在順反異構的條件?【練習】下列有機化合物有順反異構體的是( )A .CH 3CH 3B .CH 2=CH 2C .CH 3CH =CH 2D .CH 3CH =CHCH 3 探究四:乙炔和炔烴1、對比乙烷、乙烯和乙炔的分子式、結構簡式,分析它們的結構特點,試推出乙炔可能具有的化學性質2、【總結歸納】有哪些類別的脂肪烴能被KMnO 4/H +溶液氧化?他們的結構特點怎樣?3、【思考】在烯烴分子中如果雙鍵碳上連接了兩個不同的原子或原子團,將可以出現順反異構。
新人教版化学选修5高中《脂肪烃》学案

新人教版化学选修5高中《脂肪烃》学案《脂肪烃》学案(第一课时)【学习目标】1.了解烷烃烯烃同系物的物理性质递变规律2.掌握烷烃烯烃炔烃的结构特点和主要化学性质烯烃的顺反异构现象【知识梳理】一、烃的分类及结构,性质烷烃的化学性质【相似性】1. 取代反应(特征性质)写出乙烷与溴单质生成溴乙烷的反应__________________________________ 烷烃取代反应的共同特征有: 2. 燃烧:用通式表示烷烃燃烧的化学方程式:___________________________________ 随着碳原子数的增加,往往燃烧越来越不充分,火焰明亮,并伴有黑烟。
3. 高温分解反应:甲烷高温下可分解成碳和氢气;长链烷烃高温下可分解成短链烷烃和烯烃,这在石要的应用,称为__________________________。
三、烯烃复习: 1.烯烃――单烯烃: 多烯烃: 2.单烯烃的通式及组成特点 (1)通式推导: (2)组成特点归纳: 3.化学性质:【相似性】 (1)燃烧:用通式表示烯烃的燃烧化学方程式_____________________________(2)氧化反应(双键的还原性,特征性质):一个特征反应现象就是__________________________________________ (3)加成反应(特征性质) ①写出下列反应的化学方程式:乙烯通入溴水中____________________________________________ 乙烯与水的反应________________________________________ 乙烯与溴化氢反应______________________________________ ②丙稀与氯化氢反应后,会生成什么产物呢?试着写出反应方程式:观察反应归纳:单烯烃加聚反应的通式是烯烃的顺反异构体 观察下列两组有机物结构特点:它们都是互为同分异构体吗? 归纳:什么是顺反异构?【典题解悟】例 1. 甲烷中混有乙烯,欲除乙烯得到纯净的甲烷,最好依次通过盛有哪些试剂的洗气瓶?( )A.澄清石灰水、浓H 2SO 4B. 酸性KMnO 4溶液、浓H 2SO 4C.溴水、浓H 2SO 4D. 浓H 2SO 4、酸性KMnO 4溶液解析:乙烯可以被酸性KMnO 4溶液氧化,而甲烷不能。
化学选修五第二章_第一节_脂肪烃学案

高二化学选修五第二章 第一节 脂肪烃学案主备人:黄修利 审核:荆志宇【学习目标】了解烷烃、烯烃的结构及物理性质递变规律,脂肪烃的来源和石油化工.掌握烷烃、烯烃、炔烃的结构特点和主要化学性质 ;烯烃的顺反异构现象;掌握乙炔的实验室制法. 【自学导学】烷烃: 单烯烃: 三.(认真观察分析P28表2-1、2—2,进行总结)烷烃和烯烃的物理性质随分子中碳原子数递增的规律性变化: 状态变化: 熔沸点变化: 密度变化:四.烷烃、烯烃的化学性质(一)烷烃1.取代反应(特征性质)写出乙烷与溴单质生成溴乙烷的反应__________________________2.燃烧:用通式表示烷烃燃烧的化学方程式:______________________________3..高温分解反应:甲烷高温下可分解成碳和氢气;长链烷烃高温下可分解成短链烷烃和烯烃,这在石油化工上有很重要的应用,称为 。
(二)烯烃的化学性质 (1)燃烧 用通式表示单烯烃的燃烧化学方程式: (2)氧化反应(双键的还原性,特征性质)乙烯通入酸性高锰酸钾溶液中现象是_______________ (3)加成反应(特征性质) ①写出下列反应的化学方程式:乙烯通入溴水中:乙烯与水的反应:乙烯与氯化氢的反应 ②丙烯与氯化氢反应后,会生成什么产物呢?试着写出反应方程式:(4)烯烃的自身加成聚合反应 — 加聚反应 乙烯的加聚反应:丙烯的加聚反应 :探究:你能写出CH 2=CH —CH =CH 2与H 2发生加成反应的方程式吗?五.烯烃的顺反异构 观察下列两组有机物结构特点:它们都是互为同分异构体吗?六.炔烃 (一)乙炔 1. 书写乙炔的分子式、电子式和结构式及物理性质。
分子式: 电子式: 结构式: 官能团: 物理性质:乙炔是一种 色、 味、 溶于水的气体, 溶于有机溶剂。
C C = H H H 3C CH 3 C C = H H H 3C CH 3第二组—C —C —HHH H CH 3 CH 3—C —C —H CH 3 H H CH 3 H 第一组2. 乙炔的实验室制法及性质实验:(1)原理: (化学方程式表示) (2)(3) ②B ③C②乙炔是无色无味的气体,实验室制的乙炔为什么会有臭味呢?③如何去除乙炔的臭味? ④可以用排空气法收集乙炔吗?为什么? 3.乙炔的化学性质 乙炔含有 键,化学性质 ,可发生的反应有:氧化反应、加成反应、聚合反应等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高二化学1100×0.13 第二章烃和卤代烃
第一节脂肪烃学案
一、烷烃和烯烃
1.结构特点和通式:
(1) 烷烃:仅含C—C键和C—H键的饱和链烃。
通式:(n≥1)
(2) 烯烃:分子里含有一个的不饱和链烃叫做烯烃。
通式:(n≥2)
乙烯的分子式,结构简式,分子中6个原子在上,键角约为。
2.物理性质
(1) 物理性质随着分子中碳原子数的递增,呈规律性变化,沸点,相对密度;
(2) 碳原子数相同时,支链越多,熔沸点。
(3) 常温下的存在状态,也由气态(n≤4)逐渐过渡到液态(5≤n≤16)、固态(17≤n)。
(4) 烃的密度比水,溶于水,溶于有机溶剂。
3.基本反应类型
(1) 取代反应:
(2) 加成反应;
(3) 聚合反应:
下面是我们学过的有机化学反应,写出其反应的化学方程式,并指明反应类型。
①乙烷和氯气反应生成一氯乙烷:
②乙烯和溴的反应:
③乙烯和水的反应:
④乙烯生成聚乙烯的反应
4.由于烷烃和烯烃的结构不同,使其在很多性质方面都存在较大差异,填写表格加以对比总结。
5.二烯烃的1,2—加成与1,4—加成:
①CH2=CH—CH=CH2+Cl2→
②CH2=CH—CH=CH2+Cl2→
③nCH2=CH—CH=CH2→
二、烯烃的顺反异构
1.异构现象的产生
由于不能旋转而导致分子中原子或原子团不同。
2.异构的分类
两个相同的原子或原子团排列在双键的的成为顺式结构;两个相同的原子或原子团分别排列在双键的的成为反式结构。
如:顺—2—丁烯:;反—2—丁烯:。
3.性质的异同
顺反异构体的化学性质,物理性质。
例1:对于C F
2Cl
2
(商品名称是氟利昂—122),下列有关叙述不正确的是()
A、有两种同分异构体
B、分子中有非极性键
C、只有一种结构无同分异构体
D、是一种制冷剂
例 2 :下列五种烃①2-甲基丁烷②2,2-二甲基丙烷③戊烷④丙烷⑤丁烷,按沸点由高到低的顺序排列的是()A.①>②>③>④>⑤B.②>③>⑤>④>①
C.③>①>②>⑤>④D.④>⑤>②>①>③
三、乙炔
1. 分子中含有的一类脂肪烃称为炔烃。
通式为;其代表物。
2. 总结乙炔的物理性质
3. 列表对比乙烷、乙烯和乙炔的分子式、最简式、电子式、结构式、结构简式、空间结构、键角。
4. 乙炔的实验室制取(课本)
(1)反应原理:
(2)装置:
(3)收集方法:
(4)注意事项:
①为有效地控制产生气体的速度,可用饱和食盐水代替水。
②点燃乙炔前必须检验其纯度。
5. 乙炔的化学性质
(1)氧化反应:
①可燃性(明亮带黑烟):
②易被KMnO
4酸性溶液氧化(叁键断裂),乙炔能使KMnO
4
酸性溶液。
(2)加成反应:
①乙炔与溴发生加成反应:
②乙炔和氯化氢发生加成反应:
③乙炔的加聚反应;
6.炔烃的性质
炔烃的化学性质与相似,容易发生、、等,使KMnO
4酸性溶液和溴的四氯化碳溶液褪色。
四、脂肪烃的来源及其应用
1. 请利用P34,图2—12中所显示的信息,并查阅资料、调查身边使用石油制品的情况,写出通过原油所制得的主要产品和它们的用途。
2. 试举例说明天然气在人民生活、工农业生产中的作用,以及在使用天然气的过程中应该注意的事项?
3. 写出煤干馏的主要产品,说明“煤制油”的重要意义。
溶液褪色的是()
例1:不能使酸性KMnO
4
A.乙烯 B.聚乙烯 C.丙烯 D.乙炔
例2:关于炔烃的下列描述正确的是()
A.分子里含有碳碳三键的不饱和链烃叫炔烃
B.炔烃分子里的所有碳原子都在同一直线上
C.炔烃易发生加成反应,也易发生取代反应
D.炔烃不能使溴水褪色,但可以使酸性高锰酸钾溶液褪色。
