《晶体的类型与性质》
【华师一】《晶体的类型与性质》第一节《离子晶体分子晶体原子晶体》第二课时

第一单元晶体的类型与性质第一节离子晶体、分子晶体和原子晶体第二课时1、下列晶体由原子直接构成,且属于分子晶体的是()A、固态氢B、固态氖C、磷D、三氧化硫2、下列性质适合于分子晶体的是()A、熔点1070℃,易溶于水,水溶液能导电B、熔点10.31℃,液态不导电,水溶液能导电C、能溶于CS2,熔点112.8℃,沸点444.6℃D、熔点97.81℃,质软,导电,密度0.97g/cm33、下列各组物质中,形成的晶体全部是分子晶体的是()A、CO2、Ar、Al2O3B、H2O、CO2、I2C、PH4I、H2O2、CCl4D、SO3、MgCl2、Al2Cl64、下列过程中,共价键被破坏的是()A、碘升华B、溴蒸气被木炭吸附C、酒精溶于水D、HCl气体溶于水5、结合课本上(P5图1—10)干冰晶体结构模型图分析每个CO2分子周围距离相等且最近的CO2分子数目为()A、6B、8C、10D、126、碘的熔、沸点较低,其原因是()A、碘的非金属性较弱B、I2中I-I键不稳定C、碘晶体属于分子晶体D、碘的氧化性较弱7、下列叙述正确的是()A、两种元素构成的共价化合物分子中的化学键都是极性键B、两种元素原子间形成的化学键都是极性键C、含有极性键的化合物不一定是极性分子D、只要是离子化合物,其熔点就比共价化合物高8、SiCl4的分子结构与CCl4类似,对其做出如下推断:①SiCl4晶体是分子晶体;②常温常压SiCl4不是气体;③SiCl4分子是由极性键构成的非极性分子;④SiCl4熔点高于CCl4。
其中正确的是()A 、只有①B、只有①②C、只有②③D、①②③④9、水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是()A、范德华力B、共价键C、氢键D、相对分子质量10、下列说法正确的是()A、离子晶体中可能含有共价键,但一定含有金属元素B、分子晶体中一定含有共价健C、离子晶体中一定不存在非极性键D、石英与晶体硅都是原子晶体11、有下列几种氢键①O—H…O;②N—H…N;③F—H…F;④O—H…N。
晶体类型和性质.

习题讲练:
1、共价键、离子键和范德瓦耳斯力是构成物 质粒子间的不同作用方式,下列物质中, 只含有上述一种作用的是 ( B ) A.干冰 B.氯化钠 C.氢氧化钠 D.碘
2、在解释下列物质性质的变化规律与物质结构间的因果 关系时,与键作用强弱无关的变化规律是( C D) A.HF、HCI、HBr、HI的热稳定性依次减弱 B.NaF、NaCl、NaBr、NaI的熔点依次减低 C.F2、C12、Br2、I2的熔、沸点逐渐升高 D.H2S的熔沸点小于H2O的熔、沸点
结束
3、PtCl2(NH3)2成平面正方形结构,它可以形 成两种固体。一种为淡黄色,在水中溶解度较小, 则其为___________ 性分子,构型为 ___________ ; 另一种为黄绿色,在水中溶解度较大则其为___________ 性分子,构型为 ___________ 。 4、试解释:钠的卤化物比相应的硅的卤化物熔点高的多 5、在干冰晶体中每个CO2分子周围紧邻的 CO2分子 12 有___________ 个 在晶体中截取一个最小的正方体; 使正方体的四个顶点部落到CO2分子的中心, 4 个C02分子。 则在这个正方形的平面上有___________
结束
◆什么叫分子晶体? ●分子间通过分子间作用力结合成的晶体。 ◆分子晶体的特点? ●有单个分子存在;化学式就是分子式。“相似相溶” ●熔沸点较低,硬度较小,易升华。固体或熔化时不导电 ◆哪些物质可以形成分子晶体? ●卤素、氧气、氢气等多数非金属单质、稀有气体、非金 属氢化物、多数非金属氧化物等。 ◆分子晶体中的化学键与结构 ●有的分晶体中无化学键(如:Ar等),其它一般含共价 键
结束
物质溶沸点高低的比较
(1)不同晶体类型的物质: 原子晶体大于离子晶体大于分子晶体 (2)同种晶体类型的物质: 晶体内粒子间的作用力越大,熔沸点越高 ①对原子晶体:一般是原子半径越小,键能越大,键长 越短共价键越强,晶体的熔沸点越高。 ②对离子晶体:一般是离子半径越小,离子电荷数越多 离子键作越强,晶体的熔沸点越高。 ③对分晶体:A 组成和结构相似的物质,相对分子质量越 大熔沸点越高;B 组成和结构不相似的物质,极性大则熔 结束 沸点高。C有的还与分子形状有关。
【华师一】《晶体的类型与性质》第一节《离子晶体分子晶体原子晶体》第一课时

第一单元晶体的类型与性质第一节离子晶体、分子晶体和原子晶体第一课时1、下列物质中含有极性键的离子化合物是()A、CaCl2B、Na2O2C、NaOHD、K2S2、下列性质中,可以证明某化合物内一定存在离子键的是A、可溶于水B、具有较高的熔点C、水溶液能导电D、熔融状态能导电3、碱金属与卤素所形成的化合物大都具有的性质是:①高沸点;②能溶于水;③水溶液能导电;④低熔点;⑤熔融状态不导电。
()A、①②③B、③④⑤C、①④⑤D、②③⑤4、下列有关离子晶体的描述中,不正确的是()A、离子晶体中离子间存在着较强的离子键B、一般来说,离子晶体有较低的熔点和沸点、较小的硬度C、离子晶体溶于水或熔融时都能导电D、由于构成离子晶体的粒子是离子,故离子晶体中都不存在单个的分子5、下列离子化合物中,阴、阳离子所含的电子数不相等的是()A、Na2O2B、NaNH2C、NaFD、Mg(OH)26、下列离子化合物中,阳离子和阴离子半径之比最大的是()A、KIB、CsFC、LiBrD、NaCl7、某离子晶体晶胞结构如图所示,X位于立方体的顶点,Y位于立方体的中心,晶体中距离最近的两个X与一个Y形成的夹角∠XYX的角度为()A、109°28′B、90° C 60 °D、120°8、氯化钠晶体结构中,Na+(●)和Cl-(○)都是等距离交错排列的(如下图所示)已知氯化钠晶体的摩尔质量为58.5g·mol-1,密度为2.2g·cm—3,阿佛加德罗常数为6.02×1023mol-1,在氯化钠晶体中两个距离最近的Na+中心间的距离接近于()A、3.0×10-8cmB、3.5×10-8cmC、4.0×10-8cmD、5.0×10-8cm9、在NaCl晶体中与每个Na+距离相等且最近的几个Na+共有()A、6个B、8个C、10个D、12个10、Cs是ⅠA族元素,F是ⅦA族元素,估计Cs和F形成的化合物可能是()A、离子化合物B、化学式为CsF2C、室温下为固体D、室温下为气体11、某离子晶体结构如图所示,X (●表示)位于立方体的顶点,Y (○表示)位于立方体的中心。
晶体的类型与性质
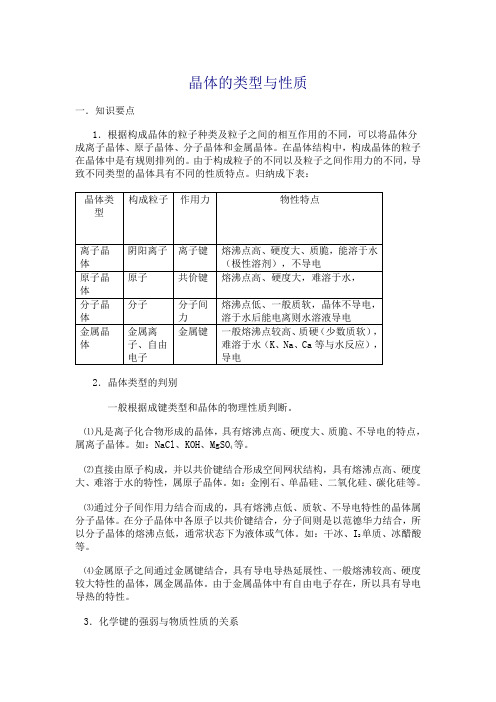
晶体的类型与性质一.知识要点1.根据构成晶体的粒子种类及粒子之间的相互作用的不同,可以将晶体分成离子晶体、原子晶体、分子晶体和金属晶体。
在晶体结构中,构成晶体的粒子在晶体中是有规则排列的。
由于构成粒子的不同以及粒子之间作用力的不同,导致不同类型的晶体具有不同的性质特点。
归纳成下表:2.晶体类型的判别一般根据成键类型和晶体的物理性质判断。
⑴凡是离子化合物形成的晶体,具有熔沸点高、硬度大、质脆、不导电的特点,等。
属离子晶体。
如:NaCl、KOH、MgSO4⑵直接由原子构成,并以共价键结合形成空间网状结构,具有熔沸点高、硬度大、难溶于水的特性,属原子晶体。
如:金刚石、单晶硅、二氧化硅、碳化硅等。
⑶通过分子间作用力结合而成的,具有熔沸点低、质软、不导电特性的晶体属分子晶体。
在分子晶体中各原子以共价键结合,分子间则是以范德华力结合,所单质、冰醋酸以分子晶体的熔沸点低,通常状态下为液体或气体。
如:干冰、I2等。
⑷金属原子之间通过金属键结合,具有导电导热延展性、一般熔沸较高、硬度较大特性的晶体,属金属晶体。
由于金属晶体中有自由电子存在,所以具有导电导热的特性。
3.化学键的强弱与物质性质的关系离子晶体中,离子键键能的大小与离子的半径、离子所带的电荷数、离子的核电荷数有关,一般起决定作用的主要是离子半径的大小。
离子半径小,阴、阳离子间的静电作用力大,离子键键能就大,离子晶体的熔沸点就高,硬度也大。
原子晶体中共价键键能的大小与成键的原子半径有关,原子半径越小,键长越短,键能就越大,晶体的熔沸点就越高,硬度也就越大。
分子晶体中分子与分子之间的作用力为范德华力,其能量较小。
对于组成和结构相似的物质,其分子间的作用力随相对分子质量的增大而增大,熔沸点也随之增高。
还与分子的极性有关,分子极性大,分子间作用力大,熔沸点高。
金属晶体中金属离子半径越小,离子电荷数越大,其金属离子与自由电子间的作用力越强,金属的熔沸点就越高。
4.石墨晶体具有层状结构的特点,层内原子间以共价键的方式形成平面网状结构(相当于原子晶体),层与层之间以范德华力结合(相当于分子晶体),层与层间有自由电子存在,晶体具有导电性(相当于金属晶体),所以石墨是一种过渡性或混合型晶体。
晶体的类型和性质

B A
ABC3
2006年江苏-15
• 下列关于晶体的说法一定正确的 是( B )。
• A.分子晶体中都存在共价键 • B.CaTiO3晶体中每个Ti4+和 • 12个O2-相紧邻 • C.SiO2晶体中每个硅原子与 • 两个氧原子以共价键相结合 • D.金属晶体的熔点都比分子 • 晶体的熔点高
A2BC2
4.常见的离子晶体: 强碱(NaOH、KOH)、活 泼金属氧化物(Na2O、MgO、Na2O2)、大多 数盐类[BeCl2、AlCl3、Pb(Ac)2等除外]。
(二)分子晶体
1.定义:分子间以分子间作用力相结合而形成的晶体。 2.结构特点:
(1)构成粒子:分子。 (2)粒子间的作用:分子间作用力或氢键。 (3)存在单个的分子,有分子式。其化学式就是分子式。
2.由共价键形成的的原子晶体中,原子半径小的,键长 ( 短 ),键能( 大 ),共价键( 强 ) ,晶体的熔沸点就 ( 高 ) 。如:金刚石 > 碳化硅 > 晶体硅。
3.离子晶体中比( 离子键 )强弱。一般地说,阴、阳离子的 电荷数越多,离子半径越小,则离子间的作用力就越 ( 强 ),其晶体的熔、沸点就越( 高 ), 如CsCl < NaCl < MgCl2 < MgO 。
4.分子晶体:组成和结构相似的物质,相对分子质量
越大,熔、沸点就越( 高 ),如HI > HBr > HCl 。
分子间有氢键作用的物质(如HF 、H2O 、NH3 、 低级醇和羧酸等)熔、沸点反常。同分异构体中, 一般地说,支链数越多,熔、沸点就越( ),如沸
点低:正戊烷 异戊烷 >新戊烷; 5>.金属晶体中金
2.结构特点:
物质的晶体结构和晶体的性质

物质的晶体结构和晶体的性质晶体是物质的一种特殊的形态,具有有序排列的原子、离子或分子结构。
物质的晶体结构决定了晶体的性质和行为。
本文将探讨物质的晶体结构对晶体性质的影响。
一、晶体的结构类型不同的物质可以形成不同类型的晶体结构。
常见的晶体结构类型有离子晶体结构、共价晶体结构和金属晶体结构。
1.离子晶体结构离子晶体由带正电荷和带负电荷的离子组成,它们通过离子键相互连接。
在离子晶体结构中,离子根据它们的尺寸和电荷排列在特定的位置上。
典型的例子是氯化钠晶体,其中钠离子和氯离子以离子键相互连接。
2.共价晶体结构共价晶体由共用电子对相互连接的原子组成。
在共价晶体结构中,原子通过共价键连接在一起。
典型的例子是碳化硅晶体,其中碳原子和硅原子通过共价键相互连接。
3.金属晶体结构金属晶体由金属原子组成,原子之间通过金属键相互连接形成金属结构。
金属晶体结构中的原子呈现紧密堆积的球形排列,典型的例子是金属铜。
二、晶体的性质晶体的结构类型决定了其独特的性质。
以下介绍几种与晶体结构相关的晶体性质。
1.透明性晶体的有序结构可以使光线通过,使其具有透明性。
透明的晶体如水晶和钻石,能让光线穿透并发生折射和反射。
2.硬度晶体的有序结构通常使其具有较高的硬度。
由于晶体结构的稳定性,物质的晶体形态往往比非晶体更坚固。
例如,石英晶体是一种非常硬的物质。
3.熔点和沸点晶体的结构类型也会对物质的熔点和沸点产生影响。
由于晶体结构的稳定性,晶体的熔点和沸点通常较高。
与之相反,非晶体的熔点和沸点较低。
4.电导性晶体中的离子或电子可以通过晶体结构的导电性使电流通过。
离子晶体具有较好的导电性,而共价晶体和典型的金属晶体则具有较差的导电性。
三、晶体结构与物质性质的关系物质的晶体结构决定了它的性质和行为。
晶体结构的稳定性使得晶体具有较高的硬度和稳定的几何形状。
晶体结构的有序性使晶体表面产生平整的晶面,使得晶体呈现出色彩斑斓的光学效果。
此外,晶体结构还决定了物质的热导性、电导性等物理性质。
晶体的类型与性质

晶体的类型与性质作者:李金洲来源:《神州·中旬刊》2013年第06期摘要:四种晶体所涉及的知识点多,学生经常把性质张冠李戴,本文就知识点加以总结,应用图表把性质、代表物加以分析,并配有练习,能够使学生轻松掌握该知识点。
关键词:离子晶体原子晶体分子晶体金属晶体一、知识点精讲1、晶体类型及性质比较*注意:⑴四种晶体类型的化学式表示的意义不同:离子晶体、原子晶体中化学式表示的分别是阴阳离子最简比和原子最简比,从而有的资料上把离子晶体和原子晶体看成是巨型分子;分子晶体中表示的是单个的分子。
⑵晶体讨论的是固态形式,而我们通常讨论化学性质时,不仅仅讨论其固态形式,包括其液态、气态和其水溶液。
2、化学键与分子间作用力的比较3、化学键和分子间作用力对物理、化学性质的影响(1)不同晶体类型的硬度大小、熔沸点高低等物理性质由于化学键键能比较大,使得其硬度较大和熔沸点较高,所以原子晶体、离子晶体和金属晶体分别大于和高于分子晶体。
但必须注意得是融化过程中原子晶体、离子晶体和金属晶体破坏的是化学键而分子晶体是分子间作用力(有的是氢键)。
(2)晶体性质的比较:比较晶体的硬度大小、熔沸点高低等物理性质的依据是:原子晶体→共价键键能→键长→由原子半径决定。
如:金刚石>晶体硅离子晶体→离子键强弱→离子半径和离子所带电荷数决定。
如:NaCl金属晶体→金属键→金属阳离子半径、所带的电荷数、自由电子的多少而定。
阳离子半径越小,所带的电荷越多,自由电子越多,相互作用就越大,熔点就会相应升高。
如:熔点KNa>K>Rb>Cs。
分子晶体→分子间力→结构相似的情况下由相对分子质量决定(分子有氢键例外)(3)氢键对分子晶体物理性质的影响⑴对溶解度的影响,分子中有氢键的可以在水中溶解,如NH3极易溶于水。
⑵对熔沸点的影响,分子中有氢键的相对而言熔沸点较高,如氧族元素中H2O的熔沸点最高。
⑶解释一些反常现象,如冰的密度小于水。
高三化学晶体的类型和性质

质对市爱慕阳光实验学校高三化学晶体的类型和性质【本讲主要内容】晶体的类型和性质【知识掌握】【知识点精析】1. 晶体的概念晶体是经过自然结晶而形成的具有规那么几何外形的固体。
自然结晶可以是液态物质降温变成固体的过程,也可是蒸发溶剂析出晶体的过程。
比方:水结成冰,海水蒸发得到的食盐固体。
晶体的宏观结构特点:有规那么的几何外形。
晶体的微观结构特点:构成晶体的微粒空间排列有规那么。
构成晶体的粒子有:分子、原子、离子。
晶体内部粒子间的作用有:离子键〔离子晶体〕、共价键〔原子晶体〕、分子间的作用力〔又叫范德瓦耳斯力,分子晶体〕,甚至氢键〔氢键不是化学健,是一种比拟强的范德瓦耳斯力,特殊的分子晶体,如:冰〕。
2. 晶体的分类根据构成晶体的粒子种类及粒子间的相互作用不同,可将晶体分为假设干类型,如:离子晶体、分子晶体、原子晶体、金属晶体。
〔1〕离子晶体①离子间通过离子键结合而成的晶体叫做离子晶体。
构成离子晶体的粒子是阴离子和阳离子。
离子晶体中离子间的作用是离子键。
离子化合物的晶体是离子晶体。
②典型离子晶体的结构模型NaCl晶体的结构模型 CsCl晶体的结构模型晶胞的概念:晶体中可以重复的最小单元。
③离子晶体的物理性质由于离子晶体离子键的能量较大,阴阳离子之间具有稳的结合方式,所以离子晶体的硬度较大、难于压缩,具有较高的熔点和沸点。
④离子晶体熔化、溶解过程中,均破坏离子键。
氯化钠晶体熔化变成液态,离子能够自由移动,离子键被破坏;氯化钠晶体溶于水中,电离成自由移动的离子,也破坏了离子键。
离子晶体固态时不导电,但熔化或溶解过程中,均能产生自由移动的阴、阳离子而导电。
〔2〕分子晶体①分子间作用力〔范德瓦耳斯力〕:分子间作用力比化学键弱得多,它对物质的熔点、沸点有影响。
②分子晶体的概念分子间以分子间的作用力相结合的晶体叫做分子晶体。
构成分子晶体的粒子是分子。
构成分子晶体的粒子间的作用是分子间作用力〔即范德瓦耳斯力〕。
由分子构成的物质在固态时都属于分子晶体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
是表示离子晶体中离子个数比的化学 式,而不是表示分子组成的分子式。
离子个数比又是怎么得出来的??
每 个 氯 化 钠 晶 胞 中 钠 、 氯 离 子 各 多 少 个 ?
氯化钠晶胞结构图
氯化钠晶胞中的氯骨架
有多少个氯离子? Cl-=(8/8+6/2)=4个
氯化钠中晶胞中的钠骨架
提问:一个氯化钠晶胞中有多少个钠离子?
离子晶体、分子晶体 和原子晶体
第一课时
复习巩固
1.什么是化学键?什么是离子键、共价键?
相邻的两个或多个原子之间强烈的相互作用叫化学键; 使阴、阳离子结合成化合物的静电作用叫做离子键; 原子之间通过共用电子对所形成的相互作用叫做共价键。
2、常见的离子化合物与共价化合物有哪些?
[练习]
1.指出下列物质中的化学键类型。
讨论二:
为什么NaCl的熔沸点比CsCl高?
Na+ 与Cs+ 均带一个单位正电荷, 阴离子均为氯离子。 Na+半径比Cs+ 小 Na+与Cl- 的相互作用比Cs+与Cl- 的相互作用强 NaCl晶体中的离子键较强,
NaCl晶体的熔沸点较高。
一、离 子 晶 体
4.典型的晶体结构
(1)NaCl晶体
ClClNa+ ClNa+ + Na ClCl+ Cl+ Na ClNa+ Na Na+ ClNa+ Na+
Na+=(12/4+1)=4个 即氯化钠晶胞中Na+和Cl-的个数比为1:1
晶胞中含微粒个数比的计算方法(均摊法)
①顶点:处于顶点的离子,同时为8个晶胞所共 有,每个离子有1/8属于该晶胞
②棱上:处于棱上的离子,同时为4个晶胞所共 有,每个离子有1/4属于该晶胞 ③面心:处于面心的离子,同时为2个晶胞所共 有,每个离子有1/2属于该晶胞 ④体内:处于体心的离子,完全属于该晶胞, 该离子按1计入晶胞
晶型代表:NaCl型 、 CsCl型
ClNa+ Cl-
Na+ Na
ClCl+
Na
Na+
Cl+
?在NaCl晶体中,每个Na+周围距离最近的Cl有 个?距离最近的Na+有 个?
NaCl的晶体结构特点
(1)组成NaCl晶体的微 粒 是什么?它们之间的 在氯化钠晶体中, 作用力(短线)是什么? 每个Na+同时吸引着 (2)一个Na+周围有多少 6个Cl-,每个Cl-也 个Cl-?一个Cl-周围有多 同时吸引着6个Na+. 少个Na+? 所以在NaCl晶体中, (3)NaCl晶体中Na+与 不存在单个Na Cl分 Cl-个数比是多少? 子,Na+与Cl-个数比 (4) NaCl能不能称为 为 分子式? 1:1.
Na+
Cl-
晶胞的概念:
晶体中的最小重复单元。 重复的含义:通过上、下、左、右、前、后 的平移能与下一个最小单元(晶胞)重复。
(2) CsCl晶体 (体心立方体)
在CsCl晶体中,每个Cs+同时吸引( 8 )个Cl-, 每个Cl- 同时吸引( 8 )个Cs+。
讨论二:
NaCl和 CsCl是不是表示分子组成的的分子式? 那么,它们表示的是什么?
:
练习3 某物质的晶体中,含A、B、C三种元素,其排 列方式如图所示(其中前后两面心上的B原子不能画
出)。晶体中的A、B、C的原子个数比依次为:
(A)1:3:1 (B) 2:3:1 (C)2:2:1 (D)1:3:3
立方晶胞顶点粒子为8个晶胞共有
棱上粒子为4个晶胞共有 面上粒子为2个晶胞共有
A:B:C = 1/8×8 : 1/2×6 : 1 = 1 : 3 : 1
KBr
CCl4
N2
CaO
H2S NaOH
2.下列物质中哪些是离子化合物?哪些是共价 化合物?哪些是只含离子键的离子化合物?哪 些是既含离子键又含共价键的离子化合物?
KCl HCl Na2SO4 NH4Cl O2 Na2O2
HNO3
晶
体
1、定义:经过结晶过程而形成的具有规则的 几何外形的固体。 2、分类: 离子晶体 依据:构成晶体 的粒子种类及粒 子之间的作用
分子晶体
原子晶体 金属晶体
一、离 子 晶 体
1、定义: 离子间通过离子键结合而成的晶体 微粒间的作用力: 离子键 构成微粒: 离子 组成元素: 一般由典型金属元素和非金属元素组成
特殊: AlCl3、NH4Cl等
常见的离子晶体:强碱、部分金属氧化状态或水溶液时能 导电? 1、当晶体受热熔化时,由于温度的升高,离 子的运动加快,克服了阴、阳离子间的引力,产 生了能自由移动的阴、阳离子,所以熔融的NaCl 能导电。 2、当晶体溶于水时,由于水分子的作用,使 Na+和Cl-之间的作用力减弱,NaCl成为能自由移 动的水合钠离子和水合氯离子,所以NaCl水溶液 能导电。
一、离 子 晶 体
2、离子晶体的物理性质:
熔沸点较高,难压缩,难挥发,硬而脆; 固体不导电,水溶液或者熔融状态下一般均导电; 大多易溶于极性溶剂,难溶于非极性溶剂。
熔点℃ NaCl CsCl 801
沸点℃ 1413
645
1290
一、离 子 晶 体
3、离子晶体熔沸点高低的影响因素 离子所带的电荷(Q)和离子半径(r) Q越大、r越小,则离子键越强熔沸点越高 如:NaF >NaCl >NaBr > NaI
练习1、下列物质中,属于离子晶体的是 ________;含共价键的离子晶体是_______。 KBr、NaOH、HCl、CO2 、NH4Cl、I2
练习 2 某离子晶体的结构(局部如图),X位 于立方体的顶点,Y位于立方体的中心,则该晶 (XY2) 体的化学式是
X
Y
X : Y = 1/8×4 1 = 1 :2
练习 4 某物质的晶体中含A、B、C三种元素, 其排列方式如图,则该离子晶体的化学式是 (AB3C)
A : B : C = 1/8×8 : = 1 : 3 : 1
12×1/4 : 1
